Documente Academic
Documente Profesional
Documente Cultură
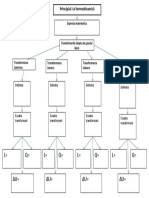
Transformarile Simple Ale Gazului Ideal
Încărcat de
Alex BandacTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Transformarile Simple Ale Gazului Ideal
Încărcat de
Alex BandacDrepturi de autor:
Formate disponibile
T.7.
Ecuaia caloric de stare a gazului ideal
Energia intern a unui gaz (U, U SI = J = Joule ) = energia cinetic a micrii de agitaie termic (Ec) + energia potenial datorat forelor intermoleculre, de interaciune dintre particule (Ep) + energia potenial datorat interaciunii cu cmpurile de fore exterioare (Ep) (de exemplu interaciune cu cmpul gravitaional). n cazul gazului ideal forele de interaciune intermolecular se neglijeaz, la fel interaciunile cu cmpurile de fore exterioare, deci vom lua n considerare doar energiile cinetice ale moleculelor n micare de agitaie termic pentru calculul energiei interne:
U = N = N A = N A
3 3 3 k B T = N A k B T = RT 2 2 2
U=
Ecuaia caloric de stare a gazului ideal este: unde = numrul de moli
3 i T = T R R 2 2
R = 8,31
J = constanta universal a gazelor mol K
T = temperatura absolut a gazului (exprimat n Kelvin) i = numrul gradelor de libertate ale moleculelor gazului ideal (i = 3 pentru gaz monoatomic, i = 5 pentru gaz biatomic, i = 6 pentru gaz tri/poliatomic) Concluzie: Energia intern a gazului ideal ( U ) depinde doar de cantitatea de gaz ( ) i de temperatura gazului (T): U = U ( , T).
T.8. Transformrile simple ale gazului ideal
Ecuaia termic de stare, caracter universal.
p V = R T
, este independent de natura gazului, avnd un
Cnd la trecerea de la o stare de echilibru termodinamic A (p1 , V1 , T1 ) la alt stare de echilibru termodinamic B (p2 , V2 , T2 ) toi parametrii macroscopici variaz, transformarea se numete general. Dac unul din parametri rmne constant, atunci se obin urmtoarele transformri particulare: transformarea izoterm: T = constant transformarea izobar: p = constant transformarea izocor: V = constant Observaie: Din ecuaia termic de stare se pot deduce toate legile transformrilor simple ale gazului ideal.
15
S-ar putea să vă placă și
- Gaze IdealeDocument12 paginiGaze IdealePascal Cătălin100% (2)
- Moleculara 04Document24 paginiMoleculara 04anitarazÎncă nu există evaluări
- TermodinamicaDocument12 paginiTermodinamicaPara CataÎncă nu există evaluări
- ProblemerezolvatexiiDocument1 paginăProblemerezolvatexii13 cm FairyÎncă nu există evaluări
- E D Fizica Teoretic Vocational 2023 Bar 06 LRODocument4 paginiE D Fizica Teoretic Vocational 2023 Bar 06 LROTeodor Mihai AndreiÎncă nu există evaluări
- Transformari de StareDocument15 paginiTransformari de StareAndreea ManuÎncă nu există evaluări
- Determinarea Caldurii Specifice A Unui Corp SolidDocument2 paginiDeterminarea Caldurii Specifice A Unui Corp SolidBugulet AnaÎncă nu există evaluări
- 31 - 39 - Probleme Propuse Pentru LiceuDocument9 pagini31 - 39 - Probleme Propuse Pentru LiceuAlexandra CibricÎncă nu există evaluări
- Belo HorizonteDocument5 paginiBelo HorizonteGeorgiana DutuÎncă nu există evaluări
- Morfism Si IzomorfismDocument7 paginiMorfism Si IzomorfismRely ElenaÎncă nu există evaluări
- Punte Cu FirDocument1 paginăPunte Cu FirbyancaaÎncă nu există evaluări
- Verificarea Legilor GazuluiDocument4 paginiVerificarea Legilor GazuluiRaresÎncă nu există evaluări
- Probleme de TermdinamicaDocument6 paginiProbleme de TermdinamicaChristian 04Încă nu există evaluări
- Lectiagrupuri de MatriceDocument7 paginiLectiagrupuri de MatriceMaria BrutiuÎncă nu există evaluări
- 1 Notiuni de CinematicaDocument4 pagini1 Notiuni de CinematicaSusu OanaÎncă nu există evaluări
- 8.randamentul Planului InclinatDocument2 pagini8.randamentul Planului InclinatAdelina BrondaÎncă nu există evaluări
- Lucrare 3 Unde StationareDocument10 paginiLucrare 3 Unde StationareRobert TulbureÎncă nu există evaluări
- Modelul ,,oscilator Armonic''Document4 paginiModelul ,,oscilator Armonic''Ioana-Alexandra TrincăÎncă nu există evaluări
- Det - Caldurii Specifice A Unui Corp SolidDocument1 paginăDet - Caldurii Specifice A Unui Corp SolidAlexandru-Cristian CostacheÎncă nu există evaluări
- Sensul Conventional Si Sensul Real de Deplasare Al ElectronilorDocument3 paginiSensul Conventional Si Sensul Real de Deplasare Al ElectronilorseitancalinÎncă nu există evaluări
- FizicaDocument6 paginiFizicavictorÎncă nu există evaluări
- Harta ConceptualaDocument1 paginăHarta ConceptualaTania Ella100% (1)
- Relatia Dintre Energia Totala A Unui Corp Si Impulsul SauDocument2 paginiRelatia Dintre Energia Totala A Unui Corp Si Impulsul SauMaurice Lachaud0% (1)
- Un Număr N Se Numeşte Extraprim Dacă Atât El Cât Şi Orice Număr Obţinut Prin PermutareaDocument2 paginiUn Număr N Se Numeşte Extraprim Dacă Atât El Cât Şi Orice Număr Obţinut Prin PermutareaMihai OpreaÎncă nu există evaluări
- Miscarea Oscilatorie ArmonicaDocument5 paginiMiscarea Oscilatorie ArmonicaSzelesÎncă nu există evaluări
- Barem Fizica Teoretic 2018Document5 paginiBarem Fizica Teoretic 2018Claudia SpridonÎncă nu există evaluări
- Test Seminar 11 - Restantieri-Cu RezolvariDocument1 paginăTest Seminar 11 - Restantieri-Cu RezolvariDenisa ZahariaÎncă nu există evaluări
- Cum Rezolvam Inecuatiile de Gradul Al DoileaDocument4 paginiCum Rezolvam Inecuatiile de Gradul Al DoileaCristian OlaruÎncă nu există evaluări
- Cursul 6-7Document23 paginiCursul 6-7Paul IvascuÎncă nu există evaluări
- LG OhmDocument5 paginiLG OhmTeodora RîștariuÎncă nu există evaluări
- Test Legile Lui KDocument2 paginiTest Legile Lui KAna DumitrescuÎncă nu există evaluări
- 116675fsdfsfa468 Energia in Sisteme BiologiceDocument8 pagini116675fsdfsfa468 Energia in Sisteme BiologiceIoana MoldovanÎncă nu există evaluări
- REBUSDocument1 paginăREBUSmeliabogdiÎncă nu există evaluări
- E D Fizica Tehnologic 2017 Bar Simulare LRODocument5 paginiE D Fizica Tehnologic 2017 Bar Simulare LROAnonymous GzRc2mww4Încă nu există evaluări
- Primul Principiu Al Termodinamicii Şi Aplicabilitatea Lui În Lumea VieDocument9 paginiPrimul Principiu Al Termodinamicii Şi Aplicabilitatea Lui În Lumea VieSimona PetranÎncă nu există evaluări
- Formule MECANICADocument1 paginăFormule MECANICADavid DavidÎncă nu există evaluări
- Noțiuni de Geometrie Descriptivă - Drepte ConcurenteDocument3 paginiNoțiuni de Geometrie Descriptivă - Drepte ConcurenteapolegioÎncă nu există evaluări
- 40 Intrebari GrilaDocument6 pagini40 Intrebari GrilaVoicu RaduÎncă nu există evaluări
- Dioptrul SfericDocument2 paginiDioptrul Sfericdragos popaÎncă nu există evaluări
- Simulare Buzău 2024 Barem Varianta 1 Fizica TeoreticDocument8 paginiSimulare Buzău 2024 Barem Varianta 1 Fizica TeoreticDouglas SchmidtÎncă nu există evaluări
- Teoria RelativitatiiDocument10 paginiTeoria RelativitatiiMihaella AdinaÎncă nu există evaluări
- Formule Fizica Clasa IX-aDocument1 paginăFormule Fizica Clasa IX-aZuZuÎncă nu există evaluări
- Sisteme de Lentile CentrateDocument35 paginiSisteme de Lentile CentrateAnca HarapuÎncă nu există evaluări
- Atomul Cu Mai Multi ElectroniDocument14 paginiAtomul Cu Mai Multi ElectronipetricheiirinaÎncă nu există evaluări
- Calorimetrie - Coeficienti CaloriciDocument2 paginiCalorimetrie - Coeficienti CaloriciBrad IanisÎncă nu există evaluări
- Referat Moara Cu NorocDocument4 paginiReferat Moara Cu NorocBrassYÎncă nu există evaluări
- Polirom ManualDocument62 paginiPolirom ManualCobzaru George CiprianÎncă nu există evaluări
- Algoritm Verificare Daca Un Numar e Prim CDocument2 paginiAlgoritm Verificare Daca Un Numar e Prim CMaria DamianÎncă nu există evaluări
- Curs 7 - Probabilitati ConditionateDocument6 paginiCurs 7 - Probabilitati ConditionateVali[; x]Încă nu există evaluări
- Bilantul Puterilor MADocument18 paginiBilantul Puterilor MAMihai CiobâcăÎncă nu există evaluări
- Termodinamica Pentru BacalaureatDocument12 paginiTermodinamica Pentru Bacalaureationcazacu100% (4)
- Aplicarea principiului întâi al termodinamicii la transformările gazului idealDocument2 paginiAplicarea principiului întâi al termodinamicii la transformările gazului idealtaedy4287Încă nu există evaluări
- 2 TermodinamicaDocument54 pagini2 TermodinamicaBanita CarmenÎncă nu există evaluări
- TermodinamicaDocument3 paginiTermodinamicaCristinaa1998Încă nu există evaluări
- Rezolvari Fizica F2 2015Document7 paginiRezolvari Fizica F2 2015CorinaGhergheÎncă nu există evaluări
- Principiul I Al TermodinamiciiDocument3 paginiPrincipiul I Al TermodinamiciiBernad AmandaÎncă nu există evaluări
- FF. Termodinamica CURS 1Document36 paginiFF. Termodinamica CURS 1Andra CosmaÎncă nu există evaluări
- Lucrarea de Laborator nr.8Document7 paginiLucrarea de Laborator nr.8Paula PopescuÎncă nu există evaluări
- Disocierea MoleculelorDocument2 paginiDisocierea MoleculelorAdina LicsorÎncă nu există evaluări
- HoroscopDocument4 paginiHoroscopAlex BandacÎncă nu există evaluări
- Cronica 1Document3 paginiCronica 1Alex BandacÎncă nu există evaluări
- Varza MurataDocument1 paginăVarza MurataAlex BandacÎncă nu există evaluări
- MICHAEL CEHOV - Exercises For ActorsDocument54 paginiMICHAEL CEHOV - Exercises For ActorsAlina94% (17)
- Marimi FiziceDocument15 paginiMarimi FiziceAlex BandacÎncă nu există evaluări
- GestpsihDocument1 paginăGestpsihAlex BandacÎncă nu există evaluări
- 6 Trucuri Simple Pentru Prăjituri DelicioaseDocument1 pagină6 Trucuri Simple Pentru Prăjituri DelicioaseAlex BandacÎncă nu există evaluări
- Ordin - Standarde Minimale Iulie 2013Document8 paginiOrdin - Standarde Minimale Iulie 2013Alex BandacÎncă nu există evaluări
- 6 Trucuri Simple Pentru Prăjituri DelicioaseDocument1 pagină6 Trucuri Simple Pentru Prăjituri DelicioaseAlex BandacÎncă nu există evaluări
- Rețete AperitiveDocument1 paginăRețete AperitiveAlex BandacÎncă nu există evaluări
- Agenda Culturala LIBREX 2013 in Constructie Noul DesignDocument16 paginiAgenda Culturala LIBREX 2013 in Constructie Noul DesignAlex BandacÎncă nu există evaluări
- Intalnire Cu FizicaDocument9 paginiIntalnire Cu FizicaAlex BandacÎncă nu există evaluări
- Universitatea Babeş-Bolyai" Cluj-Napoca Facultatea de Studii EuropeneDocument16 paginiUniversitatea Babeş-Bolyai" Cluj-Napoca Facultatea de Studii Europenetoxxypunk0% (1)
- Biologie - Teste Admitere Medicina 2011, BucurestiDocument90 paginiBiologie - Teste Admitere Medicina 2011, Bucurestiroxanaperianu95% (39)
- Ecuatia Termica de StareDocument3 paginiEcuatia Termica de StareAlex BandacÎncă nu există evaluări
- Unu 2010Document3 paginiUnu 2010Alex BandacÎncă nu există evaluări
- TermodinamicaDocument7 paginiTermodinamicaAlex BandacÎncă nu există evaluări
- Universitatea Babeş-Bolyai" Cluj-Napoca Facultatea de Studii EuropeneDocument16 paginiUniversitatea Babeş-Bolyai" Cluj-Napoca Facultatea de Studii Europenetoxxypunk0% (1)
- Racine - FedraDocument26 paginiRacine - Fedraaurora_marin97% (35)
- Mihail Bulgakov Jourdain Cel ScrantitDocument22 paginiMihail Bulgakov Jourdain Cel ScrantitAlex BandacÎncă nu există evaluări
- Tramvai Numit DorintaDocument2 paginiTramvai Numit DorintaAlex Bandac100% (3)
- Auditia de Alexander GalinDocument1 paginăAuditia de Alexander GalinAlex BandacÎncă nu există evaluări
- Cameristele - Jean GenetDocument7 paginiCameristele - Jean GenetbloomgrlÎncă nu există evaluări