Documente Academic
Documente Profesional
Documente Cultură
Amérique Du Nord 2008 EXERCICE I
Încărcat de
Lotfi ChimieTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Amérique Du Nord 2008 EXERCICE I
Încărcat de
Lotfi ChimieDrepturi de autor:
Formate disponibile
Amrique du nord 2008 EXERCICE I : RACTIONS TOTALES ?
(7 points)
http://labolycee.org
Les trois parties de lexercice sont indpendantes.
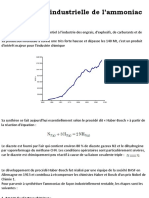
1. Lammoniac
La synthse industrielle de lammoniac seffectue en phase gazeuse. Les ractifs
dihydrogne et diazote sont introduits dans les proportions stchiomtriques. La
raction a lieu en prsence dun catalyseur qui est du ruthnium sur support de graphite,
sous une pression comprise entre 100.10
5
Pa et 200.10
5
Pa et une temprature
comprise entre 350C et 500C.
Daprs : http://www.iupac.org
Lquation associe la raction de synthse est :
N
2 (g)
+ 3 H
2 (g)
= 2 NH
3 (g)
Dans un racteur, on mlange 1,0.10
2
mol de diazote et 3,0.10
2
mol de dihydrogne.
Le taux davancement final de cette raction est = 0,70.
1.1. Donner lexpression du taux davancement final et la signification des termes utiliss.
1.2. La raction de synthse de lammoniac est-elle une raction totale ?
Justifier la rponse.
1.3. tablir le tableau davancement relatif cette raction.
En dduire la composition finale en quantit de matire du mlange.
1.4. Quel intrt a-t-on dun point de vue microscopique choisir une temprature
leve lors dune transformation chimique ?
1.5. Quel est le rle du catalyseur dans la synthse de lammoniac ?
2. La solution aqueuse dammoniac
Donnes : dans les conditions exprimentales de lexercice on a :
Volume molaire dun gaz : V
m
= 24,0 L.mol
-1
;
Produit ionique de leau : K
e
= 1,0.10
14
.
Un volume gazeux dammoniac v = 2,4.10
-1
L est dissous dans de leau distille
pour obtenir V
S
= 1,0 L de solution aqueuse dammoniac S.
2.1. Donner lexpression, puis calculer la quantit de matire dammoniac n
0
contenue
dans le volume gazeux v.
2.2. Le pH de la solution S est mesur et a pour valeur 10,6.
2.2.1. Rappeler la dfinition dune base selon Bronsted.
2.2.2. crire lquation de la raction modlisant la transformation chimique de
lammoniac avec leau.
2.2.3. Calculer la quantit de matire en ions hydroxyde prsente dans la solution S.
2.2.4. La transformation chimique associe la raction dont lquation a t crite
en 2.2.2. est-elle totale ? Justifier la rponse.
2.3. Dtermination de la constante dacidit.
2.3.1. Donner lexpression de la constante dquilibre associe lquation de la
raction 2.2.2. et dterminer sa valeur.
2.3.2. En dduire la valeur de la constante dacidit K
a
du couple : NH
4
+
/NH
3
.
3. tude dun mlange dacide thanoque et dune solution aqueuse dammoniac.
Donnes : dans les conditions exprimentales de lexercice on a :
Produit ionique de leau : K
e
= 1,0.10
14
;
pK
a
du couple NH
4
+
/ NH
3
= 9,2 ;
pK
a
du couple CH
3
CO
2
H/CH
3
CO
2
= 4,8.
Exprience :
tat initial : dans un bcher on introduit V
A
= 100,0 mL dune solution dacide thanoque
de concentration c
A
= 1,0.10
-1
mol.L
-1
et V
B
= 40,0 mL dune solution aqueuse
dammoniac de concentration c
B
= 5,0.10
-1
mol.L
-1
. Dans cet tat, on nglige la prsence
dions CH
3
CO
2
-
et NH
4
+
. Toutes les grandeurs relatives cet tat seront notes avec i en
indice.
tat dquilibre : le pH du mlange est mesur et a pour valeur 9,2. Toutes les grandeurs
dans cet tat seront notes avec eq en indice.
Questions :
La transformation chimique qui a lieu est modlise par la raction chimique dquation :
CH
3
CO
2
H
(aq)
+ NH
3(aq)
= CH
3
CO
2
(aq)
+ NH
4
+
(aq)
(quation 1)
3.1. Dtermination du quotient de raction
3.1.1. Donner lexpression littrale puis calculer le quotient de raction du systme
dans ltat dquilibre : Q
r,eq
.
3.1.2. Quelle est la valeur du quotient de raction dans ltat initial Q
r,i
? Le
comparer Q
r,eq
et conclure sur lvolution du systme.
3.2. Composition du mlange
3.2.1. Pour le couple NH
4
+
/NH
3
, tracer le diagramme de prdominance des
espces en fonction du pH.
3.2.2. En dduire la relation entre [NH
3
]
eq
et [NH
4
+
]
eq
dans le mlange tudi.
3.3. Donner, en la justifiant, la relation entre [NH
4
+
]
eq
et [CH
3
CO
2
-
]
eq
.
3.4. La mesure de la conductivit de la solution S a permis de connatre la concentration
en ion ammonium lorsque lquilibre est atteint. Sa valeur est [NH
4
+
]
eq
= 7,1.10
-2
mol.L
-1
.
3.4.1. En dduire la quantit de matire des espces NH
4
+
, CH
3
CO
2
-
, NH
3
et
CH
3
COOH prsentes dans le mlange lquilibre. On pourra saider
ventuellement dun tableau davancement.
3.4.2. La transformation chimique entre lacide thanoque et lammoniac,
modlise par la raction chimique dquation 1, est-elle totale ?
2008 Amrique du nord Exercice n1 : RACTIONS TOTALES ? (7 points)
Correction http://labolycee.org
1. Lammoniac
1.1.
f
max
x
=
x
, avec x
f
: avancement final de la raction (lorsque ltat final dquilibre est atteint)
et x
max
lavancement maximal ( avancement si la transformation chimique est totale).
1.2. < 1, la raction nest donc pas totale, elle est limite.
1.3. quation de la raction N
2(g)
+ 3 H
2(g)
= 2 NH
3(g)
tat Avancement n(N
2
) en mol n(H
2
) en mol n(NH
3
) en mol
Initial 0 1,0.10
2
3,0.10
2
0
En cours x 1,0.10
2
x 3,0.10
2
3.x 2.x
Final x
f
1,0.10
2
x
f
3,0.10
2
3.x
f
2.x
f
Daprs le 1.1. on a x
f
= .x
max
.
Les ractifs ont t introduits dans les proportions stchiomtriques, si la transformation est
totale, ils sont totalement consomms, donc x
max
= 1,0.10
2
mol.
Il vient x
f
= 0,70 1,0 10
2
= 70 mol
La composition finale du mlange est donc : n(N
2
) = 1,0 10
2
70 = 30
mol
n(H
2
) = 3,0 10
2
3 70 = 90 mol
n(NH
3
) = 2 70 = 1,4 10
2
mol
1.4. Dun point de vue microscopique une temprature leve permet daugmenter la vitesse
des molcules. Ds lors, les chocs entre les molcules sont plus nombreux et leur efficacit est
plus importante. Ainsi la vitesse de la raction augmente.
1.5. Le catalyseur permet galement daugmenter la vitesse de raction.
2. La solution aqueuse dammoniac
2.1. n
0
=
m
v
V
donc n
0
=
-1
2,4 10
24,0
= 1,0 10
2
mol dammoniac dissous initialement.
2.2.1. Une base selon Bronsted est une espce chimique capable de capter un proton H
+
.
2.2.2. NH
3(aq)
+ H
2
O
(l)
= NH
4
+
(aq)
+ HO
(aq)
2.2.3. n(HO
-
(aq)
)
q
= [HO
-
(aq)
]
q
.V
S
Dautre part K
e
= [H
3
O
+
(aq)
]
q
. [HO
(aq)
]
q
. et [H
3
O
+
(aq)
]
q
= 10
pH
K
e
= 10
pH
. [HO
(aq)
]
q
.
donc [HO
(aq)
]
q
=
e
pH
K
10
Soit n(HO
(aq)
) =
e
pH
K
10
.V
S
n(HO
(aq)
)
q
=
14
10,6
1, 0.10
1, 0
10
= 4,0 10
4
mol prsente dans la solution S.
2.2.4. Si la transformation chimique associe la raction dont lquation a t crite en 2.2.2.
tait totale, il se formerait n
0
= 1,0 10
2
mol danions hydroxyde. Or il ne sen forme que
4,0 10
4
mol. La raction nest pas totale, elle est trs limite.
2.3.1. K =
- +
(aq) 4(aq)
q q
3(aq)
q
HO . NH
NH
1 1
] ]
1
]
Daprs lquation chimique [HO
(aq)
]
q
= [NH
4
+
(aq)
]
q
et daprs 2.2.3. [HO
(aq)
]
q
=
e
pH
K
10
De plus [NH
3(aq)
]
q
=
0
S
n n(HO )
V
q
=
e
0 S pH
S
K
.V
10
V
n
=
0 e
pH
S
K
V 10
n
Il vient K =
2
e
pH
0 e
S
K
10
K
V 10
_
,
pH
n
K =
2
-14
10,6
2 14
10,6
1,0.10
10
1, 0 10 1,0.10
1,0 10
_
,
=
( )
2
3,4
2 3,4
10
1, 0 10 10
= 1,710
5
2.3.2. NH
4
+
(aq)
+ H
2
O
(l)
= NH
3(aq)
+ H
3
O
+
(aq)
K
a
=
+
3(aq) 3 (aq)
q q
+
4(aq)
q
NH . H O
NH
1 1
] ]
1
]
, en multipliant K
a
par
( )
( )
1
]
1
]
aq
q
aq
q
HO
HO
K
a
= =
e
K
K
K
a
=
14
5
1, 0.10
1, 7 10
= 6,110
10
(calcul effectu avec la valeur non arrondie de K)
(Remarque : pK
a
= log K
a
permet de retrouver la valeur du pKa
=9,2 donne ensuite au 3.)
3. tude dun mlange dacide thanoque et dune solution aqueuse dammoniac
CH
3
CO
2
H
(aq)
+ NH
3(aq)
= CH
3
CO
2
(aq)
+ NH
4
+
(aq)
(quation 1)
3.1.1. Q
r
,
q
=
+ -
4(aq) 3 2(aq)
q q
3(aq) 3 2 (aq)
q q
NH . CH CO
NH . CH CO H
1 1
] ]
1 1
] ]
en multipliant par
3 ( )
3 ( )
+
+
1
]
1
]
aq
q
aq
q
H O
H O
Q
r
,
q
= =
-
3 2 3 2
+
4 3
A
(CH CO H/CH CO )
A
(NH /NH )
K
K
=
A -
(CH CO H/CH CO )
3 2 3 2
A +
(NH /NH )
4 3
pK
pK
10
10
Q
r
,
q
=
4,8
9,2
10
10
= 10
4,4
= 2,5 10
4
3.1.2. Dans ltat initial, on nglige la prsence des ions CH
3
CO
2
et NH
4
+
, il ny a donc pas de
produits encore forms. Q
r, i
= 0
Q
r, i
< Q
r
,
q
Le systme va voluer dans le sens direct de la raction.
+
3(aq) 3 (aq) ( )
q q
+
4(aq) ( )
q
NH . H O .
NH .
1 1 1
] ] ]
1 1
] ]
aq
q
aq
q
HO
HO
+ - +
4(aq) 3 2(aq) 3 (aq)
q q q
+
3(aq) 3 (aq) 3 2 (aq)
q q q
NH . CH CO . H O
NH . H O . CH CO H
1 1 1
] ] ]
1 1 1
] ] ]
3.2. Composition du mlange
3.2.1.
3.2.2. Le pH du mlange est de 9,2 soit gal au pK
A
du couple considr.
On a alors : [NH
3
]
q
= [NH
4
+
]
q
3.3. Daprs lquation 1, il se forme une mole dions thanoate pour une mole dions
ammonium, on a donc : [NH
4
+
]
q
= [CH
3
CO
2
]
q
.
3.4.1. Daprs 3.2.2. [NH
3
]
q
= [NH
4
+
]
q
et daprs 3.3. [NH
4
+
]
q
= [CH
3
CO
2
]
q
, enfin le texte
indique [NH
4
+
]
q
= 7,1.10
2
mol.L
1
.
Soit [NH
3
]
q
= [NH
4
+
]
q
= [CH
3
CO
2
]
q
= 7,1.10
2
mol.L
1
,
donc n(NH
3
)
q
= n(NH
4
+
)
q
= n(CH
3
CO
2
-
)
q
.
Le volume de la solution est V
A
+ V
B
, alors
n(NH
3
)
q
= n(NH
4
+
)
q
= n(CH
3
CO
2
)
q
= [NH
4
+
]
q
.(V
A
+V
B
)
n(NH
3
)
q
= n(NH
4
+
)
q
= n(CH
3
CO
2
)
q
= 7,1.10
2
140,0 10
3
= 9,9 10
3
mol
quation chimique (1) CH3CO2H(aq) + NH3(aq) = CH3CO2
(aq) + NH4
+
(aq)
tat du
systme
Avancement
(mol)
Quantits de matire (mol)
tat initial x = 0
n(CH
3
CO
2
H)
ini
= cA.VA
n(NH
3
)
ini
= cB.VB
0 0
En cours de
transformation
x cA.VA x cB.VB x x x
tat final xf
n(CH
3
CO
2
H)
q
=
c
A
.V
A
x
q
n(NH
3
)
q
= cB.VB xq
n(CH
3
CO
2
)
q
= x
q
n(NH
4
+
)
q
= [NH4
+
]q.(VA+VB)
= x
q
tat final si
totale
xmax cA.VA xmax cB.VB xmax x
max
x
max
n(CH
3
CO
2
H)
q
= n(CH
3
CO
2
H)
ini
n(NH
4
+
)
q
= c
A
.V
A
[NH
4
+
]
q
.(V
A
+V
B
)
n(CH
3
CO
2
H)
q
= 1,0.10
1
0,1000 7,1 10
2
140,0 10
3
n(CH
3
CO
2
H)
q
= 6,0 10
5
mol
3.4.2. n(CH
3
CO
2
H)
ini
x
q
= n(CH
3
CO
2
H)
q
x
q
= n(CH
3
CO
2
H)
ini
n(CH
3
CO
2
H)
q
x
q
n(CH
3
CO
2
H)
ini
Lacide thanoque est totalement consomm, on peut considrer la raction comme totale.
En cas derreur constate, merci de nous envoyer un courriel labolycee@gmail.com
pH
pK
A
= 9,2
NH
3
NH
4
+
S-ar putea să vă placă și
- Annales de Mathématiques, Baccalauréat C et E, Cameroun, 2008 - 2018: Sujets et CorrigésDe la EverandAnnales de Mathématiques, Baccalauréat C et E, Cameroun, 2008 - 2018: Sujets et CorrigésEvaluare: 4.5 din 5 stele4.5/5 (4)
- Concours Agregation - Chimie - Marrakech 2014Document8 paginiConcours Agregation - Chimie - Marrakech 2014Win's Miringui'sÎncă nu există evaluări
- Extrait 42319210Document132 paginiExtrait 42319210hicham bouatlaouiÎncă nu există evaluări
- 2008 AmNord Exo1 Sujet ReactionsTotalesDocument2 pagini2008 AmNord Exo1 Sujet ReactionsTotalesbaptlaser.fortniteÎncă nu există evaluări
- 2008 AmNord Exo1 Sujet ReactionsTotalesDocument2 pagini2008 AmNord Exo1 Sujet ReactionsTotalesla physique selon le programme Français100% (1)
- C3Chim - Transformations - Limitees - Exercices - Sabatier PDFDocument5 paginiC3Chim - Transformations - Limitees - Exercices - Sabatier PDFAzizElheni0% (1)
- Série 1 - équilibre Chimique (WWW - Pc1.ma)Document6 paginiSérie 1 - équilibre Chimique (WWW - Pc1.ma)b01554837Încă nu există evaluări
- Série 1 - Équilibre ChimiqueDocument6 paginiSérie 1 - Équilibre ChimiqueMed RT100% (1)
- 2007 Antilles Exo1 Correction BenzoateMethyle 5.5ptsDocument3 pagini2007 Antilles Exo1 Correction BenzoateMethyle 5.5ptsHafid Tlemcen Rossignol PoèteÎncă nu există evaluări
- Série D'exercices 5, Transformations Associées À Des Réactions Acido-Basiques en Solution - Dosage, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument12 paginiSérie D'exercices 5, Transformations Associées À Des Réactions Acido-Basiques en Solution - Dosage, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDboudhar mohamed0% (1)
- Correction Devoir No4 Equilibre Dosage NucleaireDocument6 paginiCorrection Devoir No4 Equilibre Dosage NucleaireridhajamelÎncă nu există evaluări
- Serie Suivi 2 Bac Biof SM PC FrancaisDocument5 paginiSerie Suivi 2 Bac Biof SM PC FrancaisMoussa Traoré100% (1)
- 2005 Antilles Correction Exo2 DeterminationK 6 5ptsDocument2 pagini2005 Antilles Correction Exo2 DeterminationK 6 5ptsayakhalifa251Încă nu există evaluări
- Examens de Chimie-1Document17 paginiExamens de Chimie-1Anas HajimÎncă nu există evaluări
- Série D'exercices N°7 - Chimie Série Physique Dipole RLC SCIENCE & MATH - Bac Sciences Exp (2011-2012) MR TLILI TOUHAMI PDFDocument2 paginiSérie D'exercices N°7 - Chimie Série Physique Dipole RLC SCIENCE & MATH - Bac Sciences Exp (2011-2012) MR TLILI TOUHAMI PDFAzizElheni100% (1)
- Serie 2 Les Transformations S'effectuants en Deux Sens Etat D'equilibre (2) - 1Document4 paginiSerie 2 Les Transformations S'effectuants en Deux Sens Etat D'equilibre (2) - 1yunuabou3Încă nu există evaluări
- Série de Chimie - 4ème Année Sc. Exp - Technique & MathématiquesDocument3 paginiSérie de Chimie - 4ème Année Sc. Exp - Technique & MathématiquesأشرفالمبروكÎncă nu există evaluări
- 2005 Reunion Sujet Exo2 Ammoniac 6 5ptsDocument3 pagini2005 Reunion Sujet Exo2 Ammoniac 6 5ptsla physique selon le programme Français100% (1)
- Exercice 29 Suivi Temporel D'une Transformation Chimique (Pr. DIAM)Document5 paginiExercice 29 Suivi Temporel D'une Transformation Chimique (Pr. DIAM)mndmtrofixÎncă nu există evaluări
- Devoir de Revision2 2023bac Math DefDocument5 paginiDevoir de Revision2 2023bac Math DefNour NessahÎncă nu există evaluări
- Série D'exercices - Sciences Physiques Préparation Bac 2011 - Bac Mathématiques (2010-2011) MR BenaichDocument21 paginiSérie D'exercices - Sciences Physiques Préparation Bac 2011 - Bac Mathématiques (2010-2011) MR BenaichTawfiq Weld EL ArbiÎncă nu există evaluări
- 2006 09 National Exo1 Sujet pHPoisson 6 5ptsDocument5 pagini2006 09 National Exo1 Sujet pHPoisson 6 5ptsla physique selon le programme FrançaisÎncă nu există evaluări
- Capture D'écran . 2023-11-16 À 19.24.58Document14 paginiCapture D'écran . 2023-11-16 À 19.24.58azeddineelghazoui637Încă nu există evaluări
- DS1 2022-2023 Sujet Corrige BaremeDocument10 paginiDS1 2022-2023 Sujet Corrige Baremearnaud.bedouinÎncă nu există evaluări
- Chimie 2012 SNDocument1 paginăChimie 2012 SNlina elouadihÎncă nu există evaluări
- Exercice Chimie 02Document3 paginiExercice Chimie 02matmatijamelÎncă nu există evaluări
- TS Benzoïque BenzoateDocument1 paginăTS Benzoïque BenzoateHanine HmidaÎncă nu există evaluări
- Exercice Revision Chimie PDFDocument4 paginiExercice Revision Chimie PDFAsmaaÎncă nu există evaluări
- Exercices Révision GénéraleDocument3 paginiExercices Révision Généraleklunx0% (1)
- SDM 1Document3 paginiSDM 1la physique selon le programme FrançaisÎncă nu există evaluări
- TD1 - CorrectionDocument8 paginiTD1 - Correctionmm72c48gbgÎncă nu există evaluări
- Exercices 5 Etat D'équilibre D'un Système Chimique (PR Hammou Mouna)Document1 paginăExercices 5 Etat D'équilibre D'un Système Chimique (PR Hammou Mouna)Ahmed AhmedÎncă nu există evaluări
- Killian - 2022 - Tp1Document9 paginiKillian - 2022 - Tp1amandine gaianiÎncă nu există evaluări
- DM Nâ°1Document8 paginiDM Nâ°1grégoire beraudÎncă nu există evaluări
- Révision Equilibre ChimiqueDocument6 paginiRévision Equilibre ChimiquechadaÎncă nu există evaluări
- SA-Exos - 1 - 1112 Acido Basique ExocorrigéDocument12 paginiSA-Exos - 1 - 1112 Acido Basique ExocorrigéLarbii BadrourÎncă nu există evaluări
- TP5' ChimieDocument2 paginiTP5' Chimiebouaiedanissa61Încă nu există evaluări
- TD1 Description Et Évolution-1 À 10 CorrDocument10 paginiTD1 Description Et Évolution-1 À 10 CorrmpofÎncă nu există evaluări
- Exercice 1 (7 Points) Étude Cinétique de La Réaction de L'éthanoate D'éthyle Avec L'hydroxyde de SodiumDocument9 paginiExercice 1 (7 Points) Étude Cinétique de La Réaction de L'éthanoate D'éthyle Avec L'hydroxyde de SodiumAli A RammalÎncă nu există evaluări
- 2005 09 Antilles Correction Exo3 Menthe 4ptsDocument3 pagini2005 09 Antilles Correction Exo3 Menthe 4ptsAnthea MallaÎncă nu există evaluări
- Correction DS ExempleDocument4 paginiCorrection DS ExempleAngélique GUAZÎncă nu există evaluări
- TD1 023 024Document7 paginiTD1 023 024ilyesfares49Încă nu există evaluări
- Acide Base ExercicesDocument36 paginiAcide Base Exerciceschaari abdelouahadÎncă nu există evaluări
- 2005 Antilles Sujet Exo2 Ka 6 5ptsDocument3 pagini2005 Antilles Sujet Exo2 Ka 6 5ptsla physique selon le programme FrançaisÎncă nu există evaluări
- TD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseDocument5 paginiTD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseLOUkmen Bel100% (1)
- Coorectionv Exercices TypesDocument11 paginiCoorectionv Exercices TypesJulian BaliaÎncă nu există evaluări
- Transformatios Dans Les 2 SensDocument2 paginiTransformatios Dans Les 2 Sensyassineria276Încă nu există evaluări
- Exercice IDocument15 paginiExercice IInes De Paul Feudjeu100% (1)
- Transformations Chimiques S Effectuant Dans Les 2 Sens Exercices Non Corriges 1 1Document4 paginiTransformations Chimiques S Effectuant Dans Les 2 Sens Exercices Non Corriges 1 1boufdili0% (2)
- 6 TDPCSIcinetique 2015Document8 pagini6 TDPCSIcinetique 2015Nguissaly SonkoÎncă nu există evaluări
- (C1) TDDocument2 pagini(C1) TDMeneÎncă nu există evaluări
- C4 Correction Exercices AciditeDocument5 paginiC4 Correction Exercices AciditeAndrés Tobías Mba MICHA ALENEÎncă nu există evaluări
- 2004 Polynesie Correction Exo1 PhsangDocument2 pagini2004 Polynesie Correction Exo1 Phsangla physique selon le programme Français100% (1)
- 2006 Pondichery Exo1 Sujet Acide Base 7ptsDocument4 pagini2006 Pondichery Exo1 Sujet Acide Base 7ptsasakuma2006Încă nu există evaluări
- EquilibreQoutionReactionExercices 16-17 PDFDocument4 paginiEquilibreQoutionReactionExercices 16-17 PDFالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- TD TransfMat01-1Document4 paginiTD TransfMat01-1Chaymae OuahmaneÎncă nu există evaluări
- Équilibres en solution: Les Grands Articles d'UniversalisDe la EverandÉquilibres en solution: Les Grands Articles d'UniversalisÎncă nu există evaluări
- Applications de la spectrophotomérie en phytochimie: sciencesDe la EverandApplications de la spectrophotomérie en phytochimie: sciencesÎncă nu există evaluări
- Amérique Du Nord 2008 EXERCICE IDocument5 paginiAmérique Du Nord 2008 EXERCICE ILotfi ChimieÎncă nu există evaluări
- Analyse ÉlémentaireDocument2 paginiAnalyse ÉlémentaireLotfi ChimieÎncă nu există evaluări
- Amplificateur Opérationnel IdéalDocument2 paginiAmplificateur Opérationnel IdéalLotfi ChimieÎncă nu există evaluări
- Amplificateur Opérationnel IdéalDocument2 paginiAmplificateur Opérationnel IdéalLotfi ChimieÎncă nu există evaluări
- Amérique Du Nord 2008 EXERCICE IDocument5 paginiAmérique Du Nord 2008 EXERCICE ILotfi ChimieÎncă nu există evaluări
- Amérique Du Nord 2008 EXERCICE IDocument5 paginiAmérique Du Nord 2008 EXERCICE ILotfi ChimieÎncă nu există evaluări
- Acides Et Bases Selon BrönstedDocument3 paginiAcides Et Bases Selon BrönstedLotfi Chimie100% (1)
- Circuit RLC LibreDocument3 paginiCircuit RLC LibreLotfi ChimieÎncă nu există evaluări
- 10extrait Rappels Chimie AnalytiqueDocument14 pagini10extrait Rappels Chimie AnalytiqueAnas HasniÎncă nu există evaluări
- Synthèse de L'ammoniacDocument9 paginiSynthèse de L'ammoniacSaoud HadjerÎncă nu există evaluări
- Serie 1 Avancement D'une Reaction 2021Document6 paginiSerie 1 Avancement D'une Reaction 2021ja3bek ma9rouna0% (1)
- BATAN - Cours - Chimie Minérale Descriprive - C245 - BCG - S4 - 2019 - 2020Document46 paginiBATAN - Cours - Chimie Minérale Descriprive - C245 - BCG - S4 - 2019 - 2020Yassine MOUHIBÎncă nu există evaluări
- 3 ADS Unite Synthese IndusDocument7 pagini3 ADS Unite Synthese IndusBedel KabayoÎncă nu există evaluări
- Devoir de Synthèse N°1 Lycée Pilote - Physique - Bac Math (2008-2009) Elève MarwaDocument5 paginiDevoir de Synthèse N°1 Lycée Pilote - Physique - Bac Math (2008-2009) Elève Marwachaari abdelouahad67% (3)
- Révision Équilibre Chimique CorrectionDocument10 paginiRévision Équilibre Chimique CorrectionchadaÎncă nu există evaluări
- Chap 2 DM12Document3 paginiChap 2 DM12cours importantÎncă nu există evaluări
- Copie de Chimie Minerale - L2S3-MPCI - SEADocument75 paginiCopie de Chimie Minerale - L2S3-MPCI - SEAknikiema28Încă nu există evaluări
- MedjourDocument16 paginiMedjournadaÎncă nu există evaluări
- The Crime and Punishment of IGFarbenDocument255 paginiThe Crime and Punishment of IGFarbenragod2Încă nu există evaluări
- DM 6. Thermo Second PCP Et OptimisationDocument10 paginiDM 6. Thermo Second PCP Et Optimisationhabet.houria63Încă nu există evaluări
- Grands Volumes de Produits Chimique Inorganiques Ammoniac, Acides Et EngraisDocument471 paginiGrands Volumes de Produits Chimique Inorganiques Ammoniac, Acides Et EngraisYassine LemsyehÎncă nu există evaluări
- AP08 Synthese AmmoniacDocument2 paginiAP08 Synthese AmmoniacnadaÎncă nu există evaluări
- FR Reactions AmmoniacDocument3 paginiFR Reactions AmmoniacErina KhÎncă nu există evaluări
- CG GC 2007Document3 paginiCG GC 2007Kacem MokdedÎncă nu există evaluări
- BREF Produit Chimie Inorganiques AAFDocument471 paginiBREF Produit Chimie Inorganiques AAFEstebanÎncă nu există evaluări
- Sujet 14Document7 paginiSujet 14KhairLatamnaÎncă nu există evaluări
- CIA Heterogene 2011 PDFDocument22 paginiCIA Heterogene 2011 PDFabderrahimnÎncă nu există evaluări
- Synthèse D'ammoniacDocument20 paginiSynthèse D'ammoniacSơn PhanThanh100% (1)
- 2.2. Synthèse Et Stockage de L'ammoniacDocument8 pagini2.2. Synthèse Et Stockage de L'ammoniacVeron djonkepÎncă nu există evaluări
- EquilibDocument74 paginiEquilibcoucou8949Încă nu există evaluări
- Séance 1Document15 paginiSéance 1zizi abdeessamadÎncă nu există evaluări
- Chapitre 2Document11 paginiChapitre 2infor. andÎncă nu există evaluări
- E chmp2016Document5 paginiE chmp2016christina.tchissamboÎncă nu există evaluări
- Ammoniac, AnhydreDocument110 paginiAmmoniac, AnhydreMourad RabahÎncă nu există evaluări
- Synthèse de L'ammoniac Exercice de Sciences Physiques de Maths Sup - 287013Document3 paginiSynthèse de L'ammoniac Exercice de Sciences Physiques de Maths Sup - 287013Rode NkontaÎncă nu există evaluări