Documente Academic
Documente Profesional
Documente Cultură
Exercices Corriges Chimie en Solution
Încărcat de
Khalid ZegDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Exercices Corriges Chimie en Solution
Încărcat de
Khalid ZegDrepturi de autor:
Formate disponibile
Page 1 sur 20
QUILIBRES EN SOLUTION
AQUEUSE
EXERCICES
Chapitre 1
1 SENS DVOLUTION DUNE TRANSFORMATION CHIMIQUE
Soit la raction doxydation du mtal cuivre par une solution aqueuse dacide nitrique H
, NO
,
dquation chimique :
3Cu
s
+ 8H
O
aq
+ 2NO
aq
= 3Cu
aq
+ 2NO
g
+12H
O
liq
La constante dquilibre de cette raction vaut, 25C :
= 10
.
un instant donn, la solution de volume = 500 mL contient 0,015 mol dions Cu
dissous, une
concentration en ions nitrate de [NO
] = 80 mmol L
, et son pH est de 1,0.
Un morceau de cuivre de 12 grammes est immerg dans la solution (
Cu
= 63,5 g mol
).
La solution est surmonte dune atmosphre o la pression partielle en monoxyde dazote est de
NO
= 15 kPa.
Calculer le quotient ractionnel cet instant et en dduire si la raction chimique doxydation du
cuivre est lquilibre. Dans le cas contraire, prvoir son sens dvolution.
2 QUILIBRE EN PHASE GAZEUSE
On sintresse lquilibre en phase gazeuse ci-dessous :
2NO +Br
= 2NOBr
On introduit jusqu la pression
= 6000 Pa dans un rcipient de volume constant = 2,000 L
initialement vide de loxyde dazote NO initialement la temprature
= 300 K.
On ajoute ensuite dans ce rcipient une masse
Br
= 300 mg de dibrome. La temprature du mlange
est porte
= 333 K. Une fois ltat dquilibre tabli, la pression totale dans le rcipient est
= 8220 Pa.
Les gaz sont supposs parfaits et on rappelle : = 8,31
mol
.
Masse molaire du dibrome : (Br
) = 159,81
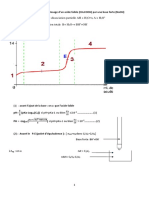
1) Calculer la quantit de matire de chaque compos introduit dans le rcipient.
2) Calculer la quantit de matire totale lquilibre.
3) Dduire des questions prcdentes lavancement de la raction lquilibre.
4) Calculer la pression partielle de chaque compos lquilibre.
5) Calculer la constante dquilibre de la raction la temprature
.
Page 2 sur 20
3 TUDE DU COUPLE CH
COOH/CH
COO
On donne :
p
(CH
COOH/CH
COO
) = 4,8
Densit de lacide actique : = 1,05
Masse molaire de lacide actique : = 60,05
1) Tracer le diagramme de prdominance de lacide actique et de lion actate en solution aqueuse
en fonction du pH.
2) On constitue une solution aqueuse (S1) de la manire suivante : dans une fiole jauge de
= 500 mL est introduit un volume
= 10,0 mL dacide actique glacial (pur). On complte au trait
de jauge avec de leau distille, en agitant rgulirement. On obtient une solution limpide. Une analyse
rapide laide de papier pH montre que le pH de la solution ainsi constitue est compris entre 2 et 3.
a) Dterminer la concentration apporte en acide actique dans la solution (S1).
b) crire lquation chimique de mise en solution aqueuse de lacide actique.
c) En observant le diagramme de prdominance, que peut-on dduire du rsultat fourni par
le papier pH ?
d) En dduire, par le calcul le plus simple possible, la concentration de toutes les espces en
solution et donner la valeur du pH de la solution (S1) avec un chiffre aprs la virgule.
3) la solution prcdente est ajout un volume
= 100 mL dune solution de soude de
concentration
= 1,00
. Aprs agitation, on obtient une solution (S2).
a) crire un mode opratoire pour indiquer un apprenti technicien comment prparer le
volume
= 100 mL de la solution de soude. On suppose quon dispose de pastilles
dhydroxyde de sodium pur au laboratoire.
b) Quelle est la nouvelle concentration apporte dacide actique dans la solution ?
c) Quelle est la concentration apporte dhydroxyde de sodium ?
d) crire lquation chimique de la raction acido-basique entre la soude et lacide actique.
Calculer sa constante dquilibre ; conclure. Faire un bilan de concentrations en ne
considrant que cette raction.
e) Quelles sont les espces majoritaires et minoritaires dans cette solution ? Justifier la
rponse, qualitativement, puis numriquement.
f) La solution (S2) est qualifie de solution tampon. Quelles sont les proprits dune telle
solution ?
4 PRCIPITATION DE CHLORURE DE PLOMB ?
On mlange deux solutions, lune de nitrate de plomb, lautre de chlorure de sodium, de telle sorte que
les concentrations apportes dans le mlange soient :
1)
Pb
= 0,01 mol L
et
Cl
= 0,20 mol L
;
2)
Pb
= 0,05 mol L
et
Cl
= 0,03 mol L
;
3)
Pb
= 0,002 mol L
et
Cl
= 0,001 mol L
.
Sachant que le produit de solubilit du chlorure de plomb vaut
= 1,6 10
, dterminer ltat
dquilibre pour chacun des trois cas (solution limpide ou prsence dun prcipit, concentration des
ions).
Page 3 sur 20
Chapitre 2
5 DIAGRAMME DE RPARTITION DE LACIDE CITRIQUE
Lacide citrique de formule C
est un triacide, que lon notera H
A. Son diagramme de rpartition
en fonction du pH est donn ci-aprs. Les courbes traces reprsentent le pourcentage de chacune des
espces contenant A lorsque le pH varie.
1) Identifier chacune des courbes.
2) En dduire les constantes p
et
relatives aux trois couples mis en jeu ( = 1,2,3).
3) Dterminer lquation des courbes de rpartition.
4) On prpare
= 250 mL de solution en dissolvant dans de leau distille
= 1,05 g dacide
citrique monohydrat C
, H
O. La solution est agite jusqu atteindre son tat dquilibre. On
notera (S) cette solution lquilibre.
On introduit dans (S) quelques gouttes dhliantine. Une coloration rose apparat, ce qui montre que le
pH de la solution est infrieur 3,1.
a) Calculer la concentration apporte
en acide citrique.
b) Daprs le diagramme de rpartition, quelles sont les formes acido-basiques de lacide
citrique dont la concentration est ngligeable dans (S) ?
c) crire lquation chimique de la raction responsable du fait que la solution (S) soit acide.
d) Dterminer par le calcul la concentration des espces non ngligeables dans (S), leur
pourcentage, ainsi que le pH de la solution. Vrifier graphiquement.
e) Dterminer alors la concentration des espces minoritaires et vrifier quon avait bien
raison de les ngliger.
Masses molaires en
: H : 1,0 ; C : 12,0 ; O : 16,0
%
1 4
2 3
pH
6 COMPLEXATION DES IONS CUIVRE (II) CU
PAR LES IONS THIOCYANATE SCN
Le diagramme de distribution des espces pour les complexes des ions thiocyanate SCN
et des ions
Cu
en fonction de pSCN = log
[SCN
(o
= 1
) est donn ci-aprs.
Page 4 sur 20
Lindice de coordination (nombre de ligands dans un complexe) varie de 1 4. Les courbes traces
reprsentent les pourcentages de chacune des espces comportant llment cuivre lorsque pSCN
varie.
Les complexes
1) Le numro atomique du cuivre est = 29. En dduire la position de cet lment dans le tableau
priodique (numro de ligne, numro de colonne) en justifiant la rponse. Donner la
configuration lectronique de lion Cu
.
2) Montrer que le ligand thiocyanate SCN
peut tre crit selon deux formes msomres de
reprsentativit proche (le soufre est situ sous loxygne dans la classification). Expliquer alors
pourquoi on qualifie ce ligand de ligand ambident, et non pas de ligand bident.
3) Donner la formule du complexe correspondant chacune des courbes de distribution. Quel
complexe se rapproche le plus de la rgle des dix-huit lectrons ?
4) Dterminer les constantes de formation successives
de ces complexes. On justifiera la
mthode utilise.
5) Le complexe correspondant la courbe 4 a une forte tendance la dismutation. quoi le voit-on
sur le diagramme de distribution ? crire une quation chimique qui rende compte de ce
phnomne et calculer sa constante dquilibre.
Complexation en dfaut de ligand
On constitue une solution aqueuse en dissolvant une masse = 2,10 g de sulfate de cuivre
pentahydrat (CuSO
, 5 H
O) dans une solution contenant 1,0 10
mol de thiocyanate de potassium
KSCN. On obtient = 250 mL de solution.
6) Calculer les concentrations apportes en ions Cu
et SCN
. Pourquoi est-il raisonnable de
penser que seul le complexe comportant un seul ligand devrait se former notablement dans ces
conditions ?
7) crire la raction de complexation et calculer son avancement volumique lquilibre. En
dduire les pourcentages de rpartition des espces Cu
et du complexe, et vrifier sur le
graphe de distribution.
8) Calculer les concentrations des trois autres complexes et vrifier quelles sont bien ngligeables.
Page 5 sur 20
7 COCKTAILS ACIDO-BASIQUES
Exercice de cours reprenant diverses situations usuelles de mlanges dacides et de bases.
rsoudre par la mthode de la raction prpondrante.
Calculer le pH des solutions de volume 1,00 L obtenues en dissolvant :
1) 0,010 mol de chlorure dhydrogne et 0,020 mol dacide actique ;
2) 0,010 mol de chlorure dhydrogne et 0,020 mol dhydrognosulfate de sodium ;
3) 0,10 mol de fluorure dhydrogne et 0,20 mol dacide actique ;
4) 0,10 mol de fluorure dhydrogne et 0,50 mol dacide formique ;
5) 0,015 mol de chlorure dammonium et 0,020 mol dactate de sodium ;
6) 0,030 mol dhydrognosulfure de sodium NaHS ;
7) 0,10 mol de chlorure dhydrogne, 0,20 mol dacide sulfurique et 0,35 mol dhydroxyde de
sodium ;
8) 0,10 mol de chlorure dammonium, 0,050 mol dactate dammonium, 0,15 mol dacide actique,
et 0,15 mol dhydroxyde de sodium ;
9) 0,010 mol dacide sulfurique, 0,015 mol dammoniac et 0,0050 mol de chlorure dammonium ;
calculer ensuite le nombre de moles dhydroxyde de sodium quil faudrait ajouter cette
solution pour avoir un pH gal 10,0 (on ne tiendra pas compte de la dilution) ;
10) 0,010 mol dacide sulfurique, 0,0050 mol de chlorure dammonium, 0,020 mol dammoniac et
0,010 mol dactate de sodium.
Donnes :
couple NH
/NH
HF/F
CH
COOH
/CH
COO
HCOOH
/HCOO
HSO
/SO
S/HS
HS
/S
9,2 3,2 4,8 3,8 2,0 7,0 13,0
8 PLUIES ACIDES
Leau de pluie est naturellement acide (pH voisin de 6), en raison du dioxyde de carbone quelle
dissout. Cette acidification est trs nettement augmente dans les zones forte activit industrielle. La
pollution par les oxydes de soufre constitue lune des hypothses avances pour expliquer ce
phnomne.
Pour modliser leffet de SO
sur lacidit de leau, on place de leau initialement pure dans un rcipient
lintrieur duquel est maintenue une pression constante de dioxyde de soufre gazeux gale
8,0 10
bar.
SO
sera considr comme un gaz parfait. La temprature est de = 25.
Le dioxyde de soufre se dissout et shydrate selon les quilibres suivants :
SO
(g)
SO
(aq)
(1)
SO
(aq)
+H
O H
SO
(aq)
(2)
Pour la commodit des calculs, les quilibres (1) et (2) sont regroups et lquilibre (3) rsultant est
caractris par sa constante thermodynamique
= 1,25 :
SO
(g)
+H
O H
SO
(aq)
(3)
1) Tracer le diagramme de prdominance des espces acido-basiques du soufre intervenant dans la
solution aqueuse.
Donnes :
p
= p
(H
SO
/HSO
) = 1,8 ; p
= p
(HSO
/SO
) = 7,2
2) Sachant que la solution lquilibre est plus acide que leau de pluie naturelle, quelle espce du
diagramme de prdominance prcdent est assurment en concentration ngligeable ?
3) En dduire lquation chimique responsable majoritairement de lacidification de leau partir
de H
SO
.
Page 6 sur 20
4) Dterminer partir de lquilibre (3) la concentration de H
SO
lquilibre. Calculer alors le pH
de la solution aqueuse.
5) Vrifier lhypothse formule au 2).
9 COMPLEXES DE LION MANGANSE (II) AVEC LES IONS OXALATE
Les raisonnements sont les mmes avec les couples de complexation quavec les couples acido-basiques.
La particule change est lion oxalate ; elle est lquivalent de H
en acido-basicit
Lion Mn
donne avec les ions oxalate C
deux complexes : [Mn(C
)]et [Mn(C
tels que
log
= 3,82 et log
= 5,25.
1) Tracer le diagramme de prdominance des espces en fonction de pL = log[C
.
2) Dterminer la composition de la solution obtenue en dissolvant dans 100 mL deau une quantit
de sulfate de manganse (II) et une quantit
doxalate de sodium dans les deux cas
suivants :
a)
= 4,0 10
mol et
= 2,0 10
mol ;
b)
= 2,0 10
mol et
= 8,0 10
mol.
10 COMPLEXES DU FER (III)
Dans cet exercice, on voit que la particule change peut tre le cation mtallique plutt que le ligand ce
qui ne change rien aux raisonnements !
On considre une solution aqueuse contenant des ions Fe
la concentration apporte
= 1,0
10
.
1) cette solution est ajout du thiocyanate dammonium, de telle sorte que la concentration
apporte en ions thiocyante (SCN
) soit gale
= 2,0 10
.
Il se forme un complexe rouge vif [Fe(SCN)]
, dont on donne la constante de formation
= 100.
a) crire lquilibre de formation du complexe.
b) Tracer le diagramme de prdominance associ au couple [Fe(SCN)]
/SCN
, la particule
change tant le cation Fe
.
c) Calculer les concentrations des espces Fe
, SCN
et du complexe [Fe(SCN)]
lquilibre.
2) la solution du 1) on ajoute prsent un sel soluble contenant lion fluorure, de telle sorte que
la concentration apporte en ion fluorure soit gale
= 1,0 10
. On observe
rapidement une dcoloration de la solution, qui tait auparavant rouge vif en raison de la
prsence de thiocyanate ferrique.
On donne la constante de formation du complexe incolore [FeF]
= 10
,
.
a) Complter le diagramme du 1)b) en traant le diagramme de prdominance associ au
couple [FeF]
/F
.
b) Dterminer la composition finale de la solution en donnant les concentrations lquilibre
des espces Fe
, SCN
, F
et des complexes [Fe(SCN)]
et [FeF]
.
11 COMPLEXATIONS COMPTITIVES DE LION THIOSULFATE
Cas o deux cations sont en comptition en tant quaccepteurs du ligand thiosulfate. Qui va lemporter ?..
Lion thiosulfate S
donne, avec lion Ag
, le complexe [Ag(S
de constante de formation
globale
= 10
,
; il donne aussi, avec lion Hg
, le complexe [Hg(S
de constante de
formation globale
= 10
.
On mlange
= 20,0 mL de solution de nitrate dargent
= 2,00 10
et
= 30,0 mL
de solution de thiosulfate de potassium
= 5,00 10
.
Page 7 sur 20
1) Tracer les diagrammes de prdominance.
2) Dterminer la composition du mlange obtenu.
3) la solution ci-dessus, on ajoute
= 50,0 mL de solution de nitrate de mercure (II)
= 4,00 10
. Dterminer la composition de la solution alors obtenue.
12 LAMMONIAC EST UNE BASE ET UN LIGAND
Lammoniac est la fois une base de Brnsted et une base de Lewis. Dans cet exercice, ces deux proprits
interviennent simultanment !
Soit une solution S, obtenue en mlangeant 500 mL de solution dammoniac NH
2,0 10
et 500 mL de solution de chlorure dammonium 2,0 10
.
1) Calculer le pH de S.
2) On ajoute, sans dilution, 0,40 mol de nitrate dargent. Dterminer les concentrations de toutes
les espces en solution et donner le pH de la solution ainsi obtenue.
Donnes :
p
(NH
/NH
) = 9,2 ; log
([Ag(NH
)]
= 3,3 ; log
([Ag(NH
) = 7,2
13 PROPRITS ACIDO-BASIQUES DE LA VITAMINE C
La vitamine C, ou acide ascorbique, note AscH
, a pour formule semi-dveloppe :
O
O
OH
O H
H
CH
2
OH H
O H
Il sagit dun diacide, de p
= 4,2 et p
= 11,6.
On donne :
- la masse molaire de lacide ascorbique :
AscH
= 176
;
- la masse molaire de lascorbate de sodium :
AscHNa
= 198
.
pH dune solution S
de vitamine C
On introduit un comprim de vitamine C contenant
= 500 mg dacide ascorbique dans une fiole
jauge de volume
= 200 mL. On ajoute de leau distille, on agite pour dissoudre le comprim, on
complte au trait de jauge et on agite nouveau pour homogniser.
La solution obtenue est nomme S
.
1) Calculer la concentration apporte
, en
, de la solution S
en acide ascorbique.
2) Nommer les lectrodes constituant le pH-mtre. Rappeler le principe de la mesure ; justifier et
dcrire la procdure dtalonnage.
3) Tracer le diagramme de prdominance des formes acido-basiques de la vitamine C et expliquer
pourquoi lespce Asc
est ncessairement ngligeable dans la solution S
lquilibre.
4) crire lquation chimique de la raction prpondrante qui se produit lorsquon dissout le
comprim de vitamine C. Calculer le pH de la solution S
, en justifiant soigneusement les
approximations faites.
Titrage de S0
On souhaite vrifier que le comprim contient bien
= 500 mg dacide ascorbique, autrement dit
que la solution S
a bien la concentration
calcule la question 1).
5) Expliquer pourquoi une simple mesure de pH nest pas satisfaisante pour effectuer cette
vrification.
Page 8 sur 20
On prlve alors
= 100 mL de la solution S
et on procde son titrage, en utilisant la pH-mtrie
comme mthode de suivi.
Le ractif titrant est une solution S
dhydroxyde de sodium, de concentration prcisment connue
= 0,100
.
6) crire la raction de titrage se produisant au dbut du dosage et calculer sa constante
dquilibre.
7) La courbe de titrage exprimentale pH = () est reprsente ci-aprs. Exploiter cette courbe
pour en dduire la concentration de la solution en acide ascorbique et conclure.
8) Par application de la mthode de la raction prpondrante, prciser quoi est quivalente la
solution au point thorique =
et calculer le pH en ce point.
9) Montrer qu la demi-quivalence de ce titrage ( =
), on doit retrouver pH = p
= 4,2.
Justifier soigneusement les approximations.
10) Quelle raction de titrage peut-on crire aprs lquivalence ? Expliquer pourquoi aucun saut de
pH nest dcelable pour cette raction.
Comprim de vitamine C tamponne
La vitamine C existe en comprim, sous forme tamponne, ralis en mlangeant de lacide ascorbique
AscH
et de lascorbate de sodium AscHNa.
Un comprim de vitamine C tamponne, de masse 500 mg en principe actif, est dissous dans 100 mL
deau distille. La solution obtenue a un pH gal 4,4.
11) Dterminer la masse dacide ascorbique et la masse dascorbate de sodium contenues dans ce
comprim.
On rappelle quun comprim de masse 500 mg en principe actif contient une quantit de vitamine C
telle que si toutes les formes acido-basiques sont converties en AscH
, la masse de AscH
est alors de
500 mg.
14 TITRAGE DACIDES FAIBLES PAR UNE BASE FAIBLE
On dose
= 10,0 mL dune solution aqueuse contenant de lacide formique (HCOOH) en
concentration initiale
et de lacide hypochloreux (HClO) en concentration initiale
, par
du phnolate de sodium en solution aqueuse, la concentration = 0,100
.
Page 9 sur 20
Le p
de lacide hypochloreux est dtermin par ailleurs et vaut : p
= 7,5.
1) crire les ractions se produisant. Sagit-il de dosages successifs ou simultans ?
2) Dterminer
et
ainsi que le p
= p
du couple acide formique/formiate et le p
= p
du couple phnol/phnolate.
3) Dterminer le degr dionisation de lacide formique dans la solution aqueuse initiale.
4) Calculer les pH lquivalence.
Donne : ci-aprs, la courbe de dosage pH = (), o est le volume (en mL) de solution de phnolate
de sodium vers. De plus, on a reprsent pH
=
dpH
d
sur le mme graphique.
15 TITRAGE PAR COMPLEXATION
Les ractions de titrage peuvent tout aussi bien tre des ractions de complexation. Dans cet exemple, la
particule change est le ligand NH
; la courbe de titrage est donc pNH
= ().
Les courbes de rpartition % = () fournies par le simulateur permettent de dterminer si les ractions
de titrage sont successives ou simultanes et de dterminer les constantes caractristiques des couples de
complexation.
Le document ci-aprs reprsente lvolution de pNH
= log[NH
] et du pourcentage des espces
Cu
, [Cu(NH
)]
et [Cu(NH
lors de laddition dun volume (NH
) dune solution dammoniac
= 0,30
un volume
= 10,0 mL dune solution contenant des ions cuivre (I)
= 0,050
.
1) Identifier chacun des graphes.
2) En dduire, par simple lecture sur le graphe, les constantes de formation successives des deux
complexes.
3) Dterminer, par le calcul, la composition de la solution lorsque :
a) (NH
) = 1,5 mL ;
b) (NH
) = 3,0 mL.
Vrifier sur le document les rsultats obtenus.
Page 10 sur 20
Chapitre 3
16 COMPTITION ENTRE PRCIPITS
Lallure du diagramme avec ses points anguleux A et B est caractristique du phnomne de rupture
dquilibre quest lapparition ou la disparition dun prcipit.
En prsence dions iodure, les ions Pb
donnent un prcipit jaune et les ions Hg
un prcipit
rouge-orang. Lorsquon ajoute goutte goutte des ions Hg
dans un tube essais contenant un
prcipit diodure de plomb, le prcipit devient rouge-orang ds les premires gouttes.
1) Que peut-on conclure de cette observation ?
2) Le document ci-aprs correspond la simulation de lajout dune solution dions iodure une
solution quimolaire en ions Pb
et Hg
, toutes deux 0,100
. Les graphes tracs
reprsentent le pourcentage de cations mtalliques prsents dans la solution en fonction de
pI = log[I
].
a) Identifier les deux courbes traces.
b) Que reprsentent les points anguleux ? En dduire les produits de solubilit de PbI
et
HgI
.
c) Dterminer la constante dquilibre de la raction qui se produit lorsquon met en
prsence des ions Hg
avec un prcipit diodure de plomb.
Page 11 sur 20
17 SOLUBILITS
Cet exercice est un exercice de cours. Il rassemble diffrents calculs-type de solubilit classs par difficult
croissante.
1) Calculer la solubilit du chlorure dargent et du chlorure de plomb dans leau pure.
Donnes :
(AgCl) = 1,8 10
(PbCl
) = 1,2 10
2) Calculer la solubilit du chlorure dargent et du chlorure de plomb dans une solution de chlorure
de sodium de concentration = 1,0 10
.
Donnes :
(AgCl) = 1,8 10
(PbCl
) = 1,2 10
3) Calculer la solubilit de lactate dargent dans leau pure.
Donnes : p
(CH
COOAg) = 2,7 ; p
(CH
COOH/CH
COO
) = 4,8
4) Calculer la solubilit du carbonate de plomb dans leau pure.
Donnes :
(PbCO
) = 1,5 10
; p
(HCO
/CO
) = 10,3
5) Calculer la solubilit du carbonate de calcium (calcaire) dans leau pure.
Donnes : p
(CaCO
) = 8,3 ; p
(HCO
/CO
) = 10,3
6) Calculer la solubilit de lactate dargent dans une solution dacide nitrique de concentration
= 0,100
.
Donnes : p
(CH
COOAg) = 2,7 ; p
(CH
COOH/CH
COO
) = 4,8
7) Calculer la solubilit du sulfure de manganse dans une solution dacide chlorhydrique de
concentration = 0,200 L
.
Donnes : p
(MnS) = 9,6 ; p
(H
S/HS
) = 7,0 ; p
(HS
/S
) = 12,9
8) Calculer la solubilit de lhydroxyde de cadmium dans leau pure, puis dans une solution
dammoniac molaire (1
).
Donnes : p
(Cd(OH)
) = 14,0 ; log ([Cd(NH
) = 7,0 ; p
(NH
/NH
) = 9,2
18 LE ZINC (II) EN SOLUTION AQUEUSE
Cet exercice est un grand classique. Connatre le comportement dun cation mtallique en solution
aqueuse est essentiel en hydromtallurgie, afin de connatre le pH choisir selon que lon veut lavoir en
solution (pour une lectrolyse ultrieure conduisant lobtention du mtal) ou au contraire le prcipiter,
sil sagit dune impuret liminer.
1) On introduit = 1,0 10
mol dions Zn
dans 1,00 L deau. tudier la solubilit de
lhydroxyde de zinc Zn(OH)
en fonction du pH. Reprsenter la courbe log = (pH).
Page 12 sur 20
Le terme solubilit est comprendre dans cette question comme la concentration totale en zinc(II)
dissous . Le zinc(II) peut ici tre dissous sous deux formes : lion Zn
libre et le complexe [Zn(OH)
(ion zincate). Commencer par tracer le diagramme de prdominance de ce couple de complexation en
fonction du pH
2) Calculer la solubilit de Zn(OH)
dans leau pure.
Donnes :
p
(Zn(OH)
) = 16,4 ; log ([Zn(OH)
) = 15,4
19 TITRAGE DUNE SOLUTION DIONS CHLORURE PAR LA MTHODE DE MOHR
Exemple dutilisation dun prcipit en tant qu indicateur color.
On introduit dans un bcher un volume
= 20,0 mL dune solution de chlorure de sodium de
concentration
= 5,00 10
molL
.
Afin de vrifier la valeur de
, cette solution est titre par une solution de nitrate dargent, de
concentration
= 0,0250 mol L
.
1) crire la raction de titrage.
2) Sachant quune goutte dlivre par une burette a environ un volume d1/20
me
de millilitre, la
raction de titrage dbute-t-elle ds la premire goutte de nitrate dargent vers ?
3) Calculer le volume quivalent
.
Afin de dtecter exprimentalement cette quivalence, on ajoute dans la solution avant le titrage
quelques gouttes de solution incolore de chromate de sodium Na
CrO
.
4) Sachant que les ions chromate sont susceptibles de donner avec les ions Ag
un prcipit rouge
vif de chromate dargent, calculer la concentration
en ions chromate apporter dans la
solution initiale pour que lapparition du prcipit rouge se produise exactement lquivalence,
et permette ainsi de dtecter celle-ci avec prcision.
5) En quoi la prcision du titrage serait-elle affecte si on introduisait au dbut du titrage une
concentration 10
de chromate de sodium ? une concentration
/10 ? Commenter.
Donnes :
AgCl : p
= 9,8 ; Ag
CrO
: p
= 12,0
20 TITRAGE ET SPARATION DUN MLANGE DHALOGNURES
Ce titrage sera ralis exprimentalement en TP au chapitre suivant, lorsquon disposera de la mthode
potentiomtrique pour le suivi de pAg.
On dispose dans un bcher dun volume
= 100 mL dune solution aqueuse de chlorure de sodium
= 0,100
et de bromure de sodium
= 0,200
.
On dispose dautre part dune solution de nitrate dargent = 1,00
dans une burette de 50
mL.
1) Tracer les domaines dexistence des prcipits AgCl et AgBr en fonction de pAg pour les
concentrations
en Cl
et
en Br
.
2) Dcrire les phnomnes qui se produisent lorsquon introduit progressivement le nitrate
dargent de la burette dans le bcher. Simuler la courbe pAg = () au cours de cette addition.
En dduire que cette opration pourrait tre utilise pour dterminer les concentrations
et
si elles taient inconnues.
3) Peut-on rcuprer un prcipit absolument pur ? Lequel ? Pour quel volume de nitrate dargent
vers ? Quel est le rendement maximal thorique en ce prcipit pur ?
Donnes :
AgCl : p
= 9,8 ; AgBr : p
= 12,3
Page 13 sur 20
21 TITRAGE DUNE SOLUTION ACIDIFIE DALUMINIUM (III)
Les ractions de titrage sont ici des ractions acido-basiques, de complexation et de prcipitation ! Pour
sy retrouver, reprer immdiatement un point crucial : le point anguleux B
Le document ci-aprs donne les graphes obtenus par simulation du dosage de
= 10,0 mL dune
solution contenant de lacide chlorhydrique la concentration
et du chlorure daluminium la
concentration
par une solution de soude 0,100
.
Les courbes traces reprsentent pH = () et le pourcentage de chacune des espces en solution
contenant llment aluminium, cest dire Al
et [Al(OH)
.
1) Identifier chacune des courbes.
Pour chacune des portions AB, BC et CD, crire lquation chimique de la raction de titrage qui
se produit.
2) En dduire
et
.
3) Dterminer
(Al(OH)
) et ([Al(OH)
) partir de points, pris lun sur la portion BC, lautre
sur la portion CD.
4) Calculer la solubilit de Al(OH)
dans leau pure.
22 DOSAGES DUNE SOLUTION DACIDE PHOSPHORIQUE
Premire partie : dosage acido-basique direct
On souhaite effectuer le dosage de
= 50,0 mL dune solution dacide phosphorique H
PO
de
concentration
= 1,00 10
, par une solution de soude (hydroxyde de sodium) de
concentration = 0,100
.
Le dosage est suivi par pH-mtrie.
La temprature est fixe 25, temprature laquelle le produit ionique de leau vaut
= 1,0
10
.
On admettra que la dilution est ngligeable dans tout lexercice, cest--dire que le volume du bcher
reste constant
= 50,0 mL.
Lacide phosphorique est un triacide, que lon pourra noter H
A et dont les p
sont les suivants :
p
= 2,1 ; p
= 7,2 et p
= 12,4.
Page 14 sur 20
1) Rappeler en quelques lignes le principe dune mesure pH-mtrique, les lectrodes utiliser et la
procdure dtalonnage.
2) crire lquation chimique des ractions de titrage, notes (RT1), (RT2) et (RT3) et calculer leur
constante dquilibre.
3) Calculer les volumes quivalents thoriques
et
.
4) combien de sauts de pH marqus doit-on sattendre ? Justifier la rponse sans faire de calcul.
5) Calculer le pH de la solution initiale.
6) Dmontrer que lon mesure pH = p
= 7,2 la demi-quivalence de (RT2), puis expliquer sans
calcul pourquoi on ne mesure pas les autres p
aux deux autres demi-quivalences.
7) Calculer le pH approximatif de la solution en
et
. Remarque : dans chacun des cas, le calcul
prcis du pH, par la mthode de la raction prpondrante, ncessiterait la prise en compte de deux
ractions peu avances simultanment. On pourra ici admettre quon obtient une valeur approche
satisfaisante du pH en ne considrant que la raction la plus avance des deux.
8) Tracer lallure de la courbe de titrage pH = () en plaant tous les points particuliers
dtermins prcdemment (on donne, de plus, pH = 11,9 en =
).
Sur la courbe prcdente (utiliser des couleurs et une lgende claire !), tracer lallure des courbes
reprsentant lvolution des quantits de matire des diffrentes formes de lacide
phosphorique
H
A
,
H
A
,
HA
et
A
dans le bcher au cours du titrage.
Deuxime partie : dosage en prsence de lion Ag
Lion Ag
forme avec lion phosphate PO
= A
un sel peu soluble Ag
PO
, de produit de solubilit
= 10
,
.
On cherche tout dabord dterminer la solubilit de Ag
PO
dans leau pure.
9) crire les quations chimiques des ractions susceptibles de dcrire au mieux la dissolution du
phosphate dargent solide dans leau pure.
10) laide dapproximations clairement justifies, dterminer la concentration des espces
prdominantes en solution suite la dissolution et en dduire la solubilit du solide et le pH de
la solution sature ainsi obtenue.
On introduit dans un bcher un volume
= 50,0 mL dune solution dacide phosphorique H
PO
de
concentration
= 1,00 10
contenant galement du nitrate dargent (sel entirement
dissous en ions Ag
et NO
) la concentration
= 3,00 10
.
La figure ci-aprs reprsente lvolution du pH au cours du titrage de la solution prcdente par une
solution de soude (hydroxyde de sodium) de concentration = 0,100
.
0 5 10 15 20 25 30 35 40 45 50
volume de soude vers en mL
Page 15 sur 20
11) En utilisant le pH initial lu graphiquement (ou la valeur calcule la question 5), estimer lordre
de grandeur de la concentration en ion phosphate A
= PO
.
En dduire que la solution est initialement limpide (absence du prcipit de phosphate
dargent).
12) crire la raction de titrage (RT1) se droulant entre = 0 et le saut de pH
= 5,0 mL. Ce
saut de pH est interrompu par un point anguleux : interprter.
13) Entre
= 5,0 mL et
= 15,0 mL on observe une augmentation de la quantit de prcipit
dans le bcher. crire la raction de titrage (RT2) qui se produit sur cette portion.
Justifier les
= 10,0 mL de soude ncessaires pour cette raction (RT2).
Le saut de pH observ la fin de (RT2) est lui aussi interrompu par un point anguleux. Ceci peut
sinterprter par lapparition dun nouveau prcipit dhydroxyde dargent Ag(OH), plus stable que le
prcipit Ag
PO
en prsence dun excs dions HO
.
On donne :
Ag(OH) =
= 10
,
.
14) Par lecture graphique du pH, estimer la concentration rsiduelle en ions Ag
lorsque le prcipit
Ag(OH) apparat.
En dduire que la raction (RT2) peut tre considre comme termine lorsque la raction de
titrage suivante commence
15) crire la raction de titrage (RT3) qui se produit sur la portion entre
= 15,0 mL et
= 25,0 mL. Justifier les
= 10,0 mL ncessaires pour cette raction (RT3).
16) Justifier le point anguleux observ en
= 25,0 mL et interprter lallure de la courbe pH-
mtrique au-del de ce point.
Chapitre 4
23 NOMBRES DOXYDATION
Pour chacune des espces suivantes, tablir la reprsentation de Lewis, donner la gomtrie par la
mthode VSEPR et dterminer le nombre doxydation de chacun des atomes :
ClO
; Cl
O ; SO
; SO
Cl
; MnO
; Mn
(o un atome doxygne assure la liaison entre deux
atomes de manganse).
Dterminer si les couples suivants sont des couples acido-basiques ou doxydorduction : ClO
/Cl
O ;
SO
Cl
/SO
; Mn
/ MnO
.
24 RACTIONS REDOX EN MILIEU ACIDE
Il sagit dquilibrer des quations chimiques doxydorduction en utilisant la particule H
sil est
ncessaire dquilibrer en hydrogne (I). Les quations chimiques obtenues permettront de raliser des
bilans de matire en milieu aqueux acide, c'est--dire lorsque H
(H
) est consomm ou produit dans
des concentrations usuelles despces majoritaires.
Par ailleurs, les potentiels standard
(Ox/Red) tant toujours dfinis pH = 0,0, il faut toujours
quilibrer avec H
une demi-quation lectronique lorsquon va lutiliser pour appliquer la formule de
Nernst.
quilibrer les quations chimiques des ractions suivantes, qui se produisent en milieu acide :
1) HBrO +Br
= Br
2) C
OH +MnO
= CH
COOH+Mn
3) Cr
+I
= Cr
+I
4) IO
+H
= I
+O
5) HNO
+I
= NO +I
6) HgS +NO
+Cl
= HgCl
+NO +S
Page 16 sur 20
25 RACTIONS REDOX EN MILIEU BASIQUE
Cette fois, on demande dutiliser la particule HO
pour quilibrer. Les quations chimiques obtenues
permettront de raliser des bilans de matire en milieu aqueux basique, c'est--dire lorsque HO
est
consomm ou produit dans des concentrations usuelles despces majoritaires.
quilibrer les quations chimiques des ractions suivantes, qui se produisent en milieu basique :
1) Fe(OH)
+Pb
= Fe(OH)
+Pb
2) [CuT
+CH
CHO = Cu
O +T
+CH
COO
, o T
reprsente lion tartrate
3) BrO
+F
= BrO
+F
4) MnO
+MnO
= MnO
5) I
+H
AsO
= I
+HAsO
6) ClO
+C +Ca
= ClO
+CaCO
26 TUDE DUNE PILE
On considre la pile schmatise par :
Ag Ag
() Zn
() Zn
avec = 0,18
et
= 0,30
.
Le compartiment de gauche a un volume = 100 mL ; celui de droite
= 250 mL.
1) Dterminer la force lectromotrice de cette pile. crire la raction de fonctionnement.
2) Dterminer la composition de la pile lorsquelle ne dbite plus.
Donnes :
Zn
/Zn :
= 0,76 V ; Ag
/Ag :
= +0,80 V
27 TUDE DUNE PILE COMBUSTIBLE AU MTHANOL
On constitue une pile en solution aqueuse dans laquelle le mthanol liquide est dissous dans leau. Il
est oxyd en dioxyde de carbone gazeux lune des lectrodes, tandis que le dioxygne gazeux est
rduit en eau lautre. Llectrolyte est une solution aqueuse dacide phosphorique.
Les deux lectrodes sont spares par une membrane poreuse, que lon supposera impermable au
mthanol mais permable lacide phosphorique.
1) Proposer un matriau pour les lectrodes. Justifier.
2) Faire un schma de cette pile en justifiant, vues les donnes, la polarit des lectrodes. Donner le
nom des lectrodes et le sens de circulation des lectrons dans le circuit extrieur.
3) Donner une reprsentation conventionnelle de cette pile.
4) Lorsque la pile dbite, crire les quations des ractions se produisant chaque lectrode, ainsi
que la raction doxydorduction globale de fonctionnement.
5) Donner lexpression littrale du potentiel de chaque lectrode.
Les gaz seront supposs parfaits et les solutions suffisamment dilues.
6) Exprimer la constante dquilibre de la raction de fonctionnement de la pile en fonction des
potentiels standard des couples (relation dmontrer).
7) La pile dbite un courant de 50 mA pendant 2 heures. Quelle masse de mthanol a t
consomme ?
8) Un des problmes techniques actuels est loxydation incomplte du mthanol en acide
mthanoque. crire cette demi-raction doxydorduction. Comment modifie-t-elle la quantit
dlectricit produite par une quantit donne de mthanol consomme ?
9) Un second problme est le passage du mthanol travers la membrane qui spare les deux
compartiments de la pile. En quoi ce passage est-il gnant ?
Donnes :
Page 17 sur 20
Masses molaires en
: H : 1,0 ; C : 12,0 ; O : 16,0
Constante de Faraday : = 9,65 10
On note :
ln10 = 0,059 V 25
28 MDIAMUTATION DU MANGANSE
1) Calculer les potentiels des frontires de stabilit des espces stables du manganse pH = 0.
Sagit-il de frontires dexistence ou de prdominance ? Tracer le diagramme.
2) Dterminer la valeur du potentiel standard
(MnO
/Mn
).
3) On mlange
= 10,0 mL de solution de sulfate de manganse et
= 10,0 mL de solution de
permanganate de potassium toutes deux
= 0,100
. Dterminer la composition
finale de la solution obtenue et la masse de solide form pH=0.
Donnes :
(MnO
/MnO
) = 1,70 V ;
(MnO
/Mn
) = 1,23 V ; (Mn) = 54,9
29 MLANGES DOXYDANTS ET DE RDUCTEURS DLMENTS MTALLIQUES
Quelques mlanges doxydants et de rducteurs. La mthode est toujours la mme vue depuis le chapitre
2 ! Noubliez pas de commencer par tracer les diagrammes de prdominance ou existence pour chaque
lment (cobalt, chrome et crium).
Calculer le potentiel de Nernst lquilibre pour chacun des mlanges suivants :
1) 0,10 mole de chrome mtal, 0,10 mole de cobalt mtal, 0,80 mole dions Ce
dans un volume de
solution de 1,00 L.
2) 0,10 mole de chrome mtal, 0,10 mole de cobalt mtal, 0,45 mole dions Ce
dans un volume de
solution de 1,00 L.
Donnes :
1 2 3 4 5
Couple Co
/Co Co
/Co
Cr
/Cr Cr
/Cr
Ce
/Ce
/V 0,28 +1,92 0,91 0,41 +1,72
30 MLANGES PROCHES DE LQUILIBRE
La simple chelle des potentiels standard permet de voir quapparemment il ne se passe rien quand on
ralise les mlanges suivants ! Quel potentiel dlectrode prendrait alors un fil de platine plong dans ces
solutions ?
Calculer le potentiel de Nernst des mlanges suivants, et les concentrations lquilibre :
1) Cr
: 0,10
+ Hg
: 0,30
;
2) I
: 3,0 10
+ Br
: 5,0 10
.
Donnes :
1 2 3 4
Couple Cr
/Cr
Hg
/Hg
/I
Br
/Br
/V 0,41 +0,91 +0,61 +1,09
Page 18 sur 20
31 SYSTMES DU CHLORE
Mdiamutation ou dismutation ? Tout dpend du pH !
1) Dans une solution aqueuse tamponne pH = 2,0, on introduit HClO 0,050
et Cl
0,050
. crire la raction doxydorduction se produisant. Calculer sa constante
dquilibre. Calculer les concentrations et le potentiel de Nernst lquilibre.
2) Mmes questions dans une solution de pH initial gal 2,0, non tamponne.
3) Mmes questions dans une solution non tamponne, de pH initial gal 13,3 (par apport dune
concentration
= 0,200
de soude).
Donnes :
Cl
(aq)
/Cl
= 1,395 V ; HClO/Cl
(aq)
:
= 1,615 V ; HClO/ClO
: p
= 7,53
32 SOLUBILIT DU BROMURE DARGENT EN PRSENCE DE CRIUM (IV)
O lon mle prcipitation et oxydorduction
Revoir lexercice Calculs de solubilits pour trouver les analogies avec les situations dj rencontres.
Calculer la solubilit de AgBr dans leau pure, puis dans une solution de Ce
0,10
.
Donnes : AgBr : p
= 12,3 ; Ce
/Ce
= 1,72 V ; Br
/Br
= 1,10 V.
33 COUPLES DU COBALT DANS LAMMONIAC
Cette fois, on mle oxydorduction, acido-basicit et complexation !
1) Calculer le potentiel standard apparent du couple Co
III
/Co
II
dans une solution aqueuse assez
concentre dammoniac, en fonction de pNH
.
2) Que se passe-t-il quand on soumet, laction de loxygne de lair une solution 0,10
en
hexaamminecobalt (III) et en ttraamminecobalt (II) dans NH
?
Donnes :
Co
/Co
= 1,92 V ; O
/H
O :
= 1,23 V ; NH
/NH
: p
= 9,2 ; [Co(NH
:
p
= 4,6 ; [Co(NH
: p
= 35,0.
34 DTERMINATION DUN PRODUIT DE SOLUBILIT PAR POTENTIOMTRIE
On ralise une pile de la manire suivante :
Deux lectrodes dargent plongent dans deux bchers et sont relis par un millivoltmtre. Entre les
deux bchers se trouve un pont salin contenant une solution glifie de nitrate dammonium.
Dans le bcher de gauche (bcher 1), on introduit 25 mL de chlorure de potassium de concentration
= 5,0.10
, ainsi quune goutte de solution trs dilue de nitrate dargent. On observe un
lger trouble blanchtre.
Dans le bcher de droite (bcher 2), on introduit 25 mL de nitrate dargent de concentration
= 5,0.10
.
La tension lue sur le millivoltmtre est alors de = +298 mV.
1) Exprimer le potentiel doxydorduction dune lectrode dargent plongeant dans une solution
contenant des ions Ag
la concentration .
2) Quel est le rle du pont salin dans la pile ?
3) Donner la reprsentation conventionnelle de cette pile.
4) Calculer la valeur du produit de solubilit du chlorure dargent 25.
5) Dterminer
(AgCl/Ag) ; conclure.
Donne :
(Ag
/Ag) = 0,80 V
Page 19 sur 20
35 TITRAGE REDOX SUIVI PAR POTENTIOMTRIE
On dispose dun volume
= 10,0 mL dune solution aqueuse de Pt
de concentration
.
On ajoute, petit petit, au moyen dune burette, du nitrate ferreux = 1,00
.
Le pH est maintenu constamment gal 0.
1) Pourquoi doit-on maintenir le pH 0 pendant ce titrage ?
2) Donner les expressions = () o est le potentiel de Nernst de la solution et le volume de
la solution ferreuse verse (exprim en mL) pour [0; 2]. Tracer la courbe correspondante.
On prendra
= 0,050
pour cette simulation.
3) Proposer un montage exprimental pour suivre ce titrage par potentiomtrie.
4) la place dun suivi potentiomtrique, proposer une mthode de dtection de lquivalence au
moyen dun indicateur color ( choisir dans le tableau ci-dessous).
Donnes :
Pt
/Pt :
= 1,22 V ; Fe
/Fe
= 0,77 V
Indicateurs colors redox :
Nom
(volts) couleur Ox couleur Red
5- nitroferrone 1,25 bleu rouge-violet
ferrone 1,06 bleu rouge
5,6-dimthylferrone 0,97 bleu rouge
diphnylamine 0,76 violet incolore
2,6-dichloroindophnol 0,67 bleu incolore
bleu de mthylne 0,53 bleu incolore
36 TITRAGE POTENTIOMTRIQUE DUNE SOLUTION DE CYANURE
Une solution concentre de nitrate dargent est progressivement ajoute un volume
= 100 mL
dune solution de cyanure de potassium de concentration
= 0,10
.
On nglige la dilution et on appelle la quantit de matire dions Ag
ajouts.
Soit le potentiel, par rapport une lectrode standard hydrogne, dune lectrode dargent
plongeant dans la solution lors du dosage.
1) crire les quations-bilan des deux ractions qui se produisent successivement.
2) Le graphe = () prsente deux variations brusques ; dterminer les valeurs de
correspondantes, soit
et
.
3) tablir les relations = () dans les trois domaines : 0 < <
< <
et >
.
4) Calculer pour =
et =
.
5) Tracer la courbe = () sur papier millimtr.
Donnes :
(Ag
/Ag) = 0,80 V ;
p
(AgCN) = 15,9 ;
log
([Ag(CN)
) = 20,7.
37 UTILISATION DU BORE DANS UN AGENT DE BLANCHIMENT
Les lessives classiques contiennent de nombreux agents de blanchiment, dont certains sont oxydants.
Il sagit le plus souvent de perborate de sodium ttrahydrat, de formule : NaBO
, 4 H
O. Ce compos
est stable temprature ambiante mais shydrolyse 60 en librant du peroxyde dhydrogne H
,
qui est lagent rel de blanchiment. Cest loxygne actif que vantent de nombreuses publicits.
1) crire le schma de Lewis de lion perborate BO
, en admettant le squelette linaire OBOO.
2) Dterminer les nombres doxydation de chaque atome dans lion perborate.
Page 20 sur 20
3) crire lquation de la raction dhydrolyse dcrite ci-dessus, conduisant la formation du
peroxyde dhydrogne H
, sachant quau cours de cette raction, les ions BO
sont rduits en
ions BO
.
4) Exprimer le potentiel de Nernst du couple O
(g)
/H
(aq)
. En dduire un diagramme de
prdominance pour ce couple, en prenant pour convention de frontire
O
,
=
= 1 bar et
,
= 1. La valeur de la frontire sera donne en fonction du pH.
5) De mme, exprimer le potentiel de Nernst du couple H
(aq)
/H
O et tracer un diagramme de
prdominance avec les mmes conventions de frontire. La valeur de la frontire sera nouveau
donne en fonction du pH.
6) En dduire le comportement du peroxyde dhydrogne en solution aqueuse, quel que soit le pH
du milieu.
Dosage du perborate dans une lessive
Le perborate de sodium contenu dans une lessive en poudre libre du peroxyde dhydrogne qui est
dos rapidement par un oxydant. Le protocole du dosage est le suivant :
x Dans un bcher de 150 mL, prparer une solution de lessive en dissolvant 2,00g de cette lessive,
pess avec prcision, dans 50 mL deau distille. Ajouter ensuite 5,0 mL dacide sulfurique la
concentration 5,0molL
. Chauffer le mlange 60 pendant 5 minutes.
x Suite au chauffage, le perborate donne quantitativement du peroxyde dhydrogne. Ce dernier est
titr rapidement par du sulfate de crium (IV) acidifi, dont la concentration en ions Ce
est gale
= 0,100molL
. Le titrage est suivi par potentiomtrie.
La courbe donnant la diffrence de potentiel aux bornes de deux lectrodes judicieusement choisies en
fonction du volume de sulfate de crium (IV) ainsi que la courbe drive premire sont reprsentes
ci-dessous.
7) crire la raction de titrage. Pourquoi ce titrage doit-il tre fait rapidement ?
8) tablir lexpression de la constante dquilibre
de cette raction de titrage 298 K. La
calculer et conclure.
9) Quelles lectrodes peut-on proposer pour suivre ce titrage ? Faire un schma du montage.
10) Justifier en quelques lignes lallure de la courbe potentiomtrique ci-dessus.
11) Utiliser cette courbe pour dterminer le pourcentage massique de perborate de sodium
ttrahydrat prsent dans cette lessive.
Donnes :
Masses molaires (gmol
) :
B : 10,8 ; O : 16,0 ; Na : 23,0
Potentiels standard 298 K :
H
O/H
(g)
: 0,00 V ; O
(g)
/H
O: 1,23 V ; H
(aq)
/H
O: 1,77 V ; O
(g)
/H
(aq)
: 0,68 V ;
Ce
(aq)
/Ce
(aq)
: 1,71 V
Les gaz seront supposs parfaits et les solutions suffisamment dilues.
On ne tiendra pas compte de lacidit de H
.
quilibres en solution aqueuse Exercice 1 Page 1 sur 1
Corrig exercice 1
SENS DVOLUTION DUNE TRANSFORMATION CHIMIQUE
Daprs lquation chimique de la raction, le quotient ractionnel a pour expression :
=
Cu
NO
Cu
NO
o chaque
dsigne lactivit des diffrents constituants de lquation chimique linstant dont il
est question dans lnonc ( un instant donn ), puisquon calcule un quotient ractionnel.
x Le cuivre est un corps condens (solide) suppos pur, donc
Cu
= 1 (les donnes de la masse et
de la masse molaire ntaient pas utiliser !)
x Leau est un corps condens (liquide), que lon peut supposer presque pur, puisquil sagit du
solvant et en considrant la solution suffisamment dilue ; donc
B
0
1.
x Le monoxyde dazote est un gaz, de pression partielle
N0
= 1S kPa = 0,15 bar ; si on admet quil
est parfait, alors son activit est
NO
=
NO
= 0,15 : (on rappelle que
dsigne la pression
standard, conventionnellement choisie
= 1 bar exactement).
x Enfin, les ions sont des soluts de la solution aqueuse ; si on considre que la solution est
suffisamment dilue pour que les ions ninteragissent pas entre eux, alors lactivit sexprime par
=
[A
, o [A
] est la concentration de lion A
et
= 1
exactement est la
concentration unitaire.
On calcule donc chaque concentration en
:
Cu
=
, mol
, L
= 0,030 mol L
, donc
Cu
= 0,030
[NO
] = 0,080 mol L
, donc
NO
= 0,080
x Lactivit de lion H
est donne directement par
H
O
= 10
pH
= 0,10
On peut maintenant calculer numriquement le quotient ractionnel :
=
Cu
NO
Cu
NO
= 9,5 10
On constate alors que
: le systme nest pas lquilibre chimique.
Comme <
, le systme va voluer dans le sens direct, cest--dire que le cuivre va tre oxyd par
lacide nitrique.
quilibres en solution aqueuse Exercice 2 Page 1 sur 2
Corrig exercice 2
QUILIBRE EN PHASE GAZEUSE
1) La quantit de matire du gaz parfait NO pur sobtient en appliquant lquation dtat du gaz
parfait :
=
NO
On trouve (utiliser les units SI, convertir le volume en m
) :
NO,0
=
= 4,81 10
mol
Pour le dibrome, on connat la masse introduite et la masse molaire, donc immdiatement :
Br
,
=
Br
(Br
)
= 1,88 10
mol
2) Lnonc fournit la temprature et la pression dquilibre, on applique donc nouveau la loi des
gaz parfaits :
est la quantit de matire totale de gaz, on trouve donc :
= 5,94 10
mol
3) Pour trouver la composition du systme lquilibre, on ralise un tableau davancement :
2NO + Br
= 2NOBr
tat initial
NO,0
Br
,
0
tat dquilibre
NO,0
2
Br
,
2
(quantits de matire)
La quantit de matire de gaz totale est alors de :
=
NO,0
+
Br
,
On trouve donc lavancement lquilibre :
=
NO,0
+
Br
= 0,75 10
mol
4) On rappelle que la pression partielle dun gaz dans un mlange est la pression quaurait ce gaz
sil tait seul dans lenceinte, la mme temprature.
Pour un gaz parfait A
, la pression partielle est la fraction molaire multiplie par la pression totale :
Ici, on trouve :
NO
=
NO,0
2
= 4,58 10
Pa = 0,0458 bar
Br
Br
= 1,56 10
Pa = 0,0156 bar
NOBr
=
2
= 2,08 10
Pa = 0,0208 bar
5) Comme on est lquilibre chimique et que tous les constituants sont prsents, la loi de
quilibres en solution aqueuse Exercice 2 Page 2 sur 2
Guldberg et Waage est applicable, on trouve donc :
) =
NOBr
NO
Br
o les
dsigne les activits des diffrents gaz lquilibre.
On sait que lactivit dun gaz parfait A
sexprime par :
= 1 bar exactement est la pression standard. On trouve donc :
) =
NOBr
NO
Br
= 13,2
quilibres en solution aqueuse Exercice 3 Page 1 sur 3
Corrig exercice 3
TUDE DU COUPLE CH
COOH/CH
COO
1) Diagramme de prdominance :
CH
3
COOH CH
3
COO
pH
4,8
_
2) a) Quantit prleve de CH
COOH
()
pur, de masse volumique = 1,05
La concentration apporte est donc :
=
= 0,350
b) Lacide actique se dissout tout dabord totalement, cest--dire que lintgralit des molcules
CH
COOH se retrouvent solvates (il se produit CH
COOH
()
CH
COOH
(aq)
de manire
rigoureusement totale). On omettra dans toute la suite lindice (aq) et on notera simplement CH
COOH
lacide actique solvat.
Lacide actique est un acide faible. Une fois dissous dans leau, il ragit selon :
CH
COOH+H
O CH
COO
+H
c) Pour 2 < pH < 3, on voit sur le diagramme de prdominance que CH
COOH prdomine. Comme on
est deux units environ de la frontire de prdominance, on en dduit que le rapport
[CH
COO
]
[CH
COOH]
est de
lordre de
:
On en dduit que la raction de dissociation prcdente est trs peu avance.
d) On postule alors qu lquilibre, la concentration de CH
COOH reste sensiblement gale la
concentration apporte, soit [CH
COOH] = 0,35
.
Le tableau davancement donne alors :
CH
COOH + H
O CH
COO
+ H
apport 0,35 0 0
quilibre 0,35 0,35
(concentrations en
)
Et la loi de dquilibre chimique conduit lexpression :
= 10
,
=
0,35
qui donne immdiatement, en
, = 2,4 10
.
On vrifie alors que lapproximation 0,35 0,35 est acceptable, car on a bien 0,35, ce qui
valide le rsultat.
Conclusions :
[CH
COOH] = 0,35 molL
[CH
COO
] = [H
] = 2,4 10
pH = 2,4 10
= 2,6
quilibres en solution aqueuse Exercice 3 Page 2 sur 3
3) a) La concentration de la solution de soude est, par dfinition :
NaOH,
Pour prparer une solution de volume
, il faut donc introduire une quantit de matire
NaOH,
=
= 0,100 dhydroxyde de sodium, soit une masse de = = 4,00 g.
Mode opratoire :
x Introduire de leau distille dans une fiole jauge de 100 mL, environ moiti de la fiole.
x Peser 4,00 g dhydroxyde de sodium trs pur dans une coupelle et les introduire dans la fiole
jauge avec un entonnoir solide.
x Rincer la coupelle et lentonnoir avec de leau distille recueillie dans la fiole.
x Boucher et agiter dlicatement la fiole (attention au caractre exothermique de la dissolution,
prvoir un cristallisoir eau-glace).
x Ajouter de leau distille en sarrtant un peu avant le trait de jauge. Boucher et agiter.
x Faire enfin la mise au trait (bas du mnisque align avec le trait de jauge). Boucher et agiter.
On ajoute maintenant cette solution la prcdente. Aprs cet ajout, le volume vaut
= 600 ,
ce qui conduit recalculer la concentration apporte dacide actique :
b) Concentration apporte en CH
COOH :
CH
COOH
=
)
= 0,291 molL
c) Concentration apporte en HO
HO
= 0,167 molL
d) La raction entre lacide actique et lion hydroxyde est :
CH
COOH+HO
CH
COO
+H
O
Pour trouver la constante dquilibre, on applique la loi de Guldberg et Waage et on multiplie
numrateur et dnominateur par afin de faire apparatre les constantes connues
et
(rappel :
et dsignent respectivement les concentrations [H
] et [HO
]) :
=
[CH
COO
]
[CH
COOH]
=
[CH
COO
]
[CH
COOH]
= 10
,
= 10
,
La valeur trs leve 1 permet de penser que la raction est trs probablement quasi-totale.
Ceci est cohrent avec le fait que HO
est une base beaucoup plus forte que CH
COO
(placer les
couples sur une chelle de p
).
On fait alors un bilan de matire (en concentrations) en la considrant comme rigoureusement totale :
CH
COOH + HO
CH
COO
+ H
O
apport 0,291 0,167 0
si totale 0,124 0 0,167
(concentrations en
)
Le problme pos est donc quivalent un mlange o on aurait apport :
CH
COOH
= 0,124 molL
et
CH
COO
= 0,167 molL
e) Tous les quilibres que lon peut crire partir de cet tat doivent tre trs peu avancs (tracer
une chelle de p
pour sen assurer) : ractions de CH
COOH avec leau, de CH
COO
avec leau, ou a
fortiori autoprotolyse de leau.
On peut donc penser que les espces trs majoritaires lquilibre resteront CH
COOH et CH
COO
, et
que leurs concentrations lquilibre ne seront pas notablement modifies, donc :
quilibres en solution aqueuse Exercice 3 Page 3 sur 3
[CH
COOH] = 0,124 molL
et [CH
COO
] = 0,167 molL
Pour vrifier cette hypothse, on calcule :
pH = 4,8 +
0,167
0,124
= 4,9
et on en dduit :
H
= 10
pH
molL
= 1,2 10
molL
[HO
] =
= 8,5 10
molL
Ces deux concentrations sont bien ngligeables devant 0,124 et 0,167
. On avait donc bien
raison de ngliger toutes les ractions crant H
et HO
. Le rsultat est valide.
e) Il sagit dune solution tampon, car elle contient lacide actique et lactate dans des
concentrations voisines. Son pH est voisin de 4,8.
Une solution tampon possde deux proprits fondamentales :
- son pH est invariant par dilution modre ;
- son pH varie peu par ajout modr dacide fort ou de base forte.
quilibres en solution aqueuse Exercice 4 Page 1 sur 2
Corrig exercice 4
PRCIPITATION DE CHLORURE DE PLOMB ?
1) On calcule le quotient ractionnel de la raction de dissolution :
=
Pb
Cl
= 0,01 0,2
= 4 10
Comme >
, cest que la solution est sature : il se produit une prcipitation.
La prcipitation est : Pb
+ 2Cl
PbCl
, de constante dquilibre =
= 6,25 10
. Comme
1, on peut penser que la prcipitation est quasi-totale. En la considrant comme totale, on devrait
donc obtenir un tat proche de ltat dquilibre cherch :
Pb
+ 2 Cl
PbCl
apport 0,01 0,20 absent
bilan si totale 0 0,18 prsent
(en mol L
)
Le systme est donc quivalent une solution
Cl
= 0,18 mol L
surmontant un prcipit de PbCl
.
On peut alors supposer que la concentration de Cl
nest plus modifie, cest--dire que la dissolution
de PbCl
est ngligeable, autrement dit que la raction de prcipitation tait bien quasi-totale. On a
alors lquilibre :
[Cl
] = 0,18 mol L
Pour valider ce rsultat, il faut vrifier que Pb
est minoritaire, que sa concentration est ngligeable,
ce qui se fait aisment car en solution sature
= [Pb
] [Cl
est applicable :
Pb
[Cl
= 4,9 10
mol L
On vrifie donc bien [Pb
] [Cl
], ce qui valide le rsultat.
2) On calcule le quotient ractionnel de la raction de dissolution :
=
Pb
Cl
= 0,05 0,03
= 4,5 10
Comme >
, cest que la solution est sature : il se produit une prcipitation.
Comme prcdemment, on peut penser que la prcipitation est quasi-totale. En la considrant comme
totale, on devrait donc obtenir un tat proche de ltat dquilibre cherch :
Pb
+ 2 Cl
PbCl
apport 0,05 0,03 absent
bilan si totale 0,035 0 prsent
(en mol L
)
Le systme est donc quivalent une solution
Pb
= 0,035 mol L
surmontant un prcipit de
PbCl
. On peut alors supposer que la concentration de Pb
nest plus modifie, cest--dire que la
dissolution de PbCl
est ngligeable, autrement dit que la raction de prcipitation tait bien quasi-
totale. On a alors lquilibre :
Pb
= 0,035 mol L
Pour valider ce rsultat, il faut vrifier que Cl
est minoritaire, que sa concentration est ngligeable :
[Cl
] =
Pb
= 0,021 mol L
Lhypothse nest pas vrifie ! [Cl
] nest pas ngligeable devant Pb
!
quilibres en solution aqueuse Exercice 4 Page 2 sur 2
Mthode 1 : on reprend ltat prcdent et on considre la dissolution non ngligeable de PbCl
dans
une solution
Pb
= 0,035 mol L
:
PbCl
Pb
+ 2 Cl
solution quivalente prsent 0,035 0
quilibre prsent 0,035 + 2
(en mol L
)
La mise en quation donne :
= (0,035 +)(2)
soit rsoudre :
4
+0,14
1,6 10
= 0
La rsolution numrique de lquation donne = 0,0095 mol L
.
Mthode 2 : on reprend le problme depuis le dbut, sachant que la prcipitation ne peut tre
considre comme totale :
Pb
+ 2 Cl
PbCl
apport 0,05 0,03 absent
quilibre 0,05 0,03 2 prsent
(en mol L
)
La mise en quation donne :
= (0,05 )(0,03 2)
soit rsoudre :
4
0,32
+6,9 10
2,9 10
= 0
La rsolution numrique de lquation donne = 0,0055 mol L
.
Selon lune ou lautre approche, on montre donc que les concentrations lquilibre sont :
Pb
= 0,0445 mol L
[Cl
] = 0,0190 mol L
3) On calcule le quotient ractionnel de la raction de dissolution :
=
Pb
Cl
= 0,002 0,001
= 2 10
Comme <
, la solution reste limpide.
Les concentrations des ions restent donc identiques celles quon a apportes, elles sont
indpendantes lune de lautre :
Pb
= 0,002 mol L
[Cl
] = 0,001 mol L
quilibres en solution aqueuse Exercice 5 Page 1 sur 3
Corrig exercice 5
DIAGRAMME DE RPARTITION DE LACIDE CITRIQUE
1) Dans chaque couple, le donneur de H
(lacide), prdomine l o la concentration de H
dans le
milieu est la plus forte, cest--dire aux bas pH. On dduit :
1 : H
A ; 2 : H
; 3 : HA
; 4 : A
2) Pour un couple A/B : pH = p
+log
[B]
[A]
. On trouve donc pH = p
lorsque [A] = [B], cest--
dire lintersection des courbes correspondantes.
- pour le couple H
A/H
(premire acidit de lacide citrique), on lit : p
= 3,1
lintersection des courbes 1 et 2 ;
- pour le couple H
/HA
(deuxime acidit de lacide citrique), on lit : p
= 4,8
lintersection des courbes 2 et 3 ;
- pour le couple HA
/A
(troisime acidit de lacide citrique), on lit : p
= 6,4
lintersection des courbes 3 et 4.
= 10
p
, on trouve donc :
1 2 3
p
3,1 4,8 6,4
7,9 10
1,6 10
4,0 10
3) Question de cours ultra-classique, expose dans le document de cours correspondant
%H
A = 100
[H
A]
[H
A] +[H
] +HA
+A
%H
A =
100
1 +
[H
]
[H
A]
+
HA
[H
A]
+
A
[H
A]
On exprime les diffrents rapports partir des constantes dacidit (rappel, on note la concentration
de H
) :
[H
]
[H
A]
=
HA
[H
A]
=
HA
[H
A]
[H
]
[H
]
=
[H
A]
=
A
[H
A]
[H
]
[H
[HA
]
[HA
]
=
On trouve donc :
%H
A =
100
1 +
=
100
1 +10
pHp
+10
pHp
+10
pHp
Remarque : cette expression peut se simplifier si on ne souhaite tracer la courbe que dans un domaine de
pH particulier. En pratique, on veut en gnral tracer la courbe dans le domaine de pH o H
A nest pas
ngligeable (ici 0 < pH < 5). Dans cette zone, lespce A
est ngligeable, donc :
quilibres en solution aqueuse Exercice 5 Page 2 sur 3
%H
A 100
[H
A]
[H
A] +[H
] +HA
=
100
1 +10
pHp
+10
pHp
On procde de mme pour obtenir les quations des autres courbes de rpartition et on trouve :
%H
=
100
10
p
pH
+1 +10
pHp
+10
pHp
%HA
=
100
10
p
pH
+10
p
pH
+1 +10
pHp
%A
=
100
10
p
pH
+10
p
pH
+10
p
pH
+1
4) Solution (S)
a) La masse molaire du solide que lon pse est :
= 210
Attention : un solide hydrat est un solide qui a pig des molcules deau lors de la cristallisation. Il faut
donc compter cette eau dans la masse molaire, puisquelle fait bien partie de la masse de solide que lon
pse sur la balance lorsquon prpare la solution.
La quantit de matire de (C
, H
O), donc de C
, apporte est donc :
Par consquent, la concentration apporte est :
= 0,0200 molL
b) Le test lhliantine montre que le pH de la solution (S) est lquilibre infrieur 3,1. En
observant les courbes de rpartition, on voit que lacide citrique sest rparti presque exclusivement
entre les formes H
A et H
: les courbes 3 et 4 reprsentant %HA
et %A
sont quasiment
confondues avec laxe des abscisses avec lchelle dont on dispose, ces pourcentages sont ainsi bien
infrieurs 1% :
Les espces HA
et A
sont en concentrations ngligeables dans la solution (S).
c) On apporte H
A, acide faible, dans leau pure. La raction qui rend compte de lapparition dions
H
(pH infrieur 3,1), ainsi que de la conversion dune partie de H
A en H
est donc :
H
A +H
O H
+H
Cette raction a pour constante dquilibre
.
On nglige toute raction conduisant former HA
et A
car ces espces sont en concentration
ngligeable dans un tel milieu acide (question prcdente).
d) Pour calculer les concentrations lquilibre, on ralise un tableau davancement et on applique la
loi de lquilibre chimique :
H
A + H
O H
+ H
apport
0 0
quilibre
(bilan en concentrations)
lquilibre, tous les constituants sont prsents. En assimilant activit et concentration, la loi de
lquilibre chimique scrit (
= 1
) :
= 7,9 10
quilibres en solution aqueuse Exercice 5 Page 3 sur 3
En raison de la faible valeur de
1, on pourrait faire lhypothse que la raction prcdente est
trs peu avance. On aurait dans ce cas [H
A]
= 0,0200 molL
et lquation se simplifierait en
, soit =
= 4,0 10
. Lhypothse ne peut donc pas tre valide, car
on na pas
( reprsenterait 20% de
). Il faut donc rsoudre lquation du second
degr :
= 0
On trouve :
= 0,0036 molL
Conclusions :
[H
] = H
= = 0,0036 molL
[H
A] =
= 0,0164
pH = log
H
= 2,4
On trouve galement les pourcentages de rpartition :
%H
A = 100
= 82%
%H
= 100
= 18%
On lit bien graphiquement ces pourcentages sur les courbes 1 et 2 respectivement, au point dabscisse
pH = 2,4.
e) Les pourcentages des espces minoritaires HA
et A
ne peuvent tre lus graphiquement sur les
courbes fournies car leur valeur est trop faible pH = 2,4. Il faut calculer leurs concentrations partir
de celles des espces majoritaires et des
correspondants, que lon a dtermins au dbut de
lexercice :
HA
[H
= 1,6 10
molL
[A
] =
[HA
= 1,8 10
Ces concentrations sont bien infimes par rapport celles des espces majoritaires (moins de 0,5%),
ce qui confirme bien quon avait raison de ngliger toute raction crant ces espces dans la question
prcdente.
quilibres en solution aqueuse Exercice 6 Page 1 sur 3
Corrig exercice 6
COMPLEXATION DES IONS CUIVRE (II) CU
PAR LES IONS THIOCYANATE SCN
Lescomplexes
1) On crit la configuration lectronique dun atome de cuivre isol en appliquant la rgle de
Klechkowski :
Cu ( = 29) : 1
Remarque : le cuivre est une exception la rgle de Klechkowski et sa configuration se termine en ralit
par 4
.
La position du cuivre dans le tableau priodique se dduit de la configuration lectronique :
- le nombre quantique principal le plus lev de la configuration est
= 4 : le cuivre est
dans la 4
me
priode ;
- la configuration lectronique se termine en 4
selon Klechkowski : le cuivre est donc
dans la 9
me
colonne du bloc , celui-ci tant prcd des deux colonnes du bloc : le cuivre
est dans la colonne n11.
Cuivre : 4
me
priode, 11
me
colonne
La rgle de Klechkowski nest pas valable pour les cations : pour obtenir la configuration lectronique
du cation Cu
, on retire les deux lectrons les plus externes du cuivre neutre (dabord les lectrons
4, puis 3) :
Cu
: 1
2) Ion thiocyanate :
S C N S C N
_ _
Le soufre et lazote sont dlectrongativits voisines. Les deux formes msomres sont donc de
reprsentativits proches. Lion SCN
rel tant lhybride de rsonance entre ces deux formes, on en
dduit que la charge ngative est peu prs quitablement rpartie entre les atomes de soufre et
dazote.
Lion SCN
peut donc se lier un atome lacunaire partir dun doublet non liant port parSoubien
parN, cest pourquoi on qualifie ce ligand dambident.
En revanche, ce ligand nestpasbident, car il nepeutpas se lier simultanment par S et par N,
puisque lion est linaire (type VSEPR AX
autour du carbone central).
3) Lion Cu
ne peut prdominer que pour les concentrations en ligands les plus faibles, cest--
dire pour les valeurs leves de pSCN. La courbe 1 reprsente donc le pourcentage du cuivre non
complex, puis de proche en proche, quand pSCN diminue, la concentration des complexes augmente
tour tour :
quilibres en solution aqueuse Exercice 6 Page 2 sur 3
Courbe 1 : %[Cu
]
Courbe 2 : %[Cu(SCN)]
Courbe 3 : %[Cu(SCN)
]
Courbe 4 : %[Cu(SCN)
Courbe 5 : %[Cu(SCN)
Lion Cu
possde 9 lectrons de valence (3
). Chaque ligand fait un don partiel dun doublet
(liaison coordinative). Ainsi, on dcompte 9 +2 4 = lectronspourlecomplexe[Cu(SCN)
.
Cest ce complexe qui se rapproche le plus des 18 lectrons caractristiques dun gaz rare (en
comptant les lectrons ).
4) On crit la dfinition dune constante de formation successive :
=
[Cu(SCN)
[Cu(SCN)
[SCN
]
Ainsi, lintersection des courbes +1 et , on a [Cu(SCN)
= [Cu(SCN)
, on trouve donc :
=
1
[SCN
pSCN
inter
= +log
On lit donc log
aux diffrentes intersections des courbes :
= 10
,
= 39
= 10
,
= 9
= 10
,
= 0,9
= 10
,
= 2,5
5) On constate que la courbe 4 reprsentant %[Cu(SCN)
est toujours situe en-dessous dau
moins une autre courbe, ce qui signifie que ce complexe nest jamais prdominant sur tous les autres
complexes la fois. Si on lintroduit en solution, il ne peut donc rester majoritaire et doit se dismuter,
selon :
2[Cu(SCN)
[Cu(SCN)
] +[Cu(SCN)
Constante dquilibre :
=
[Cu(SCN)
][Cu(SCN)
([Cu(SCN)
=
[Cu(SCN)
][Cu(SCN)
([Cu(SCN)
[SCN
]
[SCN
]
=
= 2,8 > 1
Complexationendfautdeligand
6) La masse molaire du sulfate de cuivre pentahydrat est = 249,6
. Lorsquune mole de
CuSO
, 5H
O se dissout, une mole dions Cu
est libre, donc :
Cu
=
= 0,0337 molL
Une mole de KSCN libre une mole dions K
et dions SCN
en se dissolvant, on a donc simplement :
SCN
=
1,0 10
mol
= 0,0040 molL
On constate que lion Cu
est en large excs. La concentration apporte en ligand reprsente environ
10% de la concentration apporte en Cu
, si bien que si Cu
venait se complexer totalement, il en
resterait au moins 90%. La courbe 1 ne peut donc tre quau-del de 90% lquilibre, cest--dire
quon est sr davoir pSCN > 2,7. On voit bien sur les courbes fournies que seul le complexe
[Cu(SCN)]
nest pas ngligeable dans cette zone.
quilibres en solution aqueuse Exercice 6 Page 3 sur 3
7) La raction de complexation prendre en compte est donc celle qui forme [Cu(SCN)]
:
Cu
+ SCN
[Cu(SCN)]
apport 0,0337 0,0040 0
quilibre 0,0337 0,0040 (concentrations en
)
On crit la loi de lquilibre chimique :
= 39 =
(0,0337 )(0,0040 )
On dveloppe et on rsout lquation du deuxime degr qui en dcoule, pour trouver :
= [Cu(SCN)]
= 0,0022 molL
Le cuivre se rpartit essentiellement en Cu
libres et en complexe [Cu(SCN)]
, donc :
%Cu
=
0,0337
0,0337
100 = 93%
%[Cu(SCN)]
0,0337
100 = 7%
On a galement [SCN
] = 0,0040 = 0,0018
lquilibre, soit pSCN = 2,74.
On retrouve bien les pourcentages de rpartition que lon a calculs, en se plaant labscisse
pSCN = 2,74.
8) Les rsultats prcdents ne sont valides que si les concentrations des autres complexes sont
ngligeables. On les calcule partir des concentrations prcdentes dj connues et des constantes
successives :
[Cu(SCN)
] =
[Cu(SCN)]
[SCN
] = 3,6 10
[Cu(SCN)
[Cu(SCN)
] [SCN
] = 5,8 10
[Cu(SCN)
[Cu(SCN)
[SCN
] = 2,6 10
Ces concentrations sont bien ngligeables devant celles des espces Cu
, [Cu(SCN)]
et SCN
: on
avait bien raison de ne pas tenir compte des ractions formant les complexes dindices de coordination
= 2, 3 et 4.
quilibres en solution aqueuse Exercice 7 Page 1 sur 19
Corrig exercice 7
COCKTAILS ACIDO-BASIQUES
On donne tout dabord le schma de rsolution dun problme par la mthode de la raction
prpondrante :
tat initial : calculer
les concentrations
apportes
placer les espces sur
un diagramme de prdominance
(ou une chelle de pK
a
)
trsavance ? (espces apportes oui
faire le bilan de la RP en la
considrant comme totale :
on obtient un problme quivalent,
plus proche de ltat final
non
y a-t-il une RP
incompatibles ?)
tat final : conclure en donnant
les concentrations
de toutes les espces lquilibre
et le pH de la solution
Le systme volue a priori peu.
Une ou plusieurs RP peuavances crent
les espces minoritaires ; calculer
les concentrations en faisant les
hypothses judicieuses, puis les vrifier.
*
Ltape *, incontournable, a t expose en cours dans un grand nombre de situations-type : acide
faible ou base faible, mlanges dacides, mlanges de bases, mlanges dacide et de base DP
communs, ampholyte, solution tampon
Les questions1 6 passent directement par cette tape *.
Les autres questions parcourent une ou plusieurs fois la boucle de la RP trs avance dans lalgorithme
ci-dessus puis terminent en * par une situation-type dj rencontre
quilibres en solution aqueuse Exercice 7 Page 2 sur 19
pH
4,8
pH
2,0
1) Concentrations apportes :
O
= 0,010
(pH
= 2,0)
CH
COOH
= 0,020
Diagramme de prdominance :
H
CH
COOH CH
COO
Le systme est stable ; aucune raction trs avance nest prvoir, le systme doit donc peu voluer.
La RP (peu avance) est la raction de lacide faible sur leau :
CH
COOH +H
O CH
COO
+H
Si on suppose que cette raction a un avancement ngligeable devant
H
O
= 0,010
, alors
lquilibre, on a immdiatement [H
] =
H
O
= 0,010
et pH = 2,0.
On dit que lacidefortimposesonpH. Lacide faible joue un rle ngligeable pour crer des ions
H
.
Lhypothse de la RP peu avance conduit galement supposer quon garde lquilibre
[CH
COOH] =
CH
COOH
= 0,020
.
Vrification de lhypothse : lavancement de la RP est gal la concentration de CH
COO
, que lon
calcule facilement partir du
=
0,010 [CH
COO
]
0,020
[CH
COO
] = 3,2 10
3,2 10
0,020 et 0,010 : les hypothses sont valides.
Lautoprotolyse de leau est bien entendu encore plus ngligeable car on trouve [HO
] =
[H
]
= 1,0
10
molL
[H
].
Conclusion:
[CH
COOH] =
CH
COOH
= 0,020 molL
=
H
O
= 0,010 molL
; pH = ,
[CH
COO
] = 3,2 10
molL
[HO
] = 1,0 10
molL
2) Concentrations apportes :
O
= 0,010
(pH
= 2,0)
HSO
= 0,020
Diagramme de prdominance :
H
HSO
SO
Il sagit nouveau du mlange dun acide fort et dun acide faible mais on voit ici quil est impossible
de ngliger la dissociation de lacide faible. En effet, si on considrait que lacide fort imposait son pH
de 2,0 comme la question prcdente, on serait la frontire de prdominance du couple HSO
/
quilibres en solution aqueuse Exercice 7 Page 3 sur 19
pH
4,8
3,2
SO
, ce qui impliquerait un taux de dissociation de 50%.
La RP nest cette fois-ci pas ngligeable, il faut en faire le bilan de matire et calculer son avancement
lquilibre par la loi de Guldberg et Waage :
HSO
+ H
O SO
+ H
apport 0,020 0 0,010
quilibre 0,020 0,010 + (concentrations en
= 10
,
=
(0,010 +)
0,020
+(0,01 +
) 0,02
= 0
= 7,3 10
Conclusion:
[HSO
] = 0,020 = 0,013
[H
] = 0,010 + = 0,017
; pH = ,
[SO
] = = 0,0073
[HO
] =
= 5,8 10
molL
Lautoprotolyse de leau est bien entendu ngligeable car on trouve [HO
] [H
].
3) Concentrations apportes :
HF
= 0,10
CH
COOH
= 0,20
Diagramme de prdominance :
HF F
CH
COOH CH
COO
Ce systme semble stable.
A priori, selon lhypothse des acides faibles, les ractions des acides faibles sur leau sont peu
avances :
(R1) HF +H
O F
+H
(R2) CH
COOH+H
O CH
COO
+H
Mais on constate que lacide HF est plus fort que CH
COOH. On peut donc faire lhypothse que la RP
est (R1) : HF +H
O F
+H
cest--dire que lacidefaibleleplusfortimposesonpH.
On peut alors appliquer la formule des acides faibles (ou la retrouver) sur ceseulacide, et on obtient :
pH =
1
2
3,2
1
2
log 0,1 = 2,1
La formule des acides faibles est valide car on a alors :
[F
] = [H
] = 10
,
= 7,9 10
[HF] 0,10
Lacide faible est bien trs peu dissoci.
quilibres en solution aqueuse Exercice 7 Page 4 sur 19
pH
3,8
3,2
Il faut maintenant vrifier que lautre acide ne jouait aucun rle, cest--dire que lavancement de (R2)
CH
COOH+H
O CH
COO
+H
est ngligeable devant celui de la RP. Pour cela, il faut vrifier
que [CH
COO
] est bien ngligeable devant [H
] = 7,9 10
crs par la RP.
Lacide actique tant moins fort, donc encore moins dissoci que HF, on postule naturellement quon
conserve [CH
COOH] =
CH
COOH
= 0,20
, et on dduit immdiatement [CH
COO
] par :
pH = 2,1 = 4,8 +log
[CH
COO
]
0,20
[CH
COO
] = 4,0 10
qui est bien ngligeable devant [CH
COOH] =
CH
COOH
= 0,20
(lacide actique est bien trs
peu dissoci) et devant [H
] = 7,9 10
(avec un rapport de 20, lavancement de (R2) est
bien ngligeable devant celui de (R1) pour crer les ions H
).
Conclusion:
[HF] = 0,10
[F
] = [H
] = 7,9 10
; pH = ,
[CH
COOH] = 0,20 molL
[CH
COO
] = 4,0 10
[HO
] =
= 1,3 10
molL
Lautoprotolyse de leau est bien entendu ngligeable car on trouve [HO
] [H
].
4) Concentrations apportes :
HF
= 0,10
HCOOH
= 0,50
Diagramme de prdominance :
HF F
HCOOH HCOO
Ce systme semble stable.
A priori, selon lhypothse des acides faibles, les ractions des acides faibles sur leau sont peu
avances :
(R1) HF +H
O F
+H
(R2) HCOOH +H
O HCOO
+H
Cette fois-ci, la force relative des deux acides est trs proche et de plus lacide le moins fort est le plus
concentr.
Si on fait nanmoins lhypothse que la RP est (R1) HF +H
O F
+H
, on trouve comme la
question prcdente un pH de 2,1.On calcule alors comme prcdemment [HCOO
] = 1,0
10
, qui nest pas ngligeable devant [H
] = 7,9 10
. (R1) nest donc pas
prpondrante sur (R2).
Dans ce cas, (R1) et (R2) sont donc RPsimultanes.
On pose alors le bilan de matire sur les deux quations :
quilibres en solution aqueuse Exercice 7 Page 5 sur 19
pH
4,8
9,2
(R1) HF + H
O F
+ H
apport 0,10 0 0
quilibre 0,10 + (concentrations en
)
(R2) HCOOH + H
O HCOO
+ H
apport 0,50 0 0
quilibre 0,50 + (concentrations en
)
Les deux RP sont peu avances, on peut donc postuler que et resteront petites devant les
concentrations apportes, donc [HF] 0,10
et [HCOOH] 0,50
.
On crit alors :
=
( +)
0,10
=
( +)
0,50
En divisant ces deux quations, on obtient
, soit = 0,796 qui confirme bien que les deux
avancements sont comparables. On injecte cette dernire relation dans lun des
=
1,796
0,5
= 6,6 10
= 5,3 10
On a bien 0,10 et 0,50 : les rsultats sont valides !
Conclusion:
[HF] = 0,10 molL
[HCOOH] = 0,50 molL
[F
] = = 5,3 10
molL
[HCOO
] = = 6,6 10
molL
= + = 1,19 10
molL
; pH = ,
[HO
] =
= 8,4 10
molL
Lautoprotolyse de leau est bien entendu ngligeable car on trouve [HO
] [H
].
5) Concentrations apportes :
NH
= 0,015
CH
COO
= 0,020
Diagramme de prdominance :
NH
NH
CH
COOH CH
COO
Les espces apportes sont dans des domaines de prdominance communs, on peut donc prvoir que
le systme voluera peu par rapport aux concentrations apportes, donc que NH
et CH
COO
resteront majoritaires lquilibre.
quilibres en solution aqueuse Exercice 7 Page 6 sur 19
Il reste cependant trop dinconnues pour pouvoir trouver la concentration dune autre espce
directement.
Il faut donc trouver la RP peu avance qui cre les espces minoritaires, parmi toutes les ractions
possibles :
(R1) NH
+CH
COO
NH
+CH
COOH
(R2) NH
+H
O NH
+H
(R3) CH
COO
+H
O CH
COOH +HO
(R4) 2H
O H
+HO
Pour trouver la RP, on peut raisonner de plusieurs faons.
- la RP est probablement entre lacide le plus fort et la base la plus forte (on peut saider dun axe
de p
) ;
- la RP est probablement celle entre espces ayant les DP les plus troits en commun (en
admettant que leau prdomine entre les pH 0 et 14) ;
- on estime que le pH sera peu prs au milieu entre les valeurs 4,8 et 9,2, soit aux environs
de 7,0 (les espces apportes restent ainsi largement prdominantes, le pH est loin des deux
frontires) ; dans ce cas, H
et HO
seront en concentrations voisines de 10
, alors
que [CH
COOH] et [NH
] seront plutt de lordre de 10
(pH distant de 2 units des
frontires, donc concentrations 100 fois plus faibles que les concentrations des espces
majoritaires qui sont voisines de 10
). La RP doit donc crer CH
COOH et NH
et non
pas H
ou HO
.
Chacun de ces trois raisonnements (le troisime tant le plus sr) conduit faire lhypothse que laRP
est(R1) :
(R1) NH
+ CH
COO
NH
+ CH
COOH =
= 10
,
apport 0,015 0,020 0 0
quilibre 0,015 0,020 (concentrations en
)
Cette raction tant peu avance, il est logique de penser que sera ngligeable devant les
concentrations apportes. On peut alors calculer par :
=
0,015 0,020
= 1,1 10
On trouve bien 0,015 : la RP est bien peu avance.
Il faut maintenant vrifier que (R1) est bien la RP. Ceci nous a permis dtablir que les deux espces les
moins minoritaires sont produites en quantit gale par (R1) : [NH
] = [CH
COOH] = = 1,1
10
. Il faut donc calculer les concentrations des espces H
et HO
afin de vrifier que les
ractions qui les crent ((R2), (R3) et (R4)) ont bien un avancement ngligeable devant celui de (R1).
Il suffit pour cela de calculer le pH, ce qui est maintenant immdiat car on connat les concentrations
de lacide et de la base conjugue dans les deux couples :
pH = 4,8 +log
0,020
= 9,2 +log
0,015
= 7,1
Donc H
= 10
,
= 7,9 10
molL
et [HO
] =
= 1,3 10
molL
: ces deux
concentrations sont bien ngligeables devant = 1,1 10
: la RP est bien (R1) !
quilibres en solution aqueuse Exercice 7 Page 7 sur 19
pH
7,0 13,0
Conclusion:
[NH
] = 0,015 molL
[CH
COO
] = 0,020 molL
[NH
] = [CH
COOH] = = 1,1 10
molL
= 7,9 10
molL
; pH = ,
[HO
] = 1,3 10
molL
6) Concentration apporte :
HS
= 0,030
Diagramme de prdominance :
p
S HS
HS
est une espce amphotre : la situation sapparente beaucoup celle de la question prcdente, o
lacide et la base domaines de prdominance communs seraient une seule et mme espce.
On peut donc crire les 4 quilibres peu avancs :
(R1) 2 HS
S +S
(R2) HS
+H
O S
+H
(R3) HS
+H
O H
S +HO
(R4) 2H
O H
+HO
En gnral, dans le cas dun ampholyte, la raction prpondrante est (R1) : on a montr en cours que
dans ce cas : pH =
(p
+p
) = 10,0 (formule des ampholytes).
Cette formule nest valide que si (R1) est prpondrante sur les autres quilibres, cest--dire si
[H
S] = [S
] [H
] et [HO
].
Pour vrifier lhypothse, on utilise : pH = 10,0 = 7,0 +log
[HS
]
[H
S]
= 13,0 +log
S
[HS
]
; si on suppose de
plus la RP peu avance, alors [HS
] =
HS
= 0,030
, dont on tire : [H
S] = [S
] = 3,0
10
(valide : la RP est bien peu avance).
Mais de pH = 10,0, on dduit aussi immdiatement [HO
] = 1,0 10
qui nest pas
ngligeable devant [H
S] = [S
] = 3,0 10
!
(R1) nest donc pas seule RP. LaractionquiposeproblmeestlaractionquicreHO
(sans
crer H
),donclaraction(R3).
(R1) et (R3) sont alors RP simultanes et on pose le problme ainsi :
(R1) 2 HS
S + S
= 10
apport 0,030 0 0
quilibre 0,030 2 + (concentrations en
)
(R2) HS
+ H
O H
S + HO
= 10
apport 0,030 0 0
quilibre 0,030 2 + (concentrations en
)
En supposant les deux ractions peu avances, la mise en quation donne :
quilibres en solution aqueuse Exercice 7 Page 8 sur 19
pH
2,0
=
( +)
0,030
=
( +)
0,030
En divisant ces deux quations, on obtient
,
=
, donc = 0,3 : les deux avancements sont bien
du mme ordre de grandeur. On injecte cette relation dans lune des constantes dquilibre :
=
(1,3)
0,03
= 4,8 10
= 1,4 10
mol
Ces deux valeurs sont bien ngligeables devant 0,030
: les deux RP sont bien trs peu
avances.
Conclusion:
[HS
] = 0,030
[H
S] = + = 6,5 10
[S
] = = 1,4 10
[HO
] = = 4,8 10
molL
[HO
]
= 2,1 10
molL
; pH = ,
7) Concentrations apportes :
O
= 0,10 +0,20 = 0,30
(pH
= 0,5)
HSO
= 0,20
HO
= 0,35
(pH
= 13,5)
Rappel : Lacide sulfurique est un diacide dont seule la premire acidit est forte (quation de dissolution :
H
SO
+H
O HSO
+H
). On le traite donc comme si on apportait HSO
et H
sparment.
Diagramme de prdominance :
H
HSO
SO
HO
On voit que le systme apport possde des espces incompatibles.
Le systme doit donc voluer trs fortement. La raction prpondrante quasi-totale considrer en
premier est la raction entre les espces les plus loignes dans le diagramme, cest--dire entre
lacide le plus fort et la base la plus forte :
(RP) H
+HO
2 H
O
Selon la mthode de la RP, on traite cette raction trs avance comme rigoureusement totale, afin de
transformer le problme en un problme quivalent mais beaucoup plus proche de ltat final
recherch.
(RP) H
+ HO
2 H
O
apport 0,30 0,35
si totale 0 0,05 (concentrations en
)
quilibres en solution aqueuse Exercice 7 Page 9 sur 19
pH
2,0
pH
2,0
y La solution est donc quivalente une solution o on aurait apport :
HSO
= 0,20
HO
= 0,05
(pH
= 12,7)
On prend cette nouvelle solution comme point de dpart et on recommence
Diagramme de prdominance :
HSO
SO
HO
On voit que le systme apport possde des espces incompatibles.
Le systme doit donc voluer trs fortement. La raction prpondrante quasi-totale est la raction
entre HSO
et HO
:
(RP) HSO
+HO
SO
+H
O
Selon la mthode de la RP, on traite cette raction trs avance comme rigoureusement totale, afin de
transformer le problme en un problme quivalent mais beaucoup plus proche de ltat final
recherch.
(RP) HSO
+ HO
SO
+ H
O
apport 0,20 0,05 0
si totale 0,15 0 0,05 (concentrations en
)
y La solution est donc quivalente une solution o on aurait apport :
HSO
= 0,15
SO
= 0,05
On prend cette nouvelle solution comme point de dpart et on recommence
Diagramme de prdominance :
HSO
SO
Il ny a plus despces incompatibles. On apporte lacide et la base dun mme couple en concentrations
du mme ordre de grandeur, on reconnat donc la situation des solutionstampon (vue en cours).
Les ractions a priori peu avances que lon peut crire sont :
(R1) HSO
+H
O SO
+H
(R2) SO
+H
O HSO
+HO
(R3) 2H
O H
+HO
Si les ractions sont peu avances, alors les espces majoritaires gardent quasiment lquilibre leur
concentration apporte (approximation des solutions tampons) et on trouve alors immdiatement :
pH = 2,0 +log
,
,
= 1,5. Mais cela impliquerait [H
] = 0,032
qui nest pas ngligeable
devant
SO
= 0,05
!
La raction (R1) qui cre H
est donc la RP et son avancement nest pas ngligeable il faut donc
rsoudre :
quilibres en solution aqueuse Exercice 7 Page 10 sur 19
pH
4,8
9,2
(R1) HSO
+ H
O SO
+ H
apport 0,15 0,05 0
quilibre 0,15 0,05 + (concentrations en
= 10
,
=
(0,05 +)
0,15
+(0,05 +
) 0,15
= 0
= 0,019
Conclusion:
[HSO
] = 0,15 = 0,131
[SO
] = 0,05 + = 0,069
[H
] = = 0,019
; pH = ,
[HO
] =
= 5,3 10
molL
On vrifie : (R2) et (R3) taient bien ngligeables car [HO
] .
8) Concentrations apportes :
NH
= 0,10 +0,05 = 0,15
CH
COO
= 0,050
CH
COOH
= 0,15
HO
= 0,15
(pH
= 12,3)
Diagramme de prdominance :
NH
NH
CH
COOH CH
COO
HO
On voit que le systme apport possde des espces incompatibles.
Le systme doit donc voluer trs fortement. La raction prpondrante quasi-totale est la raction
entre les espces les plus loignes dans le diagramme, cest--dire entre lacide le plus fort et la base
la plus forte :
(RP) CH
COOH +HO
CH
COO
+H
O
Selon la mthode de la RP, on traite cette raction trs avance comme rigoureusement totale, afin de
transformer le problme en un problme quivalent mais beaucoup plus proche de ltat final
recherch.
(RP) CH
COOH + HO
CH
COO
+ H
O
apport 0,15 0,15 0,05
si totale 0 0 0,20 (concentrations en
)
quilibres en solution aqueuse Exercice 7 Page 11 sur 19
pH
4,8
9,2
y La solution est donc quivalente une solution o on aurait apport :
NH
= 0,15
CH
COO
= 0,20
On prend cette nouvelle solution comme point de dpart et on recommence
On se rend compte alors quon retombe sur un problme similaire la question 5)
Diagramme de prdominance :
NH
NH
CH
COOH CH
COO
Les espces apportes sont dans des domaines de prdominance communs, on peut donc prvoir que
le systme voluera peu par rapport aux concentrations apportes, donc que NH
et CH
COO
resteront majoritaires lquilibre.
Il faut donc trouver la RP peu avance qui cre les espces minoritaires, parmi toutes les ractions
possibles :
(R1) NH
+CH
COO
NH
+CH
COOH
(R2) NH
+H
O NH
+H
(R3) CH
COO
+H
O CH
COOH +HO
(R4) 2H
O H
+HO
Comme pour 5), on fait lhypothse que laRPest(R1) :
(R1) NH
+ CH
COO
NH
+ CH
COOH =
= 10
,
apport 0,15 0,20 0 0
quilibre 0,15 0,20 (concentrations en
)
Cette raction tant peu avance, il est logique de penser que sera ngligeable devant les
concentrations apportes. On peut alors calculer par :
=
0,15 0,20
= 1,1 10
On trouve bien 0,15 : la RP est bien peu avance.
Finalement :
pH = 4,8 +log
0,20
= 9,2 +log
0,15
= 7,1
Donc H
= 10
,
= 7,9 10
molL
et [HO
] =
= 1,3 10
molL
: ces deux
concentrations, cres par (R2), (R3) et (R4) sont bien ngligeables devant = 1,1 10
: la
RP est bien (R1) !
quilibres en solution aqueuse Exercice 7 Page 12 sur 19
pH
2,0
9,2
pH
2,0
9,2
Conclusion:
[NH
] = 0,15 molL
[CH
COO
] = 0,20 molL
[NH
] = [CH
COOH] = = 1,1 10
molL
= 7,9 10
molL
; pH = ,
[HO
] = 1,3 10
molL
9) Concentrations apportes :
O
= 0,010
(pH
= 2,0)
HSO
= 0,010
NH
= 0,015
NH
= 0,005
Rappel : Lacide sulfurique est un diacide dont seule la premire acidit est forte (quation de dissolution :
H
SO
+H
O HSO
+H
). On le traite donc comme si on apportait HSO
et H
sparment.
Diagramme de prdominance :
H
HSO
SO
NH
NH
On voit que le systme apport possde des espces incompatibles.
Le systme doit donc voluer trs fortement. La raction prpondrante quasi-totale est la raction
entre lacide le plus fort et la base la plus forte :
(RP) H
+NH
O +NH
Selon la mthode de la RP, on traite cette raction trs avance comme rigoureusement totale, afin de
transformer le problme en un problme quivalent mais beaucoup plus proche de ltat final
recherch.
(RP) H
+ NH
O + NH
apport 0,010 0,015 0,005
si totale 0 0,005 0,015 (concentrations en
)
y La solution est donc quivalente une solution o on aurait apport :
HSO
= 0,010
NH
= 0,005
NH
= 0,015
On prend cette nouvelle solution comme point de dpart et on recommence
Diagramme de prdominance :
HSO
SO
NH
NH
quilibres en solution aqueuse Exercice 7 Page 13 sur 19
pH
2,0
9,2
On voit que le systme apport possde des espces incompatibles.
Le systme doit donc voluer trs fortement. La raction prpondrante quasi-totale est la raction
entre HSO
et NH
:
(RP) HSO
+NH
SO
+NH
Selon la mthode de la RP, on traite cette raction trs avance comme rigoureusement totale, afin de
transformer le problme en un problme quivalent mais beaucoup plus proche de ltat final
recherch.
(RP) HSO
+ NH
SO
+ NH
apport 0,010 0,005 0 0,015
si totale 0,005 0 0,005 0,020 (concentrations en
)
y La solution est donc quivalente une solution o on aurait apport :
HSO
= 0,005
SO
= 0,005
NH
= 0,020
On prend cette nouvelle solution comme point de dpart et on recommence
Diagramme de prdominance :
HSO
SO
NH
NH
Il ny a plus despces incompatibles. La situation doit alors peut voluer, et on peut prvoir que le pH
sera voisin de 2 cause du couple HSO
/SO
.
Les ractions a priori peu avances que lon peut crire sont nombreuses (les acides faibles HSO
et
NH
avec leau, la base faible SO
avec leau, SO
avec NH
et lautoprotolyse). Mais il est facile de
voir que la RP sera :
(RP) HSO
+H
O SO
+H
En effet, HSO
est un acide particulirement fort et est responsable de la libration dions H
pour
un pH prvisible autour de 2 ; la situation est trs voisine de celle de la question 7.
En outre, comme on sattend tre trs loin de la frontire entre NH
et NH
, la concentration de NH
sera probablement infime, donc les ractions mettant en jeu NH
ne seront pas RP
Si la RP est peu avance, alors les espces majoritaires gardent quasiment lquilibre leur
concentration apporte (approximation des solutions tampons) et on trouve immdiatement :
pH = 2,0 +log
,
,
= 2,0. Mais cela impliquerait [H
] = 0,010
qui nest pas ngligeable
devant 0,005
!
Il faut donc rsoudre :
(RP) HSO
+ H
O SO
+ H
apport 0,005 0,005 0
quilibre 0,005 0,005 + (concentrations en
= 10
,
=
(0,005 +)
0,005
+(0,005 +
) 0,005
= 0 = 0,0028
quilibres en solution aqueuse Exercice 7 Page 14 sur 19
Si cette raction est bien RP, on a donc [H
] = = 0,0028
, soit pH = 2,6.
Toutes les autres ractions envisageables que lon a ngliges crent NH
ou HO
. Il faut donc vrifier
que les concentrations de ces deux espces sont ngligeables devant lavancement de la RP, cest--
dire devant = 0,0028
:
pH = 2,6 = 9,22 +log
[NH
]
,
donne [NH
] = 5,0 10
: cest valide
[HO
] =
[H
]
= 3,6 10
: cest valide
Conclusion:
[HSO
] = 0,005 = 0,0022
[SO
] = 0,005 + = 0,0078
[NH
] = 0,020
[NH
] = 5,0 10
molL
[H
] = = 0,0028
; pH = ,
[HO
] = 3,6 10
Dans la deuxime partie de cette question, on connat le pH que lon souhaite obtenir et on doit
dterminer la concentration de soude apporter pour y parvenir.
yChoixdeltatinitial:
Comme on la montr tout au long de la partie prcdente, la solution que lon vient de prparer est
quivalente :
- un mlange
H
O
= 0,010
et
HSO
= 0,010
et
NH
= 0,015
et
NH
= 0,005
(tat n1) ;
- un mlange
HSO
= 0,010
et
NH
= 0,005
et
NH
= 0,015
(tat
n2) ;
- un mlange
HSO
= 0,005
et
SO
= 0,005
et
NH
= 0,020
(tat
n3) ;
- un mlange [HSO
] = 0,0022
et [SO
] = 0,0078
et [NH
= 0,020
et [NH
] = 5,0 10
molL
et [H
] = 0,0028
et [HO
] = 3,6 10
(tat
n4, quilibre).
Dans ce dernier cas n4, il sagit de ltatdquilibre de la solution. Maisilseraittrsmaladroitde
raisonnerpartirdelpournotreajoutdesoude, car le nombre despces est beaucoup trop
nombreux, les ordres de grandeur ne correspondent pas les uns avec les autres
Lorsquun exercice enchane les questions dajouts successifs, il est toujours fortement conseill de
repartir dun tat quivalent des concentrations apportes (tat n1, 2 ou 3).
En gnral, il est plus judicieux de partir de ltat le plus proche de ltat dquilibre (tat n3), car cest
lui le plus proche de la vraie nature de la solution. On comprendra donc mieux les phnomnes
conscutifs notre ajout et on limitera le nombre de RP quasi-totales crire.
Par consquent, les concentrations apportes sont :
HSO
= 0,005
SO
= 0,005
NH
= 0,020
HO
= inconnue dterminer
quilibres en solution aqueuse Exercice 7 Page 15 sur 19
pH
2,0
9,2
pH
2,0
9,2
Diagramme de prdominance :
HSO
SO
NH
NH
HO
On voit que la soude que lon doit apporter :
- doit tout dabord transformer lintgralitde HSO
en SO
, afin que lon quitte la zone
tampon autour du pH de 2 ;
- doit ensuite transformer unepartie de NH
en NH
afin que lon obtienne un tampon
ammonium/ammoniac, puisque le pH souhait est voisin de la frontire de prdominance de
ce couple.
Ilfautdoncapporter
HO
= , +,oestdterminer.
La premire raction prpondrante quasi-totale est donc :
(RP) HSO
+HO
SO
+H
O
Selon la mthode de la RP, on traite cette raction trs avance comme rigoureusement totale, afin de
transformer le problme en un problme quivalent mais beaucoup plus proche de ltat final
recherch.
(RP) HSO
+ HO
SO
+ H
O
apport 0,005 0,005 + 0,005
si totale 0 0,010 (concentrations en
)
y La solution est donc quivalente une solution o on aurait apport :
SO
= 0,010
NH
= 0,020
HO
= , qui reste dterminer
On prend cette nouvelle solution comme point de dpart et on recommence
Diagramme de prdominance :
HSO
SO
NH
NH
HO
La RP que lon considre totale est maintenant :
(RP) NH
+ HO
NH
+ H
O
apport 0,020 0
si totale 0,020 0 (concentrations en
)
y La solution est donc quivalente une solution o on aurait apport :
SO
= 0,010
NH
= 0,020
quilibres en solution aqueuse Exercice 7 Page 16 sur 19
pH
2,0
9,2
NH
= , qui reste dterminer
On prend cette nouvelle solution comme point de dpart et on recommence
Diagramme de prdominance :
HSO
SO
NH
NH
Il ny a plus despces incompatibles. La situation doit alors peut voluer, on a bien constitu une
solution tampon ammoniacale, au pH voisin de 9,2.
Si on suppose que toutes les ractions que lon peut crire sont maintenant ngligeables, alors les
concentrations nvoluent plus notablement, lapproximation des tampons est valable et on peut
crire :
pH = 10,0 = 9,2 +log
0,020
Ceci permet de calculer la concentration :
=
0,020 10
,
1 +10
,
= 0,017
Ce rsultat est valide si aucune raction ne modifie les concentrations des espces majoritaires du
tampon, cest--dire :
[NH
] = 0,020 = 0,003
[NH
] = 0,017
(et [SO
] = 0,010
)
Pour la vrification, on calcule les concentrations des espces minoritaires :
[H
] = 10
pH
= 1,0 10
[HO
] =
[H
]
= 1,0 10
[HSO
] =
[H
] [SO
= 1,0 10
toutes ces concentrations sont bien ngligeables devant les concentrations des espces du tampon :
le rsultat est valide.
Note : la RP peu avance responsable de la basicit est NH
+H
O NH
+HO
.
Conclusion:
Pour constituer cette solution tampon, on a apport :
HO
= 0,005 + = 0,022
Le volume tant de 1L, on a apport une quantit de matire de soude de :
= , mol
10) Concentrations apportes :
O
= 0,010
(pH
= 2,0)
HSO
= 0,010
NH
= 0,005
NH
= 0,020
quilibres en solution aqueuse Exercice 7 Page 17 sur 19
pH
2,0
9,2
4,8
pH
2,0
9,2
4,8
CH
COO
= 0,010
Rappel : Lacide sulfurique est un diacide dont seule la premire acidit est forte (quation de dissolution :
H
SO
+H
O HSO
+H
). On le traite donc comme si on apportait HSO
et H
sparment.
Diagramme de prdominance :
H
HSO
SO
CH
COOH CH
COO
NH
NH
Daprs le diagramme, de nombreuses espces sont incompatibles.
La raction prpondrante quasi-totale, entre lacide le plus fort et la base la plus forte, est :
(RP) H
+ NH
O + NH
apport 0,010 0,020 0,005
si totale 0 0,010 0,015 (concentrations en
)
y La solution est donc quivalente une solution o on aurait apport :
HSO
= 0,010
NH
= 0,015
NH
= 0,010
CH
COO
= 0,010
On prend cette nouvelle solution comme point de dpart et on recommence
Diagramme de prdominance :
HSO
SO
CH
COOH CH
COO
NH
NH
Daprs le diagramme, on voit que NH
et HSO
ont des domaines de prdominance nettement
disjoints.
On prvoit donc que la ractionprpondrante ci-dessous est quasi-totale :
(RP) HSO
+ NH
SO
+ NH
apport 0,010 0,010 0 0,015
si totale 0 0 0,010 0,025 (concentrations en
)
y La solution est donc quivalente une solution o on aurait apport :
SO
= 0,010
NH
= 0,025
quilibres en solution aqueuse Exercice 7 Page 18 sur 19
pH
2,0
9,2
4,8
CH
COO
= 0,010
On prend cette nouvelle solution comme point de dpart et on recommence
Diagramme de prdominance :
HSO
SO
CH
COOH CH
COO
NH
NH
Daprs le diagramme, on voit que toutes les espces ont des domaines de prdominance compatibles.
Par consquent, on en dduit que cette situation est proche de ltat dquilibre.
Les espces majoritaires devraient donc tre lquilibre : SO
, CH
COO
et NH
.
On peut postuler que tous les quilibres que lon peut maintenant crire (et ils sont nombreux !)
seront trs peu avancs, et que les concentrations des espces majoritaires resteront quasiment gales
:
[SO
] = 0,010
[NH
] = 0,025
[CH
COO
] = 0,010
Afin de vrifier cette hypothse, et calculer le pH, il faut calculer les concentrations des espces
minoritaires.
Pour cela, on peut chercher la ractionprpondrante, qui devrait tre la raction entre les deux
espces ayant les domaines de prdominance communs les plus troits, savoir NH
et CH
COO
(acide le plus fort avec base la plus forte) et on se ramne encore une fois une situation quivalente
celle des questions 5 et 8 :
(RP) NH
+ CH
COO
NH
+ CH
COOH = 10
,,
= 10
,
apport 0,025 0,010 0 0
quilibre 0,025 0,010 (concentrations en
)
On peut alors calculer par :
=
0,025 0,010
= 1,0 10
On vrifie immdiatement lhypothse 0,010
: cette raction ne modifie pas les
concentrations des espces majoritaires, comme postul plus haut.
Ceci permet dtablir :
[NH
] = [CH
COOH] = 1,0 10
Il reste vrifier que cette raction peu avance tait bien la raction prpondrante.
Pour cela, il faut sassurer que toutes les autres espces sont ngligeables devant NH
et CH
COOH.
On trouve :
pH = 4,8 +log
,
,
= 6,8, soit [H
] = 1,6 10
1,0 10
: valide
[HO
] =
,
10
= 6,3 10
1,0 10
: valide
[HSO
] =
H
SO
= 1,6 10
1,0 10
: valide
quilibres en solution aqueuse Exercice 7 Page 19 sur 19
Conclusion :
[HSO
] = 1,6 10
[SO
] = 0,010
[CH
COOH] = 1,0 10
molL
[CH
COO
] = 0,010 molL
[NH
] = 0,025
[NH
] = 1,0 10
molL
[H
] = 1,6 10
; pH = ,
[HO
] = 6,3 10
quilibres en solution aqueuse Exercice 8 Page 1 sur 2
Corrig exercice 8
PLUIES ACIDES
1) Diagramme de prdominance :
H
2
SO
3
HSO
3
SO
3
2
_ _
pH
1,8 7,2
2) La dissolution de H
SO
entrane lacidification de la solution. Le pH dquilibre tant infrieur
celui de leau de pluie (de lordre de 6 comme lindique lnonc la premire ligne), on voit sur le
diagramme de prdominance que cela signifie que lon est hors du domaine de prdominance de SO
.
On en dduit donc que [SO
] est probablement en concentration ngligeable.
3) Lquation responsable de lacidification de leau de pluie est donc :
H
SO
+H
O HSO
+H
4) On applique la loi de lquilibre chimique la raction (3) :
= 1,25 =
SO
SO
O
La solution tant assez dilue, on peut admettre que
H
O
= 1 et que lon peut remplacer lactivit du
solut H
SO
par sa concentration. Par contre, il ne faut pas oublier que SO
est un gaz (suppos
parfait), donc
SO
=
SO
, avec
= 1 bar, donc :
= 1,25 =
[H
SO
SO
, avec
= 1
Comme la solution est surmonte dune atmosphre telle que
SO
= 8,0 10
bar, on en dduit :
[H
SO
] = 1,0 10
molL
Le bilan de matire de la raction crite au 3) montre que lon a ncessairement [HSO
] = [H
]
lquilibre. Notons cette concentration commune. Comme on vient de calculer [H
SO
] lquilibre,
lapplication du
donne directement :
= 10
,
=
[H
SO
dont on tire :
= 4,0 10
= [HSO
] = [H
]
pH = log
H
= 4,4
5) Les concentrations des espces majoritaires [HSO
] et [H
] tant maintenant connues, on
calcule la concentration [SO
] en utilisant simplement la constante
= 10
,
=
H
SO
[HSO
On trouve :
SO
= 6,3 10
molL
Cette concentration est bien ngligeable devant [HSO
] = [H
], ce qui valide le fait quon pouvait
quilibres en solution aqueuse Exercice 8 Page 2 sur 2
ngliger les ractions formant SO
pour calculer la concentration en H
.
Remarque : On na rien vrifier sur la concentration dquilibre de H
SO
car celle-ci est maintenue
constante par lquilibre (3), et donc par la pression partielle de SO
dans latmosphre extrieure,
indpendamment des ractions acido-basiques qui ont lieu dans la solution.
quilibres en solution aqueuse Exercice 9 Page 1 sur 4
Corrig exercice 9
COMPLEXES DE LION MANGANSE (II) AVEC LES IONS OXALATE
1) Frontire de prdominance pourlecouple[Mn(C
)]/Mn
:
On exprime la constante caractrisant ce couple dans un cas dquilibre gnral :
=
[Mn(C
)]
[Mn
] [C
]
la frontire, on a [Mn(C
)] = [Mn
], donc :
=
1
C
Finalement :
pC
= log
Pourlecouple[Mn(C
/[Mn(C
)], on procde de mme pour montrer :
pC
= log
Mais attention, dans les relations prcdentes, il sagit bien des constantes de formations successives
et
. Or lnonc fournit les constantes de formation globales des complexes.
Pour lincorporation du premier ligand, formation globale ou successive se confondent :
.
Par contre, on doit calculer
sachant que
: on trouve donc :
Finalement :
couple [Mn(C
)]/Mn
: pC
= log
= 3,82
couple [Mn(C
/[Mn(C
)] : pC
= log
log
= 5,25 3,82 = 1,43
Do le diagramme de prdominance :
pC
2
O
4
Mn(C
2
O
4
)
2
Mn(C
2
O
4
) Mn
2+
1,43 3,82
2-
[ [ ] ]
2) Casa)
On calcule tout dabord les concentrations apportes en ions intervenant dans le problme :
Mn
=
= 0,040
= 0,020
On constate que cette concentration en ligand correspond, en chelle logarithmique, pC
=
log
C
= 1,70.
On place les espces apportes sur le diagramme de prdominance :
quilibres en solution aqueuse Exercice 9 Page 2 sur 4
pC
2
O
4
Mn(C
2
O
4
)
2
Mn(C
2
O
4
) Mn
2+
C
2
O
4
1,43 3,82
2-
[ [ ] ]
2-
(lion oxalate est la particule change, on indique donc que son apport correspond une position sur
laxe des abscisses
= 1,70).
On voit sur le diagramme que le systme apport est loin de ltat dquilibre (Mn
ne peut
prdominer lorsque = 1,70) : il doit donc se produire une complexation trs avance entre C
et Mn
:
Mn
+C
[Mn(C
)] : quilibre de constante
= 10
,
1
Remarque : cette complexation ne peut que consommer le ligand et augmenter pL. On est donc sr que le
complexe [Mn(C
sera minoritaire lquilibre Il ne faut donc surtout pas envisager
Mn
+2C
[Mn(C
comme raction quasi-totale, bien que sa constante
soit suprieure
.
Le bilan de matire de cette raction considrecommetotale (faire un tableau davancement si
ncessaire) montre que le systme est quivalent un mlange :
Mn
= 0,020
[Mn(C
)]
= 0,020 molL
et on reprend ce nouveau problme :
pC
2
O
4
Mn(C
2
O
4
)
2
Mn(C
2
O
4
) Mn
2+
1,43 3,82
2-
[ [ ] ]
On voit quun tel systme est a priori stable, proche de lquilibre : il sagit dun tamponde
complexation.
On peut donc prvoir que toutes les ractions que lon pourrait crire seront ngligeables, cest--dire
ne modifieront pas sensiblement les concentrations des espces apportes. Donc lquilibre, on fait
lhypothse quon a :
Mn
= 0,020 mol L
et [Mn(C
)] = 0,020 molL
On vrifie alors que toutes les autres espces sont en concentration ngligeable :
pC
= 3,82 car on se situe la frontire de prdominance, donc :
C
= 10
,
= 1,5 10
molL
Cette valeur est bien ngligeable devant 0,020
: la raction [Mn(C
)] Mn
+C
ne
modifie donc pas sensiblement la concentration des espces majoritaires.
De plus :
[Mn(C
Mn
= 8,0 10
molL
Cette concentration est, elle aussi, ngligeable devant 0,020
: la raction 2[Mn(C
)]
Mn
+[Mn(C
est donc elle aussi ngligeable.
Les rsultats sont valides.
Casb)
Concentrations apportes :
Mn
=
= 0,020
= 0,080
quilibres en solution aqueuse Exercice 9 Page 3 sur 4
On constate que cette concentration en ligand correspond, en chelle logarithmique, pC
=
log
C
= 1,10.
On place les espces apportes sur le diagramme de prdominance :
pC
2
O
4
Mn(C
2
O
4
)
2
Mn(C
2
O
4
) Mn
2+
C
2
O
4
1,43 3,82
2-
[ [ ] ]
2-
On voit sur le diagramme que le systme apport est loin de ltat dquilibre : il doit donc se produire
une complexation trs avance entre C
et Mn
:
Mn
+C
[Mn(C
)] : quilibre de constante
= 10
,
1
Remarque : ici, il serait tentant de choisir comme RP directement la double complexation conduisant
[Mn(C
car la concentration initiale du ligand correspond la prdominance de ce complexe.
Cependant, on est trs proche de la frontire et lincorporation dun premier ligand fera augmenter pL Il
vaut donc mieux envisager dabord la formation du complexe [Mn(C
)]. On pourra toujours envisager
la formation de [Mn(C
comme 2
me
RP quasi-totale ensuite.
Dune manire gnrale, moins dtre sr davoir assez de ligand, et des ractions de complexation assez
avances, il est conseill denvisager les RP de complexation successivement.
Le bilan de matire de cette raction considrecommetotale montre que le systme est quivalent
un mlange :
[Mn(C
)]
= 0,020 molL
= 0,060
= 1,22)
et on reprend ce nouveau problme :
pC
2
O
4
Mn(C
2
O
4
)
2
Mn(C
2
O
4
) Mn
2+
C
2
O
4
1,43 3,82
2-
[ [ ] ]
2-
ce stade, on constate que le systme doit encore voluer, par la RP :
[Mn(C
)] +C
[Mn(C
: quilibre de constante
= 10
,
Cette raction va consommer le ligand, donc pL va augmenter on est donc certain de terminer trs
proche de la frontire. On se doute donc fortement que ni [Mn(C
)] ni [Mn(C
ne seront
ngligeables lun devant lautre. On passe donc directement la rsolution de lquation du second
degr :
RP [Mn(C
)] + C
[Mn(C
= 10
,
apport 0,020 0,060 0
quilibre 0,020 0,060 (concentrations en
)
On pose la loi de Guldberg et Waage :
(0,020 )(0,060 )
qui donne :
0,117 +0,0012 = 0
quilibres en solution aqueuse Exercice 9 Page 4 sur 4
On trouve finalement :
= [Mn(C
= 0,0114
[Mn(C
)] = 0,0086 molL
= 0,0486 molL
( = 1,31)
Remarque : Il naurait pas t absurde de considrer cette dernire RP comme quasi-totale, en esprant
que le complexe [Mn(C
)] serait ngligeable lquilibre mais cette hypothse naurait pas t
vrifie, et il aurait fallu envisager la redissociation de [Mn(C
, rsoudre de toutes faons par
une quation du second degr. Ce serait donc un dtour inutile.
On est bien trs proche de la frontire, le complexe [Mn(C
tant lgrement prdominant,
mais du mme ordre de grandeur que [Mn(C
)] :
pC
2
O
4
Mn(C
2
O
4
)
2
Mn(C
2
O
4
) Mn
2+
1,43 3,82
2-
[ [ ] ]
pL=1,31
La seule hypothse vrifier est que [Mn
] est ngligeable, ce qui se fait aisment :
[Mn
] =
[Mn(C
O)
[C
]
= 2,7 10
[Mn(C
)] (valide)
quilibres en solution aqueuse Exercice 10 Page 1 sur 3
Corrig exercice 10
COMPLEXES DU FER (III)
En lisant lintgralit de lnonc, on remarque que les ions Fe
peuvent se complexer avec deux
ligands diffrents : lion thiocyanate SCN
et lion fluorure F
.
Il est donc judicieux de considrer SCN
et F
comme deux accepteurs de la particule commune Fe
,
ce qui dfinit les couples donneurs/accepteurs [Fe(SCN)]
/SCN
et [FeF]
/F
.
On peut alors tracer le diagramme de prdominance en abscisse pFe :
pFe
[Fe(SCN)] SCN
[FeF] F
2+ -
2+
2,0
5,5
_
(les frontires de prdominance stablissent en crivant, par exemple,
=
[Fe(SCN)]
[Fe
][SCN
]
, soit la
frontire
=
[Fe
, do pFe
= +log
)
1) On apporte lion Fe
= 1,0 10
(soit pFe
= 3,0) et lion SCN
= 2,0 10
.
a) Lquilibre de formation du complexe (de constante
= 100) est :
Fe
+SCN
[Fe(SCN)]
b) Voir introduction de lexercice ci-dessus
c) On peut tout dabord remarquer que lion Fe
tant en net dfaut, la concentration de SCN
ne peut
que trs peu varier. Ceci est compatible avec le fait que, puisquon ne peut que consommer Fe
, on
aura pFe
> pFe
= 3,0. On se retrouve ncessairement lquilibre dans le domaine de
prdominance de SCN
.
On peut donc postuler qu lquilibre, mieux de 5% prs :
[SCN
] = 2,0 10
molL
Soit lavancement volumique de la raction de complexation, on trouve donc :
= 100 =
(0,001 ) 0,02
soit 0,002 2 = ,
do =
,
= 6,7 10
On trouve bien 2,0 10
( 3 % prs), ce qui valide lhypothse.
[Fe
] = 3,3 10
, pFe = 3,5
[Fe(SCN)]
= 6,7 10
On remarque que la concentration du complexe [Fe(SCN)]
= 6,7 10
est suffisante pour
donner une coloration rouge intense la solution.
quilibres en solution aqueuse Exercice 10 Page 2 sur 3
2) On apporte maintenant des ions fluorure la concentration
= 1,0 10
.
a) Voir introduction de lexercice
b) On remarque que les ions fluorure et le complexe [Fe(SCN)]
ont des domaines de
prdominance disjoints. On peut en dduire que les ions fluorure vont dtruire le complexe
[Fe(SCN)]
au profit de [FeF]
, do la disparition de la coloration rouge.
Le problme traiter correspond au mlange :
de Fe
= 1,0 10
de SCN
= 2,0 10
de
F :
= 1,0 10
(NB : lorsque des questions senchanent par des ajouts successifs, il est fortement dconseill de
repartir dune situation dquilibre, car les bilans de matire sont plus complexes et on risque
denchaner les erreurs darrondi ; repartir toujours despces apportes).
La raction prpondrante est la complexation des ions Fe
avec les ions fluorure. On prvoit que
cette raction est quasi-totale. En effet, pFe
= 3,0 et les ions F
tant en large excs, on
terminera ncessairement dans leur domaine de prdominance, cest--dire pFe
> 5,5.
RP : Fe
+F
[FeF]
En considrant cette raction comme totale, on peut dire que la solution est quivalente au mlange :
de SCN
= 2,0 10
de F
:
F
= 0,9 10
de [FeF]
:
FeF
= 0,1 10
molL
pFe
[Fe(SCN)] SCN
[FeF] F
2+
-
2+
2,0
5,5
_
Daprs le diagramme, on voit que toutes les espces ont des domaines de prdominance compatibles.
Par consquent, on en dduit que cette situation est proche de ltat dquilibre. Les espces
majoritaires devraient donc tre lquilibre : SCN
, F
et [FeF]
.
On peut postuler que tous les quilibres que lon peut maintenant crire seront trs peu avancs, et
que les concentrations des espces majoritaires resteront gales :
[SCN
] = 2,0 10
[F
] = 0,9 10
[FeF]
= 0,1 10
molL
Afin de vrifier cette hypothse, il faut calculer les concentrations des espces minoritaires.
= 10
,
=
0,1 10
[Fe
] 0,9 10
Fe
= 3,5 10
molL
0,1 10
(valide)
On trouve donc : pFe = 6,4(5)
De plus :
quilibres en solution aqueuse Exercice 10 Page 3 sur 3
= 100 =
[Fe(SCN)]
3,5 10
2,0 10
[Fe(SCN)]
= 7,0 10
molL
0,1 10
(valide)
Cette fois, on conclut que la concentration du complexe [Fe(SCN)]
= 7,0 10
molL
est si faible
quelle ne donne plus une coloration rouge perceptible la solution.
quilibres en solution aqueuse Exercice 11 Page 1 sur 3
Corrig exercice 11
COMPLEXATIONS COMPTITIVES DE LION THIOSULFATE
1) On choisit S
comme particule change car elle est commune aux deux couples.
Attention cependant, dans chaque couple il y a deux particules changes et le complexe intermdiaire
nexiste pas. Les couples [ML
]/M sont caractriss par leur constante de formation globale, qui a pour
expression gnrale lquilibre :
=
[ML
]
[M] [L]
la frontire de prdominance, [ML
] = [M], on peut donc trouver la concentration du ligand la
frontire :
=
1
[L]
[L]
=
1
pL
=
1
2
log
Do le diagramme demand (chaque complexe prdomine pour les pL bas, cest--dire lorsque la
solution est riche en ligand) :
6,7(5) 14,5 pS
[Ag(S
Ag
[Hg(S
Hg
2) On calcule les concentrations apportes en ion Ag
(issu de la solution de AgNO
) et en ligand
S
(issu de la solution de K
(S
)) :
Ag
=
= 0,0080
= 0,0300
Cette concentration apporte correspond un pS
de lordre de 2 ce qui appartient au
domaine de prdominance du complexe. En labsence dions mercuriques, la seule raction trs
avance considrer est la formation du complexe [Ag(S
:
Ag
+ 2S
[Ag(S
= 10
,
1
apport 0,0080 0,0300 0
sitotale 0 0,0140 0,0080 (concentrations en
)
Attention la stchiomtrie ! Lavancement final vaut
= 0,0080
car Ag
est limitant et a
un nombre stchiomtrique de 1.
La concentration finale de S
est donc de 0,0030 molL
= 0,0014
.
Aprs cette complexation considre comme totale, le systme est quivalent au mlange :
[Ag(S
]
= 0,0080
= 0,0140
Notons que la concentration en ligand correspond pS
= 1,8(5), ce qui est bien largement dans le
domaine de prdominance du complexe. Ce systme est donc stable. Les concentrations prcdentes
doivent donc rester quasiment inchanges lquilibre. Le seul quilibre peu avanc que lon peut
crire est linverse de la raction prcdente, cest--dire la dissociation du complexe. On peut penser
quilibres en solution aqueuse Exercice 11 Page 2 sur 3
que cette raction inverse sera trs peu avance et ne modifiera plus les concentrations des espces
majoritaires, do ltat final :
[Ag(S
= 0,0080
= 0,0140 molL
et pS
= 1,8(5)
On en dduit la concentration en Ag
grce lexpression de
=
0,0080
[Ag
] (0,0140)
On trouve :
[Ag
] = 1,3 10
Cette concentration est bien totalement ngligeable devant celle des espces majoritaires.
Le rsultat est valide.
6,7(5) 14,5 pS
[Ag(S
Ag
1,8(5)
3) On reprend la solution prcdente, dont on a tabli quelle tait quivalente au mlange :
[Ag(S
]
= 0,0080
= 0,0140
On ajoute alors une autre solution contenant des ions Hg
, ce qui a pour effet de diluerlesespces
prcdentes, et dapporter lion Hg
.
On calcule donc avec soin les concentrations apportes ; le problme consiste mlanger :
[Ag(S
]
= 0,0080 L
= 0,0040
= 0,0140
= 0,0070
(pS
= 2,1(5))
Hg
=
= 0,0200
On peut traduire cette situation apporte sur un diagramme de prdominance :
S
2,1(5) 6,7(5) 14,5 pS
[Ag(S
Ag
[Hg(S
Hg
On constate sur le diagramme que la situation est instable. Hg
ne peut coexister ni avec le ligand ni
avec le complexe [Ag(S
.
On crit dabord la raction que lon pense la plus favorable. Comme leligandestlemeilleur
donneurdelui-mme (cest lquivalent de H
en acido-basicit de Brnsted), la raction est :
Hg
+ 2S
[Hg(S
= 10
1
apport 0,0200 0,0070 0
sitotale 0,0165 0 0,0035 (concentrations en
)
Attention nouveau la stchiomtrie ! Ici, le ractif limitant est S
et
= 0,0035 molL
.
quilibres en solution aqueuse Exercice 11 Page 3 sur 3
On reporte cette nouvelle situation sur le diagramme de prdominance :
6,7(5) 14,5 pS
[Ag(S
Ag
[Hg(S
Hg
Le diagramme de prdominance montre que les ions mercuriques restant ne peuvent coexister avec le
complexe [Ag(S
: les domaines de prdominance sont disjoints. Ils vont donc le dtruire au
profit du complexe plus stable [Hg(S
, selon la raction :
Hg
+ [Ag(S
[Hg(S
+ Ag
apport 0,0165 0,0040 0,0035 0
sitotale 0,0125 0 0,0075 0,0040 (concentrations en
)
Il ny a alors plus despces incompatibles, donc plus de raction trs avance. On est proche de ltat
dquilibre.
En faisant lhypothse que les espces majoritaires prcdemment calcules ne voient pas leur
concentration modifie par les ractions secondaires, on trouve :
[Hg
] = 0,0125
[Hg(S
= 0,0075
[Ag
] = 0,0040
Les concentrations des espces minoritaires se calculent en utilisant les constantes appropries
S
=
[Hg(S
Hg
= 2,4 10
molL
Cette concentration est bien ngligeable devant [Hg(S
(la dissociation spontane du complexe
est compltement ngligeable).
pS
= log[S
] = 14,6
On est en prsence dun tampon de complexation avec une lgre prdominance de laccepteur Hg
.
[Ag(S
[Ag
] S
= 7,3 10
molL
ce qui vrifie sans problme lhypothse que cette espce est ngligeable.
On peut schmatiser la situation dquilibre :
6,7(5) 14,5 pS
[Ag(S
Ag
[Hg(S
Hg
14,6
quilibres en solution aqueuse Exercice 12 Page 1 sur 2
Corrig exercice 12
LAMMONIAC EST UNE BASE ET UN LIGAND
1) On constitue une solutiontampon en apportant une concentration de 1,0 10
de
NH
dune part et de 1,0 10
de NH
dautre part.
Les quilibres peu avancs quon peut crire sont les ractions de NH
et de NH
sur leau, librant
HO
et H
(et lautoprotolyse de leau). Si on nglige lavancement de ces ractions devant
1,0 10
, alors on dit que lesapproximationsdestampons(oudeHenderson)sont
vrifies, et on conserve lquilibre :
[NH
] = NH
= 1,0 10
molL
On trouve donc le pH :
pH = p
+log
1 10
1 10
= p
= 9,2
Vrification : Le tampon tant basique, HO
est plus concentr que H
ce qui veut dire que la
ractionprpondrante peu avance est :
NH
+H
O NH
+HO
Or lavancement de cet quilibre vaut = [HO
] = 10
pH
= 10
,
= 1,6 10
, cequi
estngligeable devant 1,0 10
et ne modifie donc pas les concentrations des espces
majoritaires : [NH
] = NH
= 1,0 10
molL
.
2) Le volume tant de 1,000 , la concentration apporte de Ag
est de 0,40
.
Cette concentration est en large excs devant les concentrations de NH
et NH
.
On commence par rechercher la raction prpondrante trs avance.
On a vu la question prcdente que NH
et NH
ne donnaient que des ractions trs limites sur
leau. La RP trs avance ne peut donc tre quune complexation.
On a en prsence la particule NH
et un large excs de laccepteur Ag
.
La RP trs avance est donc probablement :
Ag
+ NH
[Ag(NH
)]
apport 0,40 1,0 10
0
bilan si totale 0,40 0 1,0 10
(concentrations en
)
Remarque : Avec le nombre de chiffres significatifs dont on dispose, cette RP na pas deffet sur la
concentration en Ag
qui reste quoi quil arrive 0,40
dans tout lexercice. Ce grand excs de
Ag
devant [Ag(NH
)]
entrane un pNH
trs lev lquilibre et donc on sattend ce que
[Ag(NH
soit ngligeable devant [Ag(NH
)]
. Pour sen convaincre, revoir les diagrammes de
prdominance et de rpartition des complexes argent-ammoniac vus dans le cours.
La solution est donc quivalente au mlange de :
Ag
: 0,40 molL
[Ag(NH
)]
: 1,0 10
molL
NH
: 1,0 10
molL
Y a-t-il entre ces espces de nouvelles ractions prpondrantes trs avances ?
La dissociation spontane du complexe et la raction de lammonium sur leau sont videmment peu
avances.
Reste la raction entre Ag
et NH
. NH
est un acide, donc un donneur de NH
. On peut alors crire :
quilibres en solution aqueuse Exercice 12 Page 2 sur 2
Ag
+NH
+H
O [Ag(NH
)]
+H
(*)
Cet quilibre est trs important parce quil est a priori plus avanc que la simple raction de NH
sur
leau. En effet, il est favoris par la formation du complexe stable qui pige les molcules dammoniac.
La question quil faut alors se poser est : le complexe est-il suffisamment stable pour dplacer
fortement cet quilibre (*) vers la droite ? Si oui, alors (*) est traiter comme une RP trs avance et
on remarque que NH
se comporterait comme un acide fort !
Or ici, NH
est un acide trs faible, donc aussi un mauvais donneur de NH
(p
= 9,2) et le complexe
na pas une grande constante de formation (
= 10
,
) : on peut donc sattendre ce que (*) soit trs
peu avance. Le calcul de sa constante dquilibre
= 10
,
1 le confirme a priori.
Par consquent, il ny a plus de RP trs avance et on peut passer la dernire tape : dterminer les
concentrations des espces minoritaires.
On va faire lhypothse usuelle que les concentrations des espces majoritaires ne sont pas modifies
par les quilibres peu avancs.
Ltat final contient donc selon cette hypothse :
[Ag
] = 0,40 molL
[Ag(NH
)]
= 1,0 10
molL
[NH
] = 1,0 10
molL
Les espces minoritaires dont on cherche dterminer les concentrations sont donc : NH
, H
,
[Ag(NH
et HO
.
On choisit alors les constantes dquilibre dont une seule concentration est inconnue.
Ainsi, la concentration en NH
doit vrifier :
=
[Ag(NH
)]
[Ag
] [NH
]
=
0,001
0,4 [NH
]
dont on tire :
[NH
] = 1,3 10
molL
[NH
] tant maintenant connue, on en dduit le pH par :
pH = 9,2 +log
1,3 10
1,0 10
= 6,3
H
= 5,0 10
molL
Do immdiatement :
[HO
] = 2,0 10
molL
On trouve enfin, en utilisant
:
[Ag(NH
= 1,0 10
molL
Les concentrations des espces minoritaires tant toutes compltement ngligeables devant celles des
espces majoritaires, aucun des quilibres qui les impliquent ne peuvent les modifier
significativement, ce qui valide lhypothse et permet de conclure :
[Ag
] = 0,40 molL
[Ag(NH
)]
= 1,0 10
molL
NH
= 1,0 10
molL
Conclusion : les ions Ag
introduits ont eu un effet inattendu : ils ont fait passer le pH de 9,2 (tampon
ammoniacal) 6,3. Ceci est d au fait quils ont consomm les molcules NH
et ont ainsi
compltement dsquilibr le tampon.
quilibres en solution aqueuse Exercice 13 Page 1 sur 6
pH
4,2 11,6
Corrig exercice 13
PROPRITS ACIDO-BASIQUES DE LA VITAMINE C
pHdunesolutionS
devitamineC
1) On apporte une quantit
AscH
dacide ascorbique dans un volume total
, donc :
AscH
= 0,0142
2) La mesure dun pH est une mesure de diffrence de potentiel entre deux lectrodes :
- llectrodedeverre reconnaissable au petit globe de verre son extrmit, qui est
llectrode active ;
- une lectrodederfrence.
La diffrence de potentiel qui stablit entre ces deux lectrodes varie de manire affine avec le pH
de la solution (proprit du potentiel de membrane de llectrode de verre) :
= + pH
et sont des constantes qui dpendent des caractristiques exactes de la membrane de verre, de
llectrode de rfrence et de la temprature.
Pour que lappareil affiche le pH partir de la mesure de la d.d.p. , il faut donc dterminer la valeur
des deux constantes et , do la ncessit dtalonner avec deux solutions tampon (une de pH =
7,0, puis une de pH proche de la zone o on souhaite mesurer le pH prcisment).
3) Diagramme de prdominance, daprs les p
fournis :
AscH
AscH
Asc
La vitamine C tant un acide faible, onpeuttrecertainqueS
auralquilibreunpHinfrieur
ougal7,0. On voit sur le diagramme quon est donc forcment trs loin du domaine de
prdominance de Asc
(au moins 4,6 units de pH) : cette espce ne peut donc tre que trs
minoritaire lquilibre.
4) Comme on vient de le dire, seule la premire acidit est prendre en compte, la raction
prpondrante est donc :
AscH
+ H
O AscH
+ H
= 10
,
apport
0 0
quilibre
(concentrations)
Cette raction tant a priori peu avance, on peut faire lhypothse quelle ne modifiera la
concentration dacide ascorbique que de manire ngligeable (hypothse classique des acides faibles),
soit :
[AscH
= 0,0142 molL
Do :
= 9,5 10
On a bien
: lhypothse est valide.
quilibres en solution aqueuse Exercice 13 Page 2 sur 6
On trouve :
pH = log = 3,0
Avec
, on trouve :
Asc
[AscH
]
H
= 2,5 10
molL
On a bien Asc
, ce qui confirme que la deuxime acidit ntait pas prendre en compte.
Lautoprotolyse est galement videmment ngligeable car [HO
] = 10
.
TitragedeS
5) La prcision dune mesure de pH est dun chiffre aprs la virgule soit, dans le meilleur de cas,
pH = 0,05.
Or pH = log[H
] =
[H
dpH =
d[H
]
[H
]
; on en dduit le lien approximatif entre la
prcision en concentration et la prcision en pH :
[H
]
[H
]
= 2,3 (0,05) = 12%
Ainsi, lorsquon dduit une concentration dune mesure de pH, la prcision nest que de 12% au mieux,
ce qui est tout fait insuffisant.
Un titrage a une prcision de lordre de 1%, cest donc la mthode utiliser pour dterminer une
concentration.
6) La seule espce apporte est lacide ascorbique, dont on dose dabord la premire acidit :
(RT1) AscH
+HO
AscH
+H
O
La constante dquilibre vaut :
=
1
= 10
,
1 : Cette raction est bien trs favorable et convient donc a priori pour le titrage.
7) La raction de titrage tant trs avance et la deuxime acidit tant telle que p
+4,
(RT1) se produit seule et il se produit unsautdepHtrsmarqulquivalence.
Exprimentalement, on entre les points (
, pH
) dans lordinateur, on trace la courbe pH = ()et on
demande lordinateur dafficher la courbedrive. Labscisse du maximum de la drive donne une
valeur approche prcise du volume quivalent
. dfaut de courbe drive, on peut ici utiliser la
mthodedestangentesparallles partir de la courbe fournie pour estimer :
14,1 mL
Par dfinition, lquivalence est telle que la quantit de soude apporte (
) est gale la quantit
dacide ascorbique apporte dans le prlvement (
) car la stchiomtrie de la raction de titrage
est de 1:1 :
On trouve donc :
= 0,0141
On retrouve bien la valeur attendue, mieux de 1% prs, ce qui correspond la prcision classique
lors de lexploitation dune courbe pH-mtrique.
8) Comme on la dit la question prcdente, on a apport en =
exactement autant de HO
que dacide ascorbique :
. Par bilan de matire de la raction de titrage considre comme
totale, on obtient donc unesolutionquivalenteunesolutionoonauraitapportunequantit
quilibres en solution aqueuse Exercice 13 Page 3 sur 6
dionsascorbateAscH
.
Le volume tant maintenant de
, la solution est quivalente une solution de AscH
de
concentration apporte
AscH
=
= 0,0124
.
AscH
est un ampholyte. On peut donc penser utiliser la formule des ampholytes :
pH =
1
2
(p
+p
) = 7,9
Il faut alors vrifierlesconditionsdevaliditdecetteformule.
Cette formule est tablie est considrant que la raction prpondrante peu avance est la raction
dautoprotolyse :
2AscH
AscH
+Asc
On suppose tout dabord cette raction trs peu avance, donc quon conserve lquilibre
[AscH
] = 0,0124
, et on dduit (en utilisant pH = 7,9 = p
+log
[B]
[A]
) :
[AscH
] = Asc
= 2,5 10
molL
On a bien 2,5 10
0,0124 : la raction dautoprotolyse de AscH
est bien trs peu avance.
Il faut alors vrifier que les ractions de AscH
sur leau sont ngligeables. La raction concurrente est
ventuellement celle librant HO
puisque le pH prvu est suprieur 7,0 :
AscH
+H
O AscH
+HO
pH = 7,9, [HO
] = 7,9 10
molL
ce qui nest pas vraiment ngligeable devant [AscH
] =
Asc
= 2,5 10
molL
que lon avait prvues avec la seule RP dautoprotolyse
Conclusion : on ne peut pas vraiment ngliger la basicit de AscH
devant son autoprotolyse, mais on
nen est pas loin. Le pH recherch sera donc trs proche de 7,9 un calcul avec deux RP permet de le
prciser, mais si on manque de temps, on est sr quen rpondant pH = 7,9, on est trs proche de la
ralit.
Calcul complet avec deux RP trs peu avances :
(1) 2AscH
AscH
+ Asc
()
=
= 10
,
apport 0,0124 0 0
quilibre 0,0124 + (concentrations en
)
(2) AscH
+ H
O AscH
+ HO
()
=
= 10
,
apport 0,0124 0 0
quilibre 0,0124 + (concentrations en
)
Systme rsoudre :
()
=
( +)
0,0124
()
=
( +)
0,0124
En divisant les deux quations :
()
()
=
(0,0124)
= 0,321
que lon injecte dans
()
pour trouver :
quilibres en solution aqueuse Exercice 13 Page 4 sur 6
= Asc
= 2,2 10
molL
= [HO
] = 6,9 10
molL
Ces deux concentrations sont bien ngligeables devant [AscH
] = 0,0124
: les RP sont bien
trs peu avances. La concentration de HO
permet de trouver le pH :
pH = 7,8
9) On fait le bilan de la raction de titrage la demi-quivalence en la considrant comme totale :
AscH
+ HO
AscH
+ H
O
apport
2
0
bilan
2
0
2
(quantits de matire)
Ceci montre qu la demi-quivalence, la solution est quivalente au mlange de AscH
et de AscH
la
concentration apporte commune :
=
2
= 0,0066 molL
Une telle solution est une solutiontampon.
On peut partir de l crire divers quilibres peu avancs : raction de AscH
sur leau, de AscH
sur
leau, autoprotolyse de AscH
ou de leau
Si on fait lhypothse que toutes ces ractions sont trs peu avances, alors les concentrations
lquilibre des espces du tampon restent inchanges :
[AscH
] = [AscH
] = = 0,0066 molL
.
Dans ce cas :
pH = p
= 4,2
Vrification :
H
= 10
,
= 6,3 10
molL
[HO
] =
[H
]
= 1,6 10
[Asc
] =
[AscH
]
[H
]
= 2,6 10
Toutes ces concentrations sont bien compltement ngligeables devant , les diffrentes ractions qui
crent ces espces ont donc bien un avancement ngligeable.
Remarque : la RP est la raction crant H
, qui est lespce la moins minoritaire, savoir la raction
AscH
+H
O AscH
+H
.
10) lquivalence de (RT1), la solution est quivalente une solution de AscH
. On continue alors
ajouter de la soude. Il se produit donc le dosage de la deuxime acidit :
(RT2) AscH
+HO
Asc
+H
O
La constante dquilibre vaut
= 10
,
Notons que cette constante dquilibre est trs diffrente de celle du premier dosage (qui valait
10
,
) : ce dosage est donc bien successif au premier.
Lquivalence de ce dosage est a priori situe 2
28,2 , puisquil y a la mme quantit de
AscH
doser quil y avait de AscH
pour le premier dosage. Or on nobserve aucun saut 28,2 . En
effet, cette raction de dosage na pas une constante assez leve (10
,
) pour tre rellement
quilibres en solution aqueuse Exercice 13 Page 5 sur 6
quantitative lquivalence. On ne passera donc pas brutalement dune zone o la soude est quasi
intgralement consomme une zone o elle saccumule.
On peut aussi dire, cela revient au mme, que Asc
est une base trop forte ; elle reste dissocie de
manire non ngligeable quand on est au voisinage de lquivalence.
ComprimdevitamineCtamponne
11) Lorsquon dissout lacide ascorbique et sa base conjugue ascorbate dans leau, on se trouve en
prsence dune solutiontampon, de pH voisin du p
du couple.
On se trouve dans une situation similaire celle de la question 9, cest--dire quon suppose que les
concentrations de AscH
et AscH
restent lquilibre telles quon les a apportes car toutes les
ractions sont ngligeables.
Do les concentrations lquilibre :
[AscH
] =
AscH
AscH
AscH
[AscH
] =
AscH
=
AscHNa
AscHNa
Or :
pH = p
+log
[AscH
]
[AscH
]
= 4,2 +log
AscHNa
AscH
AscHNa
AscH
= 4,4
On en tire :
AscHNa
AscH
AscHNa
AscH
10
,,
Par ailleurs, si la quantit de matire totale
AscH
+
AscHNa
tait convertie en AscH
(principe actif),
cela reprsenterait une masse de = 500 mg, ce qui sexprime par :
AscH
AscH
AscHNa
AscHNa
=
AscH
Des deux relations prcdentes, on tire :
AscH
(1 +10
,,
) =
Do :
AscH
= 193 mg
AscHNa
=
AscH
AscHNa
AscH
10
,,
AscHNa
= 345 mg
Vrification des hypothses :
Espces majoritaires :
[AscH
] =
AscH
AscH
AscH
= 0,0110
[AscH
] =
AscH
=
AscHNa
AscHNa
= 0,0174
Espces minoritaires :
H
= 10
,
= 4,0 10
molL
[HO
] =
[H
]
= 2,5 10
quilibres en solution aqueuse Exercice 13 Page 6 sur 6
[Asc
] =
[AscH
]
[H
]
= 1,1 10
Ces trois concentrations sont bien totalement ngligeables devant celles des espces majoritaires. On
avait bien raison de ngliger toutes les ractions mettant en jeu les espces du tampon.
quilibres en solution aqueuse Exercice 14 Page 1 sur 4
Corrig exercice 14
TITRAGE DACIDES FAIBLES PAR UNE BASE FAIBLE
1) Les sauts de pH sont peu nets, mais on a accs la courbe drive
dpH
d
. Les pics de la courbe
drive permettent de localiser deuxsautsdepH (ou plutt un saut et une vague ) correspondant
la fin de chacune des deux ractions de titrage RT1 et RT2. Lepremiersautestleplusmarqu, ce
qui permet bien de dceler le passage de RT1 RT2 :
Les dosages sont donc successifs.
Les maxima de la drive permettent de trouver les volumes quivalents :
Premier dosage :
= 1,0 mL
Deuxime dosage :
= 3,0 mL
Remarque : ceci est une tude thorique, avec un simulateur. Exprimentalement, le deuxime saut de pH
serait inexploitable (pic de la drive beaucoup trop large et soumis aux irrgularits exprimentales). De
plus, les volumes verss, de lordre du millilitre, sont beaucoup trop faibles : lincertitude relative de la
burette serait bien trop importante.
Comme on retrouve pH = p
la deuximedemi-quivalence ( =
= 2,0 mL), on en dduit
quon dose HClO lors de RT2, do les ractions de dosage :
RT1 : HCOOH +PhO
HCOO
+PhOH
RT2 : HClO +PhO
ClO
+PhOH
2) Par dfinition de lquivalence :
, do
= 0,010
= (
), do
= 0,020
Dtermination de p
:
Supposons que lon puisse lire pH = p
la premiredemi-quivalence. Lorsque = 0,5 mL, on lit
pH = p
= 3,8.
Mais attention, il faut vrifier la validit de ce rsultat : on sait en effet quon na pas toujours
pH = p
la demi-quivalence ! Ceci est valide uniquement si [HCOOH] = [HCOO
] lquilibre en
ce point.
Il faut donc dterminer ltat complet du systme en = 0,5 mL.
la premire demi-quivalence, on a introduit
moles de PhO
et le volume total est de
+ = 10,5 mL.
Onfaitlebilandematiredela(RT1)enlaconsidrantcommetotale. On montre ainsi que le
systme est quivalent au mlange schmatis sur le diagramme de prdominance suivant (
) :
quilibres en solution aqueuse Exercice 14 Page 2 sur 4
pH
3,8
7,5
?
)
= 4,8 10
)
= 4,8 10
HCOOH HCOO
HClO ClO
PhOH PhO
= 1,9 10
)
= 4,8 10
Il sagit bien dun tampon HCOOH/HCOO
et il ny a plus de domaines disjoints. Ce systme doit donc
tre proche de lquilibre. Toutes les ractions que lon peut maintenant crire doivent donc tre
ngligeables, ce quon vrifie en calculant les concentrations des espces minoritaires.
Si on conserve lquilibre les concentrations indiques prcdemment, alors :
pH = 3,8 H
= 10
,
= 1,6 10
molL
4,8 10
molL
: la raction
HCOOH +H
O HCOO
+H
est bien ngligeable
[ClO
] =
[ClOH]
[H
]
= 3,8 10
4,8 10
molL
: la raction HClO +HCOO
ClO
+HCOOH est galement ngligeable
PhO
, dont le domaine de prdominance est encore plus loign que celui de ClO
, est bien entendu
encore plus ngligeable, de mme que HO
, de lordre de 10
ce pH
Conclusion : on conserve bien lquilibre [HCOOH] = [HCOO
] = 4,8 10
mol L
, ce qui implique
bien :
pH = p
= 3,8
Dtermination de p :
Pour trouver p du couple phnol/phnolate, on lit le pH aprs
, par exemple = 4,0 mL. Cest en
effet aprs la deuxime quivalence que PhO
peut saccumuler et se trouver en concentration du
mme ordre de grandeur que PhOH cr par les ractions de titrage. On est dans la zonetamponde
PhOH/PhO
.
Par bilan de matire de RT1 et RT2 considres totales, on montre que le systme contient maintenant
PhO
et PhOH aux concentrations indiques ci-dessous en
:
(
+
= 7,1 10
pH = 9,5 = p +log
[PhO
]
[PhOH]
(
+
= 0,021
Do p = 10,0 ceci en faisant lhypothse quaprs avoir considr les deux ractions de titrage
comme totales, plus rien ne modifiait les concentrations de PhOH et PhO
.
Il faut donc vrifier :
- que la raction de PhO
sur leau ne modifie pas [PhOH] et [PhO
] :
[HO
] = 1,0 10
[PhO
] : cest valide ;
- que la raction de PhOH avec les bases faibles, notamment la plus forte ClO
, ne modifie pas
quilibres en solution aqueuse Exercice 14 Page 3 sur 4
pH
3,8
7,5
10,0
non plus [PhOH] et [PhO
] :
[ClO
] =
= 1,4 10
, do [HClO] = 1,4 10
[PhO
] : valide.
3) Initialement, on a un mlange de deux acides faibles. On peut supposer que seullacide
formiqueimposelepH, car son p
est nettement infrieur celui de lacide hypochloreux et
et
sont du mme ordre de grandeur.
La formule des acides faibles est en dfaut, car elle donnerait un pH de 2,9 qui nest pas infrieur 2,8.
De toutes faons, on demande un taux de dissociation au pourcent prs, donc la prcision usuelle de
10% ne serait pas suffisante. On doit donc rsoudre lquation du second degr issu du bilan de la
raction prpondrante :
HCOOH + H
O HCOO
+ H
apport 0,010 0 0
quilibre 0,010 (concentrations en
0,010
= 10
,
= 1,2 10
pH = 2,9
Taux de dissociation :
=
0,010
= 12%
On vrifie que HClO nintervient pas, car [ClO
] = 5,0 10
: lacide faible le plus fort
tait bien le seul prendre en compte.
4) Premire quivalence :
Par bilan de la premire raction de dosage considre totale lquivalence ( = 1,0 mL), le systme
est quivalent (
) :
)
= 9,1 10
HCOOH HCOO
HClO ClO
PhOH PhO
= 1,8 10
)
= 9,1 10
On a un mlange de la base faible HCOO
avec lacide faible HClO (on nglige leffet de PhOH, qui est un
acide beaucoup plus faible), qui ont des domaines de prdominance communs. La RP peu avance est a
priori :
HClO + HCOO
ClO
+ HCOOH = 10
,,
= 10
,
apport 0,018 0,0091 0 0
quilibre 0,018 0,0091 (concentrations en
)
On rsout en supposant la raction peu avance :
,,
= 10
,
= 1,8 10
0,0091
: cest valide.
pH = 3,8 +log
0,0091
= 5,5
quilibres en solution aqueuse Exercice 14 Page 4 sur 4
pH
3,8
7,5
10,0
On vrifie aussi que la raction de HClO sur leau ne modifie pas [ClO
] :
H
= 3,2 10
molL
: cest valide.
Comme le milieu est acide, HO
est encore plus ngligeable que H
: la raction de HCOO
sur leau
est donc aussi ngligeable.
Et on calcule aussi [PhO
] = 2,9 10
: lacide PhOH ne jouait aucun rle
Deuxime quivalence :
= 3,0 mL, on a nouveau un mlange acide faible - base faible, dont le bilan est (
) :
)
= 7,7 10
HCOOH HCOO
HClO ClO
PhOH PhO
)
= 2,3 10
= 1,5 10
La RP se trouve entre lacide faible PhOH et la base faible la plus forte ClO
:
PhOH + ClO
PhO
+ HClO = 10
,
= 10
,
apport 0,023 0,015 0 0
quilibre 0,023 0,015 (concentrations en
)
On rsout en supposant la raction peu avance :
,,
= 10
,
= 1,0 10
0,015
: cest valide, mais = [HClO]
reprsente tout de mme 7% de [ClO
] : laractiondedosagenestpasvraiment
quantitative,dolesautdepHtrsattnu.
pH = 7,5 +log
0,015
= 8,7
Les ractions sur leau sont bien entendu ngligeables car :
[HO
] = 5 10
et [H
] est encore plus ngligeable car on est en milieu basique.
En enfin : [HCOOH] 1 10
: confirme que HCOO
ne jouait aucun rle.
quilibres en solution aqueuse Exercice 15 Page 1 sur 3
Corrig exercice 15
TITRAGE PAR COMPLEXATION
1) On part dune solution dions Cu
en absence de ligand. La courbe d, qui vaut 100%
initialement, est donc le pourcentage de Cu
. Puis on forme les complexes [Cu(NH
)]
(courbe e) et
[Cu(NH
(courbe f) qui est lespce qui atteint environ 100% en excs dammoniac.
La courbe c, qui prsente un saut initial venant de + (absence dammoniac), puis un autre saut vers
3,3 mL, est la courbe pNH
= ().
2) Dtermination de
et
=
[Cu(NH
)]
[Cu
][NH
]
: lorsque les courbes d et e se coupent ( = 1,0 mL), on a [Cu
] =
[Cu(NH
)]
et donc log
= pNH
. On lit log
= 5,8 (attention bien reporter la lecture
sur la courbe c). Donc :
= 6,3 10
De mme,
=
[Cu(NH
[Cu(NH
)]
[NH
]
: lorsque les courbes e et f se coupent ( = 2,3 mL), on a
[Cu(NH
)]
= [Cu(NH
et donc log
= pNH
. On lit log
= 5,0, soit :
= 1,0 10
3) Calcul de pNH
en deux points particuliers
Diagramme de prdominance :
5,0 5,8 pNH
[Cu(NH
[Cu(NH
)]
Cu
Analyse du dosage :
Les ractions de titrage quasi-totales sont :
RD1 : Cu
+NH
[Cu(NH
)]
RD2 : [Cu(NH
)]
+NH
[Cu(NH
tant donne la proximit des
, on sattend des dosages simultans, ce quon vrifie en observant
les courbes de rpartition : le complexe [Cu(NH
commence se former pratiquement ds le
dbut du dosage, le complexe [Cu(NH
)]
ne monte pas 100% avant de redescendre
Lunique quivalence dcelable se produit donc lorsque les deux ractions de dosage sont acheves, il
a donc fallu apporter deux quivalents dammoniac :
= 2
=
2
= 3,3 mL
La courbe de [Cu(NH
atteint bien 100% en ce point et on a un saut de pNH
.
Onpeutgalementdfinir
= 1,7 mLet
= 3,3 mL,lesdeuxquivalencesdechaquetitrage.
Mais
nestpasaccessibleexprimentalementcarlesdeuxdosagessontsimultans.
Calcul de pNH
en = 1,5 mL <
:
La RD1 est raction prpondrante trs avance. On en fait le bilan de matire :
quilibres en solution aqueuse Exercice 15 Page 2 sur 3
Cu
+ NH
[Cu(NH
)]
apport
+
= 0,0435
+
= 0,0391
0
considre totale 0,0044 0 0,0391
(concentrations en
)
La solution est donc quivalente une solution o on aurait apport :
Cu
= 0,0044
[Cu(NH
)]
= 0,0391
Selon le diagramme de prdominance, ce systme est stable (correspond un tampon de
complexation). Cependant, le domaine de prdominance du complexe intermdiaire est trs troit ; on
peut donc penser que sa raction sur lui-mme (dismutation) est assez avance.
Ceci est confirm car on voit sur la courbe de rpartition quil se cre beaucoup de [Cu(NH
(environ 20%), on peut donc faire lhypothse que la RP peu avance, mais non ngligeable, est :
2[Cu(NH
)]
Cu
+ [Cu(NH
apport 0,0391 0,0044 0
considre totale 0,0391 2 0,0044 +
(concentrations en
)
On en dduit en rsolvant
(0,0044 +)
(0,0391 2)
= 10
,
= 0,0076
On a alors :
[Cu
] = 0,0120
(28%)
[Cu(NH
)]
= 0,0239
(55%)
[Cu(NH
= 0,0076
(17%)
[NH
] =
[Cu(NH
)]
[Cu
= 3 10
pNH
= 5,5
Calcul de pNH
en = 3,0 mL <
:
La RD1 est la premire RP trs avance. Puis il reste de lammoniac et la RD2 est la deuxime RP trs
avance. On les considre toutes deux successivement comme totales :
Cu
+ NH
[Cu(NH
)]
apport
+
= 0,0385
+
= 0,0692
0
considre totale 0 0,307 0,0385
(concentrations en
)
Puis :
[Cu(NH
)]
+ NH
[Cu(NH
apport 0,0385 0,0307 0
considre totale 0,0078 0 0,0307
(concentrations en
)
La solution est donc quivalente une solution o on aurait apport :
[Cu(NH
)]
= 0,0078
[Cu(NH
]
= 0,0307
quilibres en solution aqueuse Exercice 15 Page 3 sur 3
Ce systme est stable, cest un tampon de complexation.
Les ractions peu avances que lon peut crire sont alors les dissociations spontanes des complexes,
librant de lammoniac, et la dismutation de [Cu(NH
)]
donnant Cu
et [Cu(NH
.
On va vrifier que ces quilibres sont tous ngligeables et ne modifient pas les concentrations des deux
complexes, espces majoritaires.
Tout dabord, on calcule [NH
] =
[Cu(NH
[Cu(NH
)]
= 4 10
(pNH
= 4,4), qui est bien
ngligeable devant les concentrations des complexes.
Puis on dduit [Cu
] =
[Cu(NH
)]
[NH
= 3 10
. Cette concentration est ngligeable devant celle
de [Cu(NH
)]
; il faut toutefois dire que la concentration de [Cu(NH
)]
est plutt de lordre de
0,0072 que de 0,0078
mais cela ne change rien au pNH
.
Par consquent, si le but de lexercice est essentiellement de dterminer pNH
et les pourcentages
approximatifs (20% de [Cu(NH
)]
et 80% de [Cu(NH
), on peut sarrter l.
Sionsouhaiteparcontrecalculerlestroispourcentagesavecprcision,ilfautavoiraumoinsdeux
chiffressignificatifsfiablessurlesconcentrationsdescomplexes.Onrsoutdonc(laRPestladismutation
ducomplexe):
(0,0307 +)
(0,078 2)
= 10
,
quilibres en solution aqueuse Exercice 16 Page 1 sur 2
Corrig exercice 16
COMPTITION ENTRE PRCIPITS
1) Les ions iodure I
peuvent prcipiter avec les ions Pb
pour donner PbI
, jaune, et avec Hg
par donner HgI
, rouge-orang.
On dfinit donc les deux couples donneur/accepteur de la particulechangeI
: PbI
/Pb
et
HgI
/Hg
.
Lorsquon introduit des ions mercuriques dans une solution en prsence de prcipit diodure de
plomb, la coloration rouge-orange, caractristique de HgI
, apparat. Il se produit donc la raction
suivante :
PbI
+Hg
Pb
+HgI
(1)
Cette raction (1) tant trs favorable dans le sens direct ( 1), on en dduit que Hg
estun
meilleuraccepteurdeI
quePb
.
Sur un diagramme de stabilit, cela se traduit par des domainesdisjointspourPbI
etHg
:
PbI
2 Pb
2+
HgI
2 Hg
2+
pI
On peut galement dire que HgI
est moinssolubledansleau que PbI
. Son domaine dexistence est
plus tendu.
2) Labscisse du diagramme est pI car I
est la particule change, comme on la vu dans le
diagramme prcdent.
a) Initialement, la solution ne contient pas de I
(pI +) et les ions Pb
et Hg
sont tous deux
la concentration
= 0,100
. En pourcentage, 100%descationssontensolution, la
solution est limpide.
Puis on ajoute des ions I
: en venant de +, rien ne se passe jusquau point B (pI
= 13,6). droite
deB,lescourbes1et2sontconfondueslavaleur100%. La solution est limpide, il ny a pas
assez dions I
pour saturer la solution, ni en PbI
, ni en HgI
.
Le point B est un pointanguleux. Cela traduit une rupturedquilibre, en loccurrence lapparition
dun prcipit. Daprs la question prcdente, on sait que Hg
est un meilleur accepteur de I
que
Pb
, cest donc le prcipit HgI
qui apparat en B. Cest la premire frontire dexistence que lon
rencontre en venant des pI levs sur le diagramme trac la question 1).
Si on continue dajouter I
, cela entrane la prcipitation de HgI
, donc la diminution de la
concentration de Hg
:
La courbe d reprsente donc la concentration de Hg
, exprime en pourcentage de
.
Lorsque Hg
a quasiment disparu, le pI peut nouveau baisser au fur et mesure quon apporte I
.
La courbe c reste 100% jusquen A, o un nouveau point anguleux survient, (pI
= 3,6), ce qui
traduit cette fois le dbut de prcipitation de PbI
. On observe alors la chute de la concentration de
Pb
de la mme faon que prcdemment :
La courbe c reprsente donc la concentration de Pb
, exprime en pourcentage de
.
b) Les points anguleux traduisent des rupturesdquilibre, ici lapparitiondesprcipits:
HgI
en B et PbI
en A, comme expliqu prcdemment.
Pour trouver le produit de solubilit de HgI
, on utilise les coordonnes du point B : en effet, en B le
devientapplicable et la concentration de Hg
est encore 100%, donc vaut
= 0,100
,
do :
(HgI
) =
[I
= 0,1 (10
,
)
6 10
quilibres en solution aqueuse Exercice 16 Page 2 sur 2
De mme en A pour PbI
(PbI
) =
[I
= 0,1 (10
,
)
6 10
Remarques :
- il est inutile de donner plus de chiffres significatifs, tant donne limprcision de la lecture de labscisse
des points A et B.
- le
est applicable sur les courbes c et d gauche des points anguleux, mais il est plus judicieux de
se placer exactement aux points anguleux pour la dtermination des
car la concentration des cations
est directement la concentration apporte
(vite davoir lire et calculer un pourcentage de
).
c) Il sagit de la raction (1) que lon a crite la question 1).
Lapplication de la loi de lquilibre chimique (applicablelorsquelesdeuxprcipitssont
prsents!) donne :
=
Pb
Hg
=
Pb
Hg
[I
[I
(PbI
HgI
= 10
est bien trs suprieure 1 comme prvu.
quilibres en solution aqueuse Exercice 17 Page 1 sur 10
Corrig exercice 17
SOLUBILITS
Lorsquon calcule la solubilit dun solide ionique, il faut crire tout dabord la ou les quation(s)
chimique(s) de la ou des raction(s)dedissolutionde ce sel. On la (les) notera RD dans ce
corrig.
Sil y en a plusieurs, il faut trouver la raction prpondrante
On notera la solubilit en
.
Afin de ne pas alourdir les expressions en introduisant la concentration unitaire
, on admettra que,
dans les expressions de la loi de lquilibre chimique, les concentrations sont des nombres purs
(valeur numrique de la concentration lorsque celle-ci est exprime en
).
1) Dissolutiondunselionsindiffrentsdansleaupure
Cest le cas le plus classique et le plus facile !
RD : AgCl Ag
+ Cl
quilibre excs (concentrations)
Donc
= [Ag
][Cl
] =
, do :
=
= 1,3 10
RD : PbCl
Pb
+ 2Cl
quilibre excs 2 (concentrations)
Donc
= [Pb
][Cl
= (2)
= 4
, do :
=
= 0,014
2) Dissolutiondunseldansunesolutioncontenantdjlundesions
On tient compte de la concentration de lion apport dans le bilan de matire puis on pose la loi de
lquilibre chimique avec
comme prcdemment.
RD : AgCl Ag
+ Cl
quilibre excs 0,010 + (concentrations en
)
RD : PbCl
Pb
+ 2Cl
quilibre excs 0,010 +2 (concentrations en
)
Deux situations extrmes peuvent se rencontrer ici, ce qui peut simplifier le calcul.
Dans le cas dun sel trs peu soluble et dune concentration apporte suffisamment leve,
on peut fairelhypothsequelasolubilitestngligeabledevantlaconcentration
apporte.
quilibres en solution aqueuse Exercice 17 Page 2 sur 10
4,8
pH
Dans le cas de AgCl, cette hypothse est valide. En effet, si on pose qu lquilibre
[Cl
] = 0,010 mol
, alors on trouve [Ag
] =
[Cl
]
= 1,8 10
mol
, qui est bien
ngligeable devant 0,010. Do la solubilit de AgCl : = [Ag
] = 1,8 10
mol
Pour PbCl
, on espre trouver de mme : 2 0,010
Dans le cadre de cette hypothse, on trouve
= [Pb
][Cl
= [Pb
] (0,010)
, do
[Pb
] =
= 0,12
= ; on voit donc que lhypothse nest pas vrifie ! 2
nest pas ngligeable devant 0,010, ce nest donc pas la solution du problme.
Dans le cas o la concentration apporte est assez faible, elle est peut-tre ngligeable
devant la solubilit. Ici : 0,010 2 ?
Dans le cadre de cette hypothse, on trouve
= [Pb
][Cl
= 4
, do =
=
0,014
(cf. solubilit dans leau pure) ; cette hypothse nest pas non plus vrifie,
on na pas 0,010 2 !
Lorsquaucune des deux hypothses classiques nest vrifie (on aurait pu sen douter ici car la
concentration apporte en Cl
est du mme ordre de grandeur que la solubilit de PbCl
dans leau
pure quon avait calcule dans la question 1), il faut poser le calcul :
= [Pb
][Cl
= (0,010 +2)
= 4
+0,04
+0,0001
On rsout alors lquation du troisime degr :
4
+0,04
+0,0001 1,2 10
= 0
Une rsolution numrique donne :
= 0,011 molL
En comparant la solubilit dans leau pure, on voit que lapport de lion Cl
abaisse la solubilit du
sel, car cela provoque le dplacement de lquilibre de dissolution vers la gauche. On parle dun effet
dion commun .
3) Dissolutiondunselpeubasique
La dissolution de lactate dargent conduit la libration de lion actate CH
COO
, qui est une base
faible dans leau. Lion actate peut donc, une fois libr, ragir sur leau pour donner CH
COOH+HO
de manire quilibre.
Le diagramme de prdominance de ce couple est :
CH
COOH CH
COO
Par consquent,onpeutcriredeuxractionsdedissolution :
RD1 : CH
COOAg CH
COO
+Ag
RD2 : CH
COOAg +H
O CH
COOH+HO
+Ag
Bien comprendre que RD2 est la somme de RD1 et de la raction CH
COO
+H
O CH
COOH+HO
.
La RD2 montre que la solution aqueuse doit ncessairement devenir basique, puisquil y a libration
dions HO
. On est donc certain davoir pH > 7,0 lquilibre.
Or le diagramme de prdominance montre qu pH > 7,0, lespce largement prdominante est
CH
COO
!
Ceci permet de penser que laRD1estbeaucoupplusavancequelaRD2: RD1estlaraction
prpondrantededissolution.
On fait donc lhypothse que la RD1 est la seule raction significative pour le calcul de la solubilit.
quilibres en solution aqueuse Exercice 17 Page 3 sur 10
pH
10,3
RD : CH
COOAg Ag
+ CH
COO
quilibre excs (concentrations)
Donc
= 10
,
= [Ag
][CH
COO
] =
, do :
=
= 0,045 molL
On a tabli :
[Ag
] = [CH
COO
] = = 0,045 molL
Il faut alors calculer les concentrations des espces minoritaires, pour vrifier quelles sont bien
ngligeables.
Selon le bilan de matire de la RD2, on est sr que [CH
COOH] = [HO
] (not ).
On peut donc crire :
=
[H
][CH
COO
]
[CH
COOH]
=
On en tire :
= 5,3 10
molL
On a bien [CH
COOH] = [HO
] = 5,3 10
molL
ngligeable devant = 0,045 molL
.
La RD2 a donc bien un avancement ngligeable devant la RD1, le rsultat est valide.
La solution lquilibre a un pH de 14 +log = 8,7, ce qui confirme que le milieu est basique et quon
est largement dans le domaine de prdominance de CH
COO
.
4) Dissolutiondunseltrsbasique
Comme prcdemment, la dissolution du carbonate de plomb conduit la libration dune base faible,
lion carbonate CO
. Lion carbonate peut donc, une fois libr, ragir sur leau pour donner
HCO
+HO
de manire quilibre.
Le diagramme de prdominance de ce couple est :
HCO
CO
Par consquent, on peut crire deux ractions de dissolution :
RD1 : PbCO
Pb
+CO
RD2 : PbCO
+H
O Pb
+HCO
+HO
On sait que la solution sera basique lquilibre mais doit-on sattendre ce que lespce majoritaire
soit CO
(auquel cas la raction de dissolution prpondrante serait RD1) ou bien HCO
(et la
raction prpondrante serait RD2) ?
Si on suppose que CO
est majoritaire sur HCO
(RD1 beaucoup plus avance que RD2), il faut quau
minimum le pH soit de 11, daprs le diagramme de prdominance. Il faut donc que [HO
] vaille au
moins 10
Or HO
est libr par la raction RD2. Il parat contradictoire de supposer que
RD2 libre autant de HO
et quelle soit en mme temps ngligeable devant RD1 !
Dautant plus que le carbonate de plomb est un sel trs peu soluble (
= 1,5 10
1). Il parat
plus raisonnable de penser que le pH lquilibre ne sera pas donc trs suprieur celui de leau pure.
On peut donc penser quon sera plutt dans le domaine de prdominance de HCO
Supposons donc que RD2 soit la seule raction de dissolution significative :
quilibres en solution aqueuse Exercice 17 Page 4 sur 10
RD : PbCO
+ H
O Pb
+ HCO
+ HO
quilibre excs (concentrations)
On calcule tout dabord la constante dquilibre de cette raction :
= Pb
[HCO
][HO
] = Pb
[HCO
][HO
]
CO
CO
Puis on applique la loi de lquilibre chimique :
=
Finalement :
=
= 3,1 10
molL
On trouve donc lquilibre les espces majoritaires :
Pb
= [HCO
] = [HO
] = 3,1 10
molL
Pour vrifier que RD1 ntait pas prendre en compte, on calcule :
[CO
] =
[Pb
]
= 4,8 10
Cette concentration est bien compltement ngligeable devant : lavancement de RD1 tait bien
ngligeable devant celui de RD2.
Le pH lquilibre vaut pH = 14 +log[HO
] = 8,5.
5) Deuxractionsdedissolutionsimultanes
Cette question semble similaire aux prcdentes. Cest pourtant un cas complexe, car aucune des
approximations classiques nest valide et car on doit rsoudre finalement une quation du quatrime
degr !
Ce cas conduit comme prcdemment envisager deux ractions de dissolution :
RD1 : CaCO
Ca
+CO
RD2 : CaCO
+H
O Ca
+HCO
+HO
On peut faire lhypothse que RD1 est seule raction de dissolution significative. Ceci donne (voir
question 3) : = [CO
] =
= 7,1 10
molL
et donc = 1,2 10
non
ngligeable ! Cette hypothse est fausse
Si on suppose maintenant que cest RD2 la seule raction de dissolution prendre en compte, on
trouve (voir question 4) : =
= 1,0 10
molL
. Mais alors [CO
] = 5,0 10
ce
nest pas ngligeable !
Les deux ractions de dissolution ont donc un avancement du mme ordre de grandeur. Il faut donc
crire deux bilans simultans :
RD1 : CaCO
Ca
+ CO
quilibre excs + (concentrations)
quilibres en solution aqueuse Exercice 17 Page 5 sur 10
RD2 : CaCO
+ H
O Ca
+ HCO
+ HO
quilibre excs + (concentrations)
Attention bien crire [Ca
] = + : cet ion est cr par les deux ractions de dissolution.
Lgalit = [Ca
] = [CO
] +[HCO
] traduit la rpartition de lanion en ses deux formes acido-
basiques lors de la dissolution du sel.
On met le systme en quations :
= ( +)
= ( +)
On trouve (quotient des deux quations) :
= 5,0 10
= 5,0 10
Donc :
= (5000
+) 5000
(quation du quatrime degr)
ce qui donne, par rsolution numrique :
= 8,9 10
molL
= 4,0 10
Finalement :
= Ca
= + = 1,3 10
molL
Le pH de cette solution sature est de : pH = 10,3 +log
= 10,0.
6) Dissolutiondunselbasiquedansunesolutiondacidefort
Les espces apportes sont cette fois lactate dargent CH
COOAg et un acide fort : H
= 0,100
.
On peut crire les mmes ractions de dissolution qu la question 3, mais la dissolution de lactate
dargent librant lion basique CH
COO
, celui-ci ne peut coexister avec lion H
. Il doit
ncessairement se protonner, do une nouvelle quation de dissolution prendre en compte :
CH
COOAg +H
CH
COOH+Ag
+H
O
On calcule la constante dquilibre de cette raction :
=
[CH
COOH][Ag
]
[H
]
=
[CH
COOH][Ag
]
[H
]
[CH
COO
]
[CH
COO
]
=
= 126
On constate que lon a > 1, la raction de dissolution est favorable ! Ceci ntait pas vident a priori,
et est d au fait que
>
(le sel est suffisamment soluble et la base quil libre suffisamment forte).
On peut donc sattendre une raction prpondrante trsavance, donc la disparition quasi-totale
de lacide fort.
On utilise alors la mthode usuelle, onconsidrelaractioncommetotalepourobtenirun
systmequivalentplusprochedeltatdquilibre :
RD : CH
COOAg + H
CH
COOH + Ag
+ H
O
apport excs 0,100 0 0
bilan
totalit
prsent 0 0,100 0,100
(concentrations en
)
quilibres en solution aqueuse Exercice 17 Page 6 sur 10
Le problme pos est donc quivalent une dissolution dactate dargent dans une solution dions
Ag
et dacide actique, chacun la concentration apporte 0,10
.
Toutes les ractions que lon peut alors crire sont peu avances ; on peut supposer que le systme
voluera trs peu, que les espcesmajoritaires lquilibre garderont donc pour concentrations :
[CH
COOH] = [Ag
] = 0,100
Les espcesminoritaires devraient tre lion actate et les ions H
et HO
.
Si on suppose quelles sont ngligeables, on trouve :
[CH
COO
] =
[Ag
]
=
0,100
= 0,020
pH = 4,8 +log
0,020
0,10
= 4,1 [H
] = 7,9 10
On voit que lhypothse [H
] ngligeable (et a fortiori [HO
])ne pose aucun problme.
En revanche, CH
COO
nest pas vraiment en concentration ngligeable devant Ag
(20%...).
Lhypothse nest pas valide, il existe une raction de dissolution, qui nest pas ngligeable. Il sagit
ncessairement de laractionquilibrelionactatesanslibrerdionH
niHO
, cest donc la
raction de dissolution simple :
RP : CH
COOAg Ag
+ CH
COO
quilibre excs 0,100 + (concentrations en
)
Finalement :
(0,100 +) =
= 0,017
En conclusion, la solution lquilibre contient :
Ag
= 0,117 molL
[CH
COO
] = 0,017 molL
[CH
COOH] = 0,100 molL
[NO
] = 0,100 molL
(ion indiffrent apport par HNO
)
pH = 4,8 +log
0,017
0,100
= 4,0
H
= 1,0 10
molL
[HO
] = 1,0 10
molL
et [HO
] sont bien en concentration ngligeable devant les autres espces : le rsultat est
valide.
La solubilit est la quantit totale dactate dargent qui sest dissoute par litre de solution, ce qui
correspond :
= Ag
= [CH
COOH] +[CH
COO
] = 0,117 molL
7) Dissolutiondunsellibrantunedibasedansunesolutionacide
Les espces apportes sont maintenant le sulfure de manganse MnS et un acide fort : H
= 0,200
(pH
voisin de 0,7).
Cette question ressemble la prcdente. Lorsque le prcipit MnS se dissout, il libre une dibase S
qui ne peut coexister avec lacide fort et va donc se protonner.
Mais la RP de dissolution est-elle plutt celle qui conduit H
S ou bien HS
?
quilibres en solution aqueuse Exercice 17 Page 7 sur 10
pH
7,0 12,9
On peut tracer le diagramme de prdominance des couples acido-basiques :
H
S HS
On voit que tant quil reste des ions H
, le pH reste voisin de 1, donc largement dans le domaine de
prdominance de H
S. Par consquent, lorsque le prcipit commence se dissoudre, les ions S
sont
intgralement convertis en H
S.
Ce nest que si les ions H
sont intgralement puiss quon envisagera ensuite de former HS
.
On va donc considrer comme premire RP :
RP : MnS + 2H
S + Mn
+ 2H
O
apport excs 0,200 0 0
bilan RP
totale
prsent 0 0,100 0,100
(concentrations en
)
Au vu de la constante dquilibre =
= 10
,
1, on pense quen considrant cette RP
comme totale, on obtiendra un systme quivalent beaucoup plus proche de ltat dquilibre
recherch.
LesystmeestdoncquivalentladissolutiondeMnSdansunesolutioncontenantH
SetMn
tousdeuxlaconcentrationapporte, mol
.
Les ractions que lon peut crire ce stade sont :
- La raction de lacide faible H
S sur leau, de constante
, donc a priori peuavance.
- Lautoprotolyse de leau, de constante
, donc a priori peuavance.
- La dissolution simple de MnS, de constante
, donc a priori peuavance.
- La dissolution de MnS, qui en prsence de H
S donnera HS
. En effet, S
et H
S sont dans
des domaines de prdominance disjoints, ils doivent donc ragir entre eux pour donner
lampholyte. On pense donc que la RP pourrait tre :
MnS +H
S 2HS
+Mn
, de constante =
= 10
,
Comme on trouve
1, on en dduit que cetteractiondoittrepeuavance. (Si on avait trouv
1, on aurait considr la raction comme totale !)
Par consquent, on ne trouve plus aucune raction trs avance. On peut donc faire lhypothse que
rien ne modifiera notablement les concentrations des espces majoritaires, et quon conservera
lquilibre [H
S] = 0,100 mol
et [Mn
] = 0,100 mol
.
De
, on dduit S
Mn
= 2,5 10
mol L
De
, on dduit [HS
] =
[H
S]
Mn
= 0,014 mol L
On trouve pH = 7,0 +log
,
,
= 6,1(46) ou pH = 12,9 +log
,
,
= 6,1(52) soit
pratiquement le mme rsultat : pH 6,1(5), donc H
7 10
mol L
et
[HO
] 1,4 10
mol
.
Conclusion : lespce HS
pose problme Sa concentration nest pas ngligeable devant
0,100
sauf si on se contente dune approximation 14% prs
Si on ne sen contente pas, alors on pose le bilan de matire sur la raction prpondrante (celle qui
cre HS
sans crer dautre espce minoritaire) :
quilibres en solution aqueuse Exercice 17 Page 8 sur 10
RP : MnS + H
S 2HS
+ Mn
= 10
,
apport excs 0,100 0 0,100
bilan RP
totale
prsent 0,100 2 0,100 + (concentrations en
)
et on rsout :
= 4
0,1 +
0,1
qui donne = 6,6 10
.
Do ltat final :
[H
S] = 0,093 mol L
Mn
= = , mol L
[HS
] = 2 = 0,013 mol L
Mn
= 2,3 10
mol L
pH = 7,0 +log
0,013
0,093
= 6,1
8) Dissolutiondunselbasiquedansunesolutionricheenunligandlui-mmebasique!
Solubilitdansleaupure
Si on nglige lautoprotolyse de leau, la raction prpondrante de dissolution de lhydroxyde de
cadmium est tout simplement :
RD : Cd(OH)
Cd
+ 2HO
quilibre excs 2 (concentrations)
On rsout donc :
(2)
= 1,4 10
molL
La concentration en HO
est donc = 2 = 2,7 10
, le pH vaut 14 +log = 9,4.
On vrifie que lautoprotolyse de leau ntait pas prendre en compte car
[H
] = 3,7 10
, qui est bien ngligeable devant [HO
].
Solubilitdansunesolutiondammoniacmolaire
Espces apportes : excs de Cd(OH)
, NH
NH
= 1
et de leau.
Espces pouvant apparatre : Cd
, [Cd(NH
, NH
, HO
, H
.
Onrecherchelaractionprpondrante.
Les ractions possibles mettant en jeu les espces apportes sont :
(1) la dissolution simple de Cd(OH)
, comme la question prcdente ;
(2) la dissolution de Cd(OH)
avec complexation de lion cadmium :
quilibres en solution aqueuse Exercice 17 Page 9 sur 10
Cd(OH)
+4NH
[Cd(NH
+2HO
= 10
)
(3) la raction de lammoniac sur leau :
NH
+H
O NH
+HO
= 10
,
)
(4) lautoprotolyse de leau.
On remarque tout dabord que les quatre ractions envisageables ont des constantes dquilibre trs
faibles. Lesystmevoluedoncpeu et on peut supposer que lammoniac reste lquilibre lespce
ultra majoritaire :
[NH
] 1
Pour trouver les espces les moins minoritaires, il faut trouver la ou les ractions prpondrantes.
Tout dabord, on peut prvoir qu cause de (2) et (3) la solution sera basique (libration de HO
) ;
H
devrait donc tre infime et comme seule lautoprotolyse les cre, cest que lautoprotolyse ne
peut pas tre RP.
Secundo, comme on sait que lon est en fort excs dammoniac et que = 10
1, on peut tre
certain que lon aura [Cd
] [Cd(NH
(le complexe prdomine largement sur Cd
lorsque
pNH
= 0), ce qui veut dire que la raction (2) est ncessairement prpondrante sur la raction (1).
IlyadoncdeuxractionscandidatestreRP:(2)et(3)
Hypothse:(3)estRP
La comparaison des constantes dquilibre pourrait laisser penser que (3) est RP, mais les expressions
des constantes sont trs diffrentes, donc on ne peut pas sy fier.
Si, nanmoins, on poursuit dans cette hypothse, guid par lintuition que lammoniac et les amines
sont des bases relativement bonnes, on trouve directement le pH par la formule des bases faibles (ou
on la retrouve aisment en supposant que [NH
] [NH
]) :
pH = 7 +
9,2 +
log 1 = 11,6 (> p
+1 : valide)
Donc : [HO
] = 4,0 10
On calcule alors le complexe trs simplement :
=
[Cd(NH
(4,0 10
[Cd(NH
= 6,3 10
molL
Cette concentration nest pas ngligeable devant [HO
] !
Conclusion:(3)nestpasprpondrantesur(2).
Il semble daprs la tentative prcdente que (2) et (3) ont des avancements du mme ordre de
grandeur, il sera donc probablement infructueux de supposer que (2) est RP.
(2)et(3)sontRPsimultanment
On crit donc les bilans de matire :
(2) Cd(OH)
+ 4NH
[Cd(NH
+ 2HO
= 10
quilibre excs 1 2 + (concentrations en
)
(3) NH
+ H
O NH
+ HO
= 10
,
quilibre 1 2 + (concentrations en
)
et on met le systme en quations :
quilibres en solution aqueuse Exercice 17 Page 10 sur 10
=
(2 +)
=
(2 +)
1
Ceci donne :
= 398
= (796
+)
= NH
= 2,35 10
molL
= [Cd(NH
= 2,20 10
molL
[HO
] = 2 + = 6,75 10
molL
pH = 14 +log[HO
] = 11,8
On vrifie bien :
- dune part que et 1
;
- dautre part que [Cd
] =
[HO
= 2,2 10
et [H
] = 1,6 10
sont
bien ngligeables devant et , ce qui valide le fait que (2) et (3) taient RP par rapport (1)
et (4).
Conclusion:lasolubilitdemandeestlaquantittotaledhydroxydedecadmiumdissous,
cest--direquasimentlaconcentrationducomplexe[Cd(NH
:
= 2,2 10
molL
On constate que la complexation avec lammoniac a trs fortement augment la solubilit de
lhydroxyde de cadmium (200 fois environ).
quilibres en solution aqueuse Exercice 18 Page 1 sur 3
Corrig exercice 18
LE ZINC (II) EN SOLUTION AQUEUSE
1) La solubilit est ici la concentration totale en zinc (II) dissous. Celui-ci existe sous forme dion
libre Zn
ou bien de complexe zincate [Zn(OH)
. Donc :
= [Zn
] +[Zn(OH)
Attention, rappel ! Ne pas confondre les complexes, que lon note en gnral entre crochets, qui sont
souvent chargs mais pas toujours, et dont lactivit est gale la concentration (en solution assez
dilue), avec les prcipits, qui sont toujours neutres, que lon ne note jamais entre crochets, qui ne
sont prsents quen solution sature, et dont lactivit, dans ce cas, est gale 1.
On peut commencer par tracer le diagramme de prdominance du couple de complexation
[Zn(OH)
/Zn
.
=
[Zn(OH)
Zn
[HO
, donc la frontire de prdominance, [Zn(OH)
= Zn
=
[HO
=
H
:
pH
= 14
1
4
log = 10,15
Notons que le complexe prdomine pour pH > pH
(fortes concentrations de HO
) et quen prenant
[Zn(OH)
= 10 [Zn
], on trouve =
[HO
= 10
[H
, soit pH = pH
log 10 = pH
+
0,25 = 10,4.
De mme, on trouve pour [Zn
] = 10 [Zn(OH)
: pH = pH
log 10 = pH
0,25 =9,9.
En rsum :
Zn
2+
Zn
2+
zincate
pH
10,15
9,9 10,4
mme ordre
de grandeur
zincate
ngligable
ngligeable
Comme on vient de le voir, le complexe est absolument ngligeable en milieu acide.
De plus, on peut galement prvoir que le prcipit sera absent si le milieu est assez acide
(concentration trs faible de HO
donc non saturation en Zn(OH)
).
On commence donc toujours un exercice de ce type pH = , : domaine de lion libre.
Puis on calcule le pH dapparition du prcipit.
Hypothse : ce pH sera largement infrieur 10,15, on suppose donc le complexe ngligeable.
Lion Zn
est donc la concentration apporte [Zn
] = 0,010
.
La saturation est atteinte lorsque la concentration en HO
est suffisamment grande pour que le
soit
juste atteint avec [Zn
] = 0,010
, soit :
= 0,010 [HO
= 0,010
[H
[H
0,010
pH
= p
1
2
p
1
2
log 0,010 = 6,8
On valide bien lhypothse quon est largement dans le domaine o le complexe est en concentration
ngligeable.
Conclusion : Pour 0,0 < pH < 6,8, la solution est limpide, donc = 0,010
, soit log = 2, et
quasiment tout le zinc (II) est sous forme dion libre Zn
.
quilibres en solution aqueuse Exercice 18 Page 2 sur 3
Lorsque le prcipit est prsent, on peut appliquer
= [Zn
][HO
, ce qui permet dexprimer la
solubilit en fonction uniquement du pH :
= Zn
+[Zn(OH)
[HO
+[Zn
][HO
[HO
[HO
[H
[H
Mais lexception de ltroite zone entre 9,9 et 10,4, lion libre ou le complexe sont ngligeables,
lexpression de se simplifie :
Pour 6,8 < pH < 9,9, le complexe est ngligeable, donc Zn
:
log = 2p
2pH = 11,6 2pH
Ceci montre que tant que le complexe nintervient pas, la prcipitation des ions Zn
avec HO
fait
chuter la solubilit : Zn
+2HO
Zn(OH)
.
Pour 10,4 < pH < pH
, Zn
est ngligeable, donc [Zn(OH)
[H
:
log = log 2p
+2pH = 29 +2pH
On constate que la solubilit augmente alors avec le pH. Ce phnomne, appel redissolution dun
prcipit, est d la raction : Zn(OH)
+2HO
[Zn(OH)
.
La redissolution est termine lorsque le prcipit disparat, cest--dire lorsque la concentration en
complexe atteint la concentration totale en zinc apporte, soit lorsque log = 2 = 29 +2pH
.
On trouve dans ce cas pH
= 13,5.
Au-del, pour 13,5 < pH < 14,0, la solution est limpide, donc = 0,010
, soit log = 2, et
quasiment tout le zinc (II) est sous forme de complexe zincate.
Il reste examiner la zone troite entre 9,9 et 10,4. Dans ce cas, lexpression =
[H
[H
ne se simplifie pas.
La drive
d
d[H
]
=
[H
[H
sannule pour [H
] =
, qui est la frontire de
prdominance entre lion libre et le complexe, soit pour pH = 10,15.
La solubilit est donc minimale pour pH = 10,15 et on trouve :
= 4,0 10
ou log
= 8,4
On dispose maintenant de tous les renseignements pour tracer la courbe demande log = (pH) :
logs
pH
6,8 10,15 13,5
-2
-8,4
quilibres en solution aqueuse Exercice 18 Page 3 sur 3
pH
6,8 13,5
2) Le prcipit Zn(OH)
est un hydroxyde amphotre.
En effet, son acide conjugu est lion Zn
et sa base conjugue lion zincate [Zn(OH)
, ce que lon
visualise sur le diagramme dexistence, que lon extrait du graphe prcdent (correspondant une
concentration de trac de 10
) :
Zn
Zn(OH)
[Zn(OH)
Si on dissout Zn(OH)
dans de leau pure, il y a donc quatre ractions susceptibles dtre ractions
prpondrantes (comme pour les ampholytes classiques tudis au chapitre 2) : lautoprotolyse de
lampholyte, ses ractions (sur leau) en tant quacide ou de base, et lautoprotolyse de leau.
(1) 2Zn(OH)
Zn
+[Zn(OH)
= 10
,
(2) Zn(OH)
+4H
O [Zn(OH)
+2H
= 10
(3) Zn(OH)
Zn
+2HO
= 10
,
(4) 2H
O H
+HO
= 10
Les constantes dquilibre ont des expressions trs diffrentes, il faut donc se mfier de leur
comparaison directe. Cependant, il y a une telle diffrence dordre de grandeur, quon peut avoir
lintuition que (2) ne sera pas RP
On essaie plutt de raisonner sur les diagrammes de prdominance et dexistence.
Le diagramme dexistence laisse entrevoir que le prcipit semble tre stable dans une zone basique
(pH entre 6,8 et 13,5). Sil se comporte comme un ampholyte habituel, le pH sera centr dans cette
zone, donc on sattend un milieu basique lquilibre.
On va donc supposer que [H
] sera ngligeable, autrement dit que (2) et (4) ne sont pas RP.
Reste une hsitation entre (1) et (3). Si (1) est RP, on aura autant dion Zn
que de complexe zincate
lquilibre, on sera donc pH=10,15 ce qui signifie un milieu fortement basique ce qui entranerait
donc plutt que (3) est RP ! Cela semble contradictoire.
Si on suppose que (3) est RP, alors on trouve les deux espces majoritaires lquilibre ( est la
solubilit) : [Zn
] = et [HO
] = 2, donc
= (2)
= 4
.
On trouve alors :
=
= 2,2 10
molL
Il faut alors vrifier lhypothse que (3) est RP en calculant les concentrations des autres espces,
cres par les ractions (1), (2) ou (4) :
[Zn(OH)
= Zn
[HO
= 1,8 10
moL
[HO
]
= 2,3 10
molL
Ces deux concentrations sont bien ngligeables, lhypothse est valide : (3) est la RP.
Conclusion : la solubilit de Zn(OH)
dans leau pure est de = 2,2 10
.
La solution sature a un pH de 8,6.
quilibres en solution aqueuse Exercice 19 Page 1 sur 2
Corrig exercice 19
TITRAGE DUNE SOLUTION DIONS CHLORURE PAR LA MTHODE DE MOHR
1) La raction quasi-instantane et quasi-totale qui se produit lorsquon apporte une solution
dions Ag
dans une solution dions Cl
est la raction de prcipitation :
Ag
+ Cl
AgCl
2) On calcule les concentrations apportes de chaque ion dans le bcher aprs lajout dune goutte
de titrant.
On peut considrer que la goutte a un volume
ngligeable devant
= 0,05 mL
=
20,0 mL), donc le volume dans le bcher reste gal
et on trouve :
Cl
= 5,00 10
mol L
Ag
=
= 6,3 10
mol L
On calcule alors :
=
Cl
Ag
= 3,15 10
.
On a donc >
= 10
,
= 1,5 10
: la solution est sature.
Le prcipit apparat donc ds la premire goutte de titrant verse.
3) Par dfinition, lquivalence est obtenue lorsquon a apport Ag
et Cl
dans les proportions
stchiomtriques de la raction de titrage, ici 1:1, soit
= 4,00 mL
4) lquivalence, le bilan de matire de la raction de titrage considre comme totale montre
que la solution est quivalente un prcipit de AgCl dans de leau pure.
La RP peu avance est alors linverse la raction de titrage, cest--dire la dissolution de AgCl ; on
trouve donc lquilibre que [Ag
] = [Cl
] = (solubilit de AgCl dans leau pure), soit :
Ag
= [Cl
] = =
= 1,3 10
mol L
Si on veut que la solution devienne sature en Ag
CrO
exactement ce point-l (et donc que le
prcipit rouge apparaisse brusquement lquivalence), il faut que la concentration en CrO
soit
telle quon atteigne juste
lorsque [Ag
] = 1,3 10
mol L
. On crit donc :
= Ag
CrO
et on en tire : CrO
Ag
= 6,3 10
mol L
.
On vient de calculer la concentration de CrO
dans le volume
. Si on note
la concentration
apporte en ions chromate dans la solution de dpart, alors [CrO
] =
, dont on tire :
= CrO
= 7,6 10
mol L
Remarque :
et [CrO
] sont peu diffrents. Dans la question suivante, on considrera que la dilution est
ngligeable pour simplifier.
5) Si on apporte 10
7 10
mol L
dions chromate, alors le prcipit va apparatre avant
lquivalence. Mais le dcalage nest pas trs important. En effet, si on nglige la dilution, la
quilibres en solution aqueuse Exercice 19 Page 2 sur 2
prcipitation apparat ds que [Ag
] =
4 10
mol L
. La concentration de Cl
est alors
de [Cl
] =
[Ag
]
4 10
mol L
, ce qui signifie que la solution devient brusquement rouge alors
quil reste peine 1% des ions Cl
que lon avait titrer : lerreur est donc faible.
Si on apporte
7 10
mol L
dions chromate, alors le prcipit va apparatre aprs
lquivalence. Mais le dcalage nest pas non plus trs important. En effet, si on nglige la dilution, la
prcipitation apparat ds que [Ag
] =
4 10
mol L
. Ceci correspond apporter
environ 3 10
mol L
dions Ag
non consomms aprs lquivalence, donc dpasser celle-ci
dun volume
tel que
= 3 10
mol L
, dont on tire :
0,03 mL, ce qui
reprsente l aussi moins de 1% de
. Lerreur est faible.
Conclusion : La quantit exacte de lindicateur color na pas dimportance (heureusement, car sinon il
faudrait connatre la concentration
pour savoir combien mettre dindicateur, alors que le but du
titrage est justement de dterminer
!).
Pour assurer un titrage 1% prs, il faut toutefois connatre lordre de grandeur de
et introduire
lindicateur dans le mme ordre de grandeur.
quilibres en solution aqueuse Exercice 20 Page 1 sur 3
pAg
8,8
11,6
Corrig exercice 20
TITRAGE ET SPARATION DUN MLANGE DHALOGNURES
1) Cet exercice est une prcipitation comptitive de la particule Ag
avec deux accepteurs
potentiels : lion Cl
et lion Br
. On choisit donc Ag
comme particule change et les couples
donneur/accepteur sont AgCl/Cl
et AgBr/Br
.
Couple AgCl/Cl
:
La constante caractrisant ce couple est :
= [Ag
][Cl
]
relation applicable lorsque le prcipit est prsent. La frontiredexistence du prcipit sobtient
lorsque [Cl
] atteint la concentration de trac, donc :
= [Ag
On dduit :
pAg
= p
+log
= 8,8
Couple AgBr/Br
:
De mme, on trouve :
pAg
= p
+log
= 11,6
Diagramme dexistence des prcipits :
AgCl Cl
AgBr Br
2) Initialement, lorsquon na pas apport dion Ag
, pAg +.
La premire goutte de nitrate dargent verse
Le volume dune goutte est denviron
mL. Donc une goutte de nitrate dargent correspond
apporter
Ag
=
5 10
.
En calculant =
Ag
= 1 10
>
, on voit que la solution est ncessairement sature en
AgBr. Autrement dit, la concentration apporte par une seule goutte de nitrate dargent dpasse
largement les 10
,
ncessaires pour que le prcipit AgBr apparaisse.
On en dduit quunprcipitdAgBrseformedslapremiregouttedenitratedargentverse.
La plupart des ions Ag
que lon a apports dans cette goutte prcipitent donc selon la raction quasi-
totale :
Ag
+Br
AgBr = 10
,
1
Comme
Ag
, ceci naffecte pas notablement la concentration de Br
: [Br
.
La concentration de Ag
lquilibre, aprs la prcipitation, est donc :
[Ag
] =
= 10
,
Ag
La prcipitation a bien t quasi-totale. Le pAg se fixe 11,6. On voit sur le diagramme dexistence que
leprcipitAgClestabsent dans ces conditions.
quilibres en solution aqueuse Exercice 20 Page 2 sur 3
Courbe pAg = () attendue :
Ag
+
Br AgBr
Ag
+
Cl
AgCl
Ag
+
20
30
V(mL)
pAg
11,6
8,7
point anguleux thorique :
dbut de la prcipi-
tation de AgBr
point anguleux :
dbut de la prcipi-
tation de AgCl
+
+
s'accumule
4,9
1
re
portion : la premire goutte et les suivantes apportent des ions Ag
, qui sont consomms selon la
ractiondetitrage :
(RT1) Ag
+Br
AgBr
Comme les ions Ag
que lon verse sont consomms quasi totalement, leur concentration dans le
bcher ne peut pas augmenter notablement et pAg reste quasi constant.
Pour un volume de nitrate dargent vers, le bilan de matire de (RT1) considre comme totale
montre que la solution est quivalente une solution contenant du prcipit et une concentration en
Br
restante : [Br
] =
.
Remarque : La concentration rsiduelle des ions Ag
, tant quelle est ngligeable (pas trop prs de
),
sexprime donc par [Ag
] =
[Br
]
=
, do lquation thorique de la premire portion :
pAg = p
+log
+
lquivalence de (RT1), lorsquon a apport autant dions Ag
quil y avait dions Br
initialement,
soit un volume
tel que
, soit
= , mL, alors les ions Br
sont puiss. Les
ions Ag
que lon verse ne sont alors plus consomms par la prcipitation, et leur concentration
augmente brusquement dans le bcher : on observe un sautdepAg.
Notons que si
tait inconnue, lexploitation de la courbe exprimentale (par la mthode de la
drive) permettrait de trouver
et den dduire :
La concentration en Cl
est alors de
Cl
=
= 0,0833
; la solution devient satureen
quilibres en solution aqueuse Exercice 20 Page 3 sur 3
AgCl ds que [Ag
] atteint
Cl
= 1,9 10
, soit pAg = 8,7. Il apparat alors un point
anguleux, correspondant au dbut de la prcipitation de AgCl (RT2).
Remarque : il sagit de la frontire dexistence de AgCl, quon lit sur le diagramme. On la recalcule car en
toute rigueur, la concentration de trac a t modifie par la dilution. Mais en chelle logarithmique, on
voit que ceci na pas deffet notable.
On remarque galement que sil ny avait pas dions Cl
dans la solution, la solution lquivalence
serait une solution de AgBr dans leau pure, on trouverait donc une concentration rsiduelle [Ag
] =
[Br
] =
AgBr
=
= 7,1 10
, do pAg
= 6,1(5). En prsence de Cl
, cette valeur nest
pas atteinte car le saut de pAg est interrompu en 8,7 par le dmarrage de la raction (RT2).
Comme la courbe pAg = () est quasi verticale cet endroit, on suppose que labscisse du point
anguleux est malgr tout quasiment de
, cest--dire que (RT1) est quasiment termine quand (RT2)
commence. On vrifiera ce point la question 3).
2
me
portion : on retrouve la mme allure que la premire portion. Cette fois, les ions Ag
que lon
apporte prcipitent quasi-totalement avec les ions Cl
selon la ractiondetitrage :
(RT2) Ag
+Cl
AgCl
pAg reste donc presque constant dans le bcher tant quil y a des Cl
.
Lquivalence est dfinie par le volume
tel quon a apport autant dions Ag
pour faire ce dosage
quil y avait de Cl
apports dans le bcher initialement, soit (
) =
, do
= 30,0 mL.
On observe alors un sautdepAg, puis les Ag
saccumulent et deviennent en concentration
majoritaire (pour un volume trs lev dlivr la burette, [Ag
] tend vers = 1
, donc pAg
tend vers 0)
Lexploitation de ce saut de pAg par la mthode de la drive permettrait daccder la valeur
exprimentale de
et donc den dduire
par :
=
(
3) Si on sarrte dajouter le nitrate dargent un choua avant
, en sassurant que pAg reste
suprieur 8,7, puis que lon filtre ou que lon centrifuge la solution, on peut alors rcuprer le
prcipit AgBr absolumentpur. En effet, la prcipitation de AgCl na rigoureusement pas dbut
avant le point anguleux.
Le rendement maximal de la rcupration du bromure est la quantit maximale de prcipit AgBr que
lon peut esprer rcuprer pur (donc si on va jusquau point anguleux pAg = 8,7) par rapport la
quantit de Br
apporte initialement.
Comme on la dit la question prcdente, le point anguleux apparat en pAg = 8,7, plus prcisment
pour :
[Ag
] =
Cl
, avec
Cl
=
Il reste donc :
[Br
] =
Ag
Cl
= 2,6 10
molL
de bromure non prcipit, soit une quantit :
= [Br
] (
) = 3,1 10
mol
Finalement :
= 100
= 1001
= 99,84%
On avait donc bien raison de considrer que (RT1) tait termine au moment o (RT2) commenait.
quilibres en solution aqueuse Exercice 21 Page 1 sur 3
Corrig exercice 21
TITRAGE DUNE SOLUTION ACIDIFIE DALUMINIUM (III)
La solution dose contient les ions H
(concentration
) et Al
(concentration
).
On introduit HO
la burette ( = 0,100
).
1) La courbe c reprsente lvolution du pH pendant le dosage (courbe pH = ()). Elle permet de
distinguer deux sauts nets (B et C) et une vague (D). On peut donc penser quil y a trois dosages
successifs. De plus, on voit que les espces contenant de laluminium dissous restent 100% de la
concentration initiale sur la portion AB. Laluminium nest donc pas concern et il se produit la
raction acido-basique :
(RT1) H
+HO
2H
O sur la portion AB
Lorsque les ions H
sont consomms, on voit samorcer le saut de pH caractristique de
lquivalence du dosage dun acide fort par une base forte. Or B est un point anguleux, ce qui traduit
une rupture dquilibre, en loccurrence lapparition du prcipit Al(OH)
. Sur la portion BC, la
courbe d, qui reprsente le pourcentage de la concentration en Al
par rapport la concentration
apporte, diminue rgulirement, sans quune autre espce dissoute napparaisse : ceci traduit quil se
produit la raction de prcipitation :
(RT2) Al
+3HO
Al(OH)
sur la portion BC
Aprs C, il se forme le complexe [Al(OH)
(courbe e). Comme quasiment tout tait prcipit au
point C, cest quil se produit la redissolution du prcipit selon :
(RT3) Al(OH)
+HO
[Al(OH)
sur la portion CD
Le point D reprsente la fin de la raction RT3. Remarquons que la position exacte du point D nest pas
claire sur la courbe fournie. En fait, comme on va le voir plus loin, lquivalence (notion thorique) se
trouve en = 14,0 mais la raction de dosage ntant pas termine, la disparition du prcipit
nintervient que lorsque la courbe e atteint 100%, soit vers 14,3 . On choisit dappeler D le point
dabscisse 14,0 , cest dire le point reprsentant lquivalence de (RT3).
La portion restante reprsente le pH impos par lexcs de soude.
2) lquivalence du dosage acido-basique, on a trs nettement
= 2,0 .
En ce point, on a ajout autant dions HO
quil ny avait initialement dions H
, soit
;
do :
= 0,020
Remarque:aupointB,onestenfaitunchouaavantlquivalencede(RT1),carsilnyavaitpasdions
Al
,lepHyvaudrait7,0(quivalencedudosagedunacidefortparunebaseforte).Toutefois,lesautde
pHtantquasiverticalcetendroit,onrelveraitdetoutesfaons
= 2,0 .
Lquivalence suivante est au point C :
= 11,0 . Entre B et C, cest la raction de prcipitation
qui a lieu, qui ncessite dapporter 3 HO
pour 1 Al
initialement prsent. La quantit de HO
apporter est donc telle que
(
; do :
=
(
)
3
= 0,030
3) Pour dterminer
, on exprime la condition dapparition du prcipit en B (point anguleux).
Le prcipit apparat ds que :
[Al
] [HO
Or au point B, les ions Al
nont pas encore t consomms, donc, en tenant simplement compte de la
dilution :
quilibres en solution aqueuse Exercice 21 Page 2 sur 3
pH
3,8 11,2
[Al
] =
= 0,025
On lit pH
3,75, do [HO
] = 5,6 10
. Donc :
= 4,4 10
Portion CD : Lquivalence de la raction (RT3) est obtenue, par dfinition, en crivant que la quantit
de HO
apporte est gale la quantit de prcipit cre lquivalence de la raction (RT2)
suppose totale, ceci implique : (
) =
, dont on tire
= 14,0 .
On constate alors que la raction de dosage (RT3) nest pas termine puisque la concentration du
complexe nest que de 90% de son maximum.
Pour dterminer , on peut se placer en = 14,0 . Comme on vient de le voir, le prcipit est
encore prsent. On peut alors crire (sachant que =
[Al(OH)
[Al
][HO
) :
[Al
] [HO
[Al(OH)
[HO
]
=
En ce point D, on lit :
pH
11,0 [OH
] = 10
[Al(OH)
90%
= 0,0113
Do :
= 3 10
On ne donnera pas plus dun chiffre significatif car cette dtermination est issue de lectures peu
prcises sur le graphe et de la rpercussion de lerreur sur
. Cette prcision est gnralement
acceptable pour une constante dquilibre.
On peut alors calculer la constante dquilibre de (RT3) : =
13. Cette constante nest pas trs
grande, ce qui traduit le fait que la raction nest pas vraiment quantitative. Il reste encore du prcipit
lquivalence. Il ny a pas de saut de pH marqu. En fait, il y a une rupture dquilibre, donc un point
anguleux, vers 14,3 , mais cela nest pas trs visible sur la courbe fournie.
Remarque:onauraitpuchoisirdeseplaceren14,3 ,olecomplexeatteint % 100 ,soit:
[Al(OH)
+14,3
= 0,0123
Cepointanguleux(pasvraimentvisible)estlarupturedquilibre,derniermomento
estapplicable,
onretrouvedonc =
[Al(OH)
[Al
][HO
=
[Al(OH)
[HO
]
.
OnlitpH = 11,1(5)en14,3 ,soit[HO
] = 3,2 10
.
Do 2 10
;onretrouvebienlordredegrandeurprcdent,mmesi,commeonpouvaitsy
attendreavecceslecturesgraphiques,lechiffreprcdentlapuissancede10estbienincertain.
4) Le prcipit Al(OH)
est un hydroxyde amphotre.
En effet, son acide conjugu est lion Al
et sa base conjugue lion [Al(OH)
, ce que lon visualise
sur le diagramme dexistence, dont on extrait lallure partir du graphe du titrage (le prcipit existe
entre les deux points anguleux) :
Al
Al(OH)
[Al(OH)
Si on dissout Al(OH)
dans de leau pure, il y a donc quatre ractions susceptibles dtre ractions
prpondrantes : lautoprotolyse de lampholyte, ses ractions (sur leau) en tant quacide ou de base,
et lautoprotolyse de leau.
quilibres en solution aqueuse Exercice 21 Page 3 sur 3
pH
5,6
(1) 4Al(OH)
Al
+3[Al(OH)
= 6,9 10
(2) Al(OH)
+H
O [Al(OH)
+H
= 1,2 10
(3) Al(OH)
Al
+3HO
= 4,4 10
(4) 2H
O H
+HO
= 1,0 10
Les constantes dquilibre ont des expressions trs diffrentes, il faut donc se mfier de leur
comparaison directe. Cependant, il y a une telle diffrence dordre de grandeur, quon peut avoir
lintuition que (1) et (3) ne seront pas RP
Onpeutaussitracerlediagrammedeprdominancedesespcesdissoutes,ettablirquelafrontireest
pH = 14
= 5,6 :
Al
[Al(OH)
Onpeutalorssupposerque,puisquilsagitdunselextrmementpeusoluble(
= 4,4 10
),lepH
lquilibreseraassezprochede7,doncquontermineradansledomainedeprdominanceducomplexe.
Cecimilitepourlideque(2)estprobablementlaRP
Si on suppose que (2) est RP, alors on trouve les deux espces majoritaires lquilibre :
[Al(OH)
= [H
] =
= 3,5 10
pH = 6,5
Il faut alors vrifier lhypothse en calculant les concentrations des autres espces, cres par les
ractions (1), (3) ou (4) :
[HO
] =
= 2,9 10
molL
[Al
] =
[HO
= 1,7 10
Ces deux concentrations sont bien ngligeables devant 3,5 10
, lhypothse est valide.
Conclusion : la solubilit de Al(OH)
dans leau pure est de = 3,5 10
.
La solution sature a un pH de 6,5.
quilibres en solution aqueuse Exercice 22 Page 1 sur 9
Corrig exercice 22
DOSAGES DUNE SOLUTION DACIDE PHOSPHORIQUE
Premirepartie:dosageacido-basiquedirect
1) Un pH-mtre est un voltmtre, connect llectrodedeverre et une lectrode de rfrence
(en gnral llectrode de rfrence au calomel). Avec un tel montage, le voltmtre mesure, une
constante prs, la diffrence de potentiel de membrane de llectrode de verre.
La relation entre le pH et le potentiel mesur par le voltmtre est en thorie affine : = + pH ,
o et sont des constantes dpendant de la temprature et de la nature des lectrodes.
Comme il y a deuxconstantes et dterminer pralablement toute mesure, il est ncessaire
dtalonner un pH-mtre avec deux solutions tampon : lune pH = 7,0, lautre pH voisin de la zone
qui nous intresse.
2) Il y a trois ractions de titrage, car lacide phosphorique H
A est un triacide.
(RT1) H
A +HO
+H
=
[H
]
[H
A]
= 10
,
= 7,9 10
(RT2) H
+HO
HA
+H
= 10
,
= 6,3 10
(RT3) HA
+HO
+H
= 10
,
= 40
3) Par dfinition, lquivalence correspond au point o les ractifs titr et titrant ont t apports
dans les proportions stchiomtriques de la raction de titrage.
Ainsi, pour (RT1) :
, donc :
= 5,0 mL
Puis pour (RT2) :
= (
), donc
, soit :
= 2
= 10,0 mL
Puis pour (RT3) :
= (
), donc
, soit :
= 3
= 15,0 mL
4)
, le rapport entre ces deux constantes est suprieur 10
(ou, ce qui revient au
mme, lcart de p
entre les deux premires acidits de lacide phosphorique est suprieur 5
units). On peut donc sattendre ce que (RT1) et (RT2) soient des ractions de titrages successives.
Comme, de plus,
> 10
1, on sattend donc observer donc un saut de pH marqu la fin de
(RT1).
De mme,
avec un rapport suprieur 10
. (RT3) est donc galement successive
(RT2). Comme, de plus,
> 10
1, on attend un saut de pH marqu la fin de (RT2).
En revanche, la constante
ne vaut que 40, ce qui est beaucoup trop faible pour que la raction de
titrage soit quantitative lquivalence. On nattend donc pas de saut de pH en
.
On peut aussi dire que la solution titrante ayant un pH de 13,0, le pH dans le becher ne pourra jamais
tre suprieur 13,0. Or p
= 12,4 On restera donc ncessairement proche de la frontire de
prdominance, cest--dire quon ne pourra jamais convertir quasi-totalement HA
en A
.
On attend donc deux sauts de pH marqus, en
= 5,0 mL et en
= 10,0 mL.
5) La solution initiale est une solution dacide phosphorique H
A de concentration
= 1,00
10
.
Si on suppose lautoprotolyse de leau ngligeable, ainsi que la seconde et troisime acidit de lacide
phosphorique, alors la ractionprpondrante est :
quilibres en solution aqueuse Exercice 22 Page 2 sur 9
(RP) H
A + H
O H
+ H
= 10
,
apport
0 0
quilibre
(concentrations)
Cette raction est a priori peuavance car
1 : si on tente lhypothse classique des acides
faibles, savoir quils sont peu dissocis, alors on suppose
, ce qui donne lquation
, soit
=
= 8,9 10
, qui nest pas ngligeable devant la concentration
= 1,00
10
. Lhypothse dune faible dissociation est contredite !
Remarque : si on connat par cur la formule des acides faibles, on peut tenter de lappliquer
directement pH =
= 2,0(5). La formule nest donc pas valide car on nest pas
largement dans le domaine de prdominance de lacide (on na pas pH < p
1).
Il faut donc rsoudre lquation du second degr issue de
, savoir :
= 0,
dont la seule solution acceptable est :
= 5,8 10
= [H
] =
Lacide phosphorique est dissoci 58% en H
et il ne reste que 42% de H
A.
On calcule les espces minoritaires :
=
= 1,7 10
: lautoprotolyse de leau est bien ngligeable ;
[HA
] =
[H
= 6,3 10
: la deuxime acidit de H
A est
ngligeable ;
[A
] =
HA
= 4,3 10
: la troisime acidit de H
A est ngligeable.
Conclusion : le rsultat = = 5,8 10
est valide, donc :
pH = 2,2
Remarque : Lessai de lhypothse
ou de la formule des acides faibles nest en rien obligatoire. On
peut dailleurs lessayer au brouillon et ne pas en parler sur la copie
On pouvait en effet tout fait se douter que, le p
tant trs bas (2,1), lacide H
A tait un acide faible
particulirement fort, donc dont la dissociation ne serait pas ngligeable.
6) Pour calculer rigoureusement le pH la deuxime demi-quivalence, on applique
scrupuleusement la mthode de la RP.
La quantit apporte initialement de H
A est
.
La deuxime demi-quivalence correspond un volume de soude vers gal :
=
2
= 7,5 mL
Les premiers
= 5,0 mL de soude verss correspondent une quantit
de HO
apports : le bilandematirede(RT1)considrecommetotale montre que la solution est alors
quivalente une solution o on aurait apport
de H
.
On ajoute alors
= 2,5 mL de soude supplmentaire, soit une quantit
de HO
.
Le bilan de matire de (RT2) considre comme totale donne :
quilibres en solution aqueuse Exercice 22 Page 3 sur 9
(RT2) H
. + HO
HA
+ H
O
apport
2
0
bilan
totalit
2
0
2
(quantits de matire)
Comme on nglige la dilution (
, on a donc montr que la solution la deuxime demi-
quivalence taitquivalenteunmlange
H
A
=
avec
HA
=
.
Un tel systme est une solutiontampon. Si on suppose (approximation dHenderson) que toutes les
ractions que lon peut alors crire sont ngligeables (ractions de H
et de HA
sur leau,
autoprotolyses de H
et de HA
et de leau), alors on postule qu lquilibre, on conserve :
[H
] = [HA
] =
2
= 5,0 10
...et on dduit alors :
pH = p
+log
[HA
]
[H
]
= p
= 7,2
Vrification : on calcule les concentrations de toutes les espces minoritaires.
[H
] = 10
,
= 6,3 10
[HO
] =
[H
]
= 1,6 10
[A
] =
[HA
]
[H
]
= 3,2 10
[H
A] =
[H
][H
= 4,0 10
Ces quatre concentrations sont bien ngligeables devant les concentrations du tampon [H
] =
[HA
] =
= 5,0 10
. Toutes les ractions qui taient susceptibles de modifier ces
concentrations sont donc bien ngligeables :lersultatestvalide.
OnvamaintenantexpliquerpourquoionnetrouvepaspH = p
auxautresdemi-
quivalences:
y la premire demi-quivalence ( =
= 2,5 mL), le bilan de matire de (RT1) considre comme
totale montre que la solution est quivalente un mlange
H
A
=
avec
H
A
=
.
Or si on supposait que ces concentrations restaient inchanges lquilibre (approximation
dHenderson), on trouverait pH = p
= 2,1, soit [H
] = 10
,
, concentration suprieure
! Ceci met en vidence que la raction H
A +H
O H
+H
est beaucoup trop avance pour
tre ngligeable. Ceci illustre le fait, dj constat la question 5, que H
A est un acidetropfort !
On pouvait galement dire que le pH initial de 2,2, calcul la question 5, tant dj suprieur au p
,
et lajout de soude ne pouvant que faire augmenter le pH, on ne peut logiquement jamais obtenir une
valeur de pH gale p
= 2,1 !
y la troisime demi-quivalence ( =
= (10,0 +2,5) mL = 12,5 mL), les bilans de
matire de (RT1), puis (RT2), puis (RT3), considres comme totales montrent que la solution est
quivalente un mlange
HA
=
avec
A
=
.
Or si on supposait que ces concentrations restaient inchanges lquilibre (approximation
dHenderson), on trouverait pH = p
= 12,4, soit [HO
] = 10
,
, concentration suprieure
! Ceci met en vidence que la raction A
+H
O HA
+HO
est beaucoup trop avance pour
tre ngligeable. Ceci illustre que le fait que A
est unebasetropforte !
On peut galement dire, ce qui revient au mme, que la raction (RT3) nest en ralit pas assez totale,
quilibres en solution aqueuse Exercice 22 Page 4 sur 9
comme on la constat la question 4, la soude ne convertit donc pas intgralement HA
en A
. On
na donc pas [HA
] = [A
] la demi-quivalence.
7) En =
, ont t apports :
de H
A et
de HO
.
Le bilandematirede(RT1)traitecommetotale montre que la solution est alors quivalente
une solution o on aurait apport
de H
.
Comme on nglige la dilution,
, la solution est donc quivalente une solution
H
A
=
=
1,0 10
.
H
est un ampholyte. Les ractions candidates tre ractions prpondrantes sont alors
lautoprotolyse de lampholyte ainsi quventuellement ses ractions sur leau.
On commence par tenter lapproximation usuelle, cest--dire que la RP est lautoprotolyse :
(RP) 2H
A +HA
Dans ce cas, on sait que le pH sobtient par la formule des ampholytes :
pH =
1
2
(p
+p
) = 4,6(5)
Vrification :
[H
] = 10
,
= 2,2 10
puis, en supposant que [H
, on trouve par
et
:
[H
A] = [HA
] = 2,8 10
Les trois concentrations des espces minoritaires sont bien ngligeables devant
(donc [H
est bien valide). Par contre, [H
] = 2,2 10
nest pas ngligeable devant [H
A] =
[HA
] = 2,8 10
! La raction de H
sur leau en tant quacide ne peut donc en principe
pas tre nglige !
Toutefois, lnonc permettait explicitement de ne considrer que la raction la plus avance pour
obtenir un rsultat approch. O pouvait donc se contenter de dire que [H
A] = [HA
] = 2,8
10
est suprieur [H
] = 2,2 10
pour valider pH =
(p
+p
) = 4,6(5) !
Ceci nest certes pas trs satisfaisant, mais les ordres de grandeur des concentrations sont justes, donc
on sait que le pH ne doit pas scarter de plus de quelques diximes de cette valeur, ce qui, comme on
se situe au niveau dun saut de pH, nous suffit a priori.
On trouve donc :
pH
4,7
Remarque : le calcul rigoureux ncessiterait de considrer deux RP simultanes.
(RP1) 2H
A +HA
(RP2) H
+H
O HA
+H
Aprs rsolution du systme, on trouve : pH = 4,8. La valeur approche 4,7 que lon a donne tait donc
bien satisfaisante.
Pourpasserde =
, on ajoute nouveau (
) =
de HO
Le bilandematirede(RT2)traitecommetotale montre que la solution est alors quivalente
une solution o on aurait apport
de HA
.
Comme on nglige la dilution,
, la solution est donc quivalente une solution
HA
=
=
1,0 10
.
De nouveau, HA
est un ampholyte. Les ractions candidates tre ractions prpondrantes sont
alors lautoprotolyse de lampholyte ainsi quventuellement ses ractions sur leau.
On commence par tenter lapproximation usuelle, cest--dire que la RP est lautoprotolyse :
(RP) 2HA
+A
Dans ce cas, on sait que le pH sobtient par la formule des ampholytes :
quilibres en solution aqueuse Exercice 22 Page 5 sur 9
pH =
1
2
(p
+p
) = 9,8
Vrification :
[HO
] = 10
,
= 6,3 10
puis, en supposant que [HA
, on trouve par
et
:
[H
] = [A
] = 2,5 10
Les trois concentrations des espces minoritaires sont bien ngligeables devant
(donc [HA
est bien valide). Par contre, on constate que [HO
] = 6,3 10
est largement suprieure
[H
] = [A
] = 2,5 10
! Ainsi, la raction de H
sur leau en tant que base semble en
ralit beaucoup plus avance que son autoprotolyse !
De manire inattendue, HA
est davantageunebasefaiblequunampholyte !
Comme lnonc permettait explicitement de ne considrer que la raction la plus avance pour
obtenir un rsultat approch, il fallait donc considrer comme raction prpondrante :
(RP) HA
+ H
O H
+ HO
solution
quivalente
0 0
quilibre
On trouve alors
, soit =
= 4,5 10
, ce qui vrifie bien
(approximation usuelle des bases faibles).
De plus, on trouve avec
: [A
] = 1,6 10
(lautoprotolyse de HA
est moins avance
mais non ngligeable en toute rigueur).
On conclut :
pH
9,6
Le rsultat rigoureux ncessiterait l aussi de prendre en compte les deux RP simultanes :
(RP1) 2HA
+A
(RP2) HA
+H
O H
+HO
La rsolution donne : pH = 9,5. La valeur 9,6 propose est donc trs correcte, bien meilleure en tout cas
que la valeur 9,8 que donnait la formule des ampholytes.
8) Allure de la courbe de titrage :
quilibres en solution aqueuse Exercice 22 Page 6 sur 9
Deuximepartie:dosageenprsencedelionAg
Ag
PO
est not Ag
A.
9) Ag
A peut se dissoudre en ses ions constitutifs Ag
et A
. Mais comme A
est une base, celle-ci
peut son tour ragir sur leau pour donner les diffrentes formes acido-basiques de lacide
phosphorique.
On peut donc crire quatre ractions de dissolution partir de Ag
A :
(R1) Ag
A 3Ag
+A
(R2) Ag
A +H
O 3Ag
+HA
+HO
(R3) Ag
A +2H
O 3Ag
+H
+2HO
(R4) Ag
A +3H
O 3Ag
+H
A +3HO
10) On recherche parmi les quatre ractions prcdentes la raction pouvant tre la raction
prpondrantededissolution. Pour cela, il faut se demander quelle pourrait tre lespce acido-
basique de lacide phosphorique prdominante dans la solution sature.
Demble, on remarque quen raison des ractions (R2), (R3) et (R4), la solution devient
ncessairement basique lors de la dissolution du sel : pH > 7,0. On est donc certain que H
A sera
ngligeable lquilibre (cf. diagramme de prdominance ci-aprs) : (R4) ne peut pas tre RP.
quilibres en solution aqueuse Exercice 22 Page 7 sur 9
2,1 7,2 12,4 pH
H
A H
HA
moins dune dissolution compltement ngligeable devant lautoprotolyse de leau, on peut
galement penser que le pH sera nettement suprieur 7,2. On postule alors que H
sera galement
minoritaire dans la solution sature, et donc que (R3) nest pas RP.
Enfin, on voit que pour que A
soit majoritaire et que (R1) soit RP, il faudrait un pH suprieur 12,4,
soit une libration dions HO
de lordre de 0,1
, ce qui semble norme pour une raction de
constante dquilibre seulement
= 10
,
!
Il est donc extrmement probable que la ractionprpondrantededissolution soit (R2).
(R2)=(RP) Ag
A +H
O 3Ag
+HA
+HO
= 10
,
quilibre excs 3
(o est la solubilit
cherche)
On pose alors :
= (3)
...ce qui donne directement :
=
27
= 1,7 10
Il reste vrifier lhypothse que (R2) est RP.
[HO
] = = 1,7 10
, donc pH = 14 +log = 10,2. Le diagramme de prdominance
confirme quon est largement dans le domaine de prdominance de HA
.
Les concentrations des espces minoritaires se dduisent de [HA
] = = 1,7 10
et de
pH = 10,2. On trouve :
[A
] = 1,1 10
;
[H
] = 1,7 10
[H
A] = 1,4 10
on avait donc bien raison de ngliger (R1), (R3) et (R4) devant la RP (R2).
Conclusion :
La solubilit de Ag
PO
dans leau pure est de = 1,7 10
et la solution sature a un pH de 10,2.
11) La concentration apporte dacide phosphorique tant voisine de 10
et le pH voisin de
2,2, on se situe proche de la frontire de prdominance entre H
A et H
, on peut donc prvoir
[H
A] [H
] 5 10
(calcul prcis dans la question 5).
2,1 7,2 12,4 pH
H
A H
HA
Le pH se situe 5 units de la frontire de prdominance entre H
et HA
. On peut donc estimer :
[HA
]
[H
5 10
.
Le pH se situe un peu plus de 10 units de la frontire de prdominance entre HA
et A
. On peut
donc estimer :
[A
]
[HA
]
10
5 10
quilibres en solution aqueuse Exercice 22 Page 8 sur 9
On vrifie alors que le prcipit est absent en calculant le quotient ractionnel de la raction de
dissolution du sel en ses ions constitutifs et en le comparant
:
= [Ag
[A
] =
5 10
10
= 10
,
La solution nest pas sature en Ag
PO
.
12) Le prcipit tant absent, la prsence des ions Ag
na aucun effet et le dbut du titrage est
exactement comme celui de la premire partie :
(RT1) H
A +HO
+H
O
En
= 5,0 mL, on atteint lquivalence et le saut de pH se produit. Ce saut est brutalement
interrompu par un pointanguleux, ce qui traduit lapparitionduprcipitAg
A.
Le pH au point anguleux est denviron 5,3, les ordres de grandeur sont alors de :
[H
= 10
[HA
] =
[H
]
10
,,
10
[A
] =
[HA
]
10
,,
10
Cette dernire concentration est toujours infime, mais elle suffit bien fois atteindre la saturation en
Ag
A, comme le montre le calcul :
=
10
3 10
13) Daprs lindication fournie, (RT2) doit avoir Ag
A comme produit. On part dune solution de
H
et on ajoute de la soude Il reste ajuster les nombres stchiomtriques pour trouver la
raction :
(RT2) H
+2HO
+3Ag
Ag
A +2H
O
Cette raction de titrage consomme les deux ractifs du titrage simultanment (H
issu de (RT1) et
Ag
). Or les conditions initiales choisies font quils sont apports en quantits stchiomtriques :
. Ils seront donc puiss en mme temps. lquivalence, la quantit de soude apporte
vrifie donc
(
)
2
=
3
On en tire :
=
2
=
2
3
= 10,0 mL
14) On lit pH 9,5 au deuxime point anguleux, soit [HO
] = 10
,
= 3,2 10
.
Au point anguleux, Ag(OH) apparat, son produit de solubilit devient donc applicable et on en dduit :
[Ag
] =
[HO
]
8 10
Cette concentration reprsente moinsde3% de la concentration
initiale en ions Ag
. On peut donc
considrer que la raction (RT2) a prcipit quasiment tous les ions Ag
lorsquon atteint ce nouveau
point anguleux.
15) Lnonc prcise que le prcipit Ag(OH) est plus stable que Ag
A. On en dduit que lapport de
soude convertit le prcipit Ag
A en Ag(OH). Ceci entrane la libration des ions A
du prcipit, mais
attention : entre
et
, zone o (RT3) a lieu, le pH est voisin de 10 La forme acido-basique
prdominante est donc HA
et non pas A
!
Do la raction de titrage :
(RT3) Ag
A +2HO
+H
O 3Ag(OH) +HA
quilibres en solution aqueuse Exercice 22 Page 9 sur 9
Si on considre (RT1) et (RT2) comme totales, la quantit de Ag
A doser est de
, do la
relation dfinissant
:
(
)
2
=
3
...dont on tire :
=
2
=
2
3
= 10,0 mL
16) Le point anguleux traduit une rupture dquilibre, qui ne peut correspondre ici qu la
disparitionduprcipitAg
A, la fin de (RT3).
La soude apporte ensuite sert alors convertir HA
en A
, selon :
(RT4) HA
+HO
+H
O
Cette raction tait la dernire raction du titrage de la premire partie. On a vu quelle tait trop
avance pour donner un saut.
La courbe pH-mtrique devient alors identique la dernire portion du dosage de la premire partie,
partir du point anguleux pH voisin de 10,2 :
Parties communes aux titrages
des parties 1 et 2 du problme
quilibres en solution aqueuse Exercice 23 Page 1 sur 4
Corrig exercice 23
NOMBRES DOXYDATION
Ion perchlorate ClO
StructuredeLewis:
Cl
O
O
O
O Cl
O
O
O
O
_
_
...
Gomtrie:
Le type VSEPR est AX
: les quatre liaisons Cl O sont rigoureusement de mme nature (mme
longueur, mme rpulsivit), en raison de lquivalence des quatre formes msomres.
La molcule est donc un ttradrergulier, tous les angles valent 109,47.
Cl
O
O
O
O
109,47
Nombresdoxydation:
Loxygne est plus lectrongatif que le chlore. On attribue donc formellement chaque oxygne les
lectrons de la (des) liaison(s) covalente(s). Chaque oxygne se retrouve donc avec formellement
quatre doublets : nombre doxydation II.
Le nombre doxydation du chlore se dtermine :
- soit en considrant que, puisque tous les lectrons de valence ont t donns formellement aux
atomes O, il nen reste plus sur le chlore. Comme cet lment a sept lectrons de valence
lorsquil est neutre, on en dduit un nombre doxydation de +VII.
- soit en appliquant le fait que la somme des n.o. des atomes est gale la charge de lion, soit :
4 (II) +(Cl) = 1, do : (Cl) = +VII.
Remarques:
+VII est le nombre doxydation maximal du chlore car cela correspond la perte formelle de
tous ses lectrons de valence. Ceci est lorigine du prfixe per dans le nom perchlorate ,
car ce prfixe dsigne un n.o. particulirement lev dun lment.
Mthode rapide courante pour dterminer les n.o. sans crire la structure de Lewis : sassurer
quil ny a ni liaison F O ni liaison O O et en dduire immdiatement que tous les oxygnes
sont II. Puis en dduire par la somme des n.o. que le chlore est +VII.
quilibres en solution aqueuse Exercice 23 Page 2 sur 4
Anhydride hypochloreux Cl
O
StructuredeLewis:
O Cl Cl
Gomtrie:
Le type VSEPR est AX
: on prvoit donc une gomtrie drive du ttradre rgulier (angles idaux
109,47).
Cependant, deux sommets du ttradre sont occups par des doublets non liants : il sagit donc dune
molculecoude. En raison de la rpulsivit plus grande des doublets non liants, on sattend un
angle Cl O Cl lgrement infrieur 109,47.
En ralit, langle exprimental est de 110,8. Ceci peut sinterprter par la relative grande taille de
latome de chlore par rapport loxygne : la liaison Cl O est assez courte pour que les deux atomes
de chlore se retrouvent assez proches pour entrer en rpulsion.
Nombresdoxydation:
Loxygne est plus lectrongatif que le chlore. On lui attribue donc formellement les lectrons des
liaisons covalentes. Loxygne se retrouve donc avec formellement quatre doublets :
nombre doxydation II.
Le nombre doxydation du chlore se dtermine :
- soit en considrant que, puisque tous les lectrons de valence ont t donns formellement O,
chaque chlore ne conserve que trois doublets soit six lectrons. Comme cet lment a sept
lectrons de valence lorsquil est neutre, on en dduit un nombre doxydation de +I.
- soit en appliquant le fait que la somme des n.o. des atomes est gale la charge de lion, soit :
(II) +2 (Cl) = 0, do (Cl) = +I.
Remarques:
Les deux questions prcdentes montrent immdiatement que le couple ClO
/Cl
O estun
coupledoxydorductiondellmentchlore, o ClO
est loxydant et Cl
O le rducteur.
Mthode rapide courante pour dterminer les n.o. sans crire la structure de Lewis : sassurer
quil ny a ni liaison F O ni liaison O O et en dduire immdiatement que tous les oxygnes
sont II. Puis en dduire par la somme des n.o. que le chlore est +I.
quilibres en solution aqueuse Exercice 23 Page 3 sur 4
Ion sulfite SO
StructuredeLewis:
S
O
O O S
O
O O S
O
O O
_
_
_
_
_
_
Gomtrie:
Le type VSEPR est AX
: on prvoit donc une gomtrie drive du ttradre rgulier (angles idaux
109,47).
Cependant, un sommet du ttradre est occup par un doublet non liant : il sagit donc dun ion
pyramidalbasetriangulaire de sommet S.
Les trois liaisons S O sont rigoureusement de mme longueur et de mme rpulsivit, car les trois
formes msomres montrent quelles sont parfaitement quivalentes, intermdiaires entre liaison
simple et double. Le doublet non liant tant plus rpulsif, les angles OSO
sont lgrement infrieurs
109.
S
O
O
O
<~109
Nombresdoxydation:
Pas de liaison O O, donc (O) = II ;
3 (II) +(S) = 2, donc (S) = +IV.
Chlorure de sulfuryle SO
Cl
StructuredeLewis:
S
Cl
O O
Cl
Gomtrie:
Le type VSEPR est AX
. La molcule est donc ttradrique.
Les angles sont proches de 109,47, mais pas tous gaux car une liaison double est plus rpulsive
quune simple. On peut donc sattendre une lgre ouverture de langle OSO
au dtriment de langle
ClSCl
.
S
O
O
Cl
Cl
>~109
<~109
Nombresdoxydation:
Pas de liaison O O, donc (O) = II ;
Le chlore est plus lectrongatif que le soufre, on lui attribue le doublet, donc (Cl) = I ;
2 (II) +2 (I) +(S) = 0, donc (S) = +VI.
Remarque:
Notons que SO
Cl
/SO
estuncoupledoxydorductiondusoufre (+VI/+IV),dont SO
Cl
est
loxydant et SO
le rducteur.
quilibres en solution aqueuse Exercice 23 Page 4 sur 4
Ion permanganate MnO
Voir le cas de lion perchlorate ci-dessus : cest exactement le mme cas en remplaant chlore par
manganse !
Anhydride permanganique Mn
StructuredeLewis:
Mn
O
O
O
O Mn
O
O
O
Gomtrie:
x Type AX
autour de loxygne central : gomtrie coude, avec des angles lgrement
infrieurs 109 en raison de la rpulsivit des doublets non liants (mais leffet strique pourrait
contrecarrer cette prvision).
x Type AX
autour dun atome de manganse. Les liaisons Mn O
externes
sont doubles, donc plus
courtes et plus rpulsives que ne lest la liaison Mn O
central
, simple. Les angles O
ext
MnO
ext
sont donc
lgrement suprieurs 109, contre un peu moins pour les angles O
ext
MnO
centr
.
Mn
O
Mn
O O
O O O O
<~109
<~109
>~109
Nombresdoxydation:
Pas de liaison O O, donc (O) = II ;
7 (II) +(Mn) = 0, donc (Mn) = +VII.
Remarques:
Notons quil sagit du degr doxydation maximal du manganse, do le prfixe per .
Mn est aussi au nombre doxydation +VII dans lion permanganate MnO
donc le couple
Mn
/MnO
nestpasuncoupledoxydorductionmaisuncoupleacido-basique :
Mn
+H
O 2MnO
+2H
quilibres en solution aqueuse Exercice 24 Page 1 sur 2
Corrig exercice 24
RACTIONS REDOX EN MILIEU ACIDE
Les nombres doxydation des atomes qui en changent sont indiqus ct de chaque espce.
1) Bien identifier les deux couples : Br
est loxydant dans un couple et le rducteur dans lautre.
+I 0
2HBrO +2
+2H
Br
+2H
O
2Br
Br
+2
I 0
BILAN :
H
+HBrO +Br
Br
+H
O (aprs simplification par 2)
Remarque : le sens 1 est une mdiamutation, le sens 2 une dismutation.
2) Attention aux n.o. dans les molcules organiques (C est plus lectrongatif que H) : crire la formule
dveloppe des molcules pour retrouver les n.o. indiqus.
I (C portant OH) +III (C de CO
H)
CH
CH
OH +H
O CH
CO
H +4
+4H
( 5)
MnO
+5
+8H
Mn
+4H
O ( 4)
+VII +II
BILAN :
12H
+5CH
CH
OH +4MnO
5CH
CO
H+4Mn
+11H
O (aprs simplification des H
et H
O)
3)
+VI +III
Cr
+6
+14H
2Cr
+7H
O
3I
+2
( 3)
I
(0, I,0)
I I I
_
BILAN :
14H
+Cr
+9I
2Cr
+3I
+7H
O
quilibres en solution aqueuse Exercice 24 Page 2 sur 2
4)
+VII
I I I
_
(0, I,0)
3IO
+22
+24H
+12H
O
H
+2
+2H
( 11)
I(oxygne) 0
BILAN :
2H
+3IO
+11H
+11O
+12H
O (aprs simplification des H
)
5)
+III +II
HNO
+1
+1H
NO +H
O ( 2)
3I
+2
I (0, I,0)
I I I
_
BILAN :
2H
+2HNO
+3I
2NO +I
+2H
O
6)
II (soufre) 0
HgS +2Cl
S +2
+HgCl
( 3)
NO
+3
+4H
NO +2H
O ( 2)
+V +II
BILAN :
8H
+3Hg +2NO
+6Cl
3HgCl
+2NO +3S +4H
O
Remarque :
Pour la premire demi-quation lectronique, procder comme suit :
- on remarque tout dabord que cest le soufre qui change de nombre doxydation (couple S/HgS
et on quilibre avec 2
;
- on quilibre alors en mercure, qui ne change pas de nombre doxydation : il est +II dans HgS ;
on pourrait penser crire +Hg
droite, mais lnonc nous impose HgCl
, qui est bien de
toutes faons du mercure +II ;
- il faut alors quilibrer en chlore. Lui non plus ne change pas de n.o., il est I dans HgCl
, on
quilibre alors gauche avec 2Cl
.
quilibres en solution aqueuse Exercice 25 Page 1 sur 2
Corrig exercice 25
RACTIONS REDOX EN MILIEU BASIQUE
Les nombres doxydation des atomes qui en changent sont indiqus ct de chaque espce.
1) Les hydroxydes de fer sont des prcipits de cations du fer avec lion HO
; un prcipit tant neutre,
on retrouve immdiatement la charge du cation, donc le n.o. du fer
+II 0
Pb
+2
Pb
Fe(OH)
+HO
Fe(OH)
+1
( 2)
+II +III
BILAN :
2HO
+2Fe(OH)
+Pb
2Fe(OH)
+Pb
2) Lion tartrate est un anion organique qui ne participe pas loxydorduction. Sa charge est 2 (on le
note T
).
+II +I
2[CuT
+2
+2HO
Cu
O +4T
+H
O
CH
CHO +3HO
CH
CO
+2
+2H
O
+I (C de
laldhyde)
+III (C du
carboxylate)
BILAN :
5HO
+2[CuT
+CH
CHO Cu
O +4T
+CH
CO
+3H
O
3)
+V +VII
BrO
+2HO
BrO
+2
+H
O
F
+2
2F
0 I
BILAN :
2HO
+BrO
+F
BrO
+2F
+H
O
quilibres en solution aqueuse Exercice 25 Page 2 sur 2
4)
+VII +VI
MnO
+1
MnO
( 2)
MnO
+4HO
MnO
+2
+2H
O
+IV +VI
BILAN :
4HO
+2MnO
+MnO
3MnO
+2H
O
Remarque : Le sens 1 est une mdiamutation, le sens 2 une dismutation.
5)
0 I
I
+2
2I
AsO
+3HO
HAsO
+2
+2H
O
+III +V
BILAN :
3HO
+I
+H
AsO
2I
+HAsO
+2H
O
6)
+IV +III
ClO
+1
ClO
( 4)
C
+Ca
+6HO
CaCO
+4
+3H
O
0
+IV
(carbone)
BILAN :
6HO
+4ClO
+C +Ca
4ClO
+CaCO
+3H
O
Remarque : CaCO
est le carbonate de calcium (calcaire). Cest un solide ionique, constitu dions Ca
(le calcium, alcalino-terreux, est son nombre doxydation usuel +II) et dions carbonate CO
.
quilibres en solution aqueuse Exercice 26 Page 1 sur 2
Corrig exercice 26
TUDE DUNE PILE
On note :
ln10 = 0,059 V 298 K.
1) On applique la formule de Nernst pour dterminer les potentielsdlectrode :
lectrode de droite : Zn
+2
Zn
2
log = 0,78 V
lectrode de gauche : Ag
Ag
log = +0,76 V
>
: le ple + de la pile est donc llectrode de gauche (argent) et le ple llectrode de droite
(zinc).
La f..m. algbrique conventionnelle est :
= 1,54 V
La raction de fonctionnement scrit dans le sens de la rduction pour le couple de droite :
Zn
+2Ag
Zn +2Ag
2) Lorsquon ferme le circuit extrieur, les lectrons y circulent du ple (zinc) vers le ple +
(argent). Les lectrons sont donc librs par la raction Zn Zn
+2
. Le zinc est oxyd : cest
lanode.
La raction de fonctionnement volue donc spontanment dans le sens2.
Au cours du fonctionnement de la pile :
- lectrode de zinc : le zinc est consomm progressivement et la concentration en Zn
augmente. Si le mtal est en quantit insuffisante, alors il va spuiser avant les ions Ag
et
disparatre. Comme cest lui qui assure le contact avec le circuit extrieur, le circuit va
souvrir : la pile sarrte alors de fonctionner ! On supposera que ceci ne se produit pas, cest-
-dire que le zinc est en excs, sinon on ne pourrait pas traiter le problme.
Si le zinc reste prsent, alors le potentiel de llectrode volue progressivement selon la
formule de Nernst :
2
logZn
Comme la concentration en ions Zn
augmente mais ne peut pas changer dordre de
grandeur, on en dduit de cette expression logarithmique que
doit augmenter trs peu et
rester voisin de la valeur initiale de 0,78 V.
- lectrode dargent (cathode) : les ions Ag
sont rduits en argent mtallique qui se dpose
sur largent dj prsent. Le potentiel dlectrode vrifie :
log[Ag
]
Tant que la concentration en ions Ag
reste du mme ordre de grandeur,
reste voisin de la
valeur initiale +0,76 V.
Pendant la dure de vie de la pile, sa f..m. reste donc quasiment constante.
Mais lorsquelesionsAg
sontquasimentpuiss,alorsleurconcentrationchange
dordredegrandeur. En fin de vie de la pile,
chutebrusquement, car [Ag
] 0.
Lorsque la pile est rigoureusement use, sa f..m. est nulle, donc
.
Lexercice se traite alors comme un exercice de solutions aqueuses traditionnel : on suppose que la
raction de fonctionnement est quasi-totale lorsque la pile est use, on fait donc un bilan de matire en
quilibres en solution aqueuse Exercice 26 Page 2 sur 2
la considrant comme totale pour trouver la quantit dions Zn
, espce majoritaire.
Attention : les deux volumes sont diffrents, il faut imprativement faire le bilan de matire en quantit de
matire et non pas en concentrations !
La raction volue dans le sens 2 :
Zn
+ 2Ag Zn + 2Ag
apport 0,075 prsent excs 0,018
si totale 0,084 prsent prsent 0 (quantits de matire en mol)
La concentration de Zn
est alors :
Zn
=
0,084 mol
= 0,336 mol L
On trouve donc :
2
logZn
= 0,77 V
Comme prvu, ce potentiel dlectrode est quasiment inchang par rapport ltat initial.
Pour trouver la concentration rsiduelle en ions Ag
, et ainsi vrifier quon avait bien raison de
supposer la raction de fonctionnement comme quasi-totale, on utilise
pour la pile use, do :
log[Ag
] = 0,77 V [Ag
] = 10
, V
= 2,5 10
Il reste donc seulement 2,5 10
mol dion Ag
dans le compartiment de gauche lorsque la pile est
use !!! La raction de fonctionnement a donc bien t quasi-totale.
Remarque : cette anne, comme dans les chapitres prcdents, on recherche uniquement ltat final du
systme (la pile use). La cintique de lvolution, et donc la puissance que peut dlivrer la pile, dpendent
de nombreux paramtres, notamment la cintique des processus aux lectrodes et la nature de
llectrolyte support. Ces questions seront abordes en seconde anne dans le chapitre sur les courbes
intensit / potentiel.
quilibres en solution aqueuse Exercice 27 Page 1 sur 3
Corrig exercice 27
TUDE DUNE PILE COMBUSTIBLE AU MTHANOL
1) Les espces intervenant dans les couples redox sont soit des espces dissoutes soit des gaz. Il
faut donc utiliser des lectrodes inattaquables. On peut choisir pour cela un mtal noble permettant en
gnral des changes lectroniques rapides sa surface : le platine.
2) Dessin du montage :
tuyau apportant le gaz
dioxygne
bulles de dioxygne
solution aqueuse de mthanol
et dacide phosphorique
bulles de dioxyde de carbone
lorsque la pile dbite
lectrodes de platine
membrane
poreuse
solution aqueuse
dacide phosphorique
Daprs les renseignements fournis, llectrode de gauche est le sige de loxydation du mthanol : cest
donc lanode. Puisquune oxydation a lieu, le mthanol cde des lectrons dans le circuit extrieur.
Cest donc le ple ngatif de la pile.
Llectrode de droite est le sige de la rduction du dioxygne ; cest donc la cathode. Les lectrons
arrivent cet lectrode depuis le circuit extrieur pour permettre la rduction. Cest donc le ple
positif de la pile.
3) Reprsentation conventionnelle :
solution aqueuse solution aqueuse
Pt CO
(g)
CH
OH
(aq)
, H
O
(aq)
, H
O
(aq)
, H
PO
(aq)
O
(g)
Pt
H
PO
(aq)
4) lectrode de gauche : CH
OH+H
O CO
+6
+6H
lectrode de droite :
+2
+2H
O
Bilan de fonctionnement :
3
2
O
+CH
OH CO
+2H
O
Lorsque la pile fonctionne, la raction volue dans le sens direct. Il sagit donc bien dune oxydation du
mthanol par le dioxygne. Les ions H
crs dans la solution llectrode de gauche circulent ensuite
dans llectrolyte o ils sont consomms llectrode de droite. Ils participent ainsi la conduction du
courant lectrique lintrieur de la pile.
5) Lorsque la pile ne dbite pas (ou trs peu), la formule de Nernst est applicable chaque
lectrode.
quilibres en solution aqueuse Exercice 27 Page 2 sur 3
On note
ln 10 = 0,059 V 25.
On suppose les gaz parfaits pour remplacer leur activit par
(avec
= 1 bar exactement) et les
solutions assez dilues pour remplacer les activits des soluts par
[A
(avec
= 1
exactement).
lectrode de gauche :
(CO
(g)
/CH
OH
(aq)
) +
6
log
CO
[H
[CH
OH]
lectrode de droite :
(O
(g)
/H
O
()
) +
2
log
[H
6) En fonctionnement normal, la pile prsente une f..m.
non nulle.
Lorsque la pile est use, par exemple car le mthanol est puis, la f..m. sannule. La raction de
fonctionnement ne peut plus alors avancer spontanment, ni dans le sens direct ni dans le sens
indirect : cest une situation dquilibre chimique.
On exprime donc qu lquilibre :
= 0
(CO
(g)
/CH
OH
(aq)
) +
6
log
CO
[H
[CH
OH]
(O
(g)
/H
O
()
) +
2
log
[H
6
log
CO
[H
[CH
OH]
[H
(O
(g)
/H
O
()
)
(CO
(g)
/CH
OH
(aq)
)
6
log
CO
[CH
OH]
=
(O
(g)
/H
O
()
)
(CO
(g)
/CH
OH
(aq)
)
On reconnat sous le logarithme la constante dquilibre de la raction de fonctionnement :
6
log() =
(O
(g)
/H
O
()
)
(CO
(g)
/CH
OH
(aq)
)
Finalement :
= 10
(O
(g)
/H
O
()
)
(CO
(g)
/CH
OH
(aq)
)
7) La charge dbite par la pile vaut :
=
Ceci correspond la circulation dune quantit dlectrons :
Or daprs la demi-quation de llectrode de gauche, une mole de mthanol consomm libre 6 moles
dlectrons dans le circuit extrieur. La quantit totale de mthanol consomm est donc :
quilibres en solution aqueuse Exercice 27 Page 3 sur 3
=
6
=
6
= 6,2 10
mol
Ceci correspond une masse de mthanol :
= = 20 mg
8) Oxydation du mthanol en acide mthanoque :
CH
OH+H
O HCOOH +4
+4H
On voit que cette raction ne libre que 4 moles dlectrons par mole de mthanol consomm, contre 6
pour la transformation en CO
.
9) Si du mthanol traverse la membrane, il peut se retrouver oxyd directement par le dioxygne
au niveau de llectrode de droite, sans entraner de passage de courant lectrique dans le circuit
extrieur. Cest donc une perte nette de mthanol, le rendement de la pile baisse
quilibres en solution aqueuse Exercice 28 Page 1 sur 3
Corrig exercice 28
MDIAMUTATION DU MANGANSE
On note :
ln10 = 0,059 V 298 K.
1) Diagramme de stabilit du manganse pH = 0
On recense les diffrentes espces du manganse qui interviennent et on les classe par leur nombre
doxydation :
+VII MnO
+IV MnO
+II Mn
MnO
tant un solide, on va rechercher ses frontires dexistence
dans le couple MnO
/MnO
dune part, et
dans le couple MnO
/Mn
dautre part.
On choisit une valeur de concentration de trac qui corresponde la situation de la question 3). La
concentrationmaximaletotalequelonpeutatteindreenlmentmanganseensolution est la
somme de toutes les concentrations apportes en lment manganse. Comme on mlange 10,0 mL de
MnSO
0,100 L
avec 10,0 mL de KMnO
0,100 L
=
10 0,100 +10 0,100
20
= 0,100 molL
Couple MnO
/MnO
:
MnO
+4H
+ 3
MnO
+ 2H
O
La formule de Nernst est applicable si MnO
est prsent :
=
3
log[MnO
]
H
H
= 1 car pH = 0.
la frontire dexistence de MnO
, les ions en solution atteignent la concentration de trac, donc
= [MnO
] +[Mn
] [MnO
] si on suppose que Mn
est en concentration ngligeable cet
endroit.
On trouve donc :
3
log(
) = 1,68 V
Couple MnO
/Mn
:
MnO
+ 4H
+2
Mn
+2H
O
La formule de Nernst est applicable si MnO
est prsent :
=
2
log
H
Mn
H
= 1 car pH = 0.
la frontire dexistence de MnO
, les ions en solution atteignent la concentration de trac, donc
= [MnO
] +[Mn
] [Mn
] si on suppose que MnO
est en concentration ngligeable cet
endroit.
On trouve donc :
2
log
1
= 1,26 V
quilibres en solution aqueuse Exercice 28 Page 2 sur 3
1,68
1,26
frontires
d'existence
de MnO
2
Comme
>
, MnO
prsente bien un domaine dexistence, cest une espce stable.
Remarque : si on trouvait
>
cela signifierait que MnO
se dismute totalement et ne peut exister.
Il faudrait alors tracer le diagramme de prdominance du couple MnO
/Mn
.
On vrifie les hypothses :
En =
, lunicit du potentiel 1,68 V =
log
Mn
permet de calculer
Mn
= 5,6 10
molL
, qui est bien ngligeable devant
.
En =
, lunicit du potentiel 1,26 V =
log([MnO
]) permet de calculer
[MnO
] = 4,2 10
molL
, qui est bien ngligeable devant
.
On peut alors tracer le diagramme :
/V
MnO
MnO
Mn
diagrammedestabilitdumanganse
pH = etpour
= ,
2) On applique la relation barycentrique de loxydorduction :
Couple MnO
/MnO
(n.o. +VII/+IV) :
= 3 lectrons changs par manganse
Couple MnO
/Mn
(n.o. +IV/+II) :
= 2 lectrons changs par manganse
Couple MnO
/Mn
(n.o. +VII/+II) :
= 5 lectrons changs par manganse
On trouve donc :
5
= 3
+2
=
3
+2
5
= 1,51 V
3) La raction qui se produit entre espces apportes (loxydant MnO
et le rducteur Mn
) est :
2MnO
+3Mn
+2H
O 5MnO
+4H
: cest une mdiamutation (on la note RM).
On voit sur le diagramme dexistence du 1) que MnO
et Mn
sont dans des domainesdisjoints : la
raction de mdiamutation (RM) est donc trs probablement quasi-totale.
On fait alors le bilan de matire de la raction en la considrantcommetotale.
Les ions H
(H
) ne sont pas concerns par le bilan car on nous dit que le pH est 0 pendant toute
lexprience : les ions H
sont donc en grand excs et leur variation relative est ngligeable.
Attention aux nombres stchiomtriques pour le bilan de matire !
quilibres en solution aqueuse Exercice 28 Page 3 sur 3
(RM) 2MnO
+ 3Mn
+2H
O 5MnO
+ 4H
apport 0,050 0,050 absent excs
raction totale 0,0167 0 prsent excs
(concentrations en
)
La solution est donc quivalente une solution de concentration apporte
MnO
= 0,0167
surmontant le prcipit MnO
.
Daprs le diagramme, un tel systme est alors stable, le potentiel dquilibre doit se trouver trs
proche de la frontire du couple MnO
/MnO
, lintrieur du domaine dexistence de MnO
(ce qui
revient dire que la dismutation de MnO
, inverse de la raction (RM), est trs peu avance).
On postule donc que la concentration de MnO
lquilibre est :
[MnO
] = 0,0167
On en dduit le potentiel dlectrode (la loi de Nernst est applicable au couple MnO
/MnO
car MnO
est prsent) :
=
3
log[MnO
]
H
= 1,67 V
(on prend
H
= 1 car pH = 0).
Par unicit du potentiel, on en dduit [Mn
] par lautre couple :
=
2
log
H
Mn
= 1,67 V
[Mn
] = 1,8 10
[Mn
] est donc bien ngligeable devant [MnO
] lquilibre.
Pour trouver la quantit de MnO
forme, il faut faire le bilan de matire de la raction (RM) en
quantit de matire. Or on a dj calcul lavancement volumique pour le bilan de matire en
concentrations, il faut donc multiplier par le volume
= 20,0 mL pour obtenir
lavancement : =
.
Quantit de MnO
forme :
= 5 = 5
= 5
0,050
3
= 1,67 10
mol
Il reste multiplier par la masse molaire = 86,9
:
= = 0,145 g de MnO
form.
quilibres en solution aqueuse Exercice 29 Page 1 sur 4
Corrig exercice 29
MLANGES DOXYDANTS ET DE RDUCTEURS DLMENTS MTALLIQUES
On note :
ln10 = 0,059 V 298 K.
On trace tout dabord les diagrammes de prdominance/existence pour les trois lments
mtalliques : crium, cobalt et chrome.
Pour les couples Ce
/Ce
, Co
/Co
et Cr
/Cr
, il sagit de frontires de prdominance ;
dans les trois cas, la demi-quation lectronique est de la forme Ox +1
Red, o Ox et Red
sont des cations dissous, donc le potentiel de solution scrit : =
log
[Ox]
[Red]
.
la frontire de prdominance, [Ox] = [Red], donc
.
Pour le couple Co
/Co (et de mme pour Cr
/Cr), il sagit dune frontire dexistence ; la
demi-quation lectronique est ici Co
+2
Co. On tablit donc en prsence du mtal :
=
log[Co
].
la frontire dexistence, le mtal disparat. Lintgralit du cobalt dissous atteint donc la
concentration de trac : [Co
] +[Co
] =
. On peut faire lhypothse que cette frontire
se situera trs nettement en-dessous de la frontire de prdominance du couple Co
/Co
,
donc dans ce cas, [Co
] [Co
] et [Co
. Finalement :
.
Dans les questions 1 et 2, on constate que
= ,
aussi bien pour le cobalt que
pour le chrome (concentration maximale que peut atteindre llment en solution sil se
dissout intgralement).
/V
Co
Ce
1,92
1,72
Co
Cr
Ce
0,31
0,41
Cr
Co 0,94
Cr
Cet exercice se rsout par la mthode de la raction prpondrante, exactement comme dans les
autres chapitres de solutions aqueuses. Tant quon trouve des espces domaines disjoints, on traite
leur raction comme totale pour transformer le problme en un problme quivalent se rapprochant
de ltat dquilibre.
Lorsque tous les domaines sont compatibles, on postule que les concentrations des espces
majoritaires ne devraient plus gure voluer et on calcule les concentrations des espces minoritaires
pour valider cette hypothse.
quilibres en solution aqueuse Exercice 29 Page 2 sur 4
1) On apporte :
Cr : 0,10 mol + Co : 0,10 mol +
Ce
= 0,80
En entourant ces espces apportes sur le diagramme, on constate que Ce
et Cr ont les domaines les
plus disjoints. On prvoit donc la raction quasi-totale :
Cr +2Ce
Cr
+2Ce
En la considrant comme totale, un bilan de matire montre que le systme est quivalent un
mlange :
Cr
= 0,10
+ Co : 0,10 mol +
Ce
= 0,60
+
Ce
= 0,20
En entourant ces espces sur le diagramme, on constate que Ce
et Cr
ont les domaines les plus
disjoints. On prvoit donc la raction quasi-totale :
Cr
+Ce
Cr
+Ce
En la considrant comme totale, un bilan de matire montre que le systme est quivalent un
mlange :
Cr
= 0,10
+ Co : 0,10 mol +
Ce
= 0,50 m
+
Ce
= 0,30
En entourant ces espces sur le diagramme, on constate que Ce
et Co ont des domaines disjoints. On
prvoit donc la raction quasi-totale :
Co +2Ce
Co
+2Ce
En la considrant comme totale, un bilan de matire montre que le systme est quivalent un
mlange :
Cr
= 0,10
+
Co
= 0,10
+
Ce
= 0,30
+
Ce
= 0,50
Toutes ces espces peuvent alors coexister daprs le diagramme.
On est donc trs proche de ltat dquilibre et on fait lhypothse que les espces majoritaires
nvoluent quasiment plus :
[Cr
] = 0,10
[Co
] = 0,10
[Ce
] = 0,30
[Ce
] = 0,50
Il reste calculer les concentrations des espces minoritaires pour vrifier quelles sont bien
ngligeables et valider les concentrations ci-dessus.
On utilise pour cela lunicit du potentiel de la solution lquilibre.
On calcule tout dabord le potentiel dquilibre avec le couple Ce
/Ce
puisquon connat les
concentrations des deux ions (quivalent dun tampon en acido-basicit) :
=
log
0,30
0,50
= +1,71 V
On peut alors accder [Co
] par lunicit du potentiel :
= +1,71 V=
log
Co
,
Co
= 2,4 10
molL
et [Cr
] de mme :
= +1,71 V=
log
,
[Cr
]
Cr
= 1,2 10
molL
Ces deux concentrations sont bien ngligeables devant celles des espces majoritaires, ce qui valide le
rsultat.
Les mtaux Co et Cr sont rigoureusement absents,
puisque = +1,71 V nest pas dans leur domaine dexistence.
quilibres en solution aqueuse Exercice 29 Page 3 sur 4
2) On apporte :
Cr : 0,10 mol + Co : 0,10 mol +
Ce
= 0,45
En entourant ces espces apportes sur le diagramme, on constate que Ce
et Cr ont les domaines les
plus disjoints. On prvoit donc la raction quasi-totale :
Cr +2Ce
Cr
+2Ce
En la considrant comme totale, un bilan de matire montre que le systme est quivalent un
mlange :
Cr
= 0,10
+ Co : 0,10 mol +
Ce
= 0,25
+
Ce
= 0,20
En entourant ces espces sur le diagramme, on constate que Ce
et Cr
ont les domaines les plus
disjoints. On prvoit donc la raction quasi-totale :
Cr
+Ce
Cr
+Ce
En la considrant comme totale, un bilan de matire montre que le systme est quivalent un
mlange :
Cr
= 0,10
+ Co : 0,10 mol +
Ce
= 0,15
+
Ce
= 0,30
En entourant ces espces sur le diagramme, on constate que Ce
et Co ont des domaines disjoints. On
prvoit donc la raction quasi-totale :
Co +2Ce
Co
+2Ce
En la considrant comme totale, un bilan de matire montre que le systme est quivalent un
mlange :
Cr
= 0,10
+ Co : 0,025 mol +
Co
= 0,075
+
Ce
= 0,45
Toutes ces espces peuvent alors coexister daprs le diagramme.
On est donc trs proche de ltat dquilibre et on fait lhypothse que les espces majoritaires
nvoluent quasiment plus :
[Cr
] = 0,10
[Co
] = 0,075
[Ce
] = 0,45
Co : 0,025 mol
Il reste calculer les concentrations des espces minoritaires pour vrifier quelles sont bien
ngligeables et valider les concentrations ci-dessus.
On utilise pour cela lunicit du potentiel de la solution lquilibre.
On calcule tout dabord le potentiel dquilibre avec le couple Co
/Co puisquon connat [Co
] et
quil reste du cobalt mtallique. La formule de Nernst est donc applicable :
=
2
log 0,075 = 0,31 V
On peut alors accder [Cr
] par lunicit du potentiel :
= 0,31 V=
log
,
[Cr
]
Cr
= 2,0 10
molL
Cette concentration est tout juste ngligeable (environ 40 fois par rapport [Co
]) ; cela est
acceptable mais ne garantit pas le chiffre 5 dans [Co
] = 0,075
(ce serait plutt 0,076),
ce qui na pas de consquence sur la valeur numrique de .
Remarque : la raction peu avance qui cre Cr
est : Co +2Cr
Co
+2Cr
, de constante
= 4 10
, pas si petite que cela).
Les autres concentrations ne posent pas de problme :
quilibres en solution aqueuse Exercice 29 Page 4 sur 4
= 0,31 V =
log
Co
,
Co
= 1,2 10
molL
= 0,31 V =
log
[Ce
]
,
Ce
= 1,8 10
molL
Le mtal chrome est rigoureusement absent,
puisque = 0,31 V nest pas dans son domaine dexistence.
quilibres en solution aqueuse Exercice 30 Page 1 sur 2
Corrig exercice 30
MLANGES PROCHES DE LQUILIBRE
On note :
ln10 = 0,059 V 298 K.
1) Les ions apports sont compatibles car Cr
est un bien moins bon oxydant que Hg
, comme on
le voit sur lchelle des potentiels standard :
Hg
+0,91 V Hg
Cr
0,41 V Cr
On prvoit donc que la raction doxydorduction est trs peu avance :
Hg
+ 2Cr
2Hg
+ 2Cr
apports 0,30 0,10 0 0
quilibre 0,30 0,10 2 2 (concentrations en
)
On postule que les concentrations des espces apportes voluent trs peu et quon conserve
lquilibre :
Hg
= 0,30 molL
Cr
= 0,10 molL
Pour calculer lavancement volumique et vrifier ainsi lhypothse, on peut calculer la constante
dquilibre (crire lunicit du potentiel de Nernst pour le systme lquilibre pour tablir
= 10
) et appliquer =
()
,,
.
Il est cependant plus lgant dutiliser directement lunicit du potentiel ainsi :
=
log
0,10
2
=
2
log
4
0,30
=
log
2
0,30
On voit quil suffit dajouter ces deux expressions pour faire disparatre linconnue :
2 =
log
0,10
0,30
On en dduit le potentiel de Nernst :
=
2
+
2
log
0,10
0,30
= 0,23 V
On revient alors aux expressions de Nernst pour tablir :
Hg
= Cr
= 2 = 1,5 10
molL
Ces concentrations sont bien ngligeables devant celles des espces majoritaires, le rsultat est valide.
quilibres en solution aqueuse Exercice 30 Page 2 sur 2
2) Ici aussi, les espces apportes sont compatibles car I
est un moins bon oxydant que Br
Br
+1,09 V Br
+0,61 V I
Rappel : le classement des halognes par pouvoir oxydant croissant (I
< Br
< Cl
< F
) a t vu en TP-
cours datomistique en dbut danne. Cest une illustration de laugmentation de llectrongativit
quand on monte dans une colonne du tableau priodique.
On prvoit donc que la raction doxydorduction est trs peu avance :
I
+ 2Br
2I
+ Br
apports 0,030 0,050 0 0
quilibre 0,030 0,050 2 (concentrations en
)
On postule que les concentrations des espces apportes voluent trs peu et quon conserve
lquilibre :
[I
] = 0,030 molL
[Br
] = 0,050 molL
Pour calculer lavancement volumique et vrifier ainsi lhypothse, on peut calculer la constante
dquilibre (crire lunicit du potentiel de Nernst pour le systme lquilibre pour tablir
= 10
) et appliquer =
()
,,
.
Il est cependant plus lgant dutiliser directement lunicit du potentiel ainsi :
=
2
log
0,030
(2)
2
log
0,050
On voit quil faut ajouter la premire expression deux fois la deuxime pour faire disparatre
linconnue :
3 =
+2
2
log
0,030
4 0,050
On en dduit le potentiel de Nernst :
=
3
+
6
log
0,030
4 0,050
= 0,96 V
On revient alors aux expressions de Nernst pour tablir :
[Br
] = = 1,0 10
[I
] = 2 = 2,0 10
molL
Ces concentrations sont bien ngligeables devant celles des espces majoritaires, le rsultat est valide.
quilibres en solution aqueuse Exercice 31 Page 1 sur 3
Corrig exercice 31
SYSTMES DU CHLORE
On note :
ln10 = 0,0592 V 298 K.
1) On commence par remarquer qu pH = 2,0, on est trs largement dans le domaine de
prdominance acido-basique de HClO face ClO
. On peut prciser :
[ClO
]
[HClO]
= 10
pHp
= 10
,
On peut donc ngliger compltement lespce ClO
HClO/Cl
1,615 V
Cl
/Cl
1,395 V
On voit que le seul rducteur apport est Cl
. Le seul oxydant apport dun autre couple tant aussi Cl
,
la seule raction que lon peut crire entre espces apportes est la dismutation de Cl
:
Cl
+H
O HClO +Cl
+H
=
[HClO][Cl
][H
]
[Cl
]
n.o. Cl : 0 +I I
Comme
(Cl
/Cl
) <
(HClO/Cl
) , on prvoit que la raction aura une constante dquilibre
infrieure 1.
Pour calculer cette constante dquilibre, on considre un systme lquilibre et on exprime lunicit
du potentiel.
Couple Cl
/Cl
: Cl
+2
2Cl
Couple HClO/Cl
: 2HClO +2H
+2
Cl
+2H
O
Rappel : les
tant conventionnellement donns pH = 0, on a utilis la particule H
pour quilibrer
les demi-quations afin dappliquer la formule de Nernst ainsi :
2
log
[Cl
]
[Cl
2
log
[HClO]
[H
[Cl
]
dont on tire :
log
, donc :
= 10
= 1,92 10
On demande ensuite de dterminer les concentrations lquilibre. On fait donc le bilan de matire de
la raction, en appelant x lavancement volumique :
Cl
+ H
O HClO + Cl
+ H
apport 0,050 0,050 0 10
,
quilibre 0,050 0,050 + 10
,
(concentrations en
)
Remarque : la solution est tamponne . La concentration en H
est maintenue constante dans toute
cette partie par un couple A/B de p
voisin de 2, de nature non prcise.
A priori, la raction de dismutation est peu avance.
quilibres en solution aqueuse Exercice 31 Page 2 sur 3
On peut sy attendre car 1, ou bien on peut utiliser un argument du type rgle du gamma ;
cependant, il faut sen mfier ici car on rappelle que les
sont donns conventionnellement pH = 0 et
quon est ici pH = 2.
On peut donc tenter lhypothse 0,050
(cest--dire concentrations en Cl
et HClO quasi
inchanges lquilibre), ce qui entrane :
,
,
,
= 1,92 10
, soit = 0,019
:
hypothse non valide !
Donc nest pas ngligeable et il faut rsoudre lquation du deuxime degr issue de :
(0,050 +) 10
,
0,050
= 1,92 10
La rsolution donne : = 1,2 10
.
Finalement :
[Cl
] = 0,012
[HClO] = 0,062
[Cl
] = 0,038
Pour trouver le potentiel de Nernst, on utilise lun ou lautre couple.
Les deux formules de Nernst donnent :
= 1,467 V
Cet exercice montre que le dichlore est une espce stable en milieu acide, elle se dismute trs peu.
Pour diminuer encore la dismutation, il faut augmenter la quantit de H
pour dplacer lquilibre
dans le sens de la mdiamutation. Il faut donc diminuer le pH.
2) Dans le cas o la solution nest pas tamponne, la concentration en H
nest plus constante et
doit tre prise en compte dans le bilan de matire. Le pH ne pouvant que diminuer, on en sr que
lespce ClO
sera toujours absolument ngligeable.
Cl
+ H
O HClO + Cl
+ H
apport 0,050 0,050 0 0,010
quilibre 0,050 0,050 + 0,010 + (concentrations en
)
La mise en quation donne une quation du troisime degr rsoudre :
(0,050 +) (0,010 +)
0,050
= 1,92 10
+0,06
+6,92 10
9,6 10
= 0
Une rsolution numrique donne = 0,0078
, soit :
[Cl
] = 0,0078 molL
[HClO] = 0,0578 molL
[Cl
] = 0,00422 molL
[H
] = 0,0178
(pH = 1,7)
Pour trouver le potentiel de Nernst, on utilise lun ou lautre couple.
Les deux formules de Nernst donnent :
= 1,473 V
La dismutation est moins avance qu la question prcdente, car elle conduit un abaissement du
pH. Leau de chlore est une solution acide.
quilibres en solution aqueuse Exercice 31 Page 3 sur 3
3) La concentration apporte de HO
est de
= 200 molL
. Ceci est un trs large excs par
rapport toutes les autres concentrations apportes : on peut donc prvoir que le milieu final sera
encore largement basique, et donc que cette fois-ci lespce prdominante sera ClO
.
Dans cette solution, on introduit HClO et Cl
: HClO, acide, ragit de manire quasi totale avec HO
. Il
faut galement crire la dismutation de Cl
, cette fois en milieu basique :
Les deux ractions sont donc :
HClO +HO
ClO
+H
= 10
,
Cl
+2HO
ClO
+Cl
+H
= 10
,
(o est la constante de la question prcdente)
Daprs les constantes trouves, les deux ractions sont trs avances : on peut les prvoir quasi
totales. En milieu basique, le dichlore se dismute fortement !
HO
est bien en excs. Le bilan de ces deux ractions considres comme TOTALES donne un
systme quivalent :
ClO
= 0,100
Cl
= 0,050
HO
= 0,050
Il ny a alors plus de raction trs avance. On peut supposer que les espces majoritaires ci-dessus ne
verront plus leur concentration varier (les ractions que lon a considr totales le sont bien
quasiment).
On conserve dans ce cas :
[ClO
] = 0,100 molL
[Cl
] = 0,050 molL
[HO
] = 0,050 molL
Pour vrifier cela, on calcule les concentrations des espces minoritaires.
H
0,050
= 2,0 10
molL
[HClO] =
[H
][ClO
= 6,8 10
[Cl
] =
[ClO
][Cl
[HO
= 3,6 10
Conclusion : les espces minoritaires sont bien en concentration ngligeable devant les espces
majoritaires, ce qui valide le rsultat.
On trouve alors le potentiel de Nernst de la solution :
= 0,985 V
Dans les questions 1 et 2, on avait vu que le dichlore tait stable en milieu acide. En revanche, on
saperoit quil se dismute quasi-totalement en milieu basique en ClO
et Cl
. Une solution de chlore
dans la soude porte le nom courant deau de Javel. Cest en fait une solution dhypochlorite de sodium
ClO
, Na
et de chlorure de sodium Cl
, Na
.
Elle est oxydante cause de lion hypochlorite, qui contient llment chlore au degr doxydation +I.
Comme vous le savez sans doute, il ne faut jamais mettre de leau de Javel en prsence dun acide (par
exemple un dtartrant). Ceci est clairement indiqu sur toutes les bouteilles deau de Javel. En effet, en
milieu acide, cest la raction de mdiamutation qui est favorise (question a). Leau de Javel donne
donc de grandes quantits de dichlore en milieu acide. Comme celui-ci est peu soluble dans leau, il se
dgage dans latmosphre : le dichlore est un gaz trs toxique, irritant et suffocant !
quilibres en solution aqueuse Exercice 32 Page 1 sur 2
Corrig exercice 32
SOLUBILIT DU BROMURE DARGENT EN PRSENCE DE CRIUM (IV)
1) Dissolution de AgBr dans leau pure
AgBr
(s)
Ag
+ Br
(1)
apport excs 0 0
quilibre solution
sature
prsent (concentrations)
On a donc immdiatement :
La solubilit vaut donc :
=
= 7,1 10
molL
2) Dissolution de AgBr dans une solution contenant des ions Ce
Les ions Br
, librs lors de la dissolution de AgBr, peuvent tre oxyds par lion Ce
, comme on le
voit sur lchelle des potentiels standard :
Ce
/Ce
1,72 V
Br
/Br
1,10 V
Lquation chimique est :
Ce
+Br
Ce
+
1
2
Br
(2)
On peut prvoir que cette raction (2) sera trs avance : Br
ne peut presque pas coexister avec Ce
,
il y a plus de 0,6 V dcart entre les couples.
La constante dquilibre de (2) vaut
= 10
= 10
,
1.
Laractionprpondrantededissolutionestdonclasommedesractions(1)et(2) (notez la
similitude de raisonnement avec le cas des sels basiques vus lexercice calculs de solubilits ) :
AgBr
(s)
+ Ce
Ag
+ Ce
+
1
2
Br
(3)
apport excs 0,10 0 0 0
quilibre solution
sature
prsent 0,10
2
(concentrations en
)
On peut calculer
= 10
,
.
On trouve
< 1, donc AgBr est un sel peu soluble, mme en prsence de crium (IV), car la raction
(2) nest pas suffisante pour entraner la dissolution de AgBr.
Si on postule alors 0,10
, on obtient
,
=
, qui donne
= 0,102
, soit
= 0,087
qui nest pas ngligeable devant 0,10
!
Il faut donc rsoudre :
quilibres en solution aqueuse Exercice 32 Page 2 sur 2
2
0,10
=
Cette quations scrit :
2 0,102
= 0
Une rsolution numrique donne :
= 0,060 molL
On peut alors donner le potentiel de Nernst de la solution. Par lun ou lautre couple, on trouve :
= 1,71 V
Validit : on trouve
[Br
] =
= 8,4 10
Cette concentration est bien compltement ngligeable devant : (3) est bien largement
prpondrante sur (1).
quilibres en solution aqueuse Exercice 33 Page 1 sur 3
Corrig exercice 33
COUPLES DU COBALT DANS LAMMONIAC
On note :
ln10 = 0,06 V = 298 K
= 1 bar exactement la pression standard
= 1
exactement la concentration unitaire
1) Le couple Co
III
/Co
II
sexprime avec les ions Co
et Co
libres en solution aqueuse par la demi-
quation :
Co
Co
Do le potentiel de Nernst dune solution contenant ces ions :
=
log
[Co
]
[Co
]
(1)
Lorsquon se trouve en milieu ammoniacal, cest--dire en prsence dun excs dammoniac, les ions du
cobalt se trouvent complexs presque totalement.
Le potentiel de Nernst peut toujours scrire avec la relation (1), mais elle nest pas trs utile, puisque
les concentrations des ions libres sont infimes et nont rien voir avec les concentrations relles des
tats doxydation III et II du cobalt, qui sont en fait les concentrations des complexes.
On cherche alors crire le potentiel de la manire suivante :
=
,
log
[Co(NH
[Co(NH
(2)
ce qui dfinit le potentiel standard apparent (tout se passe comme si on avait un couple Co
III
/Co
II
dions libres mais qui aurait
,
et non plus
comme potentiel standard).
Lexpression de
,
sobtient tout naturellement en crivant lunicit du potentiel, que lon utilise
lexpression (1) ou lexpression (2) :
=
,
log
[Co(NH
[Co(NH
log
[Co
]
[Co
]
Do :
log
[Co
][Co(NH
[Co
][Co(NH
Lnonc fournit les constantesdedissociationglobales des complexes, dexpressions :
=
Co
[NH
[Co(NH
et
=
Co
[NH
[Co(NH
On en dduit :
log
[NH
Finalement :
(p
) +2
pNH
Numriquement :
= (0,10 V) +(0,118 V) pNH
quilibres en solution aqueuse Exercice 33 Page 2 sur 3
Pour des concentrations voisines de la molarit en ammoniac, on voit que le potentiel apparent est de
0,10 V. Cette valeur, bien plus faible que
= 1,92 V, montre que la complexation stabilise (rend
moins ractif) beaucoup plus le cobalt III que le cobalt II, ce que lon pouvait prvoir en comparant les
valeurs des p
: [Co(NH
est beaucoup plus difficile dissocier que [Co(NH
).
Notons que la demi-quation lectronique reprsentant mieux le couple Co
III
/Co
II
est alors :
[Co(NH
[Co(NH
+2NH
2) En observant les potentiels standard
et
des deux couples mis en jeu, on pourrait penser
quaucune raction nest possible significativement entre le dioxygne et le cobalt II.
Cependant, on a vu la question prcdente que la complexation modifiait compltement les
proprits oxydorductrices du couple Co
III
/Co
II
.
Il en va de mme pour le pH dans le couple O
/H
O, puisquon rappelle que
est le potentiel
standard pH = 0, mais ici, en milieu ammoniacal, on en en milieu trs basique !
Pour savoir si une raction est possible, on va donc utiliser les potentielsstandardapparentsdes
deuxcouplesconcerns, dans les conditions de pH et de pNH
o les espces sont introduites.
Ces conditions sont les suivantes :
[NH
] = 5
pNH
0,7
Une solution aqueuse dammoniac 5
est basique. La formule des bases faibles donne :
pH = 11,9 (valide car 11,9 > 9,2 = p
+1).
Couple Co
III
/Co
II
dans lammoniac 5
= (0,10 V) +(0,118 V) pNH
= +0,02 V
Couple O
/H
O :
O
+4H
+4
2H
O
=
4
log
pH+
4
log
Do le potentiel apparent :
pH
Donc pH = 11,9, on trouve :
= +0,52 V
Finalement, on voit que dans ces conditions, le dioxygne est un bien meilleur oxydant que le cobalt
(III) car
,
>
,
. On peut donc prvoir une raction quasi-totale doxydation du cobalt II par le
dioxygne.
On crit alors lquation chimique de cette raction.
Lquation quilibre en H
ne convient pas pour un bilan de matire, car H
nest pas une espce
apporte.
Il faut donc quilibrer lquation avec HO
et on obtient :
O
+4[Co(NH
+8NH
+2H
O 4[Co(NH
+4HO
On ralise alors un bilan de matire en considrant la raction comme totale. Le problme est alors
quivalent une solution o on aurait apport :
[Co(NH
]
= 0 (ractif limitant puis)
[Co(NH
]
= 0,20
NH
= 4,8
HO
= 0,10
quilibres en solution aqueuse Exercice 33 Page 3 sur 3
La pression partielle de O
reste gale 0,2 bar dans tout lexercice, car on suppose que lon fait
barboter de lair en continu dans la solution.
Conclusion : si on suppose quil ny a plus que des ractions trs peu avances, on connat maintenant
les concentrations des espces majoritaires, trs peu modifies par rapport aux concentrations
prcdentes :
[Co(NH
= 0,20 molL
[NH
] = 4,8 molL
pNH
0,7
[HO
] = 0,10 molL
pH = 13,0
On peut en dduire le potentiel de Nernst par le couple O
/H
O :
=
pH+
4
log
= +0,44 V
Validit:ilfautvrifierquetouteslesautresespcesontdesconcentrationsngligeables.
La concentration [Co(NH
sobtient par lunicit du potentiel de Nernst :
=
,
log
[Co(NH
[Co(NH
= +0,44 V
Or
,
= (0,10 V) +(0,118 V) pNH
= +0,02 V, on en dduit :
[Co(NH
= 2,0 10
molL
Cette concentration est bien ngligeable devant toutes les autres espces : on pouvait donc bien
ngligerlinversedelaRPquasi-totale.
[NH
] =
10
4,8
10
,
= 7,6 10
Cette valeur est ngligeable devant [HO
] = 0,10 molL
, ce qui montre que la raction de
lammoniac sur leau est ngligeable.
Ilnestplusquestionicidutiliserlaformuledesbasesfaibles!Lasolutionestquivalenteunmlange
delabasefaibleNH
avec la base forte HO
qui impose son pH.Laractiondoxydationaprovoqu
unefortelibrationdionsHO
.
Enfin, on peut utiliser
et
pour vrifier que les ions libres sont compltement ngligeables :
Co
= 1,6 10
molL
Co
= 9,5 10
molL
pas de problme !
quilibres en solution aqueuse Exercice 34 Page 1 sur 2
Corrig exercice 34
DTERMINATION DUN PRODUIT DE SOLUBILIT PAR POTENTIOMTRIE
1) Une lectrode dargent plongeant dans une solution contenant des ions Ag
prend un potentiel
de Nernst, en volts et 25 :
=
+0,059logAg
Dans le bcher de droite, la concentration apporte en Ag
est de , et rien ne modifie cette
concentration, donc cest aussi la concentration dquilibre :
+0,059log
Bien se rappeler quen potentiomtrie intensit nulle, le circuit extrieur est ouvert. Cest une mthode
analytique qui ne modifie en rien les concentrations dans les compartiments.
2) Le pont salin est un milieu trs conducteur par voie ionique, qui permet aux deux potentiels
lectriques des solutions de sgaler. Grce au pont salin, lensemble des deux solutions et du pont
salin forme un milieu de potentiel lectrique
unique. Ainsi, la f..m. mesure est la simple diffrence
des potentiels de Nernst dus aux d.d.p. aux interfaces de chaque lectrode :
Remarques :
Il nexiste pas de pont salin parfait, il subsiste toujours un potentiel de jonction entre les deux solutions,
mais les ions du pont sont choisis pour la minimiser et on la considre ngligeable (infrieure au centime
de volt).
Si le circuit extrieur tait ferm (ce nest pas le cas ici !), le pont salin permettrait galement le passage
du courant lectrique entre les deux solutions (fermeture du circuit).
3) Reprsentation conventionnelle :
K
, Cl
Ag trace de Ag
Ag
, NO
Ag
trace de AgCl
4) On a apport une trace dions Ag
dans le becher de gauche, ce qui a provoqu un lger trouble
d lapparition du prcipit AgCl. La solution de gauche est donc sature en AgCl et on peut
appliquer le
= Ag
[Cl
La concentration dquilibre en Cl
peut tre considre comme toujours gale , puisque la quantit
qui a prcipit est ngligeable : [Cl
= .
La concentration dquilibre de Ag
est dtermine par la mesure potentiomtrique. En effet :
+0,059log
+0,059logAg
= 0,059log
Ag
.
On trouve donc :
Ag
= 10
,
= 4,4 10
mol L
.
Finalement :
= Ag
[Cl
= 2,2 10
quilibres en solution aqueuse Exercice 34 Page 2 sur 2
5) Lorsque AgCl et largent mtallique sont prsents dans une solution, il y a deux expressions
possibles du potentiel de Nernst pour le couple Ag
I
/Ag
, selon la demi-quation quon considre :
Couple Ag
/Ag : =
+0,059log[Ag
]
Couple AgCl/Ag : =
(AgCl/Ag) +0,059log
[Cl
]
(car la demi-quation est alors : AgCl +
Ag +Cl
)
Par unicit du potentiel, ces deux expressions donnent la mme valeur, donc :
+0,059log[Ag
] =
(AgCl/Ag) +0,059log
1
[Cl
]
On trouve alors :
(AgCl/Ag) =
+0,059log[Ag
] +0,059log
1
[Cl
]
Finalement :
(AgCl/Ag) =
+0,059log
= 0,23 V
On trouve
(AgCl/Ag) <
(Ag
/Ag), ce qui illustre le fait que AgCl est moins oxydant que lion libre
Ag
, ce qui tait prvisible car dans AgCl largent (I) est emprisonn dans un prcipit trs peu soluble.
quilibres en solution aqueuse Exercice 35 Page 1 sur 4
Corrig exercice 35
TITRAGE REDOX SUIVI PAR POTENTIOMTRIE
On note :
ln10 = 0,059 V 25.
1) Maintenir le pH 0 permet de garder une concentration extrmement faible en ions HO
dans le
bcher. Ceci permet dviter la saturation donc la prcipitation dhydroxydesmtalliques, cest--
dire de sels associant les cations mtalliques avec les ions HO
: Pt(OH)
, Fe(OH)
et Fe(OH)
.
2) On crit tout dabord la ractiondetitrage :
(RT) Pt
+2Fe
Pt +2Fe
On en dduit le volumelquivalence, qui vrifie par dfinition :
2
On trouve :
=
2
= 1,0 mL
Remarque : ce volume est trop petit par rapport lincertitude dune burette. Exprimentalement, on ne
choisirait pas une concentration de titrant aussi leve pour un tel dosage, afin davoir une descente de
burette plus importante lquivalence. Mais ici ce nest quune simulation
Solution initiale (point = 0 )
On considre que la raction est mene dans un bcher dans lequel plonge un fil de platine, afin de
constituer une lectrode. La solution contient [Pt
] = 0,050
, donc :
( = 0) =
2
log 0,050 = 1,18 V
Entre = 0 et =
On dtermine quoi la solution est quivalente en faisant le bilan de matire de la raction de titrage
en la considrant comme totale.
(RT) Pt
+ 2Fe
Pt + 2Fe
apport
lectrode 0
si totale
2
0 lectrode (quantits de matire)
La solution est donc quivalente une solution :
Pt
=
+
=
(
)
2(
+)
Fe
=
+
La seule raction que lon pourrait crire partir de cet tat est linverse la (RT) qui recre de Pt
et
2 de Fe
. Comme la raction (RT) est quasi-totale dans le sens direct (cart de 0,45 V entre les
potentiels standard des couples), on peut supposer jusqu un point trs proche de lquivalence que
Pt
.
On utilise donc la formule de Nernst avec :
[Pt
] =
(
)
2(
+)
quilibres en solution aqueuse Exercice 35 Page 2 sur 4
(0 <
) =
2
log
(
)
2(
+)
Lunicit du potentiel pourrait nous permettre de trouver en chaque point la concentration rsiduelle
dions Fe
en galant lexpression prcdente avec
log
(
)[Fe
]
. On pourrait ainsi vrifier
que est ngligeable devant
Pt
, sauf si on sapproche trop de
car
Pt
change brutalement
dordre de grandeur quand il est puis.
lquivalence, =
= 1,0 mL
On dtermine quoi la solution est quivalente en faisant le bilan de matire de la raction de titrage
en la considrant comme totale.
(RT) Pt
+ 2Fe
Pt + 2Fe
apport
lectrode 0
si totale 0 0 lectrode
(quantits de matire)
La solution est donc quivalente une solution o plonge un fil de platine et dans laquelle on a
apport :
Fe
=
= 0,091
La seule raction que lon peut crire partir de cet tat est linverse la (RT) qui recre de Pt
et 2
de Fe
. Comme la raction (RT) est quasi-totale dans le sens direct, cest--dire quelle ne modifie pas
la concentration en ions Fe
:
Fe
0,091 molL
On peut alors trouver le potentiel en crivant la formule de Nernst avec les deux couples prsents :
=
2
log =
log
0,091
2
On ajoute deux fois la premire expression la deuxime de faon faire disparatre linconnue et de
trouver ainsi le potentiel de Nernst de la solution :
3 = 2 + = 2
log
0,091
2
( =
) =
2
3
+
3
log
0,091
2
= 1,04 V
Vrification de lhypothse : on calcule 8 10
avec lune ou lautre des expressions de
Nernst. 2 est bien compltement ngligeable devant
Fe
. Le rsultat est valide.
Pour >
On dtermine quoi la solution est quivalente en faisant le bilan de matire de la raction de titrage
en la considrant comme totale.
(RT) Pt
+ 2Fe
Pt + 2Fe
apport
lectrode 0
si totale 0 (
) lectrode
(quantits de matire)
Rappel :
La solution est donc quivalente une solution :
quilibres en solution aqueuse Exercice 35 Page 3 sur 4
Fe
=
(
)
(
+)
Fe
=
+
La seule raction que lon pourrait crire partir de cet tat est linverse la (RT) qui recre de Pt
et
2 de Fe
. Comme la raction (RT) est quasi-totale dans le sens direct, on peut supposer partir dun
point pas trop proche de lquivalence que
Fe
et
Fe
.
On utilise donc la formule de Nernst avec :
[Fe
] =
(
)
(
+)
[Fe
] =
+
( >
) =
log
Lunicit du potentiel pourrait nous permettre de trouver en chaque point la concentration rsiduelle
dions Pt
en galant lexpression prcdente avec
log[Pt
]. On pourrait ainsi vrifier que
est ngligeable devant
Fe
et
Fe
, sauf si on est encore trop proche de
et que
Fe
nest pas
encore assez leve.
Autre point particulier : la double quivalence = 2
= 2,0 mL
Lexpression prcdente est valable et donne :
(2
) = E
= 0,77 V
En effet, sur les deux millilitres de titrant apports depuis le dpart, le premier a t converti en Fe
et le deuxime est rest sous forme Fe
. On a donc bien [Fe
] = [Fe
] en ce point.
Linverse de la (RT) est bien ngligeable : = [Pt
] = 6 10
.
Conclusion : courbe de titrage
/
1,18
1,04
0,77
0 1,0 2,0 /mL
Remarque : cette courbe tant dissymtrique, on ne peut pas dterminer le potentiel lquivalence par la
mthode des tangentes parallles.
quilibres en solution aqueuse Exercice 35 Page 4 sur 4
3) Par dfinition, la grandeur quon a note dans la question prcdente, est la f..m. de la pile
constitue par llectrode standard hydrogne (ESH) gauche et par la solution dans laquelle plonge
un fil de platine droite :
ESH
E
pont
salin
Pt
Comme lESH nexiste pas, il faut la remplacer par une lectrode de rfrence, cest--dire dont le
potentiel est parfaitement constant et connu par rapport lESH.
On utilise couramment llectrodederfrenceaucalomel (lectrode au calomel sature en KCl,
note ECS), que lon plonge dans le bcher de mesure.
Hg
2
Cl
2
***
*
calomel
mercure Hg
pastille poreuse
solution
interne de
KCl
sature
cristaux
de KCl
Pt
E
pile
On mesure alors
, et on en dduit =
.
4) On reporte la zone de virage de lindicateur color (entre
qques centimes de V et
+qques centimes de V) sur la courbe simule la question 2).
On saperoit :
- que la 5-nitroferrone serait rouge-violet pendant tout le titrage car le potentiel de Nernst
dans le bcher est nettement dans la zone de prdominance de la forme rduite pendant tout
le titrage.
- que la diphnylamine, le 2,6-dichloroindophnol et le bleu de mhtylne resteraient sous
forme oxyde pendant tout le titrage, soit violet ou bleu.
Les deux autres indicateurs semblent convenir, leur zone de virage contient le potentiel
lquivalence. Cependant, tant donn le caractre dissymtrique de la courbe, la ferrone entrera trop
tt dans sa zone de virage, la couleur virera progressivement du bleu au rouge quelques millilitres
avant lquivalence.
La 5,6-dimthylferrone semble donc plus adapte, sa zone de virage est situe dans la partie la plus
verticale du saut, ce qui laisse penser quon franchira la zone de virage la goutte prs (passage
brusque de bleu rouge de part et dautre de
).
quilibres en solution aqueuse Exercice 36 Page 1 sur 4
Corrig exercice 36
TITRAGE POTENTIOMTRIQUE DUNE SOLUTION DE CYANURE
On note
ln 10 = 0,059 V 25 dans tout ce corrig.
On commence par tracer le diagramme de prdominance ou dexistence pour les espces cyanures en
fonction de pAg. Le choix de pAg est guid par le fait quon demande de tracer la courbe = (), et
que le potentiel est celui dune lectrode dargent, donc =
(Ag
/Ag)
pAg.
Le but du diagramme est de savoir qui de la prcipitation ou de la complexation a lieu en premier. On
va sintresser chaque couple en le supposant seul : prcipitation sil ny a pas eu complexation, puis
complexation en absence de prcipit.
Couple AgCN/CN
: la prsence du prcipit implique
= Ag
[CN
]. Lorsque[CN
] =
= 0,10 molL
, la concentration enAg
saturant la solution est donc Ag
, soit :
pAg
= p
= , .
Couple [Ag(CN)
/CN
: on a, par dfinition,
=
[Ag(CN)
[Ag
][CN
. La frontire de prdominance
est obtenue lorsque la concentration du complexe et de lion cyanure sont gales. On obtient
donc :
=
[Ag
[CN
. Notons que, dans ce cas, la concentration de CN
ne se simplifie
pas ; cela signifie que la frontire dpend de la concentration de trac. Or, sil ny a pas de
prcipit,
= [CN
] +2[Ag(CN)
. la frontire, on trouve donc
= 3[CN
.
Finalement, [Ag
, soit : pAg
= , .
Do le diagramme recherch :
14,9 pAg
AgCN CN
[Ag(CN)
CN
19,2
1) On voit sur le diagramme que, lorsquon ajoute des ions Ag
dans une solution dions cyanure
(pAg venant de +), cest la complexation qui a lieu en premier.
(RT1) : Ag
+2CN
[Ag(CN)
= 10
,
Le diagramme montre aussi que tout au long de cette raction de dosage, le pAg se maintient au
voisinage de 19,2 (zone tampon), donc le potentiel au voisinage de
19,2 = 0,33 V.
En revanche, la frontire de prcipitation 14,9 na plus aucune signification. En effet, on lavait tablie
pour une concentration de CN
gale
, or on est trs largement dans le domaine de prdominance
du complexe, donc il ny a cet endroit que des traces dions libres CN
.
La deuxime raction de dosage est la prcipitation. Elle est successive la formation du complexe,
do :
(RT2) : Ag
+[Ag(CN)
2AgCN =
= 10
,
La raction (RT2) ne commence qu la saturation en AgCN. On observe donc un point anguleux, qui
interrompt le saut de la RT1.
Remarque : Le trac des diagrammes dexistence et de prdominance ntait pas indispensable. En effet, si
on essaie dcrire la prcipitation en premier, on ne voit pas quelle pourrait tre la seconde raction de
dosage : puisque le complexe contient relativement moins de Ag
que le prcipit, un excs de Ag
ne
quilibres en solution aqueuse Exercice 36 Page 2 sur 4
pourra pas entraner la redissolution du prcipit ! Par limination, comme lnonc signale quil y a deux
sauts, cest donc que cest la complexation qui a lieu la premire.
2) On crit les relations dfinissant les quivalences.
Pour (RT1) :
= 0,0050 mol (attention la stchiomtrie !)
La solution lquivalence de (RT1) est quivalente une solution de [Ag(CN)
en quantit
. Cest cette quantit qui est dose dans la (RT2), do :
= 0,0050 mol (ici la
stchiomtrie est de 1:1), donc :
= 0,010 mol
3) Partie a) : 0 < <
(RT1) Ag
+ 2CN
[Ag(CN)
apport <
0 (quantits de matire)
bilan si totale 0
2
En ralit, il reste des traces dions Ag
, qui sont ngligeables (sauf trop prs de
) et quon calcule
grce
(ne pas oublier de repasser en concentrations, en prenant
car on nglige la
dilution) :
[Ag
] =
2)
Par consquent :
=
log
2)
= 0,80 0,059log
+0,059log
+0,059log
(0,010 2)
= 0,48 +0,059log
(0,010 2)
Cette expression nest pas dfinie en = 0 car pAg est thoriquement infini puisquon na pas encore
apport dions Ag
. Cependant, on sait quexprimentalement on mesurera tout de mme une valeur
finie en = 0 puisque lorsquon introduit un fil dargent dans une solution aqueuse, il y a toujours des
traces dions Ag
qui se forment par oxydation.
Lexpression nest pas non plus valide en =
et un choua avant, cest--dire lorsque la
concentration de Ag
nest plus ngligeable devant celle de CN
, lorsque ceux-ci sont quasi puiss.
Cependant, il y a aussi le problme du dbut de la (RT2) qui interrompt le saut. On lenvisage la
question 4).
Partie b) :
< <
(RT2) Ag
+ [Ag(CN)
2AgCN
apport depuis
0 (quantits de matire)
bilan si totale 0 2
2(
)
En prsence de prcipit, on peut maintenant utiliser la constante pour dterminer la concentration
rsiduelle en Ag
:
Ag
(2
)
=
7,9 10
0,010
= 0,09 0,059log(0,010 )
quilibres en solution aqueuse Exercice 36 Page 3 sur 4
Lorsque tend vers
= 0,010 mol, on a nouveau une singularit ; lexpression cesse dtre valable
ds que Ag
cesse dtre ngligeable devant le rsidu de complexe.
Partie c) : >
Les ions Ag
ne sont plus consomms aprs lquivalence
. Si on nglige les traces provenant du
prcipit et du complexe, la concentration de Ag
est celle apporte depuis
, soit :
[Ag
] =
=
0,010
0,1
= 0,86 +0,059log( 0,010)
4) =
: Sil ny avait pas la (RT2), on raisonnerait comme suit :
Par bilan de la (RT1), la solution est quivalente en =
une solution o on aurait apport le
complexe la concentration
= 0,050
. Linverse de (RT1) est alors la raction
prpondrante peu avance : elle libre en Ag
et 2 en CN
, donc
=
,
, soit [Ag
] = =
2,9 10
, qui est bien ngligeable devant 0,050. On trouve alors = 0,36 V.
Mais y a-t-il prsence de prcipit ce stade ? La raction (RT2) a-t-elle commenc ?
Pour le savoir, on calcule le quotient ractionnel de la raction de dissolution et on compare au
:
= (2) = 1,7 10
>
= 1,3 10
. Conclusion, le prcipit est prsent ! Cette valeur de
calcule est donc fausse. La saturation a lieu juste avant lquivalence et interrompt le saut de
potentiel de la (RT1).
On peut considrer que, de toutes faons, le complexe atteint quasiment la concentration
0,050
, puisquun saut brusque rvle que la (RT1) est quasiment termine. On doit alors
utiliser pour en dduire [Ag
] =
,
= 1,6 10
lorsque la saturation a lieu. On trouve
donc, lorsque (RT2) commence, cest--dire que le point anguleux apparat, un potentiel :
= 0,22 V
=
: La solution est quivalente une solution deau pure (contenant les ions spectateurs) de
volume
dans lequel est prsent le prcipit seulement.
La RP peu avance est alors la dissolution du prcipit, qui se dissout en complexe dans ces
conditions (prpondrant devant CN
). La RP est donc linverse de la (RT2). En notant son
avancement, on trouve [Ag
] = [Ag(CN)
= 2,8 10
= 0,47 V
Vrification : [CN
] =
[Ag
]
= 4,5 10
, qui est bien compltement ngligeable devant les
concentrations prcdentes.
5) On a maintenant tous les renseignements pour tracer la courbe :
quilibres en solution aqueuse Exercice 36 Page 4 sur 4
-0,6
-0,4
-0,2
0
0,2
0,4
0,6
0,8
0 0,005 0,01 0,015
E
(
V
)
n (mol)
E=f(n) pour le dosage d'une solution de cyanure par le
nitrate d'argent
quilibres en solution aqueuse Exercice 37 Page 1 sur 5
Corrig exercice 37
UTILISATION DU BORE DANS UN AGENT DE BLANCHIMENT
On note :
ln10 = 0,06 V = 298 K.
1) Le bore reste lacunaire dans lion perborate (lment de la colonne 13) et loxygne porte la
charge formelle ngative :
B O O O
_
Remarque : quand lnonc parle de squelette linaire , il faut comprendre que les atomes sont
enchans. La gomtrie relle de cet ion est bien linaire autour du bore (AX
) mais coude autour de
loxygne (AX
).
2) On attribue les doublets des liaisons O B loxygne, plus lectrongatif que le bore. Les deux
lectrons de la liaison O O sont rpartis quitablement.
B O O O
_
- II + III - I - I
3) Lnonc signale que les ions BO
sont rduits en BO
. Dans ces deux ions, le bore est au nombre
doxydation +III. Il sagit dun couple de loxygne, car tous les atomes O sont II dans BO
.
BO
+2
+2H
BO
+H
O
La raction tant une hydrolyse, lautre ractif est H
O, et du peroxyde dhydrogne H
est libr. Il
sagit donc du couple H
/H
O qui est aussi un couple I/II de loxygne :
2H
O H
+2
+2H
La somme de ces deux demi-quations donne lquation demande :
BO
+2H
O BO
+H
4) La demi-quation lectronique est :
O
(g)
+2
+2H
(aq)
On rappelle que, quel que soit le pH du milieu, il faut quilibrer cette demi-quation lectronique avec H
,
pour pouvoir utiliser le potentiel standard
(donn conventionnellement pH=0 ) dans la formule de
Nernst.
Do la formule de Nernst en fonction des activits des espces :
=
O
(g)
/H
O
(aq)
2
log
la frontire de prdominance, on prend
O
= 1 et
H
= 1, ce qui signifie que le gaz
dioxygne commence se dgager sous 1 bar partir dune solution de concentration de H
voisine
de 1
.
On trouve alors :
=
O
(g)
/H
O
(aq)
2
log
H
=
O
(g)
/H
O
(aq)
pH
quilibres en solution aqueuse Exercice 37 Page 2 sur 5
Diagramme de prdominance :
/V
O
(g)
0,68 0,06pH
H
(aq)
5) La demi-quation lectronique est :
H
(aq)
+2
+2H
2H
O
Do la formule de Nernst en fonction des activits des espces :
=
H
O
(aq)
/H
2
log
la frontire de prdominance, on prend
H
= 1, ce qui correspond une concentration de trac de
H
voisine de 1
.
On trouve alors :
=
H
O
(aq)
/H
2
log
H
=
H
O
(aq)
/H
pH
Diagramme de prdominance :
/V
H
(aq)
0,77 0,06pH
H
O
6) En superposant les deux diagrammes prcdents, qui avaient t tablis en supposant chaque
couple seul, on saperoit qu tout pH, H
(aq)
est dans des domaines disjoints selon le couple :
/V
H
(aq)
0,77 0,06pH
O
(g)
0,68 0,06pH
H
O
H
(aq)
quilibres en solution aqueuse Exercice 37 Page 3 sur 5
H
est donc une espce instable, qui doit se dismuter, selon : 2H
2H
O +O
En labsence de catalyseur, la dismutation du peroxyde dhydrogne est trs lente, cest pourquoi on peut
conserver des solutions deau oxygne.
Dosage du perborate dans une lessive
7) Lors de la prparation de la solution, le perborate est converti en peroxyde dhydrogne H
selon la raction crite la question 3. On doit alors doser H
rapidement, car, comme on la dit la
question prcdente, il a tendance se dismuter lentement.
La raction de titrage consiste en une oxydation de H
par lion Ce
. Les demi-quations
lectroniques sont :
H
(g)
+2
+2H
Ce
Ce
( 2)
Do la raction de titrage :
H
+2Ce
(g)
+2H
+2Ce
8) On imagine un systme o tous les constituants de lquation chimique sont prsents et
lquilibre. Dans ce cas, il y a unicit du potentiel de solution, la formule de Nernst donne la mme
valeur pour les deux couples prsents :
=
O
(g)
/H
2
log
=
Ce
/Ce
log
Ce
Ce
On en dduit :
2
log
log
Ce
Ce
=
Ce
/Ce
O
(g)
/H
2
log
Ce
Ce
=
Ce
/Ce
O
(g)
/H
On reconnat sous le logarithme la constante dquilibre
de la raction, on a donc :
2
log
=
Ce
/Ce
O
(g)
/H
= 10
Ce
/Ce
O
(g)
/H
= 10
,
1 : on en dduit que
la raction de titrage est quasi-totale.
9) Pour suivre ce titrage par potentiomtrie, on plonge dans le bcher du titrage un fil de platine
pour constituer une lectrode inattaquable, indicatrice du potentiel de la solution, et on introduit
galement dans le bcher une lectrode de rfrence. On mesure la f..m. de la pile ainsi constitue
au moyen dun voltmtre.
Si on choisit llectrode standard hydrogne (ESH) comme rfrence, on mesure directement le
potentiel de Nernst :
quilibres en solution aqueuse Exercice 37 Page 4 sur 5
ESH
E
pont
salin
Pt
Mais comme lESH nexiste pas, il faut en fait utiliser une lectrode de rfrence, cest--dire dont le
potentiel est parfaitement constant et connu par rapport lESH.
On utilise couramment llectrode de rfrence au calomel (lectrode au calomel sature en KCl,
note ECS), que lon plonge dans le bcher de mesure.
Hg
2
Cl
2
***
*
calomel
mercure Hg
pastille poreuse
solution
interne de
KCl
sature
cristaux
de KCl
Pt
E
pile
On mesure alors
, et on en dduit =
.
10) La courbe est globalement croissante car on ajoute un oxydant la burette : le potentiel de
solution ne peut donc que crotre. Mais cette croissance se fait en trois phases distinctes :
- avant lquivalence, tant quil reste H
, les ions Ce
verss sont quasi-totalement
consomms et transforms progressivement en Ce
; les concentrations varient mais sans
changer dordre de grandeur, do la stabilit du potentiel ;
- lquivalence, H
est brusquement puis : les ions Ce
que lon verse commencent
donc brusquement saccumuler, leur concentration change dordre de grandeur (de
puissance de 10), do le saut de potentiel ;
- aprs lquivalence, les ions Ce
saccumulent mais ne changent plus dordre de grandeur
et se mlent aux ions Ce
crs avant lquivalence. Le couple Ce
/Ce
impose donc un
potentiel quasi constant.
11) La courbe drive permet de dterminer prcisment la position du saut de potentiel, donc
destimer le volume quivalent :
= 40,0
Daprs la stchiomtrie de la raction de titrage (H
+2Ce
(g)
+2H
+2Ce
), on en
dduit que la quantit de H
dos tait :
2
Or daprs la raction dhydrolyse crite la question 3 (BO
+2H
O BO
+H
), on sait quune
mole de perborate a t convertie en une mole de H
. La quantit de perborate dans la lessive tait
quilibres en solution aqueuse Exercice 37 Page 5 sur 5
donc aussi de :
2
On en dduit la masse de perborate de sodium ttrahydrat NaBO
, 4 H
O en multipliant par la masse
molaire ( = 23,0 +10,8 +7 16,0 +8 1,0 = 153,8
) :
2
= 0,308 g
Comme on avait prlev 2,00 g de lessive, le pourcentage de perborate est de :
15,4%
S-ar putea să vă placă și
- TD Exercices Corrigés Chimie en SolutionDocument21 paginiTD Exercices Corrigés Chimie en SolutionOussam Ouadidi65% (17)
- Banque D'exercicesDocument37 paginiBanque D'exercicesyves100% (4)
- Oxydo-Reduction Et Piles Electrochimiques SMPC2 Fsr. 2015Document13 paginiOxydo-Reduction Et Piles Electrochimiques SMPC2 Fsr. 2015Djilali Morsli100% (2)
- QCM Dentrainement Chimie GeneraleDocument6 paginiQCM Dentrainement Chimie GeneraleHarakat Elhoucine100% (1)
- Examen Correction L1 Chimie Organique 2006 2Document7 paginiExamen Correction L1 Chimie Organique 2006 2R-win100% (4)
- TD Cinetique ChimiqueDocument3 paginiTD Cinetique ChimiqueSimplice Assemien100% (3)
- Cours Et Exercice Chimie Des Solution MR Hebbar Nordine PDFDocument103 paginiCours Et Exercice Chimie Des Solution MR Hebbar Nordine PDFNour El Houda100% (1)
- TD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseDocument5 paginiTD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - Monobaseel hazbi fadilaÎncă nu există evaluări
- Loi de FOURIERDocument6 paginiLoi de FOURIERHamza_Leconstant_44250% (2)
- CHP 2 TD - Chimie - SolutionDocument8 paginiCHP 2 TD - Chimie - SolutionSimplice Assemien100% (2)
- Exercices Et Problèmes PDFDocument71 paginiExercices Et Problèmes PDFsidi80% (5)
- Chimie en Solution PDFDocument27 paginiChimie en Solution PDFKhalid Zeg0% (1)
- Exercices Chimie en Solution PDFDocument2 paginiExercices Chimie en Solution PDFDenarius67% (6)
- Chimie en SolutionDocument27 paginiChimie en SolutionNabil holmes100% (3)
- Exercices Organique Corrige WebDocument3 paginiExercices Organique Corrige WebGelo Ratouvo100% (1)
- 2-Série Acide Base + CorrigéDocument14 pagini2-Série Acide Base + Corrigémimi mimiÎncă nu există evaluări
- Exercices Et Problèmes de ConcoursDocument12 paginiExercices Et Problèmes de ConcoursSa LimÎncă nu există evaluări
- Série de TD N°2 - Équilibres Acido-BasiquesDocument2 paginiSérie de TD N°2 - Équilibres Acido-Basiqueskim namjoon100% (1)
- Chimie Des Solutions MpsiDocument41 paginiChimie Des Solutions Mpsihanaaaaaaaaae100% (5)
- Exercices N 5 Et 6Document7 paginiExercices N 5 Et 6ahlemmÎncă nu există evaluări
- TD2 Chimie Generale +CORRIGE 2016-2017Document10 paginiTD2 Chimie Generale +CORRIGE 2016-2017Awatif BeÎncă nu există evaluări
- Chimie Organique Exercices Corrigés 6Document25 paginiChimie Organique Exercices Corrigés 6Hossam Bendali100% (9)
- Olympiades Nationales de La Chimie - Annales Vol. 1Document240 paginiOlympiades Nationales de La Chimie - Annales Vol. 1Olympiades_Chimie100% (3)
- Examen Cinetique Chimique Session 1 2012-2013Document1 paginăExamen Cinetique Chimique Session 1 2012-2013Ganiyou Adenidji100% (5)
- Chimie OrganiqueS3Document70 paginiChimie OrganiqueS3Akram OmariÎncă nu există evaluări
- Exercices Supplementaires en Chimie Analytique PDFDocument18 paginiExercices Supplementaires en Chimie Analytique PDFyacine100% (1)
- TD 4 Avec Corrigé de Chimie Des SolutionsDocument7 paginiTD 4 Avec Corrigé de Chimie Des SolutionsETUSUP100% (1)
- Oxy Do ReductionDocument39 paginiOxy Do ReductionKHALIFÎncă nu există evaluări
- Thermodynamique Et Équilibres Chimiques - Cours Et Exercices Corrigés PDF - Télécharger, LireDocument8 paginiThermodynamique Et Équilibres Chimiques - Cours Et Exercices Corrigés PDF - Télécharger, LireSoumia BehihÎncă nu există evaluări
- ChemDocument5 paginiChemAnonymous svBEhGhEIÎncă nu există evaluări
- QCM ChimieDocument2 paginiQCM Chimieslimani abdelhak100% (1)
- Sujet Dexamen Chimie Analytique Et Corrige 2013-2014Document4 paginiSujet Dexamen Chimie Analytique Et Corrige 2013-2014elhidhab2014100% (2)
- Cours Et Exercices ElectrochimieDocument14 paginiCours Et Exercices ElectrochimietitebinÎncă nu există evaluări
- Cours 1 Chimie Des SolutionsDocument14 paginiCours 1 Chimie Des SolutionsLoubna El JehouariÎncă nu există evaluări
- CHIMIE ORGANIQUE Chapitre 4-Effet Electronique PDFDocument31 paginiCHIMIE ORGANIQUE Chapitre 4-Effet Electronique PDFMohamedBahmed89% (19)
- Chimie: - Chimie en Solution AqueuseDocument35 paginiChimie: - Chimie en Solution AqueuseAyoub Maverick100% (1)
- Correction Exercices de Revision: Les Reactions de PrecipitationDocument5 paginiCorrection Exercices de Revision: Les Reactions de PrecipitationRitaj-Rayane KarimÎncă nu există evaluări
- Exercices Corrigs Nomenclature Chimie Organique PDFDocument2 paginiExercices Corrigs Nomenclature Chimie Organique PDFMarcus67% (9)
- Analyse Spectrale Exercices PDFDocument17 paginiAnalyse Spectrale Exercices PDFhhÎncă nu există evaluări
- Examens Chimie Des Solutions Fsa-AgadirDocument49 paginiExamens Chimie Des Solutions Fsa-AgadirMohamd Bobs100% (2)
- Correction - TD 6 Acide BaseDocument8 paginiCorrection - TD 6 Acide BaseBILLBOARD TOP AFRICAÎncă nu există evaluări
- Aldehydes CetonesDocument29 paginiAldehydes Cetonesvaslek terriyo100% (1)
- Cours de Chimie OrganiquesDocument118 paginiCours de Chimie OrganiquesUrbain VODOUNNOU100% (1)
- TD Cinetique ChimiqueDocument2 paginiTD Cinetique Chimiquemomos55100% (3)
- Exercices de Physique Nucléaire et de la MatièreDe la EverandExercices de Physique Nucléaire et de la MatièreÎncă nu există evaluări
- Solutions Aqueuses IpDocument13 paginiSolutions Aqueuses IpEmmanuel PolvenskyÎncă nu există evaluări
- EXERCICES DE CHIMIE Confinement 2Document4 paginiEXERCICES DE CHIMIE Confinement 2yalhsankonÎncă nu există evaluări
- TD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseDocument5 paginiTD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseLOUkmen Bel100% (1)
- DM Nâ°1Document8 paginiDM Nâ°1grégoire beraudÎncă nu există evaluări
- DS2 Tspé 2020-2021-5Document5 paginiDS2 Tspé 2020-2021-5hanaemaaroufÎncă nu există evaluări
- TD Acide Faible Base Faible Constante Dacidite TS2 2023 2024Document12 paginiTD Acide Faible Base Faible Constante Dacidite TS2 2023 2024fallccheikhÎncă nu există evaluări
- Dosage ExDocument2 paginiDosage ExHou ChanÎncă nu există evaluări
- Cours de VirologieDocument5 paginiCours de VirologieFrancisca AgboviÎncă nu există evaluări
- Les Dosages Ou Titrages Directs Exercices Non Corriges 1Document5 paginiLes Dosages Ou Titrages Directs Exercices Non Corriges 1Zeineb BiadÎncă nu există evaluări
- TD C567Document7 paginiTD C567Mouhamed SarryÎncă nu există evaluări
- Acides Bases PDFDocument8 paginiAcides Bases PDFHafidi AhmedÎncă nu există evaluări
- Serie 2 Les Transformations S'effectuants en Deux Sens Etat D'equilibre (2) - 1Document4 paginiSerie 2 Les Transformations S'effectuants en Deux Sens Etat D'equilibre (2) - 1yunuabou3Încă nu există evaluări
- Epreuve de Physique: Concours Avenir - 8 Mai 2014Document16 paginiEpreuve de Physique: Concours Avenir - 8 Mai 2014Khalid ZegÎncă nu există evaluări
- Epreuve de Physique: DUREE: 1h30mn Coefficient 5Document16 paginiEpreuve de Physique: DUREE: 1h30mn Coefficient 5Khalid ZegÎncă nu există evaluări
- Text MarkDocument6 paginiText MarkKhalid ZegÎncă nu există evaluări
- Masse Ir RMNDocument80 paginiMasse Ir RMNKhalid ZegÎncă nu există evaluări
- TD N1 ElectromagnetismeDocument3 paginiTD N1 ElectromagnetismeKhalid ZegÎncă nu există evaluări
- Corrigé 4Document4 paginiCorrigé 4Khalid ZegÎncă nu există evaluări
- TD N1 Algebre 2Document7 paginiTD N1 Algebre 2Khalid Zeg100% (1)
- Controle 3Document2 paginiControle 3Khalid ZegÎncă nu există evaluări
- Controle 6Document2 paginiControle 6Khalid ZegÎncă nu există evaluări
- Corrigé 5Document5 paginiCorrigé 5Khalid ZegÎncă nu există evaluări
- Corrigé 3Document5 paginiCorrigé 3Khalid ZegÎncă nu există evaluări
- Controle 4Document2 paginiControle 4Khalid ZegÎncă nu există evaluări
- TD Chimie Organique SMC S4Document4 paginiTD Chimie Organique SMC S4Khalid Zeg100% (1)
- Cours 1 - L'air Qui Nous Entoure (WWW - Pc1.ma)Document3 paginiCours 1 - L'air Qui Nous Entoure (WWW - Pc1.ma)Khalid ZegÎncă nu există evaluări
- Les MelangesDocument1 paginăLes MelangesKhalid Zeg100% (2)
- Huckel 1Document4 paginiHuckel 1Khalid ZegÎncă nu există evaluări
- TD N1 Electricite 1Document7 paginiTD N1 Electricite 1Khalid Zeg100% (1)
- Chapitre 1 L'air Qui Nous Entoure Prof - Khouya (WWW - Pc1.ma) PDFDocument4 paginiChapitre 1 L'air Qui Nous Entoure Prof - Khouya (WWW - Pc1.ma) PDFKhalid ZegÎncă nu există evaluări
- 04 Series Resume PDFDocument2 pagini04 Series Resume PDFKhalid ZegÎncă nu există evaluări
- TD MMSS PDFDocument6 paginiTD MMSS PDFKhalid ZegÎncă nu există evaluări
- Canevas Poster L3 2022Document1 paginăCanevas Poster L3 2022nourelhoudatebbaneÎncă nu există evaluări
- TPCH2 TSspectroDocument2 paginiTPCH2 TSspectrokarim mazizÎncă nu există evaluări
- Biophysique2an SolutionsDocument71 paginiBiophysique2an SolutionsMina RhmÎncă nu există evaluări
- Leçon Re - Solution - de - PB - 1e - Re - S - Synthe - Se - Savon - ReluDocument2 paginiLeçon Re - Solution - de - PB - 1e - Re - S - Synthe - Se - Savon - ReluVolanirina RaharintsoaÎncă nu există evaluări
- Application Note Spray CoatingsDocument6 paginiApplication Note Spray CoatingsElly PegÎncă nu există evaluări
- Chapitre 5Document6 paginiChapitre 5deprado.leoÎncă nu există evaluări
- Chapitre 6Document28 paginiChapitre 6Mohamed SarmoukÎncă nu există evaluări
- TD1 ThermodynamiqueDocument4 paginiTD1 ThermodynamiqueYunusÎncă nu există evaluări
- Master Academique: ThèmeDocument80 paginiMaster Academique: ThèmeCrocus AdelyseÎncă nu există evaluări
- Chapitre1 Chimie 2Document8 paginiChapitre1 Chimie 2bachir bennaoumÎncă nu există evaluări
- TD3 Réaction D'oxydoréduction (1) 1bac SMDocument4 paginiTD3 Réaction D'oxydoréduction (1) 1bac SMmaroua gainouÎncă nu există evaluări
- Cours Réactions Précipitation Et Complexation-L1SVTE 2020-2021Document27 paginiCours Réactions Précipitation Et Complexation-L1SVTE 2020-2021Haroun moussa HarounÎncă nu există evaluări
- Devoir de Synthèse N°2 Collège Pilote - Physique - 9ème (2015-2016) Mme Hanen Othmani PDFDocument5 paginiDevoir de Synthèse N°2 Collège Pilote - Physique - 9ème (2015-2016) Mme Hanen Othmani PDFOussemaÎncă nu există evaluări
- Ec Chim4231-Chimie Structurale - Td2-2: Université de Yaoundé I-Ecole Normale Supérieure-Département de ChimieDocument2 paginiEc Chim4231-Chimie Structurale - Td2-2: Université de Yaoundé I-Ecole Normale Supérieure-Département de ChimieKeuamene Djogue MarozzottiÎncă nu există evaluări
- Cours de PlongéeDocument7 paginiCours de PlongéecinscriptionÎncă nu există evaluări
- Préchauffage de BRADocument144 paginiPréchauffage de BRAHasni jilaliÎncă nu există evaluări
- TD - Diagramme BinaireDocument3 paginiTD - Diagramme BinaireOumeyma Hamlaui100% (2)
- CH C2 Propagation de La LumièreDocument2 paginiCH C2 Propagation de La LumièretoÎncă nu există evaluări
- TD Électrochimie de Chimie Analytique 2eme Année Pharmacie DR DJAOUDocument5 paginiTD Électrochimie de Chimie Analytique 2eme Année Pharmacie DR DJAOUmoh moh100% (1)
- Série 03 TCSFDocument3 paginiSérie 03 TCSFAliÎncă nu există evaluări
- Chimie 2016Document4 paginiChimie 2016Zahi AlkhaledÎncă nu există evaluări
- 2022 CCINP Physique Chimie PSI Corrige Développement DurableDocument9 pagini2022 CCINP Physique Chimie PSI Corrige Développement DurableMeriem El AbzazeÎncă nu există evaluări
- Cours 1Document48 paginiCours 1Faris Abd ElmajidÎncă nu există evaluări
- CHIMIEDocument3 paginiCHIMIEMelvin LavironÎncă nu există evaluări
- Coefficients de Diffusion 2011-2012Document8 paginiCoefficients de Diffusion 2011-2012Kreirate Sid Ahmed100% (14)
- Cours IntroductionauRaffinageetlaPtrochimie LABSI Nov2021Document40 paginiCours IntroductionauRaffinageetlaPtrochimie LABSI Nov2021Loïc steve Nyamsi BefouraÎncă nu există evaluări
- Inter Sismique Reflexion M1 GGDocument12 paginiInter Sismique Reflexion M1 GGfrancoise xavierÎncă nu există evaluări
- Chimie Minerale 1Document16 paginiChimie Minerale 1HenockÎncă nu există evaluări