Documente Academic
Documente Profesional
Documente Cultură
Guia Ba1 2013
Încărcat de
Roger BernalTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Guia Ba1 2013
Încărcat de
Roger BernalDrepturi de autor:
Formate disponibile
~ 2 ~
Carlos Luis Mori Nuez
Ing. en Industrias Alimentarias
Profesor del Bioqumica de los Alimentos
Universidad Catlica de Santa Mara
ucsm1355@gmail.com
Danissa Paredes Muoz
Ing. Qumico
Profesor del Bioqumica de los Alimentos
Universidad Catlica de Santa Mara
danissap@gmail.com
Bioqumica de los Alimentos I
Gua de Practicas
Primera Edicin: 2013
Queda prohibida la reproduccin o transmisin
total o parcial del contenido de la presente obra
por cualquiera de las formas, sean electrnicas o
mecnicas, sin el consentimiento previo y por
escrito del editor.
Impreso en Per
~ 3 ~
PRESENTACIN
Como estudiante de Ingeniera de Industria Alimentaria debes tener en
cuenta que la conservacin, transformacin y/o comercializacin de
alimentos tanto para nuestro pas como para la exportacin tiene que
ser competitiva y sustentable. Es sabido que los cambios que puedan
generarse en un alimento tienen su base en la bioqumica de los
principales componentes y las modificaciones que en ellas se realizan.
Es importante que usted sepa que el laboratorio es un lugar de trabajo
serio y que su atencin y comportamiento sern observados por los
docentes encargados del desarrollo de la prctica, quienes estn para
guiarlos y responder a sus dudas.
Cuando usted ingresa al laboratorio se entiende que sabe lo que tiene
que hacer, para lo cual habr ledo con la suficiente anticipacin el o los
experimentos que han de realizarse.
El xito de un experimento est en la observacin acuciosa de los
fenmenos que ocurren, en la exactitud de la anotacin de los datos y
mediciones, en el orden correcto de los pasos de cada experimento, en
la nitidez y habilidad para la manipulacin de los aparatos y/o equipos,
en la adquisicin de los buenos hbitos que son la base de la formacin
de un cientfico.
En este manuscrito se ha buscado que se enfatice acerca de la
importancia de las Ciencias Biolgicas, como es el caso de la bioqumica
aplicada al sector Agroindustrial y Pecuario, y lograr con esto no solo
que algunos conceptos se refuercen sino adems que se evidencie la
necesidad de desarrollar an ms esta rea en particular, para as lograr
que los profesionales apliquen con rigor el oficio de las ciencias y
desarrollen la habilidad crtica de el porqu, el cmo y el para que en su
vida diaria. Con esto se pretende alcanzar un desarrollo ideal de uno de
los sectores que tiene mayor relevancia en nuestro pas, como sabemos
la alimentacin es uno de los pilares para el desarrollo, pues vivimos en
un mundo globalizado y es ah donde debemos incursionar y aprovechar
todos los recursos con que se cuenta.
~ 4 ~
TABLA DE CONTENIDOS
CARATULA 1
PRESENTACIN 3
TABLA DE CONTENIDOS 4
REGLAMENTOS (Funciones, Sugerencias, Normas en el laboratorio) 5
PRACTICAS DE LABORATORIO 9
Prctica 1. Soluciones valoradas 9
Prctica 2. Actividad enzimtica en tejidos animales y vegetales 15
Prctica 3. Actividad de la tirosinasa en el pardeamiento enzimtico 19
Prctica 4. Inhibicin de la actividad enzimtica de la polifenoloxidasa 25
Prctica 5. Efecto de la temperatura en la actividad enzimtica 31
Prctica 6. Identificacin de carbohidratos 35
Prctica 7. Cuantificacin de carbohidratos Mtodo fenol-sulfrico 41
Prctica 8. Determinacin de la actividad diastsica en harinas 45
Prctica 9. Aislamiento y cuantificacin de glicgeno 49
Prctica 10. Glucolisis 53
Prctica 11. Fermentacin 57
Prctica 12. Identificacin de aminocidos 61
Prctica 13. Hidrolisis de protenas 67
Prctica 14. Determinacin del punto isoelctrico de una protena 73
Prctica 15. Identificacin y solubilidad de lpidos 79
Prctica 16. Identificacin de colesterol en alimentos 83
BIBLIOGRAFIA 87
ANEXOS 89
~ 5 ~
REGLAMENTOS
A continuacin les describimos algunas indicaciones para el uso correcto de los ambientes y materiales con
que usted desarrollar su experimentacin.
Funciones del Profesor y/o Jefe de Prctica de la asignatura.-
Planificar, coordinar, supervisar, ejecutar y/o controlar la realizacin de las experiencias de laboratorio
Formular el petitorio de materiales de laboratorio con 48 horas hbiles antes de la realizacin de la prctica
Entregar al finalizar la prctica, el material recepcionado para la verificacin de su conformidad
Responsabilizarse de todas las ocurrencias durante el desarrollo de los trabajos prcticos
Funciones del Alumno durante la ejecucin de prctica de laboratorio.-
Presentarse en el laboratorio en la hora fijada con guardapolvo y mandil blanco
Estar enterado de la experiencia (material de laboratorio, mtodos, tcnicas y procedimientos) a realizar.
Mantener en orden y limpieza su rea de trabajo y entregar en buen estado de conservacin los materiales
de laboratorio recibidos bajo su responsabilidad.
Mantenerse atento y prevenido en la seguridad personal y la de sus compaeros.
Responsabilizarse del deterioro o ruptura de equipos u otros bienes que utiliza, debiendo reponerlos o
abonar su valor a la universidad, como adicional a la quinta tasa educativa.
Funciones del Asistente de laboratorio.-
Prepara y entrega los pedidos de materiales de laboratorio solicitados por los profesores y jefes de prctica
Se responsabiliza de la recepcin de materiales luego de finalizada la practica
Mantiene en buen estado de conservacin los materiales de laboratorio
Presenta al coordinar los adeudos de materiales de laboratorio que hayan generado los alumnos
Informa al profesor o jefe de prctica, con la debida anticipacin, la inexistencia de materiales de
laboratorio y otras.
Recibe los equipos, accesorios y mesas de trabajo en buen estado de limpieza, los mantiene y entrega de
igual forma.
Sugerencias y normas para el trabajo prctico.-
Evitar movimientos innecesarios como cambios de asiento, lugar. No hacer ruidos y/o bullicio durante el
desarrollo de la prctica, el laboratorio es compartido con otros docentes y/o alumnos del mismo u otro
Programa Profesional
No colocar sobre la mesa de trabajo carteras, maletines, libros y dems tiles, para ello tiene los anaqueles
respectivos
Conservar el lugar limpio y ordenado todo el tiempo.
Revisar cuidadosamente el material que recibe e informar si este se encuentra defectuoso.
Entregar el material de trabajo limpio y ordenado para un rpido control.
~ 6 ~
Sugerencias para las materias primas solicitadas.-
Informarse sobre los requerimientos de los materiales que debe traer para la prctica
Procurar adquirir las materias primas e insumos solicitados de lugares confiables, para garantizar el buen
desarrollo de la prctica.
Para los casos que es necesario realizar algn tratamiento previo en la materia prima, deber consultar
donde, como y cuando va a realizar dicho trabajo.
Norma a seguir para el control y/o anlisis desarrollados en el laboratorio.-
Limpiar la superficie de trabajo al inicio y al final de cada sesin de trabajo.
Anotar el tipo de muestra, procedencia, fecha y hora de extraccin de la misma y hora de llegada al
laboratorio y cualquier otra observacin previa al anlisis. En la prueba o el anlisis realizado se debe
anotar la tcnica empleada, los reactivos utilizados y los resultados obtenidos.
Identificar las muestras antes de comenzar la prueba o el anlisis; y en general, no desecharlas hasta haber
obtenido los resultados.
Manipular la muestra con los instrumentos previamente higienizados y/o esterilizados. No tocar las
muestras con las manos.
Colocar las pipetas y los dems materiales de vidrio usados en recipientes destinados para tal fin.
Desechar las envolturas de papel, botellas de plstico y otros en los que se trajera las muestras en los
respectivos tachos.
El material a descartar se debe colocar en recipientes especiales, debidamente rotulados para evitar
confusin con los materiales servibles. Si se derrama o quiebra un material de vidrio y/o recipiente con
material contaminante, no tocar nada. Avisar al responsable del laboratorio.
Una vez terminada la prctica deber colocar todo el material en las bandejas y/o recipientes
proporcionados por el tcnico de laboratorio.
Sugerencia para el uso de maquinarias y/o equipos de control.-
Leer cuidadosamente los manuales de funcionamiento.
Informarse del tcnico responsable sobre el estado de funcionamiento de la maquinaria y/o equipo de
control.
Higienizar la maquinaria y/o equipos de control antes y despus de haberlo utilizado.
No manipular las maquinarias y/o equipos de control sin la autorizacin del docente o del tcnico
responsable del rea.
Avisar si sucede algn problema durante el uso de la maquinaria y/o equipo de control.
Sobre la presentacin de los informes tcnicos de laboratorio.-
Los informes deben presentarse en las fechas establecidas y deben contener lo siguiente:
Portada.- Donde debe indicar lo siguiente: Universidad Catlica de Santa Mara; Facultad de Ciencias e
Ingenieras Biolgicas y Qumicas; Programa profesional de Ingeniera de Industria Alimentaria; Numero de
prctica desarrollada y Nombre de la prctica desarrollada; Alumnos que presentan el informe de prctica
(Cdigo, Apellidos y Nombres); Docente con quien desarrollo la prctica de laboratorio; Fecha de entrega
del informe de prctica
ndice.- Se debe enumerar las hojas presentadas e indicar en qu pgina se encuentra cada tem solicitado.
Introduccin.- Es la presentacin del o de los temas desarrollados en la prctica.
~ 7 ~
Marco terico.- Debe contener informacin relevante sobre el o los temas tratados en la prctica.
Generalmente sirve de soporte para la discusin de los resultados y el desarrollo del cuestionario.
Parte experimental.- Se detalla la forma como se ha desarrollado la experimentacin y se presentan los
resultados de la misma.
Discusin y conclusiones.- El informe deber brindar una explicacin de los resultados respecto a
informacin presentada en el marco terico, presentando finalmente una conclusin sobre el desarrollo de
la prctica.
Resumen.- Redactar el resumen en un solo prrafo, modo impersonal y en tiempo pasado, excepto las
conclusiones que llevan el verbo en presente. Cuidar que los datos cualitativos y cuantitativos sean exactos.
Bibliografa.- Proporciona la informacin de los textos, tesis, revistas, revisin de Internet, entre otros
utilizados para la elaboracin del informe.
Cuestionario.- Lea las preguntas atentamente, revise libros, revistas y/o investigaciones y responda con
claridad.
Anexos.- Se puede incluir fotos, grficos, u otro material que ayude a ilustrar los resultados obtenidos en la
prctica.
Algunos principios generales de Seguridad y Salud en el Laboratorio.-
El Diseo del Laboratorio (distribucin, instalaciones, procedimientos de trabajo, etc.) debe ser el adecuado
para el mantenimiento de un buen nivel preventivo.
Se debe disponer de las instalaciones de emergencia o elementos de actuacin como duchas, lavaojos,
extintores, etc. adems de los equipos de proteccin individual (tambin denominados EPIs).
El laboratorio, incluidas las zonas de paso, salidas, vas de circulacin, equipos e instalaciones deben estar
en perfecto estado de orden y limpieza, estableciendo para ello un mantenimiento peridico de las mismas.
Los desperdicios, manchas y residuos de sustancias peligrosas se eliminarn con rapidez.
Est prohibido realizar trabajos diferentes a los autorizados por los responsables directos, as como utilizar
aparatos e instalaciones sin conocer previamente su funcionamiento.
El personal debe lavarse las manos antes y despus de su entrada en el laboratorio.
La ropa de trabajo debe estar abrochada en todo momento, evitando vestir mangas anchas o colgantes, y
tener los cabellos recogidos.
Debe estar prohibido comer, beber y fumar en el laboratorio.
Cuando se llevan lentes de contacto, ser obligatorio el uso de gafas de seguridad.
El buen estado de los productos y materiales as como su etiquetado debe comprobarse antes de su
utilizacin.
Todos los preparados deben estar etiquetados adecuadamente, estando prohibida la reutilizacin de los
envases vacos sin la retirada de la etiqueta original.
Para el encendido de los mecheros Bunsen se recomienda la utilizacin de encendedores piezoelctricos,
intentando reducir al mximo el uso de llamas vivas una vez encendidos.
Se deber trabajar, siempre que sea posible y operativo, en las vitrinas.
Una vez finalizada la operacin o la tarea en el laboratorio, se debern guardar los materiales y reactivos,
limpiar el lugar de trabajo, y asegurarse la desconexin de aparatos, conductos de agua y gas, etc.
~ 8 ~
Algunas sealizaciones de Seguridad en el Laboratorio.-
Seales de advertencia.- Presentan forma triangular, siendo el pictograma negro sobre fondo amarillo (el
amarillo deber cubrir el 50% de la superficie) con bordes negros. Excepcin ser el fondo de la seal sobre
materias nocivas o irritantes de color naranja.
MATERIAL TOXICO
MATERIAL INFLAMABLE
MATERIAL EXPLOSIVO
MATERIAL IRRITANTE
Seales de prohibicin.- Presentan forma redonda, siendo el pictograma negro sobre fondo blanco, bordes
y banda rojos (el rojo deber cubrir el 35%).
PROHIBIDO PASAR
PROHIBIDO FUMAR
PROHIBIDO FUMAR Y
ENCENDER FUEGO
PROHIBIDO TOCAR
Seales de obligacin.- Presentan forma redonda, siendo el pictograma blanco sobre fondo azul (el azul
deber cubrir el 50% de la superficie de la seal).
USO OBL.IGATORIO
DEL MANDIL
USO OBLIGATORIO DE
LENTES DE SEGURIDAD
USO OBLIGATORIO
DE GUANTES
VIA OBLIGATORIA
PARA PEATONES
Seales de lucha contra incendios.- Presentan una forma rectangular o cuadrada, con el pictograma de
blanco sobre un fondo rojo (el rojo deber cubrir el 50% de la superficie).
EXTINTOR
MANTA APAGAFUEGOS
TELEFONO PARA USO
EN CASO DE INCENDIO
MANGUERA CONTRA
INCENDIO
Seales de salvamento o socorro.- Presentan una forma rectangular o cuadrada, con el pictograma de color
blanco sobre un fondo verde (el verde deber cubrir el 50% de la superficie).
PRIMEROS AUXILIOS
DUCHA DE
EMERGENCIA
LAVADO OJOS DE
EMERGENCIA
SALIDA DE
EMERGENCIA
Seal complementaria de riesgo permanente.- La sealizacin se efectuar mediante franjas alternas
amarillas y negras. Las franjas debern tener una inclinacin de 45 y ser de dimensiones similares al
modelo:
~ 9 ~
Prctica N 01
TEMA SOLUCIONES VALORADAS
OBJETIVO(S)
Teorizar y calcular la preparacin de soluciones
Preparar soluciones y disoluciones
Aplicar distintas tcnicas en la preparacin de soluciones
Valorar soluciones por el mtodo de titulacin
Diferenciar entre distintos tipos de patrones
MARCO TERICO:
Las soluciones son mezclas de dos o ms componentes, que pueden
separarse por mtodos fsicos en sus diversas substancias componentes. En
una solucin, aquella substancia que se encuentra en mayor proporcin se
conoce como solvente y las dems como solutos. La relacin o
proporcin de la mezcla soluto a solvente se conoce como concentracin.
Las soluciones verdaderas difieren de las suspensiones y de los sistemas
coloidales, fundamentalmente en el tamao de partcula del soluto o de la
fase dispersa y en las propiedades que derivan de dicha diferencia. En
general, las soluciones verdaderas en fase lquida, no desprenden soluto
por decantacin ni tienen la propiedad de dispersar la luz. En rigor, se dice
que una partcula se encuentra en solucin cuando esta se halla dispersa
en otro medio, en un grado de fragmentacin inferior a 0,45 .
Existen varias formas de referirse a la concentracin de una solucin, esto es, a la proporcin de soluto a
solvente. Para efectos cualitativos, frecuentemente se habla de soluciones diluidas, concentradas, saturadas
o sobresaturadas. Sin embargo, ya que en muchos casos estas descripciones cualitativas no son suficientes, la
forma cuantitativa de referirse a la proporcin de soluto a solvente (concentracin) de una solucin, es
mediante los conceptos de Molaridad (M), Normalidad (N), el porcentaje peso a peso (PPP), el porcentaje peso
a volumen (PPV), las partes por milln (ppm) y las partes por billn (ppb).
Molaridad.- es por excelencia, la forma como se expresa la concentracin de una solucin en trabajos de
qumica, fsica, biologa o ingeniera. La molaridad es por definicin, el nmero de moles de soluto que se
hallan contenidos en un litro de solucin, tambin es en el laboratorio la mejor forma de prepararla.
Para preparar una solucin 1 molar se tiene:
Normalidad: es el nmero de equivalentes gramo de soluto que se hallan contenidos en 1 litro de solucin.
El valor del equivalente gramo de un cido, base o sal depende de su papel como reactivo en la reaccin de
que se trate. Un equivalente gramo del oxidante o del reductor es igual a la masa formula dividida entre la
suma de los cambios en el nmero de oxidacin de los tomos que intervienen en la frmula del oxidante o
del reductor, esto es:
~ 10 ~
Porcentaje peso a peso: es una relacin que expresa los gramos de soluto que se hallan contenidos en cada
100 gramos de solucin. Esta forma de expresar la concentracin implica al momento de preparar una
solucin, pesar separadamente el soluto y el solvente. Si bien, este procedimiento facilita la comprensin de la
proporcin de la mezcla la aplicacin de esta forma de referirse a la concentracin en el trabajo rutinario de
laboratorio se dificulta un poco, debido a que obliga a conocer tambin la densidad de la solucin. A esta
desventaja se le suma el hecho de que a los lquidos, es ms fcil medirles el volumen que medirles la masa.
La expresin porcentual peso a peso de las soluciones se conserva particularmente, para las soluciones
acuosas de los gases, tales como el HCl, el HF, el HBr y el NH
3
. La mayora de los cidos que se utilizan como
reactivos en el laboratorio (clorhdrico, ntrico, sulfrico, actico, fosfrico, entre otros) vienen con sus
concentraciones en trminos de porcentaje peso a peso. Para facilitar el manejo de estas soluciones, la
concentracin peso a peso de la solucin se acompaa con tablas que registran la densidad de la solucin a
diferentes concentraciones.
Porcentaje peso a volumen: es una relacin que expresa los gramos de soluto que se hallan contenidos en
cada 100 mililitros de solucin. Esta forma de expresar la concentracin de una solucin facilita enormemente
su preparacin y aplicacin; el nico inconveniente radica en que el porcentaje peso a volumen es una unidad
muy grande para muchos fines analticos frecuentes. Generalmente, cuando se expresa la concentracin de
una solucin en trminos porcentuales, la expresin se refiere al porcentaje peso a volumen.
Partes por milln: La expresin porcentual, molar o normal para referirse a la concentracin de una solucin,
se aplica generalmente a las soluciones en las cuales la proporcin de soluto a solvente es relativamente alta,
proporcin que generalmente se halla en la escala de las partes por mil. Sin embargo, existen muchas
substancias cuya concentracin regular en una solucin es mucho menor que las partes por mil.
Las partes por milln son una relacin que expresa las partes de soluto que se hallan contenidas en un milln
de partes de solucin. De esta forma, las partes por milln pueden expresarse como, los gramos de soluto por
metro cubico de solucin, los gramos de soluto por tonelada de solucin o los miligramos de soluto por
kilogramo de solucin. Ya que esta forma de expresar la concentracin de una solucin se utiliza
particularmente para soluciones muy diluidas y como un kilogramo equivale a un litro en trminos de
volumen, generalmente las partes por milln se asocian a los miligramos de soluto contenidos en cada litro
de solucin.
Preparacin de soluciones: Uno de los problemas que con mayor frecuencia
se deben resolver en un laboratorio, lo constituyen el acondicionamiento y
concentracin de las soluciones a las necesidades especficas de los
diferentes usos; esto, debido a que con frecuencia la concentracin de las
soluciones de trabajo dista mucho de la concentracin de los reactivos en su
presentacin comercial.
Este es precisamente el caso de los cidos clorhdrico, ntrico, sulfrico,
fosfrico y actico, cuyas soluciones de trabajo se preparan normalmente
por dilucin de otras ms concentradas: tambin en algunos casos, son las mismas muestras las que deben
diluirse con objeto de adecuar la concentracin de alguno de sus constituyentes al rango de medicin de un
mtodo especfico de anlisis. Todos los procedimientos de dilucin, implican tcnicas y clculos que son
precisos conocer y desarrollar para poder realizar.
~ 11 ~
Valoracin: Aunque tericamente la preparacin de soluciones involucra
procedimientos de clculo y la forma como se debe preparar, en la prctica existen
muchos inconvenientes que obligan, a que una vez que la solucin ha sido
preparada en la forma descrita, deba realizarse un proceso de confirmacin de esta
concentracin: Dicho proceso de chequeo o certificacin se conoce como
valoracin. As, valorar una solucin, es certificar su concentracin por
comparacin con la concentracin de una solucin patrn o de referencia.
Anlisis volumtrico: en este procedimiento se determina la concentracin de una
solucin cuya concentracin se desconoce, midiendo el volumen que se requiere
de ella para reaccionar con un volumen fijo de otra solucin cuya concentracin es
perfectamente conocida. Esta operacin se le conoce como titulacin,
normalizacin o valoracin volumtrica, exige el conocimiento de la reaccin
qumica involucrada. Con frecuencia se agrega a la mezcla reaccionante una
substancia que tiene por objeto indicar el momento en el cual la valoracin ha
alcanzado el punto de equivalencia.
Desde el punto de vista qumico, un indicador es una substancia que reacciona
con el agente titulante pero cuya constante de formacin es menor que la
correspondiente al producto de la reaccin entre el agente titulante (reactivo que
se adiciona desde una bureta) y el agente titulado (Substancia que reacciona con el
agente titulante y que se halla presente en la solucin problema). As, el indicador reacciona solamente
cuando en el medio ya no exista el agente titulado.
Como ya se dijo antes, en el punto final de una valoracin volumtrica la cantidad de agente titulado debe ser
igual a la cantidad del agente titulante o lo que es lo mismo, en el punto final de una valoracin, las
concentraciones de los solutos reaccionantes deben ser equivalentes. Por tal razn:
Solucin saturada: Es aquella solucin que no disuelve ms soluto; es decir la solubilidad de soluto llego a su
lmite, esta solucin se encuentra en un equilibrio dinmico.
Solucin sobresaturada: Contiene mayor cantidad de soluto que la solucin saturada; este se pudo disolver en
la solucin a una temperatura superior a la solucin saturada. La solubilidad de las substancias, depende entre
otros factores, de la temperatura, como consecuencia disminuye la solubilidad y la sustancia puede, por
ejemplo, separarse por cristalizacin. Debido a este efecto, las soluciones sobresaturadas se preparan de las
soluciones saturadas caliente, en las cuales se logr, a una nueva temperatura disolver ms soluto. Se tiene
cuidado de no enfriar bruscamente la solucin saturada para que la sustancia en exceso no cristalice.
MATERIA PRIMA, EQUIPOS Y REACTIVOS:
Sacarosa comercial (azcar de caa)
Cloruro de sodio (Sal comn)
Piceta con agua destilada
Balanza analtica ( 0,0001 g)
Balanza gramera ( 0,001 g)
Probeta
Bureta de 25 ml con soporte
Fiola 50, 100 ml
Erlemeyer 100 ml
Beaker 100 ml
Pipeta 1, 2, 5, 10, 20 ml
Vidrio de reloj
Embudo de vidrio
Esptula
~ 12 ~
Pro pipeta
Hidrxido de sodio en escamas
cido clorhdrico al 10 %
Hidrxido de sodio 1 N (solucin valorada)
cido clorhdrico 1 M (solucin valorada)
Fenolftalena al 1% en solucin alcohlica al 50 %
PROCEDIMIENTO EXPERIMENTAL:
Preparacin de una solucin de sacarosa al 3 % m/v
Calcular la cantidad de sacarosa que debe pesar para preparar 50 ml de solucin.
Seleccionar el vaso de precipitados ms adecuado para pesar el soluto y disolverlo en la menor cantidad
posible de solvente.
Pesar la cantidad necesaria de sacarosa en balanza gramera
Agregar agua en la menor cantidad posible que permita la disolucin
Trasvasar cuidadosamente la disolucin a una fiola de 50 ml
Lavar el vaso repetidas veces con pequeas alcuotas de solvente. Tener presente no superar el aforo
del matraz.
Llevar el volumen hasta 1 cm del aforo y dejar reposar para que escurra el lquido de las paredes.
Enrasar a volumen con una piceta, tapar e invertir para homogeneizar la mezcla.
Rotular la solucin resultante
Preparacin de una solucin 0,1 N de hidrxido de sodio
Calcular la masa de reactivo slido que se necesitan para preparar 100 ml de solucin.
Efectuar la pesada usando una esptula plstica
Disolver las lentejas en un volumen de agua destilada pequeo agitando con varilla de vidrio. Al ser la
reaccin exotrmica notar un aumento de temperatura lo que favorecer la disolucin.
Completada la disolucin, transvasar a una fiola lavando 3 o 4 veces para no perder material.
Llevar luego a su volumen final.
Una vez enrasada, invertir el matraz para homogenizacin de la mezcla.
Rotular, guardando la solucin tapada pues se carbonata.
Preparacin de una solucin 0,1 N de cido clorhdrico
Partir de una solucin concentrada, en el caso del HCl, densidad 1,19 g/ml, 37% m/m.
Calcular que volumen de cido concentrado ser necesario para preparar 100 ml de cido 0,1N
Utilizando Pro pipeta, tomar el cido concentrado del recipiente que lo contiene. Siempre enrasar a cero
la pipeta utilizada y descargar el volumen necesario segn el clculo
Volcar el volumen medido sobre unos 20 o 30 ml de agua destilada contenidos en la fiola del volumen
adecuado a la cantidad de solucin que desea realizar.
Agitar suavemente para mezclar, no inclinar el matraz
Llevar al volumen final deseado con agua destilada con la ayuda de piceta o pipeta.
Rotular.
Valoracin de una solucin de NaOH utilizando ftalato acido de potasio (FHK) como patrn primario
Para realizar esta experiencia necesita montar el equipo para una valoracin volumtrica. Tenga en
cuenta los materiales a utilizar (soporte, bureta, erlemeyer).
Preparar 3 matraces erlenmeyer donde cada uno contenga 10 ml de solucin de FHK y agregar 2 gotas
de fenolftalena.
Cargar la bureta con solucin de NaOH preparado
Usando el robinete, agregar NaOH hasta aparicin de la una suave coloracin rosada. Tome nota de ese
volumen.
Repita el procedimiento con los dos erlenmeyer restantes a fin de obtener un promedio de medidas.
Calcular la concentracin real de la solucin de NaOH
~ 13 ~
Valoracin de una solucin de NaOH utilizando cido clorhdrico valorado (HCl) como patrn secundario
Para realizar esta experiencia necesita montar el equipo para una valoracin volumtrica. Tenga en
cuenta los materiales a utilizar (soporte, bureta, erlemeyer).
Preparar 3 matraces erlenmeyer donde cada uno contenga 10 ml de solucin de HCl y agregar 2 gotas
de fenolftalena.
Cargar la bureta con solucin de NaOH preparado
Usando el robinete, agregar NaOH hasta aparicin de la una suave coloracin rosada. Tome nota de ese
volumen.
Repita el procedimiento con los dos erlenmeyer restantes a fin de obtener un promedio de medidas.
Calcular la concentracin real de la solucin de NaOH
Valoracin de una solucin de HCl utilizando NaOH como patrn secundario
Utilizando la solucin de NaOH, previamente valorada por el tcnico de laboratorio, utilizar esta como
patrn secundario para valorar la solucin de HCl.
Cargar en la bureta la solucin de HCL y en cada uno de los tres erlenmeyer, 10 ml de solucin de NaOH
de concentracin conocida y dos gotas de fenolftalena.
Titular la solucin de NaOH hasta la desaparicin del color rosado en el erlenmeyer
Tomar nota del volumen gastado
Repetir los pasos anteriores en los dos erlenmeyer restantes.
Calcular la concentracin exacta del HCl preparado
CUESTIONARIO:
1. Qu funcin cumple el FHK en la secuencia de titulacin? Por qu?
2. Por qu se considera que NaOH es un patrn secundario?
3. Cul es la funcin de la fenolftalena en las titulaciones realizadas?
4. Considera que este trabajo prctico es de utilidad para su formacin como estudiante de ingeniera en
industria alimentaria? Por qu?
PROBLEMAS A DESARROLLAR EN LA PRCTICA
1. Calcular cunto debo pesar de NaOH solido (en perlas) para preparar una solucin 1 molar (1 M)
2. Calcular cunto debo pipetear de HCl grado qumicamente puro (QP) para preparar una solucin 1
normal (1 N)
~ 14 ~
3. Que cantidades debo mezclar de agua destilada y HCl 1 M para preparar 100 ml de una solucin de HCl
0,1 N
4. Calcular cunto de H
2
SO
4
QP debo utilizar para preparar 1 litro de una solucin 0,1 N
5. Que cantidad de H
2
SO
4
con una densidad de 1,84 gr/cm
3
debo mezclar con agua para obtener 100 ml un
reactivo de H
2
SO
4
con una densidad de 1,80 gr/cm
3
6. Cuanto debo mezclar de HCL al 10 % con agua destilada para preparar 250 ml de HCl 0,25 M
7. Cuanto debo mezclar de HCL al 10 % con agua destilada para preparar 250 ml de HCl 0,25 M
~ 15 ~
Prctica N 02
TEMA ACTIVIDAD ENZIMATICA EN TEJIDOS ANIMALES Y VEGETALES
OBJETIVO(S)
Estudiar el efecto de una enzima presente en tejidos animales y vegetales.
Comparar la accin de la peroxidasa (catalizador presente en tejidos orgnicos) y del
MnO
2
(catalizador inorgnico) sobre un mismo sustrato (agua oxigenada)
Estudiar el efecto de la temperatura en la intensidad de la reaccin
Medir la actividad cataltica por medio del desprendimiento de burbujas y la
produccin de calor.
MARCO TERICO:
En el mbito de la bioqumica de los alimentos la enzimologa es quizs uno de
los campos que se ha desarrollado ms rpidamente en los ltimos aos.
Los amplios estudios realizados en esta rea han puesto en evidencia la
importancia de los procesos enzimticos en la elaboracin y conservacin de los
alimentos. Fenmenos tan importantes en la tecnologa actual, como las
reacciones de pardeamiento enzimtico (frutas), de rancidez (grasas y aceites),
de coloracin (vegetales verdes), de textura (salsa de tomate) son ejemplos muy
conocidos de la intervencin de enzimas.
Estas sustancias catalizadoras de los procesos vitales pueden presentarse
extraordinariamente activas durante el periodo posterior a la cosecha (alimentos
vegetales) y los cambios que ellas determinan pueden influir en forma
considerable sobre los caracteres organolpticos, textura y presentacin del
producto terminado.
As como hay enzimas perjudiciales que deben ser inactivadas en el momento oportuno, hay otras que la
tecnologa de los alimentos utiliza para una mejor preparacin del alimento, como lo son las enzimas de
filtracin o de clarificacin, las enzimas proteolticas, para ablandar las carnes. La glucosa-oxidasa, que permite
eliminar la glucosa de ciertos alimentos, para evitar su pardeamiento posterior.
Tambin ha sido motivo de interesantes estudios la adicin de enzimas de accin aromatizante a los alimentos
o bebidas que durante su procesamiento han sufrido en su aroma pero han conservado sus precursores,
permitiendo, de este modo, restaurar sus componentes aromticos originales.
Las enzimas son protenas especficas que actan como catalizadores de las reacciones bioqumicas de todos
los seres vivos. La actividad enzimtica puede comprobarse experimentalmente mediante la identificacin y
cuantificacin de los productos formados de la reaccin que ellas regulan.
La accin de los compuestos proteicos en una reaccin, se afecta por la variacin de factores fsicos y qumicos
tales como la temperatura, la concentracin de la enzima y del sustrato, del pH, etc.
En esta prctica se disean experimentos utilizando un catalizador inorgnico (MnO
2
) y otro orgnico
(peroxidasa); esta ltima, se encuentra tanto en tejidos animales como vegetales y acta sobre el perxido de
hidrogeno o agua oxigenada (H
2
O
2
). El perxido es un producto de la actividad celular y el acumularse en
exceso intoxica la clula por lo cual debe ser degradado por una enzima especfica.
La reaccin en la cual interviene la peroxidasa se presenta de la siguiente manera:
Peroxidasa
2 H
2
O
2
2 H
2
O + O
2
~ 16 ~
Esta reaccin puede visualizarse por la formacin de burbujas, las cuales se producen debido al
desprendimiento de oxgeno. La cantidad de burbujas en una medida cualitativa proporcional a la intensidad
de reaccin y puede utilizarse para evaluar la dinmica de la reaccin.
Como la mayora de las enzimas, la peroxidasa puede ser inactivada por el calor, siendo una de las que
precisan mayor temperatura y ms tiempo para su inactivacin. Posee, adems, la propiedad peculiar de la
regeneracin enzimtica. Este fenmeno consiste en que al inactivarla por medio del calor recupera
parcialmente su actividad despus de un cierto tiempo. Esto ha sido explicado, aduciendo que la fraccin
proteica de la enzima sufre una desnaturalizacin slo parcial, con prdida de su estructura terciaria, cuando
el calor se aplica en un tiempo muy corto, se produce luego una reversin de la protena a su estado normal
por recombinacin de sus grupos hidrgenos o sulfhidrlicos.
Este efecto del calor sobre la actividad peroxidsica es muy, importante en la industria de alimentos y la
regeneracin enzimtica de la peroxidasa puede causar serios problemas en los caracteres organolpticos. Se
ha demostrado en el laboratorio que esta actividad enzimtica puede detenerse totalmente, si el
calentamiento es suficientemente largo, de manera que sobre 30" la regeneracin es muy dbil generalmente.
MATERIA PRIMA, EQUIPOS Y REACTIVOS:
Hgado de res
Papa blanca
Agua destilada
Agua oxigenada de 30 volmenes
Dixido de manganeso
Balanza analtica ( 0,0001 g)
Pipetas de 2 cc
Tubos de ensayo
Gradilla
Licuadora
Tabla de picar y cuchillo
Placas petri
Esptula
Bao de agua caliente
Balanza analtica
Cronometro
Soporte universal
Termmetro
PROCEDIMIENTO EXPERIMENTAL: se realizara los siguientes procedimientos:
Nota: conserve en una gradilla todos los tubos que utilice en esta prctica para efectuar comparaciones
posteriores.
Accin de un catalizador inorgnico sobre el H
2
O
2
: Marque cuatro tubos de ensayo con los nmeros 1, 2, 3,
4 agregue a cada tubo lo que pueda tomar con la punta de una esptula dixido de manganeso (procure
que las cantidades sean constantes para todos los tubos) y proceda de la siguiente manera:
Tome el tubo 1, agrguele 2 ml de agua oxigenada. Observe la intensidad de la reaccin para que
compare con los siguientes tubos; analizar qu papel desempea el MnO
2
y el H
2
O
2
en la reaccin;
verificar si hubo desprendimiento de calor.
~ 17 ~
Utilizando pinzas coloque el tubo 2 en bao de agua mara durante 10 minutos. Retrelo, deje enfriar y
agrguele 2 ml de agua oxigenada. Compare la reaccin con la anterior, se present con mayor o menor
intensidad. Analizar si la temperatura afecto al catalizador.
Coloque el tubo 3 en un recipiente con hielo durante 10 minutos, retrelo e inmediatamente agrguele 2
ml de agua oxigenada, compare la reaccin con las anteriores. Compare como afecto la disminucin de
la temperatura y cul es la accin del MnO
2
.
Tome el tubo 4, agrguele 4 ml de agua oxigenada. Observe la intensidad de la reaccin para que
compare con la reaccin con el tubo 1. Analizar si la cantidad de agua oxigenada influye en la reaccin.
Accin de un catalizador de origen animal sobre el H
2
O
2
: Marque cuatro tubos de ensayo con los nmeros
1, 2, 3, 4 agregue a los tubos 1, 2,3 un pedazo de hgado (procure que las cantidades sean constantes para
todos los tubos); Para el tubo 4, realice un licuado del hgado y agregue al tubo una cantidad similar al de
los tubos anteriores, luego proceda de la siguiente manera:
Tome el tubo 1, agrguele 2 ml de agua oxigenada. Observe la intensidad de la reaccin para que
compare con los siguientes tubos; analizar qu papel desempea el hgado en la reaccin; Explique cul
es la naturaleza qumica de la sustancia que cataliza esta reaccin; verificar si hubo desprendimiento de
calor.
Utilizando pinzas coloque el tubo 2 en bao de agua mara durante 10 minutos. Retrelo, deje enfriar y
agrguele 2 ml de agua oxigenada. Se presenta reaccin?; Como explica este resultado.
Coloque el tubo 3 en un recipiente con hielo durante 10 minutos, retrelo e inmediatamente agrguele 2
ml de agua oxigenada. Ocurre reaccin?. Como es su intensidad en relacin con las reacciones
anteriores. Que efecto tiene la disminucin de la temperatura sobre el catalizador?. Cree usted que si se
agrega el agua oxigenada se agrega despus que el hgado vuelva a la temperatura ambiente, la
intensidad de la reaccin seria como la del tubo 1. Explique.
Tome el tubo 4, agrguele 2 ml de agua oxigenada. Observe la intensidad de la reaccin para que
compare con la reaccin con el tubo 1. Analizar si la reaccin es en mayor o menor intensidad a la del
hgado sin homogenizar. Porque?.
Accin de un catalizador de origen vegetal sobre el H
2
O
2
: Marque cuatro tubos de ensayo con los nmeros
1, 2, 3, 4 agregue a los tubos 1, 2,3 un pedazo de papa (procure que las cantidades sean constantes para
todos los tubos); Para el tubo 4, realice un licuado de papa y agregue al tubo una cantidad similar al de los
tubos anteriores, luego proceda de la siguiente manera:
Tome el tubo 1, agrguele 2 ml de agua oxigenada. Observe la intensidad de la reaccin para que
compare con los siguientes tubos; analizar qu papel desempea la papa en la reaccin; Explique cul es
la naturaleza qumica de la sustancia que cataliza esta reaccin; verificar si hubo desprendimiento de
calor.
Utilizando pinzas coloque el tubo 2 en bao de agua mara durante 10 minutos. Retrelo, deje enfriar y
agrguele 2 ml de agua oxigenada. Se presenta reaccin?. Como explica este resultado.
Coloque el tubo 3 en un recipiente con hielo durante 10 minutos, retrelo e inmediatamente agrguele 2
ml de agua oxigenada. Ocurre reaccin?. Como es su intensidad en relacin con las reacciones
anteriores. Que efecto tiene la disminucin de la temperatura sobre el catalizador?.
Deje el tubo en reposo por unos 5 minutos y observe de nuevo la reaccin. Que ha ocurrido?. Que
explicacin tiene este hecho.
Tome el tubo 4, agrguele 2 ml de agua oxigenada. Observe la intensidad de la reaccin para que
compare con la reaccin con el tubo 1. Analizar si la reaccin es en mayor o menor intensidad a la da la
papa sin homogenizar. Porque?
Medicin de la accin de una enzima en trminos de la produccin de calor: Haga el montaje de tal manera
que pueda proceder como se indica a continuacin: Coloque un tubo de ensayo en una gradilla y adicione
una cantidad constante de muestra homogenizada (papa e hgado, un tubo para cada muestra), inserte en
~ 18 ~
cada tubo un termmetro con la escala de tal forma que pueda leer los valores (el termmetro debe
dejarse descansar libremente). Tome la temperatura inicial. Posteriormente proceda de la siguiente
manera:
En el tubo con el homogenizado de papa adicione 2 ml de agua oxigenada y empiece a observar los
valores de temperatura cada 30 segundos. Las variaciones de temperatura que tengan lugar deben
quedar registradas por pequeas que estas sean. Anote los datos en la tabla y realice una grfica con los
datos obtenidos. Tiempo (seg); Temperatura (C)
Seg 0 30 60 90 120 150 180 210 240 270
C
En el tubo con el homogenizado de hgado adicione 2 ml de agua oxigenada y empiece a observar los
valores de temperatura cada 30 segundos. Las variaciones de temperatura que tengan lugar deben
quedar registradas por pequeas que estas sean. Anote los datos en la tabla y realice una grfica con los
datos obtenidos.
Seg 0 30 60 90 120 150 180 210 240 270
C
Grafique los resultados obtenidos
CUESTIONARIO:
1. Cmo varia la accin enzimtica sobre la naturaleza fsica de la muestra, comparar resultados del hgado y
la para homogenizadas y sin homogenizar?
2. Cul es la funcin de un catalizador sobre la velocidad de reaccin?
3. Diagrame el mecanismo de accin enzima-sustrato soportado sobre las nuevas teoras existentes?
~ 19 ~
Prctica N 03
TEMA ACTIVIDAD DE LA TIROSINASA EN EL PARDEAMIENTO ENZIMATICO
OBJETIVO(S)
Experimentar la extraccin de la enzima tirosinasa a partir de la manzana
Evaluar el efecto de la concentracin de la enzima en la medicin de la actividad del
pardeamiento enzimtico
Evaluar el efecto de la concentracin del sustrato en la medicin de la actividad del
pardeamiento enzimtico
Determinar los parmetros cinticos para la actividad de la tirosinasa presente en la
manzana
MARCO TERICO:
ltimamente, la produccin de frutas y hortalizas mnimamente procesadas (FyHMP) ha crecido notoriamente
tanto en cantidad como en variedad, debido a que proporcionan al consumidor un producto similar al fresco
con una vida til relativamente prolongada y, al mismo tiempo, garantizan su inocuidad, calidad nutritiva y
sensorial.
La apariencia, determinada principalmente por el color, es uno de los
atributos ms utilizados por los consumidores para evaluar la calidad
de FyHMP. El color, se debe a los pigmentos naturales, como las
clorofilas, los carotenoides y las antocianinas, o a los pigmentos que
resultan de las reacciones de pardeamiento enzimtico. Este proceso,
relacionado con la actividad de la enzima polifenoloxidasa (PPO), no
ocurre en clulas de la planta intacta debido a que los sustratos
(compuestos fenlicos) estn contenidos en vacuolas celulares
citoplasmticas, separadas de la enzima. Una vez que el tejido celular
es daado, ya sea por la propia manipulacin o por el corte de la
fruta, se pierde la compartimentalizacin celular, se pone en
contacto la enzima y el sustrato, y se desencadenan las reacciones de
pardeamiento.
Las polifenoloxidasas, tambin conocidas como tirosinasas, fenoloxidasasas, monofenoloxidasas o cresolasas,
catalizan la hidroxilacin de monofenoles a ortodifenoles, posteriormente oxidados a ortoquinonas, las cuales
se polimerizan dando lugar a pigmentos que presentan color marrn, rojo o negro, dependiendo de los
componentes naturales presentes en los tejidos vegetales.
Para que el fenmeno de pardeamiento enzimtico tenga lugar se requiere de la presencia de cuatro
diferentes compuestos: el oxgeno molecular, substratos apropiados, la polifenoloxidasa y la presencia de
cobre en el centro activo de la enzima. Estos factores determinan la velocidad de pardeamiento, que puede
tener lugar muy rpidamente, incluso en 30 min. Esta velocidad depender de factores tales como la
concentracin y actividad de la enzima, la cantidad y naturaleza de los compuestos fenlicos, pH,
temperatura, actividad del agua y de la cantidad de oxgeno disponible en el entorno del tejido vegetal. Otros
factores intrnsecos que influyen en la intensidad del pardeamiento son: la especie, la variedad y el estado
fisiolgico de los frutos.
En la industria alimentaria es comn que en las operaciones unitarias de reduccin de tamao de productos
como la papa, manzana, pltanos u otras frutas adquieran un color marrn; esto se debe a la conversin del
aminocido tirosina en el pigmento melanina de acuerdo con la secuencia de reacciones que se describen a
continuacin:
~ 20 ~
El mismo proceso ocurre en la piel por exposicin a la radiacin ultravioleta. Las reacciones enzimticas son
catalizadas por la tirosinasa (monofenol dihidroxifenilalanina: oxigeno oxidoreductasa); la enzima se encuentra
en el interior del tejido vegetal, y dado que la reaccin requiere O
2
, esta no ocurre hasta que los productos en
su parte interior estn expuesta al aire.
MATERIA PRIMA, EQUIPOS Y REACTIVOS:
Manzana
Agua destilada
Agua destilada
Buffer 1. Fosfato de sodio 0,1 M a pH 7,2 Mantenido en refrigeracin ( 2C )
Buffer 2. Fosfato de sodio 0,1 M a pH 6,0
D.L-dihidroxifenilalanina 20 mM (DOPA)
Balanza analtica ( 0,0001 g)
Mortero
Bao de hielo
Bao de agua caliente
Tubos de ensayo
~ 21 ~
Gradilla
Balanza gramera
Pipeta de 20, 5, 2, 1, 0,1 ml
Embudo Buchner con sistema de vaco
Papel Whatman N 42
Centrfuga a 3500 RPM
Espectrofotmetro a 420 nm
PROCEDIMIENTO EXPERIMENTAL: se realizara los siguientes procedimientos:
Nota: conserve en una gradilla todos los tubos que utilice en esta prctica para efectuar comparaciones
posteriores.
Extraccin de la enzima tirosinasa
Lavar cuidadosamente la manzana para evitar que se dae la cascara y se produzca el pardeamiento
enzimtico rpidamente; una alternativa es que la manzana este previamente refrigerada a 2 C para
retardar el pardeamiento.
Colocar 40 gramos de manzana en un mortero pre-enfriado con hielo (adems puede mantenerse
previamente en refrigeracin a 2 C) y extraer el zumo de la manzana.
Filtrar al vaco en un embudo buchner conectado a un sistema de vaco (empapar el papel filtro con el
Buffer 1 para que se pegue perfectamente en el embudo)
Centrifugar a 3500 rpm durante 5 minutos a 4 C
Recuperar el sobrenadante y dividirlo en las porciones que sean necesarias. Las muestras deben ser
colocadas en bao de hielo, este extracto presenta un color marrn oscuro caracterstico, el cual se
vuelve ms oscuro con el paso del tiempo.
Medicin de la actividad enzimtica en funcin a la concentracin de la enzima.
La actividad de la tirosinasa puede ser fcilmente determinada colorimtricamente midiendo el aumento
de absorbancia a 420 nm debido a la conversin de la DOPA en DOPA-cromo (color rojo)
Pipetear en una celda para espectrofotmetro 0,2 ml del extracto y 3,8 ml del Buffer 2.
La reaccin inicia con la adicin de 1 ml de DOPA (mezclar varias veces por inversin y colocar la celda
en el espectrofotmetro previa calibracin del instrumento)
Llevar a cero la absorbancia y comenzar a cronometrar rpidamente, medir la absorbancia a 420 nm
cada minuto hasta el minuto 10, sin retirar la celda del espectrofotmetro. (Prueba P1)
Repetir el experimento pero pipeteando las siguientes cantidades en la celda de medicin: 0,4 ml del
extracto, 3,6 ml del Buffer 2 y 1 ml de DOPA. (Prueba P2)
Para obtener los datos de calibracin de la absorbancia de la reaccin enzimtica debe pipetear 2 ml del
extracto en un tubo de ensayo, calentarlo en bao mara a ebullicin durante 10 minutos; enfriar y
realizar la prueba de actividad enzimtica con 0,4 ml del extracto, 3,6 ml del Buffer 2 y 1 ml de DOPA
medida espectrofotomtricamente a 420 nm durante 10 minutos, con intervalos de lectura de 1 minuto,
como se realiz en los anteriores experimentos. (Prueba de calibracin PC)
Nota: las celdas de medicin deben estar perfectamente limpias y secas por fuera antes de medir, de
otro modo las medidas de absorbancia pueden ser afectadas por errores de lectura.
Completar la siguiente tabla con los valores de absorbancia a 420 nm.
Min 0 1 2 3 4 5 6 7 8 9 10
P1
P2
PC
~ 22 ~
Encontrar la velocidad V
0
para cada muestra
Muestra
Velocidad (V
0
)
Dibujar una grfica donde se muestre la relacin entre absorbancia y el tiempo.
Medicin de la actividad enzimtica en funcin a la concentracin del sustrato.
Se repetir el experimento anterior utilizando 0,4 ml del extracto enzimtico y variando la concentracin
de L-DOPA (preferiblemente 5 concentraciones distintas) se medir la absorbancia cada minuto durante
6 minutos.
Enzima Buffer Sustrato 0 min 1 min 2 min 3 min 4 min 5 min 6 min
A 0,4 ml 3,6 ml 1,0 ml
B 0,4 ml 3,1 ml 1,5 ml
C 0,4 ml 2,6 ml 2,0 ml
D 0,4 ml 2,1 ml 2,5 ml
E 0,4 ml 1,6 ml 3,0 ml
Nota 1: Para el experimento con 1 ml de DOPA se puede utilizar los datos obtenidos anteriormente
Nota 2: Enzima: Polifenoloxidasa
Buffer: Fosfato de sodio 0,1 M a pH 6,0
Sustrato: D.L-dihidroxifenilalanina 20 mM (L-DOPA)
~ 23 ~
Graficar absorbancia en funcin del tiempo para las diferentes concentraciones de sustrato estudiadas.
Calcular la V
0
para las 5 concentraciones de sustrato estudiadas, se puede calcular as: V
0
= Abs / t
Una forma ms cientfica es determinando la regresin lineal de los puntos que puedan tener una
correlacin 0,98
Completar la siguiente tabla
[] ()
[]
(
)
A
B
C
D
E
~ 24 ~
Representar los datos obtenidos en una grfica doble recproca o de Lineweaver-Burk y hallar
grficamente los valores de Km y Vmax.
Calcular matemticamente los valores de
mediante la siguiente expresin
[]
)
CUESTIONARIO:
1. Qu enzima se est estudiando? De qu tipo de enzima se trata
2. Cules son los sustratos y los productos in- vivo e in-vitro?
3. Cmo se podr medir la formacin de productos?
~ 25 ~
Prctica N 04
TEMA INHIBICION DE LA ACTIVIDAD ENZIMATICA DE LA POLIFENOLOXIDASA
OBJETIVO(S)
Experimentar la extraccin de la enzima polifenoloxidasa de los championes
Evaluar el efecto de inhibidores en la medicin de la actividad enzimtica de la
polifenoloxidasa extrada de los championes
Evaluar el efecto de la concentracin de un inhibidor qumico en la medicin de la
actividad del pardeamiento enzimtico de la polifenoloxidasa.
Determinar los parmetros cinticos de la actividad de la polifenoloxidasa presente en
la presente en los championes tratados con inhibidores qumicos.
MARCO TERICO:
La polifenoloxidasa conocida como tirosinasa, fenolasa, catecol oxidasa, o-
difenoloxidasa, monofenol oxidasa cresolasa, fue descubierta y aislada inicialmente de
championes; ella acta sobre dos tipos de sustratos: monohidroxifenoles como por
ejemplo el p-cresol hidroxilandolos en posicin orto con respecto al grupo hidroxilo
original, EC 1.14.18.1, y sobre o-dihidroxifenoles tales como el catecol, oxidndolos a
benzoquinonas por remocin de hidrgenos del grupo hidroxilo.
La caracterstica estructural ms importante de la polifenoloxidasa (PPO) es la
presencia, en su centro activo, de dos tomos de cobre unidos a histidina. Alrededor
de ellos, se sitan aminocidos hidrofbicos con anillos aromticos, importantes para
su unin a los sustratos. La primera metodologa utilizada para controlar el
pardeamiento enzimtico, consisti en la adicin de sulfitos que actan como agentes
reductores transformando las o-quinonas en difenoles menos reactivos para prevenir
el desarrollo de melaninas. Si bien de esta forma se previene el pardeamiento
enzimtico, su utilizacin ha sido restringida en vegetales y frutas debido a que el uso
de esta sustancia present casos de reacciones alrgicas en individuos, especialmente
asmticos, que consumieron alimentos que contenan este agente reductor. Las
reacciones de pardeamiento enzimtico pueden, tambin controlarse mediante
mtodos fsicos que incluyen la reduccin de temperatura y/o de la disponibilidad del
oxgeno molecular, el uso de atmsferas modificadas o recubrimientos comestibles y
tratamientos con irradiacin gamma o altas presiones hidrostticas. Por otro lado,
puede utilizarse mtodos qumicos basados en la utilizacin de compuestos que
inhiben la enzima, reducen la disponibilidad del sustrato y/o de los productos de la
catlisis enzimtica que evitan la formacin de productos coloreados.
Su aplicacin en los alimentos est restringida debido a consideraciones relevantes
tales como la toxicidad, la salubridad y el efecto que puede causar sobre el sabor, la
textura o eventualmente por el costo. Entre los agentes reductores utilizados en la
actualidad, se encuentra el cido ascrbico que reduce las o-benzoquinonas a o-
difenoles. Dado que durante la reaccin este compuesto se consume por oxidacin, la
proteccin que confiere es slo temporal y tambin pueden aplicarse los cidos
orgnicos para controlar el pardeamiento enzimtico que logran disminuir el pH y
garantizar la inocuidad microbiolgica. Adems, algunos de ellos, pueden actuar como
fungicidas/fungistticos y como inhibidores del crecimiento de gran parte de la flora
de deterioro.
Los acidulantes se utilizan frecuentemente en combinacin con otros agentes de antipardeamiento, debido a
que es muy difcil lograr una inhibicin completa del oscurecimiento nicamente por el control del pH. El ms
~ 26 ~
utilizado es el cido ctrico que reduce el pardeamiento capturando o quelando el cobre del sitio activo de la
PPO, y potencia el efecto de compuestos tales como el cido ascrbico. Otro compuesto de inters es el cido
etilendiamino tetraactico (EDTA) que inactiva a la enzima y forma complejos con iones de metales pesados
tales como el cobre de la PPO.
Entre las sales propuestas para controlar el pardeamiento la ms usada es el coluro de sodio (NaCl), cuya
accin impide la actividad de la polifenoloxidasa frente al cido clorognico. Una inmersin en solucin acuosa
diluida de NaCl (0,3%) se usa mucho cuando se quiere evitar por corto tiempo el oscurecimiento de frutas
peladas, como rodajas de manzanas, antes de ser sometidas al procesamiento.
El efecto inhibitorio de la POO mediante radiaciones de microondas ha sido objeto de varias investigaciones.
En el control del pardeamiento de rodajas de pltano, el tratamiento de inactivacin a 650 W durante 2
minutos mostr grandes variaciones de eficiencia segn la madurez del producto tratado. Con un tratamiento
a 475 W durante 60 segundos se obtuvo una inactivacin del 70% de la PPO en purs de kiwi y fresa. La
disminucin de la actividad polifenoloxidasa en ambos productos fue casi lineal a la potencia utilizada en el
tratamiento. No obstante, el color de los productos tratados trmicamente con microondas se modific como
consecuencia de la alteracin que la radiacin provoc sobre las clorofilas en kiwi y sobre los antocianos en
fresa. En el caso de champin, se ha propuesto un tratamiento combinado con microondas y bao de agua
caliente para conseguir satisfactoriamente la completa inactivacin a tiempos cortos de la PPO.
El modo ms satisfactorio de inhibir el pardeamiento enzimtico es eliminando por completo el oxgeno. Esto
puede obtenerse por desoxigenacin a vaco, borboteo de nitrgeno o apelando a la accin combinada de la
glucosa oxidasa y la catalasa. Sin embargo, es importante considerar que el oxgeno es un requisito de los
tejidos vivos. En el caso de slidos, como las porciones de frutas y hortalizas, la eliminacin del oxgeno ms
sencilla es por inmersin en soluciones como jarabe, salmueras o agua para retardar la difusin del oxgeno.
Sin embargo, el tejido pardear cuando entre en contacto nuevamente con el aire. Adems, durante el tiempo
el cual en el que el tejido est inmerso, el equilibrio osmtico puede producir una prdida de solutos y la
imbibicin de la solucin de inmersin, en algunas ocasiones no deseada. Otra alternativa seria el envasado
del producto en atmsfera inerte. Pero el desarrollo de metabolismo anaerobio alterara las propiedades
organolpticas de las frutas hace este tratamiento inaplicable. Frecuentemente se usan atmsferas
modificadas para la comercializacin de frutas y hortalizas Mnimamente Procesadas.
MATERIA PRIMA, EQUIPOS Y REACTIVOS:
Championes
Agua destilada
Buffer 1. Fosfato de sodio 0,1 M a pH 7,2 Mantenido en refrigeracin ( 2C )
Buffer 2. Fosfato de sodio 0,1 M a pH 6,0
D.L-dihidroxifenilalanina 20 mM (DOPA)
Inhibidor 1. Solucin de 2,0 % cido ascrbico + 1,0 % de cido ctrico + 0,5 % EDTA
Inhibidor 2. Solucin de 1,0 % cido ascrbico + 0,5 % de cido ctrico + 0,25 % EDTA
Inhibidor 3. Solucin isotnica de sacarosa 15 Brix + 0,75 % cido ascrbico + 0,25 % de cido ctrico
Inhibidor 4. Solucin isotnica de sacarosa 40 Brix + 0,25 % cido ascrbico + 0,75 % de cido ctrico
Balanza analtica ( 0,0001 g)
Mortero
Bao de hielo
Bao de agua caliente
Tubos de ensayo
Gradilla
Balanza gramera
~ 27 ~
Pipeta de 20 ml
Pipeta de 5 ml
Pipeta de 2 ml
Pipeta de 1 ml
Pipeta de 0,1 ml
Embudo Buchner con sistema de vaco
Embudo de vidrio
Beaker de 100 ml
Erlemeyer de 100 ml
Probeta graduada
Papel Whatman N 42
Centrfuga a 3500 RPM
Espectrofotmetro a 420 nm
PROCEDIMIENTO EXPERIMENTAL: se realizara los siguientes procedimientos:
NOTA: Limpiar cuidadosamente los championes para evitar que se daen y se produzca el pardeamiento
enzimtico rpidamente; una alternativa es que los championes estn previamente refrigerados a 2 C para
retardar el pardeamiento.
Inactivacin de la enzima polifenoloxidasa
Colocar en un Beaker (previamente refrigerado entre 2 a 4 C) 100 ml de la solucin inhibidora
Pesar aproximadamente 20 gramos de championes
Cortar en lminas de 1 a 2 mm de espesor e introducirlos inmediatamente en la solucin inhibidora
Mantener los championes en la solucin inhibidora durante 5 minutos (de ser posible utilice bao de
agua helada para mantener la temperatura entre 2 a 4 C)
Sacar los championes y escurrirlos en un papel filtro (mximo 1 minuto)
Continuar inmediatamente con la extraccin de la enzima polifenoloxidasa.
Extraccin de la enzima polifenoloxidasa
Colocar los championes en un mortero pre-enfriado con hielo (tambin puede mantenerse
previamente en refrigeracin a 2 C) y agregar 40 ml del Buffer 1; procurar extraer mediante presin la
mayor parte de polifenoloxidasa de la muestra.
Filtrar al vaco en un embudo buchner conectado a un sistema de vaco (empapar el papel filtro con el
Buffer 1 para que se pegue perfectamente en el embudo)
Centrifugar a 3500 rpm durante 5 minutos a 4 C
Recuperar el sobrenadante y dividirlo en las porciones que sean necesarias. Las muestras deben ser
colocadas en bao de hielo, este extracto presenta un color marrn oscuro caracterstico, el cual se
vuelve ms oscuro con el paso del tiempo.
Medicin de la actividad enzimtica.
La actividad de la polifenoloxidasa puede ser fcilmente determinada colorimtricamente midiendo el
aumento de absorbancia a 420 nm debido a la conversin de la DOPA en DOPA-cromo (color rojo)
Pipetear en cada celda para espectrofotmetro
PC= Muestra de calibracin = 0,4 ml E+I; 3,6 ml de Buffer 2 y 1,0 ml de sustrato
A= Muestra con 4 mM de L-DOPA = 0,4 ml E+I; 3,6 ml de Buffer 2 y 1,0 ml de sustrato
B= Muestra con 6 mM de L-DOPA = 0,4 ml E+I; 3,1 ml de Buffer 2 y 1,5 ml de sustrato
C= Muestra con 8 mM de L-DOPA = 0,4 ml E+I; 2,6 ml de Buffer 2 y 2,0 ml de sustrato
Llevar a cero la absorbancia y comenzar a cronometrar rpidamente, medir la absorbancia a 420 nm
cada minuto hasta el minuto 6, sin retirar la celda del espectrofotmetro.
~ 28 ~
Repetir el experimento con cada una de los tratamientos a los que ha sido sometido los championes
Completar la siguiente tabla con los valores de absorbancia a 420 nm.
I0. Sin inhibidor
I0 E+I Buffer Sustrato 0 min 1 min 2 min 3 min 4 min 5 min 6 min
PC 0,4 ml 3,6 ml 1,0 ml
A 0,4 ml 3,6 ml 1,0 ml
B 0,4 ml 3,1 ml 1,5 ml
C 0,4 ml 2,6 ml 2,0 ml
I1. Solucin de 2,0 % cido ascrbico + 1,0 % de cido ctrico + 0,5 % EDTA
I0 E+I Buffer Sustrato 0 min 1 min 2 min 3 min 4 min 5 min 6 min
PC 0,4 ml 3,6 ml 1,0 ml
A 0,4 ml 3,6 ml 1,0 ml
B 0,4 ml 3,1 ml 1,5 ml
C 0,4 ml 2,6 ml 2,0 ml
I2. Solucin de 1,0 % cido ascrbico + 0,5 % de cido ctrico + 0,25 % EDTA
I0 E+I Buffer Sustrato 0 min 1 min 2 min 3 min 4 min 5 min 6 min
PC 0,4 ml 3,6 ml 1,0 ml
A 0,4 ml 3,6 ml 1,0 ml
B 0,4 ml 3,1 ml 1,5 ml
C 0,4 ml 2,6 ml 2,0 ml
I3. Solucin isotnica de sacarosa 15 Brix + 0,75 % cido ascrbico + 0,25 % de cido ctrico
I0 E+I Buffer Sustrato 0 min 1 min 2 min 3 min 4 min 5 min 6 min
PC 0,4 ml 3,6 ml 1,0 ml
A 0,4 ml 3,6 ml 1,0 ml
B 0,4 ml 3,1 ml 1,5 ml
C 0,4 ml 2,6 ml 2,0 ml
I4. Solucin isotnica de sacarosa 40 Brix + 0,25 % cido ascrbico + 0,75 % de cido ctrico
I0 E+I Buffer Sustrato 0 min 1 min 2 min 3 min 4 min 5 min 6 min
PC 0,4 ml 3,6 ml 1,0 ml
A 0,4 ml 3,6 ml 1,0 ml
B 0,4 ml 3,1 ml 1,5 ml
C 0,4 ml 2,6 ml 2,0 ml
~ 29 ~
Graficar la Absorbancia vs el tiempo de cada una de las muestras estudiadas
Calcular la V
0
para las de sustrato estudiadas, se puede calcular as: V
0
= (Abs) / t
Tratamiento I0 Tratamiento I1 Tratamiento I2 Tratamiento I3 Tratamiento I4
A= [] 4 mM
A= [] 6 mM
A= [] 8 mM
Calcular matemticamente los valores de
para cada tratamiento, la
y el valor de
mediante las
siguientes expresiones:
[]
)
[]
~ 30 ~
Graficar para cada tratamiento en estudio
[]
(eje x) vs
(eje y); grfica doble recproca o de
Lineweaver-Burk. Hallar grficamente los valores de Km y Vmax.
CUESTIONARIO:
1. Cmo actan los inhibidores en la cintica enzimtica?
2. Esquematice la bioqumica de la actividad de los inhibidores estudiados?
~ 31 ~
Prctica N 05
TEMA EFECTO DE LA TEMPERATURA EN LA ACTIVIDAD ENZIMATICA
OBJETIVO(S)
Experimentar la extraccin de la enzima polifenoloxidasa de la uva
Determinar los parmetros cinticos de la actividad enzimtica de la polifenoloxidasa
extrada de la uva
Evaluar el efecto de la temperatura en la actividad enzimtica de la polifenoloxidasa
extrada de la uva
MARCO TERICO:
El vino es el producto de la fermentacin del mosto de uvas por clulas de levaduras, su
caracterstica o calidad organolptica est ntimamente relacionada al buen manejo de la
cosecha y cuidado del mosto desde su obtencin, pasando por las diversas etapas de
vinificacin y almacenamiento antes de su comercializacin.
Uno de los principales problemas en la elaboracin del vino blanco es el contacto del
mosto y del vino con el oxgeno del aire en las diversas secciones de elaboracin. Resulta
difcil evitar este contacto durante las etapas de procesamiento, conservacin y
almacenamiento. El oxgeno desnaturaliza el aroma, destruye el afrutado y oscurece el
color.
Durante la vinificacin, las oxidaciones son ms graves porque el mosto es ms sensible que el vino y ms
difcil de proteger, debido a que los sistemas enzimticos siguen intactos, mientras que en el vino la oxidacin
se da por oxidacin no enzimtica. La oxidacin de la vendimia estrujada y de las diferentes fracciones del
mosto es mucho ms acentuada por la presencia de oxidasas. Las uvas presentan alta actividad de
polifenoloxidasas y el oscurecimiento enzimtico ocurre rpidamente en la baya daada o durante la
trituracin de uvas frescas para jugos y vinos. La indeseable reaccin de oscurecimiento est asociada a la
enzima polifenoloxidasa (PPO) (monofenol, dihidroxi-L-fenilalanina) cuyo nmero cdigo es (E.C. 1.14.18.1). La
enzima cataliza dos distintos tipos de reacciones que involucran al oxgeno molecular, llamadas: a) La o-
hidroxilacin de monofenoles a o-difenoles o actividad de la cresolasa y b) la subsecuente oxidacin de o-
difenoles a o-quinonas o actividad de la catecolasa. El oxgeno para la hidroxilacin de monofenoles para dar
o-difenoles viene directamente a partir del O
2
no a partir de agua. Un tomo de oxgeno es incorporado dentro
del fenol, y el otro dentro del agua formada. As, la polifenoloxidasa acta como una monooxigenasa en esta
reaccin. El mecanismo de oxidacin de o-difenoles por la polifenoloxidasa no es conocido con certeza, sin
embargo, en este mecanismo existen evidencias de que no son formados intermediarios radicales.
Investigaciones sobre la interaccin del O
2
y el o-difenol para la enzima indica que el O
2
reacciona primero.
Este mecanismo es realizado sobre mecanismo Bi. Las polifenoloxidasas que actan sobre las sustancias
fenlicas provocando modificaciones intensas, en casos extremos, llegan a producir la quiebra oxidsica, la
formacin de sustancias acres y amargas. Las sustancias responsables del aroma del mosto son tambin
oxidadas.
El oscurecimiento del color durante las etapas de produccin del vino resulta esencialmente a partir de
reacciones qumicas que envuelven compuestos fenlicos, particularmente derivados del flavan 3-ol
(catequinas).
Los cambios ms significativos, producidos por la oxidacin de mostos y vinos, son la polimerizacin de fenoles
y la generacin de acetaldehdo, este hecho repercute bsicamente en el aspecto fsico del producto ya que
causa un cambio radical en el color y en el aroma del mosto, lo que implica la disminucin de la calidad del
producto final.
Hasta ahora, el oscurecimiento ha sido considerado principalmente debido al empobrecimiento de las
caractersticas sensoriales y a la reduccin de la vida del vino, sin embargo, los aspectos nutricionales del
~ 32 ~
oscurecimiento deben tambin tenerse presentes. La oxidacin de los fenoles, conduce a la reduccin de la
habilidad de oxidacin del vino y a una reduccin de la disponibilidad de aminocidos esenciales importantes
como: lisina, triptfano, histidina, cistena y metionina, por la formacin de compuestos que combinan fenoles
y protenas oxidadas en el tracto duodenal del aparato digestivo.
Algunos mtodos utilizados para prevenir el contacto del oxgeno con el vino son: antioxidantes y qumicos,
tratamientos trmicos y remocin de polifenoles que han sido propuestos para prevenir el oscurecimiento de
los vinos blancos.
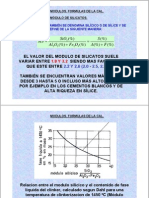
La polifenoloxidasa es una enzima resistente a temperaturas menores de 60 C por periodos cortos de tiempo,
mientras que a temperaturas mayores de 80 C se muestra una reduccin brusca de la actividad enzimtica. El
valor de reduccin decimal a 80 C es de 3,18 minutos, mientras que para 60 C es de 20,31 minutos
La temperatura ptima determinada para la enzima PFO aislada de tallos de clavel de la variedad tolerante fue
45 C. La enzima tuvo su mayor actividad en un intervalo de temperatura entre 37 y 45 C declinando tal
actividad a temperaturas superiores a 60C y menores de 37 C. Este intervalo de temperatura concuerda con
reportes de PFO de nspero 35 C, Hevea brasilensis 45 C, morera 45 C, ferula 30 C, menta 30 C y manzana
40 C, , entre otros. La notoria disminucin de actividad a temperaturas superiores a 50 C confirman la
labilidad de la enzima, al igual que por largos periodos de almacenamiento y manipulacin, condiciones en las
cuales la enzima pierde su actividad.
MATERIA PRIMA, EQUIPOS Y REACTIVOS:
Uva negra
Uva blanca
Agua destilada
Buffer 1. Fosfato de sodio 0,1 M a pH 7,2 Mantenido en refrigeracin ( 2C )
Buffer 2. Fosfato de sodio 0,1 M a pH 6,0
D.L-dihidroxifenilalanina 20 mM (DOPA)
Balanza analtica ( 0,0001 g)
Mortero
Bao de hielo
Bao de agua caliente
Tubos de ensayo y gradilla
Termmetros
Balanza gramera
Pipeta de 20, 5, 2, 1, 0,1 ml
Embudo Buchner con sistema de vaco
Papel Whatman N 42
Centrfuga a 3500 RPM
Espectrofotmetro a 420 nm
PROCEDIMIENTO EXPERIMENTAL: se realizara los siguientes procedimientos:
NOTA: conserve en una gradilla todos los tubos que utilice en esta prctica para efectuar comparaciones
posteriores.
Extraccin de la enzima polifenoloxidasa
Colocar 60 gr uvas en un mortero pre-enfriado con hielo (tambin puede mantenerse previamente en
refrigeracin a 2 C) y agregar 30 ml del Buffer 1; procurar extraer mediante presin la mayor parte de
polifenoloxidasa de la muestra.
~ 33 ~
Filtrar al vaco en un embudo buchner conectado a un sistema de vaco (empapar el papel filtro con el
Buffer 1 para que se pegue perfectamente en el embudo)
Centrifugar a 3500 rpm durante 5 minutos a 4 C
Recuperar el sobrenadante y dividirlo en las porciones que sean necesarias. Las muestras deben ser
colocadas en bao de hielo, este extracto presenta un color marrn oscuro caracterstico, el cual se
vuelve ms oscuro con el paso del tiempo.
Medicin de la actividad enzimtica.
La actividad de la polifenoloxidasa puede ser fcilmente determinada colorimtricamente midiendo el
aumento de absorbancia a 420 nm debido a la conversin de la DOPA en DOPA-cromo (color rojo)
Pipetear en cada celda para espectrofotmetro
Muestra = 0,4 ml de Enzima; 3,6 ml de Buffer 2 y 1,0 ml de sustrato
Se debe considerar la muestra de correccin de lectura de absorbancia
Controlar la temperatura de trabajo para la cintica enzimtica a desarrollar
Llevar a cero la absorbancia y comenzar a cronometrar rpidamente, medir la absorbancia a 420 nm
cada minuto hasta el minuto 9, sin retirar la celda del espectrofotmetro.
Completar las siguientes tablas con mediciones de absorbancia a 420 nm
T1 0 min 1 min 2 min 3 min 4 min 5 min 6 min 7 min 8 min 9 min
PC
5 C
20 C
35 C
50 C
65 C
80 C
Graficar la Absorbancia vs el tiempo de cada una de las muestras estudiadas
~ 34 ~
Calcular la V
0
para las de sustrato estudiadas, se puede calcular as: V
0
= (Abs) / t
5 C 20 C 35 C 50 C 65 C 80 C
V
0
Graficar y calcular matemticamente los valores de y
mediante las siguientes expresiones:
() ()
)
CUESTIONARIO:
1. Qu significa Energa de activacin
y que funcin cumple en la cintica enzimtica?
2. Qu significa tiempo de reduccin decimal y como se relaciona con la cintica enzimtica?
~ 35 ~
Prctica N 06
TEMA IDENTIFICACION DE CARBOHIDRATOS
OBJETIVO(S)
Reconocer cualitativamente los carbohidratos
Diferenciar monosacridos, disacridos o polisacridos
Diferenciar Hexosas de pentosas
Diferenciar e identificar almidones y disacrido
Diferenciar e identificar azucares reductores y no reductores
Diferenciar aldosas de cetosas.
Distinguir la forma de los cristales en mono y disacridos
MARCO TERICO:
El trmino "carbohidratos", o "hidratos de carbono"
procede de la antigua forma de escribir la frmula
emprica de algunos de los ms importantes, como
Cn(H2O)n.. Uno de los carbohidratos, la celulosa, es la
sustancia orgnica ms abundante en el conjunto de los
seres vivos terrestres. Qumicamente se definen como
polihidroxialdehdos o polihidroxiacetonas cclicas o
sustancias que luego de hidrolizarse dan origen a los
mismos.
Segn el resultado de su hidrlisis, los carbohidratos se pueden clasificar "polisacridos", formados por
muchas unidades separables por hidrlisis, "oligosacridos", formados por unas cuantas unidades, y
"monosacridos", que son las unidades elementales que no producen, por hidrlisis, unidades de tamao
menor. A diferencia de lo que sucede en el caso de las protenas, en el que no existe un corte ntido entre un
polipptido grande y una protena pequea, entre oligosacridos y polisacridos naturales existe una divisin
clara. Los oligosacridos tienen menos de 20 unidades, mientras que los polisacridos comienzan en los
centenares.
Monosacridos.- Podemos definir los monosacridos como polihidroxialdehdos y polihidroxiacetonas.. Los
monosacridos se dividen en aldosas y cetosas, segn tengan un grupo aldehdo o un grupo cetona. Aunque
existen muchas decenas de monosacridos, solamente dos, glucosa y fructosa, son realmente importantes,
como tales, en el mundo de los alimentos.
Aunque se pueden representar en forma abierta, con los grupos aldehdo o cetona evidentes, los
monosacridos de cinco o ms carbonos se encuentran fundamentalmente en forma cerrada, es decir, con el
grupo carboxilo formando parte de un anillo hemiacetlico, que puede tener 5 o 6 tomos. Si tiene 5 tomos,
la forma se llama furanosa, por analoga con la estructura del heterociclo furano, y si tiene 6 tomos, la forma
se llama piranosa, por analoga con la estructura del pirano.
Todos los monosacridos son reductores, es decir, su grupo carbonilo es capaz de reaccionar como tal. Esto es
importante en la industria alimentaria, porque el poder reductor est relacionado directamente con la
capacidad de formar colores y aromas de tostado por reaccin con las protenas.
Disacrido.- Los disacridos o azcares dobles son un tipo de hidratos de carbono, o carbohidratos, formados
por la unin de dos monosacridos iguales o distintos mediante enlace O-glucosdico, mono o dicarbonlico,
que adems puede ser o en funcin del -OH hemiacetal. Los disacridos ms comunes son: sacarosa
(formada por la unin de una glucosa y una fructosa. A la sacarosa se le llama tambin azcar comn), lactosa
(formada por la unin de una glucosa y una galactosa. Es el azcar de la leche), maltosa, isomaltosa, trehalosa,
celobiosa (formadas todas por la unin de dos glucosas, son diferentes dependiendo de la unin entre las
glucosas). La frmula emprica de los disacridos es C
12
H
22
O
11
. El enlace covalente entre dos monosacridos
~ 36 ~
provoca la eliminacin de un tomo de hidrgeno de uno de los monosacridos y de un grupo hidroxilo del
otro monosacrido. En la mucosa del tubo digestivo del hombre existen unas enzimas llamadas disacaridasas,
que hidrolizan el enlace glucosdico que une a los dos monosacridos, para su absorcin intestinal.
Oligosacrido.- Los oligosacridos son polmeros de monosacridos con un nmero de unidades monomricas
entre 2 y 10. Los oligosacridos ms presentes en la naturaleza son la inulina, la oligofructosa
(fructooligosacridos) y los galactooligosacridos. La inulina y oligofructosa estn formados por cadenas de
fructosa que pueden terminar en glucosa o fructosa. Estn presentes en muchos vegetales: achicoria, cebolla,
puerro, ajo, pltano, alcachofa, etc. Los galactooligosacridos estn formados por cadenas de galactosa y estn
presentes en la leche y en algunas plantas. Los oligosacridos forman parte de los glucolpidos y glucoprotenas
que se encuentran en la superficie externa de la membrana plasmtica y por lo tanto tienen una gran
importancia en las funciones de reconocimiento celular.
Polisacrido.- Los polisacridos son polmeros, cuyos monmeros constituyentes son monosacridos, los
cuales se unen repetitivamente mediante enlaces glucosdicos. Los polisacridos pueden descomponerse, por
hidrlisis de los enlaces glucosdicos entre residuos, en polisacridos ms pequeos, as como en disacridos o
monosacridos. Su digestin dentro de las clulas, o en las cavidades digestivas, consiste en una hidrlisis
catalizada por enzimas digestivas (hidrolasas) llamadas genricamente glucosidasas, que son especficas para
determinados polisacridos y, sobre todo, para determinados tipos de enlace glucosdico
Principales Polisacridos : Almidn (qumicamente es una mezcla de dos polisacridos muy similares, la
amilosa y la amilopectina), glucgeno (su estructura puede parecerse a la de amilopectina del almidn,
aunque mucho ms ramificada que sta), celulosa (se forma por la unin de molculas de -glucosa mediante
enlaces -1,4-O-glucosdico. Es una hexosa que por hidrlisis da glucosa. La celulosa es una larga cadena
polimrica de peso molecular variable, con frmula emprica (C
6
H
10
0
5
)n, con un valor mnimo de n= 200)
Fundamentos qumicos de las pruebas cualitativas.-
Prueba de Molish .- Este ensayo es un ensayo para reconocimiento general de carbohidratos en el que los
polisacridos y disacridos se hidrolizan con cido sulfrico concentrado hasta monosacridos y se convierten
en derivados del furfural o 5-hidroximetil furfural los cuales reaccionan con -naftol formando un color
prpura violeta.
Prueba de Barfoed.- Es una reaccin para identificar monosacridos, aunque algunos disacridos (los
reductores) dan positiva la reaccin, pero con ms tiempo de calentamiento, ya que as se hidroliza el
disacrido. El fundamento radica en la reduccin del acetato cprico a oxido cuproso.
Prueba de Bial o de Orcinol-HCl.- Es una prueba especfica para pentosas, el reactivo de Bial contiene orcinol
en cido clorhdrico, el cual forma complejos de coloracin slo con las pentosas.. La positividad se reconoce
por la formacin de una coloracin verde botella brillante.
Prueba de Seliwanoff.- Este ensayo es especfico para cetosas y se basa en la conversin de la cetosa en 5-
hidro-metil-furfural y su posterior condensacin con resorcinol formando as complejos coloreados, se usa casi
exclusivamente para identificar fructosa.
Prueba de Lugol.- Es una prueba que se usa para identificar polisacridos. Particularmente el almidn por la
formacin de una coloracin azul violeta intensa (El color azul, se debe, posiblemente a la formacin de un
complejo: Ioduro de almidn)y el glicgeno y las dextrinas por formacin de coloracin roja .
Prueba de Benedict.- El ensayo de Benedict permite el reconocimiento de carbohidratos reductores (con
grupos carboxilos libres), al igual que el reactivo de Fehling, el de Benedict contiene ion cprico en medio
alcalino que se reduce hasta xido cuproso en presencia de azcares con el hidroxilo hemiacetlico libre.
Prueba Fenilhidrazina.- Una particularidad importante de los monosacridos consiste en su capacidad de
entrar en reaccin con la fenilhidrazina y formar fenilhidrazonas y osazonas. La reaccin de formacin de
osazonas transcurre en tres etapas. Al reaccionar los monosacridos con la fenilhidrazina, en la primera etapa
se forman fenilhidrazonas solubles en agua (reaccin de sustitucin). En la segunda etapa, con la
fenilhidrazonas solubles en agua (reaccin de sustitucin). En la segunda etapa, con la fenilhidrazona formada
reacciona otra molcula de fenilhidrazina y, oxidndola, transforma el grupo hidroxilo en grupo carbonilo. La
~ 37 ~
tercera molcula de fenilhidrazina entra en reaccin de sustitucin con el grupo carbonilo recin formado, lo
que conduce a la formacin de compuestos poco solubles en agua: osazonas, que producen cristales de color
amarillo, de forma caracterstica. La forma de los cristales de osazonas es variable y depende de la estructura
de los monosacridos, de los cuales se forman las osazonas.
Las osazonas de diferentes monosacridos se distinguen por la forma de los cristales, punto de fusin,
solubilidad y actividad ptica. Por eso, estas propiedades se utilizan para aislar los monosacridos de la
disolucin, como tambin para distinguir unos azcares de otros. En conclusin es una prueba para distinguir
osas (y oligosacridos). Los carbohidratos que solo se diferencian en sus tomos de carbono 1 y/o 2 darn la
misma osazona, como es el caso de la glucosa y la fructosa, que son ismeros de funcin.
Glucosa
Galactosa
Arabinosa
Lactosa
Maltosa
Xilosa
MATERIA PRIMA, EQUIPOS Y REACTIVOS:
Sacarosa comercial (azcar de caa)
Huevo entero
Yogurt natural
Xilosa 0,1 M
Ribosa al 0,1 M
Arabinosa al 0,1 M
Glucosa al 0,1 M
Fructosa al 0,1 M
Lactosa al 2 %
Maltosa al 2 %
Sacarosa al 2 %
Almidn al 1 %
Casena al 1 %
H
2
SO
4
concentrado
Solucin de Lugol
Reactivo de Benedict
Reactivo de Molish
Reactivo de Barfoed
Reactivo de Bial
Reactivo de Seliwanof
Reactivo de Fenilhidrazina
Piceta con agua destilada
Balanza analtica ( 0,0001 g)
Balanza gramera ( 0,001 g)
Microscopio electrnico
Porta y cubre objetos
Probeta de 10 ml
Fiola de 25 ml
~ 38 ~
Bureta de 25 ml con soporte
Erlemeyer 100 ml
Beaker 100 ml
Pipeta 1, 2, 5, 10 ml
Pipeta Pasteur
Tubos de ensayo
Gradilla para tubos de ensayo
Pinzas para tubo de ensayo
Mechero bunsen
Cocina elctrica
Bao de agua hirviente
Esptula
Pro pipeta
PROCEDIMIENTO EXPERIMENTAL: se realizara los siguientes procedimientos:
Identificacin de carbohidratos en sustancias puras
Prueba de Molish.- Colocar en el tubo de ensayo 0,5 ml de la sustancia problema, agregar 4 gotas del
reactivo de Molish, mezclar bien y posteriormente dejar caer lentamente y por las paredes del tubo de
ensayo 0,5 ml H
2
SO
4
concentrado. La aparicin de un anillo violeta rojizo en el sitio de contacto de los
dos lquidos, indica que la muestra contiene carbohidratos.
Sustancias Problema: Ver cuadro de muestras a analizar
Prueba de Barfoed.- Colocar en el tubo de ensayo 1 ml de la sustancia problema, agregar 2,5 ml del
reactivo de Barfoed, mezclar bien y calentar en bao de agua hirviente, contando los minutos y sacar del
bao cada tubo inmediatamente despus que haya aparecido el precipitado rojo ladrillo de Cu
2
O.
Anotar el tiempo que corresponda a cada carbohidrato. La aparicin de un precipitado rojo, antes de los
6 minutos, indica la presencia de un monosacrido, entre 9 y 12 minutos indica la presencia de
disacrido (lactosa o maltosa) o un polisacrido.
Sustancias Problema: Ver cuadro de muestras a analizar
Prueba de Bial.- Colocar en el tubo de ensayo 1 ml de la sustancia problema, agregar 1,5 ml del reactivo
de Bial, mezclar bien y llevar a bao de agua hirviente durante 3 minutos. La aparicin de un color verde
botella, brillante y totalmente transparente, indica la presencia de una pentosa. Algunos azcares dan
una coloracin verde, pero esta es opaca.
Sustancias Problema: Ver cuadro de muestras a analizar
Prueba de Lugol.- Colocar en el tubo de ensayo 2 ml de la sustancia problema, agregar 1 gota del
reactivo de lugol, mezclar bien y observar. La aparicin de una coloracin azul indica la presencia de
almidn y una coloracin roja, indica el glicgeno o eritrodextrina. Si el color no cambia el carbohidrato
es un monosacrido o un disacrido.
Sustancias Problema: Ver cuadro de muestras a analizar
Prueba de Seliwanof.- Colocar en el tubo de ensayo 1 ml de la sustancia problema, agregar 2 ml del
reactivo de Seliwanof, mezclar bien llevar a bao mara hirviente durante 10 minutos. La formacin de
un color rojo cereza, indica la presencia de fructosa.
Sustancias Problema: Ver cuadro de muestras a analizar
Prueba de Benedict.-Colocar en el tubo de ensayo 0,5 ml de la sustancia problema, agregar 2 ml del
reactivo de Benedict, mezclar bien llevar a bao mara hirviente durante 5 minutos. La aparicin de un
precipitado verde, amarillo o rojo indica la presencia de un azcar reductor
Sustancias Problema: Ver cuadro de muestras a analizar
~ 39 ~
Prueba de Fenilhidrazina.- Colocar en el tubo de ensayo 2 ml de la sustancia problema, agregar 0,5 ml
del reactivo de Fenilhidrazina, mezclar bien y coloque los tubos en bao de agua hirviendo durante 10
minutos. Al final del periodo de calentamiento, enfre los tubos en chorro de agua. Dejar en reposo
durante 5 minutos y posteriormente examine al microscopio la caracterstica de los cristales de osazona,
colocando con mucho cuidado una gota en el portaobjeto, cubrir con la lmina cubreobjetos, evitando
daar a los cristales con movimientos bruscos o excesos de muestra.
Sustancias Problema: Ver cuadro de muestras a analizar
Identificacin de carbohidratos en muestras desconocidas
Preparacin de muestra.- Pese 5 gramos de muestra (alimento) y diluya en 95 cc de agua destilada,
homogenizar la muestra durante 5 minutos, posteriormente proceder a filtrar con papel whatman N
42, tome del filtrado la muestra y proceda a identificar.
Nota: La muestra problema debe ser incolora y sin turbidez, en caso de que esto ocurra procure volver a
filtrar o utilizar algunas sustancia decolorante.
Realice la identificacin de carbohidratos siguiendo las tcnicas descritas anteriormente y guindose del
siguiente flujo:
Cuadro de muestras a analizar
Prueba A
g
u
a
d
e
s
t
i
l
a
d
a
A
l
m
i
d
n
a
l
1
%
M
a
l
t
o
s
a
a
l
2
%
L
a
c
t
o
s
a
a
l
2
%
S
a
c
a
r
o
s
a
a
l
2
%
G
l
u
c
o
s
a
0
,
1
M
F
r
u
c
t
o
s
a
0
,
1
M
R
i
b
o
s
a
0
,
1
M
A
r
a
b
i
n
o
s
a
0
,
1
M
X
i
l
o
s
a
0
,
1
M
C
a
s
e
n
a
a
l
1
%
M
u
e
s
t
r
a
1
M
u
e
s
t
r
a
2
Molish
Barfoed
Bial
Lugol
Seliwanof
Benedict
Fenilhidrazina
CUESTIONARIO:
1. Explique por qu existe variacin en el tiempo de precipitacin (color rojo ladrillo) en los diversos
carbohidratos experimentados mediante la prueba de Barfoed
2. Porque la prueba de lugol da positivo con colores diferenciados en el glucgeno y en el almidn
3. Presente las ecuaciones que fundamentan cada prueba cualitativa
~ 40 ~
CUADRO RESUMEN:
SUSTANCIA DESCONOCIDA
Prueba de Bial
(-) Otro color
Hexosa
(+) Verde
Pentosa
Prueba de Lugol
(+) Rojo
Amarillo Oscuro
Glucgeno
(-) Amarillo
Disacarido
(+) Azul
Almidn
Prueba de Barfoed
Precipitado rojo
< 6 minutos
Monosacarido
Precipitado rojo
entre 9 a 12 minutos
Disacrido o Polisacrido
Prueba de Molish
(-) Incolora
No es Carbohidrato
(+) Anillo rojo o violeta
Carbohidrato
Prueba de Benedict
(+) Precipitado Rojo
Reductor
(-) No cambia
No es reductor
Sacarosa
Prueba de Seliwanoff
(-) Incoloro o con leve
coloracin
Glucosa/Galactosa
(+) Rojo
Fructosa
Prueba de Fenilhidrazina
(+) Cristales en
forma de Palma
(Glucosazona)
Glucosa
(+) Cristales en
forma de Estrella
(Galactosazona)
Glucosa
(+) Cristales en
forma de Flor
(Maltosazona)
Glucosa
(+) Cristales en
forma de Nido
(Lactosazona)
Glucosa
~ 41 ~
Prctica N 07
TEMA CUANTIFICACION DE CARBOHIDRATOS - Mtodo fenol-sulfrico
OBJETIVO(S)
Establecer la curva patrn para la determinacin de glucosa
Evaluar la inversin de azcar (sacarosa) por mtodo espectrofotomtrico
MARCO TERICO:
El trmino "carbohidratos", o "hidratos de carbono"
procede de la antigua forma de escribir la frmula
emprica de algunos de los ms importantes, como
Cn(H2O)n.. Uno de los carbohidratos, la celulosa, es la
sustancia orgnica ms abundante en el conjunto de los
seres vivos terrestres. Qumicamente se definen como
polihidroxialdehdos o polihidroxiacetonas cclicas o
sustancias que luego de hidrolizarse dan origen a los
mismos.
Este mtodo propuesto por Dubois et al en 1956 se fundamenta en que los carbohidratos son particularmente
sensible a cidos fuertes y altas temperaturas. Bajo estas condiciones una serie de reacciones complejas
toman lugar empezando con una deshidratacin simple, si se contina el calentamiento y la catlisis cida se
producen varios derivados del furano que condensan consigo mismos y con otros subproductos para producir
compuestos coloridos producto de la condensacin de compuestos fenlicos y con hetero ciclos con el
nitrgeno como hetero tomo. La condensacin ms comn es con fenol. Este mtodo es fcil, eficaz y rpido.
Todos los azcares como oligosacridos y polisacridos pueden ser determinados, recordando que stos bajo
hidrlisis cida producen monosacridos. La forma en que procede la reaccin no es estequiomtrica y
depende de la estructura del azcar, por lo tanto se realiza una curva patrn.
El contenido total de carbohidratos de medios lquidos, extractos, extractos, alimentos lquidos puede ser
determinado como azucares simples, oligosacridos, polisacridos y sus derivados. Dando un color naranja
muy estable cuando reaccionan con fenol y en presencia de cido sulfrico concentrado.
La intensidad del color naranja es proporcional a la cantidad total de carbohidratos presente. Esta absorbancia
puede ser medida a 492 nanmetros (nm) y la concentracin total de carbohidratos de las soluciones
problema puede ser medida con respecto a una estndar preparada.
Para evaluar los carbohidratos totales presentes en una muestra es necesario establecer una curva patrn, la
misma que puede ser realiza
linealizado dicha curva patrn encontrando valores de [] () , para valores de
glucosa entre 0 y 400
Esta tcnica solo puede determinar azucares totales dado que la reaccin con cido sulfrico desdobla los
oligosacridos y polisacridos en monosacridos. Para que la prueba tenga una validez cientfica debe
mantenerse los tiempos de hidrolisis descritos en la metodologa, caso contrario, solo reportara la
cuantificacin parcial de los azucares totales.
MATERIA PRIMA, EQUIPOS Y REACTIVOS:
Sacarosa comercial (azcar de caa)
Vino blanco
Yogurt natural
~ 42 ~
cido clorhdrico al 20 %
Hidrxido de sodio al 5 %
Algodn
Glucosa (400
Fenol en agua al 80 % en peso
cido sulfrico concentrado al 95 %
Solucin acuosa de ferrocianuro potsico Fe(CN)
6
K
4
.3H
2
O (15 gr en 100 ml)
Solucin acuosa de acetato de zinc (CH
3
COO)
2
Zn.2H
2
O (30 gr en 100 ml)
Carbn activado
Agente clarificante (albumina de huevo, etc.)
Piceta con agua destilada
Balanza analtica ( 0,0001 g)
Fiola de 100 cc
Erlemeyer de 100, 500 cc
Beaker de 100 cc
Tubos de ensayo y gradilla
Espectrofotmetro
pH metro
Centrifuga a 4000 RPM
Pipetas de 1 ml
Pipetas 2 ml
Pipetas de 5 ml
Pipetas 10 ml
Papel filtro
Embudo de vidrio
Termmetro
PROCEDIMIENTO EXPERIMENTAL:
Preparacin de la curva patrn de glucosa
Preparar la siguiente batera de tubos
Tubo N 0 1 2 3 4 5 6 7 8 9 10
Agua Destilada 1,0 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0,0
0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0
Glucosa equivalente
400 360 320 280 240 200 160 120 80 40 0
Agregar a cada tubo de ensayo 0,1 ml de fenol
Agitar suavemente y dejar en reposo durante 10 minutos
Adicionar a cada tubo de ensayo 3,0 ml de cido sulfrico concentrado
Agitar suavemente y dejar en reposo durante 30 minutos
Leer la absorbancia a 492 nm
~ 43 ~
Reportar las lecturas de absorbancia para la glucosa
Tubo N 0 1 2 3 4 5 6 7 8 9 10
400 360 320 280 240 200 160 120 80 40 0
Absorbancia
Preparacin de la curva patrn de fructuosa
Preparar la siguiente batera de tubos
Tubo N 0 1 2 3 4 5 6 7 8 9 10
Agua Destilada 1,0 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0,0
0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0
Glucosa equivalente
400 360 320 280 240 200 160 120 80 40 0
Agregar a cada tubo de ensayo 0,1 ml de fenol
Agitar suavemente y dejar en reposo durante 10 minutos
Adicionar a cada tubo de ensayo 3,0 ml de cido sulfrico concentrado
Agitar suavemente y dejar en reposo durante 30 minutos
Leer la absorbancia a 492 nm
Reportar las lecturas de absorbancia para la fructuosa
Tubo N 0 1 2 3 4 5 6 7 8 9 10
400 360 320 280 240 200 160 120 80 40 0
Absorbancia
Graficar la curva patrn para glucosa y fructuosa
~ 44 ~
Preparacin de la muestra de azcar invertido de sacarosa
Coloque en un erlemeyer 30 ml de sacarosa al 10 %
Agregue 5 ml de cado clorhdrico al 20 %
Caliente en bao mara a ebullicin durante 10 minutos
Enfri la solucin a temperatura ambiente
Neutralice con hidrxido de sodio al 5 %
Preparacin de la muestra de yogurt
Coloque en un erlemeyer 5 ml de yogurt
Agregue 0,5 ml de solucin acuosa de ferrocianuro de potasio
Agregue 0,5 ml de solucin acuosa de acetato de zinc
Complete a 50 ml con agua destilada
Agite suavemente
Dejar reposar hasta la separacin de fases
Con la ayuda de un papel filtro recuperar la fase acuosa (en ella se encuentra los carbohidratos y
minerales presentes en el yogurt.
Preparacin de diluciones para determinar la absorbancia de una muestra
Tomar la muestra problema y realizar un batera de diluciones tal como se esquematiza a continuacin
Determinacin de azucares totales de una muestra conocida y/o desconocida
Proceda a preparar diluciones de la muestra problema
Considerando la mecnica de trabajo del tubo N 10 (determinacin de la curva patrn), proceder a
determinar la absorbancia de las muestras
Considerando las lecturas que estn dentro del rango de la curva patrn proceda a calcular la cantidad
de azcares totales que tiene la muestra.
CUESTIONARIO:
1. Explique el funcionamiento de un espectrofotmetro
2. Explique por qu la absorbancia para el mtodo de Dubois en la determinacin de azucares totales, hay que
leerla a 492 nm.
3. Esquematice las reacciones que ocurren durante la prueba espectrofotomtrica de la determinacin de
glucosa
~ 45 ~
Prctica N 08
TEMA DETERMINACION DE ACTIVIDAD DIASTASICA EN HARINAS
OBJETIVO(S)
Determinar la actividad diastsica de las harinas a travs de la determinacin del
contenido de maltosa
MARCO TERICO:
El trigo es el principal cereal utilizado para preparar harina, aunque una pequea
cantidad de harina se elabora a partir del centeno. Aunque las protenas de la harina
de trigo son superiores para elaborar pan, nutricionalmente son incompletas, El
aminocido limitante es la lisina, El desarrollo del hbrido de trigo y centeno ha
conducido a un grano con un contenido de lisina mayor que el trigo.
Existe cierta informacin de los resultados donde se ha trabajado en la posibilidad de
utilizar harinas hechas de semillas oleaginosas para suplementar las protenas de la
harina de soya debido a su alto contenido de Iisina as como de protenas. Ms
recientemente se ha enfocado la atencin en otras harinas que incluyen las semillas de
algodn, el frijol de vaca, el chcharo, el cacahuate, el ssamo y el girasol, La mayor
parte darn un pan aceptable si fa cantidad de harina de trigo reemplazada es
limitada, si la frmula se modifica y, en algunos casos, si se altera el proceso de
manipulacin. El pan hecho de harina de trigo es el estndar cuando se miden aquellos
panes hechos de harina diferente a la del trigo.
Las harinas de trigo difieren del cereal de trigo no cocido, principalmente por el grado en que el grano se ha
fraccionado o molido. La molienda fractura muchas de las clulas del endosperma, poniendo al descubierto
sus contenidos, No todas las harinas de trigo son semejantes. El xito al hornear depende, En parte, de utilizar
el mejor tipo de harina para cada producto, por lo que es pertinente tener en consideracin como y porque
difieren las harinas.
Harinas empleadas en productos de panificacin
Las harinas de trigo se emplean para la elaboracin de una amplia gama de productos de panificacin. Cada
producto se fabrica de mejor manera a partir de distintos tipos de harina. Los panes, bollos, pasteles, galletas,
etc., todos ellos requieren una harina especial y diferente.
Harinas panaderas.- Las harinas panaderas se emplean para la elaboracin de Productos de fermentacin. La
harina se muele a partir de trigos duros empleando una sola variedad de trigo, o una mezcla de ellas, para
producir una harina con el comportamiento panadero deseado. Los trigos duros se distinguen por un alto
contenido de protenas de buena calidad.
La fabricacin de los productos leudados con levadura se basa en la calidad de la protena de la harina para
formar una masa elstica y extensible cuando se mezcla con agua, capaz de retener el CO2 producido durante
la fermentacin. Estas protenas, las formadoras de gluten, deben estar presentes en suficiente cantidad y
deben poseer la calidad necesaria para soportar las acciones de mezclado, estirado y doblado a las que se
someten las masas durante la elaboracin de pan. El gluten forma una estructura tridimensional (que debe
desarrollarse durante el mezclado) en forma de red. Contiene celdillas que atrapan al C02 y otros gases
leudantes, y que se expanden. La estructura de gluten, despus de sufrir su ltima expansin durante el
horneo, coagula impartiendo rigidez a los productos horneados.
Las harinas panaderas tienen las siguientes propiedades:
Fuerza.- La fuerza de la harina se define como la capacidad de producir una pieza de pan de muy buen
volumen, grano fino y uniforme, y una textura aterciopelada. La fuerza de la harina depende principalmente
de la cantidad y la calidad de las protenas formadoras de gluten. Estas deben ser capaces de soportar el abuso
~ 46 ~
mecnico al que se someten las masas y capaces de retener el gas generado durante la fermentacin. Muchos
investigadores opinan que, para que una harina pueda considerarse fuerte, debe poseer una buena actividad
amilsica. De esta manera se asegura una buena produccin de gas que logra un buen volumen y una ptima
hidrlisis del almidn en dextrinas, que tambin mejoran el volumen.
Tolerancia.- Las harinas panaderas deben poseer una buena tolerancia, sobre todo al mezclado y a la
fermentacin. Deben poder soportar un ligero sobre mezclado y, con un pequeo exceso de fermentacin, las
masas no deben volverse demasiado flojas o pegajosas. La tolerancia de las harinas est relacionada con la
calidad del gluten.
Absorcin.- La absorcin de las harinas panaderas es un factor de calidad muy importante. Siempre se desean
los valores superiores de absorcin. De esta manera, aumenta el rendimiento de la masa tambin se ejerce
una accin favorable sobre la vida de anaquel de los productos. La absorcin se define como "la cantidad de
agua, expresada en porciento base harina, necesaria para obtener una masa de consistencia ptima, con
buenas propiedades de manejo y que resulte en el mejor producto". La absorcin de las harinas depende en
gran parte de su contenido proteico. Sin embargo, la calidad de las protenas tambin afecta a la absorcin.
Esto explica el por qu dos harinas con el mismo contenido proteico no presenta el mismo valor de absorcin
ptimo
Anlisis de composicin qumica (Actividad Diastsica)
Entre los anlisis qumicos, destacan el de contenido de humedad, de protenas, de cenizas y actividad
diastsica. La mayora de estas determinaciones brindan informacin parcial acerca de la calidad panadera de
las harinas. Deben correlacionarse con las pruebas fsicas para establecer un cuadro ms completo de
comportamiento que se podr esperar de las harinas.
La determinacin de la actividad diastsica de la harina es un ndice de la cantidad de amilasas presentes en la
harina. Las amilasas actan sobre los grnulos de almidn daado (durante la fermentacin de las esponjas) y
sobre los grnulos de almidn gelatinizados (durante el horneo), brindando a la levadura suficiente cantidad
del azcar fermentable (maltosa), para sostener una vigorosa actividad durante las etapas de
proceso sealadas. La mayora -amilasa, enzima que provee
-amilasa de suficientes sitios donde actuar para la formacin de maltosa.
Existen numerosas pruebas para determinar la actividad amilsica. La mayora expresan los miligramos de
maltosa producidos, a una temperatura y un pH adecuado, a partir de 10 gramos de harina. Las harinas con un
valor de 250 mg de maltosa presentan una actividad amilsica reducida, los valores de 440 mg. de maltosa
indican una elevada actividad diastsica.
Importancia de la determinacin de la actividad amilsica.
-amilasa y
requieren ser completadas con un concentrado de esta enzima. Esta complementacin se realiza en las
fbricas, agregando el complemento enzimtico -amilasa es un
proceso delicado, por lo que se pide al molino que no la efecte. Se especifica un mximo de actividad
-amilasa en la fbrica.
Un exceso de actividad diastsica produce un pan de bajo volumen y miga gomosa y hmeda, que no podr
salir a la venta.
Produccin de gas y retencin de gas
La estructura y volumen caracterstico de los productos de panificacin estn basados en la produccin de C0
2
por parte de la levadura. El volumen deseado de hogaza solamente se obtiene si la masa le brinda a la
levadura el ambiente adecuado para una buena produccin de gas y, al mismo tiempo si posee la red de gluten
capaz de retener una buena proporcin del gas producido. La retencin de gas se determina en forma ms
conveniente midiendo el incremento de volumen de la masa bajo fermentacin. La produccin de gas puede
determinarse mediante el uso de un gran nmero de instrumentos que miden la presin ejercida por el C0
2
producido. Para la prueba de produccin de gas se elabora una masa de harina, levadura y agua. La prueba da
indicios de las propiedades de formacin de azcar de la harina, ya que la levadura en la masa solamente
~ 47 ~
puede actuar sobre los pocos azucares naturales de la harina y sobre los producidos por la actividad
enzimtica de la harina. Por consiguiente, una harina con buenas propiedades de formacin de azcar tendr
un mayor poder de produccin de gas, que una con poco poder de formacin de azcar (actividad diastsica).
MATERIA PRIMA, EQUIPOS Y REACTIVOS:
Harina preparada y sin preparar
Solucin Buffer Acetato (pH 4,6 4,8)
Solucin de Tungstato de sodio al 12 %
Solucin alcalina de ferrocianuro al 0,1 N
Reactivo de cido actico
Disolucin de Ioduro de potasio al 50 %
Solucin de tiosulfato de sodio 0,1N
Disolucin de almidn al 2 %
Solucin de cido sulfrico 3,7 N
Piceta con agua destilada
Fiola de 100 cc
Erlemeyer de 100 cc
Beaker de 100 cc
Bureta con soporte
Tubos de ensayo grandes
Probeta de 100 cc
Centrifuga a 4000 RPM
Tubos de centrifuga
Gradilla
Pipetas de 2, 5 y 10 cc
Pro-pipeta
Baquetas de vidrio
Papel filtro
Embudo
Esptula
Termmetro
Balanza analtica ( 0,0001 g)
Bao de agua hirviente
Bao de hielo
PROCEDIMIENTO EXPERIMENTAL:
Preparacin del extracto
Tomar 20 g de levadura de panificacin (puede ser fresca o seca), se mezcla con 5 g de harina y una
cucharadita de arena calcinada en un erlemeyer de 250 ml y se mezcla por rotacin.
Se calienta la mezcla a 30 C y se aaden 46 ml de la solucin buffer acetato (tambin a 30C), se agita la
mezcla hasta lograr que toda la harina este en suspensin.
Colocar en bao mara a 30 C y mantenerlo durante 1 hora, agitando la mezcla por rotacin cada 15
minutos
Posteriormente se aaden 2 ml de la solucin de cido sulfrico 3.7 N, se mezcla, se aaden 2 ml de
solucin de tungstato de sodio al 12 %, se mezcla de nuevo y se deja la mezcla en reposo por 2 minutos.
~ 48 ~
Se trasvasa a tubos de centrifuga y se centrifuga a 4000 RPM durante 10 minutos
Se filtra el sobrenadante a travs de un papel Whatman N 40 (o su equivalente), desechando las
primeras 10 gotas, recuperndose el filtrado en un tubo de ensayo grande.
Determinacin del contenido de maltosa
Pipetear 5 ml del filtrado obtenido y colocarlo en un tubo de ensayo grande.
Aadir 10 ml de disolucin alcalina de ferrocianuro al 0,1 N.
Sumergir el tubo de ensayo en bao mara hirviente durante 20 minutos (la superficie del lquido en el
tubo debe estar a unos 4 cm por debajo del nivel del agua hirviente).
Luego enfriar el tubo bajo agua corriente y vaciar el contenido en un erlemeyer de 100 ml, lavando el
tubo de ensayo con 25 ml del reactivo de cido actico.
Aadir 1 ml de disolucin de yoduro potsico y 2 ml de disolucin de almidn, mezclando todo
adecuadamente.
Valorar con tiosulfato de sodio 0,1 N (x ml) hasta desaparecer completamente el color azul.
Clculos: Los ml de ferrocianuro 0,1 N reducido (FR) se obtienen de restar de 10 la cantidad de (x) ml de
tiosulfato de sodio 0,1 N utilizados en la valoracin. Para obtener el ndice de maltosa (IM), expresado
en maltosa formada se utiliza la tabla anexa.
FR
(ml)
IM (%) FR
(ml)
IM (%) FR
(ml)
IM (%) FR
(ml)
IM (%) FR
(ml)
IM (%)
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
1.0
1.1
1.2
1.3
1.4
1.5
1.6
1.7
1.8
1.9
2.0
0.05
0.10
0.15
0.20
0.25
0.31
0.36
0.41
0.46
0.51
0.56
0.60
0.65
0.71
0.76
0.80
0.85
0.90
0.96
1.01
2.1
2.2
2.3
2.4
2.5
2.6
2.7
2.8
2.9
3.0
3.1
3.2
3.3
3.4
3.5
3.6
3.7
3.8
3.9
4.0
1.06
1.11
1.16
1.21
1.26
1.30
1.35
1.40
1.45
1.51
1.56
1.61
1.66
1.71
1.76
1.82
1.88
1.95
2.01
2.07
4.1
4.2
4.3
4.4
4.5
4.6
4.7
4.8
4.9
5.0
5.1
5.2
5.3
5.4
5.5
5.6
5.7
5.8
5.9
60
2.13
2.18
2.25
2.31
2.37
2.44
2.51
2.57
2.64
2.70
2.76
2.82
2.88
2.95
3.02
3.08
3.15
3.22
3.28
3.34
6.1
6.2
6.3
6.4
6.5
6.6
6.7
6.8
6.9
7.0
7.1
7.2
7.3
7.4
7.5
7.6
7.7
7.8
7.9
8.0
3.41
3.47
3.53
3.60
3.67
3.73
3.79
3.85
3.92
3.98
4.06
4.12
4.18
4.25
4.31
4.38
4.45
4.51
4.58
4.65
8.1
8.2
8.3
8.4
8.5
8.6
8.7
8.8
89
9.0
9.1
9.2
9.3
9.4
9.5
9.6
9.7
9.8
9.9
4.72
4.78
4.85
4.92
4.99
5.05
5.12
5.19
5.27
5.34
5.42
5.50
5.58
5.68
5.78
5.88
5.98
6.08
6.18
Nota: Si el material del tubo luego del tratamiento trmico en bao mara hirviente es incoloro
(debe ser un color amarillo) y no se vuelve azul despus de aadir KI se debe repetir el anlisis
usando menos extracto)
CUESTIONARIO:
1. Explique los procesos bioqumico que ocurren durante la elaboracin del pan?
2. En qu otros productos es necesario la maltosa como materia prima para la produccin de alimentos?
3. Dnde podemos encontrar la enzima maltasa?
4. Cmo podemos obtener comercialmente la enzima maltasa?
~ 49 ~
Prctica N 09
TEMA AISLAMIENTO Y CUANTIFICACION DE GLICOGENO
OBJETIVO(S)
Aislamiento de glicgeno en tejidos animales (hgado de rata)
Cuantificacin de glucgeno (Mtodo espectrofotomtrico)
MARCO TERICO:
El glicgeno sirve de reserva principal de
hidratos de carbono en el organismo de los
animales. l se deposita casi en todos los
rganos y tejidos. El depsito principal de
glicgeno son el hgado (de 2 a 5%) y los
msculos (de 0.5 a 2%) en los cuales esta
acumulado hasta 60% de su contenido en el
organismo.
El glicgeno es un polmero de o-D-glucosa
en que las unidades de glucosa estn unidas entre s por los enlaces glucosdicos 1-4 y 1-6; por su constitucin
qumica el glicgeno se asemeja a la amilopectina. Igual que el almidn, en el curso de la hidrlisis el glicgeno
da una serie de productos intermedios, las dextrinas, luego el disacrido la maltosa y, finalmente, el
monosacrido la glucosa. Al aadir iodo, la disolucin de glicgeno adquiere una coloracin rojiparda de
diferentes intensidades y matices, lo que depende de la estructura del glicgeno que difiere para distintas
especies de animales y se determina segn al grado de ramificacin de la macromolcula.
Existe almacenamiento de glucosa disponible en el hgado en forma de glicgeno que puede ser liberada por
este rgano para que otros tejidos la puedan utilizar como fuente de energa. El glicgeno es un polmetro de
residuos de glucosa unidos por uniones -(1,4)- y -(1,6). La segunda fuente importante de almacenamiento
de glucosa es el glicgeno del msculo esqueltico. Sin embargo, el glicgeno del msculo no est disponible
para otros tejidos, debido a que el msculo carece de la enzima glucosa-6-fosfatasa.
El sitio principal del consumo diario de glucosa (75%) es el cerebro por la va aerobia. La glucosa restante es
utilizada por los eritrocitos, msculo esqueltico, y msculo cardiaco. El cuerpo obtiene glucosa directamente
a partir de la dieta o a partir de aminocidos o lactato por la gluconeognesis. La glucosa que se obtiene de
CH OH
2
H
H
H
OH
OH
O
O
O
O
C
H
H
H
OH
OH
O
O
CH OH
2
H
H
H
OH
OH
O
O
CH OH
2
H
H
H
OH
OH
O
O
H
2
enlace
-1,6-glucosidico o
enlace
-1,4-glucosidico o
ESTRUCTURA
DEL GLICOGENO
~ 50 ~
estas dos fuentes primarias permanece en forma soluble en los fluidos corporales o es almacenada en forma
de polmetro, el glicgeno. El glicgeno es considerado como la forma principal de almacenamiento de glucosa
y se encuentra principalmente en el hgado y el msculo, siendo los riones y el intestino sitios menores de
almacenamiento. El glicgeno del hgado puede pesar hasta el 10% del peso de este rgano y por esto tiene el
contenido especfico ms alto que cualquier tejido del cuerpo. El msculo tiene una cantidad ms baja de
glicgeno por unidad de tejido, pero debido a que la masa muscular total es mucho ms grande que la del
hgado, el glicgeno almacenado en el msculo es aproximadamente el doble del que se almacena en el
hgado. El glicgeno almacenado en el hgado es considerado como el principal amortiguador "buffer" de los
niveles de glucosa de la sangre.
El glucgeno se libera de los tejidos que lo contienen por calentamiento con una base fuerte (KOH) hasta la
destruccin total del tejido. La separacin del glucgeno del tejido se consigue mediante la adicin de etanol
(precipita polisacridos y elimina los monosacridos solubles) y sulfato de sodio (coprecipitante). As, se
produce un precipitado que contiene una mezcla de glucgeno, protenas y cidos nucleicos, que han resistido
el calentamiento anterior. El tratamiento posterior con cido tricloroactico (TCA) hace que precipiten las
protenas y cidos nucleicos de la mezcla. El glucgeno aislado se vuelve a precipitar con etanol, obtenindose
una preparacin con un alto grado de pureza. El tratamiento con antrona (que contiene (H2SO4) es un mtodo
rpido para la determinacin de hexosas y alopentosas constituyentes de un polisacrido. Mediante este
mtodo, el glucgeno es hidrolizado por un cido (H2SO4) hasta sus unidades elementales (monosacridos),
que pueden ser luego deshidratadas dando furfural, y ste ltimo, reacciona con la antrona y se forma un
producto coloreado (azul-verdoso) con un mximo de absorbancia a 620 nm. El valor resultante se compara
con los obtenidos al preparar una recta estndar con glucosa pura, usando el mismo mtodo.
La degradacin a glucosa disponible metablicamente (glc-6-P) precisa de la accin combinada de tres enzimas
diferentes:
- Glucgeno fosforilasa.- Cataliza la denominada escisin fosforoltica, que consiste en la salida secuencial
de restos de glucosa desde el extremo no reductor, segn la reaccin:
()
()
Esta reaccin es muy ventajosa para la clula, en comparacin con una de hidrlisis.
La enzima posee PLP como coenzima, que interviene en el mecanismo de catlisis.
- Enzima desramificante del glucgeno.- La glucgeno fosforilasa no puede escidir los enlaces O-glicosdicos
-6). La enzima desramificante del glucgeno posee dos actividad -4) glucosil transfersica que
transfiere cada unidad de trisacrido al extremo no reductor, y -6) glicosidsica que HIDROLIZA el resto
-6).
- Fosfoglucomutasa.- Se encarga de transformar la glucosa-1-P en glucosa-6-P. Esta reaccin,
perfectamente reversible, transcurre mediante un mecanismo en el que se origina glucosa-1,6-bis-fosfato.
En el hgado existe otra enzima muy importante, la glucosa-6-fosfatasa, necesaria para que pueda cumplir
su funcin de proveedor de glucosa a otros tejidos.
MATERIA PRIMA, EQUIPOS Y REACTIVOS:
Hgado de rata en ayunas
Hgado de rata bien alimentada
Hidrxido de potasio al 30 %
Solucin saturada de sulfato de sodio (10 gNa
2
SO
4
llevar hasta 30 ml con agua destilada)
Etanol al 95 %
cido clorhdrico al 2,5 %
Hidrxido de sodio al 10 %
~ 51 ~
Solucin de glucosa 9mg/ml
Reactivo de Barfoed
Solucin amortiguadora (tampn fosfato sdico 0,02 M + NaCl 0,005 M y pH 7)
Solucin de glucgeno (80 mg de glucgeno llevar a 10 ml con solucin amortiguadora)
Solucin de antrona 0,2% en cido sulfrico
Solucin de tricloroactico al 10 %
Piceta con agua destilada
Erlemeyer de 50 cc
Beaker de 50 cc
Tubos de ensayo grandes
Centrifuga a 4000 RPM
Tubos de centrifuga
Gradilla
Pipetas de 2, 5 y 10 cc
Propipeta
Baquetas de vidrio
Papel filtro
Embudo
Termmetro
Balanza analtica ( 0,0001 g)
Bao de agua hirviente
Bao de hielo
PROCEDIMIENTO EXPERIMENTAL:
Aislamiento de glucgeno de hgado de rata (Procedimiento a realizar con cada tipo de hgado)
Se ponen 3 ml de la solucin de hidrxido potsico al 30% en un tubo de ensayo de vidrio grueso.
Se pesan 4 g de tejido (aproximadamente) y se introducen en el tubo anterior. Anotar el peso exacto.
Se calienta en un bao de agua hirviendo, agitando con cuidado para acelerar el proceso, durante 20
minutos (o hasta su digestin). USAR UN TROZO DE PAPEL HIGINICO O PINZAS DE MADERA PARA
MANIPULAR LOS TUBOS. PRECAUCION: ALCALI HIRVIENDO!!
Se enfra el tubo bajo el grifo una vez acabada la digestin.
Una vez enfriado el tubo de ensayo (comprobadlo por contacto con el dorso de la mano), se aaden 0,2
ml de la solucin saturada de Na
2
SO
4
y se mezclan fuertemente. Dejar reposar 5 minutos.
Se precipita el glucgeno que est en solucin por adicin de 7 ml de etanol al 95%. Se agita y deja en
fro en un bao de hielo durante 5 minutos.
Se pasa la solucin a tubos de centrfuga cnicos de plstico con tapn, y se centrifuga a la mxima
velocidad (5.000 x g) durante 5 minutos. Se desecha el sobrenadante y se coloca el tubo invertido sobre
papel de filtro.
Se aaden 5 ml de la solucin de TCA al 10% al tubo y se disuelve totalmente el sedimento agitando
fuertemente.
Se centrifuga de nuevo 5 minutos a 5.000 x g.
Se pesa un tubo de centrfuga cnico de plstico vaco y anota el peso. Marcarlo con una seal para su
posterior identificacin.
~ 52 ~
Se aade el sobrenadante obtenido en la ltima centrifugacin a un tubo de ensayo largo, al que
previamente se han aadido 10 ml de etanol al 95%, desechando el sedimento de la centrifugacin. Se
deja reposar 5 minutos para que se produzca la precipitacin del glucgeno.
Se traslada la solucin al tubo de centrfuga de plstico, previamente pesado, y se centrifuga durante 5
minutos ms a 5.000 x g.
Una vez acabada la centrifugacin se elimina el sobrenadante. El sedimento obtenido representa el
glucgeno prcticamente exento de sustancias contaminantes. Secar en estufa a 35C hasta su uso.
Determinacin de la pureza del glucgeno obtenido (Procedimiento a realizar con cada tipo de hgado)
Se pesa en la balanza el tubo con el glucgeno desecado, obtenido en la parte anterior, y se anota el
resultado.
Se disuelve este glucgeno a razn de 8 mg de dicho glucgeno por ml de tampn fosfato 0,02 M pH 7,0
que contenga NaCl 0,005 M, (el ion que activa la -amilasa). De esta manera queda preparado el
glucgeno para las siguientes determinaciones.
Se prepara una dilucin 1/50 del glucgeno disuelto anteriormente (0,1 ml en 5 ml de agua).
Se preparan tres tubos de ensayo como se describe en la siguiente tabla
Tubo (n) A B C
Glucosa (9 mg/ml) 1 ml --- ---
Agua --- --- 1 ml
Glucgeno (dilucin 1/50) --- 1 ml ---
Antrona (2 g/l H
2
SO
4
) 5 ml 5 ml 5 ml
Una vez preparados los tubos, se sumergen en un bao con agua hirviendo durante 5 minutos. Pasado
este tiempo, se enfran en un bao de hielo. (Precaucin al coger los tubos. Usar pinzas).
Se mide la absorbancia a 620 nm ajustando a 0 con el tubo C (blanco).
Para calcular el porcentaje de pureza se aplica la relacin: A
620
GLUCGENO / A
620
GLUCOSA
Se expresa la relacin de absorbancia obtenida como mg de glucgeno/g de tejido, (rendimiento).
()
CUESTIONARIO:
1. Explique como ocurre el proceso de transformacin del glicgeno a glucosa durante la experimentacin
2. Explique qu funcin cumple el etanol durante el proceso experimental
3. Explique qu funcin cumple la antrona en la experimentacin
~ 53 ~
Prctica N 10
TEMA GLUCOLISIS
OBJETIVO(S)
Identificar la presencia de piruvato durante el metabolismo de una levadura
Evaluar el efecto de inhibidores en la va glucoltica de una levadura
MARCO TERICO:
En 1897, el qumico alemn Edward Buchner (1860-1917)
realizaba estudios sobre la fermentacin en levaduras. Buchner
descubri que la fermentacin es el resultado de una accin
qumica causada por una sustancia segregada por la propia
levadura y no el resultado de una accin fisiolgica producida
dentro del organismo. A esta sustancia se le dio el nombre de
enzima, de zyme, la palabra griega que significa "levadura" o
"fermento". Este resultado apoy la idea de que los seres vivos no
tienen un carcter "especial", y este concepto finalmente fue
dejado de lado. Su experimento consisti en triturar la levadura
con arena fina de cuarzo. Al filtrar la mezcla, obtuvo un lquido con las mismas propiedades que la levadura
activa para producir la fermentacin de los azcares. Por su descubrimiento, Buchner, recibi el Premio Nobel
en 1907. Buchner trataba de obtener extractos de levadura libres de clulas para utilizarlos con fines
teraputicos. Estos extractos requeran ser preservados con conservantes diferentes de los antispticos. Para
su sorpresa, al utilizar sacarosa como conservante observ que sta fermentaba rpidamente hasta etanol y
CO
2
en presencia del extracto. En forma accidental, haba observado los procesos de la glucolisis y la
fermentacin. Este hallazgo fue muy importante, dado que, por primera vez, la fermentacin poda producirse
fuera de un ser vivo. En 1860, Louis Pasteur (1822-1895), a partir de sus estudios sobre fermentacin en
levaduras, haba establecido que la fermentacin estaba siempre ligada a clulas vivas. Este hecho permite
comprender que el hallazgo de Buchner (1860-1917) contradeca ese postulado y refutaba tambin el dogma
vitalista de la poca. Estos hechos abrieron la puerta a la bioqumica moderna y, de este modo, el estudio del
metabolismo pas a abarcar tambin el campo de la qumica.
Para el estudio de la glucolisis, y de todos los metabolismos, intentaremos entender la va en cuatro niveles:
Los pasos de interconversin qumica, o sea, la secuencia de reacciones por medio de las cuales la glucosa
se convierte en los productos finales de la va
El mecanismo de conversin enzimtica de cada intermediario de la va en su sucesor
La energa de la conversin
El mecanismo que regula el flujo (velocidad de flujo) de los metabolitos a travs de la va.
Antes de comenzar con la explicacin detallada de las etapas y enzimas que intervienen en la glucolisis,
primero nos tomaremos un instante para examinar la va total desde el punto de vista de su integracin en el
metabolismo animal como un todo. La glucosa por lo general aparece como resultado de la degradacin de
polisacridos complejos o de su sntesis de precursores no glcidos. La glucosa entra en la mayora de las
clulas por medio de un transportador especfico que las lleva desde el exterior de la clula hacia dentro del
citosol. Las enzimas de la glucolisis se encuentran en el citosol, solo asociadas de manera leve, si es que o
estn, con estructuras celulares como la membrana. Sin embargo, hay evidencia circunstancial considerable de
enzimas sucesivas de la va de la glucolisis que se asocian en forma leve, se presume que para facilitar la
transferencia eficiente de los intermediarios de las enzimas. Estas asociaciones relacionadas de manera
funcional se conocen como metabolones. No obstante, an no se aislaron verdaderos complejos de enzimas
glucolticas
~ 54 ~
La gluclisis o va de Embden Meyerhof Parnas (EMP), es una va de oxidacin de las hexosas es la ms
utilizada por los microorganismos. Para algunos de ellos la glucosa es degradada exclusivamente o casi
exclusivamente por esta va.
Histricamente la elucidacin del mecanismo de la glucolisis se vincula estrechamente con la investigacin
sobre fermentacin; sin embargo es necesario el reconocimiento de al menos parte de la va glucoltica como
la etapa inicial de la respiracin.
Las etapas importantes en la cadena de gluclisis son las siguientes:
Activacin de la glucosa bajo la forma de 6 fosfato por medio del ATP, isomerizacin y segunda
fosforilacin para dar 1,6 difosfato de fructuosa y 2 ADP
Ruptura del 1,6 difosfato de fructuosa en dos molculas de fosfato de triosa, por la aldolasa, enzima
caracterstica de esta va metablica
Oxidacin del 3 fosfogliceraldehido con reduccin del NAD. Esta reaccin es acompaada de una
fosforilacin a nivel de sustrato y conduce a la formacin de 1,3 difosfoglicerato, compuesto que tiene un
enlace rico en energa.
Transferencia de un enlace ester fosfrico del 1,3 difosfoglicerato al ADP
Isomerizacin del 3 fosfoglicerato, deshidratacin para formar el fosfoenolpiruvato con un enlace rico en
energa.
Transferencia del enlace ester fosforico del fosfoenolpiruvato al ADP y formacin de piruvato y ATP.
El Balance total del proceso es
Glucosa + 2 ATP + 2 NAD
+
+ 2 P
i
2 Piruvato + 2 NADH + 4 ATP
Para cada molcula de glucosa que se consume se forman finalmente 2 ATP y son reducidos 2 NAD.
MATERIA PRIMA, EQUIPOS Y REACTIVOS:
Levadura Comercial
Glucosa 0,2 M
Glucosa 0,1 M
Glucosa 0,05 M
Buffer Fosfato de sodio PO
4
HNa
2
(0,213 gr/100 ml)
Buffer Fosfato de potasio PO
4
H
2
K (0,09 gr/100 ml)
cido tricloroactico al 10%
Nitroprusiato de sodio
2,4-di nitro fenil hidracina
Hidrxido de amonio concentrado
Hidrxido de sodio 0,1 N
Sulfato de amonio solido
Fluoruro de sodio 0,2 M
cido pirvico 0,2 M
Piceta con agua destilada
Erlemeyer de 100 cc
Probeta de 100 cc
Tubos de ensayo
Tubos de centrifuga
Centrifuga a 2500 RPM
Balanza analtica 0,0001 g
~ 55 ~
Bao Mara 37 C
Bao de agua hirviente con gradilla
Pipetas de 1 cc
Pipetas de 2 cc
Pipetas de 5 cc
Pipetas de 10 cc
Termmetro 0 a 100 C
Embudo de vidrio
Papel filtro Whatman N 42
Pipeta Pasteur
Pinzas para tubo de ensayo
Gradillas
Baqueta de vidrio
Papel parafina
PROCEDIMIENTO EXPERIMENTAL:
Preparacin de la levadura (18 horas de activacin antes de su uso)
Pesar 5 gramos de levadura disolverlo a 100 gramos con buffer fosfato bisodico. Marcar el recipiente
con BFBNa
Mantenerlo a temperatura ambiente hasta su uso (18 horas post preparacin)
Pesar 5 gramos de levadura disolverlo a 100 gramos con buffer fosfato bisodico. Marcar el recipiente
con BFMK
Mantenerlo a temperatura ambiente hasta su uso (18 horas post preparacin)
Formacin de Piruvato
Preparar la siguiente batera experimental en tubos de centrifuga
Reactantes 0,05-Na 0,10-Na 0,20-Na 0,05-K 0,10-K 0,20-K
Glucosa 0,05M 3 ml 3 ml
Glucosa 0,10 M 3 ml 3 ml
Glucosa 0,20 M 3 ml 3 ml
Suspensin levadura/PO
4
HNa
2
3 ml 3 ml 3 ml
Suspensin levadura/ PO
4
H
2
K 3 ml 3 ml 3 ml
Colocar todos los tubos en bao mara a 37.C por 30 minutos.
Adicionar a cada tubo 1 ml de cido tricloroactico mezclando vigorosamente
Centrifugar a 2500 r.p.m. por 10 minutos
Separar el sobrenadante en tubos de ensayo y desechar el precipitado.
Identificacin de Piruvato (Reaccin con Nitroprusiato de sodio)
En un tubo de ensayo colocar 1 ml del sobrenadante obtenido
Colocarlo a ebullicin durante 3 minutos
Retirarlo del bao en ebullicin, adicionarle 0.5 gr. de sulfato de amonio slido y agitar.
Agregar 2 gotas de Nitroprusiato de sodio recin preparado y mezclar vigorosamente.
~ 56 ~
Adicionar con mucho cuidado y por las paredes gotas de hidrxido de amonio concentrado (coloque la
inclinacin prudencial para que el reactivo se deslice por las paredes del tubo de ensayo), hasta que se
d la formacin de dos capas.
La formacin de un anillo verde o azul en la interface indica la presencia de piruvato.
Repetir lo anterior para cada uno de los tubos de ambas series.
Observar la coloracin e intensidad de la misma en cada caso.
Identificacin de Piruvato (2,4 dinitrofenil hidracina)
En un tubo de ensayo colocar 1 ml del sobrenadante obtenido
Agregar 1 ml de 2,4 dinitrofenil hidracina y mezclar vigorosamente.
Adicionar 1 ml de NaOH 0.1N y mezclar.
La aparicin de un color rojo indica la presencia de piruvato
Repetir lo anterior para cada uno de los tubos de ambas series.
Observar la coloracin e intensidad de la misma en cada caso.
Efecto de inhibidores de la glucolisis
Preparar la siguiente batera experimental en tubos de centrifuga
Reactantes A-Na F-Na P-Na A-K F-K P-K
Glucosa 0,20 M 3 ml 3 ml 3 ml 3 ml 3 ml 3 ml
Suspensin levadura/PO
4
HNa
2
3 ml 3 ml 3 ml
Suspensin levadura/ PO
4
H
2
K 3 ml 3 ml 3 ml
Agua destilada 1 ml 1 ml
Fluoruro de sodio 0,2 M 1 ml 1 ml
cido pirvico 1 ml 1 ml
Colocar todos los tubos en bao mara a 37.C por 30 minutos.
Adicionar a cada tubo 1 ml de cido tricloroactico mezclando vigorosamente
Centrifugar a 2500 r.p.m. por 10 minutos
Separar el sobrenadante en tubos de ensayo y desechar el precipitado.
Proceder con la tcnica de identificacin de piruvato (Reaccin con Nitroprusiato de sodio)
CUESTIONARIO:
1. Qu finalidad tiene adicionar a la suspensin de levadura Na
2
HPO
4
y KH
2
PO
4
?
2. Por qu deben estar los tubos en bao mara a 37C por 30 minutos?
3. Por qu se adiciona TCA al 10%?
4. Escriba la reaccin para la segunda reaccin. Indicando la funcin del NaOH.
5. Qu importancia tiene la glucosa en el trabajo muscular?
~ 57 ~
Prctica N 11
TEMA FERMENTACIN
OBJETIVO(S)
Identificar las rutas metablicas de fermentacin de los principales carbohidratos
utilizados en la industria alimentaria
MARCO TERICO:
La va glucoltica para la degradacin de la glucosa se divide en 3
etapas principales. La etapa 1 es preparativa, con reacciones que
no son de xido-reduccin, sin liberacin de energa, y con
formacin de 2 intermediarios de 3 tomos de carbono cada uno.
En la etapa 2 ocurren reacciones de xido-reduccin, con
liberacin de energa, formacin de ATP por el proceso de
fosforilacin a nivel del sustrato (el ATP es generado durante un
paso enzimtico especfico), y se forman 2 molculas de piruvato.
En la etapa 3 nuevamente ocurren reacciones de xido-reduccin
y se generan los productos finales de la fermentacin, que varan
segn el organismo en cuestin. Slo una pequea parte del total
de la energa libre que potencialmente puede derivar de la degradacin de una molcula de glucosa queda
disponible por esta va, debido a que los productos finales son compuestos en los que el carbono se encuentra
todava en estado reducido.
El cido pirvico derivado de la glucosa es un compuesto clave en el metabolismo fermentador de los hidratos
de carbono. En su formacin, el NAD
+
es reducido a NADH, y ste debe reoxidarse nuevamente a NAD
+
para
alcanzar el equilibrio final de xido-reduccin. Las bacterias se diferencian de las clulas eucariotas por la
forma en que eliminan el piruvato; en las bacterias la oxidacin incompleta es la regla, acumulndose gran
cantidad de metabolitos finales de la fermentacin. El estudio y conocimiento de las fermentaciones
bacterianas tiene importancia prctica, ya que, proporcionan productos de valor industrial, y son de utilidad en
el laboratorio para la identificacin de diferentes especies. Entonces, de acuerdo a los productos finales de la
fermentacin, tenemos:
Fermentacin alcohlica: el tipo de fermentacin ms antigua que se conoce es la produccin de etanol a
partir de la glucosa. Aunque ciertas bacterias producen alcohol, ste es elaborado por otras vas.
Fermentacin homolctica: Todos los miembros del gnero Streptococcus, Pediococcus y muchas especies
de Lactobacillus fermentan la glucosa fundamentalmente a cido lctico con poca acumulacin de otros
productos finales. El piruvato en este caso se reduce a cido lctico por accin de la enzima lctica
deshidrogenasa, actuando el NADH como dador de e-. Esto ocurre en la etapa 3 de la va glucoltica.
Fermentacin heterolctica: En este tipo de fermentacin slo la mitad de la glucosa se convierte en
cido lctico, el resto en una mezcla de CO2, cido frmico, cido actico, etc. En esta fermentacin se
emplea fundamentalmente el shunt de las pentosas, y se da en bacterias del gnero Leuconostoc y
Lactobacillus.
Fermentacin del cido propinico: es caracterstica en algunas bacterias anaerobias como
Propionibacterium (bacilo Gram+ no esporulado). Este tipo de fermentacin tiene la ventaja de que
genera una molcula ms de ATP.
Fermentacin cido-mixta: Es caracterstica de la mayora de las enterobacterias. Bacterias como Shigella,
Salmonella y E.coli fermentan las hexosas a travs del piruvato a cido lctico, cido actico, succnico y
frmico.
~ 58 ~
Fermentacin de butanodiol: Varias bacterias como Enterobacter, Serratia y Bacillus producen 2-3
butanodiol durante la fermentacin de la glucosa. Este deriva de la condensacin de 2 molculas de
piruvato en una molcula neutra de acetona que luego es reducida a 2-3 butanodiol.
Fermentacin del cido butrico: Se ve en bacterias del gnero Clostridium (bacilo Gram+, anaerobio,
esporulado).
Si bien hasta ahora nos hemos referido slo a la fermentacin de hidratos de carbono como procedimiento
para obtener energa por parte de las bacterias, debemos destacar que otros compuestos orgnicos pueden
ser fermentados como, por ejemplo, aminocidos (alanina, glicina). En el caso de los Clostridium proteolticos
la fermentacin de aminocidos ms caracterstica es la reaccin de Stickland.
Hemos discutido ms arriba el metabolismo de los hidratos de carbono en ausencia de un aceptor externo de
electrones y vimos que slo una pequea parte de la energa potencial contenida en el substrato es liberada.
Esto se debe fundamentalmente a que la diferencia entre los potenciales de xido-reduccin entre la molcula
dadora inicial y la molcula aceptora final es muy pequea. Otras bacterias tienen la capacidad de oxidar
completamente el substrato inicial a CO
2
, por el proceso conocido como respiracin.
La respiracin aerobia, es el proceso por el cual un substrato es oxidado completamente a CO
2
y H
2
O, con
participacin de una cadena de e- (ubicada en la membrana citoplasmtica) y el aceptor final es el oxgeno
molecular. Los primeros pasos en la respiracin de la glucosa son idnticos a los de la gluclisis, pero mientras
en esta ltima el piruvato es convertido en productos finales de la fermentacin (cido lctico, propinico,
etc.) en la respiracin es oxidado completamente a CO
2
a travs del ciclo de Krebs. Por cada molcula de
piruvato oxidada a travs del ciclo se generan 3 molculas de CO
2
. Al igual que en la fermentacin, los e-
generados en el ciclo de Krebs, pasan a coenzimas que tienen NAD
+
. Sin embargo, en la respiracin, los e- del
NADH son transferidos al oxgeno para regenerar NAD
+
a travs de un sistema transportador, en lugar de
cederlos al piruvato.
MATERIA PRIMA, EQUIPOS Y REACTIVOS:
Levadura de panificacin
Levadura para vino
Bacterias lcticas para yogurt
Bacterias acido-acticas
Buffer de agua peptonada
(pH 7,2; 10 gr peptona, 5 gr NaCl, 3.5 gr fosfato de sodio, 1.5 fosfato de potasio, diluido con agua a 1 Lt)
Glucosa 0,2 M (solucin en buffer de agua peptonada)
Fructosa 0,2 M (solucin en buffer de agua peptonada)
Maltosa 0,1 M (solucin en buffer de agua peptonada)
Lactosa 0,1 M (solucin en buffer de agua peptonada)
Sacarosa 0,1 M (solucin en buffer de agua peptonada)
Azul de bromotimol (0.1 gr en 8 ml de NaOH 0.02 M, diluido con agua a 250 ml)
Parafina liquida
Alcohol 96 GL
Piseta con agua destilada
Erlemeyer de 100 cc
Probeta de 100 cc
Tubos de ensayo
Tubos de centrifuga
Centrifuga a 2500 RPM
~ 59 ~
Balanza analtica 0,0001 g
Bao Mara 25 C
Bao Mara 45 C
Bao de agua hirviente con gradilla
Gradillas
Pipetas de 1 cc
Pipetas de 2 cc
Pipetas de 5 cc
Pipetas de 10 cc
Termmetro 0 a 100 C
Embudo de vidrio
Papel filtro Whatman N 42
Pipeta Pasteur
Pinzas para tubo de ensayo
Baqueta de vidrio
Papel parafina
PROCEDIMIENTO EXPERIMENTAL:
Preparacin de las levaduras (18 horas de activacin antes de su uso)
Pesar 5 gramos de levadura disolverlo a 100 gramos con buffer de agua peptonada
Mantenerlo a temperatura ambiente hasta su uso (18 horas post preparacin)
Preparacin de las Bacterias (18 horas de activacin antes de su uso)
Pesar 5 gramos de la bacteria disolverlo a 100 gramos con buffer de agua peptonada
Mantenerlo a temperatura ambiente hasta su uso (18 horas post preparacin)
Desarrollo de la fermentacin anaerobia (la batera es para cada bacteria evaluada)
Preparar la siguiente batera experimental en tubos de ensayo
Reactantes A B C D E F
Glucosa 0,2 M 10 ml
Fructosa 0,2 M 10 ml
Maltosa 0,1 M 10 ml
Lactosa 0,1 M 10 ml
Sacarosa 0,1 M 10 ml
Agua destilada 10 ml
Cultivo microbiano 1 ml 1 ml 1 ml 1 ml 1 ml 1 ml
Azul de bromotimol 3 gotas 3 gotas 3 gotas 3 gotas 3 gotas 3 gotas
Agitar los tubos hasta su completo mezclado
Adicionar una capa ( 3 mm) de parafina liquida
~ 60 ~
Colocar todos los tubos en bao mara a 45 C por 90 minutos.
Verificar el tiempo que demora en cambiar el color de verde a amarillo
Verificar la formacin de gas en el interior del lquido (por desplazamiento de la parafina)
Desarrollo de la fermentacin aerobia (la batera es para cada bacteria evaluada)
Preparar la siguiente batera experimental en tubos de ensayo
Reactantes A B C D E F
Glucosa 0,2 M 10 ml
Fructosa 0,2 M 10 ml
Maltosa 0,1 M 10 ml
Lactosa 0,1 M 10 ml
Sacarosa 0,1 M 10 ml
Agua destilada 10 ml
Cultivo microbiano 1 ml 1 ml 1 ml 1 ml 1 ml 1 ml
Azul de bromotimol 3 gotas 3 gotas 3 gotas 3 gotas 3 gotas 3 gotas
Agitar los tubos hasta su completo mezclado
Colocar todos los tubos en bao mara a 45 C por 90 minutos.
Verificar el tiempo que demora en cambiar el color de verde a amarillo
Reportar a que sustrato tiene afinidad el (los) microorganismo(s) estudiado(s)
Sustrato Microorganismo anaerobio Microorganismo aerobio
Glucosa 0,2 M
Fructosa 0,2 M
Maltosa 0,1 M
Lactosa 0,1 M
Sacarosa 0,1 M
CUESTIONARIO:
1. Qu finalidad tiene preparar las soluciones de azcar con buffer de agua peptonada?
2. Por qu es necesario activar previamente las bacterias y/o levaduras antes del proceso de fermentacin?
3. Por qu se adiciona azul de bromotimol?
4. Por qu se aadi parafina liquida a los tubos de ensayo?
~ 61 ~
Prctica N 12
TEMA IDENTIFICACION DE AMINOACIDOS
OBJETIVO(S)
Evaluar las reacciones fisicoqumicas de los principales reactantes de las diversas
tcnicas de identificacin de aminocidos.
MARCO TERICO:
Los aminocidos, pptidos y protenas son componentes
importantes de los alimentos. Por un lado proporcionan los
elementos necesarios para la sntesis proteica. Por otro
lado, los aminocidos y pptidos contribuyen directamente
al sabor de los alimentos y son precursores de los
componentes aromticos y las sustancias coloreadas que se
forman mediante las reacciones trmicas y/o enzimticas
que ocurren durante la obtencin, preparacin y
almacenamiento de los mismos.
Aminocido. Los aminocidos son cidos carboxlicos que contienen un grupo amino. Existen unos cien en la
naturaleza. En el hidrolizado total de las protenas existen veinte aminocidos que tienen, con algunas
excepciones, la frmula general siguiente:
En el caso ms sencillo, el radical R es un tomo de Hidrgeno (cido aminoactico o glicina), en los dems
aminocidos R es un resto aliftico, aromtico o heterocclico, que puede ser portador de otros grupos
funcionales.
Existen diez aminocidos, denominados aminocidos esenciales, que el organismo es incapaz de sintetizar y
que deben ser aportados por la alimentacin. El organismo no los puede sintetizar porque carece del
mecanismo necesario para elaborar los cetocidos correspondientes; se ha comprobado que si se le
suministran stos y sales de amonio es capaz de elaborarlos.
Los aminocidos constituyentes de las protenas son, aproximadamente, veinte: alanina, arginina, asparagina,
cido asprtico, cistena, cido glutmico, glutamina, glicina, histidina, isoleucina, leucina, lisina, metionina,
fenilalanina, prolina, serina, treonina, triptfano, tirosina y valina.
Todos ellos son aminocidos excepto dos, que son prolina y la hidroxiprolina, que tambin pueden
considerarse como aminocidos por su similitud estructural. Se les llama aminocidos porque el grupo amino
est unido al carbono de la cadena que es, por convenio, el tomo de carbono adyacente al grupo carboxilo.
Los aminocidos contienen tantos grupos cidos como bsicos, por lo que tienen propiedades cidas y bsicas
dbiles y se les llama anfolitos. Se comportan como anfiprticos porque pueden aceptar o donar electrones.
Las molculas de aminocidos transportan una carga negativa y otra positiva, lo que da como resultado una
carga total nula, esta forma se conoce como "zwitterion" del aminocido. La carga total transportada por un
aminocido depende del pH de la solucin y de los valores de la constante de acidez de los grupos ionizables
presentes. Si el pH es mucho mayor que el valor de la constante de un grupo, se libera un protn y la molcula
tendr una carga negativa, pero si el pH es menor, tendr carga positiva. El hecho de que a diferentes valores
de pH el aminocido tenga distintas formas y lleve distintas cargas netas se utiliza en muchos mtodos
analticos, como en la electroforesis y en la cromatografa de intercambio inico. El punto iso-inico de una
molcula es el pH en el que el nmero de cargas negativas debidas a los protones perdidos es igual al nmero
de cargas positivas debidas a los protones ganados, entonces predomina la forma zwitterinica. El punto
~ 62 ~
isoelctrico es el pH en el que las molculas no presentan migracin en un campo elctrico y puede
determinarse experimentalmente por electroforesis; en los aminocidos es igual que el punto iso-inico.
Un aspecto importante en el anlisis de los aminocidos es el hecho de que no se pueden detectar en el
visible-UV. Existen varios reactivos que reaccionan con los aminocidos dando compuestos coloreados o
fluorescentes y que, por tanto, pueden utilizarse para anlisis cualitativos o cuantitativos. Esto es lo que se
denomina derivatizacin de los aminocidos. Los mtodos fluorimtricos tienen muchas ventajas respecto a la
espectrofotometra para el anlisis de aminocidos.
Necesidades proteicas. Se requiere un criterio para fijar las necesidades o exigencias en protenas para el ser
humano. Por ello se establece una "protena de referencia" o "patrn".
Conocida la composicin en aminocidos de las protenas de los distintos alimentos que se consumen y cuales
han demostrado poseer mayor valor biolgico, a saber: la de la leche, la del huevo y las de la carne; y teniendo
en cuenta la composicin cualitativa y cuantitativa en aminocidos, se ha adoptado dicha "protena de
referencia" o "patrn".
En la calidad de las protenas influye el contenido en aminocidos esenciales, y es importante la presencia de
"limitantes". En efecto, se llama as al aminocido esencial que en una protena dada se encuentra en cantidad
relativa ms baja con respecto a la protena patrn porque limita el aprovechamiento de esa protena a los
fines biolgicos.
Es importante determinar el contenido en aminocidos, en conjunto, para estimar el grado de protelisis
enzimtica que ha sufrido el producto, as como la proporcin de cada uno de ellos, como componentes de la
protena, cuando se desea establecer su valor biolgico.
La determinacin de aminocidos en alimentos permite extraer algunas conclusiones acerca de su
composicin; por ejemplo, la gelatina usada como espesante se diferencia rpida y sencillamente, de otros
hidrocoloides (grasas vegetales, almidn, etc.), en funcin de su composicin aminoacdica.
La estructura qumica de los aminocidos que se encuentran en el sistema biolgico son:
~ 63 ~
Los aminocidos constituyen la base para la
formacin de protenas desde su forma ms
simple (monmeros, hasta su forma ms
compleja, como por ejemplo la estructura
cuaternaria.
Existen varias pruebas para la identificacin de
aminocidos y protenas, entre ellas tenemos:
Reaccin de la Ninhidrina.- Los aminocidos en
general reaccionan con la Ninhidrina (hidrato de
hicelohidrindeno) en presencia de calor dando
dixido de carbono, amoniaco y un aldehdo que contiene un tomo de carbono menos que el compuesto
original. La reaccin da lugar a la formacin de un producto de color azul o prpura, que es til para la
estimacin cualitativa y cuantitativa de los aminocidos. No obstante, el color azul no es especfico para
aminocidos debido a que el amonaco y la mayora de los polipptidos y protenas desarrollan el color con la
Ninhidrina.
Reaccin de Biuret.- La reaccin de Biuret est dada por aquellas sustancias cuyas molculas contienen 2
grupos carbamino (-CO.NH) ligados directamente o a travs de un solo tomo de carbono o nitrgeno.
Sustancias similares que contienen en lugar del grupo carbamino, grupos CS. NH, tambin responden a la
prueba. Esto implica que compuestos no proteicos que contienen los grupos necesarios respondern a la
prueba. Las protenas disuelven el hidrxido cprico del reactivo y forman compuestos coloreados violeta o
violeta-rosado que depende de la naturaleza de las protenas.
Reaccin de Adamskiewics.- Esta reaccin es especfica para los grupos indoles. Se basa en la propiedad que
tiene este grupo qumico de reaccionar con un gran nmero de aldehdos, entre ellos el formaldehdo, a travs
de una reaccin de condensacin mediada por la presencia de un agente deshidratante como el cido sulfrico
y generando as un derivado coloreado caracterstico propio del triptfano. Debe sealarse que las protenas
que tengan este aminocido tambin daran positiva la reaccin, pues el cido sulfrico provocara la
desnaturalizacin de la protena con la subsiguiente exposicin al medio de los grupos indlicos existentes en
las cadenas laterales de los aminocidos, entre ellos las del triptfano.
Reaccin de Milln.- Esta reaccin se debe a la presencia de grupos hidroxifenilos (C
6
H
5
OH) en la molcula
proteica. Cualquier compuesto fenlico que no est sustituido en la posicin 3, 5, como la tirosina, fenol y
timol, dan lugar a la reaccin. De estos compuestos, solamente la tirosina o tirosina halogenada se encuentran
presentes en las protenas, de manera que la reaccin de Milln tiene lugar nicamente con las protenas que
tienen tirosina. La prueba no es satisfactoria para soluciones que contienen sales inorgnicas en gran cantidad,
ya que el mercurio del reactivo de Milln es precipitado y se vuelve inactivo, razn por la que este reactivo no
se usa para medir albmina en la orina. Si la solucin a examinarse es muy alcalina debe ser previamente
neutralizada, ya que el lcali precipita tambin el mercurio en forma de xidos amarillos.
Reaccin Xantoproteica.- Esta reaccin se debe a la presencia en la molcula proteica de grupos fenilos (-C
6
H
5
),
con el cual el cido ntrico forma compuestos nitrados amarillos. Los complejos de la molcula proteica de
importancia en esta reaccin son los de tirosina y triptfano. La fenilalanina no responde a este ensayo en las
condiciones en que se ha desarrollado. La reaccin no es satisfactoria para el examen de orina debido al color
amarillo de la reaccin final.
Reaccin de los Tiogrupos.- La presencia de los grupos SH (sulfhdrico o tiol) en un compuesto orgnico
permite que transcurra una reaccin en presencia de acetato de plomo en medio alcalino. Se pone de
manifiesto por la formacin de un precipitado negruzco de sulfuro de plomo. Se basa esta reaccin en la
separacin mediante un lcali, de los aminocidos el cual al reaccionar con la solucin de acetato de plomo,
forma el sulfuro de plomo, lo que nos sirve para identificar protenas que tiene en su composicin aminocidos
con azufre.
~ 64 ~
MATERIA PRIMA, EQUIPOS Y REACTIVOS:
Albumina de huevo
Gelatina
Carne cruda
Leche fresca
Buffer acetato pH 4
Buffer fosfato pH 9
Sacarosa al 1 %
Casena al 1 %
Mezcla de aminocidos
Solucin de Ninhidrina
Reactivo de Biuret
Reactivo de Milln
Solucin de Metionina 1 %
Solucin de Alanina 1 %
Solucin de Fenilalanina 1 %
Solucin de Triptfano 1 %
Solucin de Cistena 1 %
Solucin de Prolina 1 %
Solucin de Treonina 1 %
Solucin de Tirosina 1 %
Solucin de Lisina 1 %
Solucin de Histidina 1 %
Solucin de Acido Asprtico 1 %
Solucin de Acido Glutmico 1 %
Formaldehdo al 40 %
Fenol al 20 %
cido sulfrico concentrado
cido ntrico concentrado
Solucin de hidrxido de sodio al 20%
Solucin de hidrxido de potasio al 40%
Solucin de acetato de plomo al 10%
Agua destilada
Pipetas de 1 cc
Pipetas de 2 cc
Pipetas de 5 cc
Propipeta
Pipetas Pasteur
Tubos de ensayo
Gradilla
Pinzas para tubo de ensayo
Bao de agua a ebullicin
~ 65 ~
Bao de agua helada
Beaker de 100 cc
Erlemeyer de 100 cc
Probeta de 100 cc
Baqueta
Papel filtro
Embudo de vidrio
Balanza
PROCEDIMIENTO EXPERIMENTAL:
Reaccin de Ninhidrina
Tomar 2 cc de la muestra a analizar en un tubo de ensayo
Agregar 5 gotas de solucin de Ninhidrina
Calentar en bao mara de agua hirviente durante 2 minutos
PRUEBA POSITIVA.- presenta una coloracin azul.
Reaccin de Biuret
Tomar 2 cc de la muestra a analizar en un tubo de ensayo
Agregar 2 cc del reactivo de Biuret
PRUEBA POSITIVA.- presenta una coloracin violeta.
Reaccin de Adamskiewics
Tomar 0,5 cc de la muestra a analizar en un tubo de ensayo
Agregar 3 gotas de formaldehdo y mezclar
Adicionar con mucho cuidado y lentamente por las paredes del tubo de ensayo 1 cc de cido sulfrico
concentrado
PRUEBA POSITIVA.- presenta una coloracin violeta
Reaccin de Millin
Tomar 2 cc de la muestra a analizar en un tubo de ensayo
Agregar 4 gotas del reactivo de Milln y mezclar
Calentar en bao mara de agua hirviente durante 2 minutos
PRUEBA POSITIVA.- presenta un precipitado que gradualmente se convierte de blanco a rojo por
efecto del calentamiento
NOTA.- si la prueba no desarrolla el color rojo adicione 3 gotas ms del reactivo de Milln y volver a
calentar. Se debe evitar el exceso de reactivo ya que puede producir un color amarillo, el cual no indica
una reaccin positiva.
Reaccin Xantoproteica
Tomar 2 cc de la muestra a analizar en un tubo de ensayo
Adicionar con mucho cuidado 1 cc de cido ntrico concentrado
Calentar en bao mara de agua hirviente durante 1 minuto
Enfriar el tubo de ensayo en bao mara de agua helada
Aadir 5 cc de hidrxido de sodio al 20 %
PRUEBA POSITIVA.- se observa la formacin de un precipitado amarillento y que gradualmente
conforme se va aadiendo el hidrxido de sodio presenta una coloracin amarilla, intensificndose
hasta anaranjado
Reaccin de los Tiogrupos
Tomar 1 cc de la muestra a analizar en un tubo de ensayo
Adicionar 1 cc de hidrxido de potasio al 40 %
Agregar 3 gotas de acetato de plomo al 10 %
~ 66 ~
Calentar en bao mara de agua hirviente durante 10 minutos
PRUEBA POSITIVA.- formacin de un precipitado negruzco
Preparacin de las muestras
Tomar 20 gr. de la muestra problema, adicionar 80 cc de buffer fosfato o acetato, segn el tipo de
muestra a preparar y proceder a homogenizar en una licuadora
Si la muestra es semislida reduzca el tamao en un mortero y diluya la muestra con la misma cantidad
del buffer fosfato o acetato
Si la muestra es lquida o semilquida tome 20 cc de la muestra y diluya con 80 cc buffer fosfato o
acetato segn corresponda
Para realizar las pruebas tome el sobrenadante.
Preparacin de la batera experimental
MUESTRA
TECNICA DE
IDENTIFICACION
A
g
u
a
d
e
s
t
i
l
a
d
a
S
a
c
a
r
o
s
a
C
a
s
e
n
a
M
e
t
i
o
n
i
n
a
A
l
a
n
i
n
a
F
e
n
i
l
a
l
a
n
i
n
a
T
r
i
p
t
f
a
n
o
C
i
s
t
e
n
a
P
r
o
l
i
n
a
T
r
e
o
n
i
n
a
T
i
r
o
s
i
n
a
L
i
s
i
n
a
H
i
s
t
i
d
i
n
a
c
i
d
o
a
s
p
r
t
i
c
o
c
i
d
o
g
l
u
t
m
i
c
o
F
e
n
o
l
S
o
l
.
a
m
i
n
o
c
i
d
o
s
M
u
e
s
t
r
a
1
Ninhidrina X X X X X X X X X X
Biuret X X X X X X X X X X
Adamskiewicks X X X X X X X X X X
Million X X X X X X X X X X
Xantoproteica X X X X X X X X X X
Tiogrupos X X X X X X X X X X
Identificar que muestras dan una reaccin positiva
TECNICA AMINOACIDOS QUE DAN UNA REACCION POSITIVA
Ninhidrina
Biuret
Adamskiewicks
Million
Xantoproteica
Tiogrupos
CUESTIONARIO:
1. Explique el fundamento fisicoqumico de cada una de las pruebas utilizadas
2. Indique como puede pasar de una prueba cualitativa a una cuantitativa en la identificacin de aminocidos.
~ 67 ~
Prctica N 13
TEMA HIDROLISIS DE PROTEINAS
OBJETIVO(S)
Demostrar la desnaturalizacin proteica por efecto del pH
Demostrar la desnaturalizacin proteica por efecto de metales pesados
Demostrar la desnaturalizacin proteica por efecto de la temperatura
Evaluar el efecto de la hidrolisis enzimtica de una alimento proteico
MARCO TERICO:
Las protenas son biomolculas formadas bsicamente por carbono,
hidrogeno, oxgeno y nitrgeno, pudiendo adems contener azufre;
inclusive, en algunos tipos de protenas presentan fsforo, hierro,
magnesio y cobre entre otros elementos.
Pueden considerarse polmeros de unas pequeas molculas que reciben el
nombre de aminocidos y serian por lo tanto la monmera unidad. Los
aminocidos estn unidos por enlaces peptdicos.
La unin de un bajo nmero de aminocidos nos da un pptido, si este
nmero no es mayor de 10 se denomina oligopptido y si es superior a 10
se denomina polipptido. Si este nmero es superior a 50 aminocidos se
habla de una protena.
Las protenas tienen diversas propiedades entre ellas una de las ms
importantes es su especificidad la que se refiere a su funcin, cada una lleva
acabo una determinada funcin realizndola as debido a que posee una
determinada estructura primaria y una conformacin espacial propia, por lo
que un cambio en la estructura de la protena puede significar una prdida
de su funcin. Adems, no todas las protenas son iguales en todos los
organismos, cada individuo posee protenas especficas.
Las protenas se clasifican en holoprotenas (aquellas que solo estn compuestas de aminocidos) y
heteroprotenas (llamadas tambin protenas conjugadas, y son las que poseen una parte proteica y otra no
proteica menor denominada grupo prosttico), todas las heteroprotenas son globulares y se clasifican segn
el grupo prosttico.
Funciones de las protenas.- las protenas cumplen las siguientes funciones:
- Funcin estructural como por ejemplo: Las glucoprotenas forman parte de las membranas; La histomas
forman parte de los cromosomas; El colgeno forma parte del tejido conjuntivo fibroso; La elastina forma
parte del tejido conjuntivo elstico; La queratina forma parte de la epidermis
- Funcin enzimtica, siendo estas las ms numerosas y actan como biocatalizadores de las reacciones
qumicas.
- Funcin hormonal, como por ejemplo: Insulina y glucagn; Hormona del crecimiento; Calcitonina;
Hormonas tropas
- Funcin defensiva, como por ejemplo: Inmunoglobulina; Trombina y fibringeno
- Funcin de transporte, como por ejemplo: Hemoglobina; Hemocianina; Citocromos
- Funcin de reserva, como por ejemplo: Ovoalbmina en la clara de huevo; Gliadinas en los granos de trigo;
Lactoalbmina en la leche
La desnaturalizacin consiste en la prdida de la estructura terciaria por rompimiento de los puentes que
forman dicha estructura. Todas las protenas desnaturalizadas tienen la misma conformacin, muy abierta y
~ 68 ~
con una iteracin mxima con el disolvente,
por lo que una protena soluble en agua, al ser
desnaturalizada se hace insoluble y precipita.
La desnaturalizacin de las protenas implica
modificaciones en la estructura de la protena
que trae como resultado una alteracin o
desaparicin de sus funciones. Este fenmeno
puede producirse por una diversidad de
factores, ya sean fsicos como: calor, radiacin
UV, altas presiones; o qumicos, como por
ejemplo, cidos, base, sustancias con actividad
detergente. La desnaturalizacin genera una
ruptura de los enlaces disulfuro y los puentes
de hidrgeno generando la exposicin de
estos. Cuando la protena es desnaturalizada,
pierde sus funciones como: viscosidad,
velocidad de difusin y la facilidad con que
cristalizan.
La reversibilidad de la desnaturalizacin,
depende de que tan fuerte sean los agentes
que desnaturalizan la protena. Todo depende
del grado de ruptura generado en los enlaces.
La hidrlisis de protenas termina con
fragmentos de aminocidos. En la hidrlisis se
rompen los enlaces peptdicos y deja de ser
una protena, dando lugar a los distintos
aminocidos que conforman esa protena,
mientras que en la desnaturalizacin se sigue
tendiendo la protena con un cambio de
estructura cuaternaria o terciaria, rompiendo
nicamente los enlaces intracelulares. Existen
3 tipos de hidrlisis:
Hidrlisis cida.- se basa en la ebullicin
prolongada de la protena con soluciones
cidas fuertes (HCL, H
2
SO
4
). Este mtodo
destruye completamente el triptfano y parte
de la serina y treonina.
Hidrlisis bsica.- Respeta los aminocidos que
se destruyen por la hidrlisis anterior, pero
con gran facilidad forma racematos.
Normalmente se utiliza NaOH y BaOH
Hidrlisis enzimtica.- Se utilizan enzimas proteolticas cuya actividad es lenta y a menudo incompleta, sin
embargo no se produce racemizacin (cambio de estructura) no destruyendo los aminocidos por lo tanto es
muy especfica.
Una de las aplicaciones ms importantes de los hidrolizados de protenas es su utilizacin como fuente de
nitrgeno en la formulacin de dietas enteras con destino a la alimentacin infantil y/o de adultos enfermos.
As mismo, en el proceso de ablandamiento de la carne por medio de enzimas como la papana, bromelina,
ficina, etc.
H
E
T
E
R
O
P
R
O
T
E
I
N
A
S
Glucoproteinas
Lipoproteinas
Nucleoproteinas
Cromoproteinas
Ribonucleasa
Mucoproteinas
Anticuerpos
Hormona luteinizante
Alta densidad
Baja densidad
Muy baja densidad
Nucleosoma de la cromatina
Ribosomas
Hemoglobina
Hemocianina
Mioglobina
Citocromos
Transportan O2
Transportan Electrones
H
O
L
O
P
R
O
T
E
I
N
A
S
G
L
O
B
U
L
A
R
E
S
Prolaminas
Gluteninas
Albuminas
Hormonas
Enzimas
Zeina (maiz)
Gliandina (Trigo)
Horteina (cebada)
Glutenina (trigo)
Orizanina (arroz)
Seroalbumina (sangre)
Ovoalbumina (huevo)
Lactoalbumina (leche)
Insulina
Hormona del crecimiento
Prolactina
Tirotropina
Hidrolasas
Oxidasas
Lipasas
Liasas
Transferasas
F
I
B
R
O
S
A
S
Colgenos
Queratinas
Elastinas
Fibroinas
Tejidos conjuntivos
Cartilaginosos
Formaciones epidrmicas
Pelos
Uas
Plumas
Cuernos
Tendones
Vasos sanguneos
Hilos de seda (araas, insectos)
~ 69 ~
MATERIA PRIMA, EQUIPOS Y REACTIVOS:
Albumina de huevo
Harina preparada
Carne cruda
Leche fresca
Buffer acetato pH 4
Buffer fosfato pH 9
Solucin estndar de albumina (10 mg/ml)
Solucin de Ninhidrina
Reactivo de Biuret
Nitrato de plata
Nitrato de potasio
cido clorhdrico concentrado
cido actico glacial
Agua destilada
Pipetas de 1 cc
Pipetas de 2 cc
Pipetas de 5 cc
Propipeta
Pipetas Pasteur
Tubos de ensayo y gradilla
Pinzas para tubo de ensayo
Bao de agua a ebullicin
Beaker de 100 cc
Erlemeyer de 100 cc
Probeta de 100 cc
Baqueta
Papel filtro
Embudo de vidrio
Balanza
Espectrofotmetro
PROCEDIMIENTO EXPERIMENTAL:
Se emplearan las pruebas cualitativas de Ninhidrina y Biuret
Reaccin de Ninhidrina
Tomar 2 cc de la muestra a analizar en un tubo de ensayo
Agregar 5 gotas de solucin de Ninhidrina
Calentar en bao mara de agua hirviente durante 2 minutos
PRUEBA POSITIVA.- presenta una coloracin azul.
Reaccin de Biuret
Tomar 2 cc de la muestra a analizar en un tubo de ensayo
Agregar 2 cc del reactivo de Biuret
PRUEBA POSITIVA.- presenta una coloracin violeta.
~ 70 ~
Desnaturalizacin proteica por efecto del pH
Tomar 2 cc de albmina de huevo en un tubo de ensayo
Preparar la siguiente batera experimental
Tubo de ensayo Observacin Reaccin de Biuret
Albmina + 10 gotas de agua destilada
Albmina + 5 gotas de HCL
Albmina + 10 gotas de HCL
Albmina + 5 gotas de CH
3
COOH
Albmina + 10 gotas de CH
3
COOH
Observe lo que ocurre con la muestra problema
Posteriormente realice la prueba de Biuret
Desnaturalizacin proteica por efecto de metales pesados
Tomar 2 cc de albmina de huevo en un tubo de ensayo
Preparar la siguiente batera experimental
Tubo de ensayo Observacin Reaccin de Biuret
Albmina + 10 gotas de agua destilada
Albmina + 5 gotas de nitrato de plata
Albmina + 10 gotas de nitrato de plata
Albmina + 5 gotas de nitrato de potasio
Albmina + 10 gotas de nitrato de potasio
Observe lo que ocurre con la muestra problema
Posteriormente realice la prueba de Biuret
Desnaturalizacin proteica por efecto de la temperatura
Tomar 2 cc de albmina de huevo en un tubo de ensayo
Preparar la siguiente batera experimental
Tubo de ensayo Observacin Reaccin de Biuret
Albmina Calentada a 20 C
Albmina Calentada a 40 C
Albmina Calentada a 60 C
Albmina Calentada a 80 C
Albmina Calentada a 100 C
Observe lo que ocurre con la muestra problema
Posteriormente realice la prueba de Biuret
Efecto de la hidrolisis enzimtica de un alimento proteico (Mtodo de Biuret)
Preparacin de la muestra
o Tomar 10 gr o cc de la muestra problema en un erlemeyer
o Diluirlo con 90 cc de agua destilada, buffer acetato o buffer fosfato, segn corresponda
~ 71 ~
o Tomar 10 cc de la muestra diluida en un tubo de ensayo (Muestra 0)
o Adicionar en el restante de la muestra (la que est en el erlemeyer) 0,1 gr de papana
o Mantenerla la muestra con la enzima (papana) en constante agitacin durante un tiempo de 20
minutos a temperatura ambiente. (Muestra 1)
o Proceder a desarrollar la prueba de Reaccin de Biuret y evaluarla mediante la curva patrn
Preparacin de curva patrn de Biuret
o Preparar una batera de tubos de ensayo con la solucin estndar de albmina, con cantidades
entre 0 y 1 cc
o Completar el volumen de la solucin estndar hasta 1 cc con agua destilada
o Adicionar 4 cc del reactivo de Biuret
o Mezclar cuidadosamente y dejar reposando por 30 minutos
o Posteriormente leer la absorbancia en el espectrofotmetro a 540 nm
o Construir la curva patrn
Tubo de ensayo 1 2 3 4 5 6
Albmina estndar 0,0 0,2 0,4 0,6 0,8 1,0
Agua destilada 1,0 0,8 0,6 0,4 0,2 0,0
Reactivo de Biuret 4,0 4,0 4,0 4,0 4,0 4,0
ABSORVANCIA
Graficar la curva patrn
Determinacin de la hidrlisis proteica de las muestras por el mtodo de Biuret
o Colocar 1 cc de la muestra problema en el tubo de ensayo (Tubo 1 muestra 0; tubo 2 muestra 1)
o Adicionar 4 cc del reactivo de Biuret
o Mezclar cuidadosamente y dejar reposando por 30 minutos
o Posteriormente leer la absorbancia en el espectrofotmetro a 540 nm
o Con la ayuda de la curva patrn estime la cantidad de protena expresada en % de albmina
presente en la muestra
Preparacin de curva patrn de Ninhidrina
o Preparar una batera de tubos de ensayo con la solucin estndar de albmina, con cantidades
entre 0 y 0,5 cc
o Completar el volumen de la solucin estndar hasta 10 cc con agua destilada
~ 72 ~
o Adicionar 0,5 cc del reactivo de Ninhidrina
o Colocar los tubos en bao mara a ebullicin durante 10 minutos
o Enfriar los tubos en bao de agua y mantener en reposo durante 10 minutos
o Posteriormente leer la absorbancia en el espectrofotmetro a 540 nm
o Construir la curva patrn
Tubo de ensayo 1 2 3 4 5 6
Albmina estndar 0,0 0,1 0,2 0,3 0,4 0,5
Agua destilada 10,0 9,9 9,8 9,7 9,6 9,5
Reactivo de Ninhidrina 0,5 0,5 0,5 0,5 0,5 0,5
ABSORVANCIA
Graficar la curva patrn
Determinacin de la hidrlisis proteica de las muestras por el mtodo de Ninhidrina
o Colocar 2 cc de la muestra problema en el tubo de ensayo (Tubo 1 muestra 0; tubo 2 muestra 1)
o Agregar 8 cc de agua destilada
o Adicionar 0,5 cc del reactivo de Ninhidrina y mezclar cuidadosamente
o Colocar los tubos en bao mara a ebullicin durante 10 minutos
o Enfriar los tubos en bao de agua y mantener en reposo durante 10 minutos
o Posteriormente leer la absorbancia en el espectrofotmetro a 540 nm
o Con la ayuda de la curva patrn estime la cantidad de protena expresada en % de albmina
presente en la muestra
CUESTIONARIO:
1. Indique que desventajas tiene el mtodo de Biuret en el anlisis de alimentos.
2. Explique cmo afecta el pH en la estructura de las protenas?
3. Indique por qu los metales pesados afectan en la estructuras de las protenas?
4. Explique por qu la temperatura afecta a la estabilidad de las protenas?
5. Indique que cambios ocurren en las protenas cuando se vara el pH y la temperatura?
~ 73 ~
Prctica N 14
TEMA DETERMINACION DEL PUNTO ISOELECTRICO DE UNA PROTEINA
OBJETIVO(S)
Experimentar y teorizar la funcionalidad de las protenas
Extraccin de la casena
Determinacin del punto isoelctrico de la casena
MARCO TERICO:
La leche contiene vitaminas (principalmente tiamina,
riboflavina, cido pantoteico y vitaminas A, D y K),
minerales (calcio, potasio, sodio, fsforo y metales en
pequeas cantidades), protenas (incluyendo todos los
aminocidos esenciales), carbohidratos (lactosa) y
lpidos. Los nicos elementos importantes de los que
carece la leche son el hierro y la vitamina C.
Las protenas se pueden clasificar de manera general en protenas globulares y fibrosas. Las protenas
globulares son aquellas que tienden a agregarse en forma esferoidales y no establecen interacciones
intermoleculares como son los puentes de hidrogeno (caracterstico de las protenas fibrosas) siendo
solubilizadas en suspensiones coloidales. En la leche hay tres clases de protenas: casenas, lactoalbminas y
lactoglobulinas (todas globulares).
La casena es una protena conjugada de la leche del tipo fosfoprotena, que se separa de la leche por
acidificacin y forma una masa blanca. Las fosfoprotenas son un grupo de protenas, que estn qumicamente
unidas a una sustancia que contiene cido fosfrico. En la casena la mayora de los grupos fosfatos estn
unidos por lo grupos hidroxilos de los aminocidos serina y treonina. La casena en la leche se encuentra en
forma de sal clcica (caseinato clcico). La casena representa cerca del 77 al 82 % de las protenas presente en
la leche y el 2,7 % en composicin de la leche lquida.
La casena esta formada por (s1)-casena, (s2)-casena, -casena y -casena formando uma micela o
unidad soluble. Ni la -casena ni -casena son solubles en la leche, solas o combinadas. Si se aade la kappa-
casena a las dos anteriores o a cada una de ellas por separado se forma un complejo de casena que es
solubilizado en forma de micela. Esta micela est estabilizada por la k-casena mientras que la -casena y -
casena son fosfoprotena que precipita en presencia de iones calcio.
La k-casena, sin embargo tiene poco grupo fosfato y un alto
contenido de carbohidrato unido a ella. Tambin tiene todos sus
residuos de serina y treonina con sus correspondientes grupos
hidroxilos, as como los carbohidratos dispuestos en una sola cara
de su superficie por lo que esta parte exterior es fcilmente soluble
en agua gracia a los grupos polares que poseen. La otra parte de su
superficie se une fcilmente a la -casena y -casena insolubles lo
que da lugar a la formacin de la micela.
Proteina O P O + Ca
2+
Proteina O P O Ca
- 2+
Insoluble
O
O
-
O
O
-
Submicela
de casena
Regin no
formadora
de enlace
k
k
o
o
o
o
|
|
|
~ 74 ~
La propiedad caracterstica de la casena es su baja solubilidad a pH 4,6. El pH de la leche es 6,6
aproximadamente, estando a ese pH la casena cargada negativamente y solubilizada como sal clcica. Si se
aade cido a la leche la carga negativa de la micela se neutraliza (los grupos fosfato se protonan) y la protena
neutra precipita.
( )
2
2
2 CaCl Casena HCl Caseinato Ca + +
+
La conformacin de la casena es similar a las protenas desnaturalizadas globulares. El alto nmero de
residuos de protenas en la casena causa un especial plegamiento en la cadena de casena e inhibe la
formacin de una fuerte y ordenada estructura secundaria. La casena no contiene puentes de sulfuro. De igual
manera la falta de estructura secundaria es importante para la estabilidad de la casena frente a la
desnaturalizacin por calor. La carencia de estructura terciaria facilita la situacin al exterior de los residuos
hidrofbicos lo que facilita la unin entre unidades proteicas y la convierte prcticamente insoluble en agua.
En cambio es fcilmente dispersable en lcalis diluidos y en soluciones salinas tales como el oxalato sdico y el
acetato sdico.
La funcin biolgica de las micelas de casena es transportar grandes cantidades de calcio y fsforo altamente
insoluble en forma lquida a los lactantes y formar un coagulo en el estmago para favorecer una nutricin
eficiente. Adems de casena, calcio y fsforo, la micela formada tambin contiene citrato, iones, lipasa,
enzimas plasmticas y suero. Estas micelas ocupan del 6 al 12 % del volumen total de la leche.
Las protenas que aparecern en el sobrenadante cuando precipitemos la casena en medio cido son:
protenas globulares, hidroflicas y fcilmente solubles en agua as como susceptibles de desnaturalizacin por
calor. Las principales son -lactoglobulina, -lactoalbmina, Bovis serum albumin (BSA), e inmunoglobulina
(Ig).
La casena se emplea en industria para la fabricacin de pinturas especiales, la clarificacin de vinos,
elaboracin de preparados farmacuticos y la fabricacin de plsticos.
Todas las macromolculas de la naturaleza adquieren una carga cuando se dispersan en agua. Una
caracterstica de las protenas y otros biopolmeros es que la carga total que adquieren depende del pH del
medio.
As, todas las protenas tienen una carga neta dependiendo del pH en el que se encuentran y de los
aminocidos que la componen, as como de las cargas de cualquier enlace que se encuentre unido a la
protena de forma covalente (irreversible).
Debido a la composicin en aminocidos de la protena, los radicales libres pueden existir en tres formas
dependiendo del pH del medio: catinicos, neutros y aninicos.
Micela
de caseina
P
P
P
P
P
P
P
P
P
P
P
P
P
P
P
P
P
P
P
P
P
P
P
P
P
P
Ca
Ca
Ca
Ca
Cit
Cit
Ca
Ca
Ca
Ca
Ca Ca
Ca
Ca
P Fosfato
Ca Calcio
Cit Citrato
Submicela
de caseina
~ 75 ~
Cualquier protena tendra una carga neta positiva si se encuentra en un medio lo suficientemente cido
debido a que los grupos COOH de los aminocidos asprtico y glutmico estaran en su forma neutra pero los
grupos amino de arginina y lisina estaran protonados NH
3
+
.
De igual forma si la protena se encuentra en un medio con un pH muy alto, estara cargada negativamente, ya
que en este caso los grupos carboxilo estara desprotonados (COO
-
) y los grupos amino estaran en su forma
neutra (NH
2
).
De lo anterior se deduce que las protenas tienen un pH caracterstico al cual su carga neta es cero. A este pH
se le denomina punto isoelctrico (pI).
En el punto isoelctrico, se encuentran en el equilibrio las cargas positivas y negativas, por lo que la protena
presenta su mxima posibilidad para ser precipitada al disminuir su solubilidad y facilitar su agregacin.
Si suponemos una protena formada nicamente por aminocidos sin grupos laterales ionizables la carga neta
de la protena dependera exclusivamente de la protonacin/desprotonacin de los grupos amino y carboxilo
terminal. En la realidad las protenas estn formadas por multitud de aminocidos unidos mediante enlaces
peptdicos y la carga va a depender de los grupos ionizables que poseen los aminocidos que la componen y
del pH del medio.
La electroforesis es una tcnica de separacin que se basa en el transporte de iones a travs de una disolucin
por la accin de un campo elctrico. Se aplica una diferencia de potencial entre dos electrodos de carga
opuesta de forma que los cationes, con carga positiva, se mueven hacia el electrodo negativo o ctodo y los
aniones, con carga negativa, se mueven hacia el electrodo positivo o nodo. Sobre una molcula con carga
elctrica en un sistema electrofortico, actan fuerzas como la fuerza del campo elctrico aplicado o la fuerza
debida a la resistencia (Ley de Stokes)
Las protenas son sustancias anfteras o anfolitos, es decir, que sus carga elctrica puede ser positiva, negativa
o cero, dependiendo del pH del medio en el que estn. Hay un valor de pH en el cual la carga elctrica neta es
cero. Ese valor de pH se denomina punto isoelctrico. La resolucin de un sistema electrofortico va a
depender de diferentes factores como el gradiente de potencial, la temperatura, el pH, etc
La electroforesis se realiza sobre distintos medios, que pueden ser no selectivos (inertes, que no intervienen
de forma directa en la separacin, como el gel de agarosa o el acetato de celulosa) y selectivos (separan
mediante el tamao molecular, como el almidn o la poliacrilamida). El especimen, se suele preparar
previamente con sustancias como mercaptoetanol, glicerol, sacarosa, urea, detergentes o hialuronidasa (usada
mucho en el estudio de protenas en liquido sinovial).
Tras separar los componentes por electroforesis, se puede hacer determinacin cualitativa (fijando protenas
con determinadas sustancias y luego identificando con colorantes o mtodos inmunolgicos) o determinacin
cuantitativa (por elucin, espectrofotometra de absorcin molecular, etc).
Existe una variante de la electroforesis, llamada inmunoelectroforesis, en la que tras separar por electroforesis
las protenas, se enfrentan con un suero y se observa la reaccin antgenoanticuerpo, que se pone de
manifiesto por un anillo de precipitacin.
Otras tcnicas que se pueden usar son: isoelectroenfoque (se separan las protenas segn su punto
isoelctrico en un medio con gradiente de pH); isotacoforesis (se separan los componentes segn sus
diferentes movilidades electroforticas en un sistema discontinuo, con distintas fases de diferente
composicin entre ellas); ultracentrifugacin (donde el resultado es proporcional a la diferencia de densidad y
tamao molecular); la precipitacin salina o la cromatografa.
MATERIA PRIMA, EQUIPOS Y REACTIVOS:
Albumina de huevo
Leche fresca descremada
Buffer acetato pH 4
Buffer fosfato pH 9
~ 76 ~
Solucin estndar de casena (10 mg/ml)
cido actico 1 M
Hidrxido de sodio 1 N
Acetato sdico 0,1 N
cido actico 0,01 N
cido actico 0,1 N
ter etlico
Etanol al 70 %
Agua destilada
Pipetas de 1 cc
Pipetas de 2 cc
Pipetas de 5 cc
Pipetas de 10 cc
Propipeta
Pipetas Pasteur
Tubos de ensayo
Gradilla
Pinzas para tubo de ensayo
Bao de agua a ebullicin
Cocina elctrica
Malla de asbesto
Beaker de 25 cc
Beaker de 50 cc
Beaker de 250 cc
Erlemeyer de 100 cc
Probeta de 100 cc
Fiola de 50 cc
Baqueta
Papel filtro
Embudo de vidrio
Balanza
Termmetro
Potencimetro
Espectrofotmetro
PROCEDIMIENTO EXPERIMENTAL:
Aislamiento de la casena
Caliente en un vaso de precipitado 150 cc de agua destilada a 38 C, aada 50 cc de leche y Luego gota
a gota y con agitacin, adicione cido actico 1 M, hasta que observe que se forma un precipitado (la
leche se corta)
Deje sedimentar y filtre sobre un papel de filtro usando un embudo de vidrio
Lave el precipitado con 20 cc de etanol en el mismo papel filtro
~ 77 ~
Secar el precipitado colocando varios pliegues de papel filtro
Coloque el precipitado en un beaker pequeo previamente tarado, vuelva a pesar el vaso con el
precipitado y Luego adicione 5 cc de ter etlico por gramo de casena, posteriormente filtrar
nuevamente
Deseche el lquido quedando un precipitado blanco de fcil manipulacin que es la casena.
Preparacin de la solucin de casena
Coloque aproximadamente 200 mg de casena en un vaso de precipitado de 50 cc y agregue 20 cc de
agua destilada y 5 cc de hidrxido de sodio 1 N; agite hasta lograr una solucin total de la casena.
Una vez disuelta la casena se vierte en un matraz aforado de 50 cc, adicione 5 cc de cido actico 1 N
y diluya con agua destilada hasta 50 cc y mezcle bien.
La solucin debe ser clara y limpia y si no es as, debe volver a filtrar.
Determinacin del punto isoelctrico de la casena
Prepare una batera de 10 tubos de ensayo grande de 25 cc cada uno (limpios y secos) y adicione
exactamente los volmenes de los reactivos exactamente segn la tabla anexa.
Medir experimentalmente el pH de todos los vasos que debe cubrir un rango aproximado semejante al
terico (de 3 a 6,5). Anotar los valores reales en la tabla, que deben ser semejantes a los expresados y
en todo caso creciente.
Aadir 1 cc de disolucin de casena a cada tubo
Agitar suavemente cada uno y esperar aproximadamente 3 minutos
Medir la absorbancia de cada muestra a 640 nm con la cubeta de colorimetra de 1 cm de paso ptico,
teniendo la precaucin de agitar bien el contenido de cada tubo para obtener una solucin/suspensin
homognea antes de verter una parte en la cubeta.
Anotar resultados y representar la absorbancia frente al pH y determinar el punto isoelctrico
aproximado de la casena
Tubo
N
Acetato sdico
al 0,1 N
cido Actico
al 0,1 N
cido Actico
al 0,01 N
pH resultante
Absorbancia
a 640 nm
Terico Experimental
01 0,5 9,5 --- 3,2
02 1,0 9,0 --- 3,6
03 1,5 8,5 --- 3,8
04 2,0 8,0 --- 4,0
05 3,0 7,0 --- 4,2
06 4,0 6,0 --- 4,5
07 6,0 4,0 --- 4,7
08 8,0 2,0 --- 5,1
09 6,0 --- 4,0 5,5
10 8,0 --- 2,0 6,1
~ 78 ~
Graficar la curva de Absorbancia vs pH experimental
Genere un modelo matemtico que permita determinar el punto isoelctrico de la casena con mayor
precisin.
CUESTIONARIO:
1. Porque las protenas tienen solubilidad mnima en el punto isoelctrico?
2. En forma clara y detallada explique porqu se usa una longitud de onda de 580 nm para leer estas
soluciones
3. La cuantificacin de protenas puede llevarse a cabo por la absorbancia de luz UV?, Porqu?.
~ 79 ~
Prctica N 15
TEMA IDENTIFICACIN Y SOLUBILIDAD DE LIPIDOS
OBJETIVO(S)
Identificar colorimtricamente la presencia de lpidos en los alimentos
Evaluar el comportamiento de la solubilidad de lpidos en diversas soluciones orgnicas
e inorgnicas
MARCO TERICO:
Los lpidos son biomolculas orgnicas formadas bsicamente
por carbono e hidrgeno y, generalmente, tambin oxigeno;
pero en porcentajes mucho ms bajos. Adems pueden
contener tambin fsforo, nitrgeno y azufre. Son un grupo de
sustancias muy heterogneas que solo tienen en comn estas
dos caractersticas: Son insolubles en agua y son solubles en
disolventes orgnicos como el ter, cloroformo, benceno, etc.
Una caracterstica bsica de los lpidos y de la que derivan sus principales
propiedades biolgicas es la hidrofobicidad. La baja solubilidad de los lpidos se
debe a que su estructura qumica es fundamentalmente hidrocarbonada
(aliftica, alicclica o aromtica), con gran cantidad de enlaces C-H y C-C. La
naturaleza de estos enlaces es 100 % covalente y su momento bipolar es mnimo.
El agua al ser una molcula muy polar, con gran facilidad para formar puentes de
hidrgeno, no es capaz de interaccionar con estas molculas. En presencia de molculas lipdicas, el agua
adopta en torno a ellas una estructura muy ordenada que maximiza las interacciones entre las propias
molculas de agua, forzando a la molcula hidrofbica al interior de una estructura en forma de jaula, que
tambin reduce la del lpido. Todo ello supone una configuracin de baja entropa, que resulta enrgicamente
desfavorable. Esta disminucin de entropa es mnima si las molculas lipdicas se agregan entre s, e
interaccionan mediante fuerzas de corto alcance, como las fuerzas de Van Der Waals. A este fenmeno se le
conoce como efecto hidrofbico.
Los lpidos desempean cuatro tipos de funciones:
Funcin de reserva.- son la principal reserva energtica del organismo. Un gramo de grasa produce 9
kilocaloras en las reacciones metablicas de oxidacin, mientras que las protenas y los glcidos solo producen
4 kilocaloras por gramo.
Funcin estructural.- forman las bicapas lipdicas de las membranas. Recubren rganos y le dan consistencia,
protegen mecnicamente como el tejido adiposo de pies y manos.
Funcin biocatalizadora.- en este papel los lpidos favorecen o facilitan las reacciones qumicas que se
producen en los seres vivos. Cumplen esta funcin las vitaminas lipdicas, las hormonas esteroideas y las
prostaglandinas.
Funcin transportadora.- el transporte de lpidos desde el intestino hasta su lugar de destino se realiza
mediante su emulsin gracias a los cidos biliares y a los proteolpidos.
Los lpidos se clasifican en dos grupos, atendiendo a que posean en su composicin cidos grasos (lpidos
saponificables) o no la posean (lpidos insaponificables). Los lpidos saponificables a su vez puedes ser: simples,
acilglicridos, cridos, complejos, fosfolpidos, glucolpidos. Entre los insaponificables estn: terpenos,
esteroides, prostaglandinas.
Los componentes bsicos de los lpidos son los cidos grasos, estos son molculas de una larga cadena
hidrocarbonada de tipo lineal y con un nmero par de tomos de carbono. Tienen en un extremo de la cadena
un grupo carboxilo (-COOH). Se conocen unos 70 cidos grasos que se pueden clasificar en dos grupos: Los
~ 80 ~
cidos grasos saturados, que solo tienen enlaces simples entre los tomos de carbono, como por ejemplo el
miristico (14C), el palmitito (16C) y el esterico (18C). Los cidos grasos insaturados tienen uno o varios
enlaces dobles en sus cadenas y sus molculas presentan codos, con cambios de direccin en los lugares
donde aparece un doble enlace (DE), por ejemplo: el oleico (18C y 1DE) y el linoleco (18C y 2DE).
Dentro de las propiedades de los cidos grasos se encuentra la solubilidad, donde estos poseen una zona
hidrfila, el grupo carboxilo (-COOH) y una zona lipfila, la cadena hidrocarbonada que presenta grupos
metileno (-CH
2
-) y grupos metilo (-CH
3
-) terminales. Por eso las molculas de los cidos grasos son antipticas,
pues por una parte, la cadena aliftica es apolar y por tanto, en disolventes orgnicos (lipfila) y por otra, el
grupo carboxilo es polar y soluble en agua (hidrfilo).
Desde el punto de vista qumico, los cidos grasos son capaces de formar enlaces ster con los grupos alcohol
de otras molculas. Cuando estos enlaces se hidrolizan con un lcali, se rompen y se obtiene las sales de los
cidos grasos correspondientes, denominados jabones, mediante un proceso denominado saponificacin.
Los lpidos son un grupo de sustancias muy heterogneas que solo tienen en comn estas dos caractersticas:
Son insolubles en agua y son solubles en disolventes orgnicos como el ter, cloroformo, benceno, etc.
Una caracterstica bsica de los lpidos y de la que derivan sus principales propiedades biolgicas es la
hidrofobicidad. Dentro de las propiedades de los cidos grasos se encuentra la solubilidad, donde estos poseen
una zona hidrfila, el grupo carboxilo (-COOH) y una zona lipfila, la cadena hidrocarbonada que presenta
grupos metileno (-CH
2
-) y grupos metilo (-CH
3
-) terminales. Por eso las molculas de los cidos grasos son
antipticas, pues por una parte, la cadena aliftica es apolar y por tanto, en disolventes orgnicos (lipfila) y
por otra, el grupo carboxilo es polar y soluble en agua (hidrfilo).
La baja solubilidad de los lpidos se debe a que su estructura qumica es fundamentalmente hidrocarbonada
(aliftica, alicclica o aromtica), con gran cantidad de enlaces C-H y C-C. La naturaleza de estos enlaces es 100
% covalente y su momento bipolar es mnimo. El agua al ser una molcula muy polar, con gran facilidad para
formar puentes de hidrgeno, no es capaz de interaccionar con estas molculas. En presencia de molculas
lipdicas, el agua adopta en torno a ellas una estructura muy ordenada que maximiza las interacciones entre
las propias molculas de agua, forzando a la molcula hidrofbica al interior de una estructura en forma de
jaula, que tambin reduce la del lpido. Todo ello supone una configuracin de baja entropa, que resulta
enrgicamente desfavorable. Esta disminucin de entropa es mnima si las molculas lipdicas se agregan
entre s, e interaccionan mediante fuerzas de corto alcance, como las fuerzas de Van Der Waals. A este
fenmeno se le conoce como efecto hidrofbico.
MATERIA PRIMA, EQUIPOS Y REACTIVOS:
Muestra de aceites comestibles comerciales
Manteca
Margarina
Mantequilla
Palta
Solucin de NaOH al 20 %
Solucin de almidn al 1 %
Solucin de casena al 1 %
Solucin de yodo al 1 %
Solucin Sudan I I I
Cloroformo
Etanol
ter
Benceno
Agua destilada
~ 81 ~
Pipetas de 1, 2, 5, 10 cc
Pipeta Pasteur
Tubos de ensayo
Pro pipeta
Gradilla para tubos de ensayo
Pinzas para tubo de ensayo
Bao de agua hirviendo
Beaker 100 cc
Baqueta de vidrio
Cronometro
Esptula,
Cuchillos
PROCEDIMIENTO EXPERIMENTAL:
Identificacin de lpidos
Preparar la siguiente batera de tubos de ensayo y/o placa petri:
Procedimiento M-1 M-2 M-2 M-4 M-5 M-6 M-7 M-8
Muestra (ml o mg) Aproximado 2 2 2 2 2 2 2 2
Sudan III (gotas) 8 8 8 8 8 8 8 8
Reaccin Positiva (+) o negativa (-)
01= casena; 02= almidn; 03-04= aceites; 05= manteca; 06= margarina; 07 = mantequilla; 08= palta
Agitar y observar el color
Evaluacin del nivel de instauracin
Preparar la siguiente batera de tubos de ensayo y/o placa petri:
Procedimiento M-1 M-2 M-2 M-4 M-5 M-6 M-7 M-8
Muestra (ml o mg) Aproximado 1 1 1 1 1 1 1 1
Cloroformo (ml) 2 2 2 2 2 2 2 2
Yodo al 1 % (ml) 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2
Reaccin Positiva (+) o negativa (-)
01= casena; 02= almidn; 03-04= aceites; 05= manteca; 06= margarina; 07 = mantequilla; 08= palta
Las muestras pastosas debern ser derretidas en bao mara antes de su evaluacin
Agitar y observar el tiempo de decoloracin
Reconocer la saponificacin de los lpidos
Preparar la siguiente batera de tubos de ensayo y/o placa petri:
Procedimiento
Aceite 1 Aceite 2 Aceite 3
01 02 03 04 05 06 07 08 09
Muestra de aceite 1 (ml) 2 2 2 2 2 2 2 2 2
Hidrxido de sodio al 20 % (ml) 0 1 2 0 1 2 0 1 2
Agitar y colocar en bao mara a ebullicin durante 30 minutos
~ 82 ~
Enfriar y evaluar los cambios que ocurren
Aceite 1 Aceite 2 Aceite 3
Evaluar la solubilidad de los lpidos
Preparar la siguiente batera de tubos de ensayo y/o placa petri: (1 gr o ml de la muestra y 3 ml del
solvente)
Agua
destilada
Etanol
fro
Etanol
caliente
Benceno ter Benceno
/ ter
Cloro_
formo
Aceite 1
Aceite 2
Aceite 3
Aceite 4
Manteca
Margarina
Mantequilla
Agitar y evaluar la solubilidad
Reporte con que solvente se presenta una mejor solubilidad
Producto Solubilidad
Aceite 1
Aceite 2
Aceite 3
Aceite 4
Manteca
Margarina
Mantequilla
CUESTIONARIO:
1. Qu enzima logra en el aparato digestivo la hidrlisis de las grasas?
2. Explique cmo influye la relacin aceite hidrxido de sodio en la saponificacin?
3. Qu importancia tienen los solventes de lpidos en la industria alimentaria?
~ 83 ~
Prctica N 16
TEMA IDENTIFICACION DE COLESTEROL EN ALIMENTOS
OBJETIVO(S) Determinacin cualitativa de la presencia o ausencia de colesterol en alimentos
MARCO TERICO:
El colesterol es un lpido que se encuentra en los tejidos corporales y en el
plasma sanguneo de los vertebrados. Se presenta en altas concentraciones
en el hgado, mdula espinal, pncreas y cerebro. El nombre de
COLESTEROL procede del griego Kole (bilis) y stereos (solid), por
haberse identificado por primera vez en los clculos de la vescula biliar por
Michael Eugene Chevreul quien le dio el nombre de COLESTERINA
El colesterol es un lpido esteroide (molcula de
ciclopentanoperhidrofenantreno ester), constituida por cuatro
carbociclos condensados o fundidos, denominados A, B, C y D, que
presentan varias sustituciones:
- Dos radicales metilo en las posiciones C-10 y C-13
- Una cadena no metlica en la posicin C-17
- Un grupo hidroxilo en la posicin C-3
- Una insaturacin entre los carbonos C-5 y C-6
En la molcula de colesterol se puede distinguir una cabeza polar constituida por el grupo hidroxilo y una cola
o porcin apolar formada por el carbociclo de ncleos condensados y los sustituyentes alifticos. As el
colesterol es una molcula tan hidrfoba que la solubilidad del colesterol libre en agua es de 10
-8
M y, al igual
que otros lpidos, es bastante soluble en disolverse apolares como el cloroformo y tetracloruro de carbono
(CCl
4
)
El colesterol es imprescindible para la vida animal por sus numerosas funciones:
1. Estructural: el colesterol es un componente muy importante
de las membranas plasmticas de los animales (en general,
no existe en los vegetales). Aunque el colesterol se
encuentra en pequea cantidad en las membranas
celulares, en la membrana citoplasmtica lo hallamos en
una proporcin molar 1:1 con relacin a los fosfolpidos,
regulando sus propiedades fsico-qumicas, en particular la
fluidez. Sin embargo, el colesterol se encuentra en muy baja
proporcin o est prcticamente ausente en las membranas
subcelulares.
2. Precursor de la vitamina D: esencial en el metabolismo del calcio.
3. Precursor de las hormonas sexuales: progesterona, estrgenos y testosterona
4. Precursor de las hormonas corticoesteroidales: cortisol y aldosterona.
5. Precursor de las sales biliares: esenciales en la absorcin de algunos nutrientes lipdicos y va principal para
la excrecin de colesterol corporal.
6. Precursor de las balsas de lpidos.
El ser humano obtiene colesterol a travs de dos vas: Va exgena, directamente a travs de los alimentos. Los
alimentos que contienen colesterol son exclusivamente los de origen animal, sobre todo la yema de huevo,
~ 84 ~
hgado, lcteos, sesos y carnes rojas; va endgena, es la sntesis que se produce en las clulas de los
organismos animales, las dos terceras partes. El organismo lo, sintetiza a partir de Acetil-CoA (sntesis de los
nucletidos purnicos, es muy importante porque forman los cidos nucleicos), formando el colesterol
endgeno.
Sntesis metablica de colesterol.-
La mayor parte del colesterol que tenemos en el
cuerpo no procede de la dieta sino de su sntesis
endgena. El metabolismo humano, como el de
todos los animales sintetiza colesterol. Una
persona normal (no obesa ni diabtica) sintetiza
diariamente entre 9 y 13 mg por kg de masa
corporal. As una persona de 70 kg sintetiza
entre 630 y 900 mg de colesterol diariamente.
Esta sntesis se hace en varios rganos y tejidos,
pero el principal es el hgado que da cuenta del
50-75%% de la produccin. Le sigue la corteza
adrenal y las glndulas sexuales (10-22%), el
intestino (7-18%), las clulas plasmticas (5%), y
los pulmones (3%); otros rganos y tejidos como
la piel, riones, cerebro, msculo y adiposo,
tienen una participacin mnima (entre 0,2 y
1%).
La ruta de sntesis de colesterol es una de las ms largas y complejas del metabolismo. El proceso, igual en
todos los tejidos y en todos los animales, tiene veinte pasos, con la participacin de muchas enzimas y
protenas diferentes, y multitud de procesos reguladores y transporte de productos por el citoplasma, por las
membranas internas de la clula y por los compartimentos intracelulares (retculo endoplsmico y aparto de
Golgi).
Control de la sntesis por el colesterol de la dieta.-
Sin embargo, el mecanismo de control negativo endgeno, descrito arriba, para frenar la actividad de la HMGR
y en consecuencia, la sntesis de colesterol, basado en la cantidad de colesterol que se ha producido, no es del
todo eficaz pues no puede detener por completo el proceso, y necesita un mecanismo adicional. Este segundo
mecanismo viene gobernado por el colesterol de la dieta y es mucho ms eficaz que el primero, pues l solo
llega a controlar el 100% del proceso. En efecto, si se suprime el colesterol de la dieta la sntesis de colesterol
contina descontrolada y se sigue produciendo colesterol hasta niveles altos, mientras que si la dieta tiene
suficiente colesterol (0,5% de su composicin total) su sntesis de detiene totalmente. Varios experimentos
han demostrado que en el hgado de ratas alimentadas durante 8 das con una dieta enteramente carente de
colesterol se produjo una sntesis de colesterol mucho ms alta que el de las ratas control alimentadas con una
dieta baja en colesterol, mientras que con un contenido en la dieta de 0,5% de colesterol durante ocho das, la
sntesis se detuvo por completo.
Los datos obtenidos de primates pueden ser ms representativos para aplicarlos a la especie humana. Los
experimentos con el mono ardilla (Samiri oerstedii) de Amrica central mostraron que un contenido de
colesterol en la dieta moderado o relativamente alto (0,5-1%) produjo un descenso de sntesis de colesterol
del 78,7%, frente al control con un contenido bajo de colesterol (0,04 mg/g) en la dieta. Esta reduccin ocurri
principalmente en la sntesis heptica (96%); en otros tejidos hubo una reduccin de 25-30%. Sin embargo, en
el ovario, cuya contribucin al total es muy pequea (<2%) subi un 245% (llegando al 2,1% de la produccin
total). A pesar de que este cambio es poco significativo para la totalidad del colesterol sintetizado, es
interesante, pues muestra que el ovario tiene su propio mecanismo regulador, con independencia del total: al
disponer de menos colesterol para sintetizar las hormonas sexuales, aumenta su produccin propia para
atender a su demanda particular.
~ 85 ~
Es importante indicar aqu que los cidos grasos insaturados y poliinsaturados de la dieta tambin intervienen
en el control de la sntesis de colesterol produciendo un efecto sinrgico con el colesterol de la dieta.
El mecanismo del papel regulador del colesterol de la dieta se conoce bien: en realidad, el colesterol que
interacciona con la HMGR, y la inhibe, no es propiamente el colesterol que se ha sintetizado en esta ruta sino
el que est unido a las lipoprotenas o la protena reguladora SREBP que llegan a interaccionar con ella. Estas
lipoprotenas son: las LDL que contienen el colesterol que se ha sintetizado in situ; las HDL que contienen el
colesterol procedente de los tejidos, y el que van recogiendo de sus depsitos en las arterias, y los remanentes
de quilomicrones (CMR) que contienen el colesterol de la dieta. La diferencia entre ellas es que el hgado
absorbe los CMR con mayor preferencia que las HDL y LDL, y tambin el colesterol que transportan los CMR se
disocia mejor que el de las otras partculas para interaccionar con la HMGR e inhibirla. Por tanto, el inhibidor
ms potente de la sntesis de colesterol es el que se transporta por los CMR, todo el cual procede de la dieta.
La conclusin general de estos mecanismos es que el colesterol de la dieta es el principal regulador de la
sntesis endgena de colesterol, y la forma ms eficaz (tomado con moderacin) de evitar su exceso. Este
efecto se ha demostrado directamente en el laboratorio con remanentes de quilomicrones (CMR) preparados
al efecto.
Fuentes importantes de colesterol.-
Los productos de origen animal son la principal fuente de colesterol por ingesta de alimentos, es por esta
razn que su consumo debe estar regulado, controlado o evitado. Los valores ideales de colesterol en la
sangre son los siguientes:
- Colesterol total: menor de 200 mg/dl
- Lipoprotenas de alta densidad: Mayor de 35 mg/dl
- Lipoprotenas de baja densidad: Menor de 100 mg/dl
Por lo menos debemos cuidar muy bien la dieta diaria y evitar el consumo excesivo de ciertos alimentos, entre
ellos:
Tienen muy alto contenido.- Los sesos, yema de huevo, hgado de res, riones, chicharrn, chorizo, sardinas,
salami, queso de chancho, crema de leche, queso crema, mayonesa, entre otros.
Tienen alto contenido.- Chuletas, pavo, jamn, carne oscura sin piel, bistec, calamares, ternera, tocino, queso
roquefort, queso gruyere, arenque, pollo con piel, langosta, pulpo, camarn, queso de cabra, etc.
Tienen contenido moderado.- Leche descremada, helado de crema, bacalao, atn, carne blanca de pollo sin
piel, salmn, pierna de cordero, trucha, pescado blanco, entre otros.
No tiene colesterol.- Todos los alimentos de origen vegetal y sus derivados.
MATERIA PRIMA, EQUIPOS Y REACTIVOS:
Yema de huevo
Crema de leche
Hgado de res
Palta
Mantequilla
Mayonesa
Agua destilada
cido sulfrico concentrado (H
2
SO
4
)
Anhdrido actico (C
4
H
6
O
3
)
Cloroformo (CHCl
3
)
Colesterol patron
~ 86 ~
Pipetas de 1 cc
Pipetas de 2 cc
Pipetas de 5 cc
Pipetas de 10 cc
Pipeta Pasteur
Tubos de ensayo
Propipeta
Gradilla para tubos de ensayo
Centrifuga
Tubos para centrfuga
Pinzas para tubo de ensayo
Beaker de 50 cc
Beaker de 100 cc
Baqueta de vidrio
Placas petri
Esptula
Cuchillo y tabla para picar
Balanza analtica
PROCEDIMIENTO EXPERIMENTAL:
Preparacin de la muestra
Pesar 1,5 gr de muestra y colocarlos en un Beaker de 50 cc.
Aadir 10 cc de cloroformo mediante agitacin hasta lograr la completa disolucin
Verter 7 cc de la solucin en un tubo de centrfuga (por duplicado) y centrifugar a 3000 RPM durante 10
minutos.
Separar 1 cc del sobrenadante en un tubo de ensayo y aadir 10 cc de cloroformo (invertir varias veces
para lograr un buen mezclado).
Determinacin cualitativa de colesterol (Test de Liebermann Burchard)
Este mtodo se realiza adicionando 15 gotas de cido actico a 1 ml de la solucin del esteroide en
cloroformo. (muestra preparada anteriormente)
Con precaucin aadir 1 ml de cido sulfrico concentrado sin mezclar. La aparicin de verde azuloso es
la prueba positiva.
Cuando existe presencia de ergosterol se forma rpidamente un color rojo
Esta reaccin tiene que ser realizada en ausencia de agua
CUESTIONARIO:
1. Cmo sustituira o modificara el colesterol en los alimentos procesados que tienen un alto contenido del
mismo?
2. Explique las diferencias entre los tipos de colesterol?. Cul es su influencia en el ser humano?
3. Qu alimentos recomendara a una persona que tiene 250 mg/dl de colesterol total en la sangre?
S-ar putea să vă placă și
- Los Colonos de CatánDocument9 paginiLos Colonos de CatánRoger BernalÎncă nu există evaluări
- Proyecto de Marketing, Papilla de CamoteDocument13 paginiProyecto de Marketing, Papilla de CamoteRoger Bernal0% (1)
- Practica Trabajo de Quimica de AlimentosDocument10 paginiPractica Trabajo de Quimica de AlimentosRoger BernalÎncă nu există evaluări
- Trabajo de Investigacion Pure de FresaDocument8 paginiTrabajo de Investigacion Pure de FresaRoger BernalÎncă nu există evaluări
- Reologia 2 Fase MermeladaDocument6 paginiReologia 2 Fase MermeladaRoger BernalÎncă nu există evaluări
- 5 Quimica Del VinoDocument61 pagini5 Quimica Del VinoLucia Agudo100% (1)
- CangrejoDocument9 paginiCangrejoRoger BernalÎncă nu există evaluări
- Actividad de La Tirosinasa en El Pardeamiento EnzimaticoDocument2 paginiActividad de La Tirosinasa en El Pardeamiento EnzimaticoRoger BernalÎncă nu există evaluări
- Practica #1 ChorizoDocument6 paginiPractica #1 ChorizoRoger BernalÎncă nu există evaluări
- Investigacion SecadoDocument12 paginiInvestigacion SecadoRoger BernalÎncă nu există evaluări
- Leccion11 CEMENTOS Modulos Formulascal aptitudCOCCIONDocument23 paginiLeccion11 CEMENTOS Modulos Formulascal aptitudCOCCIONJorge AldoradinÎncă nu există evaluări
- Fallas en Plantas Electricas de Emergencia PDFDocument11 paginiFallas en Plantas Electricas de Emergencia PDFAndres FelipeÎncă nu există evaluări
- Marco TeóricoDocument5 paginiMarco TeóricoJuan RojasÎncă nu există evaluări
- Violeta CristalDocument3 paginiVioleta CristalthaliaÎncă nu există evaluări
- Modulo 3 Adherencia 1Document41 paginiModulo 3 Adherencia 1Roberto RevinsacÎncă nu există evaluări
- Determinacion Del Indice de Trabajo de BondDocument10 paginiDeterminacion Del Indice de Trabajo de BondJ. M.Încă nu există evaluări
- Exposicion Nitroglicerina TerminadoooDocument19 paginiExposicion Nitroglicerina TerminadoooSiul Vargas AcaroÎncă nu există evaluări
- Desmontar y Montar El Filtro de Partículas DieselDocument5 paginiDesmontar y Montar El Filtro de Partículas DieselNicholas FinleyÎncă nu există evaluări
- Unidad 2 TamizadoDocument38 paginiUnidad 2 TamizadoJharol Quilo OrtegaÎncă nu există evaluări
- Manual de Formacion de Mecanicos Pemex-Sicam-2013 Ok Up Barran Neumatica AvanzadaDocument90 paginiManual de Formacion de Mecanicos Pemex-Sicam-2013 Ok Up Barran Neumatica AvanzadaLuis Guillermo Herrera Jr.Încă nu există evaluări
- Actividad de Aprendizaje 16 Matriz EMPRESA ALIMENTOS MEATDocument14 paginiActividad de Aprendizaje 16 Matriz EMPRESA ALIMENTOS MEATEduglowilchesÎncă nu există evaluări
- Ácidos DicarboxílicosDocument6 paginiÁcidos DicarboxílicosSanty_2hÎncă nu există evaluări
- El Papel de Los Microorganismos en La Biodegradación de Compuestos TóxicosDocument6 paginiEl Papel de Los Microorganismos en La Biodegradación de Compuestos TóxicosAlfredo CruzÎncă nu există evaluări
- Laboratorio de Materiales de ConstrucciónDocument229 paginiLaboratorio de Materiales de ConstrucciónAndy García100% (1)
- Concentración de EsfuerzosDocument6 paginiConcentración de EsfuerzosEnerio RodríguezÎncă nu există evaluări
- Tarea 1 Maria Moreno Grupo - 83Document37 paginiTarea 1 Maria Moreno Grupo - 83stilindaÎncă nu există evaluări
- Actualización de Los Diagramas MecánicosDocument10 paginiActualización de Los Diagramas MecánicosKatherine AraujoÎncă nu există evaluări
- Metales AlcalinosDocument2 paginiMetales AlcalinosValeria Del SavioÎncă nu există evaluări
- Mer. Pel. GeneralDocument158 paginiMer. Pel. GeneralHector CarbajalÎncă nu există evaluări
- Hoja de Seguridad Clomazone - Sinozone!!Document5 paginiHoja de Seguridad Clomazone - Sinozone!!FabiolaButronÎncă nu există evaluări
- Puntos A TratarDocument22 paginiPuntos A TrataredinsonÎncă nu există evaluări
- Tipos de Empuje en YacimientosDocument3 paginiTipos de Empuje en YacimientosGermanLuisCabreraÎncă nu există evaluări
- Practica 1 - Conductores eléctricos-CORREGIDADocument15 paginiPractica 1 - Conductores eléctricos-CORREGIDAItzabely SalgadoÎncă nu există evaluări
- VOLTEADORADocument12 paginiVOLTEADORAJOSE MACIASÎncă nu există evaluări
- U2 Modelo RpecvDocument8 paginiU2 Modelo RpecvFarrah CBÎncă nu există evaluări
- Tablas de Diseño de Mezcla (Tecnología Del Concreto)Document7 paginiTablas de Diseño de Mezcla (Tecnología Del Concreto)Renzo Jose AlburquequeÎncă nu există evaluări
- 12 PDFDocument4 pagini12 PDFDavid Pico TayoÎncă nu există evaluări
- El Modelo Atómico de SommerDocument3 paginiEl Modelo Atómico de SommerYesi CasasÎncă nu există evaluări
- Catalogo BerrendoDocument13 paginiCatalogo BerrendoJAVIER JUAREZÎncă nu există evaluări
- Primer Parcial de BioquimicaDocument2 paginiPrimer Parcial de BioquimicaCristian DiazÎncă nu există evaluări