Documente Academic
Documente Profesional
Documente Cultură
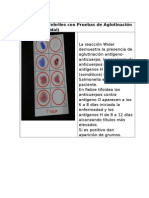
FUNDAMENTO DEL MÉTODO Pruebas Febriles
Încărcat de
mark50%(2)50% au considerat acest document util (2 voturi)
11K vizualizări4 paginiEste documento describe los procedimientos para realizar pruebas de aglutinación para identificar anticuerpos específicos contra bacterias causantes de enfermedades febriles como brucelosis y salmonelosis. Incluye información sobre los antígenos, controles, procedimientos, lectura e interpretación de resultados así como notas importantes.
Descriere originală:
Titlu original
FUNDAMENTO DEL MÉTODO pruebas febriles
Drepturi de autor
© Attribution Non-Commercial (BY-NC)
Formate disponibile
DOCX, PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentEste documento describe los procedimientos para realizar pruebas de aglutinación para identificar anticuerpos específicos contra bacterias causantes de enfermedades febriles como brucelosis y salmonelosis. Incluye información sobre los antígenos, controles, procedimientos, lectura e interpretación de resultados así como notas importantes.
Drepturi de autor:
Attribution Non-Commercial (BY-NC)
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
50%(2)50% au considerat acest document util (2 voturi)
11K vizualizări4 paginiFUNDAMENTO DEL MÉTODO Pruebas Febriles
Încărcat de
markEste documento describe los procedimientos para realizar pruebas de aglutinación para identificar anticuerpos específicos contra bacterias causantes de enfermedades febriles como brucelosis y salmonelosis. Incluye información sobre los antígenos, controles, procedimientos, lectura e interpretación de resultados así como notas importantes.
Drepturi de autor:
Attribution Non-Commercial (BY-NC)
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 4
FUNDAMENTO DEL MÉTODO
Los antígenos febriles son suspensiones normalizadas de bacterias teñidas
que se utilizan para
Identificar y cuantificar anticuerpos específicos que se desarrollan durante
algunas infecciones
Febriles tales como la brucelosis, salmonelosis y ciertas rickettsiosis. El
antígeno en suspensión
Aglutina en presencia del correspondiente anticuerpo homólogo en las
muestras ensayadas1-3.
CONTENIDO
Código Componente Individual Kit 33001 Kit 33080
33309 Brucella abortus 1 x 5 mL - -
33315 Brucella abortus/Rosa Bengala 1 x 5 mL 1 x 5 mL -
33307 Salmonella typhi H (H: d) 1 x 5 mL 1 x 5 mL 1 x 5 mL
33308 Salmonella typhi O (O: 9,12) 1 x 5 mL 1 x 5 mL 1 x 5 mL
33301 Salmonella Paratyphi AH (H:a) 1 x 5 mL 1 x 5 mL 1 x 5 mL
33302 Salmonella Paratyphi AO (O:1,2,12) 1 x 5 mL - 1 x 5 mL
33303 Salmonella Paratyphi BH (H:b) 1 x 5 mL 1 x 5 mL 1 x 5 mL
33304 Salmonella Paratyphi BO (O:1,4,5,12) 1 x 5 mL - 1 x 5 mL
33305 Salmonella Paratyphi CH (H:c) 1 x 5 mL - 1 x 5 mL
33306 Salmonella Paratyphi CO (O:6,7) 1 x 5 mL - 1 x 5 mL
33311 Proteus OX19 1 x 5 mL 1 x 5 mL -
33510 C+S: Control Positivo Salmonella 1 x 1 mL 1 x 1 mL -
33509 C+B: Control Positivo Brucella 1 x 1 mL 1 x 1 mL -
33502 C+P: Control Positivo Proteus 1 x 1 mL 1 x 1 mL -
33503 C-: Control Negativo Serología 1 x 1 mL 1 x 1 mL -
COMPOSICIÓN
Antígenos febriles: Suspensión de bacterias inactivadas y teñidas (somáticas
azul,
flagelares rojo), azida sódica 0,95 g/L.
C - Control Negativo: Suero humano negativo, azida sódica 0,95 g/L.
C + Control Positivo: Suero conteniendo el correspondiente anticuerpo febril,
azida sódica 0,95
g/L.
Todos los componentes de origen humano utilizados en la preparación del control
negativo eran negativos para el antígeno HBs y para los anticuerpos anti-HCV y
anti-HIV.
Sin embargo, los controles deben tratarse con precaución como potencialmente
infecciosos.
CONSERVACIÓN
Conservar a 2-8ºC. Los antígenos febriles y Controles son estables hasta la fecha de
caducidad
indicada en la etiqueta, siempre que se conserven bien cerrados y se evite la
contaminación
durante su uso.
Indicaciones de deterioro (Nota 1):
Antígenos febriles: presencia de aglutinación en el frasco.
Controles: presencia de material particulado.
PREPARACIÓN DE LOS REACTIVOS
Los antígenos febriles y los controles estan listos para su uso (Nota 2).
EQUIPO ADICIONAL
Agitador mecánico rotatorio de velocidad regulable a 100 r.p.m.
MUESTRAS
Suero recogido mediante procedimientos estándard. Estable 7 días a 2-8ºC. No
utilizar
muestras hemolizadas o lipémicas.
PROCEDIMIENTO
A. PRUEBA EN PORTA
1. Dejar atemperar los reactivos y las muestras a temperatura ambiente (Nota 3).
2. Depositar 1 gota (50 L) de la muestra a ensayar (Notas 4, 5) y 1 gota de cada
Control en
círculos separados del porta.
3. Homogeneizar el antígeno con suavidad antes de usarlo. Añadir a cada círculo 1
gota (50
L) de antígeno próxima a la gota de muestra.
4. Mezclar con ayuda de un mezclador desechable, procurando extender la mezcla
por toda la
superficie interior del círculo. Emplear mezcladores distintos para cada muestra.
5. Agitar el porta manualmente o en agitador rotatorio a 100 r.p.m. durante 2
minutos (B. Rosa
Bengala durante 4 minutos).
B. PRUEBA EN TUBO
1. Diluir las muestras de suero 1/20 y los Controles 1/10 con NaCl 9 g/L y preparar
de cada
uno series de dobles diluciones en NaCl 9 g/L.
2. Preparar, para cada antígeno a ensayar, una fila de tubos que contenga 1 mL de
cada
dilución del suero y de los Controles (Positivo y Negativo).
3. Agitar suavemente el vial de antígeno y añadir a cada tubo una gota (50 L) de la
suspensión apropiada. Mezclar.
4. Incubar los tubos a 37°C durante 24 h (Nota 6).
LECTURA
A. PRUEBA EN PORTA
Examinar la presencia de aglutinación en el minuto siguiente a la parada del
agitador (Nota 7).
Resultados positivos: Presencia de aglutinación. Los sueros positivos deben
cuantificarse
mediante la prueba en tubo. En el caso de la Brucella Rosa Bengala la presencia de
aglutinación indica un contenido de anticuerpo ≥ 25 UI/mL
Resultados negativos: Ausencia de aglutinación visible.
B. PRUEBA EN TUBO
Examinar la presencia y tipo de aglutinación.
Resultados positivos: Aglutinación parcial o completa acompañada de aclaramientos
variables
del sobrenadante. La aglutinación somática se caracteriza por ser fina y granular,
de formación
lenta y difícilmente disgregable. Por el contrario, la aglutinación flagelar es
algodonosa, de
formación rápida y fácilmente disgregable. Se define el título como la dilución
mayor que da
resultado positivo.
Resultados negativos: Ausencia de aglutinación visible.
CONTROL DE CALIDAD
Los Controles Positivo (C+) y Negativo (C-) deben ensayarse conjuntamente con las
muestras
de los pacientes, con el fin de verificar el correcto funcionamiento de la prueba.
El Control Positivo (C+) debe provocar la aglutinación de los correspondientes
antígenos
febriles.
El Control Negativo (C-) no debe ocasionar aglutinación visible.
Cada laboratorio debe establecer su programa de Control de Calidad interno y
procedimientos
de corrección en el caso de que los controles no cumplan con las tolerancias
aceptables.
CARACTERÍSTICAS DEL ENSAYO
Detectabilidad: 25 UI/mL para la suspensión de Brucella abortus / Rosa de Bengala
utilizando el 2º Patrón Internacional de la OMS.
Efecto de alta concentración (zona): Pueden obtenerse falsos resultados
negativos en
sueros que contengan un elevado título de anticuerpos. Una dilución de estos
sueros será
positiva.
Resultados falsos: Los resultados obtenidos con estos antígenos no muestran
diferencias
significativas al ser comparados con antígenos de referencia. Los detalles del
estudio
comparativo están disponibles bajo solicitud.
Interferencias: Los factores reumatoideos (300 UI/mL) no interfieren.
CARACTERÍSTICAS DIAGNÓSTICAS
Los resultados positivos son una ayuda en el diagnóstico de algunas enfermedades
febriles. No
obstante, la aglutinación no puede considerarse prueba de infección por un
organismo particular
ya que diferentes microorganismos tienen antígenos comunes. Las pruebas de
serodiagnóstico
febril deberían ser utilizadas en paralelo con cultivos adecuados para el aislamiento
e
identificación del organismo causal.
Títulos superiores a 1/80 para los antígenos de Salmonella o Brucella son
generalmente
indicativos de infección reciente. Títulos menores son frecuentes en indivíduos
sanos,
especialmente en áreas con elevada prevalencia de infecciones febriles. El suero de
muchos
indivíduos sanos contiene anticuerpos frente a antígenos de Proteus. Un título
inferior a 1/160
no debe ser considerado significativo.
Un resultado positivo aislado tiene menor significado clínico que la demostración de
un aumento
o disminución del título entre muestras tomadas del paciente en diferentes días.
Un resultado negativo no descarta una infección, ya que la muestra puede haber
sido tomada
antes de que el paciente produjera anticuerpos. También pueden obtenerse falsos
negativos en
casos de inmunodeficiencia, prozona (Brucelosis) y tratamiento con antibióticos.
El diagnóstico clínico no debe realizarse teniendo en cuenta el resultado de un único
ensayo,
sino que debe integrar los datos clínicos y de laboratorio.
NOTAS
1. La intensidad de color puede variar lote a lote sin que ello afecte a los resultados.
2. El antígeno Rosa de Bengala debe utilizarse exclusivamente para pruebas en
porta.
3. La sensibilidad del ensayo puede reducirse si se efectua a bajas temperaturas.
4. Para evitar la prozona, se recomienda reducir la muestra a 20 L para Brucella.
5. En paises con elevada prevalencia de enfermedades febriles, se recomienda diluir
la
muestra 1/4 en NaCl 9 g/L antes de realizar el ensayo.
6. Alternativamente, incubar a 48-50ºC durante 2 h (flagelares) o 4 h (somáticos y
Proteus).
7. Retrasos en las lecturas pueden ocasionar falsos resultados positivos.
BIBLIOGRAFÍA
1. Felix A. Technique and interpretation of the Weil-Felix test in typhus fever. Trans
Roy Soc
Trop Med Hyg 1944; 37: 321-325
2. Felix A. Standardisation des épreuves d’agglutination servant au diagnostic. Bull.
WHO
1950; 2: 685-691
3. Alton GG et al. Techniques for the brucellosis laboratory. INRA Paris, 1988.
4. Gualtney J B et al. Microagglutination procedures for febrile agglutination tests.
Appli Micr
1971; 22: 635-640
S-ar putea să vă placă și
- Libro DiabetesDocument80 paginiLibro DiabetesAmelia Sotelo RoldanÎncă nu există evaluări
- Camara de NeubaberDocument8 paginiCamara de Neubabermark67% (3)
- Informe Fosfatasa AlcalinaDocument5 paginiInforme Fosfatasa AlcalinaDiego Mendieta MolinaÎncă nu există evaluări
- Practica de AntiestreptolisinasDocument3 paginiPractica de AntiestreptolisinasCbz Sebastian Zermeño Briones25% (4)
- Determinación de Anticuerpos Antiestreptolisina O (Aso) (Prueba de Látex) Practica #3Document6 paginiDeterminación de Anticuerpos Antiestreptolisina O (Aso) (Prueba de Látex) Practica #3Ivàn Luna Gutierrez100% (1)
- Sistema Internacional de MedidasDocument4 paginiSistema Internacional de Medidasmark100% (3)
- Esquema Del Nanda Noc y NicDocument1 paginăEsquema Del Nanda Noc y NicNoa Muñoz100% (2)
- Informe de Práctica 4. Exudado Nasal y FaringeoDocument14 paginiInforme de Práctica 4. Exudado Nasal y FaringeoYadira Jaya100% (1)
- Examen General de Orina UroanalisisDocument10 paginiExamen General de Orina UroanalisisBayronMirandaÎncă nu există evaluări
- Informe - Inserto Técnica Dimero D PDFDocument25 paginiInforme - Inserto Técnica Dimero D PDFCarolina BroncanoÎncă nu există evaluări
- Albumina Spinreact IIDocument1 paginăAlbumina Spinreact IIVeronica SantanderÎncă nu există evaluări
- Fundamentos de TinciónDocument6 paginiFundamentos de TinciónKATHLEN RODRIGUEZ ZAMBRANO0% (1)
- Reacciones FebrilesDocument36 paginiReacciones FebrilesEdmundo Gutierrez TépachÎncă nu există evaluări
- Reacciones FebrilesDocument9 paginiReacciones FebrilesRocío Ivette Ramírez LópezÎncă nu există evaluări
- Serie BlancaDocument7 paginiSerie BlancaLuis Ivan Espitia GarciaÎncă nu există evaluări
- Marco Teorico Practica Floculacion InmunoDocument18 paginiMarco Teorico Practica Floculacion InmunoMiguel Angel Rodas Herrera100% (4)
- Unach Ec Lab - Clin 2015 0005 PDFDocument111 paginiUnach Ec Lab - Clin 2015 0005 PDFDenilson Fernando PérezÎncă nu există evaluări
- Guia Practica Vdrl-1Document3 paginiGuia Practica Vdrl-1JonathanSosaÎncă nu există evaluări
- Cuestionario 6-11Document2 paginiCuestionario 6-11GERARDO GARCIA CANTORÎncă nu există evaluări
- Proteina Total. InsertoDocument2 paginiProteina Total. InsertoFrancisco Baca DejoÎncă nu există evaluări
- 1 WidalDocument2 pagini1 WidalHans YoveraÎncă nu există evaluări
- Placa Neuromuscular Cardiaca y LisaDocument2 paginiPlaca Neuromuscular Cardiaca y LisaJuanÎncă nu există evaluări
- Antibiograma 2022Document54 paginiAntibiograma 2022Ricardo DoroteoÎncă nu există evaluări
- Chilomastix MesniliDocument3 paginiChilomastix MesniliJunior Huaranga JacintoÎncă nu există evaluări
- Tema 4 - InmunologíaDocument5 paginiTema 4 - InmunologíaMario CaroÎncă nu există evaluări
- Reporte Práctica 2 Inmuno SISTEMA ABO Y RHDocument6 paginiReporte Práctica 2 Inmuno SISTEMA ABO Y RHJosé Francisco Valenzuela SánchezÎncă nu există evaluări
- Citologia de Moco FecalDocument3 paginiCitologia de Moco FecalEli HinojosaÎncă nu există evaluări
- Células de LinajeDocument3 paginiCélulas de Linajetania pinargoteÎncă nu există evaluări
- Guía Practica 4 - Líquido PleuralDocument3 paginiGuía Practica 4 - Líquido PleuralELIA ANAÎncă nu există evaluări
- Alteraciones Cuantitativas de La Serie GranulocíticaDocument5 paginiAlteraciones Cuantitativas de La Serie GranulocíticaLois RangelÎncă nu există evaluări
- Manual de Prácticas. Realiza Análisis Inmunológicos 2018Document58 paginiManual de Prácticas. Realiza Análisis Inmunológicos 2018Carlos MurilloÎncă nu există evaluări
- Atlas Del Sedimento UrinarioDocument21 paginiAtlas Del Sedimento UrinarioAndré VázquezÎncă nu există evaluări
- Azucares Reductores en Materia FecalDocument1 paginăAzucares Reductores en Materia FecalBenito CameloÎncă nu există evaluări
- O P.PD 20 INSERTO Series de Identificacion BioquimicaDocument3 paginiO P.PD 20 INSERTO Series de Identificacion BioquimicaJulyAndreaMurilloÎncă nu există evaluări
- Reacciones Febriles Con Pruebas de AglutinaciónDocument1 paginăReacciones Febriles Con Pruebas de AglutinaciónMaurilio HuÎncă nu există evaluări
- PRÁCTICA Nº 13 Prueba Bioquímica Óxido Fermentación (Hugh-Leifson)Document4 paginiPRÁCTICA Nº 13 Prueba Bioquímica Óxido Fermentación (Hugh-Leifson)Francisco CastellanoÎncă nu există evaluări
- Practica de Reacciones FebrilesDocument8 paginiPractica de Reacciones FebrilesLaura Rosendo CarrilloÎncă nu există evaluări
- May Hegglin (Español)Document5 paginiMay Hegglin (Español)supersonic06Încă nu există evaluări
- Informe de Fagocitosis in VitroDocument3 paginiInforme de Fagocitosis in VitroJhon Santibañez CalcinaÎncă nu există evaluări
- Identificacion de AlcaloidesDocument3 paginiIdentificacion de AlcaloidesSebas Mena100% (1)
- Inserto BILI T&DDocument1 paginăInserto BILI T&DCarmen Elena PalominoÎncă nu există evaluări
- VDRL en Suero Serologia ABCDocument6 paginiVDRL en Suero Serologia ABCgamalielÎncă nu există evaluări
- Cuestionario Practica 7 y 8 Lab InmunoDocument5 paginiCuestionario Practica 7 y 8 Lab InmunoItzel CorderoÎncă nu există evaluări
- Que Es La GranulopoyesisDocument2 paginiQue Es La GranulopoyesisDelia Alcantara100% (1)
- AntibiogramaDocument4 paginiAntibiogramamaria celesteÎncă nu există evaluări
- Practica 8 AaDocument8 paginiPractica 8 AaBoris Milton Mamani IchutaÎncă nu există evaluări
- Cuadro Características EnterobacteriasDocument3 paginiCuadro Características EnterobacteriasCesar Nicolas SosaÎncă nu există evaluări
- Dientamoeba FragilisDocument4 paginiDientamoeba Fragilisclaudiap2802Încă nu există evaluări
- Hierro Capacidad de FijacionDocument2 paginiHierro Capacidad de FijacionNatán MarcilloÎncă nu există evaluări
- Baterias BioquimicasDocument3 paginiBaterias BioquimicasAnneÎncă nu există evaluări
- VDRLDocument2 paginiVDRLOscar NickÎncă nu există evaluări
- Pruebas de VRDLDocument13 paginiPruebas de VRDLMarlon Ordóñez MÎncă nu există evaluări
- Pruebas Inmunológicas de LaboratorioDocument16 paginiPruebas Inmunológicas de LaboratoriocesarjbcÎncă nu există evaluări
- Determinacion de Fosfatasa AlcalinaDocument4 paginiDeterminacion de Fosfatasa AlcalinaJ Anibal Colmenares PastranaÎncă nu există evaluări
- Determinacion de Anti EstreptolisinasDocument6 paginiDeterminacion de Anti EstreptolisinasJhovana VallejosÎncă nu există evaluări
- Cuestionario D EparaDocument3 paginiCuestionario D EparaShaden Dionicio50% (2)
- Derivación de Las Células SanguíneasDocument3 paginiDerivación de Las Células SanguíneasRamsés Estrada RamónÎncă nu există evaluări
- Factor ReumatoideDocument1 paginăFactor ReumatoideCamila Vargas VeraÎncă nu există evaluări
- Celulas Hep-2 (ANA)Document2 paginiCelulas Hep-2 (ANA)sadcamelÎncă nu există evaluări
- Determinacion Del Factor ReumatoideDocument2 paginiDeterminacion Del Factor ReumatoideJanette RamírezÎncă nu există evaluări
- Practica 2 Pcr-LatexDocument11 paginiPractica 2 Pcr-LatexMishiel Nicole Gomez CentellasÎncă nu există evaluări
- ASO - ManualDocument8 paginiASO - ManualIxel GonzalezÎncă nu există evaluări
- Hemoclasificación NCDocument8 paginiHemoclasificación NCsergio quinteroÎncă nu există evaluări
- Aglutinaciones FebrilesDocument2 paginiAglutinaciones FebrilesJason PinedoÎncă nu există evaluări
- Proposito (1) 123Document15 paginiProposito (1) 123markÎncă nu există evaluări
- Tarea 4 TincionDocument2 paginiTarea 4 TincionmarkÎncă nu există evaluări
- Tarea 4 TincionDocument2 paginiTarea 4 TincionmarkÎncă nu există evaluări
- Paramecium Tarea #1 ParameciumDocument1 paginăParamecium Tarea #1 ParameciummarkÎncă nu există evaluări
- PRACTICA Pipeteo #3Document5 paginiPRACTICA Pipeteo #3mark100% (1)
- TAREA 3 Prueba SerologicasDocument3 paginiTAREA 3 Prueba Serologicasmark100% (4)
- PRACTICA Pipeteo #3Document5 paginiPRACTICA Pipeteo #3mark100% (1)
- Enfoque de MicroscopioDocument33 paginiEnfoque de Microscopiomark50% (2)
- Practica de Lab Oratorio Pesos y Medidas Practica #2Document8 paginiPractica de Lab Oratorio Pesos y Medidas Practica #2markÎncă nu există evaluări
- REACTIVOS DefinicionDocument2 paginiREACTIVOS Definicionmark100% (1)
- REACTIVOS DefinicionDocument2 paginiREACTIVOS Definicionmark100% (1)
- ObjetivoDocument6 paginiObjetivomark100% (1)
- Programa Curso Tópicos de Oncología Clínica 2019Document4 paginiPrograma Curso Tópicos de Oncología Clínica 2019xLarcXDÎncă nu există evaluări
- Tratado de Alergología - Antonio Peláez Hernández - Tomos I y IIDocument1.656 paginiTratado de Alergología - Antonio Peláez Hernández - Tomos I y IIduartelaraferÎncă nu există evaluări
- DLTDocument2 paginiDLTYOLIMAR GILÎncă nu există evaluări
- 4A. Actitud Del Paciente PDFDocument113 pagini4A. Actitud Del Paciente PDFLady Huaman AguilarÎncă nu există evaluări
- Educacion en Sexualidad ResponsableDocument3 paginiEducacion en Sexualidad ResponsableDAYANA PAOLA TORRES MONTESÎncă nu există evaluări
- Puerperio FisiológicoDocument5 paginiPuerperio Fisiológicofernanda.penatÎncă nu există evaluări
- Actuación Del Celador Con El Paciente Terminal y Fallecido - IIDocument6 paginiActuación Del Celador Con El Paciente Terminal y Fallecido - IIantuanbluesÎncă nu există evaluări
- Primeros AuxiliosDocument11 paginiPrimeros AuxiliosDanna CruzaleguiÎncă nu există evaluări
- Bronquiectasias en NiñosDocument40 paginiBronquiectasias en NiñosCarlos Alberto QuispeÎncă nu există evaluări
- El Embarazo en La AdolecenciaDocument14 paginiEl Embarazo en La AdolecenciaCARLOSÎncă nu există evaluări
- Sala Situacional SE 03 - 2020Document92 paginiSala Situacional SE 03 - 2020ApoyoÎncă nu există evaluări
- Terapia RadiometabolicaDocument4 paginiTerapia RadiometabolicaArianaÎncă nu există evaluări
- Signos y Sintomas Generales - Vi PDFDocument7 paginiSignos y Sintomas Generales - Vi PDFJORGE LUIS JEREMIAS ESPEJOÎncă nu există evaluări
- UNIDAD 2 Historia Natural de La Enfermedad, 2020Document31 paginiUNIDAD 2 Historia Natural de La Enfermedad, 2020Alejandro Hernandez HernandezÎncă nu există evaluări
- VIH ExpoDocument40 paginiVIH ExpoGianella EchevarríaÎncă nu există evaluări
- Heridas y CuracionesDocument6 paginiHeridas y CuracionesRichbenavidesÎncă nu există evaluări
- Exposiciondelpartoenmujer 140215134752 Phpapp01Document22 paginiExposiciondelpartoenmujer 140215134752 Phpapp01OlgaPatyDíazBalcázarÎncă nu există evaluări
- Caso Clinico #03Document23 paginiCaso Clinico #03Adriana PerezÎncă nu există evaluări
- Noc y Nic. Funcion CardiovascularDocument3 paginiNoc y Nic. Funcion CardiovascularZafiro NietoÎncă nu există evaluări
- Discapacidad VisceralDocument10 paginiDiscapacidad VisceralHUARANGA VALDIVIEZO BAYRON ALESSANDER100% (1)
- Análisis de Los Artículos 68, 69, 70, 71 de La Ley de Medicamentos y Farmacias de Nicaragua - (Ley 292) - Luis Bravo Ph.D.Document16 paginiAnálisis de Los Artículos 68, 69, 70, 71 de La Ley de Medicamentos y Farmacias de Nicaragua - (Ley 292) - Luis Bravo Ph.D.Dr. Luis Bravo NeuroPsiquisÎncă nu există evaluări
- Ensayo OñaDocument6 paginiEnsayo OñaDamaris CatotaÎncă nu există evaluări
- Fake News "Sarampión en Perú y Movimiento Antivacunas en España"Document11 paginiFake News "Sarampión en Perú y Movimiento Antivacunas en España"Karellia GodoyÎncă nu există evaluări
- Oraciones y Su ClasifacionDocument3 paginiOraciones y Su ClasifacionHugo Chavez SalazarÎncă nu există evaluări
- Historia ContemporaneaDocument24 paginiHistoria ContemporaneaAndrea Ochoa0% (1)
- BRUXISMODocument7 paginiBRUXISMOIlse Gutierrez SalinasÎncă nu există evaluări
- Absceso CornealDocument33 paginiAbsceso CornealConstanza Direnzo100% (1)
- EmmaGarcia Producto2 U2Document13 paginiEmmaGarcia Producto2 U2Bonny Gudiño100% (1)