Documente Academic
Documente Profesional
Documente Cultură
Correction Bac ST2S PC 2014
Încărcat de
BrunoPCBC100%(1)100% au considerat acest document util (1 vot)
8K vizualizări2 paginiDrepturi de autor
© © All Rights Reserved
Formate disponibile
PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca PDF, TXT sau citiți online pe Scribd
100%(1)100% au considerat acest document util (1 vot)
8K vizualizări2 paginiCorrection Bac ST2S PC 2014
Încărcat de
BrunoPCBCDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 2
Correction BAC ST2S 2014 Physique Chimie PCBC Page 1 / 2
CHIMIE (12 points)
EXERCICE 1 : Glande thyrode Aspect hormonal (5,5 points)
1.1. Un acide -amin est une molcule qui comporte la fois un
groupe carboxyle COOH et un groupe amino NH2 sur le mme
atome de carbone (appel carbone ).
1.2. Molcule de tyrosine :
amino carboxyle
1.3. Un carbone repr par un astrisque sappelle un carbone
asymtrique.
1.4. Reprsentation de Fischer de la tyrosine :
Configuration L Configuration D
2.1. Le dipeptide form partir de la tyrosine est la molcule A.
(Aucune justification nest demande, mais la molcule B provient de la
condensation dune molcule qui possde deux groupes NH
2
avec une
molcule avec deux groupes COOH).
2.2. Nom du dipeptide : Tyr-Tyr.
2.3. Lors dune raction de condensation, il y a aussi formation dune
molcule deau.
2.4. (Question ambigu) Sans prcaution supplmentaire, aucun autre
dipeptide ne peut tre form. On nutilise que lacide amin, la tyrosine :
Tyr + Tyr Tyr Tyr + H
2
O (seul le dipeptide Tyr Tyr sera form)
3. Daprs lanalyse mdicale, les valeurs semblent normales :
T4L entre 0,93 et 1,7 ng/dl et TSH entre 0,27 et 4,2
La T4L tant normale , il ny a pas dexcs caractristique de
lhyperthyrodie, donc pas dexamens complmentaires ncessaires
pour diagnostiquer la maladie de Basedow.
EXERCICE 2 : Traitement dune hyperthyrodie (6,5 points)
1.1. Masse molaire du diiode : M(I
2
) = 2 x M(I) = 2 x 127,0 = 254,0 g.mol
-1
.
1.2. Calcul de la quantit de matire : 2 mthodes possibles,
Formule Produit en croix
n = m / M OU 254,0 g 1 mol
n = 15 / 254 15 g n (mol)
Soit : n = 0,059 mol = 5,9 x 10
-2
mol.
1.3. Concentration molaire en diiode dans la solution de Lugol : C = n / V.
Avec V = 100 mL = 100 x 10
-3
L
C = (5,9 x 10
-2
) / (100 x 10
-3
)
C = 0,59 mol/L = 5,9 x 10
-1
mol.L
-1
.
2.1. La verrerie A est la plus adapte : cest une pipette jauge.
2.2. La prsence dune bulle dair risque de fausser la valeur du volume
mesur avec la burette gradue, il faut donc la chasser (sinon la mesure
du volume serait incertaine voire fausse).
2.3. On voit que I
2
gagne des lectrons (avec le +) : cest un oxydant.
Cela se voit aussi avec la relation suivante : Ox + n.e- = Red, o daprs
lnonc I
2
est gauche.
2.4. A lquivalence du dosage, les ractifs ont t introduits dans les
proportions stchiomtriques de lquation du dosage. (Lespce
titre a disparu)
2.5.1. Pour procder au 2
e
dosage plus prcis, on ralise les mmes
tapes que pour le 1
er
dosage rapide, mais la 4
e
tape on verse
directement la solution titrante jusqu 14,0 mL environ. Puis lon verse de
0,1 mL en 0,1 mL ce qui est plus prcis, jusqu lquivalence (15,0 mL).
2.5.2. n
1
= C
1
x V
1
= 8,0 x 10
-1
x 15,0 x 10
-3
= 0,012 mol = 1,2 x 10
-2
mol.
(Avec V
1
= 15,0 mL = 15,0 x 10
-3
L)
Correction BAC ST2S 2014 Physique Chimie PCBC Page 2 / 2
2.6. Lquation du dosage montre que :
2 S
2
O
3
2-
+ 1 I
2
.
Red Ox (daprs Question 2.3)
n
Ox
n
Red
1 2
(Il faut deux fois plus de rducteur que doxydant)
2 n
Ox
= n
Red
, or daprs lnonc on note 1 le rducteur et 2 loxydant :
2 n
2
= n
1
, soit n
2
= n
1
/ 2 = 1,2 x 10
-2
/ 2 = 0,006 mol.
n
2
= 6,0 x 10
-3
mol.
2.7. C
2
= n
2
/ V
2
= 6,0 x 10
-3
/ (10,0 x 10
-3
) = 0,6 mol/L = 6,0 x 10
-1
mol.L
-1
.
2.8. Rsultat de la question 1.3 : C = 0,59 mol.L
-1
. La valeur de C
2
obtenue
la question 2.7 est donc en accord avec la question 1.3.
PHYSIQUE (8 points)
EXERCICE 3 : Thyrode et iode radioactif
1.1. Liode 131 possde 131 nuclons, dont 53 protons et 131 53 = 78
neutrons.
1.2. Il y a mission dun lectron : radioactivit
-
.
1.3. Daprs les lois de conservations (conservation du nombre de charge
et du nombre de masse) (lois de Soddy) :
e X I
0
1
131
54
131
53
Soit A = 131 et Z = 54.
1.4. La contamination par liode 131, comme le montre le texte du sujet,
peut entrainer une fixation du diiode radioactif sur la thyrode. A terme, il y
a donc un risque de dvelopper un cancer (ou autre).
1.5. Prendre des pastilles diode (non radioactive) va saturer la thyrode en
iode, empchant ainsi liode 131 radioactif de se fixer sur la thyrode
et donc la contamination.
2.1. Des isotopes sont des noyaux ayant le mme nombre de protons mais
pas le mme nombre de neutrons (mmes Z, mais A diffrents).
2.2. On donne E = (h x c) / , donc x E = h x c, soit : = (h x c) / E.
= (6,62 x 10
-34
x 3,0 x 10
8
) / (2,6 x 10
-14
)
= 7,64 x 10
-12
m.
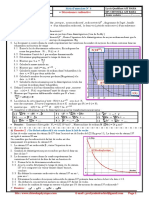
2.3.1. Aprs une priode, lactivit de dpart est divise par 2.
Aprs 2 priodes, elle est divise par 4.
Aprs 3 priodes, elle est divise par 8.
3 priodes : 3 T = 3 x 13 h = 39 h.
Il faut donc 39h pour que lactivit de dpart soit divise par 8.
Avec un exemple : si on part de 10 000 Bq au dpart (choix arbitraire)
13h 13h 13h
10 000 Bq 5 000 2 500 1250
(10000 / 2) (10000 / 4) (10000 / 8)
2.3.2. Lchantillon est inactif aprs 20 T :
20 T = 20 x 13 h = 260 h, donc aprs 260h lchantillon est inactif.
2.3.3. Au bout de 260 h, soit environ 11 jours, la dose injecte au patient
sera inactive, donc le patient aussi ! Lutilisation de ce traceur est
pertinente daprs le document du sujet, car un traceur doit tre inactif
aprs quelques semaines maximum (de plus, si lactivit de la dose est
faible il ny a aucun risque).
2.4. Le personnel mdical peut se protger :
* avec un tablier en plomb
* derrire des vitres au plomb
* des crans en plomb
S-ar putea să vă placă și
- Exercices de Physique Nucléaire et de la MatièreDe la EverandExercices de Physique Nucléaire et de la MatièreÎncă nu există evaluări
- Exercices d'Ondes, d'Optique et d'ÉlectromagnétismeDe la EverandExercices d'Ondes, d'Optique et d'ÉlectromagnétismeÎncă nu există evaluări
- Exercice 1: Dosage de L'iode: I-Préparation de La Solution de Thiosulfate de SodiumDocument4 paginiExercice 1: Dosage de L'iode: I-Préparation de La Solution de Thiosulfate de Sodiumkhaoula elhansaliÎncă nu există evaluări
- Pays: Togo Année: 2016 Session: Sciences Physiques Série: BAC, Série D Durée: 3 H Coefficient: 3Document3 paginiPays: Togo Année: 2016 Session: Sciences Physiques Série: BAC, Série D Durée: 3 H Coefficient: 3MAGNANGOUÎncă nu există evaluări
- Examen Blanc 2020 2BAC PC BIOF (4)Document8 paginiExamen Blanc 2020 2BAC PC BIOF (4)Xuxu Muna100% (1)
- TD#1-Entités Chimiques - 2020-2021 - CorrDocument7 paginiTD#1-Entités Chimiques - 2020-2021 - Corrrayan.delalayÎncă nu există evaluări
- Devoir de Sciences Physiques N°4: Exercice 1: Dosage D'un CollyreDocument5 paginiDevoir de Sciences Physiques N°4: Exercice 1: Dosage D'un CollyreRyan BoucettaÎncă nu există evaluări
- Examen Blanc PC Prof AitouarabDocument8 paginiExamen Blanc PC Prof Aitouarabmohamed laghribÎncă nu există evaluări
- Serie 9Document4 paginiSerie 9Wijdane ElamhjoubiÎncă nu există evaluări
- chimie 2nde c n°4Document2 paginichimie 2nde c n°4Johan NgokoÎncă nu există evaluări
- ds6 optionPC Corrige PDFDocument19 paginids6 optionPC Corrige PDFRochdi BAATIÎncă nu există evaluări
- DS 1 S1 - 2SP BIOF Prof - Razkaoui (WWW - Pc1.ma)Document3 paginiDS 1 S1 - 2SP BIOF Prof - Razkaoui (WWW - Pc1.ma)douaarachid2006rajaÎncă nu există evaluări
- Planning ORAUX BIOTECH 1 17 DEC 2021Document15 paginiPlanning ORAUX BIOTECH 1 17 DEC 2021Sébastien UrienÎncă nu există evaluări
- La Pile DaniellDocument4 paginiLa Pile Daniellarmelo simbeÎncă nu există evaluări
- Fiche de TD N°2 PDFDocument15 paginiFiche de TD N°2 PDFPaola DjeugaÎncă nu există evaluări
- TD Thermodynamique Et Chimie Des Solutions Salamani ADocument6 paginiTD Thermodynamique Et Chimie Des Solutions Salamani Asalma koudriÎncă nu există evaluări
- Spe Physique Chimie 2021 Zero 1 CorrigeDocument8 paginiSpe Physique Chimie 2021 Zero 1 CorrigeChahid OUAAZIZIÎncă nu există evaluări
- M.Douezy Enonce Ds 4 4 12 Enonce Ds 1 S 4 4 12 Avancement Et Lois Et Modeles 1483656512Document5 paginiM.Douezy Enonce Ds 4 4 12 Enonce Ds 1 S 4 4 12 Avancement Et Lois Et Modeles 1483656512الغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- PCSI Exercices de Révisions de ChimieDocument31 paginiPCSI Exercices de Révisions de ChimieImad MadaniÎncă nu există evaluări
- Série D'exercices 4, Décroissance Radioactive, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument7 paginiSérie D'exercices 4, Décroissance Radioactive, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDRima El100% (2)
- Correction de Devoir SurveilléDocument2 paginiCorrection de Devoir Surveilléالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Fiche de TD CHIMIE N°5 GA - 045754Document4 paginiFiche de TD CHIMIE N°5 GA - 045754Juste Landry OngoloÎncă nu există evaluări
- DS 1 S1 - 2SP BiofDocument3 paginiDS 1 S1 - 2SP BiofBa HassanÎncă nu există evaluări
- TD - Cpgo - 2023-2024 - Cinetique ChimiqueDocument4 paginiTD - Cpgo - 2023-2024 - Cinetique Chimiquedieudonnepooda71Încă nu există evaluări
- Devoir de Synthèse N°3 - Sciences Physiques - Bac Sciences Exp (2011-2012) MR Sdiri AnisDocument4 paginiDevoir de Synthèse N°3 - Sciences Physiques - Bac Sciences Exp (2011-2012) MR Sdiri AnisMohamed SaidiÎncă nu există evaluări
- Devoir de Synthèse N°3 - Sciences Physiques - Bac Sciences Exp (2014-2015) MR Handoura NaceurDocument4 paginiDevoir de Synthèse N°3 - Sciences Physiques - Bac Sciences Exp (2014-2015) MR Handoura NaceurMohamed SaidiÎncă nu există evaluări
- Pendule SimpleDocument33 paginiPendule Simplehicham189Încă nu există evaluări
- ED RadioactivitéRXinteractionRI Matière .PDF 1Document4 paginiED RadioactivitéRXinteractionRI Matière .PDF 1Belkis SioudÎncă nu există evaluări
- Exercices Partie 1 Avec CorrectionDocument5 paginiExercices Partie 1 Avec CorrectionEmi GaillardÎncă nu există evaluări
- ElectroDocument12 paginiElectroBichou Hom100% (1)
- Decroissance Radioactive Exercices Non Corriges 6Document6 paginiDecroissance Radioactive Exercices Non Corriges 6Karroum MohamedÎncă nu există evaluări
- 2013 - Poly TDDocument55 pagini2013 - Poly TDAntonin Colrat100% (2)
- Devoir 3 20172018Document4 paginiDevoir 3 20172018Amadou Makhtar SeckÎncă nu există evaluări
- BAC L2 2017 + CorrigéDocument4 paginiBAC L2 2017 + CorrigéGaye Bachir0% (1)
- 2005 09 National Sujet Exo2 MarquageIsotopiqueDocument5 pagini2005 09 National Sujet Exo2 MarquageIsotopiqueYoussef DahaniÎncă nu există evaluări
- TD AtomeDocument32 paginiTD Atomeعبدو طالب جامعيÎncă nu există evaluări
- 2024 - Devoir 2 - Cinétique ChimiqueDocument3 pagini2024 - Devoir 2 - Cinétique Chimiqueredbubbllee.nÎncă nu există evaluări
- Controle 2 . 1 S1 2Bac Fr (Www.AdrarPhysic.Fr)Document5 paginiControle 2 . 1 S1 2Bac Fr (Www.AdrarPhysic.Fr)Mohamed ElouakilÎncă nu există evaluări
- 4 5983115070844962586 PDFDocument1 pagină4 5983115070844962586 PDFtalom kamga armelÎncă nu există evaluări
- DS 3.4S.19Document5 paginiDS 3.4S.19Ayoub Ben MlahÎncă nu există evaluări
- Devoir de Synthèse N°3 - Sciences Physiques - Bac Sciences Exp (2013-2014)Document5 paginiDevoir de Synthèse N°3 - Sciences Physiques - Bac Sciences Exp (2013-2014)AliMchirguiÎncă nu există evaluări
- Série NucDocument3 paginiSérie NucMëđï Bëñmãššøůđ BnmssdÎncă nu există evaluări
- Contrôle 18 (PR Rachid Boumkehla)Document4 paginiContrôle 18 (PR Rachid Boumkehla)Mouhibi AbdellahÎncă nu există evaluări
- Devoir de Synthèse N°3 - Sciences Physiques Réaction Nucléaire - Bac Sciences Exp (2013-2014) MR JELLALI ZAHREDDINEDocument5 paginiDevoir de Synthèse N°3 - Sciences Physiques Réaction Nucléaire - Bac Sciences Exp (2013-2014) MR JELLALI ZAHREDDINEMohamed SaidiÎncă nu există evaluări
- 1cm5q85hc 441159Document5 pagini1cm5q85hc 441159Med yahyaÎncă nu există evaluări
- D2_TL2_LNDFT_2024Document2 paginiD2_TL2_LNDFT_2024Ndiouma DioufÎncă nu există evaluări
- Concours 2013 (+sol.) Proposition EPSTTDocument19 paginiConcours 2013 (+sol.) Proposition EPSTTNidal BestÎncă nu există evaluări
- TD RadioactiviteDocument1 paginăTD RadioactiviteHamza SrhÎncă nu există evaluări
- ILEPHYSIQUE Phys 1s Controle2-CorrectionDocument4 paginiILEPHYSIQUE Phys 1s Controle2-CorrectionBa MamadouÎncă nu există evaluări
- Epreuve Bac Sciences Physiques Serie A4 2019, TogoDocument3 paginiEpreuve Bac Sciences Physiques Serie A4 2019, Togoakoete Fangbemi100% (2)
- S_rie_d_exercices_corrig_s_cin_tiqueDocument6 paginiS_rie_d_exercices_corrig_s_cin_tiqueanie KheliliÎncă nu există evaluări
- PHYSIQUE CHIMIEsession2006 PDFDocument5 paginiPHYSIQUE CHIMIEsession2006 PDFKouamé Emiliano Emmanuel N'ZOÎncă nu există evaluări
- Corrige GEIPI Physique-Chimie 2003Document13 paginiCorrige GEIPI Physique-Chimie 2003ogmios_94Încă nu există evaluări
- Serie TD Biophysique Des Solutions.1èreDocument2 paginiSerie TD Biophysique Des Solutions.1èrehaha100% (1)
- Devoir Corrigé de Synthèse N°1 Lycée Pilote - Sciences Physiques - Bac Mathématiques (2014-2015) MR Ahmed Kadri PDFDocument8 paginiDevoir Corrigé de Synthèse N°1 Lycée Pilote - Sciences Physiques - Bac Mathématiques (2014-2015) MR Ahmed Kadri PDFDadati Sou80% (5)
- 5351 Entrainement TSDocument6 pagini5351 Entrainement TSmohammed laadili100% (1)
- Copie de Hicham Isotherme D'adsorptionDocument13 paginiCopie de Hicham Isotherme D'adsorptioncélia ferÎncă nu există evaluări
- Physique Nucleaire Nuclear Physics PDFDocument64 paginiPhysique Nucleaire Nuclear Physics PDFTRAOREÎncă nu există evaluări
- Cours Datations Master2 Géores2022-2023Document59 paginiCours Datations Master2 Géores2022-2023BAÏ NGUIRA-AÎncă nu există evaluări
- Exercices 2 Decroissance RadioactiveDocument1 paginăExercices 2 Decroissance RadioactivesmfouazeÎncă nu există evaluări
- Correction Activité 2 La Radioactivité 3Document2 paginiCorrection Activité 2 La Radioactivité 3Youssef MILEDÎncă nu există evaluări
- Les Méthodes de Datation - L'archéométrieDocument13 paginiLes Méthodes de Datation - L'archéométrieLejaxhe100% (1)
- TransportDocument10 paginiTransportmemberÎncă nu există evaluări
- Résumé Physique Chimie 2BAC-SVT-FrDocument46 paginiRésumé Physique Chimie 2BAC-SVT-FrAhmed SantosÎncă nu există evaluări
- La Radioactivite Sous Surveillance Et Autres Notions en RadioprotectionDocument184 paginiLa Radioactivite Sous Surveillance Et Autres Notions en RadioprotectionDietethiqueÎncă nu există evaluări
- Devoir Surveillé de Physique NucléaireDocument2 paginiDevoir Surveillé de Physique Nucléaireالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Exposé La GeologieDocument7 paginiExposé La GeologieMarius Foloruncho AdeogouÎncă nu există evaluări
- Upela Assurance EXCLUSIONS CONDITIONS GENERALESDocument6 paginiUpela Assurance EXCLUSIONS CONDITIONS GENERALESdnikosdÎncă nu există evaluări
- Capture D'écran . 2022-06-08 À 17.26.29Document21 paginiCapture D'écran . 2022-06-08 À 17.26.29FirstofalltimeÎncă nu există evaluări
- Protection - Déblai - Dégarnissage & SurveillanceDocument14 paginiProtection - Déblai - Dégarnissage & SurveillanceCOCAULTÎncă nu există evaluări
- TD PHY303 Physique Nucleaire2020 2021Document6 paginiTD PHY303 Physique Nucleaire2020 2021Amer Constat blaugrana100% (1)
- Rapport de Stage TechnicienDocument10 paginiRapport de Stage TechnicienCyrine LaabidiÎncă nu există evaluări
- RADIO-PROTECT: Rapport GT MN VFDocument45 paginiRADIO-PROTECT: Rapport GT MN VFRADIO PROTECTÎncă nu există evaluări
- Devoir de Synthèse N°3 2012 2013 (Nabil)Document6 paginiDevoir de Synthèse N°3 2012 2013 (Nabil)Ayoub Ben MlahÎncă nu există evaluări
- Loi Portant Code Minier - 2019 PDFDocument53 paginiLoi Portant Code Minier - 2019 PDFMoumouni KabreÎncă nu există evaluări
- Radioactivité Exercices 1ereDocument5 paginiRadioactivité Exercices 1ereartscribdÎncă nu există evaluări
- Ad2.Loi de DecroissanceDocument4 paginiAd2.Loi de DecroissanceAnge RaphaëlÎncă nu există evaluări
- Radio Activ It ÉDocument30 paginiRadio Activ It ÉlucasÎncă nu există evaluări
- 5 Décroissance RadioactiveDocument10 pagini5 Décroissance RadioactiveKawtar kawtarÎncă nu există evaluări
- Noyaux Et Rayonnement 2Document65 paginiNoyaux Et Rayonnement 2Tim RoyÎncă nu există evaluări
- Bases PhysiquesDocument70 paginiBases PhysiquesAbdelah El ArabiÎncă nu există evaluări
- Decroissance Radioactive Exercices Non Corriges 3 1Document2 paginiDecroissance Radioactive Exercices Non Corriges 3 1boufdiliÎncă nu există evaluări
- Cours de RadioprotectionDocument56 paginiCours de RadioprotectionAbdelazizSabbabi100% (1)
- Pathologie Des Rayonnements IonisantsDocument9 paginiPathologie Des Rayonnements Ionisantssar100% (1)
- Série Complete Nucleaire Prof Elmnaouar (WWW - Pc1.ma)Document9 paginiSérie Complete Nucleaire Prof Elmnaouar (WWW - Pc1.ma)fardadi rachidÎncă nu există evaluări
- Exercice SDocument4 paginiExercice SFata MedÎncă nu există evaluări
- La Pathologie Professionnelle Liee Aux Rayonnements IonisantsDocument13 paginiLa Pathologie Professionnelle Liee Aux Rayonnements Ionisantsmohamed_sahnoun_enisÎncă nu există evaluări