Documente Academic
Documente Profesional
Documente Cultură
Cristal Violeta Lab
Încărcat de
Ela GomezTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Cristal Violeta Lab
Încărcat de
Ela GomezDrepturi de autor:
Formate disponibile
Scientia et Technica Ao XVIII, No xx, Mesxx de Aoxx. Universidad Tecnolgica de Pereira.
ISSN 0122-1701
CINETICA CRISTAL VIOLETA
KINETIC CRYSTAL VIOLET
RESUMEN
DANIEL GUSTAVO BUSTOS
El compuesto indicador de pH "violeta cristal" (y sus Estudiante de Qumica Industrial Universidad
anlogos) se utiliza como un colorante textil y una Tecnolgica de Pereira.
herramienta para la identificacin y desinfeccin de dan_ y_gus@hotmail.com
ciertas bacterias. Tiene un color violeta en solucin
cida
y
es
incoloro
en
solucin
ms
bsica.
GLORIA JANETH CASTAO
Estudiante de Qumica Industrial Universidad
Palabras clave
Tecnolgica de Pereira.
candygloria_16@hotmail.com
Absorbancia: Es la cantidad de intensidad de la luz que
absorbe la muestra.
Cintica qumica: Es un rea de la fisicoqumica que se
encarga del estudio de la rapidez de reaccin, cmo
cambia la rapidez de reaccin bajo condiciones
variables y qu eventos moleculares se efectan
mediante la reaccin general (Difusin, ciencia de
superficies, catlisis).
Cristal violeta o violeta de genciana: Es el nombre dado
a un grupo de compuestos qumicos empleados como
indicadores de pH y colorantes.
Espectrofotmetro: Es un instrumento usado en
el anlisis qumico que sirve para medir, en funcin de
la longitud de onda, la relacin entre valores de una
misma magnitud fotomtrica relativos a dos haces
de radiaciones y la concentracin o reacciones qumicas
que se miden en una muestra.
Abstract
The pH-indicator compound crystal violet (and its
analogs) is used as a textile dye and a tool for the
identification and disinfection of certain bacteria. It has a
purple color in acidic
Solution and is colorless in more basic solution.
Fecha de Recepcin: (Letra Times New Roman de 8 puntos)
Fecha de Aceptacin: Dejar en blanco
Key Word
Absorbance intensity is the amount of light absorbed by
the sample.
Chemical kinetics: Is an area of physical chemistry that
deals with the study of reaction time, how to change the
speed of reaction variables under conditions and what
molecular events are made by the general reaction
(diffusion, surface science, catalysis).
Crystal violet or Gentian Violet: The name given to a
group of chemicals used as pH indicators and dyes
Spectrophotometer: Is an instrument used in chemical
analysis that measures, as a function of wavelength, the
relationship between the same photometric values
relating to magnitude two beams of radiation and the
concentration and chemical reactions that are
Scientia et Technica Ao XVIII, No xx, Mesxx de Aoxx. Universidad Tecnolgica de Pereira.
2
INTRODUCCION
La cintica de esta reaccin se puede monitorizar con
un espectrofotmetro mediante la observacin de la
disminucin de la absorbancia del violeta cristal, que se
puede utilizar como una medida de la tasa para
determinar la ley de velocidad a travs de las siguientes
relaciones:
El primer paso en este anlisis ser determinar la
longitud de onda de absorbancia mxima de violeta
cristal y el correspondiente coeficiente de extincin
molar a esa longitud de onda. Esta longitud de onda se
utiliza para controlar la desaparicin de cristal violeta
durante todo el curso del experimento. Una vez que
haya determinado el valor de , entonces usted puede
utilizarlo en sus hojas de clculo posteriores de los
datos cinticos, que contendrn los valores de
absorbancia en funcin del tiempo, para convertir cada
valor
de
absorbancia
a
su
correspondiente
concentracin de cristal violeta.
Tasa de desaparicin de CV = tasa de aparicin de
x
y
CVOH = [CV] [OH-]
PARTE EXPERIMENTAL
El primer paso de la prctica consisti en determinar el
coeficiente de extincin de Cristal violeta; para ello se realiz
una dilucin a 25 mL de 4 mL de solucin de cristal violeta
1*10-4 M en un matraz; posteriormente se determin en el
espectrofotmetro la absorbancia y la longitud de onda de la
mxima absorbancia; obtenindose los siguiente s resultados
: 590 nm
A: 1,393
Decoloracin del Cristal Violeta
El medio ms conveniente de control de la tasa de
decoloracin violeta cristal es controlar la prdida de
color prpura en el tiempo. La ecuacin (3) muestra que
la tasa de la reaccin es igual al opuesto de la variacin
de la concentracin de violeta cristal en el tiempo,
donde el cambio
en la concentracin de CV ( [CV]) se mide por el
cambio en el color de la solucin y el cambio en el
tiempo (time) es el tiempo entre mediciones. Esta es
una aproximacin porque la tasa de 4 cambios en el
curso de la reaccin y no es constante. Sin embargo, ya
que estamos slo estudiando la velocidad inicial de esta
reaccin, es razonable suponer una relacin lineal entre
concentracin y el tiempo. Experimentos del tipo inicial
se llevan a cabo de manera que la concentracin de
reactivos permanece dentro del 1% de sus valores
iniciales.
Tasa =
= k [CV] [OH-]
b: 1 cm
Para esta prctica se realizaron 5 ensayos, en tres de los cuales
se cambi la concentracin de NaOH mientras que mantena
constante la del cristal violeta, y en los dems ensayos se
mantena constante la concentracin de NaOH y se vari la
concentracin de Cristal Violeta
Cristal
Violeta (CV)
Ensayo
NaOH
Concentracin inicial (M)
3,3333E-05
0,0333
3,3333E-05
0,0267
3,3333E-05
0,0167
3,3333E-05
2,6667E-05
0,0333
1,6667E-05
0,0333
0,0333
Ley de Bee permite el
clculo de la
concentracin de
violeta
cristal
usando
el
valor
determinado
experimentalmente de . Es decir,
[CV] = Absorbancia / () (1 cm)
C: 1*10-4 M
Tabla 1. Concentraciones iniciales de cada reactivo para los
ensayos respectivos.
Scientia et Technica Ao XVIII, No xx, Mesxx de Aoxx. Universidad Tecnolgica de Pereira.
Se realiz la medicin en el espectrofotmetro genesys-20 a
una longitud de onda de 590nm, y se tom lecturas cada 5
segundos para cada ensayo.
Ensayo 1
2.500E-05
2.2 Resultados
CV
2.000E-05
Se determin el coeficiente de extincin molar () del cristal
violeta, a partir de la ley Beer- Lamber:
1.500E-05
1.000E-05
y = -9.0255E-08x + 2.2654E-05
R = 9.8933E-01
5.000E-06
A=bC
donde : A/ b*C
Donde A: 1,939
C: 1*10-4 M
C: A/ *b
0.000E+00
0
20
b: 1 cm
40
60
80
TIEMPO
= 72611 cm-1 M-1
GRAFICO TABLABLA 2
A partir del coeficiente de extincin se determin la
concentracin de cristal violeta a cada tiempo con la siguiente
ecuacin:
C: A/ *b
Ensayo 1
Tiempo (s)
A
1.656
5
1.598
10
1.548
15
1.507
20
1.469
25
1.434
30
1.401
35
1.365
40
1.334
45
1.304
50
1.273
55
1.246
60
1.215
65
1.189
70
1.163
75
1.137
80
1.112
85
[CV]
2.280E-05
2.200E-05
2.131E-05
2.075E-05
2.023E-05
1.975E-05
1.929E-05
1.880E-05
1.837E-05
1.796E-05
1.753E-05
1.716E-05
1.673E-05
1.637E-05
1.602E-05
1.566E-05
1.531E-05
Ensayo 2
Tiempo (s)
5
10
15
20
25
30
35
40
45
50
55
60
65
70
75
80
85
90
95
A
1.339
1.315
1.293
1.267
1.239
1.215
1.199
1.181
1.159
1.140
1.120
1.102
1.083
1.065
1.047
1.029
1.011
0.993
0.954
[CV]
1.844E-05
1.811E-05
1.781E-05
1.745E-05
1.706E-05
1.673E-05
1.651E-05
1.626E-05
1.596E-05
1.570E-05
1.542E-05
1.518E-05
1.492E-05
1.467E-05
1.442E-05
1.417E-05
1.392E-05
1.368E-05
1.314E-05
Tabla 3. Resultados de las absorbancias y concentracin de
cristal violeta cada 5 segundos de reaccin para el ensayo 2.
Tabla 2. Resultados de las absorbancias y concentracin de
cristal violeta cada 5 segundos de reaccin para el ensayo 1.
____________________________
1. Las notas de pie de pgina debern estar en la pgina donde se citan. Letra Times New Roman de 8 puntos
100
Scientia et Technica Ao XVIII, No xx, Mesxx de Aoxx. Universidad Tecnolgica de Pereira.
Ensayo 2
2.000E-05
1.800E-05
1.600E-05
1.400E-05
1.200E-05
1.000E-05
8.000E-06
6.000E-06
4.000E-06
2.000E-06
0.000E+00
Ensayo 3
2.000E-05
1.800E-05
1.600E-05
1.400E-05
1.200E-05
CV
CV
1.000E-05
8.000E-06
y = -5.5803E-08x + 1.8556E-05
R = 9.9637E-01
y = -3.7387E-08x + 1.7611E-05
R = 9.9356E-01
6.000E-06
4.000E-06
2.000E-06
50
100
0.000E+00
TIEMPO
20
40
60
80
TIEMPO
GRAFICO TABLA 2
GRAFICO TABLA 3
Ensayo 3
Tiempo (s)
5
10
15
20
25
30
35
40
45
50
55
60
65
70
75
80
85
90
95
A
1.285
1.251
1.240
1.215
1.206
1.197
1.185
1.168
1.152
1.139
1.124
1.112
1.099
1.088
1.076
1.063
1.051
1.039
1.027
[CV]
1.770E-05
1.723E-05
1.708E-05
1.673E-05
1.661E-05
1.649E-05
1.632E-05
1.609E-05
1.587E-05
1.569E-05
1.548E-05
1.531E-05
1.514E-05
1.498E-05
1.482E-05
1.464E-05
1.447E-05
1.431E-05
1.414E-05
Tabla 3. Resultados de las absorbancias y concentracin de
cristal violeta cada 5 segundos de reaccin para el ensayo 2.
Ensayo 4
Tiempo (s)
5
10
15
20
25
30
35
40
45
50
55
60
65
70
75
80
85
90
95
100
105
A
1.219
1.181
1.154
1.120
1.099
1.077
1.065
1.045
1.033
1.021
1.009
0.996
0.984
0.965
0.955
0.939
0.926
0.911
0.900
0.889
0.855
[CV]
1.679E-05
1.626E-05
1.589E-05
1.542E-05
1.514E-05
1.483E-05
1.467E-05
1.439E-05
1.423E-05
1.406E-05
1.390E-05
1.372E-05
1.355E-05
1.328E-05
1.315E-05
1.293E-05
1.276E-05
1.255E-05
1.239E-05
1.224E-05
1.178E-05
Tabla 4. Resultados de las absorbancias y concentracin de
cristal violeta cada 5 segundos de reaccin para el ensayo 3.
100
Scientia et Technica Ao XVIII, No xx, Mesxx de Aoxx. Universidad Tecnolgica de Pereira.
1.800E-05
1.600E-05
1.400E-05
1.200E-05
1.000E-05
8.000E-06
6.000E-06
4.000E-06
2.000E-06
0.000E+00
Ensayo 5
3.000E-05
2.500E-05
2.000E-05
CV
CV
Ensayo 4
1.500E-05
y = -5.9170E-08x + 2.7588E-05
R = 9.9613E-01
1.000E-05
y = -4.3973E-08x + 1.6415E-05
R = 9.7743E-01
5.000E-06
0.000E+00
20
40
60
80
100
120
20
TIEMPO
40
60
80
100
120
TIEMPO
GRAFICO TABLA 4
GRAFICO TABLA 5
Ensayo 5
Tiempo
(s)
5
10
15
20
25
30
35
40
45
50
55
60
65
70
75
80
85
90
95
100
A
1.974
1.955
1.940
1.931
1.904
1.885
1.859
1.834
1.808
1.781
1.759
1.738
1.710
1.694
1.678
1.658
1.639
1.618
1.600
1.588
[CV]
2.719E-05
2.692E-05
2.672E-05
2.659E-05
2.622E-05
2.596E-05
2.560E-05
2.526E-05
2.490E-05
2.453E-05
2.422E-05
2.394E-05
2.355E-05
2.333E-05
2.311E-05
2.283E-05
2.257E-05
2.228E-05
2.204E-05
2.187E-05
Posteriormente tomando la pendiente de cada recta, se obtiene
la velocidad de reaccin de cada ensayo. Y se calcula el
logaritmo en base 10 de la velocidad y la concentracin inicial
de cada reactivo en cada e
Cristal Violeta (CV)
Ensayo
1
Velocidad (M/s)
1
NaOH
Concentracin (M)
1,0430E-07
3,3333E-05
0,0333
8,7612E-08
3,3333E-05
0,0267
6,3866E-08
3,3333E-05
0,0167
1,0430E-07
3,3333E-05
0,0333
9,5170E-08
2,6667E-05
0,0333
7,7312E-08
1,6667E-05
0,0333
Tabla 6
Tabla 5. Resultados de las absorbancias y concentracin de
cristal violeta cada 5 segundos de reaccin para el ensayo 4.
____________________________
1. Las notas de pie de pgina debern estar en la pgina donde se citan. Letra Times New Roman de 8 puntos
Scientia et Technica Ao XVIII, No xx, Mesxx de Aoxx. Universidad Tecnolgica de Pereira.
Log (V)
Log [CV]
Log
[NaOH]
Es posible calcular la constante de velocidad de la reaccin:
Log
-6,9817
-4,4771
-1,4771
-7,0574
-4,4771
-1,5740
-7,1947
-4,4771
-1,7782
-6,9817
-4,4771
-1,4771
-7,0215
-4,5740
-1,4771
-7,1118
-4,7782
-1,4771
Continuacin tabla 6
-4,0031
1,826E-02
-4,0107
1,812E-02
-4,0047
1,823E-02
-4,0031
1,826E-02
-4,0008
1,830E-02
-4,0026
1,827E-02
K Promedio
1,824E-02
Grfica 6. Log (velocidad) vs Log [CV]
Tabla 7. Datos de la constante de velocidad y
promedio de todos los ensayos
Log(velocidad) Log[NaOH]
-2.0000
-1.5000
-1.0000
-0.5000
0.0000
-6.9500
Log(velocidad)
-7.0000
y = 0.7023x - 5.9475
R = 0.9986
-7.0500
-7.1000
-7.1500
-7.2000
Log[NaOH]
-7.2500
Grfica 67. Log (velocidad) vs Log [NaOH]
De acuerdo con las pendientes de cada recta, el orden de
reaccin para cada componente es 1.
Mediante la frmula:
Log (velocidad) = log (k) + x log [CV] + y log [OH-]
Luego se realiza una grfica de Log [CV] vs Log
(Velocidad). Y Log [NaOH] vs Log (Velocidad). Para
determinar el orden de reaccin de cada componente de
la reaccin:
Scientia et Technica Ao XVIII, No xx, Mesxx de Aoxx. Universidad Tecnolgica de Pereira.
V. CONCLUSIONES
El cristal violeta se adhiere a la pared celular
bacteriana, las bacterias gram positivas
absorben este colorante porque tienen mayor
porcentaje de acido teicoico en su estructura y
por eso adquieren un color violeta en el
microscopio, por lo tanto como colorante
primario cumple como funcin permitir la
identificacin de bacterias cuya estructura y
composicin de pared celular se encuentre
mayor proporcin y distribucin de cido
teicoico.
VI. BIBLIOGRAFIA
http://es.wikipedia.org/wiki/Cristal_violeta
http://catarina.udlap.mx/u_dl_a/tales/documento
s/leip/arredondo_d_r/capitulo7.pdf
La contribucion de (I) a la resonancia hibrida
sugiere una deficiencia de eletrones en el
carbon terciario, por lo que se espera que el ion
hidroxido ataque a esta poscicion para formar
un carbaniol derivado incoloro. Si la formacion
de este carbaniol es lenta (t 1/2 > 1 hr) ocurren
interraciones entre el carbaniol y el cristal
violeta, lo que afecta valores de la constante
reaccion, por lo cual, se recomienda hacer una
reaccion en presencia de exceso de iones
hidroxido.
El cristal violeta obedece a las leyes de beer a
longitudes de onda de 590nm. Como mxima
absorcin a concentraciones de 5E-6 M y
menores. La energa de activacin para la
reaccin en agua a 25 C es de 15.1Kcal/mol; y
la entropa de activacin bajo estas condiciones
es de -12.3 cal/gmolK.
____________________________
1. Las notas de pie de pgina debern estar en la pgina donde se citan. Letra Times New Roman de 8 puntos
S-ar putea să vă placă și
- Determinación de La Constante de Equilibrio de Un IndicadorDocument5 paginiDeterminación de La Constante de Equilibrio de Un IndicadorMaryjoseLeónÎncă nu există evaluări
- Farma 1 Practica 8Document6 paginiFarma 1 Practica 8Roxana HernandezÎncă nu există evaluări
- Pruebas de Caracterización de Compuestos OrgánicosDocument5 paginiPruebas de Caracterización de Compuestos OrgánicosHarold Andrés LeónÎncă nu există evaluări
- Microsoft Word - Ut1. Patrones para Análisis2Document16 paginiMicrosoft Word - Ut1. Patrones para Análisis2mariajose.fernandez4738250% (2)
- 2p Cinetica de Oxidacion de La Vitamina C Con Ferricianuro de Potasio PDFDocument4 pagini2p Cinetica de Oxidacion de La Vitamina C Con Ferricianuro de Potasio PDFRuben FelipeÎncă nu există evaluări
- Contenido TemáticoDocument4 paginiContenido Temáticocarina_gutiÎncă nu există evaluări
- Tema 2 Filtracion Operaciones UnitariasDocument24 paginiTema 2 Filtracion Operaciones UnitariasCoral DiazÎncă nu există evaluări
- Espectroscopia de Fluorescencia y FosforescenciaDocument5 paginiEspectroscopia de Fluorescencia y FosforescenciaLAURA VANESSA RESTREPO PALACIOÎncă nu există evaluări
- Guia-De-estudio y Cuestionario BINOLDocument5 paginiGuia-De-estudio y Cuestionario BINOLJacob100% (1)
- Análisis de métodos analíticos y factores a considerarDocument4 paginiAnálisis de métodos analíticos y factores a considerarCarolinamcr95Încă nu există evaluări
- Práctica3-Preparacion de Soluciones y DilucionesDocument8 paginiPráctica3-Preparacion de Soluciones y DilucionesDaniel Camacho GarzonÎncă nu există evaluări
- Tarea #5 Electro. I, 2018 B PDFDocument6 paginiTarea #5 Electro. I, 2018 B PDFJuan Jesus Navarro SalasÎncă nu există evaluări
- Determinación del número de transporte por el método de HittorfDocument3 paginiDeterminación del número de transporte por el método de HittorfJessica RojasÎncă nu există evaluări
- Absorciometria CorregidoDocument13 paginiAbsorciometria CorregidoMaximiliano MederoÎncă nu există evaluări
- Acetilación anilina bromación acetanilidaDocument7 paginiAcetilación anilina bromación acetanilidaHerman Ruiz Calderin100% (1)
- Practica VinosDocument47 paginiPractica VinosElaine LuuÎncă nu există evaluări
- Extraccion Cafeina y Sintesis de Salicilato de IsoamiloDocument2 paginiExtraccion Cafeina y Sintesis de Salicilato de IsoamiloHenry CarterÎncă nu există evaluări
- Practica 5 Entalpias de VaporizacionDocument5 paginiPractica 5 Entalpias de VaporizacionBelen Cy GómezÎncă nu există evaluări
- Conductividad Acetato de EtiloDocument7 paginiConductividad Acetato de EtiloFranklin Gaspar100% (1)
- Partición de AmoxicilinaDocument5 paginiPartición de AmoxicilinaCristian LamaizonÎncă nu există evaluări
- Preparacion de Las Practicas de Laboratiorio Inorganica Ii PDFDocument34 paginiPreparacion de Las Practicas de Laboratiorio Inorganica Ii PDFMONROY RAMIREZ ANDRES FELIPEÎncă nu există evaluări
- Florometría RivoflabinaDocument4 paginiFlorometría RivoflabinaAndy PhyÎncă nu există evaluări
- Informe FQ 7 (1) .Docx Solubilidad y TermodinámicaDocument4 paginiInforme FQ 7 (1) .Docx Solubilidad y TermodinámicaAighself100% (1)
- Para ExpDocument4 paginiPara Expvarzc100% (3)
- Cinetica Reporte 4Document23 paginiCinetica Reporte 4AnnBukowskiÎncă nu există evaluări
- Laboratorio Farmacéutico: Caso de hechos 2Document4 paginiLaboratorio Farmacéutico: Caso de hechos 2FATIMA ITZEL MONJARAS ELIASÎncă nu există evaluări
- Determinación espectrofotométrica de Fe(II) en jarabe farmacéuticoDocument10 paginiDeterminación espectrofotométrica de Fe(II) en jarabe farmacéuticoJ Mora GañanÎncă nu există evaluări
- Espectros InfrarrojoDocument14 paginiEspectros InfrarrojoMaira Alejandra Cubillos TorresÎncă nu există evaluări
- INFORME Acido FormicoDocument4 paginiINFORME Acido FormicoKamila MartinÎncă nu există evaluări
- Análisis Orgánico Clásico-Espectral - Informe 1Document4 paginiAnálisis Orgánico Clásico-Espectral - Informe 1CAMILA ANDREA CHAPARRO PEREZÎncă nu există evaluări
- Absorb An CIADocument22 paginiAbsorb An CIANayeli Romero VirruetaÎncă nu există evaluări
- Informe de Obtencion Del MetanoDocument9 paginiInforme de Obtencion Del MetanoKelly Palacios PonceÎncă nu există evaluări
- Cuantificación de etanol en bebidas alcohólicas mediante refractometríaDocument4 paginiCuantificación de etanol en bebidas alcohólicas mediante refractometríaDavid Valencia CarreñoÎncă nu există evaluări
- Reporte 1 O3Document3 paginiReporte 1 O3danielÎncă nu există evaluări
- Factor Gravimétrico: Relación Masa Comp Buscado/PesadoDocument4 paginiFactor Gravimétrico: Relación Masa Comp Buscado/PesadoMarco Antonio Ordinola SandovalÎncă nu există evaluări
- Tarea 1 PDFDocument1 paginăTarea 1 PDFEdith GaytánÎncă nu există evaluări
- Formas de Expresar La ConcentraciónDocument4 paginiFormas de Expresar La ConcentraciónleoespinoÎncă nu există evaluări
- Informe 4 PolarimetriaDocument8 paginiInforme 4 PolarimetriaGlendiita YepezÎncă nu există evaluări
- Síntesis de ftalimida mediante reacción de anhídrido ftálico y ureaDocument4 paginiSíntesis de ftalimida mediante reacción de anhídrido ftálico y ureaKarmen Perez100% (1)
- Clase REDOX Qui-223Document53 paginiClase REDOX Qui-223JacquelineLisetVargasVergaraÎncă nu există evaluări
- Sexto Informe de Analisis Instrumental ConductimetríaDocument18 paginiSexto Informe de Analisis Instrumental ConductimetríaJosé Enrique Jurado MenesesÎncă nu există evaluări
- Métodos de Adición Estándar.Document25 paginiMétodos de Adición Estándar.Brian HodzÎncă nu există evaluări
- Síntesis+.. DihidropiridinasDocument11 paginiSíntesis+.. DihidropiridinasLiliana CapulínÎncă nu există evaluări
- Informe Uv Fisicoquimica - Docx21 NuevoDocument16 paginiInforme Uv Fisicoquimica - Docx21 Nuevoluis villamarinÎncă nu există evaluări
- Practica 1 PDFDocument1 paginăPractica 1 PDFOscar ReynosoÎncă nu există evaluări
- Determinación de Dureza en Agua2020Document3 paginiDeterminación de Dureza en Agua2020Fernanda Nieto UriosteguiÎncă nu există evaluări
- Informe 1Document26 paginiInforme 1Tatiana RodríguezÎncă nu există evaluări
- Anteproyecto ParacetamolDocument9 paginiAnteproyecto Paracetamoldilan arguelloÎncă nu există evaluări
- Cromatografía en columna separa colorantesDocument5 paginiCromatografía en columna separa colorantesMORALES SERGIOÎncă nu există evaluări
- Práctica 4: Valoraciones Ácido-Base.Document18 paginiPráctica 4: Valoraciones Ácido-Base.Enrique DelgadoÎncă nu există evaluări
- A.I. 1-Informe 3-Análisis de Sustancias Coloreadas Por EspectrofotometríaDocument7 paginiA.I. 1-Informe 3-Análisis de Sustancias Coloreadas Por EspectrofotometríaMikhangB100% (1)
- Práctica No. 1 Síntesis Del Ácido AcetilsalicílicoDocument31 paginiPráctica No. 1 Síntesis Del Ácido AcetilsalicílicoPaola Guillén MoralesÎncă nu există evaluări
- DISOLUCIONESDocument44 paginiDISOLUCIONESMagaly BenaventeÎncă nu există evaluări
- Práctica 5 - Método MohrDocument10 paginiPráctica 5 - Método MohrJorgeLuisFR7Încă nu există evaluări
- Electro Qu MicaDocument100 paginiElectro Qu MicaRafael GonzálezÎncă nu există evaluări
- Las Normas Generales de Trabajo en Un Laboratorio de Química OrgánicaDocument9 paginiLas Normas Generales de Trabajo en Un Laboratorio de Química OrgánicaJaquelina Leal100% (1)
- ARTICULO-Prac Lab QuimicaDocument4 paginiARTICULO-Prac Lab QuimicaRocio FernandezÎncă nu există evaluări
- LabQuímOrgII-SíntFluoresceínaDocument6 paginiLabQuímOrgII-SíntFluoresceínaLeilaÎncă nu există evaluări
- Cálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaDe la EverandCálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaEvaluare: 5 din 5 stele5/5 (1)
- Informe de Lab Fisicoquimica3 CineticaDocument8 paginiInforme de Lab Fisicoquimica3 CineticaAllan Cortes BugueñoÎncă nu există evaluări
- Evaluación de Repaso Grado 11Document1 paginăEvaluación de Repaso Grado 11Ela GomezÎncă nu există evaluări
- Metodologias para Evaluar PDFDocument6 paginiMetodologias para Evaluar PDFHeinz FischerÎncă nu există evaluări
- Reino Animalia para Primero de SecundariaDocument6 paginiReino Animalia para Primero de SecundariaCarlos Rea100% (3)
- Mujeres en La CienciaDocument13 paginiMujeres en La CienciaEla GomezÎncă nu există evaluări
- Astronomia LibroDocument57 paginiAstronomia LibroEla GomezÎncă nu există evaluări
- Bngo SistcircDocument4 paginiBngo SistcircEla GomezÎncă nu există evaluări
- INTA CIA InstitutodeTecnologiadeAlimentos Martinez F G Optimización de Las Condiciones de Proceso de Hidrólisis de Pulmón Bovino Con PapaínaDocument9 paginiINTA CIA InstitutodeTecnologiadeAlimentos Martinez F G Optimización de Las Condiciones de Proceso de Hidrólisis de Pulmón Bovino Con PapaínaEla GomezÎncă nu există evaluări
- Origen de la vidaDocument2 paginiOrigen de la vidaEla Gomez100% (1)
- Taller de Mitosis y MeiosisDocument4 paginiTaller de Mitosis y MeiosisEla GomezÎncă nu există evaluări
- La Médula EspinalDocument3 paginiLa Médula EspinalEla Gomez100% (1)
- Taller Ciencias2007Document41 paginiTaller Ciencias2007Claudio Alberto Avila GonzalezÎncă nu există evaluări
- Evaluacion CcelulaDocument2 paginiEvaluacion CcelulaEla GomezÎncă nu există evaluări
- EnsayoDocument4 paginiEnsayoEla Gomez71% (14)
- Cuestionario de Conocimientos y Uso de Instrumentos TecnologicosDocument1 paginăCuestionario de Conocimientos y Uso de Instrumentos TecnologicosEla GomezÎncă nu există evaluări
- Encuesta OndasDocument1 paginăEncuesta OndasEla GomezÎncă nu există evaluări
- Plan de Aula Fisica 2018Document12 paginiPlan de Aula Fisica 2018Ela GomezÎncă nu există evaluări
- Simulacro 3 químicaDocument2 paginiSimulacro 3 químicaEla GomezÎncă nu există evaluări
- EnsayoDocument4 paginiEnsayoEla Gomez71% (14)
- Actividad 1 CelulaDocument1 paginăActividad 1 CelulaEla GomezÎncă nu există evaluări
- Nueva estructura competencia célulaDocument4 paginiNueva estructura competencia célulaEla Gomez100% (4)
- EnsayoDocument4 paginiEnsayoEla Gomez71% (14)
- Taller Geometria SextoDocument1 paginăTaller Geometria SextoEla GomezÎncă nu există evaluări
- Analisis de AzúcarDocument3 paginiAnalisis de AzúcarEla GomezÎncă nu există evaluări
- Uno PreguntaDocument7 paginiUno PreguntaEla GomezÎncă nu există evaluări
- Cuaderno de ExperimentosDocument24 paginiCuaderno de ExperimentosEla GomezÎncă nu există evaluări
- Marco Teorico LaboratoriosDocument3 paginiMarco Teorico LaboratoriosEla GomezÎncă nu există evaluări
- Ref 2900 Con DerivadasDocument2 paginiRef 2900 Con DerivadasEla GomezÎncă nu există evaluări
- Guía Orientación Pruebas Docentes MayoritariosDocument151 paginiGuía Orientación Pruebas Docentes MayoritariosJosé Leonardo Tovio FlórezÎncă nu există evaluări
- Analisis de AzúcarDocument3 paginiAnalisis de AzúcarEla GomezÎncă nu există evaluări
- Ref 2900 Con DerivadasDocument2 paginiRef 2900 Con DerivadasEla GomezÎncă nu există evaluări
- Espect Rosco Pia Atomic ADocument123 paginiEspect Rosco Pia Atomic ADavid LagomaÎncă nu există evaluări
- Intro Química: Curso BásicoDocument4 paginiIntro Química: Curso BásicoEdson Joseph Rubio RubioÎncă nu există evaluări
- Propuesta de tratamiento del depósito de relaves de Quiulacocha-PascoDocument135 paginiPropuesta de tratamiento del depósito de relaves de Quiulacocha-PascoCarlos Guerra100% (1)
- Descripción y Análisis de Pruebas PVT PDFDocument1 paginăDescripción y Análisis de Pruebas PVT PDFGuiver Suarez V.Încă nu există evaluări
- Lab Informe 2Document15 paginiLab Informe 2Daiana ZumaetaÎncă nu există evaluări
- Solucion Del EjercicooDocument3 paginiSolucion Del EjercicooPedro Pablo OblitasÎncă nu există evaluări
- EPP Selección NormasDocument9 paginiEPP Selección NormasManuel100% (1)
- 0408 Mte Farmix FCQ - IiDocument3 pagini0408 Mte Farmix FCQ - IiAntonio TincopaÎncă nu există evaluări
- La Materia OrganicaDocument48 paginiLa Materia OrganicaAldair A. Herrera HuertaÎncă nu există evaluări
- Elaboración de Néctar de Zarzamora PDFDocument10 paginiElaboración de Néctar de Zarzamora PDFMarkey Torres Montenegro0% (1)
- PhysioEx Ejercicio 8 Actividad 3Document2 paginiPhysioEx Ejercicio 8 Actividad 3Milenka SalcedoÎncă nu există evaluări
- Taller EstequiometríaDocument1 paginăTaller EstequiometríaAna Maria AÎncă nu există evaluări
- Fibras Dietarias y Su Aplicación en El Desarrollo PDFDocument97 paginiFibras Dietarias y Su Aplicación en El Desarrollo PDFMarco Montoya JuradoÎncă nu există evaluări
- El inventor crea helado fluorescente brillanteDocument3 paginiEl inventor crea helado fluorescente brillanteYT100% (1)
- La Hoja y La FotosíntesisDocument4 paginiLa Hoja y La FotosíntesistonoperuÎncă nu există evaluări
- Relleno Doña JuanaDocument13 paginiRelleno Doña JuanaEsteban AdarveÎncă nu există evaluări
- Ejercicios Resueltos Teoria de Las Aleaciones 2014-05!10!134Document22 paginiEjercicios Resueltos Teoria de Las Aleaciones 2014-05!10!134Pablo Visaguirre100% (1)
- Determinación espectrofotométrica de cromo (VI) en muestra P-01Document3 paginiDeterminación espectrofotométrica de cromo (VI) en muestra P-01Gerry ACÎncă nu există evaluări
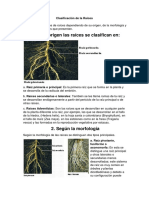
- Clasificación de La RaicesDocument7 paginiClasificación de La RaicesExcel Marroquin G.Încă nu există evaluări
- Exa 3 QM1 Julio 2022Document1 paginăExa 3 QM1 Julio 2022marcelo silvera moliÎncă nu există evaluări
- Fluidos de Corte PDFDocument3 paginiFluidos de Corte PDFCésarÎncă nu există evaluări
- Unidad 2 - MC 115 - 2020-2-Aceros AleadosDocument78 paginiUnidad 2 - MC 115 - 2020-2-Aceros AleadosCristian Junior Incacutipa PerezÎncă nu există evaluări
- Leyes de Los Gases EjerciciosDocument3 paginiLeyes de Los Gases Ejerciciosbeatrizjm9314Încă nu există evaluări
- Cotizacion Tablero General EMRDocument2 paginiCotizacion Tablero General EMRlibra4ever17Încă nu există evaluări
- Celdas de CombustibleDocument5 paginiCeldas de CombustibleGabriel Colli CabÎncă nu există evaluări
- Self-service catálogo 2015Document11 paginiSelf-service catálogo 2015klausÎncă nu există evaluări
- Ejercicio 3. Indagación, Revisión de Datos y CálculosDocument4 paginiEjercicio 3. Indagación, Revisión de Datos y CálculosAndrea Celis100% (2)
- Examen Final de Quimica 2020 Clei 6Document2 paginiExamen Final de Quimica 2020 Clei 6Yadira Valancia AlvarezÎncă nu există evaluări
- Destilación continua etanol-aguaDocument12 paginiDestilación continua etanol-aguaÁngelAlbertoGòmezSandovalÎncă nu există evaluări