Documente Academic
Documente Profesional
Documente Cultură
Transformari de Stare, Diagrame PV, Ts - Termotehnica
Încărcat de
Opris AlexandruTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Transformari de Stare, Diagrame PV, Ts - Termotehnica
Încărcat de
Opris AlexandruDrepturi de autor:
Formate disponibile
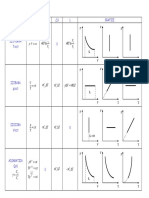
34
Termotehnica
3 TRANSFORMRI SIMPLE DE STARE A GAZELOR
n termodinamic se consider c procesele pe care le sufer agenii
termici n interiorul instalaiilor termice sunt compuse dintr-un ansamblu de
transformri termodinamice simple. Transformrile simple reprezint procese
termodinamice n cursul crora variaia parametrilor de stare se face dup o
aceeai lege, neschimbat, din starea iniial pn n cea final .
Transformrile simple de stare sunt: izocora, izobara, izoterma, adiabata i
politropa. Gazul este considerat gaz perfect.
Procesele care se desfoar n sensul de cretere a volumului se numesc
destinderi, iar cele care au loc n sensul diminurii volumului se numesc
compresiuni. n prezentarea de mai jos, diagramele sunt construite pentru un gaz
cu masa de o unitate, deci mrimile care intervin sunt mrimi specifice.
3.1.Transformarea izocor (legea lui Charles)
Transformarea izocor se desfoar la volum constant:
v=ct , deci dv=0.
Se scrie ecuaia de stare (1.4 a) pentru starea iniial 1i pentru cea final 2
ale unui gaz perfect, ntr-o transformare la volum constant. Rezult:
p1 v1 = RT1
p
p
1 = 2
p 2 v1 = RT2
T1 T2
Ecuaia transformrii izocore:
p
(3.1)
= ct
T
T
p
p2
T2
v1=v2=ct
v=ct
T1
p1
v1
a)
s1
s2
b)
Fig. 3.1 Reprezentarea transformrii izocore
a)Diagrama mecanic; b)Diagrama caloric
Reprezentarea transformrii izocore n diagrama p-v este un segment de
dreapt perpendicular pe axa volumelor (fig.3.1a).
Lucrul mecanic schimbat cu mediul exterior este nul, deoarece volumul
rmne constant:
Termotehnica
35
2
l12 = pdv = 0
(3.2)
Schimbul de cldur ntre sistem i mediul exterior n timpul transformrii
izocore:
[J/kg]
(3.3)
q12 = u 2 u1 + l12 = cv (T2 T1 ) ;
Dac q12 >0, ceea ce implic T2 > T1 nseamn c gazul primete cldur
n timpul transformrii, de la mediul exterior . Cldura q12 este proporional cu
aria cuprins ntre curba transformrii, axa absciselor i cele dou drepte verticale
corespunztoare strii iniiale i finale reprezentate n diagrama caloric.
3.2. Transformarea izobar (legea Guy-Lussac)
Transformarea izobar se desfoar la presiune constant:
p=ct , deci dp=0.
Se scrie ecuaia de stare pentru starea iniial 1 i pentru cea final 2 ale
unui gaz perfect, ntr-o transformare la presiune constant. Rezult :
p1 v1 = RT1
v
T
1 = 1
p1 v 2 = RT2
v 2 T2
Ecuaia transformrii izobare rezult:
v
(3.4)
= ct
T
Izobara se reprezint n diagrama p-v printr-un segment de dreapt
perpendicular pe axa presiunilor (fig.3.2a). Lucrul mecanic schimbat de sistem cu
mediul exterior n timpul transformrii:
2
l 12 = pdv = p(v 2 v1 ) = R(T2 T1 )
(3.5)
[J/kg].
Lucrul mecanic este egal, n valoare absolut, cu aria dreptunghiului
mrginit de axa absciselor, izobar i perpendicularele coborte din capetele
izobarei pe axa absciselor .
Cldura schimbat cu mediul exterior:
(3.6)
[J/kg] .
q 12 = h2 h1 = c p (T2 T1 )
p
p1=p2=ct
T2
p1
p=ct
T1
v1
v2
s1
a)
b)
Fig. 3.2 Reprezentarea transformrii izobare
a)Diagrama mecanic; b)Diagrama caloric
s2
36
Termotehnica
3.3.Transformarea izoterm (legea Boyle-Mariotte)
Transformarea izoterm se desfoar la temperatur constant:
T=ct , deci dT=0.
p
1
p1
T=ct
T
T=ct
2
p2
i
v1
v2
s1
s2
a)
b)
Fig 3.3 Reprezentarea transformrii izoterme
a)Diagrama mecanic; b)Diagrama caloric
Se scrie ecuaia de stare pentru starea iniial 1 i pentru cea final 2 ale
unui gaz perfect, ntr-o transformare la temperatur constant. Rezult :
p1 v1 = RT
p 1 v1 = p 2 v 2 .
p 2 v 2 = RT
Ecuaia caracteristic a transformrii izoterme rezult:
(3.7)
pv = ct
p
T<T<T
T=ct
T=ct
T=ct
v
Fig.3.4 Reprezentarea a trei transformri izoterme oarecare
n diagrama p-v , transformarea izoterm se reprezint printr-un arc de
hiperbol echilateral (fig.3.3a). Coeficientul unghiular al tangentei la curb este:
Termotehnica
37
dp
p
= .
dv
v
Lucrul mecanic specific, schimbat cu exteriorul n timpul unei transformri
izoterme, exprimat n [J/kg]:
(3.8)
tg i =
v
dv
= p 1 v1 ln 2 = p1 v1 ln
v
v1
1
(3.9) l 12 = pdv = p1 v1
1
p1
v
= RT ln 2 = RT ln
p2
v1
p2
p1
n diagrama p-v, lucrul mecanic specific este proporional cu aria
suprafeei determinat de axa absciselor, curba izotermic i ordonatele extreme.
Schimbul de cldur se deduce din expresia primului principiu :
du = q pdv
i din ecuaia caloric pentru gaze perfecte :
du = c v dT .
Pentru transformarea izoterm, dT=0, rezult:
q = pdv; deci
(3.10)
q12 = l12 [J/kg]
n cazul transformrii izotermice a unui gaz perfect, cantitatea de cldur
schimbat cu mediul exterior (absorbit sau evacuat) se transform integral n
lucru mecanic.
Teoretic, viteza de desfurare a unui proces izoterm este infinit. n
practic, nu exist procese izoterme, deoarece viteza de desfurare a proceselor
este finit. Se pot considera izoterme acele transformri care se desfoar cu
vitez foarte mic, astfel nct gazul s aib suficient timp pentru a evacua
/absorbi cldur i a-i menine temperatura constant. Apropierea proceselor
reale de caracteristicile izotermei se face, practic, prin rcirea instalaiilor n care
se produc compresiuni.
3.4.Transformarea adiabat
ntr-o transformare adiabat, agentul termic nu schimb cldur cu
exteriorul:
(q12 = 0; q = 0 ) .
Din ecuaia primului principiu al termodinamicii:
q = du + pdv
n care se nlocuiesc ecuaiile calorice ale gazelor perfecte :
du = c v dT
dh = c p dT
i tiind c entalpia elementar este:
dh = du + pdv + vdp conform relaiei de definiie (2.13b), rezult:
q = c v dT + pdv = 0
q = c p dT vdp = 0
Egalnd relaiile de mai sus:
cp
v dp
(3.11)
k=
=
cv
p dv
Rezult:
38
Termotehnica
kpdv + vdp = 0
dv dp
k
+
= 0 k ln v + ln p = ct
v
p
Se obine ecuaia caracteristic a adiabatei:
(3.12)
pv k = ct
Din ecuaia de stare (1.4a) se obine, prin derivare logaritmic:
dp dv dT
(3.13)
.
+
=
p
v
T
Se deriveaz logaritmic i ecuaia caracteristic a adiabatei (3.12)i
rezult:
dp
dv
(3.14)
+k
=0
p
v
dp dT dv
=
n ecuaia (3.14) i rezult
Se nlocuiete
p
T
v
dT
dv
+ (k 1) = 0 Tv k 1 = ct
T
v
Relaia:
(3.15)
Tv k 1 = ct
reprezint o alt form a ecuaiei de stare a adiabatei.
Eliminnd volumul ntre ecuaiile (3.12) i (3.15) se obine
T
(3.16)
= ct
k 1
p k
o a treia form a ecuaiei caracteristice a adiabatei.
p
p1
T1
s1=s2=ct
s=ct
T2
p2
a
v1
v2
s1
a)
b)
Fig. 3.5 Reprezentarea transformrii adiabate
a)Diagrama mecanic; b)Diagrama caloric
Termotehnica
39
n diagrama p-v , adiabata se reprezint (fig.3.5a) printr-un arc de
hiperbol, care are o pant mai mare dect izoterma (relaia 3.8). Panta
adiabatei este dat de relaia:
dp
p
(3.17)
tg a =
= k
dv
v
Lucrul mecanic schimbat de sistem cu mediul exterior, n timpul
transformrii adiabate este :
2
l 12 = pdv
1
Din expresia principiului nti:
du = q pdv rezult:
(3.18)
l = du
i , deci:
[J/kg].
(3.19)
l 12 = c v (T1 T2 )
n concluzie, ntr-o destindere adiabat, lucrul mecanic se efectueaz pe
seama reducerii energiei interne a gazului. ntr-o compresiune adiabat, lucrul
mecanic primit din exterior se transform integral n energie intern. Expresia
lucrului mecanic se mai poate deduce :
2
l 12 = pdv unde pv k = p 1 v1k = p 2 v 2k = ct
1
2 dv
v 1 k v11 k
p v p2 v2
= p1v1 k 2
= 1 1
=
l12 = p1v1k
k
1 k
k 1
1v
(3.20)
RT1 RT2
p1v1
=
=
1
k 1
k 1
p2
p1
k 1
k
n practic, transformrile care pot fi considerate adiabatice sunt acele
transformri care se desfoar cu viteze mari, astfel nct gazul s nu aib timp
s schimbe cldur cu mediul.
3.5 Transformarea politropic
Transformarea politropic reprezint o transformare de stare general, care
definete procesele termodinamice n cursul crora agentul termic schimb
energie sub form de cldur i lucru mecanic cu mediul exterior i n care se
modific toi parametrii de stare p,v,T.
n practic, destinderea sau comprimarea gazelor nu se poate realiza n
mod riguros adiabatic i nici izotermic. n procesele reale, schimbul de cldur
dintre agentul termic i mediu nu poate fi mpiedicat complet, pentru o izolare
adiabatic, dup cum nu poate fi nici intensificat att de mult nct temperatura
agentului s se menin constant n timpul procesului termodinamic. Procesele
reale de comprimare sau destindere din instalaiile termice pot fi considerate
transformri politropice.
Transformarea politropic poate fi definit printr-o lege de variaie a
presiunii i volumului de forma:
40
Termotehnica
pv n = ct , n care n [ ,+ ] reprezint exponentul politropic.
Formulele de calcul stabilite pentru transformarea adiabatic, se pot folosi
pentru transformarea politropic nlocuind exponentul adiabatic, k, prin
exponentul politropic, n :
(3.21)
(3.22)
(3.23)
Tv n 1 = ct
T
= ct
n 1
p n
Forma curbei politropice n digrama p-v este de hiperbol . n
termodinamic, prezint interes transformrile politropice care au exponentul
cuprins n domeniul 1<n<k.
Lucrul mecanic al transformrii politropice va fi:
n 1
p 1 v1 p 2 v 2 R(T1 T2 ) p 1 v1 p 2 n
(3.24) l 12 =
=
=
1
n 1
n 1
n 1 p 1
exprimat n [J/kg]
Cldura unitar schimbat ntre sistem i mediu:
(3.25)
q = c n dT sau, prin integrare:
(3.26)
[J/kg]
q 12 = c n (T2 T1 )
unde cn-reprezint cldura specific politropic, J (kgK ) .
Cldura specific politropic se deduce pornind de la expresia primului
principiu al termodinamicii, scris pentru un sistem nchis:
du = q pdv = q l
n care se nlocuiesc ecuaiile calorice de stare precum i relaia lucrului mecanic
elementar dedus din forma (3.22) a ecuaiei caracteristice a politropei:
du = c v dT
q = c n dT
l = p dv =
pv dT
RdT
=
(n 1)T
n 1
unde R = c p c v , J (kgK )
Se obine:
nc v c p
J
(3.27)
,
cn =
(kgK )
n1
Cldura schimbat se mai poate, deci, calcula cu relaia:
nk
J
(3.28)
q 12 =
c v (T2 T1 ) ,
kg
n 1
Transformarea politropic reprezint un proces termodinamic general.
Particulariznd valorile exponentului n n ecuaia (3.21), se pot obine celelalte
transformri termodinamice simple ale gazelor perfecte
-izobar
n = 0 ; p = ct ; c n = c p
n = 1; pv = ct ; c n =
-izoterm
Termotehnica
41
n = k ; pv k = ct ; c n = 0
-adiabat
-izocor
n = ; v = ct ; c n = c v
n fig.3.6 s-a reprezentat transformarea politropic pentru diferite valori
particulre ale exponentului politropic n. Se observ c, pe aceleai axe de
coordonate au fost trasate curbele caracteristice pentru izobar, izoterm, adiabat
i izocor, alturi de dou politrope, n > k i 1 < n < k .
p
n=0
n=1
n=
1<n<k
n=k
n>k
v
Fig.3.6 Reprezentarea politropei n diagram mecanic
ntrebri test
1.Izocora este transformarea de stare care se reprezint n coordonate p-v prin:
a) o perpendicular pe axa volumului specific, v;..................................................
a)
b) o paralel la axa volumului specific, v;
c) o perpendicular la axa presiunilor, p.
b) c)
2.Care dintre relaiile urmtoare reprezint legea unei transformri simple de stare:.........
n
a) p v = ct ;
b) p T = ct ;
c) p v = ct
a) b) c)
3.Intr-o destindere adiabatic a unui gaz, lucrul mecanic se efectueaz pe seama:
a)reducerii energiei interne a gazului;......................................................................
a) b) c)
b)creterii energiei interne a gazului;
c)reducerii entropiei gazului.
4.ntr-o transformare izoterm a unui gaz perfect, lucrul mecanic primit de sistem:
a)are valoare negativ;........................................................................................
a) b) c)
b)se regsete n variaia energiei interne;
c)se transform integral n cldur.
5.Lucrul mecanic efectuat de un sistem termodinamic n timpul unui proces de destindere, din
starea 1 n starea 2, este proporional cu aria haurat n figura:......................................
a) b) c)
2
p
1
v
a)
b)
v
c)
42
Termotehnica
6 n practic, transformrile care pot fi considerate izoterme sunt cele care se desfoar cu viteze:
a)mari, astfel nct cldura s poat fi schimbat cu exteriorul;..............................
a) b) c)
b)mici, astfel nct cldura s poat fi schimbat cu exteriorul;
c)oarecare, iar sistemul este rcit n mod adecvat.
7.Intr-o destindere izoterma a unui gaz, lucrul mecanic se efectueaz pe seama:
a)reducerii energiei interne a gazului;................................................................
b)caldurii introduse din exterior;
a)
c)caldurii evacuate n exterior.
b) c)
8 n practic, transformrile care pot fi considerate adiabatice sunt cele care se desfoar cu
viteze:
a)mici, astfel nct cldura s poat fi schimbat cu exteriorul;........................
a) b) c)
b)mari, astfel nct cldura s poat fi schimbat cu exteriorul;
c)mari, astfel nct sistemul s nu aib timp s schimbe cldur cu exteriorul.
Problema 3.1
3.1.Un kilogram dintr-un gaz perfect, cu constanta R = 300 J
kg K
de la starea 1, caracterizat prin parametrii p1 = 6 bar i v1 = 0 ,25 m
, se destinde
3
, pn la
kg
starea 2, la care volumul specific este de 2,5 ori mai mare. Procesul de destindere
este politropic, cu exponentul n = 1,5 . S se calculeze:
a)lucrul mecanic schimbat de sistem cu exteriorul, n procesul politropic 1-2;
b)cldura schimbat de sistem cu mediul, n acest proces, dac se cunosc
exponentul adiabatic k = 1,41 i cldura specific sub volum constant
.
cv = 0 ,7 kJ
kg k
Rezolvare
Masa gazului fiind unitar, volumul total coincide cu cel specific V = v .
Transformarea politropic are legea p v n = ct . nseamn c, pentru strile
iniial i final se poate scrie egalitatea:
p,
p1 v1n = p 2 v 2n
[bar]
Presiunea dup destindere rezult:
n
v
p 2 = p1 1
v2
Dar v 2 = 2 ,5v1 , deci presiunea p2 va fi:
1
p 2 = 6 10
2 ,5
5
1,5
1,518
= 1,518bar
la volumul specific v2 = 2 ,5 0 ,25 = 0 ,625 m
0,25
kg
0,625
v,
[m3/kg]
Fig. 3.1.Destindere politropic, n=1,5
Termotehnica
43
Lucrul mecanic:
2
L12 = l12 = p1 v1
1
dv
v
= p1v1
v
1
dv = p1v1
1
v 2n+1 v1n+1 =
n+1
1
0 ,625 1,5+1 0 ,25 1,5+1 = 1,102 10 5 J
kg
1,5 + 1
are valoare pozitiv, deci este efectuat de ctre sistem n exterior.
= 6 10 5 0 ,25 1,5
b)Cldura schimbat cu mediul exterior este:
Q12 = q12 = c n (T2 T1 )
unde cldura specific politropic, cn, se calculeaz cu relaia:
nk
1,5 1,41
c n = cv
= 700
= 126 J
kg K
n1
1,5 1
iar temperaturile se afl din ecuaia termic de stare:
p v
6 10 5 0 ,25
T1 = 1 1 =
= 500 K
R
300
p v
1,518 10 5 0 ,625
T2 = 2 2 =
= 316 ,25 K
R
300
Rezult
q12 = 126 (316 ,25 500 ) = 23152 ,5 J
kg
Observaie. Valoarea obinut este negativ, deci sistemul a cedat cldur
mediului, n timpul destinderii.
Probleme propuse
3.2.Aerul din interiorul unui cilindru cu piston sufer o expansiune de la volumul
3
3
specific v1 = 0 ,8 m
la presiunea
, pn la volumul specific v2 = 1,8 m
kg
kg
, precum i
constant p = 1bar . Cunoscnd constanta aerului R = 0 ,287 kJ
kg K
cldura specific izobar, c p = 1,01 kJ
, s se determine:
kg K
a)lucrul mecanic specific schimbat de sistem cu mediul exterior,
b)cldura unitar schimbat de sistem cu mediul exterior,n timpul
evoluiei din starea 1 n starea 2.
3.3.Considernd aceeai evoluie a aerului ca n problema 3.2., s se determine
variaia energiei interne specifice i variaia entalpiei specifice ntre strile 1 i 2.
3.4.O butelie metalic nchis, cu capacitatea de 40 de litri este plin cu oxigen.
Presiunea
Oxigenul se consider gaz perfect, cu constanta R = 259 ,84 J
kg K .
din butelie este de 150 bar, la temperatura de 288 K. Butelia este mutat ntr-un
mediu ambiant cu temperatura de 25oC. S se afle prin ce proces termodinamic
simplu trece oxigenul din butelie, pn n momentul n care temperatura din
butelie este egal cu cea a mediului ambiant. S se determine schimbul de lucru
44
Termotehnica
mecanic i de cldur cu exteriorul. Se cunoate cldura specific la presiune
.
constant, pentru oxigen, c p = 908 ,4 J
kg K
3.5.ntr-un cilindru cu piston, se afl aer la presiunea p1 = 1,2bar i volumul
specific v1 = 1250 dm
. Constanta aerului este R = 287 ,13 J
Pistonul se
kg
kg K .
deplaseaz n sensul comprimrii aerului, pn cnd presiunea atinge valoarea
p 2 = 5bar . Micarea se desfoar att de ncet, nct transformarea se poate
considera izoterm. Se cere s se afle:
a)temperatura la care se desfoar procesul;
b)lucrul mecanic specific schimbat de sistem cu exteriorul;
c)cldura unitar schimbat de sistem cu exteriorul;
d)variaia entalpiei sistemului, ntre cele dou stri de echilibru.
RSPUNSURI I REZOLVRI
ntrebri test
1.a; 2.a,c; 3.a; 4.a,c; 5.c; 6.b,c; 7.b; 8.c.
Probleme
3.2. Rezolvare
Procesul izobar este reprezentat grafic n figura 3.1.
p
p1=p2=ct
p1
v1
v2
Fig.3.2.Expansiune izobar
a)Lucrul mecanic specific se calculeaz cu relaia:
2
l12 = p dv = p dv = p (v 2 v1 ) = 1 10 5 (1,8 0 ,8 ) = 10 5 J
kg
Lucrul mecanic a rezultat pozitiv, deci, conform conveniei pentru semne, el
este efectuat de ctre sistem n exterior.
b)Cldura unitar se calculeaz cu ajutorul ecuaiei calorice, care pentru un
proces izobar devine:
q12 = c p (T2 T1 )
Termotehnica
45
Temperaturile T1 iT2 se pot afla aplicnd ecuaia de stare pentru starea 1,
respectiv starea2:
p v
1 10 5 0 ,8
T1 = 1 1 =
= 278 ,6 K
R
287 ,13
p v
1 10 5 1,8
T2 = 2 2 =
= 626 ,89 K
R
287 ,13
q12 = 1,01 10 3 (626 ,89 278 ,6 ) = 351783 J
= 351,783 kJ
kg
kg
Cldura are valoare pozitiv, deci, conform conveniei semnelor, cldura aceasta
este primit de sistem din mediul exterior.
3.3.
Rezolvare
Expresia primului principiu al termodinamicii, scris pentru mas unitar a
agentului termic (aerul, n acest caz):
q12 = u 2 u1 + l12
ne d posibilitatea s calculm variaia energiei interne.
u = u 2 u1 = q12 l12 = 351783 100000 = 251783 J
kg
Relaia dintre variaia entalpiei i variaia energiei interne (vezi problema 2.2)
este: h = k u
Coeficientul adiabatic k se obine din relaia:
cp
cp
1010
k=
=
=
= 1,41
cv c p R 1010 287 ,13
n care s-a utilizat relaia lui Mayer:
c p = R + cv
Variaia entalpiei rezult:
h = 1,41 251783 = 352496 ,2 J
kg
3.4. Rezolvare
Butelia fiind un sistem nchis, rigid, procesul suferit de oxigenul din interior se
desfoar la volum constant (transformare izocor). Se observ imediat c lucrul
mecanic este nul, deoarece volumul nu variaz.
Cldura schimbat cu exteriorul este dat de relaia:
Q12 = m cv T = m cv (T2 T1 )
Masa oxigenului se poate calcula din ecuaia de stare scris pentru starea
iniial a sistemului, pentru care se cunosc parametrii:
p V
150 10 5 40 10 3
p1 V1 = m R T1 rezult m = 1 1 =
= 8 ,017 kg
RT1
259 ,84 288
Cldura specific sub volum constant se deduce din relaia lui Mayer:
cv + R = c p rezult
cv = c p R = 908 ,4 259 ,84 = 648 ,56 J
kg K
Temperatura final este cea a mediului ambiant:
T2 = 273 ,15 + 25 = 288 ,15 K
Cldura schimbat cu mediul va fi:
46
Termotehnica
Q12 = 8 ,017 648 ,56 (298 288 ,15 ) = 51,215 kJ
Observaie. Cldura este primit de ctre sistem, deoarece valoarea sa este
pozitiv. Conform principiului I al termodinamicii, n cazul unei transformri
izocore, cldura primit de sistem se transform integral n energie intern,
deoarece lucrul mecanic este nul.
3.5.
Rezolvare
a)Ecuaia de stare scris pentru starea iniial permite calculul temperaturii la care
se desfoar procesul:
p v
1,2 10 5 1,25
T= 1 1 =
= 522 ,4 K
R
287 ,13
p, [bar]
2
5
p
1,2
v2
1,25
v, [m3/kg]
Fig.3.5 Reprezentarea unui proces izoterm: curba este o hiperbol echilater
b)Legea transformrii izoterme conduce la egalitatea:
p1 v1 = p 2 v 2 din care rezult
v2 =
1,2 10 5 1,25
= 0 ,3 m
kg
5 10 5
Lucrul mecanic specific va fi:
2
v
dv
= p1 v1 (ln v2 ln v1 ) = p1 v1 ln 2
v
v1
1
1
(unde presiunea s-a exprimat ca funcie de volum, folosind legea izotermei scris
1
pentru starea iniial i pentru o stare intermediar oarecare: p = p1 v1 )
v
Rezult
0 ,3
l12 = 1,2 10 5 1,25 ln
= 214067 ,5 J
kg
1,25
Lucrul mecanic specific este negativ, ceea ce nseamn c sistemul a primit acest
lucru mecanic din exterior.
l12 = p dv = p1 v1
c)n relaia primului principiu al termodinamicii, scris pentru sisteme nchise:
q12 = u + l12
variaia energiei interne se anuleaz deoarece temperatura sistemului a rmas
aceeai n timpul transformrii. Deci,
Termotehnica
q12 = l12 = 214067 ,5 J
47
kg
d)Variaia entalpiei, ca i a energiei interne este nul:
h = k u = 0
Observaie ntr-o transformare izoterm, att energia intern, ct i entalpia
rmn constante.
S-ar putea să vă placă și
- Termodinamica Pentru BacalaureatDocument12 paginiTermodinamica Pentru Bacalaureationcazacu100% (4)
- Transformari de Stare Ale Gazului PerfectDocument8 paginiTransformari de Stare Ale Gazului PerfectZavturCorneliuÎncă nu există evaluări
- Combinatorica PDFDocument10 paginiCombinatorica PDFdumitruionutandrei100% (3)
- Fizica - CLS A Xi-ADocument30 paginiFizica - CLS A Xi-ANicoleta Draguleasa JitianuÎncă nu există evaluări
- Tabel Formule TermoDocument2 paginiTabel Formule TermoAndreea LilianaÎncă nu există evaluări
- Circuite de Curent Alternativ - Lista de Texte PDFDocument8 paginiCircuite de Curent Alternativ - Lista de Texte PDFHuzumÎncă nu există evaluări
- Barem Bac Mate-Info Simulare Bucuresti 1 Februarie 2013 PDFDocument2 paginiBarem Bac Mate-Info Simulare Bucuresti 1 Februarie 2013 PDFAnonymous j9sTxpVRÎncă nu există evaluări
- Relatia R.MayerDocument2 paginiRelatia R.MayerAnonymous ByZYdUU39RÎncă nu există evaluări
- Gruparea Rezistoarelor ProblemeDocument2 paginiGruparea Rezistoarelor ProblemeSzekely Daniela100% (2)
- Forte Conservative Energia PotentialaDocument11 paginiForte Conservative Energia PotentialaCos_sensÎncă nu există evaluări
- Termodinamica Bac TeorieDocument7 paginiTermodinamica Bac TeorieCarlissyaÎncă nu există evaluări
- Determinarea Convergentei Unei Lentile Folosind Formula Fundamentala A Lentilelor SubtiriDocument4 paginiDeterminarea Convergentei Unei Lentile Folosind Formula Fundamentala A Lentilelor SubtiriSandu ValentinaÎncă nu există evaluări
- Proprietățile LogaritmilorDocument14 paginiProprietățile LogaritmilormonicaÎncă nu există evaluări
- Derivate Functii CompuseDocument2 paginiDerivate Functii CompuseGabriel Marinică100% (1)
- Moleculara 04Document24 paginiMoleculara 04anitarazÎncă nu există evaluări
- Calculul Matricei InverseDocument4 paginiCalculul Matricei InversechircuÎncă nu există evaluări
- Grile Recursivitate1Document24 paginiGrile Recursivitate1Gina CrihanăÎncă nu există evaluări
- Disocierea MoleculelorDocument2 paginiDisocierea MoleculelorAdina LicsorÎncă nu există evaluări
- Probleme Analiza Dimensionala PDFDocument9 paginiProbleme Analiza Dimensionala PDFDenisa ZahariaÎncă nu există evaluări
- 2007 Barem Informatica 45Document1 pagină2007 Barem Informatica 45Emanuel IacobÎncă nu există evaluări
- Sisteme Inertiale Si Neinetiale - Ppt.ppsDocument19 paginiSisteme Inertiale Si Neinetiale - Ppt.ppsLiliana Balan50% (2)
- Termodinamica Formule GraficeDocument2 paginiTermodinamica Formule GraficeJohn GrosuÎncă nu există evaluări
- Derivate Functii ElementareDocument2 paginiDerivate Functii Elementaren_costiqueÎncă nu există evaluări
- Poluarea LuminoasaDocument6 paginiPoluarea Luminoasaanghelmariana17Încă nu există evaluări
- Rezolvari Variante Curent Continuu 1-100Document100 paginiRezolvari Variante Curent Continuu 1-100Tanase Mihai100% (7)
- Pile ElectriceDocument4 paginiPile ElectriceAruxandei Cosmin50% (2)
- E F Fizica Termodinamica2009Document100 paginiE F Fizica Termodinamica2009Andreea Radici84% (25)
- Curs Termo 5-6Document8 paginiCurs Termo 5-6Niculinho NicushorÎncă nu există evaluări
- Curs 4 Termo 21-22-4Document9 paginiCurs 4 Termo 21-22-4Lorena ionelaÎncă nu există evaluări
- Probleme FizicaDocument10 paginiProbleme FizicaVoicu RaduÎncă nu există evaluări
- Termodinamica p1 Adnotari FinalDocument21 paginiTermodinamica p1 Adnotari FinalIonuț CarpÎncă nu există evaluări
- Curs 4 TermodinamicaDocument6 paginiCurs 4 TermodinamicaPara CataÎncă nu există evaluări
- Principiul II Al TermodinamiciiDocument12 paginiPrincipiul II Al Termodinamiciicos2inÎncă nu există evaluări
- Consideratii Privind Marirea Preciziei de Calcul Pentru Transformarile Care Stau La Baza Aprecierii Performantelor La Cazanelor Si Turbinelor Cu AburDocument6 paginiConsideratii Privind Marirea Preciziei de Calcul Pentru Transformarile Care Stau La Baza Aprecierii Performantelor La Cazanelor Si Turbinelor Cu AburConstantin CHIPERÎncă nu există evaluări
- Cap B5 TransformariDocument23 paginiCap B5 TransformariGmd28Încă nu există evaluări
- Aplicatii Transformari de StareDocument21 paginiAplicatii Transformari de StareGeorge Manuel CorneaÎncă nu există evaluări
- TermodinamicăDocument8 paginiTermodinamicăIlie Andrei75% (4)
- Mecanica Fluidelor Capitol 2Document65 paginiMecanica Fluidelor Capitol 2Liviu PascanÎncă nu există evaluări
- Lucrare Practică NR 4Document10 paginiLucrare Practică NR 4Andreea Cvl.Încă nu există evaluări
- Principiul Al Doilea A TermodinamiciiDocument13 paginiPrincipiul Al Doilea A TermodinamiciiIlie_Andreea100% (1)
- TermodinamicăDocument10 paginiTermodinamicăAndreea AntonÎncă nu există evaluări
- TermotehnicaDocument54 paginiTermotehnicaMarianÎncă nu există evaluări
- 7-2 Termodinamica ProblemeDocument11 pagini7-2 Termodinamica ProblemeDana MargaritÎncă nu există evaluări
- Transformarea Politropă A Gazului IdealDocument2 paginiTransformarea Politropă A Gazului IdealLeonard Savu86% (7)
- Probleme de TermodinamicaDocument4 paginiProbleme de Termodinamicamyaaa94Încă nu există evaluări
- Functii Termodinamice - Tranzitii de FazaDocument10 paginiFunctii Termodinamice - Tranzitii de FazanicolaemariusÎncă nu există evaluări
- Exercitii TermotehnicaDocument4 paginiExercitii TermotehnicaFlorentina ZalinschiÎncă nu există evaluări
- Cap 3 Gaze IdealeDocument26 paginiCap 3 Gaze IdealeSOrinÎncă nu există evaluări
- Schimbator de Caldura - LaboratorDocument7 paginiSchimbator de Caldura - LaboratorSorinel SorinÎncă nu există evaluări
- Instalatii Rezolvare ProblemeDocument6 paginiInstalatii Rezolvare ProblemekiradavidÎncă nu există evaluări
- ProblemeDocument6 paginiProblemeJohn SmithÎncă nu există evaluări
- ProblemeDocument8 paginiProblemeandrei1108Încă nu există evaluări
- TermodinamicaDocument14 paginiTermodinamicaAndrei ValeanuÎncă nu există evaluări
- Tema Seminar 31Document20 paginiTema Seminar 31niccolas2002Încă nu există evaluări
- Curs 4 CIFDocument8 paginiCurs 4 CIFesfirÎncă nu există evaluări
- Transformari TermotehnicaDocument3 paginiTransformari TermotehnicaMeca CosminÎncă nu există evaluări
- FizicaDocument15 paginiFizicakhrys32Încă nu există evaluări
- Aplicatii Principiul 1Document11 paginiAplicatii Principiul 1mariaalexandra ciutaÎncă nu există evaluări
- Aplicatii Rezolvate2Document8 paginiAplicatii Rezolvate2Mitulescu BogdanÎncă nu există evaluări
- Instalatii de Frig Si ClimatizareDocument71 paginiInstalatii de Frig Si ClimatizareLaurentiu RosuÎncă nu există evaluări
- Cursuri Lucrare 1Document54 paginiCursuri Lucrare 1Opris AlexandruÎncă nu există evaluări
- Mihai Eminescu - DespartireDocument2 paginiMihai Eminescu - DespartirenenapsxÎncă nu există evaluări
- Mihai Eminescu - de Ce Nu-Mi Vii....Document2 paginiMihai Eminescu - de Ce Nu-Mi Vii....Opris AlexandruÎncă nu există evaluări
- Mihai Eminescu - Atat de FragedaDocument2 paginiMihai Eminescu - Atat de FragedaOpris AlexandruÎncă nu există evaluări
- Povestea Lui Harap Alb - RezumatDocument1 paginăPovestea Lui Harap Alb - RezumatOpris AlexandruÎncă nu există evaluări
- Mihai Eminescu - de Cate Ori Iubito....Document1 paginăMihai Eminescu - de Cate Ori Iubito....Opris AlexandruÎncă nu există evaluări
- Mihai Eminescu - De-Or Trece Anii...Document1 paginăMihai Eminescu - De-Or Trece Anii...Opris AlexandruÎncă nu există evaluări
- Mihai Eminescu - Craiasa Din PovestiDocument1 paginăMihai Eminescu - Craiasa Din PovestiOpris AlexandruÎncă nu există evaluări
- Mihai Eminescu - Ce Te Legeni Codrule ....Document1 paginăMihai Eminescu - Ce Te Legeni Codrule ....Opris Alexandru100% (1)
- Mihai Eminescu - De-Or Trece Anii...Document1 paginăMihai Eminescu - De-Or Trece Anii...Opris AlexandruÎncă nu există evaluări
- La Argeş - Mateiu Ion CaragialeDocument1 paginăLa Argeş - Mateiu Ion CaragialeOpris AlexandruÎncă nu există evaluări
- Vasile Alecsandri - StelutaDocument2 paginiVasile Alecsandri - Stelutageraldine mouseÎncă nu există evaluări
- Carte Catia v5 Exemple PracticeDocument72 paginiCarte Catia v5 Exemple PracticeClaudiu Class75% (4)
- Arghezi Flori de MucigaiDocument1 paginăArghezi Flori de Mucigaimalone6x6Încă nu există evaluări
- Grădinele Amăgirii - Mateiu Ion CaragialeDocument1 paginăGrădinele Amăgirii - Mateiu Ion CaragialeOpris AlexandruÎncă nu există evaluări
- Fa4 PDFDocument12 paginiFa4 PDFOpris AlexandruÎncă nu există evaluări
- Arghezi Flori de MucigaiDocument1 paginăArghezi Flori de Mucigaimalone6x6Încă nu există evaluări
- Mihai Eminescu - Ce Te Legeni CodruleDocument1 paginăMihai Eminescu - Ce Te Legeni CodruleOpris AlexandruÎncă nu există evaluări
- FA2Document16 paginiFA2OnelIulianÎncă nu există evaluări
- Luceafarul de M. EminescuDocument2 paginiLuceafarul de M. EminescuAlex PascariuÎncă nu există evaluări
- Aplicatii Bazele TermodinamiciiDocument7 paginiAplicatii Bazele TermodinamiciiAlin WhiskeyÎncă nu există evaluări
- George Cosbuc - Noi Vrem PamantDocument2 paginiGeorge Cosbuc - Noi Vrem PamantOpris AlexandruÎncă nu există evaluări
- Transformari de Stare, Diagrame PV, Ts - TermotehnicaDocument14 paginiTransformari de Stare, Diagrame PV, Ts - TermotehnicaOpris AlexandruÎncă nu există evaluări
- Fa3 PDFDocument20 paginiFa3 PDFOpris AlexandruÎncă nu există evaluări
- MAE Transformatorul2014Document60 paginiMAE Transformatorul2014George SorinÎncă nu există evaluări
- Fa5 PDFDocument16 paginiFa5 PDFOpris AlexandruÎncă nu există evaluări
- FA1Document38 paginiFA1Andreea Diana UngureanuÎncă nu există evaluări
- Fa6 PDFDocument8 paginiFa6 PDFOpris AlexandruÎncă nu există evaluări
- Fisa de InscriereDocument1 paginăFisa de InscriereOpris AlexandruÎncă nu există evaluări