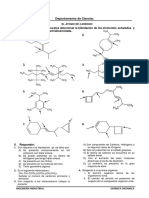
Documente Academic
Documente Profesional
Documente Cultură
Diagrama de Solubilidad Final 1
Încărcat de
pamela182212Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Diagrama de Solubilidad Final 1
Încărcat de
pamela182212Drepturi de autor:
Formate disponibile
MIER11 LFQ I - C-D
(MI: Mircoles, 11: once horas, LFQI: Laboratorio de Fisicoqumica I-C,D: Grupo)
UNIVERSIDAD NACIONAL MAYOR DE SAN
MARCOS
FACULTAD DE QUIMICA E INGENIERIA QUIMICA
DEPARTAMENTO ACADEMICO DE FISICOQUIMICA
TEMA
PROFESOR
ALUMNOS
DIAGRAMA DE SOLUBILIDAD
ING. YARANGO ROJAS,
ALEJANDRO
CRUCES MALDONADO,
STEPHANY
CUENTAS LARRAURI, FABIOLA
MENDO SALAZAR, CARLOS
TAFUR VILLA, LUIS
LABORATORIO DE FISICOQUIMICA I
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 2
Marcos
Diagrama de solubilidad
FECHA DE
REALIZADO
FECHA DE
ENTREGA
04-11-15
11-11-15
Cuidad Universitaria
TABLA DE CONTENIDO
1. RESUMEN..........................................................................................3
2. INTRODUCCION................................................................................4
3. PRINCIPIOS TEORICOS......................................................................5
4. PROCEDIMIENTO EXPERIMENTAL......................................................8
5. TABLAS DE DATOS..........................................................................10
6. EJEMPLO DE CALCULOS..................................................................14
6.1.........Clculo del porcentaje de cada componente en las mezclas14
6.2.........................Ttulo en gramo del cido actico por ml deNaOH15
6.3. Composicin global de la
mezcla..15
6.4. Determinacin de los porcentajes en peso del cido actico para la
determinacin de la lnea de
reparto
..16
7. ANALISIS Y DISCUSIN DE RESULTADOS........................................17
8. CONCLUSIONES..............................................................................18
9. RECOMENDACIONES.......................................................................19
10. BIBLIOGRAFIA...............................................................................19
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 3
Marcos
Diagrama de solubilidad
11.APENDICE......................................................................................20
11.1. CUESTIONARIO.......................................................................20
11.2. GRFICAS................................................................................22
1. RESUMEN
Esta prctica abarcara las relaciones de solubilidad del sistema de
tres componentes como lo son el N-Butanol - cido actico - agua, se
traz el diagrama de equilibrio y se construy la curva de solubilidad
(binodal) para una temperatura dada, luego se traz la lnea de
reparto y por ltimo se determin las composiciones en peso de cada
solucin.
La presente prctica experimental se realiz a condiciones de
laboratorio de 22C
de temperatura, 756 mmHg de presin
atmosfrica y 92% de humedad relativa.
El procedimiento experimental a llevarse a cabo para lograr cumplir
los objetivos anteriormente planteados se dividen en dos partes, la
primera parte, para la construccin de la curva binodal, se preparan 4
soluciones que contenan 10-15-20-25 % de cido actico en agua y
se titul con N-Butanol, luego se prepararon 4 soluciones que
contenan 10-20-30-40% de cido actico en N-Butanol y se titul con
agua, a partir del punto final de la titulacin se calcul cada una de
las composiciones en peso de cada solucin, con ellas se traz la
curva de solubilidad. La segunda parte se prepar una mezcla con
cantidades conocidas de N-Butanol, cido actico y agua, en una pera
de decantacin, se separ las capas formadas, a continuacin se
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 4
Marcos
Diagrama de solubilidad
tomara una muestra de cada disolucin y se titul con hidrxido de
sodio. Con el porcentaje en peso de cido actico de cada fase se
proyectan las lneas de unin del sistema, que es la lnea de reparto.
Los diagramas de lquidos ternarios son de considerable valor en
problemas de separacin y extraccin con solventes y gracias a ellos
es posible deducir si la separacin buscada puede realizarse y en
cuales condiciones de operacin para lograr resultados ptimos.
2. INTRODUCCIN
A lo largo de nuestra carrera de ingeniera qumica, trabajamos con
muchas soluciones principalmente puras como el agua o con
sistemas de dos compuestos que a simple vista parecieran uno por la
solubilidad entre ellos, pero nos hemos preguntado: Si agregamos un
tercer componente, hasta qu punto es soluble en un sistema de
otros dos componentes? De forma grfica el laboratorio N10 de
fisicoqumica: diagrama de solubilidad, nos describir estas
situaciones para sistemas de 3 componentes y sus relaciones entre
ellos.
Los diagramas temarios son la representacin grfica de las posibles
relaciones o combinaciones entre tres elementos. Indican la
distribucin de tres componentes diferentes y consisten en la unin
de tres diagramas binarios en los que las variables se repiten dos a
dos. Permiten trabajar con dos tipos de condiciones entre las
variables: condiciones de proporcin y condiciones de relacin. Esto
repercute en el tipo de lneas que configuran el grfico.
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 5
Marcos
Diagrama de solubilidad
Los equilibrios de solubilidad poseen gran importancia en la qumica.
Permiten resolver problemas como en la recuperacin de sustancias
muy caras que estn disueltas, la deteccin y eliminacin de las
disoluciones de iones txicos para los organismos vivos, la formacin
de cavernas de piedra caliza el ablandamiento del agua dura la
formacin de clculos renales o de las caries dentales.
El siguiente informe explicar cmo mediante una serie de
procedimientos experimentales, nos darn datos que emplearemos
para los clculos y la posterior grfica resultante.
3. PRINCIPIOS TERICOS
Solubilidad: Es la capacidad de dos o ms sustancias para formar
espontneamente y sin reaccin qumica, una dispersin homognea,
molecular o coloidal.
Fase: En termodinmica y qumica, se denomina fase (del latn phase:
partes o fase) a cada una de las partes macroscpicas de una
composicin qumica y propiedades fsicas homogneas que forman un
sistema.
Sistema de tres componentes:
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 6
Marcos
Diagrama de solubilidad
Las relaciones de solubilidad de un sistema de tres componentes, se
representan fcilmente en un diagrama de tringulo equiltero, ya que
en l se puede plotear el % de cada componente en la misma escala.
Diagrama ternario: Un diagrama ternario es la representacin grfica
del comportamiento de una propiedad caracterstica con relacin a la
composicin de un sistema de tres o multicomponente, generalmente a
presin y temperatura constantes. En esta representacin de tringulo
equiltero, cada vrtice A, B o C es un componente puro; en algunos
casos puede indicar la relacin constante de dos componentes. La
escala que recorre cada uno de los lados del tringulo seala la fraccin
porcentual entre los componentes del sistema binario correspondiente.
En la figura 1(vase Apndice), los vrtices A, B y C indican el 100 % de
cada componente. La trayectoria AB indica que la proporcin del
componente A disminuye mientras que la de B aumenta. De forma
anloga, la trayectoria BC muestra que la sustancia B disminuye y C
aumenta. La trayectoria CA indica un aumento del componente A o la
disminucin del componente C. Cualquier punto al interior del diagrama
representa la composicin global del sistema ternario, donde la suma de
las fracciones de los componentes est acotada por la siguiente
ecuacin:
xA + xB + xC = 1
(1)
En donde la composicin, expresada en moles, masa o volumen de cada
componente, se denota en trminos porcentuales o fraccionarios (figura
2). La suma de las tres fracciones (mol, peso o volumen) es la unidad
(ecuacin 1).
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 7
Marcos
Diagrama de solubilidad
Un sistema ternario puede fcilmente representarse mediante un
diagrama triangular (imagen adjunta, apndice figura a ).
Cada vrtice representa el 100% del componente representado en dicho
vrtice. Los lados del tringulo representan mezclas binarias de los
componentes situados en los vrtices extremos. Un punto situado en el
interior del tringulo representa a una mezcla ternaria.
Para establecer el punto que representa una mezcla de 25% de A, 25%
de B y 50% de C, podemos proceder del siguiente modo: El punto "a"
sobre el lado AB representa el 25% de A. Tracemos una lnea de trazos
desde el punto "a" al lado opuesto del tringulo paralela al lado BC.
Todas las mezclas que contengan 25% de A se hallarn sobre esta lnea
de trazos. El punto "b" del lado AC representa el 50% de C. Tracemos
una lnea de trazos paralela a AB hasta el lado opuesto del tringulo. Del
mismo modo se selecciona un punto de BC que represente el 25% de B y
se traza la lnea adecuada. La interseccin de estas tres lneas seala el
punto que representa la composicin de la mezcla.
Por ejemplo la adicin de cido actico a distintas mezclas de tolueno y
agua (que inicialmente forman un sistema de dos fases) acaba
produciendo sistemas lquidos de una sola fase. Las composiciones en
porcentajes se halla sobre una curva, llamada "curva de solubilidad",
como se ha dibujado sobre la figura. Se observar que esta curva va
desde el tolueno puro hasta el agua pura. Una mezcla cualquiera dentro
del rea que encierra la curva representa un sistema de dos fases, y
cualquier mezcla dentro del rea exterior a la curva formar una sola
fase lquida. La posicin de la curva cambia con la temperatura.
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 8
Marcos
Diagrama de solubilidad
Para conocer la composicin de cada fase en el sistema ternario
representado por el punto "p", hemos de trazar la "lnea de unin"
"lnea de reparto" que pasa por dicho
punto. Esta lnea corta a la curva en dos puntos "q" y "s", cuyas
composiciones corresponden con las de cada fase. Cualquier punto
situado sobre dicha lnea pose la misma composicin de cada fase.
Como podemos observar, se pueden construir infinitas "lneas de unin".
Rectas de reparto: En el diagrama triangular (vase figura b,
apndice) el rea que queda por debajo de la curva de solubilidad,
aporta informacin sobre las proporciones de los componentes cuya
mezcla da lugar a dos fases diferentes. Una de las fases es rica en agua
por lo que se denomina fase acuosa. La otra es rica en triclorometano y
se denomina fase orgnica. Ambas fases son transparentes, sin
embargo, en un sistema bifsico, se observa la existencia de una
frontera fsica que las mantiene separadas, una sobre la otra.
Imagine que mezcla las proporciones dadas por el punto K de la figura 4.
Como est incluido dentro del rea limitada por la curva de solubilidad,
esta mezcla origina dos fases. La fase situada en la zona inferior es rica
en triclorometano, pero contiene tambin agua y cido actico. Su
composicin viene dada por el punto *K. La fase superior es la acuosa y
tambin contiene triclorometano y cido actico. Su composicin la da el
punto K *.
Los puntos *K y K *, se sitan en los extremos de una recta que pasa por
el punto K. Esta lnea se denomina recta de reparto. Las rectas de
reparto se obtienen experimentalmente y no existe una metodologa
terica, a partir de la cual, se puedan conocer. Todo punto de la regin
que queda por debajo de la curva de solubilidad, da lugar a una recta de
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 9
Marcos
Diagrama de solubilidad
reparto. stas no tienen por qu ser paralelas entre s ni a la base del
tringulo.
Punto de doblez o punto crtico: Es el punto en el que las soluciones
conjugadas
(soluciones
ternarias
inmiscibles)
tienen
la
misma
composicin y las dos capas se vuelven una sola (vase figura c,
apndice).
4. PROCEDIMIENTO EXPERIMENTAL
Materiales
Erlenmeyer de 125 ml y
100 ml con tapn
Buretas de 25
ml
Pipetas de 1,5 y 10 ml
Tubos
medianos con
tapn
Procedimiento:
Vasos de
100 ml
Pera de
decantacin
Gradilla
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 10
Marcos
Diagrama de solubilidad
Curva de Solubilidad.
1. Todo el material de vidrio debe ser lavado y secado en la estufa
2. En Erlenmeyer de 125 ml, se prepara 10 ml de soluciones que
contengan 10, 15, 20, 25 % en volumen de cido actico en agua,
las muestras deben mantenerse tapadas. Mida la temperatura de
cada componente puro.
3. Titule dichas soluciones con n-butanol, agitando constantemente
despus de cada agregado, hasta la aparicin de turbidez.
Mantenga tapados los Erlenmeyer durante la valoracin.
4. Del mismo modo, prepare 10 ml de soluciones que contengan 10,
20, 30, y 40% en volumen de cido actico en n-butanol y titule
con agua destilada, hasta la primera aparicin de turbidez.
Valoracin de Solucin de NaOH
Para determinar el ttulo de la base con cido actico, pese 1
Erlenmeyer de 100ml (con tapn y seco), mida 1ml de cido
actico, tape, pese nuevamente con exactitud. Titul el cido con
la solucin de NaOH, usando como indicador la fenolftalena.
Determinacin de la lnea de reparto
1. En la pera de decantacin seca, prepare 20 ml de una mezcla que
contenga exactamente 10% de cido actico, 45% de n-butanol y
45% de agua.
2. Agite bien la mezcla durante dos minutos, luego separe cada una
de las fases en un tubo con tapn, desechando las primeras gotas
y la interface. Denomine A a la fase acuosa (inferior) y O a la fase
orgnica (superior)
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 11
Marcos
Diagrama de solubilidad
3. Pese un Erlenmeyer de 100 ml, limpio y seco con tapn y mida en
el, 5 ml de una de las fases, tape rpidamente y vuelva a pesar.
Empleando como indicador la fenolftalena, valore dicha muestra
con la solucin de NaOH, hasta coloracin grosella.
4. Repita los mismos pasos con la otra fase.
5. TABLA DE DATOS
TABLA 5.1: Condiciones experimentales
PRESIN (mmHg)
TEMPERATURA(C)
H. R. (%)
756
22
96
TABLA 5.2: Soluciones de cido Actico en agua y tituladas con n-butanol
SUSTANCIA
cido
10%V(mL)
15%V(mL)
20%V(mL)
25%V(mL)
1.0
1.5
2.0
2.5
actico
Agua
Volumen
9.0
8.5
8.0
7.5
gastado de
1.1
1.5
2.6
4.8
n-butanol
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 12
Marcos
Diagrama de solubilidad
TABLA 5.3: Soluciones de cido Actico en n-butanol y tituladas con agua
SUSTANCIA
cido
10%V(mL)
20%V(mL)
30%V(mL)
40%V(mL)
1.0
2.0
3.0
4.0
actico
n-butanol
Volumen
9.0
8.0
7.0
6.0
gastado de
1.5
3.9
7.8
9.2
Agua
TABLA 5.4: Densidades tericas de las sustancias en su respectiva temperatura
de estado puro
SUSTANCIA
T(o C)
(g/mL)
cido actico
22
1.0475
n-butanol
22
0.8081
Agua
22
0.99777
Nota: El valor terico del agua se hall para 22 C en el Manual del ingeniero
qumico Jhon Perry mientras que para el cido actico y n-butanol se tuvo que
interpolar debido que no se encontr el valor terico para 22C solo para 20C y
25C en ambos casos.
TABLA 5.5: Porcentaje en peso de cada sustancia presente en las soluciones de
cido actico en agua, tituladas con n-butanol
% en
10%V
15%V
20%V
25%V
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 13
Marcos
Diagrama de solubilidad
volumen
Sustancia
cido
W(g)
%w
W(g)
%W
W(g)
%W
W(g)
%W
1.0475
9.60
1.57125
13.95
2.095
17.20
2.61875
18.73
Actico
Agua
8.9799
8.48104
7.9821
82.26
75.29
3
0.8889
n-butanol
8.14
7.48327
65.54
6
2.1010
1.21215
10.76
53.52
5
17.26
3.87888
27.75
TABLA 5.6: Porcentaje en peso de cada sustancia presente en las soluciones de
cido actico en n-butanol, tituladas con agua
% en
volumen
Sustancia
cido
Actico
n-butanol
Agua
10%V
20%V
30%V
40%V
W(g)
%w
W(g)
%W
W(g)
%W
W(g)
%W
1.0475
10.67
2.095
16.82
3.1425
18.95
4.19
22.99
7.2729
1.49665
74.08
6.4648
3.89130
51.92
5.6567
7.78260
34.11
4.8486
9.17948
26.61
15.25
5
31.26
3
46.94
6
50.4
4
TABLA 5.7: Titulo en gramo de cido actico por mL de NaOH
Matraz vaci
Matras + cido
actico
cido actico
W(g)
52.1813
cido actico
V(mL)
1.0
53.3390
NaOH gastado
15.6
1.1577
Titulo (g HAc/mLNaOH)
0.0742
TABLA 5.8: Mezcla para determinar el coeficiente de reparto
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 14
Marcos
Diagrama de solubilidad
Sustancia
cido Actico
V(mL)
2.0
9.0
9.0
n-butanol
Agua
W(g)
2.095
7.2729
8.97993
%W
11.42
39.64
48.94
TABLA 5.9: Determinacin de la lnea de reparto
FASE ACUOSA
4.8389
6.3
0.46746
9.66
WMUESTRA (g)
VNaOH (mL)
WAC. ACETICO (g)
%WAC. ACTICO
FASE ORGANICA
4.4041
7.6
0.56392
12.80
6. EJEMPLO DE CLCULOS
6.1 .Clculo del porcentaje de cada componente de las mezclas
CIDO ACETICO EN AGUA:
WCOMPONENTE COMPONENTE VCOMPONENTE
SI:
%WCOMPONENTE
WCOMPONENTE
100
W MEZCLA
LUEGO:
-
Clculo del peso de cada componente:
W AC. ACETICO 1.0mLx1.0475 g / mL 1.0475 g
VAC. ACETICO = 1.0 mL;
W AGUA 9.0mLx0.99777 g / mL 8.481045 g
VAGUA = 9.0 mL;
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 15
Marcos
Diagrama de solubilidad
VN-BUTANOL = 1.5 mL;
-
W N BUTANOL 1.1mL 0.8081g / mL 0.88891g
Clculo del porcentaje en peso de cada componente:
W MEZCLA (1.0475 g 8.97993 g 0.88891g ) 10.91634 g
%WAC . ACETICO
%W AGUA
1.0475 g
x100 9.60%
10.91634 g
8.97993g
x100 82.26%
10.91634 g
%W N BUTANOL
0.88891g
x100 8.14%
10.91634 g
6.2. Ttulo en gramo de cido actico por mL de NaOH
TITULO
WACIDOACETICO
VNaOH
W (cido actico) = 1.1577 g
V (NaOH gastado) = 15.6 mL
Luego:
TITULO
1.1577 gAcidoAcetico
g AcidoAcetico
0.0742
15.6mLNaOH
mL
NaOH
6.3. Composicin global de la mezcla
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 16
Marcos
Diagrama de solubilidad
- Clculo del peso de cada componente:
W AC. ACETICO 2.0mLx1.0475 g / mL 2.095 g
VAC. ACETICO = 2.0 mL;
W AGUA 9.0mLx0.99777 g / mL 8.97993 g
VAGUA = 9.0 mL;
VN-BUTANOL = 9.0 mL;
W N BUTANOL 9.0mLx0.8081g / mL 7.2729 g
- Clculo del porcentaje en peso de cada componente:
W MEZCLA (2.095 g 8.97993g 7.2729 g ) 18.34783 g
%W AC. ACETICO
%W AGUA
2.095 g
x100 11.42%
18.34783 g
8.97993 g
x100 48.94%
18.34783g
%W N BUTANOL
7.2729 g
x100 39.64%
18.34783 g
6.4. Determinacin de los porcentajes en peso del cido
actico para la determinacin de la lnea de reparto
TITULO 0.0742
FASE ACUOSA:
Si:
V (NaOH gastado) = 6.3 mL
g AcidoAcetico
mL
NaOH
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 17
Marcos
Diagrama de solubilidad
W (muestra) = 4.8389 g
Luego:
W ( cidoActico) 0.0742
%W AC. ACETICO
-
g AcidoAcetico
x6.3mLNaOH 0.46746 gcidoActico
mL
NaOH
0.46746 g
x100 9.66%
4.8389 g
FASE ORGANICA:
Si:
V (NaOH gastado) = 7.6 mL
W (muestra) = 4.4041 g
Luego:
W ( cidoActico) 0.0742
%W AC. ACETICO
g AcidoAcetico
x7.6mLNaOH 0.56392 gcidoActico
mL
NaOH
0.56392 g
x100 12.80%
4.4041g
7. ANLISIS Y DISCUSIN DE RESULTADOS
Los porcentajes en peso ubicados en el diagrama triangular se nota
que el agua y el cido actico son miscibles, lo mismo ocurre para el
cido actico y el n-butanol mientras que para el agua y el n-butanol
esto ocurre pero parcialmente.
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 18
Marcos
Diagrama de solubilidad
Con los porcentajes en peso hallados se traza la curva de solubilidad
la cual indica que dentro de ella se forma un sistema de dos fases
(sistema heterogneo) mientras que los puntos que se ubiquen fuera
de dicha curva son de un sola fase (sistema homogneo).
En la lnea de reparto donde se ubic un punto el cual representa el
% en peso de los tres componentes representa el equilibrio existente
entre la fase acuosa y la fase orgnica.
Si agregamos cido actico a la solucin ternaria la composicin en
peso del n-butanol empieza a disminuir al igual que el porcentaje en
peso del agua y a medida que seguimos agregando ms cido
actico la solucin ternaria que al principio era de dos fases pasar a
una sola fase, esto se debe a la presencia de iones acetatos que
hacen que las molculas del agua y del n-butanol se separen
formndose as una sola fase.
El punto de doblez o punto crtico es el punto en el cual las
composiciones de las dos fases en equilibrio se hacen iguales a un
punto que se ubica en la curva de solubilidad
8. CONCLUSIONES
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 19
Marcos
Diagrama de solubilidad
El sistema ternario n-butanol-cido actico-agua forma sistemas con
un par de ellos parcialmente miscibles, en este caso el n-butanol y
agua.
El agua y el n-butanol que son parcialmente miscibles, al mezclarse
en el equilibrio habrn dos capas conjugadas que son los puntos de
mxima solubilidad, es decir, el punto a representa la mxima
solubilidad del agua en el n-butanol y el otro representa la mxima
solubilidad del n-butanol en agua.
Por encima de la curva binoidal, se obtendr una solucin de una
fase lquida.
Se observa una propiedad muy til del diagrama de solubilidad es
que una lnea trazada desde el vrtice del tringulo a cualquier punto
situado en el opuesto, representa las composiciones porcentuales de
todas las mezclas posibles que tienen las mismas cantidades
relativas de los otros dos componentes.
La lnea de reparto es la que corta a la curva y cada punto de
interseccin con la curva indica la composicin en cada fase.
9. RECOMENDACIONES
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 20
Marcos
Diagrama de solubilidad
Ser preciso con el reconocimiento del momento exacto de la
aparicin de turbidez, ya que es vital para que el grfico sea
correcto.
Tener cuidado de no tomar la interfase como alguna de las fases,
sino desecharla, al igual que las primeras gotas.
Lavar correctamente las buretas y erlenmeyers, posteriormente
secarlos, en especial para cuando se le agregue cido actico en
n-butanol, ya que no debe mezclarse con gotas de agua antes de
la titulacin.
10.
Trabajar con el cido actico dentro de la campana.
BIBLIOGRAFA
Pons Muzzo, G,fisicoqumica, 8va ed.; Edit. Universo S.A.2008.
Pg. 474.
Diagrama de fases y su aplicacin-Luis A. Cisternas, Ed. Revert.
Pg. 33,41.
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 21
Marcos
Diagrama de solubilidad
11. APNDICE
11.2. Cuestionario
Indicar las ventajas y desventajas que ofrece el diagrama
de Roozeboom.
Ventajas:
-
Una de las ventajas del uso de un diagrama ternario es su
representacin bidimensional. Precisamente pueden establecerse
reas con agrupaciones de puntos con las mismas propiedades:
como por ejemplo diagramas de fase.
Se puede usar el sistema para un sistema de tres componentes
para diferentes temperaturas, las que al elevar la temperatura
aumenta las solubilidades de los componentes.
Se
puede
analizar
sistemas:
dos
pares
lquidos
miscibles
parcialmente y tres pares de lquidos miscibles parcialmente
teniendo temperatura y presin fijados.
-
Nos permite saber las composiciones de las sustancia en una
mezcla determinada y usando un mtodo de separacin.
Nos permite saber hasta qu medida es soluble un tercer
componente en un sistema formado por otros dos componentes.
Desventajas:
-
Se usa con mayor precisin para fases liquidas, ya que al haber
tres fases tres fases liquidas y tres slidas, solo cuatro de estas
estarn en equilibrio temperatura y presin fijadas. Por ello se
supondr que no hay fases slidas.
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 22
Marcos
Diagrama de solubilidad
Solo es aplicable a sustancias ya establecidas dependiendo de su
naturaleza y la temperatura a que se trabaja.
Hay
tendencia
que
por
hidrlisis
se
formen
cantidades
minsculas de productos gelatinosos.
-
Sistema de dos sales y agua solo se analiza cuando dichas sales
presentacin comn.
Describe 3 procesos qumicos a nivel industrial, donde
tiene aplicacin los criterios del diagrama de solubilidad.
a) Contacto sencillo: Extraccin de cido actico y benceno
utilizando agua.
b) Contacto mltiple: Tiene varias entradas de solventes a medida
que avanza la mezcla de cido actico y benceno, para recuperar
ms productos derivados.
c) Extraccin con reflujo: extraccin de metil ciclo hexano de una
mezcla de metil a ciclo hexano y n-heptano usando solvente como
anilina.
Extraccin de nicotina en solucin acuosa con kerosene
como agente de extraccin (solvente).
Extraccin de estireno con solucin etilbenceno utilizando
como disolvente dietilenglicol.
Uso para la separacin de algunos productos obtenidos en
desintegracin nuclear y para lograr separacin del plutonio
del uranio.
Explique la regla de Tarasenkov.
Por la regla emprica de Tarasenkov, las prolongaciones de todas
las lneas de conexin en los diagramas de este tipo, en muchos
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 23
Marcos
Diagrama de solubilidad
casos se cortan en un punto. Una de las lneas de conexin se
encuentra en las prolongaciones de uno de los lados del tringulo.
Determinando las composiciones, aunque no sea ms que un par
de soluciones conjugadas, por ejemplo x e y, se puede encontrar el
punto b y por el mismo construir el sistema de conexin para la
zona de separacin en capas. Trazando desde el punto b una
tangente a la curva pxyq, obtenemos el punto a, correspondiente a
la composicin en que el sistema se hace homogneo a la
temperatura dada. La regla de Tarasenkov est lejos de cumplirse
para todos los sistemas
6.1.Grficos.
Figura a. Diagrama de solubilidad de un sistema ternario
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 24
Marcos
Diagrama de solubilidad
Figura b. Lnea de reparto *k-k* en un diagrama de solubilidad de un sistema
ternario
Figura c. Constitucin del diagrama de solubilidad
Laboratorio de Fisicoqumica I Universidad Nacional Mayor de San 25
Marcos
Diagrama de solubilidad
S-ar putea să vă placă și
- Informe 8Document19 paginiInforme 8Giuseppe Luigi Nuñez AguilarÎncă nu există evaluări
- Informe N°8 - Diagrama de SolubilidadDocument9 paginiInforme N°8 - Diagrama de SolubilidadDevra GomezÎncă nu există evaluări
- Diagrama de Solubilidad Final / Fiqui 2Document27 paginiDiagrama de Solubilidad Final / Fiqui 2Pier NavarroÎncă nu există evaluări
- Informe de Termoquimica - Laboratorio de Fisicoquimica UNMSMDocument16 paginiInforme de Termoquimica - Laboratorio de Fisicoquimica UNMSMAbel Art Bejarano Higa50% (2)
- Experiencia de MeldeDocument12 paginiExperiencia de MeldeDarwin Dario Uscacchi ValenciaÎncă nu există evaluări
- Informe de Regla de FasesDocument23 paginiInforme de Regla de FasesSkías Del Pozo Martínez100% (2)
- Mediciones Potenciometricas de PHDocument20 paginiMediciones Potenciometricas de PHJazmin ELÎncă nu există evaluări
- Fosforo Arsenico Antimonio y BismutoDocument8 paginiFosforo Arsenico Antimonio y BismutoMaria Del CarmenÎncă nu există evaluări
- Crioscopia Labo de Fiqui UNMSMDocument12 paginiCrioscopia Labo de Fiqui UNMSMAlan J. López DíazÎncă nu există evaluări
- Balances ElementalesDocument6 paginiBalances ElementalesKaren Viviana MorenoÎncă nu există evaluări
- Informe de Laboratorio N°3-Constantes FísicasDocument17 paginiInforme de Laboratorio N°3-Constantes FísicasRONALD JOEL VIDAURRE APAZAÎncă nu există evaluări
- Info1 Orga2 Compuestos Carbonilicos y Grupo CarboxilicoDocument22 paginiInfo1 Orga2 Compuestos Carbonilicos y Grupo CarboxilicoLuis AbantoÎncă nu există evaluări
- Informe N - 9 Equilibrio Liquido - VaporDocument23 paginiInforme N - 9 Equilibrio Liquido - Vaporjuancariq89% (18)
- Tension Superficial Lab. FisicoquimicaDocument24 paginiTension Superficial Lab. Fisicoquimica97602135080% (5)
- Informe 3 de Lab de OrganicaDocument16 paginiInforme 3 de Lab de OrganicaMilagros AleÎncă nu există evaluări
- Cristslización y Recristalización Laboratorio Orgánica UnmsmDocument15 paginiCristslización y Recristalización Laboratorio Orgánica UnmsmAnonymous abPUMgRlÎncă nu există evaluări
- Informe 4 Inorganica Azufre y SulfurosDocument24 paginiInforme 4 Inorganica Azufre y SulfurosANDERSSONÎncă nu există evaluări
- Informe de Termoquimica UNMSMDocument20 paginiInforme de Termoquimica UNMSMJubelo Jans Troche Huatarunco100% (1)
- Informe Computacion 1Document13 paginiInforme Computacion 1EsliDavidMolerosIngunzaÎncă nu există evaluări
- Tratamiento de Aguas ResidualesDocument3 paginiTratamiento de Aguas ResidualesShirley RomeroÎncă nu există evaluări
- Informe Viscosidad y DensidadDocument23 paginiInforme Viscosidad y DensidadClaudiaPalominoZelaya0% (1)
- Informe Diagrama de Solubilidad TerminadoDocument18 paginiInforme Diagrama de Solubilidad TerminadoFRANCO VALENCIA CHINARROÎncă nu există evaluări
- Ejercicios Balance de Materia y Energía Con Cambio de FaseDocument4 paginiEjercicios Balance de Materia y Energía Con Cambio de Fasehaidee lucenaÎncă nu există evaluări
- Fosforo Arsenico Antimonio Bismuto PDFDocument9 paginiFosforo Arsenico Antimonio Bismuto PDFJosmel PerezÎncă nu există evaluări
- REGLA DE FASES Informe Fiqui 2 UnmsmDocument16 paginiREGLA DE FASES Informe Fiqui 2 UnmsmJoselyn Matias BrañezÎncă nu există evaluări
- Conductv UnmsmDocument24 paginiConductv UnmsmBrenda wen :PÎncă nu există evaluări
- Informe 5 Fisicoquimica Tension SuperficialDocument28 paginiInforme 5 Fisicoquimica Tension SuperficialElMaharajaÎncă nu există evaluări
- Informe-6,7 de OrganicaDocument26 paginiInforme-6,7 de Organicakenyi8Încă nu există evaluări
- Informe de Laboratorio 1 de Química Inorganica UNMSMDocument8 paginiInforme de Laboratorio 1 de Química Inorganica UNMSMwaldir marcelino100% (1)
- Informe Líquido Vapor UnmsmDocument16 paginiInforme Líquido Vapor UnmsmJoselyn Matias BrañezÎncă nu există evaluări
- Vdocuments - MX Compuestos Oxigenados Del AzufreDocument5 paginiVdocuments - MX Compuestos Oxigenados Del AzufreAngélica MontalvoÎncă nu există evaluări
- Informe #4 Presión de Vapor - UNMSMDocument13 paginiInforme #4 Presión de Vapor - UNMSMJheferson Alcocer100% (5)
- Informe 07 Quimica Organica AIIDocument12 paginiInforme 07 Quimica Organica AIIKevinMego100% (2)
- Informe de Gases Fisicoquimica I UNMSMDocument22 paginiInforme de Gases Fisicoquimica I UNMSMJairo LeónÎncă nu există evaluări
- Informe Equilibrio Liquido VaporDocument16 paginiInforme Equilibrio Liquido Vaporluzvid alejo ochoa0% (1)
- Informe N°1 Equilibrio Líquido - VaporDocument12 paginiInforme N°1 Equilibrio Líquido - VaporALEJANDRA LUCERO MEJ�A CRUZÎncă nu există evaluări
- INFORME 6 - Oxigenados de Azufre 2Document13 paginiINFORME 6 - Oxigenados de Azufre 2David Francisco Benites MillanÎncă nu există evaluări
- Informe 16 - Descomposición CatalíticaDocument17 paginiInforme 16 - Descomposición CatalíticaKATHERINNE LUZ CHUCO DE LA CRUZÎncă nu există evaluări
- Informe ElectroquímicaDocument28 paginiInforme ElectroquímicaKevin Yacha Ricaldi100% (1)
- Inorg 4Document9 paginiInorg 4Kevin VizcarraÎncă nu există evaluări
- Informe #8 - Química Orgánica II PDFDocument21 paginiInforme #8 - Química Orgánica II PDFDevra Gomez100% (1)
- Labo de InorganicaDocument36 paginiLabo de InorganicaAngel Ulises Reyes NÎncă nu există evaluări
- Informe Inorganica Practica N 9 Boro y AluminioDocument10 paginiInforme Inorganica Practica N 9 Boro y Aluminioluis romeroÎncă nu există evaluări
- Informe Laboratorio Fiqui Medidas Potenciometricas de PHDocument26 paginiInforme Laboratorio Fiqui Medidas Potenciometricas de PHElMaharaja0% (1)
- Compuestos Oxigenados Del AzufreDocument9 paginiCompuestos Oxigenados Del AzufreDiana160295Încă nu există evaluări
- Informe 3 de Fiqui Presion de Vapor UnmsmDocument11 paginiInforme 3 de Fiqui Presion de Vapor UnmsmJairo LeónÎncă nu există evaluări
- Sem-9Conservacion de EnergiaDocument33 paginiSem-9Conservacion de EnergiaAdrian LVÎncă nu există evaluări
- INFORME #11 D F2Document7 paginiINFORME #11 D F2Julinho VicenteÎncă nu există evaluări
- Informe Laboratorio Fisicoquímica Presión de VaporDocument16 paginiInforme Laboratorio Fisicoquímica Presión de VaporAldahir Romaní Yerrén50% (2)
- ProblemasDocument4 paginiProblemasPaola DoğranmışÎncă nu există evaluări
- Variacion de La Solubilidad Con La Temperatura-InformeDocument21 paginiVariacion de La Solubilidad Con La Temperatura-InformeJose Cortez60% (5)
- Informe de Termoquimica UnmsmDocument17 paginiInforme de Termoquimica UnmsmPier NavarroÎncă nu există evaluări
- INFORME Conductividad FIQUIDocument24 paginiINFORME Conductividad FIQUILadhiJaniraDextreMartinezÎncă nu există evaluări
- Informe Práctica 10 Elementos Del Grupo IA y IIADocument12 paginiInforme Práctica 10 Elementos Del Grupo IA y IIABrian WilliamsÎncă nu există evaluări
- FIQT - Labo FisicoQuimica 1 - N°4 - Densidad de LiquidosDocument8 paginiFIQT - Labo FisicoQuimica 1 - N°4 - Densidad de LiquidosCarlos Chura NoriegaÎncă nu există evaluări
- Informe 2 Química InorgánicaDocument7 paginiInforme 2 Química InorgánicaClaudiaPalominoZelayaÎncă nu există evaluări
- Informe 12 - Mediciones PotenciometricasDocument20 paginiInforme 12 - Mediciones PotenciometricasjoelÎncă nu există evaluări
- Lab 4 AZUFRE Y SULFUROSDocument6 paginiLab 4 AZUFRE Y SULFUROSLilibethEspinoza100% (2)
- Diagrama de SolubilidadDocument27 paginiDiagrama de SolubilidadClaudiaPalominoZelayaÎncă nu există evaluări
- Informe de Equilibrio de Tres FasesDocument10 paginiInforme de Equilibrio de Tres FasesDiego Fernando Rodas MarinÎncă nu există evaluări
- Caballerosidad y MachismoDocument10 paginiCaballerosidad y Machismopamela182212Încă nu există evaluări
- Ingenieria Electrica y Automatizacion IndustrialDocument9 paginiIngenieria Electrica y Automatizacion Industrialpamela182212Încă nu există evaluări
- William Naranjo Gutierrez 24-02-2016Document64 paginiWilliam Naranjo Gutierrez 24-02-2016pamela182212Încă nu există evaluări
- PC5 - GTO - Grupo 6 Final 2.0Document16 paginiPC5 - GTO - Grupo 6 Final 2.0pamela182212Încă nu există evaluări
- Guia de LaboratorioDocument20 paginiGuia de Laboratoriopamela182212Încă nu există evaluări
- T4 - PAz Diego CorregidoDocument9 paginiT4 - PAz Diego Corregidopamela182212Încă nu există evaluări
- Ingenieria Electrica y Automatizacion IndustrialDocument7 paginiIngenieria Electrica y Automatizacion Industrialpamela182212Încă nu există evaluări
- Globalización en El PerúDocument5 paginiGlobalización en El Perúpamela182212Încă nu există evaluări
- T2 - Gestiontacticadeoperaciones - Paz ARanda DIegoDocument6 paginiT2 - Gestiontacticadeoperaciones - Paz ARanda DIegopamela182212Încă nu există evaluări
- 5.2 Politica SIGDocument1 pagină5.2 Politica SIGpamela182212Încă nu există evaluări
- Bombas Pulsafeeder y SekoDocument2 paginiBombas Pulsafeeder y Sekopamela182212Încă nu există evaluări
- Aplicaciones Del Ácido SulfúricoDocument4 paginiAplicaciones Del Ácido Sulfúricopamela182212Încă nu există evaluări
- Aceite Muña FinalDocument12 paginiAceite Muña Finalpamela182212Încă nu există evaluări
- Diagrama Entradas - SalidasDocument7 paginiDiagrama Entradas - Salidaspamela182212Încă nu există evaluări
- Caracteristicas Normales y PatologicasDocument4 paginiCaracteristicas Normales y Patologicaspamela182212Încă nu există evaluări
- Análisis EconómicoDocument12 paginiAnálisis Económicopamela182212Încă nu există evaluări
- Torre InformeDocument26 paginiTorre Informepamela182212Încă nu există evaluări
- Difusión MonografíaDocument11 paginiDifusión Monografíapamela182212Încă nu există evaluări
- Sintesis Del DiazepamDocument14 paginiSintesis Del DiazepamTavo Rodriguez100% (1)
- Intruccion Del JinchanDocument3 paginiIntruccion Del JinchanMercedes Guillermina Godoy BarbosaÎncă nu există evaluări
- 251945727-Elaboracion-de-Sidra Bio PDFDocument30 pagini251945727-Elaboracion-de-Sidra Bio PDFSabrina Gutierrez GarciaÎncă nu există evaluări
- Separacion de FasesDocument25 paginiSeparacion de FasesjdangladÎncă nu există evaluări
- Practica 5 Determinacion de Glucogeno en El CorazonDocument3 paginiPractica 5 Determinacion de Glucogeno en El CorazonMaca KimÎncă nu există evaluări
- Cuestionario 14Document2 paginiCuestionario 14DelmerQHÎncă nu există evaluări
- Meteorizacion QuimicaDocument26 paginiMeteorizacion QuimicaLucero Paola Arauco VÎncă nu există evaluări
- Telopicc35 ECDocument19 paginiTelopicc35 ECresÎncă nu există evaluări
- El Átomo y Su EstructuraDocument2 paginiEl Átomo y Su EstructuraJhoselin Zarela Zegarra PonteÎncă nu există evaluări
- Aminas - Ramirez Gomez Juan PabloDocument3 paginiAminas - Ramirez Gomez Juan PabloJuan RamirezÎncă nu există evaluări
- Propiedades de Los Agregados, Pruebas de Laboratorio y Propiedades de Los Productos Asfálticos.Document21 paginiPropiedades de Los Agregados, Pruebas de Laboratorio y Propiedades de Los Productos Asfálticos.Saraí MondragónÎncă nu există evaluări
- Laboratorio # 4 FisicoquimicaDocument11 paginiLaboratorio # 4 FisicoquimicaPame RamosÎncă nu există evaluări
- JornalizacionDocument20 paginiJornalizacionKAREN RODRIGUEZÎncă nu există evaluări
- 12 Agregados para ConcretoDocument35 pagini12 Agregados para ConcretoTeamPucp Dota2Încă nu există evaluări
- Endulzamiento Del Gas NaturalDocument63 paginiEndulzamiento Del Gas NaturalLuis SalamancaÎncă nu există evaluări
- Práctica 2 Lab de MaterialesDocument5 paginiPráctica 2 Lab de MaterialesJair DelgadoÎncă nu există evaluări
- Aleaciones Metal CerámicaDocument24 paginiAleaciones Metal CerámicaChrristian CadenaÎncă nu există evaluări
- Transporte de Gas NaturalDocument13 paginiTransporte de Gas NaturalMiKe GsÎncă nu există evaluări
- Resinas Intercambiadoras de IonesDocument5 paginiResinas Intercambiadoras de IonesJeffersonPalacios100% (1)
- Laboratorio 9 Q IIDocument4 paginiLaboratorio 9 Q IIAlberto luis pertuz diaz0% (1)
- RadiacionDocument6 paginiRadiacionCarloss JuarezzÎncă nu există evaluări
- Taller de Calentamiento QuimicaDocument13 paginiTaller de Calentamiento Quimicajose gabriel yee romeroÎncă nu există evaluări
- BIODIGESTORESDocument13 paginiBIODIGESTORESricardoÎncă nu există evaluări
- Unidad 2 - EDITADODocument22 paginiUnidad 2 - EDITADOAgustín UrbiniÎncă nu există evaluări
- Enlace Covalente ExposicionDocument8 paginiEnlace Covalente ExposicionJuan Jose MoralesÎncă nu există evaluări
- Enzima OGTDocument11 paginiEnzima OGTM Mónica CamposÎncă nu există evaluări
- TEORIA U4 AnaliticaDocument22 paginiTEORIA U4 AnaliticaFrida Estephany Hernandez SalazarÎncă nu există evaluări
- Paneles PrefabricadosDocument5 paginiPaneles PrefabricadosVanessa Ibarra UriosteguiÎncă nu există evaluări
- Capítulos 3 y 4Document10 paginiCapítulos 3 y 4Maria ArrochaÎncă nu există evaluări