Documente Academic
Documente Profesional
Documente Cultură
Química - Pré-Vestibular Impacto - Concentração Comum e Densidade
Încărcat de
Química QuiDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Química - Pré-Vestibular Impacto - Concentração Comum e Densidade
Încărcat de
Química QuiDrepturi de autor:
Formate disponibile
CONCENTRAÇÃO COMUM E DENSIDADE
PROFº: JAIRO CUNHA Frente: 03 Aula: 11 GE310507
(SF-mn/ CN)-n
Email:sambarokc@yahoo.com.br
SOLUCÕES Exemplo:
CONCENTRACÃO COMUM E DENSIDADE - Uma solução 1 g/l possui um grama de soluto dissolvido
em um litro de solução; uma solução 20 g/l possui 20
gramas de soluto dissolvidos em um litro de solução.
Solução é a denominação
ao sistema em que uma substância
1 g/l........1 g de soluto..........1 l de solução;
está distribuída, ou disseminada,
numa segunda substância sob
20 g/l........20 g de soluto..........1 l de solução;
forma de pequenas partículas.
Dissolvendo-se sal na água, forma-
se uma solução de íons sódio (Na+) Densidade
e íons cloreto (Cl-). Misturando-se
cal na água, obtém-se uma solução a) Conceito:
onde predominam as partículas de
cal não dissolvidas. É a razão da massa da
Nos dois exemplos acima, o sal e a cal, são a fase solução pelo volume da solução,
dispersa ou o disperso e a água é a fase de dispersão, dada em l ou ml.
A ÁGUA DO MAR
dispersante ou dispergente.
É UMA
b) Expressão matemática:
SOLUCÃO
Classificação Tamanho das partículas dispersas DENSA EM SAL
Solução verdadeira Até 1 nm (nanômetro)
Solução coloidal de 1 nm a 100 nm
Solução grosseira maior que 100 nm
Onde:
Expressão de Concentração das Soluções
d = densidade;
Existem muitas formas de expressar a
concentração de soluções, ou seja, a proporção entre
m = massa da solução;
quantidades de soluto e solvente, ou entre quantidades de
soluto e solução.
V = volume da solução, dada em l ou ml.
QUANTIDA DE DE SOLUTO QUANTIDA DE DE SOLUTO
C= C=
QUANTIDADE DE SOLVENTE QUANTIDADE DE SOLUÇÃO c) Unidade: g/l ou g/ml.
Usaremos a seguinte convenção para índices: d) Significado :
índice 1: para as quantidades relativas ao soluto. A densidade indica a massa, em gramas,
encontrada num litro ou mililitro de solução. Exemplos:
índice 2: para as quantidades relativas ao solvente
sem índice: para as quantidades relativas à solução. - Uma solução de densidade 1 g/ml possui massa de 1 g
por ml de solução, ou seja 1 ml de solução apresenta
massa igual a 1 g.
Concentração Comum ou Simplesmente
Concentração(C) CONCENTRAÇÃO SIGNIFICADO
DENSIDADE ABSOLUTA CADA LITRO DA
É o quociente da massa do soluto (em gramas)
d = 300g/L SOLUÇÃO TEM MASSA
pelo volume da solução (em litros).
DE 300G; A MASSA DA
SOLUÇÃO É, PORTANTO,
DE 300G
CONCENTRAÇÃO CADA LITRO DA
COMUM SOLUÇÃO CONTÉM 300G
C = 300 g/L DO SOLUTO, A MASSA
DA SOLUÇÃO É,
PORTANTO, MAIOR QUE
300G
UNIDADE: g/L
Fale conosco www.portalimpacto.com.br
EXERCÍCIOS DOS APROVADOS 08. O gás oxigênio pode estar na água na concentração
de 0,05 g/L, em condição ambiente. Determine a massa
01. Calcule a concentração em g/L de uma solução de oxigênio existente em um aquário com volume de 100 L
preparada com 3,0g de NaCl dissolvidos em água de capacidade.
suficiente para produzir 200 mL de solução.
09. Uma solução de soro caseiro apresenta concentração
02. (UMC-SP) O vinagre contém em média 60 g/L de um de 0,011 g/mL de sacarose. Se uma criança beber 2 L
ácido. desse soro ao longo de um dia, quantos gramas de
sacarose terá ingerido?
a) Qual é o ácido?
10. Em 200 mL de determinado leite em pó integral há,
b) Usando uma colher de vinagre (0,015 L) como tempero, após dissolvido em água, 240 mg de cálcio. Calcule a
quantas gramas do referido ácido estão contidos neste concentração em g/L de cálcio desse leite.
volume?
11. (MACK-SP) Têm-se cinco recipientes contendo
03. O valor da concentração da glicose no sangue de um soluções aquosas de cloreto de sódio.
paciente hospitalizado é de 90 mg/100 mL. Qual é a
massa de glicose em 1 litro de sangue desse paciente?
04. (Puccamp-SP) Evapora-se totalmente o solvente de
250 mL de uma solução aquosa de MgCl2 de
msal= 0,5g msal= 0,75g msal= 1,25g msal= 2,0g msal= 2,5g
concentração 9,0 g/L. quantos gramas de soluto são
obtidos? É correto afirmar que:
a) 8,0. d) 2,0. a) O recipiente 5 contém a solução menos concentrada.
b) 6,0. e) 1,0. b) O recipiente 1 contem a solução mais concentrada.
c) 4,0. c) Somente os recipientes 3 e 4 contêm soluções de igual
concentração.
05. Um técnico de laboratório preparou uma solução de d) As cinco soluções têm a mesma concentração.
NaCl adicionando 20 mg desse sal em água suficiente e) O recipiente 5 contém a solução mais concentrada.
para obter 120 mL de solução. Qual é o valor da 12. (UFBA) Uma solução de densidade igual a 1,2 g/mL é
concentração em g/L que pode ser escrito no rótulo de um formada pela dissolução de 10 g de um sal em 290 g de
frasco dessa solução? H2O.
Calcule, em g/L, a concentração desse sal;
06. Ao realizar exames de sangue de rotina, um indivíduo
apresentou concentração de colesterol total igual a 185 13. (UFF-RJ) Dissolve-se 4,6 g de NaC l em 500 g de
mg/100 mL. Isso significa que: água “pura”, fervida e isenta de bactérias. A solução
resultante foi usada como soro fisiológico na assepsia de
a) Em 100 mL de sangue há 1,85g de colesterol. lentes de contato.
b) Em 1 000 mL de sangue há 1 850g de colesterol. Assinale a opção que indica o valor aproximado da
c) Em 1 000 mL de sangue há 1 850 mg de colesterol.
porcentagem, em peso, de NaC l existente nesta solução;
d) Em 100 mL de sangue há 1 850 mg de colesterol.
e) Em 1 ml de sangue há 1,85 g de colesterol. a) 0,16%. d) 0,91%.
b) 0,32%. e) 2,30%.
07. (Fuvest-SP) Foi determinada a quantidade de dióxido c) 0,46%
de enxofre em certo local em São Paulo. Em 1,5 m3 de ar
foram encontrados 220 µ g de SO2. A concentração de 14. (FESURV-GO) O limite máximo de “ingestão diária
SO2, expressa em µ g/m3, é: aceitável” (IDA), de ácido fosfórico H3PO4, aditivo em
alimentos, é de 5 mg/kg de peso corporal. Calcule o
volume de refrigerante, contendo ácido fosfórico na
a) 0, 011.1
concentração 0,6g/L, que uma pessoa de 60kg deve
b) 0,88.
ingerir para atingir o limite Máximo do IDA.
c) 55.
d) 88. a) 50 mL. d) 400 mL.
e) 550. b) 100 mL. e) 500 mL.
c) 250 mL.
Fale conosco www.portalimpacto.com.br
S-ar putea să vă placă și
- Apostila 1 de Química X - Prof Zila - UERJ PDFDocument58 paginiApostila 1 de Química X - Prof Zila - UERJ PDFIsabelle ChristineÎncă nu există evaluări
- Exercícios de EstequiometriaDocument14 paginiExercícios de EstequiometriaMárcio Gildeon50% (2)
- 2° Ano Exercícios Concentração Densidade e TítuloDocument2 pagini2° Ano Exercícios Concentração Densidade e TítuloPriscila RodriguesÎncă nu există evaluări
- Exercícios Sobre Concentração ComumDocument10 paginiExercícios Sobre Concentração ComumDaniela Jamel100% (3)
- Resumo Fundição Por GravidadeDocument6 paginiResumo Fundição Por GravidadeFelipe ToscanoÎncă nu există evaluări
- Estudo Das SoluçõesDocument38 paginiEstudo Das SoluçõesSandro Baldez0% (1)
- 17 18 Concentracao e DiluicaoDocument6 pagini17 18 Concentracao e DiluicaoCaroline OliveiraÎncă nu există evaluări
- Resumo Sobre SoluçõesDocument19 paginiResumo Sobre SoluçõesFabíola FelixÎncă nu există evaluări
- Solucoes QuimicasDocument2 paginiSolucoes QuimicasMariana Gallo100% (1)
- Soluções PDFDocument3 paginiSoluções PDFhichuana gallina100% (1)
- Balanceamento Método de TentativasDocument2 paginiBalanceamento Método de TentativasFernandes YoshimotoÎncă nu există evaluări
- Química - Pré-Vestibular Impacto - Estrutura AtômicaDocument2 paginiQuímica - Pré-Vestibular Impacto - Estrutura AtômicaQuímica Qui100% (5)
- SEPARACAO DE MISTURAS ExercicioDocument2 paginiSEPARACAO DE MISTURAS ExercicioJonas SantosÎncă nu există evaluări
- Exercicios SoluçõesDocument2 paginiExercicios Soluçõesmoacirtomaz2760Încă nu există evaluări
- Química - Pré-Vestibular Impacto - Estudo Do CarbonoDocument2 paginiQuímica - Pré-Vestibular Impacto - Estudo Do CarbonoQuímica Qui80% (5)
- Química - Pré-Vestibular Impacto - Misturas Do Dia-DiaDocument2 paginiQuímica - Pré-Vestibular Impacto - Misturas Do Dia-DiaQuímica Qui100% (3)
- Soluções Aula1Document12 paginiSoluções Aula1Jonas SantosÎncă nu există evaluări
- Massa Molar e Número de MolDocument5 paginiMassa Molar e Número de MolhombedjoÎncă nu există evaluări
- AULA 1 - Química - 2 º Ano CN - MASSA ATÔMICA E A MASSA MOLECULAR COM O CONCEITO DE MOL E A CONSTANTE DE AVOGRADO - Texto e AtividadesDocument4 paginiAULA 1 - Química - 2 º Ano CN - MASSA ATÔMICA E A MASSA MOLECULAR COM O CONCEITO DE MOL E A CONSTANTE DE AVOGRADO - Texto e AtividadesMadison MontgomeryÎncă nu există evaluări
- Lista de Exercicios 9 - 2 Bimestre 2011 - 2 SeriesDocument2 paginiLista de Exercicios 9 - 2 Bimestre 2011 - 2 SeriesSamuca SilvaÎncă nu există evaluări
- SoluçõesDocument46 paginiSoluçõesisadoraÎncă nu există evaluări
- SoluçõesDocument40 paginiSoluçõesjmhenriques08100% (2)
- Atividade Classificação Das Soluções - NoturnoDocument2 paginiAtividade Classificação Das Soluções - NoturnoMarina Ramos100% (1)
- (AULA 01) Introdução À Química OrgânicaDocument7 pagini(AULA 01) Introdução À Química OrgânicaJonathan Araújo100% (1)
- Molaridade Fracao MolarDocument3 paginiMolaridade Fracao MolarChristtianne LimaÎncă nu există evaluări
- Exercicios SolucoesDocument12 paginiExercicios SolucoesEraclitoSL91% (11)
- Soluções (Slide)Document58 paginiSoluções (Slide)Felipe QueirozÎncă nu există evaluări
- Exercícios SoluçõesDocument6 paginiExercícios SoluçõesMirela MottaÎncă nu există evaluări
- 100 Questões de Conc de SoluçõesDocument42 pagini100 Questões de Conc de SoluçõesEraclitoSL100% (5)
- Concentração de Soluções 1º ParteDocument5 paginiConcentração de Soluções 1º ParteJosileide De Castro SantanaÎncă nu există evaluări
- Exercícios - Concentração de SoluçõesDocument4 paginiExercícios - Concentração de SoluçõesIsabela TeotônioÎncă nu există evaluări
- Reacoes OrganicasDocument62 paginiReacoes OrganicasLarissa SantosÎncă nu există evaluări
- Química - Pré-Vestibular Impacto - Ácidos - Classificação IIIDocument2 paginiQuímica - Pré-Vestibular Impacto - Ácidos - Classificação IIIQuímica Qui100% (1)
- Química - Pré-Vestibular Impacto - Ligação IônicaDocument2 paginiQuímica - Pré-Vestibular Impacto - Ligação IônicaQuímica Qui100% (2)
- Massa Molecular, Mol e Massa Atomica.Document6 paginiMassa Molecular, Mol e Massa Atomica.Zalex Ribb'sÎncă nu există evaluări
- Conceito de PHDocument3 paginiConceito de PHEverson SoaresÎncă nu există evaluări
- Exercícios Sobre Soluções QuímicasDocument3 paginiExercícios Sobre Soluções QuímicasRose NascimentoÎncă nu există evaluări
- Equilíbrio IônicoDocument23 paginiEquilíbrio IônicoThiago Brito de Almeida PROFESSORÎncă nu există evaluări
- Isomeria Plana e Geométrica - Aula 1Document18 paginiIsomeria Plana e Geométrica - Aula 1Laize ZaramelloÎncă nu există evaluări
- (AULA 08 E 09) Reações Orgânicas (Adição, Substituição, Eliminação)Document7 pagini(AULA 08 E 09) Reações Orgânicas (Adição, Substituição, Eliminação)Jonathan AraujoÎncă nu există evaluări
- Cadeias Carbonicas PPT - 1564510071Document30 paginiCadeias Carbonicas PPT - 1564510071Joel MoreiraÎncă nu există evaluări
- Solucao PDFDocument3 paginiSolucao PDFWalber PereiraÎncă nu există evaluări
- Os Estados Físicos Da MatériaDocument5 paginiOs Estados Físicos Da MatériaroosangellaÎncă nu există evaluări
- Aula 3 (Soluções) - Físico-QuímicaDocument19 paginiAula 3 (Soluções) - Físico-QuímicalourencojrÎncă nu există evaluări
- Introdução SoluçõesDocument13 paginiIntrodução SoluçõesNiko Bellic50% (2)
- Q2 - Conteúdos - SoluçõesDocument8 paginiQ2 - Conteúdos - SoluçõesmonlysÎncă nu există evaluări
- Físico-Química - Cinética Química (20 Questões)Document10 paginiFísico-Química - Cinética Química (20 Questões)Ciencias PPT100% (1)
- Química - Exercícios SoluçõesDocument5 paginiQuímica - Exercícios SoluçõeslilolokÎncă nu există evaluări
- Alcanos, Cicloalcanos, Alcenos e Alcinos - SLIDESDocument29 paginiAlcanos, Cicloalcanos, Alcenos e Alcinos - SLIDESAndré Mauricio De OliveiraÎncă nu există evaluări
- Soluções 2Document5 paginiSoluções 2Sabrina SantosÎncă nu există evaluări
- Lista de Exerc SoluçõesDocument10 paginiLista de Exerc SoluçõesSr. LêninÎncă nu există evaluări
- Soluções Aquosas - Dent - 2022-2022 - Aula 3Document29 paginiSoluções Aquosas - Dent - 2022-2022 - Aula 3Dorivaldo GomesÎncă nu există evaluări
- Exercício Concentrações Das SoluçõesDocument5 paginiExercício Concentrações Das SoluçõesShi NaraÎncă nu există evaluări
- Aula Sobre Soluções - Parte 1Document41 paginiAula Sobre Soluções - Parte 1Paula CaldasÎncă nu există evaluări
- Soluções - Profº Agamenon RobertoDocument15 paginiSoluções - Profº Agamenon Robertocb_penatrujilloÎncă nu există evaluări
- Apostila3 2007Document10 paginiApostila3 2007hallexÎncă nu există evaluări
- AULA Atual SOLUCOESDocument47 paginiAULA Atual SOLUCOESFelipe MoraesÎncă nu există evaluări
- Poligrafo T8 QuimicaDocument15 paginiPoligrafo T8 QuimicaGabriel silvaÎncă nu există evaluări
- Química 2° Ano EM 2Document26 paginiQuímica 2° Ano EM 2vivianegobi0Încă nu există evaluări
- Quimica - Organica II Reação EliminaçãoDocument54 paginiQuimica - Organica II Reação EliminaçãoQuímica Qui100% (6)
- Quimica - Propriedades Dos Líquidos e SólidosDocument3 paginiQuimica - Propriedades Dos Líquidos e SólidosQuímica Qui0% (2)
- Quimica - Propriedades Físicas Dos LíquidosDocument6 paginiQuimica - Propriedades Físicas Dos LíquidosQuímica Qui100% (1)
- Quimica - AlcenosDocument42 paginiQuimica - AlcenosQuímica QuiÎncă nu există evaluări
- Quimica - Equivalente GramaDocument12 paginiQuimica - Equivalente GramaQuímica Qui100% (1)
- Quimica - Ligações Químicas A Regra Do OctetoDocument32 paginiQuimica - Ligações Químicas A Regra Do OctetoQuímica Qui100% (1)
- Quimica - Organica II Reação de AdicaoDocument86 paginiQuimica - Organica II Reação de AdicaoQuímica Qui67% (3)
- Química - Pré-Vestibular Impacto - Propriedades Das RadiaçõesDocument2 paginiQuímica - Pré-Vestibular Impacto - Propriedades Das RadiaçõesQuímica QuiÎncă nu există evaluări
- Quimica - Leis de Faraday para A EletróliseDocument10 paginiQuimica - Leis de Faraday para A EletróliseQuímica Qui100% (1)
- Química - Pré-Vestibular Impacto - Tabela Periódica - Características Gerais IDocument2 paginiQuímica - Pré-Vestibular Impacto - Tabela Periódica - Características Gerais IQuímica Qui100% (4)
- Química - Pré-Vestibular Impacto - AtomísticaDocument2 paginiQuímica - Pré-Vestibular Impacto - AtomísticaQuímica Qui100% (1)
- Quimica - Ligações Químicas A Regra Do OctetoDocument32 paginiQuimica - Ligações Químicas A Regra Do OctetoQuímica Qui100% (1)
- Optica - EspectroDocument33 paginiOptica - EspectroQuímica Qui100% (1)
- Química - Pré-Vestibular Impacto - Ligação IônicaDocument2 paginiQuímica - Pré-Vestibular Impacto - Ligação IônicaQuímica Qui100% (2)
- Química - Pré-Vestibular Impacto - Tabela Periódica - Propriedades PeriódicasDocument2 paginiQuímica - Pré-Vestibular Impacto - Tabela Periódica - Propriedades PeriódicasQuímica Qui100% (5)
- Exercicios MolDocument2 paginiExercicios MolbyancabbÎncă nu există evaluări
- Química - Pré-Vestibular Impacto - Lei Da Radioatividade IDocument2 paginiQuímica - Pré-Vestibular Impacto - Lei Da Radioatividade IQuímica Qui100% (4)
- Química - Pré-Vestibular Impacto - Tabela Periódica - Classificação Dos Elementos IIIDocument2 paginiQuímica - Pré-Vestibular Impacto - Tabela Periódica - Classificação Dos Elementos IIIQuímica Qui100% (1)
- Química - Pré-Vestibular Impacto - Polaridade Das MoléculasDocument3 paginiQuímica - Pré-Vestibular Impacto - Polaridade Das MoléculasQuímica Qui100% (2)
- Química - Pré-Vestibular Impacto - Lei Da Radioatividade 01Document2 paginiQuímica - Pré-Vestibular Impacto - Lei Da Radioatividade 01Química Qui100% (1)
- Química - Pré-Vestibular Impacto - Fenômenos Atômicos - 01Document2 paginiQuímica - Pré-Vestibular Impacto - Fenômenos Atômicos - 01Química Qui100% (5)
- Química - Pré-Vestibular Impacto - Lei Da Radioatividade I (2 Lei)Document2 paginiQuímica - Pré-Vestibular Impacto - Lei Da Radioatividade I (2 Lei)Química Qui100% (2)
- Química - Pré-Vestibular Impacto - Tabela Periódica - CaracterísticasDocument2 paginiQuímica - Pré-Vestibular Impacto - Tabela Periódica - CaracterísticasQuímica Qui100% (2)
- Química - Pré-Vestibular Impacto - Tabela Periódica - Propriedades PeriódicasDocument2 paginiQuímica - Pré-Vestibular Impacto - Tabela Periódica - Propriedades PeriódicasQuímica Qui100% (5)
- Química - Pré-Vestibular Impacto - MolaridadeDocument2 paginiQuímica - Pré-Vestibular Impacto - MolaridadeQuímica Qui100% (3)
- Química - Pré-Vestibular Impacto - Soluções - Classificação e Curva de SolubilidadeDocument2 paginiQuímica - Pré-Vestibular Impacto - Soluções - Classificação e Curva de SolubilidadeQuímica Qui100% (1)
- Curso Maracuja PronafDocument8 paginiCurso Maracuja PronafevandermoreiraÎncă nu există evaluări
- Aula 1 - Questões PDFDocument3 paginiAula 1 - Questões PDFMackeler PolassiÎncă nu există evaluări
- NR 33 - Resumo Da Norma Regulamentadora Atualizada - GetwetDocument7 paginiNR 33 - Resumo Da Norma Regulamentadora Atualizada - GetwetBruno HolandaÎncă nu există evaluări
- Especificação Técnica Aço AISI P20Document1 paginăEspecificação Técnica Aço AISI P20Rafael SalvagniÎncă nu există evaluări
- Ed - Física - Aulas Remotas Tema - 06-EmpatiaDocument16 paginiEd - Física - Aulas Remotas Tema - 06-EmpatiaEveraldo SantosÎncă nu există evaluări
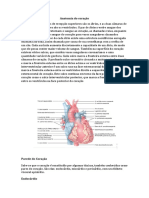
- Anatomia Do CoraçãoDocument5 paginiAnatomia Do CoraçãoLucas NevesÎncă nu există evaluări
- 15-Electricidade BateriasDocument13 pagini15-Electricidade BateriasPaulo Jorge100% (3)
- Lista 10Document14 paginiLista 10Bruno ToledoÎncă nu există evaluări
- Métodos de Separação 11 - Eletroforese CapilarDocument34 paginiMétodos de Separação 11 - Eletroforese Capilarkaroline Dutra do Amaral AndradeÎncă nu există evaluări
- Electrolux - Manutenção Preventiva e Preditiva - TécnicaDocument19 paginiElectrolux - Manutenção Preventiva e Preditiva - TécnicaJhonnyÎncă nu există evaluări
- Bake Me Por Danielle Trolezi: Panna Cotta e Uso Da GelatinaDocument7 paginiBake Me Por Danielle Trolezi: Panna Cotta e Uso Da GelatinaFernanda GracianoÎncă nu există evaluări
- Terapia MagnetoterapiaDocument150 paginiTerapia MagnetoterapiaLayla Souza100% (1)
- Anamnese InfantilDocument2 paginiAnamnese InfantilFernanda TessaroÎncă nu există evaluări
- Abelhas Sem FerrãoDocument2 paginiAbelhas Sem FerrãoCristina SantosÎncă nu există evaluări
- Hmus-Rpcar002 Rev07 Setembro2017 Utopia HFC R-410a1Document104 paginiHmus-Rpcar002 Rev07 Setembro2017 Utopia HFC R-410a1RafaelÎncă nu există evaluări
- Alara-Otimização de DoseDocument8 paginiAlara-Otimização de DoseDiana Lourenço BrandãoÎncă nu există evaluări
- NIT Dicla 39 - 03Document6 paginiNIT Dicla 39 - 03Lucas GoncalvesÎncă nu există evaluări
- Decreto #57.resumoDocument2 paginiDecreto #57.resumounitedidiomasconsultorjoaoÎncă nu există evaluări
- Lista de Espécies e P NPDocument131 paginiLista de Espécies e P NPRafael Ramos CastellariÎncă nu există evaluări
- PLANO DE ENSINO FIS Farmácia 2022Document6 paginiPLANO DE ENSINO FIS Farmácia 2022JaYÎncă nu există evaluări
- D3 D4 Simulado 3sérieDocument3 paginiD3 D4 Simulado 3sérieandressaÎncă nu există evaluări
- Aula 3 - Anomalias DentariasDocument75 paginiAula 3 - Anomalias Dentariasrobertoflycat22Încă nu există evaluări
- INIC2020 A Importância Da Fisioterapia para Os Idosos Institucionalizados-Rebeca Ariadne de Lima (6476)Document9 paginiINIC2020 A Importância Da Fisioterapia para Os Idosos Institucionalizados-Rebeca Ariadne de Lima (6476)Rebeca Ariadne de LimaÎncă nu există evaluări
- DouradoDocument6 paginiDouradoDavid MesquitaÎncă nu există evaluări
- Caderno de Questões: 1) CorretaDocument59 paginiCaderno de Questões: 1) CorretaMarco AurélioÎncă nu există evaluări
- Manual de Acolhimento No Acesso Ao Sistema de Saúde de Cidadaos EstrangeirosDocument48 paginiManual de Acolhimento No Acesso Ao Sistema de Saúde de Cidadaos EstrangeirosAllen PrinceÎncă nu există evaluări
- E-Book Onde Comer Como Um Local Na ItáliaDocument15 paginiE-Book Onde Comer Como Um Local Na ItáliaWillyanÎncă nu există evaluări
- Cebraci-045-Instrução Tecnica Liquido Penetrante-Lp - It-Lb-004Document2 paginiCebraci-045-Instrução Tecnica Liquido Penetrante-Lp - It-Lb-004leonardo_barros_48100% (2)
- Resumo de Saúde Coletiva 2-Bimestre - UNINGADocument27 paginiResumo de Saúde Coletiva 2-Bimestre - UNINGALaura ZabiskyFlorestaÎncă nu există evaluări