Documente Academic
Documente Profesional
Documente Cultură
Pruebas Bioquimicas 4 Semestre
Încărcat de
Jorge Alberto RamirezTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Pruebas Bioquimicas 4 Semestre
Încărcat de
Jorge Alberto RamirezDrepturi de autor:
Formate disponibile
BACTERIAS GRAM NEGATIVAS INTRODUCCION Las bacterias vistas al microscopio generalmente aparecen como esferas o como bastones rectos
o curvos, estas pueden clasificarse dependiendo de su forma, en cocos (esfricas), bacilos (bastones rectos) y espirilos (bastones curvos). Otra forma de clasificar las bacterias es aerobia, las que necesitan aire para vivir, anaerobia, que no pueden vivir en presencia de aire y por ltimo, aquella que indiferentemente pueden vivir con aire o sin ste. Tambin las bacterias se pueden dividir en dos grupos: Gram Positivo (+) y Gram negativo (-). Esta divisin se basa en la capacidad de reaccin de las bacterias frente al mtodo de coloracin, desarrollado por Christian Gram en 1884. Las que se tien con el colorante son Gram + y aquellas que no toman el colorante son Gram -. Normalmente a los gneros de Gram negativos y positivos se les realiza pruebas bioqumicas como son: LIA, MIO, SIM, CITRATO, KLIGGER, TSI, UREA, FENILALANINA entre otras...que ayudan en su identificacin, en el caso de las Gram negativas, existen otros tipos de medios de cultivo, as como pruebas, como es el caso de la cataraza y coagulasa. Uno de los gneros mas importantes del mundo microbiolgico bacteriano son las enterobacterias las cuales son de tipo Gram negativo, que por definicin son microorganismos entericos que producen enfermedad en el hombre y en todas las especies, como enteritis o la tpica diarrea, su aislamiento y cultivo son en medios selectivos diferenciales y perfiles bioqumicos. Una de las especies ms sobresalientes es la E.Coli. La Escherichia Coli es una bacteria que se encuentra generalmente en los intestinos animales, incluido el humano y, por ende, en las aguas negras. Fue descrita por primera vez en 1885 por Theodor von Escherich, bacterilogo alemn, quin la denomin Bacterium coli. Posteriormente la taxonoma le adjudic el nombre de Escherichia coli, en honor a su descubridor. sta y otras bacterias son necesarias para el funcionamiento correcto del proceso digestivo. Adems produce vitaminas B y K. Es un bacilo que reacciona negativamente a la tincin de Gram, es anaerobio facultativo, mvil por flagelos peritricos (que rodean su cuerpo), no forma esporas, es capaz de fermentar la glucosa y la lactosa, en 48 horas con produccin de gas y cidos orgnicos (fermentacin cido mixta). Si el microorganismo fermenta la lactosa y/o la sacarosa, como las concentraciones de estos azcares son 10 veces mayores a la glucosa, se producir gran cantidad de cido (que no puede ser neutralizado por la produccin de aminas en la superficie), por lo tanto todo el tubo (pico y fondo) virar al color amarillo (cido). Es decir las colonias que fermentan la lactosa producirn suficiente cido para causar el vire del indicador. La supervivencia de estas bacterias en medios no entricos es limitada por lo que su presencia indica una contaminacin reciente. Por estas razones, E. coli es el microorganismo ndice ideal para la deteccin de contaminaciones recientes. Los Proteus mirabilis son una bacteria Gram.-negativa, facultativo anaerobia que pertenece a la familia de las Enterobacteriaceae, este demuestra salida en enjambre, motilidad, y actividad del ureasa. Los cuales causan el 90% de todas las infecciones del Proteus. Es decir al igual que otras enterobacterias como E.coli, causa con ms frecuencia infeccin urinaria y cutnea. Est tambin implicado en septicemia especialmente en pacientes inmuncomprometidos, y ocasionalmente produce infeccin pulmonar. Se cree que el germen alcanza la va area por inhalacin, implicndose el papel de la colonizacin intestinal como posible reservorio. Los mirabilis del Proteus, se pueden diagnosticar en el laboratorio debido al motilidad caracterstico de la salida en enjambre, y la inhabilidad de metabolizar la lactosa (en una placa de agar de Mac Conkey, por ejemplo.) a causa de ello originan coloraciones incoloras. Es decir el agar de Mac Conkey es de gran apoyo ya que es un medio diferencial que permite distinguir entre enterobacterias que hidrolizan lactosa y las que no lo hacen, por decir si la bacteria es lactosa positiva la hidrlisis de la lactosa produce cidos orgnicos y las colonias que la hidrolizan adquieren un color rojo o rosa, en el caso de que las colonias fueran lactosas negativas permanecen incoloras aunque el medio vira a amarillo por la subida de pH que origina la utilizacin de las protenas (peptona) que se encuentran en el medio. Generalmente los proteus son susceptibles a la mayora de los antibiticos aparte de la tetraciclina, no obstante 10%20% de tensiones de los mirabilis del Proteus. Las caractersticas ms comunes del genero proteus es que pueden utilizar la urea y el citrato, al igual que producir el gas del sulfuro del hidrgeno, y formar las pelculas claras en medios del crecimiento. Comnmente las bacterias pueden ser encontradas a travs de las piedras, y estas bacterias que estn al acecho en las piedras pueden dar una infeccin despus del tratamiento antibitico. En el caso de los entericos positivos como los estafilococos, estreptococos, Corinebacterias, Clostridios entre otros, crecen en medios enriquecidos como el agar sangre o normalmente los medios suelen ser combinados, por ejemplo: Un medio de eosina azul de metileno es un medio selectivo diferencial. Este medio se utiliza para diferenciar las bacterias Gram positivas, a las que inhibe el crecimiento, de las Gram negativas como las enterobacterias (E. coli). Este medio contiene lactosa como nutriente, y al ser tomado por las enterobacterias se produce cido, que hace que el pH del medio baje, por lo que el color del medio pasar a ser violeta oscuro. Si por el contrario las bacterias existentes en el medio no utilizan lactosa, no se produce cido, por lo que dan lugar a colonias incoloras.
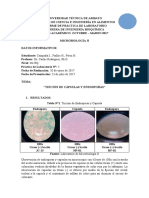
Las infecciones bacterianas son las ms frecuentes, representando entre el 50 y 80% de todas las complicaciones infecciosas generalmente representadas por bacterias Gram positivas que negativas, prevaleciendo el Staphylococcus aureus, pero ninguna bacteria esta exenta de causar enfermedad, por que en casos son indispensables ciertos factores. MATERIALES Y METODOS A partir de una cepa microbiana, etiquetada como cepa numero 12 y 13 se tomo una muestra, la cual se sembr en agar Mac Conkey, en forma de estriado, para despus incubar a 37 C, durante 24 horas. Pasado el tiempo, se realizaron las observaciones en cada placa, a partir de ello se procedi a la identificacin de microorganismos con la ayuda de una tincin Gram, la cual fue necesaria para la obtencin de datos mas cercanos al microorganismo presente. Debido a la obtencin de una colonia lactosa negativa y positiva, se realizaron pruebas bioqumicas, es decir se tomo una pequea muestra del cultivo y se inoculo de forma recta y estriado en cada una de las pruebas, segn halla sido el caso, despus del sembrado del microorganismo se incubaron a 37 C, durante 24 horas, para despus discutir las observaciones. RESULTADOS Basndonos en la actividad realizada, se discuti lo siguiente: En la siembra de la cepa 12, en medio Mac Conkey se observo que la colonia era de forma redonda y de tamao pequea, con un color rosa plido, en base a sus caractersticas fsicas se dedujo que era lactosa negativa.
Crecimiento de Proteus Mirabilis en agar Mac Conkey
Para la cepa 13 se observaron colonias en forma redondas, de tamaos grandes y chicos, con un color rosa fuerte, en base a sus caractersticas fsicas se dedujo que era lactosa positiva.
Tincin de Gram:
Crecimiento de E. coli en agar Mac Conkey.
Cepa 12: se encontraron bacilos en color morado, sin presencia de otro microorganismo. Cepa 13: se observaron microorganismos cocobasilares. En el caso de las pruebas bioqumicas, mediante cambios de coloracin, motilidad y presencia de H2S, segn haya sido el caso, se dedujo la presencia de E.coli en la cepa nmero 13 y proteus mirabilis en cepa 12.
PRUEBA DE CATALASA Introduccin Estafilococo, del griego Staphyl, que significa racimo de uvas, es una variedad bacteriana de la familia de los cocos. Poseen forma esfrica y se agrupan formando grandes masas bacterianas en forma de racimo. Son del tipo conocido como Gram Positivo. Los estafilococos son la variedad ms virulenta de la familia de los cocos, y son responsables de un gran espectro de enfermedades, desde infecciones cutneas hasta neumona, sepsis, etc. Estos microorganismos estn presentes en la mucosa y en la piel de los humanos y de otros mamferos y aves. El gnero comprende en la actualidad a 32 especies y 15 subespecies, muchas de las cuales se encuentran en los humanos. Las especies que se asocian con ms frecuencia a las enfermedades en humanos son Staphylococcus aureus (el miembro ms virulento y conocido del gnero), Staphylococcus epidermidis, Staphylococcus saprophticus, Staphylococcus capitis y Staphylococcus haemolyticus. Los estafilococos crecen fcilmente sobre casi todos los medios bacteriolgicos, en condiciones aerbicas se da el mejor crecimiento. Su mayor velocidad de crecimiento es a 5-25C. Pero tambin se puede ver en activa fisin binaria entre 30 y 27 C Los Estafilococos producen catalasa, lo que los diferencia de los estreptococos.
Staphylococcus Fundamento La enzima descompone el perxido de hidrgeno H2O2
Streptococcus
Mtodo: Aadir una gota de H2O2 a un cultivo denso y buscar burbujas (O2) Se utiliza para comprobar la presencia del enzima catalasa que se encuentra el la mayora de las bacterias aerobias y anaerobias facultativas que contienen citocromo. La principal excepcin es Streptococcus. 2H2O2 ---Catalasa---> 2H2O + O2 Originariamente, esta prueba era utilizada para diferenciar entre los siguientes gneros: Streptococcus (-) de Micrococcus (+) y/o Staphylococcus (+). Bacillus (+) de Clostridium (-). Lysteria monocytogenes (+) y/o Corynebacterium (+, con las excepciones de C.pyogenes y C.haemolyticum, ambos -) de Erysipelothrix (-)
MATERIALES Y METODOS Una prueba de rutina de la catalasa a temperatura ambiente puede hacerse siguiendo dos tcnicas: 1-. Mtodo del portaobjetos (recomendado): Con el asa de siembra recoger el centro de una colonia pura de 18-24 horas y colocar sobre un portaobjetos limpio de vidrio. Agregar con gotero o pipeta Pasteur una gota de H2O2 al 30% sobre el microorganismo sin mezclarlo con el cultivo. Observar la formacin inmediata de burbujas (resultado positivo). Desechar el portaobjetos en un recipiente con desinfectante. Si se invierte el orden del mtodo (extender la colonia sobre el agua oxigenada) pueden producirse falsos positivos. RESULTADOS Al realizar la prueba de la Catalasa arrojo un resultado positivo indicando que el microorganismo encontrado se trata de un Staphylococcus y no un Streptococcus. La funcin de esta prueba es diferenciar los gneros de Staphylococcus de los gneros de Streptococcus. PRUEBA DE COAGULASA Introduccin Los estafilococos coagulasa negativos son un grupo de microorganismos frecuentes en la piel, causa de infecciones nosocomiales sobre todo en recin nacidos de bajo peso y en pacientes inmunocomprometidos (con SIDA, con cncer, etc.). Una alta proporcin de los estafilococos coagulasa negativos aislados son portadores del gen mcA que le confiere resistencia a las betalactamasas (meticilina). Se han identificado hasta el presente 37 especies de estafilococos coagulasa negativos, de ellas 13 pueden originar infecciones en humanos. La sensibilidad a la novoviocina se utiliza para clasificar el estafilococo coagulasa negativo en dos grupos. La cepas con susceptibilidad a la novoviocina incluyen entre otras Staphylococcus epidermidis, Staphylococcus haemolyticus, Staphylococcus hominis, Staphylococcus lugdunensis, y Staphylococcus schlefieri; por el contrario entre las cepas resistentes a la novoviocina se incluyen Staphylococcus saprophyticus y Staphylococcus xylosus que originan infecciones urinarias en huspedes inmunocompetentes. Al ser el estafilococo coagulasa negativo un comensal habitual de la piel, la distincin entre infeccin y contaminacin puede resultar en ocasiones difcil. Por ello, habitualmente se considera como criterio necesario de infeccin adems de un hemocultivo positivo, la existencia de manifestaciones clnicas de infeccin o una elevacin de algn parmetro inflamatorio. Algunos son ms estrictos en los criterios diagnsticos de infeccin por estafilococo coagulasa negativo y consideran necesario al menos 2 hemocultivos positivos.
Staphylococcus coagulasa negativa fundamento
staphylococcus aureus
Esta prueba se utiliza para diferenciar al Staphylococcus aureus (coagulasa positivo) de otras especies del gnero Staphylococcus. La coagulasa es una enzima que estimula la conversin del fibringeno en fibrina, por lo que comprueba la facultad de un microorganismo de coagular el plasma por accin de esta enzima. Si es coagulasa positivo, se produce una turbidez alrededor de la colonia, debida a la coagulacin del plasma. Por otro lado, realizamos esta prueba cultivando a las bacterias en un medio rico en manitol (adems de plasma). El manitol es un azcar y gracias a este medio podremos distinguir si el microorganismo lo utiliza como fuente de carbono. Si es capaz de usarlo, se produce una acidificacin del medio, lo que da lugar a un viraje del indicador de pH de rojo a amarillo.
MATERIALES Y METODOS Para esta prueba se aade una suspensin densa de bacterias a un tubo pequea con plasma. Y se incuba a 37 oC. Se observa la coagulacin a las 4 y 24 h sin sacarlos de la estufa. Si aparece un coagulo en la suspensin el resultado ser positivo. De no observarse nada en la solucin, el resultado se tomara como negativo. RESULTADOS El resultado arrojado despus de haber realizado la prueba de la coagulasa fue negativo por lo que se compraba que el microorganismo encontrado es un Staphylococcus coagulasa negativo. Con este resultado se puede asegurar de que la especie estudiada no se trata de un Staphylococcus aureus. SIM (SULFURO-INDOL-MOTILIDAD) Introduccin Es un medio semislido destinado a verificar la movilidad, produccin de indol y de sulfuro de hidrgeno en un mismo tubo. Es til para diferenciar miembros de la familia Enterobacteriaceae.
Fundamento El triptfano es un aminocido constituyente de muchas peptonas, y particularmente de la triptena, que puede ser oxidado por algunas bacterias para formar indol. En el proceso interviene un conjunto de enzimas llamadas triptofanasa. El indol producido se combina con el aldehdo del reactivo de Kovacs o de Erlich, para originar un compuesto de color rojo. Las cepas mviles pueden apreciarse en este medio, por la turbidez que producen alrededor de la puncin de siembra, mientras que aquellas cepas productoras de sulfhdrico se distinguen por la formacin de un precipitado negro de sulfuro de hierro a partir del tiosulfato siempre que el medio se mantenga a un pH mayor a 7.2. Reacciones Produccion de indol
Triptofanasa
Triptofano ( C11H12N2O2 )
indol ( C8H7N )
Produccion de H2S
+ H+
H2S
Cisteina
on hidrogeno
Acido sulfhidrico
MATERIALES Y METODOS Siembra A partir de un cultivo de 18-24 horas en medio slido, sembrar por puncin profunda con aguja de inoculacin recta. Se debe inocular el centro del tubo, y la puncin debe abarcar 2 tercios de profundidad del medio de cultivo desde la superficie. Incubacin Durante 24 horas, a 35-37C, en aerobiosis. Luego de la incubacin, agregar 3-5 gotas de reactivo de Kovacs o de Erlich. RESULTADOS Cepas mviles: producen turbidez del medio, que se extiende ms all de la lnea de siembra. Cepas inmviles: el crecimiento se observa solamente en la lnea de siembra. Cepas SH2 positivas: ennegrecimiento a lo largo de la lnea de siembra o en todo el medio.
Cepas SH2 negativas: el medio permanece sin cambio de color. Cepas indol positivas: desarrollo de color rojo luego de agregar el reactivo de Kovacs o de Erlich. Cepas indol negativas: sin cambio de color.
Sulfuro indol motilidad
Se observa la produccin de sulfuros, que se precipitan con iones frricos, a partir del tiosulfato de sodio presente en el medio. La prueba positiva se muestra un precipitado negro en el medio de cultivo donde creci la bacteria as tambin una turbidez en el medio debido ala motilidad de la bacteria
Sulfuros indol motilidad
Se observa una coloracin caf oscuro alrededor de la puncin lo que indica el crecimiento, as tambin la motilidad de la bacteria y la falta de produccin de sulfuro en el medio. Sulfuro indol motilidad
Se
observa la capacidad de la bacteria para desdoblar el triptfano por medio de la enzima triptofanasa y producir INDOL. Al adicionar Kovacs sobre el medio cuando hay produccin de Indol se forma un anillo rojo (tubo de la derecha). De lo contrario se forma un anillo amarillo (tubo del centro y la izquierda).
Resultados obtenidos en la realizacin de la prueba
MO. Encontrado E. coli P.mirabilis
Prueba bioqumica SIM SIM
Movilidad Positivo Negativo
Indol Positivo Positivo
H2S Negativo Positivo
PRUEBA DEL CITRATO Introduccin Esta prueba sirve para determinar si un organismo es capaz de utilizar citrato como nica fuente de carbono y compuestos amoniacales como nica fuente de nitrgeno en su metabolismo, provocando una alcalinizacin del medio. Entre las enterobacterias estas caractersticas se dan en los siguientes gneros: Enterobacter, Klebsiella, Serratia, Citrobacter y algunas especies de Salmonella. Sin embargo, Escherichia, Shigella, Salmonella typhi y Salmonella paratyphi son incapaces de crecer con esos nutrientes. Se cultiva el microorganismo en agar citrato de Simmons. Este medio contiene citrato de sodio y fosfato de amonio como fuentes de carbono y de nitrgeno respectivamente y azul de bromotimol como indicador de pH. Slo las bacterias capaces de metabolizar el citrato podrn multiplicarse en este medio y liberarn iones amonio lo que, junto con la eliminacin del citrato (cido), generar una fuerte basificacin del medio que ser aparente por un cambio de color del indicador de pH, de verde a azul. Fundamento En el medio de cultivo, el fosfato monoamnico es la nica fuente de nitrgeno y el citrato de sodio es la nica fuente de carbono. Ambos componentes son necesarios para el desarrollo bacteriano. Las sales de fosfato forman un sistema buffer, el magnesio es cofactor enzimtico. El cloruro de sodio mantiene el balance osmtico, y el azul de bromotimol es el indicador de pH, que vira al color azul en medio alcalino. El medio de cultivo es diferencial en base a que los microorganismos capaces de utilizar citrato como nica fuente de carbono, usan sales de amonio como nica fuente de nitrgeno, con la consiguiente produccin de alcalinidad. El metabolismo del citrato se realiza, en aquellas bacterias poseedoras de citrato permeasa, a travs del ciclo del cido tricarboxlico. El desdoblamiento del citrato da progresivamente, oxalacetato y piruvato. Este ltimo, en presencia de un medio alcalino, da origen a cidos orgnicos que, al ser utilizados como fuente de carbono, producen carbonatos y bicarbonatos alcalinos. El medio entonces vira al azul y esto es indicativo de la produccin de citrato permeasa. Independientemente de los productos terminales producidos, el primer paso de la fermentacin del citrato da por resultado la produccin de piruvato. La degradacin del piruvato depende entonces, del pH del medio. Reacciones del citrato Citrato oxalacetato + acetato Piruvato + CO2
Los productos obtenidos del metabolismo del citrato dependen del medio. Si el pH aumenta (alcalino), se produce ms acetato y formato con una disminucin de la produccin del lactato y CO2, por encima de pH 7 no hay produccin de lactato y los productos son: Citrato CO2 + acido formico + 2 acido actico
Con el pH acido el acetilmetilcarbinol (acetoina) y el lactato son los principales productos de utilizacin del citrato. Independientemente de los productos terminales producidos, el primer paso de la fermentacin del citrato da como resultado la produccin de piruvato. La degradacin del piruvato depende entonces del pH del medio
MATERIALES Y METODOS
Siembra A partir de un cultivo de 18-24 horas en medio slido, sembrar por puncin profunda con aguja de inoculacin recta y estriado en la superficie. Incubacin Durante 24 horas, a 35-37C, en aerobiosis. RESULTADOS Prueba de citrato Simmons positiva: crecimiento con un color azul intenso en el pico de flauta Prueba negativa: No se observa crecimiento ni cambio de color (verde) POSITIVA NEGATIVO
Resultados obtenidos en la realizacin de la prueba MO. Encontrado Prueba bioqumica Resultado
E. coli P.mirabilis
Citrato Citrato
Negativo Negativo
KLIGLER (AGAR CON HIERRO) Introduccin El agar con hierro de Kligler (KIA) y el agar con azcar triple y hierro (TSI) son medios de cultivo diferenciales en tubo que cumplen un doble propsito: a) la determinacin de fermentaciones de hidratos de carbono y b) la determinacin de la produccin de H2S. El KIA contiene dos hidratos de carbono: 1% de lactosa y 0.1% de glucosa. El TSI puede sustituir el KIA: la diferencia primaria es el agregado de un tercer hidrato de carbono, la sacarosa, a una concentracin del 1%. En el KIA, algunos microorganismos pueden fermentar ambos hidratos de carbono, otros fermentan solo la glucosa: incluso otros no pueden fermentar ni la lactosa ni la glucosa. La fermentacin de los hidratos de carbono puede ocurrir con produccin de gas o sin ella (CO2 + H2). La fermentacin tiene lugar tanto en aerobiosis (en el pico de flauta) como en anaerobiosis (en el fondo). En el pico de flauta, el monosacrido glucosa es catabolizado inicialmente por la va metablica anaerobia de EmbdenMeyerhof-Parnas, usadas por aerobios y anaerobios para producir el intermediario clave cido pirvico. El cido pirvico es degradado luego a travs del ciclo de Krebs por aerobios o anaerobios facultativos para rendir CO2, H2O y energa. Fundamento
Determinar la capacidad de un microorganismo para atacar un hidrato de carbono especfico incorporado en un medio de desarrollo basal, con produccin de gas o sin ella, junto con la determinacin de la posible produccin de cido sulfhdrico (H2S). La produccin de H2S y/o los patrones de fermentacin por lo general son caractersticos de grupos bacterianos especficos, gneros o especies, sobre todo entre los miembros de la familia Enterobacteriaceae. Las reacciones del KIA se usan principalmente para identificar a los miembros de la familia Enterobacteriaceae (entricos), que por definicin son bacilos Gram negativos catalasa positivos, todos los cuales fermentan la glucosa con produccin de cido. As mismo, existen muchos bacilos intestinales Gram negativos no entricos cuya identificacin o separacin de la familia Enterobacteriaceae es facilitada por sus reacciones en el KIA. Se observan tres patrones de fermentacin bsicos en el medio KIA: a) fermentacin solo de la glucosa, b) fermentacin de glucosa y de lactosa y c) ausencia de fermentacin de glucosa o de lactosa.
MATERIALES Y METODOS Siembra A partir de un cultivo de 18-24 horas en medio slido, sembrar por puncin profunda con aguja de inoculacin recta y estra en la superficie. Se debe inocular el centro del tubo, y la puncin debe abarcar 2 tercios de profundidad del medio de cultivo desde la superficie. Incubacin Durante 24 horas, a 35-37C, en aerobiosis Reaccin
Peptonas Anaerbicamente Amoniaco (NH3)
RESULTADOS Fermentacin solo de la glucosa (alcalino/cido) El primer patrn del KIA despus de las 18-24 horas de incubacin es un pico de flauta alcalino de un fondo cido. Esta reaccin se observa con los microorganismos capaces de fermentar solo la glucosa: son los no fermentadores de la lactosa. El pico de la flauta es alcalino (rojo), lo cual indica la degradacin aerobia de la glucosa. Despus de 18-24 horas de incubacin, la concentracin baja de la glucosa (0.1%) se agota y el microorganismo empieza a usar las peptonas del medio como nutrientes de desarrollo. El catabolismo de la peptona libera amoniaco (NH3) que alcaliza el pH con el rojo fenol, el indicador de pH incorporado en el medio. Sin embargo, el fondo del KIA tiene un color amarillo debido ala degradacin anaerobia de la glucosa. La glucosa aqu tambin es degradada despus de 18-24 horas de incubacin: sin embargo, se forman productos finales cidos lo que produce un pH cido (color amarillo); la reaccin cida se mantiene en el fondo debido a la tensin de oxigeno mas baja. Fermentacin de lactosa y de glucosa (cido/cido) Algunos microorganismos pueden fermentar la lactosa y la glucosa para obtener sus nutrientes y producen una reaccin en el KIA con un pico de flauta cido y un fondo cido (cido/cido) despus de 18-24 horas de incubacin. La concentracin de lactosa (1%) es 10 veces la de la glucosa. En 18-24 horas, la lactosa (presente en mayor cantidad) no se ha agotado y todava existe un medio cido, si el mismo tubo de KIA se leyera despus de 48 horas o ms, el pico de flauta se pondra finalmente alcalino debido al agotamiento de la lactosa y al uso de las peptonas.
Aerbicamente
Ausencia de fermentacin de lactosa y de glucosa (Alcalino/alcalino; alcalino/sin cambios)
Ciertas bacterias, principalmente los bacilos Gram negativos no entricos, no pueden fermentar ni la glucosa ni la lactosa. Estas bacterias estn presentes en el tracto intestinal junto con los miembros de la familia Enterobacteriaceae y es necesario identificarlas definitivamente como no entricas. Dado que estas bacterias no pueden obtener sus nutrientes a partir de los hidratos de carbono, dependen de la peptona del medio. Estos microorganismos no entricos pueden usar la peptona de manera aerbica o anaerbica y producen dos reacciones posibles en el KIA. Un microorganismo que produce un KIA con un pico de flauta alcalino y el fondo alcalino degrada la peptona aerbica y anaerbicamente. Una reaccin con un pico de flauta alcalino y ningn cambio en el fondo es el resultado de un microorganismo que puede catabolizar la peptona slo aerbicamente: por ende, slo el pico de flauta muestra un cambio de color (rojo). Cuando las peptonas son degradadas y producen un pH alcalino debido a la liberacin de amoniaco (NH3), el medio adquiere un color rojo profundo. Por consiguiente, una reaccin en KIA puede interpretarse de cuatro maneras, segn las bacterias a probar: Alcalino/cido: slo la glucosa es degradada. cido/cido: glucosa y lactosa degradadas. Alcalino/alcalino: ni la glucosa ni la lactosa son degradadas, uso de las peptonas. Alcalino/sin cambios: ni la glucosa ni la lactosa son degradadas: uso de las peptonas. REACCION Alc/A (rojo/amarillo) A/A (amarillo/amarillo) Alc/Alc (rojo/rojo) KIA Slo la glucosa sola fermentada Peptonas usadas Glucosa fermentada, Lactosa fermentada Ausencia de fermentacin de la glucosa y la lactosa; peptonas usadas
Formacin de h2s Otro sistema para la diferenciacin es aportado por los indicadores de H2S presentes en el medio: una sal, el citrato de amonio frrico, y otro producto qumico, el tiosulfato de sodio. Ambos indicadores deben estar presentes, ya que el resultado final es un procedimiento en dos pasos. Paso 1
Bacteria (en ambiente cido) + tiosulfato de sodio
H2S gaseoso
El H2S es un gas incoloro: por ello, es necesario un segundo indicador para visualizar la produccin de H2S. Paso 2 El precipitado negro del sulfuro ferroso que indica la produccin de H2S puede enmascarar la condicin cida producida en el fondo del KIA: por consiguiente, si se produce H2S, existe una condicin cida aun cuando no sea evidente.
H2S + iones frricos
Sulfuro ferroso
(Precipitado negro insoluble)
Resultados obtenidos en la realizacin de la prueba MO. Encontrado E. coli P.mirabilis Prueba bioqumica Kigler Kigler Resultado Negativo Negativo
MIO (MOTILIDAD, INDOL, ORNITINA DESCARBOXILASA) Introduccin Medio usado para la identificacin de Enterobacterias basndose en su movilidad, actividad de ornitina descarboxilasa y produccin de indol. Medio de cultivo semislido, altamente nutritivo debido a la presencia de extracto de levadura, peptona y tripteina. Adems, la tripteina aporta grandes cantidades de triptfano, sustrato de la enzima triptofanasa, para la realizacin de la prueba del indol. La dextrosa es el hidrato de carbono fermentable, la ornitina es el sustrato para la deteccin de la enzima ornitina descarboxilasa, el prpura de bromocresol es el indicador de pH, que en medio alcalino es de color prpura y en medio cido es amarillo. Fundamento Por su composicin, es posible detectar 3 reacciones en un mismo tubo: movilidad, presencia de ornitina descarboxilasa e indol. La movilidad se demuestra por un enturbiamiento del medio o por crecimiento que difunde ms all de la lnea de inoculacin. La reaccin positiva a la ornitina esta dada por un color prpura del medio. Debido a la fermentacin de la glucosa se reduce el pH produciendo una condicin cida y originando que el indicador de pH prpura de bromocresol vire al amarillo. La presencia de acidez, otorga condiciones optimas para la actividad de la enzima ornitina descarboxilasa, la cual descarboxila la ornitina presente. Por descarboxilacin, se alcaliniza el medio, con el consecuente viraje del indicador hacia el color prpura. El indol producido a partir del triptfano por los microorganismos que contienen la enzima triptofanasa. El desarrollo de un color rojo luego de agregar unas gotas de reactivo de Kovacs o de Erlich, indica un resultado positivo. MATERIALES Y METODOS Siembra A partir de un cultivo de 18-24 horas en medio slido, sembrar por puncin profunda con aguja de inoculacin recta. Se debe inocular el centro del tubo, y la puncin debe abarcar 2 tercios de profundidad del medio de cultivo desde la superficie. Incubacin De 18 a 24 horas, a 35C, en aerobiosis Para la prueba de indol se aaden de 3 a 4 gotas de reactivo de Kovacs, y se agita suavemente el tubo. RESULTADOS Observaciones La movilidad es indicada por turbidez del medio o por crecimiento extendido a partir de la lnea de inoculacin. La ornitina descarboxilasa es indicada por el color prpura del medio. La ornitina negativa es indicada por un color amarillo, en el fondo puede ser prpura al final. La aparicin de color rosa o rojo en el reactivo se interpreta como prueba positiva de indol. Interpretacin de resultados 1.- MOVILIDAD Positivo: presencia de turbidez o crecimiento ms a all de la lnea de siembra
Negativo: crecimiento solamente en la lnea de siembra
2.- ORNITINA DESCARBOXILASA Positivo: color prpura
Negativo: color amarillo, a veces se puede observar color prpura en el fondo
3.- PRUEBA DEL INDOL: Positivo: color rojo al agregar el reactivo de Kovacs
Negativo: el color del reactivo de Kovacs permanece incoloro-amarillento
Resultados obtenidos en la realizacin de la prueba MO. Encontrado E. coli P.mirabilis Prueba bioqumica MIO MIO Movilidad Positivo Positivo Indol Negativo Positivo Ornitina Positivo Positivo
TRIPLE AZUCAR (TSI) Introduccin E TSI es un medio nutriente y diferencial que permite estudiar la capacidad de produccin de cido y gas a partir de la glucosa, sacarosa y lactosa en un nico medio. Tambin permite la identificacin de la produccin de SH2. Esta es una prueba especfica para la identificacin a nivel de gnero en la familia Enterobacteriaceae. Con objetivo de diferenciar entre: Bacterias fermentadoras de la glucosa Bacterias fermentadoras de la lactosa. Bacterias fermentadoras de sacarosa. Bacterias aerogenicas. Bacterias productoras de SH2 a partir de sustancias orgnicas que contengan azufre. Fundamento El agar se prepara en forma de pico de flauta. Esto determina que existan dos cmaras de reaccin dentro del mismo tubo. La porcin inclinada (pico) expuesta en toda su superficie al oxgeno es aerobia y la porcin inferior (fondo) est protegida del aire y es relativamente anaerobia. Al crecer un microorganismo en el TSI, el pico tiende a virar al pH alcalino (color rojo por el rojo fenol) por la produccin de aminas, debido a la utilizacin aerobia de las peptonas. En el fondo del tubo -donde no hay oxgeno- la degradacin de peptonas es menor y no se generan aminas, de manera que se pueden detectar la produccin de pequeas cantidades de cido (color amarillo por el rojo fenol). Si se inoculan microorganismo no fermentadores no se formarn cidos, pero por la produccin de aminas en el pico, todo el medio quedar rojo. La glucosa en el TSI est en una proporcin 10 veces menor que la lactosa y la sacarosa. Si el TSI es inoculado con una bacteria fermentadora de glucosa pero no de lactosa ni de sacarosa, la cantidad de cido producida por fermentacin ser baja (porque la cantidad de glucosa inicial es baja). En las primeras horas (10 a 16 hrs.) de incubacin se producir viraje del indicador al amarillo en todo el tubo (pico y fondo), pero al continuar la incubacin, el pico del tubo retornar al rojo por la produccin de aminas debida a la degradacin aerobia de las peptonas antes descrita. Si el microorganismo fermenta la lactosa y/o la sacarosa, como las concentraciones de estos azcares son 10 veces mayores a la glucosa, se producir gran cantidad de cido (que no puede ser neutralizado por la produccin de aminas en la superficie), por lo tanto todo el tubo (pico y fondo) virar al color amarillo (cido). La produccin de H2S a partir de tiosulfato se pone en evidencia por precipitacin del sulfuro ferroso (negro). Como esta reaccin se da preferencialmente en medio cido, un ennegrecimiento del fondo del tubo (que puede cubrir todo el fondo del tubo y enmascarar el color amarillo) se lee como fermentacin de algunos de los azcares del medio.
Adems puede observarse la produccin de gas (H2 y CO2), ya sea como burbujas en el fondo del tubo, por ruptura del agar o desplazamiento del mismo hacia la superficie. MATERIALES Y METODOS Siembra Con un asa recta de micromel tomar una colonia del microorganismo a investigar. Inocular los tubos de TSI con punta (alambre recto). Para eso introducir la punta hasta 3 a 5 mm del fondo del tubo. Tras retirar la punta del fondo, estriar el pico con un movimiento hacia uno y otro lado. Incubar a 37 C durante 18-24 hrs., pero no ms de 24 hrs. Incubacin De 18 a 24 horas, a 35C, en aerobiosis Para la prueba de indol se aaden de 3 a 4 gotas de reactivo de Kovacs, y se agita suavemente el tubo. DISCUSION Y RESULTADOS Taco cido (amarillo): Glucosa fermentada. Bisel cido (amarillo): Lactosa y/o sacarosa fermentada. Taco cido (amarillo): Glucosa fermentada. Bisel alcalino (rojo): Lactosa y/o sacarosa no fermentada. Taco alcalino (rojo) y Bisel alcalino (rojo): Ninguno de los tres glcidos es fermentado. La aparicin de burbujas en el taco indica que la fermentacin se ha efectuado con produccin de gas. Un ennegrecimiento en el medio indica la produccin de cido sulfhdrico.
A Glucosa, lactosa y/o sacarosa fermentada B Glucosa fermentada con produccin de cido sulfhdrico y gas C Glucosa fermentada con produccin de cido sulfhdrico D Ninguno de los tres azcares es fermentado
En el experimento que realizamos en el laboratorio de microbiologa inoculamos dos microorganismos desconocidos en tubos diferentes de agar TSI. Y por medio de esta prueba bioqumica acompaada de otras mas determnanos que los microorganismos encontrados eran los siguientes.
Resultados obtenidos en la realizacin de la prueba Moo. Encontrado Prueba bioqumica H2S MOTILIDAD FERMENTACION
E. coli P.mirabilis
TSI TSI
Negativo Positivo
Positivo Negativo
DE AZUCARES Positivo Negativo
LIA (AGAR HIERRO LISINA) Introduccin Esta prueba permite diferenciar el microorganismo. Que producen descarboxilacin o desaminacin de la lisina. Se puede detectar adems la produccin de H2S. Es muy utilizado en las tcnicas de bsqueda de Salmonella, principalmente para descartar otras bacterias que dan colonias de aspecto similar en los medios diferenciales utilizados durante el aislamiento selectivo. La glucosa es el hidrato de carbono fermentable, y la lisina es el sustrato utilizado para detectar la presencia de las enzimas decarboxilasa y deaminasa. El citrato de hierro y amonio, y el tiosulfato de sodio, son los indicadores de la produccin de cido sulfhdrico. El prpura de bromocresol, es el indicador de pH, el cual es de color amarillo a pH igual o menor a 5.2, y de color violeta a pH igual o mayor a 6.8. Las descarboxilasas son un grupo de enzimas sustrato-especificas, capaces de actuar sobre la porcin carboxilo (COOH) de los aminocidos, con formas de aminas de reacciona alcalina. Esta reaccin conocida como descarboxilacin, produce dixido de carbono con producto secundario. Cada una de las descarboxilasas es especfica para un aminocido. Lisina, ornitina y arginina son los tres aminocidos ensayados habitualmente en la identificacin de las enterobacterias y producen las siguientes aminas especficas. La cadaverina (o 1,5-diaminopentano o pentametilenodiamina pentano-1,5-diamina; o C 5H14N2) es una amina biognica que se obtiene por la descomposicin del aminocido lisina. Se encuentra principalmente en la materia orgnica muerta, y es responsable en parte del fuerte olor a descompuesto. La formacin de la cadaverina se esquematiza de la siguiente manera: (NH2) - (CH2)4-CH (COOH)-NH2 (Lisina) NH2-(CH2)5-NH2 (Cadaverina)
La Putrescina es un compuesto qumico orgnico NH2(CH2)4NH2 (1,4-diaminobutano o butanodiamina) que se crea al pudrirse la carne, dndole adems su olor caracterstico. Est relacionada con la cadaverina; ambos se forman por la descomposicin de los aminocidos en organismos vivos y muertos. La putrescina es producida en pequeas cantidades por las clulas vivas gracias a la accin de la ornitinadescarboxilasa. Las poliaminas, de las que la putrescina es uno de los ejemplos ms simples, parecen ser factores de crecimiento necesarios para la divisin celular. Otros compuestos qumicos que se caracterizan por su mal olor son el metanotiol y el cido butrico.
La arginina se sintetiza de citrulina por accin secuencial de las enzimas citoslicas argininosuccinato sintetasa (ASS) y de la argininosuccinato liasa (ASL). Esto es energticamente costoso, ya que la sntesis de cada molcula de argininosuccinato requiere la hidrlisis de adenosin trifosfato (ATP) a adenosin monofosfato (AMP); i.e., dos ATP equivalentes.
La citrulina es un compuesto que interviniente en el ciclo de la urea. Se forma por transferencia del grupo carbamoilo proveniente del anhdrido del cido fosfrico al grupo d-amino de la ornitina. El enzima ornitina transcarbamoilasa es tambin mitocondrial. La citrulina difunde desde la mitocondria al citosol, donde contina el resto del ciclo de la urea. El NO se produce mediante la accin de la enzima llamada xido ntrico sintasa (NOS, siglas que provienen del ingls nitric oxide synthase), la cual contiene diferentes molculas accesorias que trabajan en conjunto para formar el NO a partir del aminocido arginina y O2. Durante esta reaccin la arginina se convierte en una molcula de citrulina al liberar NO y consumir O2 (el cual dar lugar a una molcula de agua) La citrulina puede proveerse de mltiples fuentes:
De la arginina va xido ntrico sintetasa (NOS); De la ornitina va catabolismo de la prolilla o de la glutamina / glutamato; De la dimetilarginina asimtrica (ADMA) va DDAH.
La actividad de la enzima NOS se regula mediante la disponibilidad de diversas materias primas (o substratos), como son la arginina, el O2 y otras molculas que son necesarias para la sntesis del NO. En la conversin de arginina a citrulina interviene una dihidrolosa ms bien que una descarboxilasa, ya que en primer trmino un grupo NH2 es eliminado de la arginina. La citrulina es transformada en ornitina, que luego sufre descarboxilacin para formar putrescina. Por decarboxilacin de la lisina, se produce la amina cadaverina, que alcaliniza el medio y esto produce el viraje del indicador al color violeta. La decarboxilacin de la lisina, tiene lugar en medio cido, por lo que es necesaria que la glucosa sea previamente fermentada. Los microorganismos que no producen lisina decarboxilasa, pero que son fermentadores de la glucosa, producen un viraje de la totalidad del medio de cultivo al amarillo, pero a las 24 hrs. de incubacin se observa el pico de color violeta debido al consumo de las peptonas, y el fondo amarillo. La produccin de sulfuro de hidrgeno, se visualiza por el ennegrecimiento del medio debido a la formacin de sulfuro de hierro. Las cepas de los gneros Proteus, Providencia y algunas cepas de Morganella, desaminan la lisina, esto produce un cido alfa-ceto-carbnico, el cual, con la sal de hierro y bajo la influencia del oxgeno forma un color rojizo en la superficie del medio. Siembra Para eso introducir la punta hasta 3 a 5 mm del fondo del tubo. Tras retirar la punta del fondo, estriar el pico con un movimiento hacia uno y otro lado. Incubacin De 18 a 24 horas, a 37C, en aerobiosis
RESULTADOS
Pico alcalino/fondo alcalino/H2S +, descarboxilacin de lisina positiva. Ej.: Salmonella choleraesuis. Pico rojo/fondo cido/H2S-, desaminacin de lisina positiva, descarboxilacin de lisina negativa. Ej.: Proteus mirabilis. Pico alcalino/fondo cido/H2S- descarboxilacin de lisina negativa. Ej. E. coli Pico alcalino/fondo cido/H2S+ descarboxilacin de lisina negativa, produccin de H2S. Ej. Citrobacter freundii Coloraciones de las reacciones de la prueba bioqumica LIA.
Resultados obtenidos en la realizacin de la prueba Microorganismo Escherichia coli Proteus mirabilis Prueba bioqumica LIA LIA Resultado Negativa Positiva
PRODUCCIN DE UREASA Introduccin Determina la capacidad de un organismo de desdoblar la urea formando dos molculas de amoniaco por accin del enzima ureasa. Esta actividad enzimtica es caracterstica de todas las especies de Proteus y se usa sobre todo para diferenciar este gnero de otras enterobacterias que dan negativo o positivo retardado. Los microorganismos que poseen la enzima ureasa tienen la capacidad de hidrolizar urea con la liberacin de amoniaco. El caldo urea de stuart est fuertemente estabilizado con sales de fosfato a un ph de 6.8. El organismo en estudio debe producir cantidades relativamente grandes de amoniaco a fin de superar el sistema estabilizador y elevar el ph del medio lo suficiente como parar provocar el viaje del indicador (por encima de 8.0).El caldo urea de stuart es, por lo tanto, virtualmente selectiva para especies del genero Proteus. Fundamento Determina la capacidad de un organismo para desdoblar la urea, en amoniaco y C02, por accin de la enzima ureasa. La visualizacin del proceso se fundamenta en que la alcalinizacin producida en el medio de cultivo se detecta mediante un indicador de pH (rojo de fenol). MATERIALES Y METODOS Siembra
Inocular los tubos (asa recta). Para eso introducir la punta hasta 3 a 5 mm del fondo del tubo. Tras retirar la punta del fondo, estriar el pico con un movimiento hacia uno y otro lado. Incubacin Incubar a 35-37 C durante veinticuatro-cuarenta y ocho horas.
DISCUSION DE RESULTADOS Se considera la prueba positiva si el medio adquiere una tonalidad rosada, y negativa si mantiene su coloracin inicial.
Reaccin negativa
Reaccin positiva Resultados obtenidos en la realizacin de la prueba Bacteria Escherichia coli Proteus mirabilis Prueba bioqumica Urea Urea Resultado Negativo Negativo
S-ar putea să vă placă și
- Reproducción Asexuada FúngicaDocument37 paginiReproducción Asexuada FúngicaMaria Laura CavigliaÎncă nu există evaluări
- Medios de Cultivos-1Document25 paginiMedios de Cultivos-1Sandra BG0% (1)
- Manual de Microbiologia I Medicina 2014 PDFDocument99 paginiManual de Microbiologia I Medicina 2014 PDFAlexander Cruz100% (1)
- Pseudomona FluorescensDocument5 paginiPseudomona FluorescensAURA VALENTINA LEON SALCEDOÎncă nu există evaluări
- Manual de BacteriologíaDocument79 paginiManual de Bacteriologíavictor manuel villegas0% (1)
- Laboratorio 3 Observacion Microscopica DDocument7 paginiLaboratorio 3 Observacion Microscopica DbrayanÎncă nu există evaluări
- Hongo IdentificadoDocument2 paginiHongo IdentificadoDanaisÎncă nu există evaluări
- Poster Aislamiento Del Hongo Del Género GuignardiaDocument1 paginăPoster Aislamiento Del Hongo Del Género GuignardiaNicolás CarreñoÎncă nu există evaluări
- Bateria BioquimicaDocument26 paginiBateria BioquimicaMariisilmeÎncă nu există evaluări
- AmebaDocument11 paginiAmebakatherine albujaÎncă nu există evaluări
- Obtención de plantas transgénicas productoras de anticuerposDocument3 paginiObtención de plantas transgénicas productoras de anticuerposSheyla Espino RamosÎncă nu există evaluări
- Medios de Cultivo (Microorganismos Del Suelo)Document4 paginiMedios de Cultivo (Microorganismos Del Suelo)ANDREA DIAZ GONZALEZÎncă nu există evaluări
- Microbiología ambiental: interacciones microbianasDocument5 paginiMicrobiología ambiental: interacciones microbianasAlejandra Quintero LineroÎncă nu există evaluări
- Tribu ProteaeDocument5 paginiTribu ProteaeDaniela BelloÎncă nu există evaluări
- Formulario de Balanza PDFDocument8 paginiFormulario de Balanza PDFLuden Javier Dávila AcuñaÎncă nu există evaluări
- Medios de Cultivo FinalDocument16 paginiMedios de Cultivo FinalALISBEL CASTILLOÎncă nu există evaluări
- Informe de MicrobiologiaDocument10 paginiInforme de MicrobiologiaTorres Del Cristo Atenojeno100% (1)
- Examen Directo en HecesDocument16 paginiExamen Directo en HecesAngelo Delgado Del CarpioÎncă nu există evaluări
- Reporte Practica Laboratorio 7-8 Exodado FaringeoDocument9 paginiReporte Practica Laboratorio 7-8 Exodado FaringeoPamela SanchezÎncă nu există evaluări
- Exudado Faríngeo 4IM3 FloresRodríguez-HernándezMedinaDocument24 paginiExudado Faríngeo 4IM3 FloresRodríguez-HernándezMedinaAnalí FloresÎncă nu există evaluări
- Identificación Bioquímica de Especies BacterianasDocument11 paginiIdentificación Bioquímica de Especies BacterianasLucy Yesenia CuaranÎncă nu există evaluări
- Bacterias AcidofilasDocument5 paginiBacterias AcidofilasSebastian100% (1)
- Metodo de Diagnostico de SarampiónDocument15 paginiMetodo de Diagnostico de Sarampiónandres ferardoÎncă nu există evaluări
- NeisseriaDocument9 paginiNeisseriaanon-100540100% (3)
- Pruebas BioquimicasDocument76 paginiPruebas BioquimicasAdelheint BernsteinÎncă nu există evaluări
- 2° Lab-Observación de Microorganismos en Fresco...Document15 pagini2° Lab-Observación de Microorganismos en Fresco...Richard Taipe0% (1)
- Practica Dosis Letal 50 1Document5 paginiPractica Dosis Letal 50 1Carlos Moreno TafurÎncă nu există evaluări
- Agar XLD y Medio de HughDocument3 paginiAgar XLD y Medio de Hughines pachecoÎncă nu există evaluări
- Agar SsDocument2 paginiAgar SsAnonymous 1d7b0eUhyÎncă nu există evaluări
- Práctica 1. MicologíaDocument1 paginăPráctica 1. Micologíapao ricaldiÎncă nu există evaluări
- MICOSIS PROFUNDAS LocalizadasDocument27 paginiMICOSIS PROFUNDAS LocalizadasValentinaRiveraDelgadoÎncă nu există evaluări
- EXAMBiolMol III RespuestasDocument2 paginiEXAMBiolMol III RespuestasAngela DávilaÎncă nu există evaluări
- 12 AntibiogramaDocument4 pagini12 AntibiogramaRuvina Reque TorricoÎncă nu există evaluări
- CandidiasisDocument4 paginiCandidiasisaraalmaguerÎncă nu există evaluări
- Estructuras Fúngicas de Hongos de Interés Clínico y AmbientalDocument12 paginiEstructuras Fúngicas de Hongos de Interés Clínico y AmbientalFredy RuizÎncă nu există evaluări
- Prueba Bilis EsculinaDocument3 paginiPrueba Bilis EsculinaGino Francesco Olivieri Salas100% (2)
- DescripciondehongosDocument6 paginiDescripciondehongosMarisol MÉNDEZÎncă nu există evaluări
- Estrategias de Migración en Los InsectosDocument1 paginăEstrategias de Migración en Los InsectosAri AVÎncă nu există evaluări
- ParasitosisDocument2 paginiParasitosisMariana HerreraÎncă nu există evaluări
- Inoculación Virus HuevosDocument8 paginiInoculación Virus HuevosCarlos Moreno TafurÎncă nu există evaluări
- Laboratorio Microbiologia EQUIPO #4Document14 paginiLaboratorio Microbiologia EQUIPO #4Skarlet MKÎncă nu există evaluări
- Tinciones Especiales Lab.Document2 paginiTinciones Especiales Lab.Lairyn MéridaÎncă nu există evaluări
- Fundamentos de Medios y Pruebas (Staphi y Strep)Document2 paginiFundamentos de Medios y Pruebas (Staphi y Strep)eduardoÎncă nu există evaluări
- Urocultivo Informe de MicrobiologiaDocument29 paginiUrocultivo Informe de MicrobiologiaEmma MÎncă nu există evaluări
- Guía práctica de procedimientos en microbiología médicaDocument103 paginiGuía práctica de procedimientos en microbiología médicaRosa Maria Mosqueda VazquezÎncă nu există evaluări
- PDF Tablas de Pruebas Bioquimicas Completa - CompressDocument6 paginiPDF Tablas de Pruebas Bioquimicas Completa - CompressAna Karen Patiño SimbrónÎncă nu există evaluări
- Método KirbyDocument8 paginiMétodo KirbyAslan Angel Mateluna100% (1)
- Giardia LambliaDocument5 paginiGiardia LambliaGabrielaÎncă nu există evaluări
- Tecnica de Siembra de MicoDocument7 paginiTecnica de Siembra de MicoIván A Cueva50% (2)
- MICROPIPETASDocument6 paginiMICROPIPETASValeria Ariaas AngelÎncă nu există evaluări
- INFORME 9 MicrobioDocument12 paginiINFORME 9 MicrobioElvis Hedim Flores CalderonÎncă nu există evaluări
- Inmunizacion 2023Document34 paginiInmunizacion 2023ELIANA CHANGANAQUE GONZALESÎncă nu există evaluări
- 1 Familia MicrococcaceaeDocument10 pagini1 Familia MicrococcaceaeESLY100% (1)
- Pruebas BioquimicasDocument9 paginiPruebas BioquimicasIsa Little BirdÎncă nu există evaluări
- Trichoderma: Características y aplicaciones de este hongo del sueloDocument13 paginiTrichoderma: Características y aplicaciones de este hongo del sueloDANIA CAROLINA GUTIERREZ HINOJOSA estÎncă nu există evaluări
- Clase 8. Bacilos Gram Positivos IDocument23 paginiClase 8. Bacilos Gram Positivos IGabriel GuevaraÎncă nu există evaluări
- Agar TsiDocument5 paginiAgar TsiLuis Machuca MorenoÎncă nu există evaluări
- Tinción de EsporasDocument4 paginiTinción de EsporasJeanCarlosCampañaÎncă nu există evaluări
- Pruebas Bioquimicas 4 SemestreDocument20 paginiPruebas Bioquimicas 4 Semestrecristian david hurtado peñaÎncă nu există evaluări
- Informe LaboratorioDocument19 paginiInforme LaboratorioMarian Gutiérrez CuestaÎncă nu există evaluări
- MFHIII Semana5 Orientac EstudiDocument9 paginiMFHIII Semana5 Orientac EstudiArturo RamoniÎncă nu există evaluări
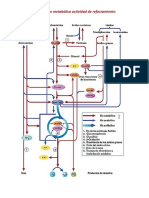
- 5.03 Metabolismo Del Nitrógeno y Ciclo de La UreaDocument6 pagini5.03 Metabolismo Del Nitrógeno y Ciclo de La UreaFrank PinedaÎncă nu există evaluări
- Metabolismo de Las ProteínasDocument10 paginiMetabolismo de Las ProteínasmarimarthaÎncă nu există evaluări
- Tema 1415Document12 paginiTema 1415wilmer_525124016Încă nu există evaluări
- Compuestos NitrogenadosDocument192 paginiCompuestos NitrogenadosMilton IsraelÎncă nu există evaluări
- MM Clinnutrivet 09Document24 paginiMM Clinnutrivet 09MONIS1987Încă nu există evaluări
- Hiperamonemia HereditariaDocument5 paginiHiperamonemia HereditariaLiliana LópezÎncă nu există evaluări
- Tarea N 21 Determinacion de Perfiles Quimicos en Muestras Biologicas Humanas LL Nallely Brissa Lopez CoteraDocument3 paginiTarea N 21 Determinacion de Perfiles Quimicos en Muestras Biologicas Humanas LL Nallely Brissa Lopez CoteraMariela MaldonadoÎncă nu există evaluări
- Corrección General Tarea 8 Metabolismo de NitrogenadosDocument14 paginiCorrección General Tarea 8 Metabolismo de NitrogenadosAnto MandarinoÎncă nu există evaluări
- .Metabolismo de AminoacidosDocument9 pagini.Metabolismo de AminoacidosFlorencia LahozÎncă nu există evaluări
- Vitaminas LiposolublesDocument48 paginiVitaminas LiposolublesHenry Palomino GutierrezÎncă nu există evaluări
- UREA Rev. 02Document2 paginiUREA Rev. 02TOTAL CIENTIFICAÎncă nu există evaluări
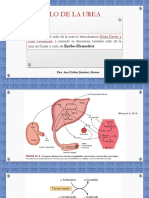
- Ciclo de La UreaDocument24 paginiCiclo de La UreaNochebuena EmÎncă nu există evaluări
- Errores Del MetabolismoDocument15 paginiErrores Del MetabolismoMaffy PatiñoÎncă nu există evaluări
- Laboratorio Quimica 2018Document11 paginiLaboratorio Quimica 2018MARY CARMEN VERA ABANTOÎncă nu există evaluări
- Ciclo de La UreaDocument17 paginiCiclo de La UreaJORGE PORTILLOÎncă nu există evaluări
- Dict 038 Sdepfyots Dets 2017Document30 paginiDict 038 Sdepfyots Dets 2017Maria Maldonado RosalesÎncă nu există evaluări
- Ciclo de La UreaDocument5 paginiCiclo de La UreaFrancisco Javier González AnguianoÎncă nu există evaluări
- Digestión, Absorcion y Metabolismo de Compuestos NitrogenadosDocument32 paginiDigestión, Absorcion y Metabolismo de Compuestos NitrogenadosRodrigo GedlerÎncă nu există evaluări
- Practica #6. Urea en SangreDocument13 paginiPractica #6. Urea en SangreJesus LimaÎncă nu există evaluări
- Actividad de Reforzamiento Integracion MetabolicaDocument14 paginiActividad de Reforzamiento Integracion MetabolicaJosselyn GaynorÎncă nu există evaluări
- Determinación de Urea en SangreDocument5 paginiDeterminación de Urea en Sangreflaca2010Încă nu există evaluări
- Metabolismo Del Nitrogeno y Ciclo de La UreaDocument22 paginiMetabolismo Del Nitrogeno y Ciclo de La UreavirginiaÎncă nu există evaluări
- Repaso Bioquimica Practica 1,2,3,4,5, y 6Document25 paginiRepaso Bioquimica Practica 1,2,3,4,5, y 6Cristina RosarioÎncă nu există evaluări
- Ciclo de La UreaDocument15 paginiCiclo de La UreaPaulina LizzethÎncă nu există evaluări
- Ciclo UreaDocument26 paginiCiclo UreaSeñor MisterioÎncă nu există evaluări
- 1.15 Aminoácidos SemiesencialesDocument38 pagini1.15 Aminoácidos SemiesencialesLuis Gómez100% (1)
- Ejercicio 1 - Letra e - Ciclo de La UreaDocument6 paginiEjercicio 1 - Letra e - Ciclo de La UreaAnlly Liceth Acosta MesaÎncă nu există evaluări
- Ciclo de la urea: metabolismo del nitrógeno en el hígadoDocument37 paginiCiclo de la urea: metabolismo del nitrógeno en el hígadoAlejandra RiveraÎncă nu există evaluări
- Presentación AMINAS BIOOGENAS2Document19 paginiPresentación AMINAS BIOOGENAS2Mario Eduardo ArenaÎncă nu există evaluări