Documente Academic
Documente Profesional
Documente Cultură
Propiedades Intensivas y Propiedades Extensivas
Încărcat de
Jannet Cuautle RosasDescriere originală:
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Propiedades Intensivas y Propiedades Extensivas
Încărcat de
Jannet Cuautle RosasDrepturi de autor:
Formate disponibile
Propiedades intensivas y propiedades extensivas
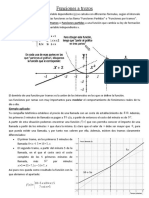
Propiedad intensiva, h (eta) Las propiedades intensivas son aquellas que no dependen de la cantidad de sustancia presente, por este motivo no son propiedades aditivas. Ejemplos de propiedades intensivas son la temperatura, la velocidad, el volumen especfico (volumen ocupado por la unidad de masa). Observe que una propiedad intensiva puede ser una magnitud escalar o una magnitud vectorial. Propiedad extensiva, H (eta) Cuando la propiedad intensiva se multiplica por la cantidad de sustancia (masa) se tiene una propiedad que s depende de la cantidad de sustancia presente y se llama propiedad extensiva, como ocurre con la masa, con la cantidad de movimiento y con el momento de la cantidad de movimiento. Relacin entre propiedades intensivas y extensivas Si se denota por H la propiedad extensiva y por h la propiedad intensiva asociada se puede establecer la relacin que define cualquier propiedad intensiva como la cantidad de propiedad extensiva por unidad de masa, as: h=dH/dm dH=hdm = hrdVol
La propiedad intensiva podr ser una funcin continua en el espacio y dar as origen a la cantidad extensiva H en una determinada regin. La propiedad extensiva si es acumulable con la acumulacin de sustancia.. La naturaleza escalar/vectorial la comparten los dos tipos de propiedades.
Propiedades intensivas y extensivas En fsica y qumica, las propiedades intensivas son las que no dependen de la cantidad de sustancia del sistema, por este motivo no son propiedades aditivas. En otras palabras, las propiedades intensivas no dependen de la masa. Por el contrario, las propiedades extensivas son las que s dependen de la cantidad de sustancia del sistema.
Propiedades intensivas Algunos ejemplos de propiedades intensivas son la temperatura, la velocidad, el volumen especfico (volumen ocupado por la unidad de masa), el punto de ebullicin, el punto de fusin,una magnitud escalar, una magnitud vectorial, la densidad etc.
Si se tiene un litro de agua, su punto de ebullicin es 100 C (a 1 atmsfera de presin). Si se agrega otro litro de agua, el nuevo sistema, formado por dos litros de agua, tiene el mismo punto de ebullicin que el sistema original. Esto ilustra la no aditividad de las propiedades intensivas.
Las propiedades intensivas se dividen en dos: .Propiedad Caracterstica, que son las que te permiten identificar las sustancias. Ej.: Punto de ebullicin, calor especfico. .Propiedad General
Propiedades extensivas Son las que si dependen de la cantidad de sustancias del sistema, y son reciprocamente equivalentes a las intensivas. Algunos ejemplos de propiedades extensivas son la masa, el volumen, el peso, cantidad de sustancia, etc.
La qumica acta sobre la materia, que es todo aquello que nos rodea, ocupa un lugar y un espacio en el universo, y que somos capaces de identificar y conocer. La materia presenta dos tipos de propiedades: propiedades extensivas y propiedades intensivas. Las propiedades extensivas se relacionan con la estructura qumica externa; es decir, aquellas que podemos medir con mayor facilidad y que dependen de la cantidad y forma de la materia. Por ejemplo: peso, volumen, longitud, energa potencial, calor, etctera. Las propiedades intensivas, en cambio, tienen que ver ms con la estructura qumica interna de la materia, como la temperatura, punto de fusin, punto de ebullicin, calor especfico o concentracin , ndice de refraccin, entre otros aspectos. Las propiedades intensivas pueden servir para identificar y caracterizar una sustancia pura, es decir, aquella que est compuesta por un solo tipo de molcula , como, por ejemplo, el agua, que est formada solo por molculas de agua (H2O), o el azcar, que solo la conforman molculas de sacarosa (C12H22O11).
S-ar putea să vă placă și
- Ramas de La QuimicaDocument4 paginiRamas de La QuimicaAndrea RodriguezÎncă nu există evaluări
- Métodos de Separación de Las MezclasDocument8 paginiMétodos de Separación de Las MezclasElena Soria100% (2)
- Propiedades Generales de Los FluidosDocument35 paginiPropiedades Generales de Los FluidosMaycol TitoÎncă nu există evaluări
- Historia de La Uptc PDFDocument3 paginiHistoria de La Uptc PDFEdwin StevenÎncă nu există evaluări
- Modulo I Fisica 10-2015Document34 paginiModulo I Fisica 10-2015Robin Junior Van DeboertÎncă nu există evaluări
- ENTROPIA Docx-1Document34 paginiENTROPIA Docx-1Ronny RamiroÎncă nu există evaluări
- Ter U1 Ea MejoDocument19 paginiTer U1 Ea MejoPepe Jimenez67% (6)
- Practica 1 - TermometríaDocument11 paginiPractica 1 - TermometríaJuan Esteban Parra HenaoÎncă nu există evaluări
- Modelo de Partículas. Propiedades de Sólidos, Liquidos y GasesDocument9 paginiModelo de Partículas. Propiedades de Sólidos, Liquidos y GasesB.AcostaÎncă nu există evaluări
- Propiedades de Los LiquidosDocument5 paginiPropiedades de Los LiquidosJose Orlando Melo Naranjo100% (1)
- Pasado PerfectoDocument2 paginiPasado PerfectoSandy LoguiÎncă nu există evaluări
- Impacto Ambiental de Los PlásticosDocument17 paginiImpacto Ambiental de Los PlásticoskikemedraÎncă nu există evaluări
- TERMODINAMICADocument27 paginiTERMODINAMICAalejandro raymundo pachecoÎncă nu există evaluări
- Crisis Económicas en México 1976-2008Document10 paginiCrisis Económicas en México 1976-2008erickÎncă nu există evaluări
- Densidad PDFDocument14 paginiDensidad PDFEdison Palma VañezÎncă nu există evaluări
- Ley de Hooke (Versión Final)Document8 paginiLey de Hooke (Versión Final)mateoÎncă nu există evaluări
- PRÁCTICO 1.masa, Volumen y DensidadDocument11 paginiPRÁCTICO 1.masa, Volumen y DensidadblackceiborÎncă nu există evaluări
- Angel - FotogeoquimicaDocument1 paginăAngel - FotogeoquimicaBryan Anthony Yucra CayoÎncă nu există evaluări
- Factores Que Afectan A La Velocidad de Una Reacción QuímicaDocument2 paginiFactores Que Afectan A La Velocidad de Una Reacción Químicajessyandy15Încă nu există evaluări
- 7401-19 FÍSICA Hidrostática e HidrodinámicaDocument42 pagini7401-19 FÍSICA Hidrostática e HidrodinámicaNoe FerrarisÎncă nu există evaluări
- Primera Ley de La TermodinamicaDocument13 paginiPrimera Ley de La TermodinamicaMiguelÎncă nu există evaluări
- Entropía WordDocument9 paginiEntropía WordAngelito RDÎncă nu există evaluări
- Guia TermodinamicaDocument22 paginiGuia TermodinamicaDidier Sequeda MartinezÎncă nu există evaluări
- FluidosDocument5 paginiFluidosCristian CgpÎncă nu există evaluări
- Mecanismos de Reaccion en La TroposferaDocument10 paginiMecanismos de Reaccion en La TroposferaEdwaef EdsfresrÎncă nu există evaluări
- Informe de MicroondasDocument26 paginiInforme de MicroondasLenin Duran100% (1)
- Ensayo Antropología Cristiana PucvDocument1 paginăEnsayo Antropología Cristiana PucvValeria BustamanteÎncă nu există evaluări
- Deterioro AmbientalDocument3 paginiDeterioro Ambientalrobert jrÎncă nu există evaluări
- Teoría CromosómicaDocument2 paginiTeoría Cromosómicaalexmr72Încă nu există evaluări
- 06 Quintana RooDocument90 pagini06 Quintana RooLeonardo ValenteÎncă nu există evaluări
- Documento Diques CartagoDocument19 paginiDocumento Diques CartagoJohannamarotoÎncă nu există evaluări
- CalorimetríaDocument3 paginiCalorimetríaJosé Mendoza RamírezÎncă nu există evaluări
- Electricidad Por FrotamientoDocument2 paginiElectricidad Por FrotamientoAlexandra Valencia Cervera100% (3)
- Historia Del TermometroDocument17 paginiHistoria Del TermometroAnnie Love100% (1)
- Números NaturalesDocument11 paginiNúmeros NaturalesJosue MejiaÎncă nu există evaluări
- Métodos de Suma y RestaDocument7 paginiMétodos de Suma y RestaNegroCanijoÎncă nu există evaluări
- Informe 3 Equilibrio TérmicoDocument21 paginiInforme 3 Equilibrio TérmicoCarlos Daniel Vanegas MarchenaÎncă nu există evaluări
- Qué Es La HidrosferaDocument5 paginiQué Es La HidrosferaEdward GuerreroÎncă nu există evaluări
- Trabajo y Energía PDFDocument27 paginiTrabajo y Energía PDFDanae RuizÎncă nu există evaluări
- TrabajoDocument3 paginiTrabajoYerly ChavarriÎncă nu există evaluări
- Termometro BimetalicoDocument29 paginiTermometro BimetalicoAngel GilÎncă nu există evaluări
- Qué Es La TemperaturaDocument9 paginiQué Es La Temperaturagueting_overÎncă nu există evaluări
- Minamata JaponDocument13 paginiMinamata Japonpochon_2014Încă nu există evaluări
- Unidades Fundamentales de La FisicaDocument1 paginăUnidades Fundamentales de La FisicaRoberto PomaresÎncă nu există evaluări
- Servicios AmbientalesDocument31 paginiServicios Ambientalesjdvr0203Încă nu există evaluări
- Cinetica de ParticulasDocument9 paginiCinetica de ParticulasTrans-xRojoÎncă nu există evaluări
- MONOGRAFIADocument37 paginiMONOGRAFIADonald Ernesto Asenjo Cajusol100% (1)
- Determinación Del Peso Molecular de Un Liquido VolatilDocument5 paginiDeterminación Del Peso Molecular de Un Liquido VolatilBrayan Alexis CeballosÎncă nu există evaluări
- Caracterización Del Comportamiento de Los Factores Ecológicos de Un Área de Bosque Secundario.Document8 paginiCaracterización Del Comportamiento de Los Factores Ecológicos de Un Área de Bosque Secundario.AlexaaÎncă nu există evaluări
- Texto ExpositivoDocument4 paginiTexto ExpositivoAnita Maria100% (1)
- Proyecto Calentamiento GlobalDocument4 paginiProyecto Calentamiento GlobalJesalbert MorenoÎncă nu există evaluări
- Informe Termodinámica Aplicada A Los Seres VivosDocument10 paginiInforme Termodinámica Aplicada A Los Seres VivosGaston barreraÎncă nu există evaluări
- Ensayo de Energia InternaDocument5 paginiEnsayo de Energia InternaRaul Alcides Chavez0% (1)
- Ensayo - 2da Ley de La Termodinamica - Procesos BiologicosDocument5 paginiEnsayo - 2da Ley de La Termodinamica - Procesos BiologicosALMA PACHECO HUICOZAÎncă nu există evaluări
- Termodinámica Fisica 2Document30 paginiTermodinámica Fisica 2Aldo Benjamin Becerra GaytanÎncă nu există evaluări
- Ciclo Del OxigenoDocument11 paginiCiclo Del OxigenoEmeVzqzÎncă nu există evaluări
- Ley de LavoisierDocument2 paginiLey de LavoisierNicole LoorÎncă nu există evaluări
- Hipótesis de GaiaDocument3 paginiHipótesis de GaiaCarlos Lozada SerranoÎncă nu există evaluări
- Propiedades IntensivasDocument2 paginiPropiedades IntensivasvdiabloÎncă nu există evaluări
- Clase 1 MateriaDocument18 paginiClase 1 MateriaGabrielÎncă nu există evaluări
- Tarea 4. Documento de ApoyoDocument7 paginiTarea 4. Documento de ApoyoIvan BriseñoÎncă nu există evaluări
- Definiciones Aplicables A La Ing. CivilDocument14 paginiDefiniciones Aplicables A La Ing. Civilluis antonio monroy castroÎncă nu există evaluări
- Int - Mult Ps. Fany AguirreDocument15 paginiInt - Mult Ps. Fany Aguirrefl557930Încă nu există evaluări
- Prueba de Ingreso Ingeniero de Desarrollo - PlacetoPayDocument5 paginiPrueba de Ingreso Ingeniero de Desarrollo - PlacetoPaydamojeÎncă nu există evaluări
- Medicina YorubaDocument4 paginiMedicina YorubavitryÎncă nu există evaluări
- Introducción A La Pedagogía de La ComunicaciónDocument76 paginiIntroducción A La Pedagogía de La Comunicaciónjose100% (1)
- Guia NBA 2016 PDFDocument67 paginiGuia NBA 2016 PDFmaifra2Încă nu există evaluări
- Bosquejo de Fin de AñoDocument7 paginiBosquejo de Fin de AñoObed Pereyra100% (3)
- Apunte Funciones Por TramosDocument4 paginiApunte Funciones Por TramosBERYLL ZICARELLIÎncă nu există evaluări
- Cormac McCarthyDocument15 paginiCormac McCarthyKevin Berger100% (4)
- Problema 6.18Document8 paginiProblema 6.18Abel RamosÎncă nu există evaluări
- Resumen de Canales No RevestidosDocument6 paginiResumen de Canales No RevestidosHUGO ALBERTO PUENTES GALLARDOÎncă nu există evaluări
- Exposicion Ley 30709Document13 paginiExposicion Ley 30709VALERIA ANAHI VILLALTA NESTAREZÎncă nu există evaluări
- Agr Cirele Af5Document4 paginiAgr Cirele Af5abelardoÎncă nu există evaluări
- Formato Hoja de Vida FACILITADORESDocument4 paginiFormato Hoja de Vida FACILITADORESHectorMichael CHipanaÎncă nu există evaluări
- Critica Del Pensamiento Amoroso (4g) 8.inddDocument8 paginiCritica Del Pensamiento Amoroso (4g) 8.inddMaria del Pilar Cordero Fernandez100% (2)
- Caso Constructora ExitosaDocument2 paginiCaso Constructora ExitosaJosé EspinozaÎncă nu există evaluări
- Dimensionamiento de Flotas de EquiposDocument16 paginiDimensionamiento de Flotas de EquiposJuan Avalos50% (2)
- Anatomia Energetica Del CuerpoDocument17 paginiAnatomia Energetica Del Cuerposonico2008100% (1)
- c3d277 - Guía de Estudio Unidad 1 - Parte 1 (Historia)Document7 paginic3d277 - Guía de Estudio Unidad 1 - Parte 1 (Historia)Lupe CarreraÎncă nu există evaluări
- Instructivo para La Elaboracion de Proyectos Iutai-Ver 1.0Document50 paginiInstructivo para La Elaboracion de Proyectos Iutai-Ver 1.0Joaura Jakeline Romero AlvarezÎncă nu există evaluări
- Manuscritos MatematicosDocument10 paginiManuscritos Matematicosjorgeveraza50% (2)
- AlimentaciónDocument2 paginiAlimentaciónSantiagoÎncă nu există evaluări
- Línea Base BiológicaDocument315 paginiLínea Base BiológicaFranco OrtegaÎncă nu există evaluări
- Semiótica de La MúsicaDocument5 paginiSemiótica de La MúsicaCristina CondeÎncă nu există evaluări
- El Poeta y Su Trabajo, 35 PDFDocument93 paginiEl Poeta y Su Trabajo, 35 PDFCaimito de Guayabal100% (1)
- S3 Electrónica IndustrialDocument10 paginiS3 Electrónica Industrialjunior baltazar coronado martinezÎncă nu există evaluări
- Mediciones de CaudalesDocument3 paginiMediciones de Caudalessantiago quispe mamaniÎncă nu există evaluări
- M.N.V.C.C: Modelo Nacional de Vigilancia Comunitaria Por CuadrantesDocument43 paginiM.N.V.C.C: Modelo Nacional de Vigilancia Comunitaria Por CuadrantesBeatriz Elena Salinas ordoñez0% (1)
- Etapas de Un Proyecto de Ingenieria 1Document19 paginiEtapas de Un Proyecto de Ingenieria 1Josue GomezÎncă nu există evaluări