Documente Academic
Documente Profesional
Documente Cultură
Ch13 Reaction Chimique Echange Proton
Încărcat de
الغزيزال الحسن EL GHZIZAL HassaneDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Ch13 Reaction Chimique Echange Proton
Încărcat de
الغزيزال الحسن EL GHZIZAL HassaneDrepturi de autor:
Formate disponibile
COMPRENDRE: Lois et modles
Chapitre 13 : raction chimique par change de proton H+
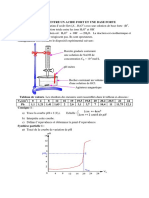
Animation 1. dosage conductimtrique, pHmtrique, courbes pHmtriques (M Gastebois) 2. effectuer un dosage conductimtrique
Table des matires COMPRENDRE: Lois et modles Chapitre 13 : raction chimique par change de proton H+
I) pH d'une solution
1) dfinition du pH
La fonction logarithme dcimal (log) est la fonction inverse de la fonction 10n. Quelques proprits de cette fonction: Log (a.b)= log (a)+log(b) Log (a)n = n.log (a) Log (10n) = n Log (a/b) =log (a)-log (b) Log (a+b)= Log (a+b)! 10log(a )= a Exemple: Log(1) = 0 Log(104 ) = 4 Log(10-3) = -3 Le pH (potentiel Hydrogne) d'une solution aqueuse est dfinie en 1909 par le chimiste danois Sorensen : pH = - log[H3O+] unit: [H3O+] en mol.L-1, le pH est sans unit. Cette relation n'est exacte que pour les concentrations [H3O+ ] 0,05 mol.L-1 10log(a )= a pH = - log[H3O+] -pH = log[H3O+] 10-pH = [H3O+] A partir du pH, on peut dterminer la concentration en ions oxonium: 10-pH = [H3O+] Exemple: le sang un pH = 7,4; la concentration en ions oxonium dans le sang est: [H3O+] = 10-pH =10-7,4 = 4,0x10-8 mol.L-1 Remarque : plus la concentration en ion oxonium diminue plus le pH augmente. reli un voltmtre. La sonde se compose d'une lectrode de fer est d'une lectrode de rfrence. La tension U aux bornes de la sonde plonge dans une solution est une fonction affine du pH: U = a-b.pH Avant toute mesure, il est ncessaire d'talonner un pHmtre avec une solution talon de pH connu. Cet talonnage permet de fixer avec prcision les valeurs de 'a' et 'b'. Un pH mtre est prcis 0,05 unit pH environ. L'incertitude relative sur la valeur de la concentration en ion oxonium est donc de 10 % environ. Exemple: le pHmtre affiche une valeur pH = 2,66 (+/- 0,05). La concentration en ions oxonium est comprise entre: 10-(2,66 -0,05) = 1,95x10-3 mol.L-1 < [H3O+] = 10-2,66 = 2,19x10-3 mol.L-1 < 10-(2,66+0,05) = 2,45x10-3 mol.L-1 Conclusion: on donnera le rsultat de la concentration en ion oxonium avec 2 chiffres significatifs [H3O+] = 2,2x10-3 mol.L-1. La concentration [H3O+] calcule partir d'une mesure de pH sera donne avec 2 chiffres significatifs.
sonde
- un pH-mtre. Le pH-mtre est constitu d'une
2) mesure du pH
Pour mesurer le pH on peut utiliser soit: - du papier pH (peu prcis)
II) notion d'quilibre chimique
1) raction chimique partielle entre l'acide ascorbique et l'eau
On dissout 0,22 g d'acide ascorbique (C6H8O6) dans un volume V = 250mL d'eau. La solution un pH de 3,2. Equation bilan de la raction est: C6H8O6(aq) + H20 C6H7O6-(aq) + H3O+(aq)
gauche). Une fois l'quilibre chimique obtenu, les proportions en ractifs et produits ne varient plus: on se trouve l'tat d' quilibre du systme chimique. En revanche l'tat microscopique chaque fois qu'une raction se fait dans le sens 1 une autre se produit dans le sens 2, laissant les concentrations en ractifs et produits constantes. Remarque: La double flche traduit le fait que la
La masse molaire de l'acide ascorbique est M = 176 g.mol-1. Dterminer l'avancement final de la raction. En dduire la concentration des espces suivantes en fin de raction: H3O+, C6H8O6 , C6H7O6-. La raction est-elle totale? Rponse (pour voir la correction vido clique ici). La concentration C1 en acide ascorbique avant raction avec l'eau est: m M = 0,22 = 5,0x10 3 mol.L-1 C1 = V 176x0,25 La concentration en ions quation C6H8O6(aq) + H20 C6H7O6-(aq) + H3O+(aq)
raction peut se faire simultanment dans les 2 sens. Lorsqu'une raction ne peut s'effectuer que dans un seul sens on n'crit qu'une seul flche .
III) acide et base selon Brnsted
1) dfinition d'un acide est d'une base selon Brnsted
Selon Brnsted, un acide est une espce chimique susceptible de cder un ou plusieurs protons H+ ;une base est susceptible de capter un ou plusieurs protons H+. chaque acide correspond une base conjugue, le tout formant un couple acide / base Exemple de couple acide / base: Acide benzoque / ion benzoate: C6H5CO2H / C6H5CO2 C6H5CO2- (aq) + H+ (aq) C H CO H 6 5 2 La base C6H5CO2- capte un proton H+ pour donner son acide conjugu C6H5CO2H
tat C1 solvant 0 0 initial x=0 tat final C1-xf/V solvant xf/V xf/V x = xf tat final C1-xmax/V=0 solvant xmax/V xmax/V si la raction est totale x = xmax Aprs calcul: [H30+]f = [C6H7O6- ]f = 10-pH = xf/V = 6,3 x 10-4 mol.L-1 [C6H8O6]f= C1-xf/V =4,4 x 10-3 mol.L-1 . Conclusion: la concentration finale en acide ascorbique C6H8O6 n'est pas nulle, la raction n'est pas totale, elle est partielle xf < xmax Pourquoi? La raction inverse est possible! A l' instant o l'quilibre chimique est atteint, les concentrations en ractifs et produits n'voluent plus. Par contre au niveau microscopique (des molcules) la raction continue. A chaque fois qu'une molcule d'acide C6H8O6 rencontre une molcule d'eau, un ion ascorbate C6H7O6-(aq) + et un ion H3O+ est produit. Simultanment un ion C6H7O6-(aq) + ragit avec un ion H3O+ pour redonner une molcule C6H8O6 et une molcule d'eau. Les concentrations globales en ractifs et produit n'voluent pas.
2) Qu'est-ce qu'une espce amphotre?
Une espce pouvant tre la fois une base est un acide est une espce ampholyte ou amphotre. Exemple: l'eau H2O est une espce amphotre. En effet elle est une base dans le couple acide base Ion oxonium, eau H3O+ / H2O H3O+ (aq) H O (L) + H+ (aq) 2 L'eau est galement un acide dans le couple acide base eau / anion hydroxyde H2O / HO H2O(L) HO- (aq)+ H+ (aq)
3) raction acido-basique / transfert de proton
2) l'quilibre chimique
Soit l'quation chimique de la raction suivante: A + B C +D
Une raction acido-basique a lieu entre deux couples acide/base AH(1)/A-(1) et AH(2)/A-(2). L'acide du couple 1 fournit un proton la base du couple 2 pour donner la base du couple 1 et l'acide du couple 2: AH(1) + A-(2) A-(1) + AH(2) La double flche signifie que la raction peut avoir lieu dans les 2 sens. Exemple : crire la raction acido-basique entre l'acide thanoque et l'eau: Couple acide base: acide thanoque / ion thanoate (CH3CO2H/CH3CO2- ) et ion oxonium / eau (H3O+ / H2O) Raction acido-basique :
La raction effectue dans le sens direct (1) (lue de gauche droite) n'est pas totale, car une raction a lieu galement dans le sens inverse (2) (lue de droite
CH3CO2H(aq) + H2O (L)
4) acide faible, base faible
CH3CO2- (aq) + H3O+ (aq)
Un acide AH est un acide faible si sa raction avec l'eau n'est pas totale. L'quation chimique est: AH(aq) + H2O (L) A (aq) + H3O+ (aq) Exemple: l'acide mthanoque (HCOOH) est un acide faible car sa raction avec l'eau n'est pas totale. Sa raction conduit un quilibre chimique : HCO2H(aq) + H2O (L) HCO2- (aq) + H3O+ (aq) Un acide est fort si sa raction avec l'eau est totale. Exemple :l'acide nitrique (HNO3) HNO3(aq) + H2O (L) NO3-(aq) + H3O+(aq) On crit une flche simple car la raction est totale Une base A- est faible si sa raction avec l'eau n'est pas totale. Son quation chimique est: A (aq) + H2O (L) AH (aq) + HO- (aq) Exemple: l'ion chlorate (ClO-) est une base faible car sa raction avec l'eau n'est pas totale. Sa raction conduit un quilibre chimique : ClO- (aq) + H2O (L) HClO (aq) + HO- (aq) Une base est forte si sa raction avec l'eau est totale. Exemple : l'ion mthylate (CH3O-) CH3O- (aq) + H2O (L) CH3OH(aq) + HO-(aq) On crit une flche simple car la raction est totale.
H N-CHR-COO-(aq) + H+(aq) 2 - une base dans le couple cation / amphion + H3N -CHR-COOH(aq) H N+-CHR-COO-(aq) + H+(aq) 3 H3N+-CHR-COO- (aq)
IV) Constante d'acidit KA
1) produit ionique Kef de l'eau
La raction d'autoprotolyse de l'eau est : H2O (L) +H2O (L) H O+ (aq) + HO-(aq) 3 L'eau pure possde un pH = 7 25 degrs Celsius. Par consquent les concentrations en ion oxonium et hydroxyde sont cette temprature : [H3O+] =[HO-] = 10-7mol/L La raction d'autoprotolyse de l'eau est trs limite dans le sens direct. La constante d'quilibre, note Ke, correspondant l'autoprotolyse de l'eau est appele produit ionique de l'eau. Ke = [H3O+]eq [HO-]eq, Ke est sans unit, les concentrations sont exprimes en mol.L-1. En gnralisant, dans toute solution aqueuse 25 C le produit ionique de l'eau est : Ke = [H3O+]eq[HO-]eq=10 -14 Le pKe est dfinit par la relation suivante: pKe =-log (Ke) A 25C pKe = -log Ke = -log 10-14 =14 Ke ne dpend pas des espces chimiques en solution aqueuse mais uniquement de la temprature. Exemple: dterminer la concentration en ion HO- dans une solution de pH = 3, la temprature de 25C: [H3O+] = 10-pH = 10-3 mol.L-1 Ke = [H3O+ ].[HO- ] Ke 10 14 [HO- ] = = = 10 11 mol.L-1 + ] 10 3 [H3O A ce pH la concentration en ions hydroxyde est ngligeable devant celle des ions hydronium.
5) les acides -amins
Un acide -amins contient les groupes carboxyle -CO2H et amine -NH2 li au mme atome de carbone. Formule gnrale:
H2N OH
R: chane carbone ou un hydrogne. En solution aqueuse on observe une auto-protonation de la molcule. Ce transfert est une raction acidobasique intramolculaire. Elle donne naissance un ion dipolaire appel amphion ou zwitterion:
2) solution neutre chimiquement, acide et basique
R H2N OH O H + H N H
R O O
-
Amphion
Dans une solution neutre chimiquement la concentration en ion hydroxyde est gale la concentration en ion hydronium: Solution neutre chimiquement [H3O+]eq =[HO-]eq donc Ke = [H3O+]eq .[HO-]eq =[H3O+]2eq pKe = -log [H3O+]2eq = -2. log [H3O+]eq = 2.pH 1 pH = .pKe 2 Dans une solution acide: [H3O+]eq >[HO-]eq pH < 1/2.pKe Dans une solution basique:
L'amphion est un ampholyte car il est la fois une base et un acide: - l'acide dans le couple amphion / anion
[H3O+]eq < [HO-]eq pH > 1/2pKe Exemple: la temprature de 25 C pKe = 14 1 14 =7 Solution neutre chimiquement: pH = .pKe = 2 2 Solution acide: pH < 1/2.pKe < 7 Solution basique: pH > 1/2pKe > 7
Exemple: l'acide NH4+ est plus faible que l'acide mthanoque HCO2H car son pKA est plus important. Sa base conjugue NH3 est plus forte que HCO2- (base conjugue de l'acide mthanoque).
5) domaine de prdominance
Les ractions acido-basiques tant rapides nous admettrons que l'tat d'quilibre est toujours atteint en solution aqueuse. L'indice 'q' ne sera parfois pas indiqu par la suite. Relation entre pH et pKA [A ]eq .[H3O + ]eq KA = [AH]eq pKA = log KA pKA = log [A ]eq.[H3O+ ]eq [AH]eq [A ]eq [AH]eq
3) constante d'acidit Ka d'un couple acide base
Soit un couple acide base HA/A- dont la raction avec l'eau est : HAaq + H2O A + H3O+aq aq La constante d'quilibre, KA, appel constante d'acidit de ce couple est : ] .[H O + ] [A eq 3 eq KA KA = [AH]eq Le pKA du couple acide / base HA/A- est : pKA = -log(KA) pKA et KA sans unit, les concentrations sont exprimes en mol.L-1. La constante d'acidit ne dpend pas des conditions initiales mais uniquement de la temprature.
pKA = log[H3O + ]eq log pKA = pH log [A ]eq [AH]eq
la relation entre le pH et le pKA est : [A ]eq [AH]eq
4) Echelle de pKA
pH = pKA + log
Les pKA permettent de comparer l'avancement final de la raction des diffrents acides faibles dans l'eau. [A ]eq .[H3O + ]eq Plus la valeur du KA = d'un acide [AH]eq est important plus la valeur du pKA = -log KA est faible. Plus la valeur du pKA est faible, plus l'acide cde facilement un proton (plus il est dissoci dans l'eau) . A l'inverse sa base conjugue d'autant moins forte que le pKA est faible. Elle accepte plus difficilement un proton. Echelle de pKA de quelques couples acide / base
- si pH = pKA ] [A eq [A ]eq log =0 =1 [AH]eq [AH]eq l'acide et la base conjugue ont la mme concentration . - si pH > pKA [A ]eq pH pKA = log >0 [AH]eq [A ]eq > 1 [A ]eq > [AH]eq [AH]eq la base est l'espce prdominante. - si pH < pKA [A ]eq pH pKA = log <0 [AH]eq [A ]eq < 1 [A ]eq < [AH]eq [AH]eq L'acide est prdominant. Conclusion: pH = pKA l'acide et la base conjugue ont la mme concentration. pH > pKA la base est l'espce prdominante. pH < pKA l'acide est l'espce prdominante. Diagramme de prdominance de l'acide et de sa base conjugue.
3) solution tampon
Exemple: l'acide amin alanine possde 2 pKA: pKA1 = 2,35 pour le couple acide / base CH3-CH(NH3+)-CO2H/ CH3-CH(NH3+)-CO2pKA2 = 9,87 , couple acide base CH3-CH(NH3+)-CO2-/ CH3-CH(NH2)-CO2Quelle est le proton le plus facilement transfrable? Celui port par l'atome d'azote ou celui port par l'atome d'oxygne? Celui port par l'atome d'oxygne car pKA1 < pKA2 Le diagramme de prdominance des espces est le suivant:
La prsence simultane en solution d'un acide et de sa base conjugue empche le pH de varier brutalement lors d'un aout modr d'acide fort ou de base forte. Une telle solution est appele solution tampon. Le sang est un milieu tamponn.
Programme officiel
Comprendre
Lois et modles
Comment exploite-t-on des phnomnes priodiques pour accder la mesure du temps ? En quoi le concept de temps joue-t-il un rle essentiel dans la relativit ? Quels paramtres influencent lvolution chimique ? Comment la structure des molcules permet-elle d'interprter leurs proprits ? Comment les ractions en chimie organique et celles par change de proton participent-elles de la transformation de la matire ? Comment seffectuent les transferts dnergie diffrentes chelles ? Comment se manifeste la ralit quantique, notamment pour la lumire ?
V) acide fort et base forte en solution aqueuse
Raction chimique par change de proton
Notions et contenus Le pH : dfinition, mesure. Thorie de Brnsted : acides faibles, bases faibles ; notion dquilibre ; couple acide-base ; constante dacidit Ka. chelle des pKA dans leau, produit ionique de leau ; domaines de prdominance (cas des acides carboxyliques, des amines, des acides -amins). Ractions quasi-totales en faveur des produits : - acide fort, base forte dans leau ; - mlange dun acide fort et dune base forte dans leau. Raction entre un acide fort et une base forte : aspect thermique de la raction. Scurit. Contrle du pH : solution tampon ; rle en milieu biologique. Comptences exigibles Mesurer le pH d'une solution aqueuse. Reconnatre un acide, une base dans la thorie de Brnsted. Utiliser les symbolismes , et dans lcriture des ractions chimiques pour rendre compte des situations observes. Identifier lespce prdominante dun couple acide-base connaissant le pH du milieu et le pKA du couple. Mettre en uvre une dmarche exprimentale pour dterminer une constante dacidit. Calculer le pH dune solution aqueuse dacide fort ou de base forte de concentration usuelle.
1) pH et concentration apporte en acide fort ou base forte
On a vu prcdemment qu'un acide est fort si sa raction avec l'eau est totale. AH(aq) + H2O (L) A-(aq) + H3O+(aq) On crit une flche simple car la raction est totale. Si la solution une concentration apporte en acide C et que le volume de solution est V, on obtient d'aprs le tableau d'avancement: [AH(aq)]finale = C - xmax /V= O donc xmax/V = C [A-(aq)]finale = [H3O+(aq)]finale = xmax/V = C pH = -log [H3O+(aq)]finale = -log C Une base est forte si sa raction avec l'eau est totale. A- (aq) + H2O (L) AH(aq) + HO-(aq) Si la solution une concentration apporte en base C et que le volume de solution est V, on obtient d'aprs le tableau d'avancement: [A-(aq)]finale = C - xmax /V= O donc xmax/V = C [A-(aq)]finale = [HO-(aq)]finale = xmax/V = C pH = - log [H3O+ (aq)]finale = - log( pH = pKe + log C Ke ) - ( aq)] [HO finale
Mettre en vidence l'influence des quantits de matire mises en jeu sur llvation de temprature observe.
Extraire et exploiter des informations pour montrer limportance du contrle du pH dans un milieu biologique.
2) raction entre un acide et une base forte
la raction entre un acide et une base forte est: H3O+ (aq) + HO-(aq) 2H2O (L) C'est la raction inverse de la raction d'autoprotolyse de l'eau qui est trs limite. Par consquent cette raction est quai totale on la note avec une flche. Cette raction est exothermique, elle dgage de la chaleur. La raction est d'autant plus dangereuse que la concentration en ractif est leve!
S-ar putea să vă placă și
- Équilibres en solution: Les Grands Articles d'UniversalisDe la EverandÉquilibres en solution: Les Grands Articles d'UniversalisÎncă nu există evaluări
- Glucides: Les Grands Articles d'UniversalisDe la EverandGlucides: Les Grands Articles d'UniversalisÎncă nu există evaluări
- ch13 Reaction Chimique Echange ProtonDocument5 paginich13 Reaction Chimique Echange ProtonSophie RosiÎncă nu există evaluări
- Cours Chim 02 La Transformation Toujours TotaleDocument11 paginiCours Chim 02 La Transformation Toujours Totalebeebac2009Încă nu există evaluări
- Chapitre I CorrectionDocument4 paginiChapitre I CorrectionNAVENDRAN AjananÎncă nu există evaluări
- Chimie: - Chimie en Solution AqueuseDocument35 paginiChimie: - Chimie en Solution AqueuseAyoub Maverick100% (1)
- Chimie-B-chap5-transfo Totales Ou LimiteesDocument4 paginiChimie-B-chap5-transfo Totales Ou LimiteesMed yahyaÎncă nu există evaluări
- Transformations Associés A Des Reactions Acido Basiques en Solution AqueusesDocument8 paginiTransformations Associés A Des Reactions Acido Basiques en Solution AqueusesJosé Ahanda NguiniÎncă nu există evaluări
- C3Chim Transformations Limitees PDFDocument4 paginiC3Chim Transformations Limitees PDFAzizElheniÎncă nu există evaluări
- Cours3 - Transformation Chimique S'effectuant Dans Les Deux SensDocument21 paginiCours3 - Transformation Chimique S'effectuant Dans Les Deux Sensbenmaleksamir84Încă nu există evaluări
- Chap 02 Re - Action Chimique Par e - Change de Proton2019Document8 paginiChap 02 Re - Action Chimique Par e - Change de Proton2019Younes HoumadiÎncă nu există evaluări
- SEQUENCE06 Acidefortbaseforte 1 STLDocument6 paginiSEQUENCE06 Acidefortbaseforte 1 STLMed BriniÎncă nu există evaluări
- Transformations Acide - Base Eleve NDocument2 paginiTransformations Acide - Base Eleve Nblack HÎncă nu există evaluări
- Cours de Chimie: Niveau: Terminale SDocument14 paginiCours de Chimie: Niveau: Terminale SmedÎncă nu există evaluări
- Chapitre 3: Transformations Chimiques S'effectuant Dans Les Deux SensDocument6 paginiChapitre 3: Transformations Chimiques S'effectuant Dans Les Deux SensDounia Larhouasli MarrakchiÎncă nu există evaluări
- Chapitre 3: Transformations Chimiques S'effectuant Dans LesDocument6 paginiChapitre 3: Transformations Chimiques S'effectuant Dans LesFATIMA fatiiiÎncă nu există evaluări
- Force Des Acides Et BasesDocument4 paginiForce Des Acides Et Basestjmhfkdkd5Încă nu există evaluări
- Corre-Exo-Ch1 3Document28 paginiCorre-Exo-Ch1 3Jihen Ben SlimaÎncă nu există evaluări
- c7 Acides Et Bases Faibles Couples Acide Base Constante D Acidite Et Classification Des Couples Acide Base.Document10 paginic7 Acides Et Bases Faibles Couples Acide Base Constante D Acidite Et Classification Des Couples Acide Base.Momo MakadjiÎncă nu există evaluări
- C4 Correction Exercices AciditeDocument5 paginiC4 Correction Exercices AciditeAndrés Tobías Mba MICHA ALENEÎncă nu există evaluări
- Le PH Et Sa Mesure BisDocument31 paginiLe PH Et Sa Mesure Bisstanbul20001156Încă nu există evaluări
- FTSCresume Acide BaseDocument3 paginiFTSCresume Acide BaseWerfelli YassineÎncă nu există evaluări
- Acide BaseDocument6 paginiAcide BaseCalixte TakamÎncă nu există evaluări
- Chapitre Un CDocument13 paginiChapitre Un CDaboÎncă nu există evaluări
- C9 ForceDesAcidesEtBasesEleveDocument13 paginiC9 ForceDesAcidesEtBasesEleveYann FourteauÎncă nu există evaluări
- Chapitre 2 - PH Des Solutions AqueusesDocument11 paginiChapitre 2 - PH Des Solutions AqueusesBeatrice Florin100% (1)
- TAT équilibre acido-basiqueDocument17 paginiTAT équilibre acido-basiquedrakox.fortniteÎncă nu există evaluări
- Cours - Réact° Chimiq Par Échange de Proton.Document8 paginiCours - Réact° Chimiq Par Échange de Proton.FILALI AOUAL OumaimaÎncă nu există evaluări
- C7 Cours T°S Acide Faible Base Faible Couple Acide Base Et Constante D AciditéDocument11 paginiC7 Cours T°S Acide Faible Base Faible Couple Acide Base Et Constante D AciditéBabacar NdiayeÎncă nu există evaluări
- CompletDocument8 paginiCompletInes De Paul FeudjeuÎncă nu există evaluări
- Cours Chimie 01Document4 paginiCours Chimie 01Anonymous FikOnlapÎncă nu există evaluări
- Fiche de Revision Physique Chimie Terminale Bac 2021 Acidebase Exercices CorrectionsDocument2 paginiFiche de Revision Physique Chimie Terminale Bac 2021 Acidebase Exercices Correctionslesucces plusplusÎncă nu există evaluări
- Chemical Engineering LabDocument15 paginiChemical Engineering LabOmairÎncă nu există evaluări
- Etat D - Equilibre D'un SystemeDocument8 paginiEtat D - Equilibre D'un SystemeOskar GottliebÎncă nu există evaluări
- Chapitre 5 PH Des Solutions AqueusesDocument16 paginiChapitre 5 PH Des Solutions AqueusesSyryne DridiÎncă nu există evaluări
- Les Acides Et Les BasesDocument59 paginiLes Acides Et Les BasesCarter JeanÎncă nu există evaluări
- ExtraitDocument9 paginiExtraitSteeven VillageÎncă nu există evaluări
- Traveaux Dirigés 2Document6 paginiTraveaux Dirigés 2Aymen BaccoucheÎncă nu există evaluări
- TP 3 Acide Base PDFDocument8 paginiTP 3 Acide Base PDFadsvgnmÎncă nu există evaluări
- Chimie SolutionDocument31 paginiChimie SolutionNabil holmesÎncă nu există evaluări
- Chapitre IIDocument12 paginiChapitre IIPascal GadedjissoÎncă nu există evaluări
- Chapitre-5-Les Transformations Liées Par Des Réactions Acido-Basique - DosageDocument13 paginiChapitre-5-Les Transformations Liées Par Des Réactions Acido-Basique - Dosagea houssÎncă nu există evaluări
- Cours Chimie IIDocument37 paginiCours Chimie IINesrine Kaddouri100% (1)
- Equilibres en Solutions AcqueusesDocument58 paginiEquilibres en Solutions AcqueusesGadede Martine ESSANÎncă nu există evaluări
- Les Solutions Aqueuses IoniquesDocument18 paginiLes Solutions Aqueuses IoniquesMétatron GamesÎncă nu există evaluări
- Acide Base PDFDocument3 paginiAcide Base PDFAbdelhakim BailalÎncă nu există evaluări
- I. PH D Une Solution AqueuseDocument5 paginiI. PH D Une Solution AqueuseJean-Loïc BauchetÎncă nu există evaluări
- Chapitre 2 Acide BaseDocument17 paginiChapitre 2 Acide BaseSouFien MabroukÎncă nu există evaluări
- TS CHIMIE GENERALEDocument36 paginiTS CHIMIE GENERALEemmanuelle.anzouaÎncă nu există evaluări
- Livre Vers Le Bacc T2Document27 paginiLivre Vers Le Bacc T2Hanine Hmida50% (2)
- Couple Acide Base PDFDocument10 paginiCouple Acide Base PDFالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Rev Ac Bas PDFDocument5 paginiRev Ac Bas PDFYoussef BerquedichÎncă nu există evaluări
- Correction TD2 - Calculs de PH (Exos 4,5,6,7,8) V2Document9 paginiCorrection TD2 - Calculs de PH (Exos 4,5,6,7,8) V2Amir NadeauÎncă nu există evaluări
- ActivitesDocument4 paginiActivitesMamadou DembaÎncă nu există evaluări
- 6 Exercices Réactions Acido-Basique 1Document1 pagină6 Exercices Réactions Acido-Basique 1RIDA SAMIÎncă nu există evaluări
- Présentation Cours N°6Document13 paginiPrésentation Cours N°6inessÎncă nu există evaluări
- Chimie Des Eaux - L2 - TD N°1Document4 paginiChimie Des Eaux - L2 - TD N°1cosinus50% (2)
- LC13 - Acides Et Bases (Lycée) : Niveau: TS BibliographieDocument13 paginiLC13 - Acides Et Bases (Lycée) : Niveau: TS BibliographieDiallo SafaiouÎncă nu există evaluări
- Cours Physique-Chimie 1bac BIOF .S1Document47 paginiCours Physique-Chimie 1bac BIOF .S1الغزيزال الحسن EL GHZIZAL Hassane100% (1)
- Physique 1 Et 2-Fi12999646Document58 paginiPhysique 1 Et 2-Fi12999646الغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Exercices Qte de Matiere2Document5 paginiExercices Qte de Matiere2الغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- 2005 Antilles Spe Sujet Exo3 ModulationDocument2 pagini2005 Antilles Spe Sujet Exo3 Modulationالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Alcootest Et Oxydoreduction, Exercice de Chimie - 232424Document3 paginiAlcootest Et Oxydoreduction, Exercice de Chimie - 232424الغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- 2005 Reunion Correction Exo2 Ammoniac 6 5ptsDocument2 pagini2005 Reunion Correction Exo2 Ammoniac 6 5ptsالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Travail Et Energie Cinetique Cours 2Document9 paginiTravail Et Energie Cinetique Cours 2Smove Oner100% (1)
- Exos OMP CorrigesDocument6 paginiExos OMP Corrigesالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Cours Chimie 1BACDocument43 paginiCours Chimie 1BACالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Exercices Qte de MatiereDocument5 paginiExercices Qte de Matiereالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Evaluations CorrectionDocument6 paginiEvaluations Correctionالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- MECANIQUE en LIGNE - Exercice de Cinématique - TreuilDocument1 paginăMECANIQUE en LIGNE - Exercice de Cinématique - Treuilالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Mouvement Particule Chargée MagnétiqueDocument6 paginiMouvement Particule Chargée Magnétiqueالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- 2010 Metropole Exo2 Correction Nucleaire Medecine 5 5ptsDocument2 pagini2010 Metropole Exo2 Correction Nucleaire Medecine 5 5ptsالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- C6 La Pile ElectrochimiqueDocument7 paginiC6 La Pile ElectrochimiquePecorellaÎncă nu există evaluări
- Serie 10 Lois de Newton FBDocument5 paginiSerie 10 Lois de Newton FBالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Devoir Surveillé de Physique NucléaireDocument2 paginiDevoir Surveillé de Physique Nucléaireالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Les Lois de MecaniqueDocument13 paginiLes Lois de MecaniqueBordeauxMeknesAlamesÎncă nu există evaluări
- Devoir SurveilléDocument3 paginiDevoir Surveilléالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Devoir N 1SII 2021 Bac BiofDocument4 paginiDevoir N 1SII 2021 Bac Biofالغزيزال الحسن EL GHZIZAL Hassane100% (1)
- Exercices 2 Les Lois de NewtonDocument1 paginăExercices 2 Les Lois de Newtonالغزيزال الحسن EL GHZIZAL Hassane100% (4)
- Devoir 2bacspf 11Document1 paginăDevoir 2bacspf 11الغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Question Discussion Réponse: LimiteDocument19 paginiQuestion Discussion Réponse: Limiteالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Correction de Devoir SurveilléDocument2 paginiCorrection de Devoir Surveilléالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Site TS C 08 Les PilesDocument9 paginiSite TS C 08 Les PilesPecorellaÎncă nu există evaluări
- Exercices Etat D Equilibre D Un Systeme ChimiqueDocument4 paginiExercices Etat D Equilibre D Un Systeme Chimiqueالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Chapitre3-Exercice Cinematique Dynamique NewtonDocument8 paginiChapitre3-Exercice Cinematique Dynamique Newtonالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Chapitre 11 Les Lois de NewtonDocument12 paginiChapitre 11 Les Lois de Newtonالغزيزال الحسن EL GHZIZAL Hassane100% (1)
- Les Piles PDFDocument38 paginiLes Piles PDFKONAN ABO PHILEMON ARONOU100% (1)
- Chapitre 2 2011-2012 Les Piles ElectrochimiqueDocument8 paginiChapitre 2 2011-2012 Les Piles ElectrochimiqueHAMADA19720% (1)
- Fiches ParcellairesDocument18 paginiFiches ParcellairesRamaÎncă nu există evaluări
- MTHEODocument2 paginiMTHEOmourad laatatÎncă nu există evaluări
- Exercices 4 Les Piles Et Récupération D'énergieDocument1 paginăExercices 4 Les Piles Et Récupération D'énergiefatima mahfoudiÎncă nu există evaluări
- PR Ése Ntation 22Document27 paginiPR Ése Ntation 22yamina bennacefÎncă nu există evaluări
- Gha Benabid AbderrahmaneDocument152 paginiGha Benabid AbderrahmaneHichem MaghÎncă nu există evaluări
- Depliant Promo c7Document24 paginiDepliant Promo c7pyllouÎncă nu există evaluări
- Ouarzazate CSP PROMES 2c-Récepteur Pour CPDocument41 paginiOuarzazate CSP PROMES 2c-Récepteur Pour CPelalaouyÎncă nu există evaluări
- Cours Distillation Flash M1Document15 paginiCours Distillation Flash M1Ilyes Tebbiche100% (1)
- BAC CetD 2006 Chimie (Corrigé)Document5 paginiBAC CetD 2006 Chimie (Corrigé)Ousmane Diarra100% (1)
- Ress - TP00307Document2 paginiRess - TP00307Saliha BrÎncă nu există evaluări
- Analyse Des Modes de Défaillances Par La Méthode AMDECDocument84 paginiAnalyse Des Modes de Défaillances Par La Méthode AMDECSaid Zitouni56% (9)
- Cours Zaid 2015 Part 04Document87 paginiCours Zaid 2015 Part 04Walid ZevonÎncă nu există evaluări
- Micro DevalDocument8 paginiMicro DevalMohamed MeraounaÎncă nu există evaluări
- Ibn Al AwanDocument10 paginiIbn Al AwanlaurentbonneauÎncă nu există evaluări
- Convection de La Chaleur en Electricite Grace A L'Effet See BeckDocument15 paginiConvection de La Chaleur en Electricite Grace A L'Effet See Beckjeaneudelawson01Încă nu există evaluări
- Methodes Complexometriques-Complexes SolublesDocument35 paginiMethodes Complexometriques-Complexes SolublessafemindÎncă nu există evaluări
- Rapport de Stage Master 2 UNCEIA-MIDATEST - 2012Document35 paginiRapport de Stage Master 2 UNCEIA-MIDATEST - 2012Mohammed SEHNINEÎncă nu există evaluări
- DS 2 BCPSTDocument5 paginiDS 2 BCPSTyakhafrÎncă nu există evaluări
- 3-Exploration Du Métabolisme Des Lipides 2013Document30 pagini3-Exploration Du Métabolisme Des Lipides 2013tami tamaÎncă nu există evaluări
- Devis Peinture & Sol Appt RDCDocument2 paginiDevis Peinture & Sol Appt RDCetravoÎncă nu există evaluări
- Brochure RevelonDocument40 paginiBrochure Revelonأحمد العابد100% (1)
- Soluflow 3090Document2 paginiSoluflow 3090Hamza DjellalÎncă nu există evaluări
- Memoire Hanane GhezalDocument90 paginiMemoire Hanane GhezalDjoud InhcÎncă nu există evaluări
- Roxtec S Frame v1Document13 paginiRoxtec S Frame v1tzuvela99Încă nu există evaluări
- Oil BseDocument12 paginiOil BseBAKOLY ANDRIAMIANDRISOAÎncă nu există evaluări
- RapportDocument33 paginiRapportIsmail AmraouiÎncă nu există evaluări
- Exercices Corrigé Codap24 Mars 1Document1 paginăExercices Corrigé Codap24 Mars 1Simo Seprob67% (3)
- Béton: Définition Et Classification Des Environnements Chimiquement AgressifsDocument17 paginiBéton: Définition Et Classification Des Environnements Chimiquement AgressifsMeyer EdouardÎncă nu există evaluări
- Chapitre I - Modèle de LewisDocument6 paginiChapitre I - Modèle de Lewisadnanwww16Încă nu există evaluări
- Dosage TitrageDocument9 paginiDosage TitrageRodrigue Tchoffo0% (1)