Documente Academic
Documente Profesional
Documente Cultură
Chimie Organique Cours Sur Les Alcools
Încărcat de
Kone KouweltonDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Chimie Organique Cours Sur Les Alcools
Încărcat de
Kone KouweltonDrepturi de autor:
Formate disponibile
1.
Ractivit Les alcools sont caractriss par deux liaisons particulires : la liaison C O et la liaison C H , ainsi quun caractre basique prononc des doublets de loxygne. Comme la liaison C X des drivs halogns, la liaison C O est polarise (diffrence dlectrongativit) et le carbone va donc subir les mmes ractions que les drivs halogns : SN1 , SN2 , E1 et E2 . La basicit de loxygne va lui permettre de crer plus facilement des liaisons avec les protons, ce qui conduira augmenter la charge positive partielle sur le carbone et donc favoriser sa ractivit. Enfin, les alcools sont des acides trs faibles dans leau, mais leur pKa extrapol est compris entre 15 et 19, ce qui montre que les bases conjugues sont relativement faciles obtenir, et quelles pourront jouer un rle nuclophile important (voir Williamson) 2. Alcoolates phnates 2.1. Acidit des alcools et phnols (solvatation, effets msomres) Leur acidit va pouvoir tre tudie en comparant les stabilits des bases conjugues (alcoolates oui phnates). Plus elles sont stables, plus lalcool sera acide. Comme ce sont des anions, ils seront stabiliss : 2.1.1. Par les effets attracteurs du substrat 2.1.2. Par les effets msomres du substrat 2.1.3. Par la solvatation due aux liaisons hydrogne du solvant qui est gnralement lalcool lui-mme. Ainsi, les alcools primaires sont-ils plus acides que les secondaires et les tertiaires :
Ce sont essentiellement les effets donneurs du CH3 qui expliquent laugmentation du pKa lorsque lon passe du mthanol lthanol. Ils permettent galement dexpliquer la forte basicit de lanion tertiobutylate, mais il faut voir dans ce pKa lev, limpossibilit qua le solvant (le tertiobutanol), de solvater cet anion cause de lencombrement strique. Cet anion sera donc extrmement instable et le tertiobutanol est un des alcools les moins acides. Par contre, lanion phnate sera trs stabilis par les effets msomres du cycle aromatique, qui , en loccurrence, se comporte ici comme un accepteur dlectrons :
Le pKa du couple phnol/phnate sera donc faible (de lordre de 6) 2.2. Williamson Ces anions alcoolate sont de bons nuclophiles, dautant plus que les pK correspondants sont levs et quils ne sont pas encombrs. Lanion tertiobutylate est par exemple trop encombr pour jouer le rle de nuclophile. Ce sera une bonne base par ailleurs. Ils pourront donc ragir avec les drivs halogns peu encombrs selon une raction de type SN2 pour donner des thers :
Une base encombre ne pourra ragir avec un driv halogn encombr que selon un mcanisme dlimination E2. 2.3. Williamson intramolculaire sur les halohydrines (strochimie) Le mme type de raction peut avoir lieu dans une mme molcule. Alors que pour former les alcoolates prcdents, il faut toujours une base assez forte ( lion hydroxyde pour former les phnates, le sodium mtallique pour les mthanolates, thanolates, le potassium pour les tertiobutylates, il suffit de traiter ces halohydrines par lion hydroxyde pour que la raction ait lieu :
On constate que cette raction ncessite que le brome et le groupement OH soient en conformation anti . 2.4. Raction avec CH2N2 (avec ou sans BF3) Les alcools peuvent tre transforms en thers mthyliques grce au diazomthane CH2N2 . Celui-ci est un mthylure de diazonium, comportant un carbone basique :
Si lalcool est suffisamment acide (phnols), il ragira spontanment avec le diazomthane :
Si lalcool nest pas assez acide, on doit rajouter un acide de Lewis qui va renforcer son acidit : BF3
3. SN sur les alcools La liaison C-O est trs stable, au point que dans la plupart des cas, les alcools sont relativement inertes dans des conditions de pH neutre. Ceci se traduit en disant que -OH est un trs mauvais groupe partant. Aussi faut-il transformer cette fonction alcool en une nouvelle structure devenue un bon groupe partant. On utilise principalement deux mthodes : la transformation de l'alcool en ester de l'acide sulfonique (sulfonate) ou la protonation en milieu fortement acide. La dernire mthode est de loin la plus importante, mais la premire est de plus en plus utilise car elle permet la ractivit des alcools en milieu anhydre. La nature du substrat (primaire, secondaire ou tertiaire) influencera la vitesse et l'ordre de la SN de la mme manire qu'il influence les SN sur les drivs halogns. 3.1. Passage par les sulfontes Les chlorures d'alkyl ou arylsulfonyle les plus utiliss sont le chlorure de mthanesulfonyle (ou chlorure de msyle) et le chlorure de paratolune-sulfonyle (chlorure de tosyle). Ils ragissent avec les alcools en prsence d'un solvant non aqueux mais basique comme la pyridine :
Les ions msylate tosylate et
sont de trs bons groupes partants, et donc les msylates et tosylates d'alkyle pourront subir la substitution nuclophile, d'ordre deux gnralement, car ces ractions se font en milieu peu ou pas protique. Elles concerneront donc essentiellement les drivs primaires et secondaires. Dans l'exemple ci-contre, au final, la fonction alcool est transforme en fonction azoture, avec inversion de configuration (SN2 dans la seconde tape). 3.2. Protonation de la fonction alcool. Cette protonation fait apparatre un trs bon groupe partant : H2O. Les deux mcanismes de substitution dj tudis sont valables pour les alcools, ou plutt, pour les alcools protons. La raction doit donc se faire en prsence de protons libres, donc dans un solvant protique, de prfrence leau, et les rgles dj vues pour les halognures sappliquent : Si le substrat est primaire, le mcanisme de la raction sera SN2 Sil est tertiaire SN1 Sil est secondaire, on aura une comptition des deux
Si le substrat primaire peut subir des ractions de rarrangement pour donner des carbocations stables, une pseudo SN1 a lieu (la vitesse est dordre 1) :
Le nuclophile Nu peut tre de diverse nature : Ce peut tre un ion halognure, dont la nuclophilie varie comme tudi prcdemment dans ce solvant protique : I > Br > Cl. Dans ce cas on obtient des halognures dalkyle. Les conditions opratoires dpendent de la facilit avec laquelle se font chacun des deux mcanismes. Ainsi, la formation dhalognures primaires ncessite-t-elle une temprature leve, alors que les halognures tertiaires se forment temprature ordinaire, surtout en prsence de catalyseur tel que ZnCl2 (raction de LUCAS) :
Un autre type de nuclophile est lalcool lui-mme. La raction se fait temprature modre ( lbullition de lalcool en prsence dacide sulfurique). On obtient un oxyde dalkyle, symtrique si lon ne fait ragir quun seul type dalcool :
Cette raction ne se fait pas par SN1 avec lalcool tertiobutylique, cause de lencombrement du nuclophile tbuOH. Cependant, le mlange de tertiobutanol, de mthanol et dacide sulfurique conduit, par SN1, lther mixte de mthyle et de tertiobutyle :
3.3. Synthses particulires des halognures avec SOCl2 et PBr3 (Pb de strochimie) Les alcools primaires et secondaires (moins facile), peuvent tre halogns selon un mcanisme SN2 par des agents halognants tels que SOCl2 , PCl3 , PCl5 et PBr3. On peut galement crer ces agents in situ en faisant ragir le dibrome Br2 ou le diiode I2 sur lalcool en prsence de phosphore rouge. Le bilan ractionnel est le suivant : ROH + SOCl2 RCl + SO2 + HCl 3 ROH + PBr3 3 RBr + H3PO3 La raction dbute toujours par la formation dun ester inorganique :
En prsence dther, bon complexant, mais peu basique, il y a rtention de configuration, car il y deux SN2 de suite, donc deux inversions de suite,
Par contre, en labsence de solvant, ou en prsence dune amine tertiaire, cest linversion qui prdomine, car il ny a quune SN2 :
3.4. Participation du groupe voisin (bromation par HBr dune halohydrine)
La SN2 peut galement tre intramolculaire. Un groupe riche en lectrons port par le carbone voisin la fonction alcool peut trs bien substituer cette fonction pralablement protone. Ainsi, la bromation par HBr des alcools secondaires estelle grandement acclre par la proximit dun brome. De plus, il y a rtention de la configuration du carbone o se fait la substitution, ou inversion des deux carbones asymtriques :
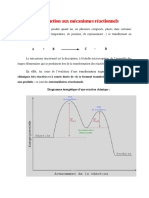
4. limination sur les alcools 4.1. E1 Llimination se fait toujours en milieu acide, haute temprature, pour obtenir un bon nuclofuge (H2O). La base qui arrache le proton est une base faible, leau, qui seule peut conserver ses proprits basiques en prsence dacide fort. En consquence, le mcanisme sera essentiellement E1, avec passage intermdiaire par un carbocation. La vitesse dlimination sera donc dautant plus grande que le carbone portant la fonction alcool sera plus substitu par des groupements donneurs :
On constate aussi que llimination sur les alcools suit la rgle de Zaytseff
L'limination partir d'un alcool secondaire ncessite l'utilisation d'acide phosphorique ou d'acide sulfurique concentr. Les alcools tertiaires se dshydratent bien plus facilement et il suffit d'une solution d'acide sulfurique 10% pour provoquer la raction. La E1 est tellement dfavorise dans le cas des alcools primaires que la dshydratation ncessite des conditions extrmes, par exemple le passage des vapeurs d'alcool sur du trioxyde de dialuminium (alumine) entre 500C et 800C. 4.2. Transposition pinacolique Les diols aussi peuvent subir llimination E1, en donnant un dine, que ce soient des diols n,n+1 (auquel cas on aura un dine conjugu), o dautres. Cependant, les diols conjugus ne donnent ce type de raction classique quen prsence dun acide associ une base conjugue assez forte ( concentr par exemple), Lacide sulfurique 15% dans leau, nest associ qu la base conjugue qui est moins basique que H2O. Dans ce cas, le dpart du proton est moins rapide que la transposition du groupe carbon port par lautre fonction alcool. On constate que la transposition est en ralit une SN2 interne, possible grce la stabilit du carbonyle proton HOC+ . Si la structure nest pas symtrique, le groupement hydroxyle proton sera celui qui donnera, par dpart de H2O, le carbocation le plus stable, et le groupement qui va migrer sera choisir dans la liste daptitude suivante : F activ , F , H , alkyle
5. Oxydation 5.1. Par les oxydants forts Les drivs du chrome VI (dichromate de potassium, trioxyde de chrome) et ceux du manganse VII (permanganate de potassium) en milieu acide sulfurique concentr, sont des oxydants puissants qui vont oxyder les alcools au maximum possible, cest dire que les alcools secondaires sont oxyds en ctones (butan2-ol butanone) et que les alcools primaires sont gnralement oxyds en acides carboxyliques. On peut cependant se limiter au stade aldhyde en distillant celuici au fur et mesure de sa formation, car les acides ont des points dbullition bien plus levs. Ce procd nest applicable quaux aldhydes de bas poids molculaire ( butanal). Lacide nitrique concentr et chaud permet de rompre par dshydratation pralable les liaisons carbone-carbone, et peut donc oxyder en acides carboxyliques, les alcools secondaires et tertiaires, avec destruction de la chane carbone de dpart. Le permanganate de potassium en milieu fortement basique permet la mme opration : synthse de lacide adipique :
5.2. Par MnO2 Les alcools allyliques et benzyliques peuvent tre oxyds slectivement en aldhydes par MnO2 qui est un oxydant doux :
5.3. Par HIO4 ou
Lacide priodique oxyde les diols vicinaux en drivs carbonyls, avec rupture de la liaison carbone carbone liant les deux groupements fonctionnels :
Le mcanisme est le suivant :
6. Raction des thers et poxydes. 6.1. Catalyse basique (uniquement poxydes) Les thers sont habituellement inertes en milieu basique. Cest pour cela quils servent souvent de solvant dans les ractions nuclophiles (organomagnsiens) ou basiques. Cependant, les poxydes (ou oxirannes, ou oxacyclopentanes), peuvent tre clivs par les nuclophiles forts. Cette raction respecte les rgles de rgioslectivit (site le moins encombr) et de strochimie des SN2 :
6.2. Catalyse acide (ex HBr) Les thers peuvent tre coups par les acides (trs forts gnralement) dont les bases conjugues sont de bons nuclophiles. HI et HBr conviennent, alors que HClO4 ne convient pas, sa base conjugue, lion perchlorate ntant pas du tout nuclophile.
Il y a protonation de loxygne, et SN2 (gnralement) de I ou Br sur le carbone le plus accessible. Ceci est particulirement vrai pour les thers aromatiques (lanisole ou mthoxybenzne par exemple), qui sont gnralement prpars pour protger un phnol lors dune raction sur le cycle aromatique :
7. Rarrangement de Claisen des thers dallyle et de phnyle Par simple chauffage, ces thers se rarrangent selon un mcanisme lectrocyclique :
On obtient un ortho-allyl-phnol.
S-ar putea să vă placă și
- La Voie Du Musulman: Aboubaker Djaber EldjazairiDocument569 paginiLa Voie Du Musulman: Aboubaker Djaber EldjazairiAbderrahmane100% (2)
- AlcynesDocument5 paginiAlcynesمريم ياسمينÎncă nu există evaluări
- OrgaDocument7 paginiOrgaDah MañůsÎncă nu există evaluări
- Derives CarbonylesDocument31 paginiDerives CarbonylesDarel Nadjiera100% (1)
- L2 Cours de Chimie OrganiqueDocument8 paginiL2 Cours de Chimie OrganiqueBeny MaboundaÎncă nu există evaluări
- Chim Orga 2 (Suite Du Dernier Chapitre)Document24 paginiChim Orga 2 (Suite Du Dernier Chapitre)Hk Eh100% (1)
- AlcoolDocument9 paginiAlcoolAmine FelloussiaÎncă nu există evaluări
- Alcools Et PhénolsDocument5 paginiAlcools Et PhénolsSalma MouÎncă nu există evaluări
- Chapitre 11Document34 paginiChapitre 11Gabriel Lapointe-GuayÎncă nu există evaluări
- Réactions de Substitution ÉlectrophileDocument5 paginiRéactions de Substitution Électrophilewarda MaÎncă nu există evaluări
- Hydrocarbures Insatures MedDocument12 paginiHydrocarbures Insatures MedousmaneditbakoresyllaÎncă nu există evaluări
- CHAPITRE 6 Les Composés À Fonctions MixtesDocument6 paginiCHAPITRE 6 Les Composés À Fonctions MixtesYves Patrick AngoÎncă nu există evaluări
- Partie I - Les Hydrocarbures - Chp1 - Les AlcanesDocument7 paginiPartie I - Les Hydrocarbures - Chp1 - Les Alcaneskobbiyoussef49Încă nu există evaluări
- Les AlcèneDocument11 paginiLes AlcèneŚặł Ặĥ ßŏukĥíặřÎncă nu există evaluări
- Chimie Orga 2Document44 paginiChimie Orga 2Yeo Ouanan LassinaÎncă nu există evaluări
- 6 - Résumé Polym Ioniques (Résumé Section B) PDFDocument5 pagini6 - Résumé Polym Ioniques (Résumé Section B) PDFomatrÎncă nu există evaluări
- 2010 Lyon Walchshofer Radix AlcanesCoursDocument2 pagini2010 Lyon Walchshofer Radix AlcanesCoursAlisson AlainÎncă nu există evaluări
- Chimie - sn1 sn2Document11 paginiChimie - sn1 sn2meyemarion99Încă nu există evaluări
- Alcnes Cours 4Document7 paginiAlcnes Cours 4Amine FelloussiaÎncă nu există evaluări
- Cours de Chimie Orga DESC I-1Document45 paginiCours de Chimie Orga DESC I-1emmanuel cerda adonaïÎncă nu există evaluări
- De Aldéhyde:: (R Représente Une Chaîne Carbonée.)Document8 paginiDe Aldéhyde:: (R Représente Une Chaîne Carbonée.)Rima RabiaÎncă nu există evaluări
- Chapitre 2 - Aldehydes& Cetones ModDocument104 paginiChapitre 2 - Aldehydes& Cetones ModYoussef Aouin100% (1)
- Cours Chimie Organique 2 (S4) TC BCG-convertiDocument126 paginiCours Chimie Organique 2 (S4) TC BCG-convertiRim ElmoutaoukkilÎncă nu există evaluări
- Che Resume 1eDocument16 paginiChe Resume 1eantarctica_05Încă nu există evaluări
- Reactions Chimie OrgaDocument47 paginiReactions Chimie OrgafluiddynamicÎncă nu există evaluări
- Chimie OrganiqueDocument16 paginiChimie OrganiqueNour Allah tabibÎncă nu există evaluări
- Exposé AlkylationDocument49 paginiExposé Alkylationhamza layachi100% (2)
- Chap5 AromatiquesDocument6 paginiChap5 AromatiquesChimie ChimieÎncă nu există evaluări
- AlcèneDocument6 paginiAlcènechristophe100% (1)
- Chim 306 - Notes de CoursDocument43 paginiChim 306 - Notes de Coursnatural recipeÎncă nu există evaluări
- Chapitre 2 Réactions de SubstitutionDocument14 paginiChapitre 2 Réactions de Substitutionsimo GriÎncă nu există evaluări
- SurplusDocument19 paginiSurplusYannick DsprbsÎncă nu există evaluări
- Cours CHM146 SVT Semaine6Document11 paginiCours CHM146 SVT Semaine6Abalo KpelemouaÎncă nu există evaluări
- 2 - Fonctions MonovalentesDocument32 pagini2 - Fonctions MonovalentesPrince AbdooÎncă nu există evaluări
- Aldehyde Et Cetone Groupe3Document29 paginiAldehyde Et Cetone Groupe3Salma MouÎncă nu există evaluări
- Alcenès Planchage FinalDocument22 paginiAlcenès Planchage FinalRima LettreuchÎncă nu există evaluări
- Corrige HEI Chimie-Organique 1999 CHIMIEDocument7 paginiCorrige HEI Chimie-Organique 1999 CHIMIENawal ZakriÎncă nu există evaluări
- Complements Notes de Cours Chim 306 Chim III Dco Fac SciencesDocument12 paginiComplements Notes de Cours Chim 306 Chim III Dco Fac SciencesTerence YepdjouÎncă nu există evaluări
- Cours Grandes Fonctions 2022-2023Document39 paginiCours Grandes Fonctions 2022-2023Kossivi issa SALOUFOUÎncă nu există evaluări
- Alcool 1Document25 paginiAlcool 1Cecile SpykilineÎncă nu există evaluări
- Fonctions OxygeneesDocument29 paginiFonctions OxygeneesharoldkossaÎncă nu există evaluări
- Chapitre 2 La Série AromatiqueDocument5 paginiChapitre 2 La Série AromatiqueYves Patrick AngoÎncă nu există evaluări
- RX ROH ArOHDocument38 paginiRX ROH ArOHIlarion MogaÎncă nu există evaluări
- Chapitre 5,6 Et 7Document31 paginiChapitre 5,6 Et 7مريم ياسمينÎncă nu există evaluări
- Les Acides Carboxyliques Et Leurs Dérivés: Pr. El Hammoumi Mohamed MerouaneDocument37 paginiLes Acides Carboxyliques Et Leurs Dérivés: Pr. El Hammoumi Mohamed MerouaneLAHCEN OUTALBÎncă nu există evaluări
- Les Dérivés HalogénésDocument9 paginiLes Dérivés Halogénésشكوب ستان100% (1)
- Chimie Organique Cours Sur Les Acides Carboxyliques Et Leurs DérivésDocument24 paginiChimie Organique Cours Sur Les Acides Carboxyliques Et Leurs DérivésKone Kouwelton100% (1)
- Composé Carbonylé - WikipédiaDocument5 paginiComposé Carbonylé - WikipédiaANDRIANOME tafita100% (1)
- Addition NucleophileDocument7 paginiAddition NucleophileجعدبندرهمÎncă nu există evaluări
- C3.2.Propriétés Phsicochimiques Des AAsDocument12 paginiC3.2.Propriétés Phsicochimiques Des AAsYacine SmiliÎncă nu există evaluări
- Chap.4 OXY RED PDFDocument36 paginiChap.4 OXY RED PDFrajaÎncă nu există evaluări
- Equilibre ChimiqueDocument14 paginiEquilibre ChimiqueMétatron GamesÎncă nu există evaluări
- Al CanesDocument29 paginiAl CanesMichael VoulnangÎncă nu există evaluări
- Chapitre II-Les Carbonylés (Les Aldéhydes Et Les Cétones)Document48 paginiChapitre II-Les Carbonylés (Les Aldéhydes Et Les Cétones)Park-j TailÎncă nu există evaluări
- Chimie (Alcools)Document5 paginiChimie (Alcools)Florent AkaffouÎncă nu există evaluări
- Action Des Ions HoDocument7 paginiAction Des Ions HoAmine RedouaneÎncă nu există evaluări
- 6-Les Réactions D'éliminationsDocument7 pagini6-Les Réactions D'éliminationsathlaalgÎncă nu există evaluări
- Composés CarbonylésDocument3 paginiComposés CarbonylésaaÎncă nu există evaluări
- Cours Chapitre IV-AromatiquesDocument13 paginiCours Chapitre IV-AromatiquesMohamed AIT KASSIÎncă nu există evaluări
- Glucides: Les Grands Articles d'UniversalisDe la EverandGlucides: Les Grands Articles d'UniversalisÎncă nu există evaluări
- Équilibres en solution: Les Grands Articles d'UniversalisDe la EverandÉquilibres en solution: Les Grands Articles d'UniversalisÎncă nu există evaluări
- Rapport de Stage de KONEDocument110 paginiRapport de Stage de KONEKone Kouwelton75% (4)
- Al Walaa Wal Baraa Et La Refutation Des Extremismes (5eme - Edition)Document47 paginiAl Walaa Wal Baraa Et La Refutation Des Extremismes (5eme - Edition)Kone KouweltonÎncă nu există evaluări
- Est-Il Permis À Un Père de Contraindre Sa Fille Vierge, Pubère, Au MariageDocument4 paginiEst-Il Permis À Un Père de Contraindre Sa Fille Vierge, Pubère, Au Mariagebismillah03Încă nu există evaluări
- 10 Moyens de Repousser Le Chatiment Du FeuDocument6 pagini10 Moyens de Repousser Le Chatiment Du FeuMathieu RichardÎncă nu există evaluări
- Chimie Organique Cours Sur Les AlcynesDocument6 paginiChimie Organique Cours Sur Les AlcynesKone KouweltonÎncă nu există evaluări
- Cours de Chimie OrganiqueDocument35 paginiCours de Chimie OrganiqueKone KouweltonÎncă nu există evaluări
- Chimie Organique Cours Sur Les AlcènesDocument25 paginiChimie Organique Cours Sur Les AlcènesKone KouweltonÎncă nu există evaluări
- Chimie Organique Cours Sur Les Acides Carboxyliques Et Leurs DérivésDocument24 paginiChimie Organique Cours Sur Les Acides Carboxyliques Et Leurs DérivésKone Kouwelton100% (1)
- Cours de Chimie Organique Sur Les Acides AminésDocument13 paginiCours de Chimie Organique Sur Les Acides AminésKone KouweltonÎncă nu există evaluări
- Hadith Sahih Bukhari (French) 2Document352 paginiHadith Sahih Bukhari (French) 2Mohammed Jobe100% (2)
- Chimie Organique - Cours EpoDocument236 paginiChimie Organique - Cours EpoMohamed Salim CompaoreÎncă nu există evaluări
- TD Substitution Nucleophile Corrige 4Document6 paginiTD Substitution Nucleophile Corrige 4Daniel Nd100% (1)
- Cours Chimie Organique 2009-2010Document179 paginiCours Chimie Organique 2009-2010AlvaroEnriqueQuinterosÎncă nu există evaluări
- Chim311-2021-Mécanismes RéactionelsDocument51 paginiChim311-2021-Mécanismes RéactionelsKornichonÎncă nu există evaluări
- COR301Document223 paginiCOR301alchimist2xÎncă nu există evaluări
- Chimie Organique MécanismesDocument17 paginiChimie Organique MécanismesMLAN HesnaÎncă nu există evaluări
- Reactions D EliminationDocument9 paginiReactions D Eliminationnini100% (1)
- Chapitre 2 Réactions de SubstitutionDocument14 paginiChapitre 2 Réactions de Substitutionsimo GriÎncă nu există evaluări
- 2009 Lyon Walchshofer AnalyseConformationnelle SCoursDocument57 pagini2009 Lyon Walchshofer AnalyseConformationnelle SCoursFATIMA ZAHRA BAGHIDAÎncă nu există evaluări
- HEI Chimie-Organique 1999 CHIMIEDocument5 paginiHEI Chimie-Organique 1999 CHIMIENawal ZakriÎncă nu există evaluări
- Halogenure AlkyleDocument21 paginiHalogenure AlkyleGrace BendaÎncă nu există evaluări
- Hétéroatomes en Chimie OrganiqueDocument31 paginiHétéroatomes en Chimie OrganiqueMohamed EL FAGHLOUMIÎncă nu există evaluări
- TD Substitution Nucleophile 4Document4 paginiTD Substitution Nucleophile 4ANONYME179Încă nu există evaluări
- Ch7 Composes Halogenes&OrganometalliquesDocument65 paginiCh7 Composes Halogenes&OrganometalliquesGaetan CasanovaÎncă nu există evaluări
- Rof1 - TD 2022Document10 paginiRof1 - TD 2022Lisa CrpsÎncă nu există evaluări
- Chapitre5 1Document9 paginiChapitre5 1Karim Radi100% (1)
- 2f - Dynamique EnzymatiqueDocument16 pagini2f - Dynamique EnzymatiqueSaid JbariÎncă nu există evaluări
- S Net EliminationDocument137 paginiS Net EliminationجعدبندرهمÎncă nu există evaluări
- RX ROH ArOHDocument38 paginiRX ROH ArOHIlarion MogaÎncă nu există evaluări
- Vanhaverbeke Cecile p01Document28 paginiVanhaverbeke Cecile p01wael khalifaÎncă nu există evaluări
- Chimie Organique Cours Sur Les AlcoolsDocument12 paginiChimie Organique Cours Sur Les AlcoolsKone KouweltonÎncă nu există evaluări
- Chimie TD00c 230725 021231Document13 paginiChimie TD00c 230725 021231baatoutmbÎncă nu există evaluări
- TD HydrocarbureDocument6 paginiTD HydrocarbureOumar Sambou50% (2)
- Chapitre 11Document34 paginiChapitre 11Gabriel Lapointe-GuayÎncă nu există evaluări
- Chap 1 SN Et SEDocument14 paginiChap 1 SN Et SEXavier DaÎncă nu există evaluări
- Cours Chimie Organique SMPC S3Document39 paginiCours Chimie Organique SMPC S3camelaÎncă nu există evaluări
- Assia Physique PDFDocument122 paginiAssia Physique PDFMicrocosmos MystiqueÎncă nu există evaluări
- Corrige TD1Document7 paginiCorrige TD1Mariam Ben AbdelouahabÎncă nu există evaluări
- Chapitre 6 Chimie OrganiqueDocument44 paginiChapitre 6 Chimie OrganiqueleloÎncă nu există evaluări
- Corrige Cours de Chimie OrganiqueDocument25 paginiCorrige Cours de Chimie Organiquehamadoukoita36Încă nu există evaluări