Documente Academic
Documente Profesional
Documente Cultură
Dosage
Încărcat de
Physique ChimieDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Dosage
Încărcat de
Physique ChimieDrepturi de autor:
Formate disponibile
Les ractions acide-base
Toutes les solutions sont prises 25C, temprature laquelle le produit ionique de leau pure est Ke=10-14.
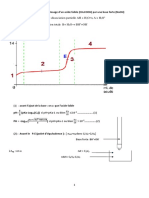
Exercice 1 : A laide dune pipette et partir dune solution aqueuse SA dun monoacide AH de concentration molaire CA, on prlve un volume VA=20 mL quon verse dans un bcher. Le dosage pH-mtrique de SA par uen solution aqueuse SB dhydroxyde de sodium NaOH (base forte), de concentration molaire CB=0,2 mol.L-1, a permis de tracer la courbe de figure -1pH
8,8
4,8 2,9
E1/2
Fig 1 Vb(mL)
1- Donner un schma annot du montage qui permet de raliser ce dosage. 2- a Dterminer graphiquement les coordonnes du point dquivalence. b- Dduire que lacide AH est faible. 3- a- Dfinir lquivalence acido-basique. Calculer CA. b- Calculer le taux davancement final de la raction de lacide AH avec leau. Dduire que 10-pH lacide est faiblement ionis. On donne F = CA c- Sachant que le pH dun acide faiblement ionis scrit sous la forme pH=1 (pKa logCA). 2 Calculer le pKa du couple AH/A puis retrouver sa valeur graphiquement. 4- A- crire lquation de la raction de dosage et montrer quelle est totale. b- Retrouver la valeur du pH au point dquivalence E sachant que lexpression de pH dune base faiblement ionise est donne par pH= 1 (pKa + pKe + logC). 2 5- On rpte le dosage prcdent aprs avoir ajout un volume V e deau pure au volume Va=20 mL de la solution SA. a- Prciser, en le justifiant, leffet de cette dilution sur : Le pH initial de la solution acide. Le pH la demi-quivalence. b- Calculer Ve sachant que la valeur de pHE a vari de 0,15. c- Parmi les indicateurs colors consigns dans le tableau ci-dessous, lequel est le plus appropri pour raliser ce dosage ? Justifier.
Indicateur color Bleu de bromothymol Hlianthine Phnolphtaline (.)
Zone de virage 6,2 7,4 3,1 4,4 8,2 10,0
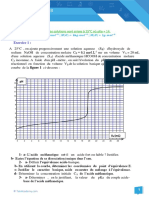
Exercice 2 :Dans une solution aqueuse dune base B de concentration molaire Cb = 4.10-2 mol.L-1 et de volume Vb=40 mL , on verse un volume Va dune solution aqueuse dacide chlorhydrique(acide fort) de concentration molaire Ca=8.10-2 mol.L-1. 1- Pour un volume vers Va=20 mL, le pH du mlange est gal 5,4. Montrer que la base B est faible. 2- Ecrire lquation de la raction acide-base qui se produit. 3- a- Sachant que la base B est faiblement ionise, tablir lexpression du pH de B en fonction de pKa, pKe et Cb. b- Sachant que le pKa(BH+/B) =9,2 ; calculer le pH de la base B avant lajout de lacide. 4- Dterminer le pH du mlange pour un volume dacide vers Va=10 mL. Toutes les solutions sont prises 25C, temperature laquelle le produit ionique de leau pure est Ke=10-14.
Exercice 3 :Dans un examen de travaux pratiques , un lve est charg deffectuer le dosage
dun volume va= 20mL dune solution dacide AH inconnu par une solution aqueuse dhydroxyde de sodium (base forte) de concentration molaire Cb afin didentifier AH. Au cours du dosage, llve suit laide dun pH-mtre lvolution de pH du milieu ractionnel en fonction du volume Vb de base verse, les rsultats sont consigns dans le tableau suivant : Vb(mL) 0 2 4 6 8 9 9.5 10 10.5 12 14 16 18 20
pH 2.81 3.62 4.03 4.38 4.8 5.16 5.48 8.31 11.2 11.7 11.97 12.12 12.23 12.3 On donne une liste de pKa de quelques couples acide-base qui peuvent tre utiles lidentification de lacide.
Couple acide-base NH4+/NH3 HCOOH/HCOO- C6H5COOH/C6H5COO- CH3NH3+/ CH3NH2 pKa 9,2 3,8 4,2 10,7
Le candidat est appel : 1- Faire un schma annot du dispositif utilis pour ce dosage. 2- Tracer la courbe reprsentative de pH=f(Vb). 3- Prlever la valeur du pH : a- lquivalence et dduire le caractre de lacide. b- A la demi-quivalence et identifier lacide. c- Initial de lacide et calculer sa concentration Ca en supposant que AH est un acide faiblement ionis. 4 - Ecrire lquation de la raction du dosage. 5- Calculer la concentration Cb de la base. 6- On dilue 10 fois la solution dacide initiale et on refait le dosage de lacide AH par la soude, tracer sur le mme papier millimtr lallure de la nouvelle courbe de pH=f(Vb)
S-ar putea să vă placă și
- Série DosageDocument8 paginiSérie DosageAicha Daou100% (1)
- TPC4Document2 paginiTPC4hhedfiÎncă nu există evaluări
- Série Réaction Acide BaseDocument5 paginiSérie Réaction Acide BaseScriblouÎncă nu există evaluări
- Dosage Acide Base IndicDocument3 paginiDosage Acide Base IndicAs Ma50% (2)
- Acides Et Bases SMDocument23 paginiAcides Et Bases SMSalma ZaÎncă nu există evaluări
- FICHE Dosage WebDocument4 paginiFICHE Dosage Webفيديو بالعربيÎncă nu există evaluări
- Yyy Suppexos cm4 cm5 Chimie Acides Bases PDFDocument16 paginiYyy Suppexos cm4 cm5 Chimie Acides Bases PDFKurosaki AimarÎncă nu există evaluări
- Série D'exercices - Chimie Cinétique Chimique - Bac Sciences Exp (2011-2012) MR Dahmani LotfiDocument0 paginiSérie D'exercices - Chimie Cinétique Chimique - Bac Sciences Exp (2011-2012) MR Dahmani LotfiMouf55Încă nu există evaluări
- Exo 54 - Dosage Acide Benzoique EDocument2 paginiExo 54 - Dosage Acide Benzoique EislameilhamiÎncă nu există evaluări
- La Loi D'action de MasseDocument4 paginiLa Loi D'action de MasseoO3atbaOoÎncă nu există evaluări
- DS2 Oct08Document6 paginiDS2 Oct08la physique selon le programme FrançaisÎncă nu există evaluări
- S Rie Des Exercices Acido-Basique 1 Bac SC - Exp BIOFDocument3 paginiS Rie Des Exercices Acido-Basique 1 Bac SC - Exp BIOFmaanane maananeÎncă nu există evaluări
- Dosage Dun Acide Fort Par Une Base Forte WebDocument2 paginiDosage Dun Acide Fort Par Une Base Forte WebHouda ElmoulouaÎncă nu există evaluări
- PrecipitationDocument6 paginiPrecipitationChloé DelcommuneÎncă nu există evaluări
- Chapitre IV 1Document37 paginiChapitre IV 1sidiÎncă nu există evaluări
- Exercice 1 (7 Points) Cinétique de La Décomposition de L'eau OxygénéeDocument8 paginiExercice 1 (7 Points) Cinétique de La Décomposition de L'eau Oxygénéeأمال بلقاسم100% (1)
- Exercice IDocument15 paginiExercice IInes De Paul Feudjeu100% (1)
- Série D'exercices N°7 - Chimie Série Physique Dipole RLC SCIENCE & MATH - Bac Sciences Exp (2011-2012) MR TLILI TOUHAMI PDFDocument2 paginiSérie D'exercices N°7 - Chimie Série Physique Dipole RLC SCIENCE & MATH - Bac Sciences Exp (2011-2012) MR TLILI TOUHAMI PDFAzizElheni100% (1)
- BAC Physique-Chimie-Specialite 2009 SDocument11 paginiBAC Physique-Chimie-Specialite 2009 SLetudiant.fr100% (7)
- Série A. Fort A. Faible B.Forte. B. FaibleDocument2 paginiSérie A. Fort A. Faible B.Forte. B. FaibleJalel Belfelah0% (1)
- Dosage 20 21Document13 paginiDosage 20 21salma benmiledÎncă nu există evaluări
- Exercice-Ph DevoirDocument3 paginiExercice-Ph DevoirBoussetta Zouhaier100% (1)
- Etat D Equilibre D Un Systeme Chimique Exercices Non Corriges 4 1Document2 paginiEtat D Equilibre D Un Systeme Chimique Exercices Non Corriges 4 1boufdiliÎncă nu există evaluări
- C5 Sol Aqueuses WahabDiopDocument3 paginiC5 Sol Aqueuses WahabDiopGaye Bachir100% (1)
- 04 PH Tau CorrectionDocument4 pagini04 PH Tau CorrectionChartier JulienÎncă nu există evaluări
- 4 - Mesure de La ConductanceDocument4 pagini4 - Mesure de La ConductanceBrahim Ouaabou100% (1)
- S2 - Equilibres Acido-Basiques en Solution AqueuseDocument4 paginiS2 - Equilibres Acido-Basiques en Solution AqueuseZAguirÎncă nu există evaluări
- Dev Cont 1 4T 2022 - 2023Document3 paginiDev Cont 1 4T 2022 - 2023Hamza RezguiÎncă nu există evaluări
- Caisse de Solidarite Du Groupe G3 Nioro Du RipDocument3 paginiCaisse de Solidarite Du Groupe G3 Nioro Du RipMohamed CoulibalyÎncă nu există evaluări
- Examens de Chimie-1Document17 paginiExamens de Chimie-1Anas HajimÎncă nu există evaluări
- Série D'exercices - Chimie - PH Des Solution - Bac Math (2016-2017) MR Afdal AliDocument3 paginiSérie D'exercices - Chimie - PH Des Solution - Bac Math (2016-2017) MR Afdal AliDhiya Klai100% (1)
- 2nd C - C11 R閍ction acido basique DosageDocument8 pagini2nd C - C11 R閍ction acido basique DosageNDAVKOUDA DZARAÎncă nu există evaluări
- Cours - Chimie - Les Acides Et Les BasesDocument6 paginiCours - Chimie - Les Acides Et Les BasesDaghsni Said100% (2)
- Les Acides Carboxyliques: L'idéal N'est Pas de Tout Faire, Mais de Bien Faire Ce Que L'on ConnaîtDocument4 paginiLes Acides Carboxyliques: L'idéal N'est Pas de Tout Faire, Mais de Bien Faire Ce Que L'on ConnaîtNjipnangÎncă nu există evaluări
- Cours - Chimie ESTERIFICATION - Bac Sciences Exp (2011-2012) MR TLILI TOUHAMIDocument2 paginiCours - Chimie ESTERIFICATION - Bac Sciences Exp (2011-2012) MR TLILI TOUHAMIMohamed HamdeneÎncă nu există evaluări
- Cours Dosage Acido-BasiqueDocument10 paginiCours Dosage Acido-BasiqueOussama ElfaqyrÎncă nu există evaluări
- 2010 AmNord Exo1 Sujet Eau 6 5ptsDocument3 pagini2010 AmNord Exo1 Sujet Eau 6 5ptsHarakat ElhoucineÎncă nu există evaluări
- Bac Math Pysh Acide Base Serie 4Document1 paginăBac Math Pysh Acide Base Serie 4Nourhene Jlassi33% (3)
- TP Suivi EsterificationDocument2 paginiTP Suivi EsterificationMondher DhahriÎncă nu există evaluări
- AvancementDocument3 paginiAvancementbaatout oumaymaÎncă nu există evaluări
- Acide Base PDFDocument16 paginiAcide Base PDFchahin07Încă nu există evaluări
- 1059 TP Doser Par ConductimetrieDocument3 pagini1059 TP Doser Par ConductimetrieAli TrikiÎncă nu există evaluări
- Chimie TD Force Acide BaseDocument3 paginiChimie TD Force Acide BaseJunior Le PyromaneÎncă nu există evaluări
- Preparz Votre Baccalaureat Cinetique ChimiqueDocument4 paginiPreparz Votre Baccalaureat Cinetique ChimiquesdirianisÎncă nu există evaluări
- Ch06 SolutionsDocument46 paginiCh06 SolutionsMateus SantosÎncă nu există evaluări
- Chap 12 - Ex3 - Cosinus Et Problèmes - CORRIGEDocument4 paginiChap 12 - Ex3 - Cosinus Et Problèmes - CORRIGEDondersÎncă nu există evaluări
- Exercices Révision GénéraleDocument3 paginiExercices Révision Généraleklunx0% (1)
- C6Chim - Titrages - Exos - Ph&conduct&color PDFDocument9 paginiC6Chim - Titrages - Exos - Ph&conduct&color PDFAzizElheniÎncă nu există evaluări
- Chimie B Chap8 Titrage AcidobasiqueDocument6 paginiChimie B Chap8 Titrage AcidobasiqueSamantha Farah100% (1)
- Exercices N 5 Et 6Document7 paginiExercices N 5 Et 6ahlemmÎncă nu există evaluări
- Avancement D - Une RéactionDocument2 paginiAvancement D - Une RéactionchebbisÎncă nu există evaluări
- Exercice 1: Dosage de L'iode: I-Préparation de La Solution de Thiosulfate de SodiumDocument4 paginiExercice 1: Dosage de L'iode: I-Préparation de La Solution de Thiosulfate de Sodiumkhaoula elhansaliÎncă nu există evaluări
- Reactions PrecipitationDocument3 paginiReactions PrecipitationRitaj-Rayane KarimÎncă nu există evaluări
- Chute Libre Verticale D Un Solide Exercices Non Corriges 4Document5 paginiChute Libre Verticale D Un Solide Exercices Non Corriges 4S Bouhmid100% (1)
- 26 Dosage 3Document3 pagini26 Dosage 3Ilyes Ben Jemaa0% (1)
- Série D'exercices N°10 - Sciences Physiques Dosage Acido Basique - Bac Sciences Exp (2011-2012) MR ALIBI ANOUAR 3Document8 paginiSérie D'exercices N°10 - Sciences Physiques Dosage Acido Basique - Bac Sciences Exp (2011-2012) MR ALIBI ANOUAR 3Tawfiq Weld EL Arbi75% (4)
- C8-Sol Tampon PDFDocument7 paginiC8-Sol Tampon PDFsKiroxÎncă nu există evaluări
- Dosages Acide ConvertiDocument6 paginiDosages Acide ConvertiAbir SoujaaÎncă nu există evaluări
- DosageDocument3 paginiDosageNourhene AbidÎncă nu există evaluări
- Solution TD 4Document9 paginiSolution TD 4Rhm Gaming100% (1)
- Initiation A La Spectroscopie Corrige Partie I 2014Document112 paginiInitiation A La Spectroscopie Corrige Partie I 2014Siham Ait TalebÎncă nu există evaluări
- IntroductionDocument4 paginiIntroductionmely ssaÎncă nu există evaluări
- PlanDocument9 paginiPlanFati MaÎncă nu există evaluări
- Chapitre IIDocument28 paginiChapitre IIchaima sagiÎncă nu există evaluări
- Chimie Descriptive-El3d PDFDocument12 paginiChimie Descriptive-El3d PDFayoub dahbiÎncă nu există evaluări
- Fiche SpectrophotométrieDocument3 paginiFiche Spectrophotométriemohammed younes100% (1)
- Spectroscopie de MasseDocument17 paginiSpectroscopie de MasseIdriss MbadingaÎncă nu există evaluări
- Chap2 - EC1 - CHM131 - Liaisons Chimiques - 2022 - ONDocument85 paginiChap2 - EC1 - CHM131 - Liaisons Chimiques - 2022 - ONDylanÎncă nu există evaluări
- CHAPITRE V Liaisons Chimiques Partie III Dec 2021Document7 paginiCHAPITRE V Liaisons Chimiques Partie III Dec 2021Monxef BlrÎncă nu există evaluări
- QCM SPEC11 Session1Document2 paginiQCM SPEC11 Session1LordWazzÎncă nu există evaluări
- Physique ChimieDocument10 paginiPhysique ChimieHk EhÎncă nu există evaluări
- Cour RMN2 Eme NMRDocument24 paginiCour RMN2 Eme NMRwanir larbiÎncă nu există evaluări
- Cours Pour Étudiants Du Chap 1 Chimie Pharmaceutique 1 M1 2018 Nouveau ProgrammeDocument14 paginiCours Pour Étudiants Du Chap 1 Chimie Pharmaceutique 1 M1 2018 Nouveau ProgrammeSalah SparrowÎncă nu există evaluări
- Séries IRDocument6 paginiSéries IRJaafar ChirigÎncă nu există evaluări
- Resume Acide Base1 Final 1Document2 paginiResume Acide Base1 Final 1MazingaÎncă nu există evaluări
- RMNCours TDOct 2016Document2 paginiRMNCours TDOct 2016Cafe EstudiantinÎncă nu există evaluări
- BouhadjelaDocument3 paginiBouhadjelaMohamed BouhadjelaÎncă nu există evaluări
- Examen SR 2016Document4 paginiExamen SR 2016Yc Yacine100% (2)
- Chimie - Chimie CoordinationDocument7 paginiChimie - Chimie CoordinationYannick d'EsparbèsÎncă nu există evaluări
- TSP2SP1Ch13T10-p340 341 n12 13 16 CorrectionDocument1 paginăTSP2SP1Ch13T10-p340 341 n12 13 16 Correctionyaya sowÎncă nu există evaluări
- Cours SMDocument7 paginiCours SMBilal BekhtaouiÎncă nu există evaluări
- Forces Comparees Des Acides Et Des BasesDocument4 paginiForces Comparees Des Acides Et Des BasesstefanÎncă nu există evaluări
- Solution TD 3Document6 paginiSolution TD 3Rhm GamingÎncă nu există evaluări
- TD Orbitalaire L3 2019-1Document31 paginiTD Orbitalaire L3 2019-1dhoubzainabÎncă nu există evaluări
- Sem2comp 4Document2 paginiSem2comp 4tv tvÎncă nu există evaluări
- Organique 13-14Document3 paginiOrganique 13-14drisszekraoui14Încă nu există evaluări
- Calcul Des Énergies Électroniques de L'azote Et de Ses IonsDocument3 paginiCalcul Des Énergies Électroniques de L'azote Et de Ses IonsAlaaEddineBoukhrisÎncă nu există evaluări
- Dosgae Etalonnage Permanganate CorrigeDocument2 paginiDosgae Etalonnage Permanganate CorrigeFERONÎncă nu există evaluări
- 3 - XPS - M VayerDocument33 pagini3 - XPS - M VayerTrâm Con NítÎncă nu există evaluări