Documente Academic
Documente Profesional
Documente Cultură
Aminoacidos Azufrados
Încărcat de
Mariana Flores GuillénDescriere originală:
Titlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Aminoacidos Azufrados
Încărcat de
Mariana Flores GuillénDrepturi de autor:
Formate disponibile
Los aminocidos son las unidades ms simples que componen las protenas.
Algunos de ellos son esenciales, es decir, han de ser aportados diariamente a travs de los alimentos porque el organismo no es capaz de producirlos por s mismo, mientras que otros no son esenciales, puesto que el organismo s es capaz de sintetizarlos a partir de otros compuestos qumicos. En el grupo de los aminocidos esenciales se encuentra la metionina (un aminocido azufrado), mientras que la cistena es un aminocido no esencial, ya que se puede formar a partir del anterior. Los aminocidos azufrados se diferencian del resto en que contienen azufre en su composicin, de ah su nombre. Tanto es as que la mayor parte del azufre que se consume en la dieta se encuentra en los aminocidos azufrados. Los alimentos de origen animal como la carne, el pescado, los huevos y los productos lcteos son los alimentos ms abundantes en estos nutrientes.
Funciones del azufre
El azufre es un componente de los aminocidos azufrados. Es un mineral necesario para la formacin del colgeno y otros componentes proteicos que forman parte del tejido conectivo, como la queratina que forma parte de la piel, y otros mucopolisacridos que componen los huesos, los cartlagos, los tendones y los ligamentos. Por ello, un aporte adecuado de azufre a travs de aminocidos azufrados es esencial para el buen mantenimiento de la piel, el cabello, as como los ligamentos y los tendones. La formacin de estos compuestos es mayor en las pocas de crecimiento y desarrollo corporal (infancia, adolescencia, embarazo), y en situaciones de recuperacin de los tejidos despus de sufrir lesiones o heridas. Entonces el metabolismo del tejido conectivo se vuelve especialmente activo con el fin de reparar la lesin corporal.
Existen 20 aminocidos diferentes de que forman parte de las protenas. Todos ellos son -aminocidos y constan de un grupo amino, un grupo carboxilo, un hidrgeno y un grupo distintivo llamado R unidos a un mismo carbono denominado carbono-. El carbono- recibe este nombre por ser el carbono adyacente al carbono del grupo carboxilo, y el grupo diferenciador de los distintos aminocidos (R) se denomina cadena lateral.
Estructura general de un aminocido
La estructura general de un aminocido se establece por la presencia de un carbono central alfa unido a: un grupo carboxilo (rojo en la figura), un grupo amino (verde), un hidrgeno (en negro) y la cadena lateral (azul):
"R" representa la cadena lateral, especfica para cada aminocido. Tcnicamente hablando, se los denomina alfa-aminocidos, debido a que el grupo amino (NH2) se encuentra a un tomo de distancia del grupo carboxilo (COOH). Como dichos grupos funcionales poseen H en sus estructuras qumicas, son grupos susceptibles a los cambios de pH; por eso, al pH de la clula prcticamente ningn aminocido se encuentra de esa forma, sino que se encuentra ionizado.
Los aminocidos a pH bajo (cido) se encuentran mayoritariamente en su forma catinica (con carga positiva), y a pH alto (bsico) se encuentran en su forma aninica (con carga negativa). Sin embargo, existe un pH especfico para cada aminocido, donde la carga positiva y la carga negativa son de la misma magnitud y el conjunto de la molcula es elctricamente neutro. En este estado se dice que el aminocido se encuentra en su forma de ion dipolar o zwitterin.
Clasificacin
Existen muchas formas de clasificar los aminocidos; las dos formas que se presentan a continuacin son las ms comunes.
Segn las propiedades de su cadena
Otra forma de clasificar los aminocidos de acuerdo a su cadena lateral.
Los aminocidos se clasifican habitualmente segn las propiedades de su cadena lateral:
Neutros polares, polares o hidrfilos : Serina (Ser, S), Treonina (Thr, T), Glutamina (Gln, Q) y Tirosina (Tyr, Y). Neutros no polares, apolares o hidrfobos: Glicina (Gly, G), Alanina (Ala, A), Valina (Val, V), Leucina (Leu, L), Isoleucina (Ile, I), Cistena (Cys, C), Metionina (Met, M), Prolina (Pro, P), Fenilalanina (Phe, F) y Triptfano (Trp, W). Con carga negativa, o cidos: cido asprtico (Asp, D) y cido glutmico (Glu, E). Con carga positiva, o bsicos: Lisina (Lys, K), Arginina (Arg, R) e Histidina (His, H).
Aromticos: Fenilalanina (Phe, F), Tirosina (Tyr, Y) y Triptfano (Trp, W) (ya incluidos en los grupos neutros polares y neutros no polares).
[editar] Segn su obtencin
A los aminocidos que necesitan ser ingeridos por el cuerpo se los llama esenciales; la carencia de estos aminocidos en la dieta limita el desarrollo del organismo, ya que no es posible reponer las clulas de los tejidos que mueren o crear tejidos nuevos, en el caso del crecimiento. Para el ser humano, los aminocidos esenciales son:
Valina (Val) Leucina (Leu) Treonina (Thr) Lisina (Lys) Triptfano (Trp) Histidina (His) * Fenilalanina (Phe) Isoleucina (Ile) Arginina (Arg) * Metionina (Met)
A los aminocidos que pueden ser sintetizados o producidos mediante la sntesis de aminocidos por el cuerpo se los conoce como no esenciales y son:
Alanina (Ala) Prolina (Pro) Glicina (Gly) Serina (Ser) Cistena (Cys) ** Asparagina (Asn) Glutamina (Gln) Tirosina (Tyr) ** cido asprtico (Asp) cido glutmico (Glu)
Estas clasificaciones varan segn la especie. Se han aislado cepas de bacterias con requerimientos diferenciales de cada tipo de aminocido. Los datos actuales en cuanto a nmero de aminocidos y de enzimas ARNt sintetasas se contradicen hasta el momento, puesto que se ha comprobado que existen 22 aminocidos distintos que intervienen en la composicin de las cadenas polipeptdicas y que las enzimas ARNt sintetasas no son siempre exclusivas para cada aminocido. El aminocido nmero 21 es la Selenocistena que aparece en eucariotas y procariotas y el nmero 22 la Pirrolisina, que aparece slo en arqueas (o arqueobacterias).
1.1.6 Prueba de los grupos SH: Es una prueba para identificar aminocidos azufrados y las protenas que los contiene, se reconocen por la formacin de una coloracin negra o gris. La figura siguiente muestra dicha reaccin.
S-ar putea să vă placă și
- Aminoácidos EsencialesDocument5 paginiAminoácidos EsencialesMayerli MoraÎncă nu există evaluări
- AminoácidosDocument7 paginiAminoácidosISIDRO JONATHAN HERNANDEZ CARMONAÎncă nu există evaluări
- AMINOACIDOSDocument24 paginiAMINOACIDOSDaniela SmithÎncă nu există evaluări
- AminoácidoDocument9 paginiAminoácidoOliver Martínez BermúdezÎncă nu există evaluări
- AminoácidoDocument9 paginiAminoácidoDiego Alexander Ortiz AsprillaÎncă nu există evaluări
- Trabajo de Aminoacidos y ProteinasDocument27 paginiTrabajo de Aminoacidos y Proteinasmariamayorca0% (1)
- AminoácidoDocument10 paginiAminoácidoNestorÎncă nu există evaluări
- AminoácidosDocument13 paginiAminoácidosluz Erika santiagoÎncă nu există evaluări
- AminoácidoDocument92 paginiAminoácidoJavier TomalaÎncă nu există evaluări
- AminoácidoDocument11 paginiAminoácidoAlexander GuadronÎncă nu există evaluări
- AMINOACIDODocument12 paginiAMINOACIDOCarmina ChaltelÎncă nu există evaluări
- AminoacidoDocument6 paginiAminoacidoVictor Eduardo Pozo EstradaÎncă nu există evaluări
- Funciones de Los Aminoácidos en El OrganismoDocument7 paginiFunciones de Los Aminoácidos en El OrganismoCuriosidad sin limitesÎncă nu există evaluări
- Seminario PDFDocument14 paginiSeminario PDFJean Franco SitaÎncă nu există evaluări
- Es Una Molécula Orgánica Con Un Grupo AminoDocument2 paginiEs Una Molécula Orgánica Con Un Grupo AminoHUGO URIEL POSADA DE LA CRUZÎncă nu există evaluări
- Aminoacidos 2022Document12 paginiAminoacidos 2022Sâmuel LópezÎncă nu există evaluări
- Amino Acid oDocument8 paginiAmino Acid osantiago dazaÎncă nu există evaluări
- Amino Acid oDocument8 paginiAmino Acid osantiago dazaÎncă nu există evaluări
- Trabajo AminoacidosDocument38 paginiTrabajo AminoacidosYojackson Pastran100% (1)
- Estructura Básica de Un AminoácidoDocument6 paginiEstructura Básica de Un AminoácidoJesus DiazÎncă nu există evaluări
- Un AminoácidoDocument19 paginiUn AminoácidoSusanaÎncă nu există evaluări
- Aminoácidos y ProteínasDocument19 paginiAminoácidos y ProteínasAndrea Vallejoambriz305Încă nu există evaluări
- SEMINARIODocument14 paginiSEMINARIOJosé Carrera0% (1)
- AminoacidosDocument34 paginiAminoacidosNatalie BravoÎncă nu există evaluări
- Correcion de Estructura y Funcion de Los AminoácidosDocument7 paginiCorrecion de Estructura y Funcion de Los AminoácidosAlejandro Tepozteco MartinezÎncă nu există evaluări
- Produccion de Aminoacidos y BiopolimerosDocument15 paginiProduccion de Aminoacidos y BiopolimerosJhan Montero100% (1)
- Aplicación de Los Aminoácidos en La Química - DayaniDocument18 paginiAplicación de Los Aminoácidos en La Química - DayaniMiguel Angel Campos MarcavillacaÎncă nu există evaluări
- Informe Seminario de ProteínasDocument15 paginiInforme Seminario de ProteínasKatherine A. Mendoza De La CruzÎncă nu există evaluări
- Organica 2 Inf 6Document13 paginiOrganica 2 Inf 6ESMIT ROCA SACSARAÎncă nu există evaluări
- Estructura de AminoácidosDocument8 paginiEstructura de Aminoácidosalcaher72Încă nu există evaluări
- Aminoácidos: Tema IIIDocument9 paginiAminoácidos: Tema IIIValentinaÎncă nu există evaluări
- AMINOACIDOSDocument9 paginiAMINOACIDOSapi-19916045100% (1)
- Aminoácidos y Proteínas.Document14 paginiAminoácidos y Proteínas.Marcela BenitezÎncă nu există evaluări
- Estructura de ProteínasDocument17 paginiEstructura de ProteínasJESUS EMILIO BENAVIDES PATIÑOÎncă nu există evaluări
- Aa. y Peptidos Con Interes BiologicoDocument16 paginiAa. y Peptidos Con Interes BiologicoBeatrízLeónÎncă nu există evaluări
- AminiacidosDocument5 paginiAminiacidosalexa velasquezÎncă nu există evaluări
- Clasificación GenomaDocument4 paginiClasificación Genomajhojanxd123Încă nu există evaluări
- Exposicion AminoacidosDocument20 paginiExposicion Aminoacidosbrayan garcia100% (1)
- Ochaeta Aminoacidos y ProteinasDocument22 paginiOchaeta Aminoacidos y ProteinasJHONWAY RANFERI MALDONADO JUAREZÎncă nu există evaluări
- AminoácidoDocument17 paginiAminoácidoandresleonliveÎncă nu există evaluări
- Laboratorio de Aminoácidos 2Document14 paginiLaboratorio de Aminoácidos 2Sandy Paola Villera TobonÎncă nu există evaluări
- Bioquimica 3parte Det Tema 2Document18 paginiBioquimica 3parte Det Tema 2Mirielys MartinezÎncă nu există evaluări
- Aminoacidos y ProteinasDocument19 paginiAminoacidos y ProteinasInvierno PlÎncă nu există evaluări
- Estructura General de Un AminoácidoDocument3 paginiEstructura General de Un AminoácidoCRISTHIAN ANTONIO PRIETO COTOÎncă nu există evaluări
- Metabolismo de ProteinasDocument61 paginiMetabolismo de ProteinasprietalindaÎncă nu există evaluări
- Aminoácido - Wikipedia, La Enciclopedia LibreDocument14 paginiAminoácido - Wikipedia, La Enciclopedia LibreAnnoli Lugo100% (1)
- Amino Acidos Aspecto Historico y ClasificacionDocument4 paginiAmino Acidos Aspecto Historico y ClasificacionFerchuy KansaguiÎncă nu există evaluări
- Taller de AminoacidosDocument9 paginiTaller de AminoacidosminaflakinÎncă nu există evaluări
- AminoácidosDocument7 paginiAminoácidosYair SalinasÎncă nu există evaluări
- Charla de Bio 2Document3 paginiCharla de Bio 2kimberly castilloÎncă nu există evaluări
- AminoácidosDocument16 paginiAminoácidosEmilyÎncă nu există evaluări
- Guia de Estudio Aminoacidos - ProteinasDocument42 paginiGuia de Estudio Aminoacidos - ProteinasSebastian CastañedaÎncă nu există evaluări
- Tarea3 Los20AminoácidosProteicos CarmenPontanillaDocument3 paginiTarea3 Los20AminoácidosProteicos CarmenPontanillacarmen PontanillaÎncă nu există evaluări
- AminoácidosDocument11 paginiAminoácidosJoel Rafael Aponte AcostaÎncă nu există evaluări
- 5 - Proteinas y AminoacidosDocument76 pagini5 - Proteinas y AminoacidosCARLOS ENRIQUE GOMEZ SIBRIANÎncă nu există evaluări
- AminoacidosDocument5 paginiAminoacidosVanessa CanoÎncă nu există evaluări
- Cuestionario Aminoácidos y ProteínasDocument7 paginiCuestionario Aminoácidos y ProteínasGibranÎncă nu există evaluări
- Resumen AminoácidosDocument6 paginiResumen AminoácidosElvisRojas972010Încă nu există evaluări
- Cardona - PROTEÍNAS Y AMINOÁCIDOS EN ALIMENTOS. NECESIDADES Y VALOR NUTRITIVO.Document7 paginiCardona - PROTEÍNAS Y AMINOÁCIDOS EN ALIMENTOS. NECESIDADES Y VALOR NUTRITIVO.Ider GuerreroÎncă nu există evaluări
- LIPIDOSDocument12 paginiLIPIDOSMariana Flores GuillénÎncă nu există evaluări
- Bioquimica BasicaDocument13 paginiBioquimica BasicaviridianakÎncă nu există evaluări
- Metabolismo de LípidosDocument9 paginiMetabolismo de LípidosClaudia AlessandraÎncă nu există evaluări
- AdnDocument4 paginiAdnMariana Flores GuillénÎncă nu există evaluări
- Quimicos Peligrosos en El HogarDocument6 paginiQuimicos Peligrosos en El HogarWant90XÎncă nu există evaluări
- Historia MaquillajeDocument8 paginiHistoria MaquillajeMariana Flores GuillénÎncă nu există evaluări
- CcosmeticoDocument3 paginiCcosmeticosociedad de servicios farmaceuticos a la comunidadÎncă nu există evaluări
- Membranacelular M Lic. M. F. GoyanesDocument11 paginiMembranacelular M Lic. M. F. GoyanesDavo Perea RiverÎncă nu există evaluări
- El Ácido AcéticoDocument3 paginiEl Ácido AcéticoFrancisco FloresÎncă nu există evaluări
- Lab Manual rc1 - BookletDocument8 paginiLab Manual rc1 - Bookletcharles izquierdoÎncă nu există evaluări
- Informe 12 - Dureza Cálcica y Total - González, Elizabeth - Paralelo 101Document8 paginiInforme 12 - Dureza Cálcica y Total - González, Elizabeth - Paralelo 101Elizabeth González DíazÎncă nu există evaluări
- Determinación de Adulteraciones (Ya)Document12 paginiDeterminación de Adulteraciones (Ya)Michelle Roxanna Gonzalez GarciaÎncă nu există evaluări
- Cómo Hacer Jabón Con Aceite de Oliva UsadoDocument3 paginiCómo Hacer Jabón Con Aceite de Oliva UsadoMari Loli RtÎncă nu există evaluări
- Taller 1 GEOQUIMICADocument5 paginiTaller 1 GEOQUIMICAHans FandinoÎncă nu există evaluări
- Capacitores de MicaDocument5 paginiCapacitores de MicaAna YaninaÎncă nu există evaluări
- INFORMEDocument24 paginiINFORMEVialy SantanaÎncă nu există evaluări
- ElectrodeposicionDocument8 paginiElectrodeposicionJorge Luis Cayllahua CÎncă nu există evaluări
- TAREA 1 (Materiales de Ingeniería)Document2 paginiTAREA 1 (Materiales de Ingeniería)JAVIER IVAN HUAMAN TAMBINEÎncă nu există evaluări
- CAPITULO 3 Cracking Catalitico (Traduccion)Document4 paginiCAPITULO 3 Cracking Catalitico (Traduccion)Doan Daniel Lopez HidalgoÎncă nu există evaluări
- Euco Estabilizador 1000 - 2019Document2 paginiEuco Estabilizador 1000 - 2019Edwin EliasÎncă nu există evaluări
- Libro de Resumenes - 99RNFDocument348 paginiLibro de Resumenes - 99RNFGustavo TorchiaÎncă nu există evaluări
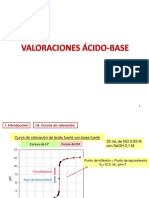
- Semana 7 Valoración Ácido-BaseDocument19 paginiSemana 7 Valoración Ácido-BaseYhonneer LizarasoÎncă nu există evaluări
- Fundaciones ProfundasDocument50 paginiFundaciones ProfundasMayraBP100% (5)
- (ACV-S04) Laboratorio #2 Simulador de Propiedades Coligativas - FISICOQUIMICA (31700)Document9 pagini(ACV-S04) Laboratorio #2 Simulador de Propiedades Coligativas - FISICOQUIMICA (31700)CHANCHITO PIÎncă nu există evaluări
- Dialnet EvaluacionDeParametrosDeCalidadDeChorizosElaborado 6031413 PDFDocument15 paginiDialnet EvaluacionDeParametrosDeCalidadDeChorizosElaborado 6031413 PDFLuis Alexander AlvarezÎncă nu există evaluări
- INFORME No. 1 BIOSEGUIRDAD Y CONOCIMENTO DE NORMAS PARA EL TRABAJO EN LABORATORIODocument5 paginiINFORME No. 1 BIOSEGUIRDAD Y CONOCIMENTO DE NORMAS PARA EL TRABAJO EN LABORATORIOcristoferÎncă nu există evaluări
- Catalogo de Productos Iluminación LED ProfesionalDocument37 paginiCatalogo de Productos Iluminación LED ProfesionalCristopher HernándezÎncă nu există evaluări
- CH2 CL 2Document7 paginiCH2 CL 2Ernesto KarlosÎncă nu există evaluări
- ¿Cuales Son Los Beneficios de La Sal Del Himalaya?Document3 pagini¿Cuales Son Los Beneficios de La Sal Del Himalaya?deadpancab4452Încă nu există evaluări
- Consideraciones para El Diseño de Pilas de Lixiviación de OroDocument22 paginiConsideraciones para El Diseño de Pilas de Lixiviación de OroKevin Y. Cornelio PradoÎncă nu există evaluări
- MATERIALES FinalDocument14 paginiMATERIALES FinalLuis Valencia EscarcenaÎncă nu există evaluări
- Taller BioinformáticaDocument10 paginiTaller BioinformáticaPaola Andrea Ramirez CastilloÎncă nu există evaluări
- Procedimiento de VacíoDocument3 paginiProcedimiento de VacíoEyro MoisesÎncă nu există evaluări
- Fuerza Hidrostatica en Superficies Planas Inclinadas y CurvasDocument25 paginiFuerza Hidrostatica en Superficies Planas Inclinadas y CurvasCristopher Garcia89% (65)
- Concreto Armado - PpsDocument120 paginiConcreto Armado - PpsCristobal Jimenez MuchoÎncă nu există evaluări
- TRIPTICO FinalDocument2 paginiTRIPTICO FinalpxdesÎncă nu există evaluări
- Agua Caliente y Agua Contra Incendios - FinalDocument17 paginiAgua Caliente y Agua Contra Incendios - FinalDelwin Darwin Q HÎncă nu există evaluări
- Monografia de Sistema Puesto A TierraDocument52 paginiMonografia de Sistema Puesto A TierraCaparachin Huaman Adrián Raul67% (6)
- Métodos Licuefacción de GasesDocument8 paginiMétodos Licuefacción de GasesJefferson Paúl AngosÎncă nu există evaluări