Documente Academic
Documente Profesional
Documente Cultură
UNIDAD III. Comportamiento de Fases en Sistemas de Hidrocarburos
Încărcat de
Yalian AlejosDescriere originală:
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
UNIDAD III. Comportamiento de Fases en Sistemas de Hidrocarburos
Încărcat de
Yalian AlejosDrepturi de autor:
Formate disponibile
REPBLICA BOLIVARIANA DE VENEZUELA MINISTERIO DEL PODER POPULAR PARA LA DEFENSA UNIVERSIDAD NACIONAL EXPERIMENTAL POLITCNICA DE LA FUERZA ARMADA
NACIONAL BOLIVARIANA INGENIERA DE GAS CTEDRA: GASOTECNIA
PROF. ING. ANNYS MRQUEZ
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
UNIDAD III: Comportamiento de Fases en Sistemas de Hidrocarburos.
3.1. COMPORTAMIENTO DE LOS HIDROCARBUROS 3.1.1. Definiciones bsicas 3.2. COMPORTAMIENTO CUALITATIVO DE FASES 3.2.1. Sistemas de un solo componente 3.2.2. Sistemas de dos componentes (binarios) 3.2.3. Sistemas multicomponentes 3.3. CLCULO DE FASES: VAPOR Y LQUIDO 3.3.1. Constantes de Equilibrio 3.3.2. Ley de Raoult 3.3.3. Ley de Dalton 3.3.4. Constantes de Equilibrio con base a la Presin de Convergencia 3.3.5. Determinacin de la presin de convergencia, Pk
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
UNIDAD III: Comportamiento de Fases en Sistemas de Hidrocarburos.
3.1. COMPORTAMIENTO DE LOS HIDROCARBUROS. El estudio de fases en sistemas de hidrocarburos se inici en los aos treinta, cuando se despert el inters por las mezclas de hidrocarburos y comenz el diseo de procesos a presiones de 500 lpcm o ms. En general, el petrleo y el gas son mezclas de hidrocarburos de una composicin qumica compleja, que se encuentran en un yacimiento a determinadas condiciones de presin y temperatura. Estas condiciones son variables. Puede hablarse de presiones entre 100 200 lpca hasta 8000 10000 lpca y ms an, y de temperaturas entre 80 100 F a 400 500 F. El estado de una mezcla de hidrocarburos a condiciones de superficie depende de la composicin de la misma en el depsito del subsuelo. A su vez, la composicin del fluido que permanece en el yacimiento, sufre cambios debido a los hidrocarburos producidos; adems, la reduccin de presin en el yacimiento, trae como consecuencia la variacin en las proporciones de gas y lquido existentes en el mismo. El conocimiento de las propiedades fsicas de tales mezclas de hidrocarburos, es indispensable para evaluar, en trminos de volmenes de lquido y gas, en condiciones normales, lo que produce una unidad de fluido del yacimiento. El objetivo del estudio de fases, es llegar a predecir, cuando se conoce la composicin y las cantidades de las fases en equilibrio del sistema, a cualquier presin y temperatura. El estudio del comportamiento de fases se divide en dos partes generales: cualitativo y cuantitativo. En el primer caso, se analizan los diferentes diagramas de presin-temperatura, P-T, presin-volumen, P-V, composicin, etc. En el segundo caso, se desarrollan frmulas y mtodos para calcular la composicin y cantidades de las fases de un sistema, a una presin y temperaturas dadas. En el estudio de fases, es necesario y conveniente tener presente una serie de definiciones de trminos y conceptos. Las siguientes son las principales: Sistema: cuerpo de materia con lmites finitos (definidos) que puede considerarse, si se desea, aislado del medio que lo rodea. Representa el material bajo consideracin para un proceso dado. Ejemplo: hidrocarburos en un yacimiento. Propiedades: caractersticas de un sistema que pueden evaluarse cuantitativamente como resultado de un experimento. Describe la condicin a un tiempo particular. Se miden en funcin de: fuerza (F), longitud (L), tiempo (t) y temperatura (T). Tipos de propiedades: a) Propiedades extensivas: dependen de la cantidad de materia, es decir, extensin del sistema. Ejemplos: volumen, masa. b) Propiedades intensivas: son independientes de la extensin o cantidad de materia del sistema. Ejemplos: temperatura, presin, densidad.
3
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
Sistema homogneo: es aquel cuyas propiedades intensivas varan continua y uniformemente de punto a punto en el sistema entre planos perpendiculares a la fuerza de gravedad. Ejemplos: un baln que contiene helio; un yacimiento por encima de su punto de saturacin (burbujeo). Sistema heterogneo: est compuesto por dos o ms sistemas homogneos y cuyas propiedades intensivas cambian bruscamente en las superficies de contacto. Ejemplo: un yacimiento por debajo de la presin de saturacin; petrleo ms agua. Fase: cuerpo de material homogneo diferente en sus propiedades a los dems que le rodean. Las zonas homogneas, discutidas en sistemas heterogneos, se refieren a fases. Existe slo una fase gaseosa, pero en lquidos y slidos se suelen llamar fases a los estratos diferenciados. Por ejemplo, en separadores se habla de tres fases para referirse al gas, petrleo y agua. Interfase: se refiere a la superficie de contacto entre dos fases. Fluido: se refiere a gas, lquido o mezcla de stos. Componente: ya que aqu no se considera reacciones qumicas, bajo estas circunstancias un componente se define como una sustancia que comprende un solo tipo de molculas. Ejemplos: dixido de carbono, agua destilada, propano. Petrleo crudo es una mezcla de componentes. Nota: en anlisis de mezcla de hidrocarburos, gases y lquidos, debido a la dificultad de analizar todos los componentes, se agrupa bajo el nombre de un solo componente del sistema cierta parte del mismo, por ejemplo C7+, heptanos y compuestos ms pesados, el cual para propsito de clculos, se trata como un solo componente. De ah que el trmino componente se defina en otras formas: Elemento constitutivo de un sistema, cuya concentracin puede sufrir variacin independiente en las diferentes fases. Elemento constitutivo que toma parte en el equilibrio de un sistema. Cualquiera del menor nmero de elementos constitutivos independientes por la cual puede expresarse la composicin de cada una de las fases de un sistema. Nmero de componentes: es el nmero total de elementos constitutivos qumicos diferentes en un sistema, menos el nmero de reacciones qumicas, distintas que pueden ocurrir entre estos elementos constitutivos del sistema. Numero de grados de libertad (variacin): tambin se denomina regla de fases de Gibbs. Es el nmero de variables (grado de libertad) requeridas para determinar el estado de un sistema de equilibrio. Se expresa generalmente por la ecuacin:
F C 2P
Donde:
C Nmero de componentes constitutivos del sistema,
4
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
P Nmero de fases, F Nmero de grados de libertad o nmero de variables requeridas para determinar el estado de un sistema en
equilibrio. Estado: condicin de un sistema a un tiempo particular. Se determina cuando todas las propiedades intensivas del sistema son fijas. El nmero mnimo de propiedades que deben describirse para fijar las propiedades depende del nmero de componentes y fases presentes en el sistema. Equilibrio: se considera que existe equilibrio en un sistema, cuando sus propiedades intensivas permanecen constantes con el tiempo, bajo las condiciones a las que existe el sistema. Presin de vapor: es la presin que ejerce la fase de vapor en el recipiente que lo contiene, cuando el lquido y vapor de un componente puro se encuentran en equilibrio a determinadas condiciones de presin y temperatura. El nmero de molculas que se escapan del lquido es igual al nmero de molculas que regresan a l. Punto de roco: estado de un sistema completamente gaseoso en equilibrio con una cantidad infinitesimal de lquido. Presin y temperatura de roco: es la condicin de presin y temperatura a la cual el sistema se encuentra a su punto de roco. Punto de burbujeo: estado de un sistema completamente liquido en equilibrio con una cantidad infinitesimal del gas. Gas o vapor saturado: vapor (gas en equilibrio con un lquido), a una temperatura y presin dadas. En el caso de sustancias puras, el estado de gas o vapor correspondientes al punto de roco. Lquido saturado: lquido en equilibrio con vapor (gas) a una presin y temperatura dadas. En el caso de sustancias puras, es el estado del lquido correspondiente al punto de burbujeo. Curva de punto de roco: lugar geomtrico de los puntos de presin y temperatura a las cuales se forma la primera gota de lquido, al pasar un sistema del estado de vapor al estado de dos fases. Comnmente se denomina curva de roco. Curva de puntos de burbujeo: lugar geomtrico de los puntos de presin y temperatura a las cuales se forma la primera burbuja, al pasar un sistema del estado de lquido al estado de dos fases. Comnmente se denomina curva de Burbujeo. Regin de dos fases: regin encerrada por las curvas de puntos de roco y de burbujeo, en un diagrama presin-temperatura del sistema, donde el gas y lquido coexisten en equilibrio. Constante de equilibrio (valores K) de un componente: es la razn de la fraccin molar del componente en fase vapor a la fraccin molar del mismo componente en la fase lquida, en un sistema de equilibrio, K= Yi/Xi.
5
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
Punto de ebullicin normal: temperatura que produce en un componente puro, una presin de vapor igual a una atmsfera. Condiciones crticas: condiciones a las cuales las propiedades intensivas de las fases lquido y vapor coexistentes, llegan a ser idnticas. Presin y temperatura crticas: presin y temperatura a las condiciones crticas. Lneas isovolumtricas: tambin se denominan lneas de calidad. Es el lugar geomtrico de los puntos de igual porcentaje de volumen lquido o vapor en la regin de dos fases de un diagrama presin temperatura de un sistema dado. Cricondembrico: presin mxima a la cual las fases lquido y vapor coexisten. Para componentes puros, el cricondembrico es igual a la presin crtica del componente. Cricondentrmico: temperatura mxima a la cual las fases lquidas y el vapor pueden coexistir. Para componentes puros, el cricondentrmico es igual a la temperatura crtica. Punto triple: condiciones a las cuales coexisten slido, lquido y vapor. Es un punto nico para un componente puro. Estado Crtico: es el trmino usado para identificar condiciones nicas de presin temperatura y composicin de un sistema, donde todas las propiedades del vapor y lquido coexistentes llegan a ser idnticas. Comportamiento retrgrado: formacin de una fase de mayor densidad (condensacin), al someter un sistema a una reduccin isotrmica de presin o a un incremento isobrico de temperatura. Tambin puede definirse en sentido inverso: formacin de una fase de menor densidad (vaporizacin), al someter un sistema a un aumento isotrmico de presin o a una reduccin isobrica de temperatura. Regin retrgrada: cualquier regin, en el diagrama presin-temperatura de un sistema donde se produce condensacin o vaporizacin en sentido inverso a lo que normalmente ocurre, es decir, donde existe comportamiento retrgrado. Condensacin retrgrada: formacin de lquido (condensacin) en un sistema, debido a la disminucin isotrmica de presin o aumento isobrico de temperatura. Vaporizacin retrgrada: formacin de vapor (vaporizacin) en un sistema, debido a la liberacin de gas en solucin y contraccin trmica del lquido. 3.2. COMPORTAMIENTO CUALITATIVO DE FASES. La mejor forma de estudiar el comportamiento cualitativo de sistemas de hidrocarburos es a travs de diagramas de fases. Por medio de estos diagramas, puede conocerse el estado del fluido a determinadas condiciones de presin y temperatura, es decir, si existe 1, 2 o 3 fases (gas, lquido, slido) en equilibrio a las condiciones impuestas.
6
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
Aunque sabemos que en los yacimientos no existen sistemas de un solo componente sino una mezcla de ellos, es conveniente comenzar por entender el comportamiento de los componentes puros. Esto ayuda a comprender las propiedades de sistemas de una sola fase y ms complejos (hidrocarburos), tal como ocurren en los yacimientos. 3.2.1 Sistemas de un solo componente.
Un sistema compuesto por un solo componente (una sustancia pura) puede presentarse como vapor, lquido o slido, dependiendo de las condiciones de presin y temperatura. La Figura 1, ilustra un diagrama tpico de presin-temperatura, P-T, para un sistema de hidrocarburos de un solo componente. A la izquierda de la lnea DHF, el sistema es slido y a la derecha de la lnea FHC, el sistema es todo gas o vapor. En la parte comprendida por DHC, el sistema es todo lquido. A las condiciones de presin y temperatura que caen exactamente sobre las lneas, ocurren sistemas de equilibrio. Por ejemplo, los puntos de lnea FH representan condiciones de sistemas slido-gas (vapor) en equilibrio; los puntos sobre la lnea DH representan condiciones de sistemas slido-lquido en equilibrio y finalmente, los puntos cobre la lnea HC representan condiciones del sistema lquido-gas (vapor) en equilibrio. A estas condiciones de equilibrio, existen dos fases en el sistema. El punto C es el punto crtico. Por encima de la presin y temperatura crticas slo existe una fase y en esta zona se habla de un "fluido". Tal como antes se mencion, las propiedades intensivas del vapor y lquido son idnticas en este punto.
Figura 1. Diagrama de Presin Temperatura para un solo componente.
El punto H es conocido como punto triple, el cual indica la presin y temperatura a la que las tres fases: slido, lquido y vapor, coexisten bajo condiciones de equilibrio. En Ingeniera de Petrleo raras veces se trabaja con hidrocarburos en estado slido. Por consiguiente, la parte correspondiente al estado slido del diagrama de la Figura 1, generalmente no aparece en la literatura petrolera. Solo vale la pena mencionar que la curva HF representa la presin de sublimacin con temperatura, o sea que un
7
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
componente en estado slido pasa directamente a vapor sin pasar por el estado lquido. La lnea HD representa la temperatura de fusin con presin. Como ilustracin de los cambios de fase con temperatura, considrese un hidrocarburo puro en estado slido en "m" y que aumenta la temperatura a presin constante P1. De "m" a "n", el sistema es totalmente slido. En el punto "n", se comienza a formar lquido. Por adicin de calor en este punto, la temperatura (temperatura de fusin) y presin permanecen constantes hasta cuando todo el hidrocarburo pasa a lquido en "o". La energa (calor) necesaria para pasar de n a "o" se denomina calor de fusin. Al agregar calor adicional, sube la temperatura del lquido, aumentando su volumen y disminuyendo su densidad hasta que llega a "b". En otras palabras, cambian las propiedades intensivas con la temperatura. En este punto "b, el sistema es un lquido saturado. Permaneciendo la presin y temperatura constantes, la adicin de calor trae como consecuencia la vaporizacin del lquido. La temperatura en "b" se denomina punto de ebullicin a presin P. En el punto "d", todo el sistema es vapor y se denomina vapor saturado. El aumento de temperatura por encima de este punto, (puntos "g" o "h"), slo trae como consecuencia el aumento en volumen, sin ningn cambio de fase. A temperaturas por encima de "d", se habla de vapor sobrecalentado. Otra forma de estudiar el comportamiento de un sistema de un solo componente es a travs de un diagrama de presin-volumen, P-V, tal como el que se presenta en la Figura 2 para el metano. En esta Figura, se presenta un grfico de presin en funcin del volumen especfico en pie3/lbs y se ilustra mejor la regin de dos fases, adems de las regiones de lquido y de gas (vapor). Considrese la lnea "abde" a temperatura constante de -150 F. La parte "ab" representa la fase lquida. La lnea es casi vertical ya que la compresibilidad del lquido es muy pequea y ocurre un cambio diminuto en volumen con presin, a temperatura constante. El punto "b" se conoce como el punto de burbujeo o de saturacin, o sea donde aparece la primera burbuja de gas al disminuir la presin del lquido. Tambin se define como un sistema completamente lquido en equilibrio con una cantidad infinitesimal de gas. El volumen especfico en este punto es 0,05 pie3/lbs. La lnea "bd" representa la regin de dos fases, donde el vapor y el lquido coexisten en equilibrio. Como se discuti anteriormente para un componente puro, el vapor y el lquido coexisten a una temperatura constante, solamente en el punto correspondiente a la presin de vapor. Por tanto, la lnea "bd" es horizontal y la presin correspondiente, es la presin de vapor a la temperatura indicada. El punto "d" es el punto de roco, o sea donde aparece la primera gota de lquido, al aumentar la presin de un sistema en estado de vapor. Tambin puede definirse como el punto donde el sistema est completamente gaseoso en equilibrio con una cantidad infinitesimal de lquido. El volumen especfico en este punto es 0,381 pie3/lbs. Finalmente, a travs de la lnea "de" el sistema es todo vapor (gas). El cambio en volumen especfico (recproco de densidad) de "b" a "d" representa el cambio en densidad, al pasar el sistema, de un lquido saturado a vapor saturado. Las lneas de igual temperatura (lneas continuas en la Figura 2) se denominan isotermas. La curva que limita la zona de dos fases (lquido vs vapor en equilibrio), se denomina lnea envolvente de fases. El
8
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
punto C es el punto crtico. La parte de la lnea envolvente, a la izquierda del punto crtico, es la curva de punto de burbujeo o simplemente curva de burbujeo. La parte de la lnea envolvente a la derecha del punto crtico, es la curva de puntos de roco o simplemente curva de roco. A travs de C pasa la isoterma correspondiente a la temperatura crtica. Al mismo tiempo, el punto C define la presin crtica y el volumen especfico crtico.
Figura 2. Diagrama Presin Volumen para el Metano.
3.2.2
Sistemas de dos componentes (binarios).
Cuando se agrega un segundo componente a un sistema, su comportamiento se hace ms complejo, debido a la introduccin de una nueva variable: la composicin. El efecto de esta nueva variable puede observarse comparando los diagramas para uno y dos componentes, tales como las Figuras 2 y 3, para el caso de diagramas PT. En un sistema binario o de ms componentes y para una composicin dada, las lneas de puntos de burbujeo y de roco ya no coinciden, sino que forman una lnea envolvente en el diagrama de fases. Adems, para cada composicin diferente del sistema se obtiene un diagrama de fases diferentes. La Figura 4 ilustra el diagrama P-T para el sistema etano-heptano normal. En la Figura 4, la lnea a la izquierda del diagrama y que termina en el punto crtico C, es la curva de presin de vapor para el etano puro (componente ms liviano). La lnea a la derecha del diagrama y que termina en el punto crtico C7, es la curva de presin de vapor del heptano normal puro (componente ms pesado). Entre estas dos curvas se encuentran los diagramas de fases para las diferentes mezclas binarias de etano-heptano normal. Las curvas A1C1B1, A2C2B2 y A3C3B3 corresponden a sistemas con porcentajes por peso de etano de 90,22; 50,25 y 9,78
9
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
respectivamente. Los puntos C1, C2 y C3, son los puntos crticos de estos sistemas. Las lneas A 1C1, A2C2 y A3C3, son las curvas de puntos de burbujeo y las lneas C1B1, C2B2 y C3B3 son las curvas de punto de roco. Por encima y a la izquierda de las curvas de burbujeo, existe solo lquido y por debajo y a la derecha de las curvas de roco, existe solo vapor (gas), para el sistema respectivo.
Figura 4. Diagrama de Presin Temperatura para el Sistema Etano Heptano C 2 C7
El valor de la temperatura crtica de cualquier mezcla, est entre las temperaturas crticas de los componentes ms liviano y ms pesado; por otro lado la presin crtica de la mezcla ser mayor que la presin crtica de cualquiera de los componentes de la misma. Una mezcla con proporciones ms o menos iguales de los dos componentes, tal como la curva A 2C2B2 de la Figura 4, cumple con varias propiedades importantes: 1. El punto crtico tiene la mxima presin respecto a las presiones crticas de las dems mezclas posibles; adems, la temperatura crtica tiene un valor no muy lejos del promedio de las temperaturas crticas de los componentes puros; 2. Presenta el diagrama de fases ms amplio (mxima rea donde ocurre dos fases) y a medida que los componentes puros tengan una diferencia mayor en puntos de ebullicin, ms amplio ser el diagrama respectivo. Por otro lado, para mayor diferencia en puntos de ebullicin de los componentes puros, se obtendr mayor valor de presin crtica mxima.
10
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
3.
A medida que un componente predomina en la mezcla, la presin y temperatura crticas de la misma tienden a acercarse a los valores de presin y temperatura crticas del componente predominante en la mezcla. Adems, el rea de dos fases del diagrama, disminuye a medida que decrece el contenido de uno de los componentes. Los diagramas P-V para el caso de sistemas binarios y de ms componentes, difieren someramente de los
mismos diagramas para un solo componente. La Figura 5 ilustra el diagrama P-V para el sistema pentano normal heptano normal (52,4 % por peso de heptano normal). Considrese una isoterma cualquiera, por ejemplo a 425 F. La parte correspondiente a la zona de vapor y de lquido son similares a las de un solo componente. Sin embargo, la parte correspondiente a la zona de dos fases difiere de la de un solo componente en el sentido que la presin vara con volumen, aumentando su valor a medida que el sistema pasa del punto de roco al punto de burbujeo. Esto es debido a que la composicin del lquido y del vapor vara continuamente al pasar el sistema a travs de la regin de dos fases. En el punto de roco, la composicin del vapor es prcticamente la composicin del sistema, solo que existe una cantidad infinitesimal de lquido, rico en el componente menos voltil. A medida que se condensa ms lquido, su composicin cambia aumentando el componente ms voltil (y por consiguiente aumentando la presin de vapor) hasta que la composicin del lquido es igual a la del sistema en el punto de burbujeo. El punto crtico no ocurre en el pice o pico de la regin de dos fases, debido a que la isoterma a travs de tal regin no es horizontal. Como consecuencia de esto, puede existir vapor a presiones por encima de la presin critica. En forma similar, puede existir lquido a temperaturas mayores que la temperatura crtica.
Figura 5. Diagrama de Presin Volumen para el sistema pentano normal y heptano (nC5 nC7). Contiene 52,4% de heptano.
3.2.3
Sistemas multicomponentes.
Los sistemas de hidrocarburos que se presentan naturalmente en yacimientos de petrleo y gas, estn compuestos de una gran variedad de componentes, que incluyen no slo hidrocarburos de la serie parafnica, sino
11
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
muchos otros componentes de otras series. El comportamiento de estos sistemas en la regin de vapor-lquido, es muy similar a los sistemas binarios. El comportamiento de fases de sistemas multicomponentes de hidrocarburos, depende de la composicin y de las propiedades de los componentes individuales. Las caractersticas de los diagramas P-V y P-T, son similares a los de los sistemas de dos componentes. Para sistemas multicomponentes de hidrocarburos voltiles, las isotermas de un diagrama P-V son similares a los de la Figura 5 para un sistema binario. Sin embargo, es muy comn encontrar que el lugar correspondiente al punto de roco se observe muy poco o no se observe en absoluto. Por lo tanto, es muy difcil fijar el punto de roco por medio de estos diagramas. La mejor forma de observar los cambios de fases de las mezclas de hidrocarburos que se presentan en los yacimientos de petrleo y gas (o condensado) es a travs de un diagrama de fases Presin- Temperatura. La Figura 6 ilustra el diagrama P-T, para una mezcla hipottica de hidrocarburos. Tal como en un sistema binario, la regin de dos fases est cerrada por una curva envolvente, LPmCTmV, formada por la curva de puntos de burbujeo, LPmC y en la curva de puntos de roco, VTmC, unidas en el punto crtico, C. Considrese lneas a igual presin (isobricas) o a igual temperatura (isotmicas) que cruzan el diagrama: a. Caso I. La lnea isobrica entre los puntos 1 y 2, cruza la curva de puntos de burbujeo en A y la curva de puntos de roco en B. Esta lnea ilustra vaporizacin o condensacin a presin constante. Entre 1 y A la mezcla no cambia de estado, slo la densidad disminuye al aumentar la temperatura. En A comienza la vaporizacin (punto de burbujeo) y al aumentar la temperatura, el lquido disminuye y el vapor aumenta hasta llegar a B donde todo el sistema es vapor. Entre B y 2, el vapor se sobrecalienta. Si se considera el sistema en sentido inverso, entre el punto 2 y B, el vapor no cambia de estado y permanece homogneo, excepto que la densidad aumenta al disminuir la temperatura. En B comienza la condensacin (punto de roco). A medida que disminuye la temperatura, aumenta la condensacin hasta llegar a A donde el sistema es todo lquido. b. Caso II. Entre los puntos 3 y 4, indica una lnea isotrmica. Es un ejemplo de vaporizacin o condensacin a temperatura constante. Entre 3 y D, el sistema es vapor homogneo y slo aumenta la densidad con aumento de la presin. Por aumento posterior en la presin, entre D y E, ocurre condensacin del sistema. Entre E y 4, el sistema es lquido homogneo y slo aumenta la densidad con la presin. Otra caracterstica de los diagramas P-T de mezclas, consiste en que la curva envolvente de la regin de dos fases, presenta valores mximos de presin y temperatura, no coincidentes con el punto crtico. En la Figura 6, la presin mxima ocurre en Pm, y la temperatura mxima ocurre en Tm, y reciben el nombre respectivamente de cricondembrico y cricondentrmico, abreviacin de "critical condensation pressure" (presin de condensacin crtica) y "critical condensation temperature" (temperatura de condensacin crtica).
12
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
Figura 6. Diagrama de Presin-Temperatura para un Sistema Policomponente de Hidrocarburos donde se ilustran las caractersticas principales.
c. Caso III. La existencia del cricondembrico permite seguir una lnea isobrica a presin mayor que la crtica (lnea entre los puntos 5 y 6), que cruza dos veces la curva de puntos de burbujeo, sin cruzar la curva de puntos de roco. d. Caso IV. Por otro lado, la existencia del cricondentrmico, permite seguir una lnea isotrmica a temperatura mayor que la crtica (lnea entre los puntos 7 y 8), que cruza dos veces la curva de puntos de roco sin cruzar la curva de puntos de burbujeo. Lo anterior, trae como consecuencia el que ocurra vaporizacin y condensacin diferente a los Casos I y II explicados anteriormente, para presin y temperatura menores que la crtica. En el caso III, por ejemplo, la lnea isobrica 5-6, est a una presin intermedia entre Pc (C) y Pm, y cruza la curva de puntos de burbujeo en F y G. Por lo tanto, bien sea que la temperatura aumente o disminuya, en el punto
13
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
inicial de interseccin con la curva de puntos de burbujeo (F o G) el sistema es un lquido homogneo y coincide con el comienzo de la vaporizacin, no Importa el camino seguido. Tan pronto como la temperatura aumente o disminuya y corte el segundo punto en la curva de burbujeo (G o F) sin cruzar la curva de roco, el sistema estar de nuevo en la misma fase lquida que cuando cort inicialmente la curva de burbujeo. Es evidente entonces, que la vaporizacin increment de cero, pas por un mximo y disminuy de nuevo a cero al cruzar por segunda vez la curva de burbujeo. Por tanto, entre F y G estar un punto de vaporizacin mxima y G indica, bien sea condensacin (con aumento de temperatura) o vaporizacin (con disminucin de temperatura) de acuerdo a la direccin seguida. Este comportamiento anmalo he denominado por Sage y Lacey como "Vaporizacin Retrgrada Isobrica". En el Caso IV, la lnea isotrmica 7-8 est a una temperatura intermedia entre Tc (C) y Tm, y cruza la curva de roco en los puntos H y J sin cruzar la curva de burbujeo, dando lugar a un comportamiento de condensacin y vaporizacin anmalas, similares al Caso III. Ya que este caso est relacionado con la curva de roco, Sage y Lacey denominan este comportamiento como "Condensacin Retrgrada Isotrmica". Las reas marcadas con lneas oblicuas se denominan "Regin Retrgrada", o sea el rea donde ocurre vaporizacin o condensacin en forma inversa al comportamiento convencional; es decir, vaporizacin retrgrada, por la cual se forma vapor al disminuir isobricamente la temperatura (lnea 6-G-K) o aumentar isotrmicamente la presin (lnea L-J-8) y condensacin retrgrada, por la cual se forma lquido al disminuir isotrmicamente la presin (lnea 8-J-L) o aumentar isobricamente la temperatura (lnea K-G-6). Los sistemas de hidrocarburos multicomponentes encontrados en los yacimientos se clasifican muy ampliamente como petrleo y gases. Para cada uno de estos sistemas, existe una clasificacin determinada. Para sistemas gaseosos, o sea aquellos que en el yacimiento se encuentran como gas, se clasifican en condensados o retrgrados, gases hmedos y gases secos. Para sistemas de petrleos, o sea aquellos que en el yacimiento se encuentran como lquidos, se clasifican, de acuerdo al lquido recuperado en superficie, como petrleos de baja o alta merma. Los diagramas P-T para estos sistemas, varan en la forma y la posicin del punto crtico, dependiendo del contenido de voltiles en el sistema. Para sistemas con un alto contenido de voltiles, la temperatura crtica del sistema se acerca ms a la temperatura crtica del componente ms liviano. En la Figura 7, presenta un diagrama P-T donde se indican diferentes zonas de acuerdo al tipo de yacimiento. Zona I. Si la temperatura del yacimiento est por encima del cricondentrmico, se habla de yacimientos de gas, tal como el punto A del diagrama. Puede ocurrir que sean yacimientos de gas seco o de gas hmedo. En ambos casos, el gas en el yacimiento siempre estar en estado gaseoso y su composicin permanece constante. El gas seco se compone principalmente de metano y etano con pequeos porcentajes de componentes ms pesados. El Gas Seco tanto en condiciones de yacimiento como de produccin (separacin en superficie) se encuentra en la zona de una sola fase en un diagrama P-T. No se condensan hidrocarburos lquidos, ni en el yacimiento ni en
14
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
superficie, aunque pueda contener vapor de agua que puede condensarse en la superficie. "Seco" en este caso, significa libre de hidrocarburos lquidos, no necesariamente libre de agua.
Figura 7. Diagrama de Presin-Temperatura para un Sistema de Hidrocarburos Multicomponentes.
Para el caso de Yacimientos De Gas Hmedo, las condiciones de produccin (separacin en superficie), se encuentran en la regin de dos fases (punto A, de la figura 7) y se obtiene una fase lquida del separador denominada Destilado o Condensado. Para un gas hmedo puede tambin ocurrir que las condiciones de separacin de gas hmedo se encuentren en la zona de una sola fase y la produccin sea totalmente gas. No obstante, el gas producido contiene fracciones lquidas que pueden removerse por separacin a baja temperatura o con el uso de plantas de gasolina natural, dejando un gas seco. Zona II. Si las condiciones iniciales del yacimiento son tales que la temperatura est entre el cricondentrmico y la temperatura crtica y la presin sea tal que exista una sola fase en el yacimiento, se habla entonces de Yacimientos De Condensado, de destilado, yacimientos de punto de roco o ms comnmente Yacimientos De Condensacin Retrgrada. Ejemplo: Punto B en el diagrama de la figura 7. A medida que la presin disminuye debido a la produccin, la composicin del fluido producido ser la misma que la del fluido del yacimiento B y permanecer constante hasta alcanzar la presin del punto de roco B1. Por debajo de esta presin, se condensa fluido en el yacimiento, y este lquido condensado se adhiere al material slido o paredes de los poros de la roca, permaneciendo inmvil pues generalmente no se llega a alcanzar la saturacin crtica. Por consiguiente, el gas
15
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
producido en la superficie tendr un contenido lquido menor, aumentando la razn gas-petrleo de produccin. Esta condensacin retrgrada contina hasta alcanzar, para el sistema de la figura 7, un porcentaje mximo de liquido de 10 % a 2250 Ipca, punto B2. Una vez que se alcance el punto de roco, debido a que la composicin del fluido producido vara, la composicin del fluido remanente en el yacimiento tambin cambia y la curva envolvente comienza a desplazarse. Desafortunadamente la regin de dos fases se desplaza hacia abajo y a la derecha y sto aumenta la condensacin del lquido retrgrado. Por disminucin posterior de la presin, de B2 a B3 (condiciones de produccin), se presenta una vaporizacin del lquido formado por condensacin retrgrada. Esta revaporizacin ayuda a la recuperacin lquida y se hace evidente por la disminucin en las razones gas-petrleo en la superficie. La condensacin neta de lquido retrgrado es mayor para: (a) menores temperaturas del yacimiento, (b) mayores presiones de abandono, y (c) mayor desviacin del diagrama de fases hacia la derecha. Esto ltimo es una propiedad del sistema de hidrocarburos. Si las condiciones iniciales coinciden con la curva de roco, punto B1, se habla de un yacimiento de punto de roco. Zona III. Si la acumulacin ocurre a una temperatura menor que la crtica y presin por encima de la curva de burbujeo, punto D por ejemplo, el fluido en el yacimiento se encuentra en estado lquido. Los yacimientos en esta regin se denominan Yacimientos No-Saturados o Subsaturados, ya que a esas condiciones de presin y temperatura, existe deficiencia de gas en el sistema. Tambin se habla de yacimientos de empuje por gas en solucin. Debido a la baja compresibilidad de lquidos del yacimiento, alrededor de 15x10-6 lpc-1, la presin disminuye rpidamente con la produccin, alcanzando el punto D1 o punto de burbujeo. Para presiones por debajo del punto de burbujeo, la liberacin de gas del petrleo aumenta formando una fase de gas libre. Eventualmente el gas libre comienza a fluir hacia el pozo, aumentando continuamente. Inversamente, el petrleo fluye cada vez en menores cantidades, aumentando la razn gas-petrleo de produccin (instantnea). A la presin de abandono (aunque casi todo el gas de solucin se ha recuperado), la recuperacin de petrleo en superficie es relativamente muy baja, dependiendo de las propiedades de la roca y fluidos del yacimiento. Cuando existe un acufero, la presin puede mantenerse en el yacimiento por encima de D1 y el petrleo fluye al pozo como una sola fase de composicin constante, y la recuperacin de petrleo en superficie es mucho mayor. En forma similar al caso del yacimiento de la Zona II, por debajo de D, o sea en la regin de dos fases, la composicin del fluido en el yacimiento cambia continuamente y la lnea envolvente se desplaza. De nuevo, un desplazamiento hacia abajo y a la derecha, hace que se recupere menos lquido (petrleo) a la presin de abandono. El desplazamiento de la envolvente, depende del tipo de petrleo. Para el caso de petrleos de baja merma o volatilidad (pesados), las lneas de calidad (igual porcentaje de lquido) estn relativamente poco espaciadas una de la otra y cerca a la curva de roco. Por cada volumen de lquido en el yacimiento se obtiene un
16
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
alto porcentaje en superficie. En cambio para el caso de petrleos voltiles (livianos), las lneas de calidad estn ms espaciadas y la recuperacin en superficie, por cada volumen en el yacimiento es relativamente baja. Si las condiciones iniciales de presin y temperatura se encuentran sobre la curva de burbujeo, punto D1, se habla de Yacimientos Saturados. En este caso, desde el inicio de la produccin, comienza a formarse una fase de gas libre. De all en adelante, su comportamiento es similar al de un yacimiento no saturado una vez que alcanza el punto de burbujeo. Si las condiciones iniciales de presin y temperatura del yacimiento se encuentran dentro de la envolvente, punto E, se habla de yacimientos de dos fases o Yacimientos Con Capa De Gas. Originalmente existe lquido (petrleo) en equilibrio con una capa de gas en la parte superior de la estructura. El gas se encontrar en el punto de roco y el petrleo en el punto de burbujeo. Ya que las composiciones de las fases de petrleo y de gas son completamente diferentes entre s, tendrn diferentes diagramas de fases y sern distintos del diagrama de fases de la mezcla. Ya que el lquido (petrleo) permanece a condiciones del punto de burbujeo, el yacimiento ser producido como un lquido saturado (o de punto de burbujeo), modificado por la presencia de una capa de gas. Esta puede presentar o no comportamiento retrgrado. Adems puede ser un gas seco o un gas hmedo. 3.3. CLCULO DE FASES: VAPOR Y LQUIDO. El clculo de las fases tiene mltiples aplicaciones en la industria petrolera. Por ejemplo, en el diseo de separadores (gas-petrleo), donde se requiere que haya una eficiente separacin de tal forma que se obtengan las cantidades de petrleo y gas estimadas en l. El clculo de la composicin de las fases se utiliza tambin para el anlisis del balance de materiales para yacimientos y en diseos de plantas de gasolina natural. Para evaluar el funcionamiento de un sistema de separacin en etapas, es necesario efectuar clculos de equilibrio vapor-lquido y de balance de materiales en cada etapa de separacin. Esto permite conocer las cantidades de gas y de lquido separadas en cada etapa, as como los parmetros necesarios para seleccionar las presiones de separacin ptimas para los fines que se pretendan. El rea limitada por la lnea envolvente de los puntos de roco y burbujeo, en un diagrama de fases presintemperatura define las condiciones, para que la fase gaseosa y la fase lquida se presenten en equilibrio. Es lgico que las cantidades y composiciones de la mezcla sean diferentes en distintos puntos dentro de la regin de dos fases, todo esto permite realizar una caracterizacin exhaustiva de la mezcla de fluido petrolero, con lo que provoca una mayor eficiencia del proceso realizado. Constantes de equilibrio. La distribucin de un componente en un sistema vapor-lquido es expresado por las Constantes de Equilibrio (Keq). Esta constante se define como la razn de la fraccin molar del componente en la fase gaseosa (Y i), y a la
17
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
fraccin molar del componente en la fase lquida (Xi). Este concepto es de gran utilidad para describir el comportamiento de los hidrocarburos, que conforman un sistema bifsico (petrleo Gas o vapor). El primer intento desarrollado para determinar la composicin de las fases gaseosa y lquida en sistemas multicomponentes en la regin de dos fases, fue considerando que el sistema (fase lquida + vapor), segua un comportamiento de soluciones ideales. En este tipo de soluciones, no se producen fuerzas de atraccin de ninguna especie entre los constituyentes moleculares y por lo tanto, pueden aplicarse las leyes de Raoult y de Dalton. Ley de Raoult. En una solucin ideal, la presin parcial, Pi, de un componente, i, en la fase de vapor (gaseosas) es igual al producto de la fraccin molar del componente en la fase lquida, xi, y la presin de vapor, (Po)i, del componente "i" puro, es decir,
Pi xi P o
Ec. 1
En este caso de soluciones ideales, la suma de las presiones parciales de los componentes, ser la presin total y tambin la presin de vapor del sistema,
Pt
Ley de Dalton.
x P
n o i i 1
Ec. 2
En una mezcla de gases perfectos cada gas ejerce una presin parcial igual a la que ejercera si estuvieran solo en el volumen ocupado por la mezcla. Segn la ley de Dalton, la presin Pi ser:
Pi ni
Y la presin total de la mezcla ser,
R *T V
Ec. 3
Pt
P n
i i 1 i 1
R *T V
Ec. 4
Dividiendo las dos ecuaciones anteriores nos queda:
Pi yi * Pt
Igualando las ecuaciones (1) y (5), puede escribirse;
Ec. 5
yi * Pt xi Po
Po yi xi Pt
Ec. 6 Ec. 7
Ki
Donde Ki se define como la razn o constante de equilibrio del componente i a una presin Pt y a una temperatura T del sistema.
18
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
La definicin de Ki Po
Pt se cumple slo a muy bajas presiones, pues es evidente que cualquier
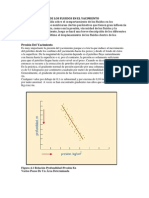
componente puro posee presin de vapor solo hasta la temperatura crtica. Por ejemplo, la temperatura crtica del metano es -116,67 F y estrictamente slo hasta esta temperatura podra trabajarse para sistemas que contengan este componente. A bajas presiones, hasta un valor alrededor de 600-800 lpca y temperaturas no cercanas a la crtica de la mezcla las constantes de equilibrio pueden considerarse independientes de la composicin del sistema y se denominan constantes de equilibrio ideales. A medida que la presin y la temperatura aumentan la composicin del sistema influye en las constantes de equilibrio, ya que las fuerzas entre las molculas afectan el equilibrio vapor-lquido. Por lo tanto, para un sistema de hidrocarburos dado, la mejor forma de obtener las constantes de equilibrio a diferentes presiones y temperaturas sera experimentalmente, es decir, obteniendo "xi" y "yi" para cada componente a diferentes presiones y temperaturas. Lgicamente, esto es imprctico, largo, tedioso y supremamente costoso ya que habra que analizar mltiples muestras, llevarlas a determinadas condiciones de presin y temperatura, obtener equilibrio entre el lquido y el vapor, luego tomar muestras de cada una de las fases y analizarlas separadamente para los diferentes componentes. Finalmente, determinar "xi" y "yi" para los componentes del lquido y vapor y por ltimo calcular las constantes Ki yi xi . Este tipo de anlisis ha sido hecho para varios compuestos y puede encontrarse en la literatura. En general, un grfico log K como funcin de log P, para hidrocarburos a temperaturas relativamente bajas, 0100 F, tiene las siguientes caractersticas: 1) A bajas presiones, la pendiente de las curvas es igual a menos uno (-1) o un valor muy cercano. Este comportamiento es lgico, si se recuerda que a bajas presiones, donde no influye la composicin del sistema, se aplican las leyes de Raoult y Dalton, y por lo tanto, K Po
Pt de donde log K log P log Po i .
2) A medida que la presin aumenta, los valores de K disminuyen, y con excepcin del metano, todos pasan por un mnimo. Sin embargo, a medida que baja la temperatura, por debajo aproximadamente de -100 F, las constantes de equilibrio de metano disminuyen y pasan por un mnimo en forma similar a los dems compuestos. Por otra parte, para temperaturas ms o menos altas, dependiendo del componente, los valores de K no pasan por un mnimo, y disminuyen directamente a un valor unitario a una presin comn o presin de convergencia. 3) Los valores de K tienen a un valor unitario a determinada presin. Este valor se denomina Presin de Convergencia.
19
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
4) A la presin de vapor los valores de K tambin son iguales a la unidad. Este comportamiento es explicable, ya que K Po
Pt para sistemas ideales.
5) Para sistemas de diferente composicin, los valores de K son diferentes a altas presiones. Ntese por ejemplo, la diferencia en la constante de equilibrio para el butano a 2.000 lpca en la Figura 8. En otras palabras, puede decirse que, a bajas presiones, los valores de K para un componente dado, son iguales, pero a medida que aumenta la presin, los valores de K tienen valores diferentes. Por lo tanto, puede decirse que los dos sistemas tendrn diferentes presiones de convergencia para concluir que la presin de convergencia es un parmetro que depende de la composicin del sistema. Constantes de Equilibrio con base a la Presin de Convergencia. Al discutir la forma tpica de las curvas de constantes de equilibrio en papel doblemente logartmico, Figura 8, se concluy que la presin de convergencia es un parmetro relacionado con la composicin del sistema. Aunque existen evidencias en el sentido de que no es suficiente slo la presin de convergencia para representar adecuadamente la composicin de un sistema, la GPSA ha mantenido esta correlacin por varias razones: (1) es una forma fcil y rpida para uso de los ingenieros, (2) dentro de sus lmites, son suficientemente exactas para muchos de los clculos en la prctica y (3) la forma grfica de las constantes, ha adquirido mucha popularidad en la industria y se prefieren a otros mtodos de nomogramas. La Presin de Convergencia, Pk, puede definirse como la presin a la cual todos los valores de K aparentemente convergen a la unidad (1,0) a la temperatura del sistema. En otras palabras, es la presin para un sistema a una temperatura dada, cuando ya no es posible la separacin del vapor y lquido. Los valores de Ki realmente son continuos y convergen en el valor unitario (1,0), slo cuando la temperatura del sistema es la temperatura critica, ya que en el punto crtico, el lquido y el vapor son idnticos y todos los valores de Ki = 1,0. Cuando la temperatura del sistema es la temperatura crtica, la presin de convergencia es igual a la presin crtica. Sin embargo, a temperatura diferente a la crtica, la porcin de alta presin de la curva log K como funcin de log P, por encima de la presin del punto de burbujeo o punto de roco no tiene significado fsico ya que el sistema existe como una sola fase y los valores de Ki no tienen sentido. Para sistemas binarios, a una temperatura entre las temperaturas crticas de los componentes puros, la presin de convergencia es slo funcin de temperatura .
20
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
Figura 8. Constantes de equilibrio para diferentes sistemas. 21
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
Para sistemas multicomponentes, la presin de convergencia depende tanto de la temperatura como de la composicin del sistema. La Figura 9 presenta constantes de equilibrio para diferentes presiones de convergencia (diferentes composiciones) a 260 F. La curva de presin de convergencia como funcin de temperatura est representada por el lugar geomtrico de los puntos crticos de las diferentes composiciones (mezclas) del sistema, Figura 10.
Figura 9. Constantes de equilibrio para varias presiones de convergencia (Varios sistemas) a 260 F.
Determinacin de la presin de convergencia, Pk. Los mtodos ms exactos para la determinacin de la presin de convergencia requieren un proceso de ensayo y error (tanteo), donde Pk se supone y luego se calcula. Cuando el valor supuesto y el calculado coinciden dentro de una aproximacin normal, el ltimo valor calculado se toma como la presin convergencia del sistema. Para la determinacin de la presin de convergencia, cuando la presin de operacin del sistema es relativamente baja (menor que la presin a la cual las curvas de K cambian de pendiente en los grficos comunes de log K como funcin de log P), se usa uno de los siguientes mtodos:
22
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
Figura 10. Presin de convergencia (o lugar geomtrico de los puntos crticos) para sistemas binarios. 23
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
1. Mtodo de Standing. Con el fin de facilitar la obtencin de un primer valor de Pk, el profesor Standing present un mtodo sencillo en el cual slo es necesario conocer la composicin del sistema y en particular el peso molecular de la fraccin heptanos y compuestos ms pesados, C 7+. De la siguiente tabulacin puede obtenerse el valor de Pk aproximado: Peso molecular del C7+: 120 170 220 Presin de convergencia, Pk, lpca 3000 6000 9000 Para valores intermedios de peso molecular, puede interpolarse linealmente. Martnez y Lorenzo, utilizaron simuladores comerciales de reconocido prestigio. Calcularon los valores de presin y temperatura crtica para 42 muestras de gas y completaron la tabla de Standing (M del C7+ vs. Pk). Esto permiti obtener un punto adicional para completar el comportamiento del sistema (M C7+= 107,75 y Pk = 2000 lpca). A continuacin se presentan los valores obtenidos de la curva promedio: Peso molecular del C7+: Presin de convergencia, Pk, lpca 100 1514 110 2142 120 2770 140 4026 160 5285 170 5910 180 6538 200 7794 220 9050
2. Mtodo de Rzasa y otros. Se requiere conocer el producto del peso molecular y la gravedad especfica de la fraccin de heptanos y compuestos ms pesados, adems de la temperatura del sistema. La Figura 12 presenta esta correlacin. A menudo se debe trabajar con temperaturas por debajo de 50 F, y valores de gravedad especfica por peso molecular del C7+ por debajo de 80. Esto impeda usar la Figura 12 para estimar el valor de Pk. Martnez y Lorenzo, utilizando muestras de gas natural de Venezuela prolongaron las curvas hasta -50 F y agregaron la curva para un valor del producto de la gravedad especfica y el peso molecular del C7+ de 72. 3. Mtodo aproximado de Hadden. Este mtodo aplica el concepto de un sistema seudobinario. Se basa en las curvas de lugares geomtricos de puntos crticos de sistemas binarios, tal como indica la Figura 11. Para determinar un valor aproximado de Pk, se emplea la curva de puntos crticos que une el componente ms liviano del sistema (generalmente metano) y el ms pesado o el equivalente a ste. Donde la temperatura del sistema corte la curva de lugares crticos, all se lee la presin de convergencia aproximada del sistema. Cuando la presin de trabajo sea alta o cuando se desee comprobar el valor de Pk determinado por uno de los mtodos anteriores, se usa el mtodo de ensayo y error de Hadden, mtodo recomendado por el GPSA. Este mtodo se recomienda para sistemas encontrados en procesamiento del gas natural, donde se ha establecido que la presin de convergencia es funcin de la temperatura y composicin de la fase lquida. Esto presupone que la composicin del lquido, ya ha sido determinada a partir de un clculo de fases usando una presin de convergencia aproximada. Luego se comprueba si este valor es el correcto, por un procedimiento de ensayo y error.
24
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
Figura 12. Valor aproximado de la presin de convergencia. Mtodo de Rzasa y otros, modificado por Martnez y Lorenzo.
El mtodo de Hadden para determinar Pk puede resumirse en los siguientes pasos: a) Se hace un clculo de fases a la presin y temperatura a la cual se desean las constantes de equilibrio, usando una presin de convergencia aproximada, obtenida por uno de los mtodos anteriores. b) La fase liquida se divide en dos partes: Parte I, componente ms liviano (generalmente metano) que debe estar presente, mnimo en un 0,1% por mol y Parte II, los dems componentes. c) Se calcula la temperatura crtica de la Parte II, con base a la fraccin por peso de los componentes. d) Se lleva esta temperatura crtica calculada en el paso (c) a la Figura 11 y se interpola una lnea de lugares crticos para la fase lquida. La Figura 13 ilustra esta interpolacin.
25
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
e) Se lee la presin de convergencia a la temperatura de operacin del sistema, en la lnea interpolada en el paso (d). f) Si Pk del paso (e) es igual al valor supuesto, el clculo de fases del paso (a) est correcto. De lo contrario se repite el proceso, pasos (a) a (f), con el valor de Pk obtenido en el paso (e) hasta que el Pk supuesto y el obtenido coincidan dentro de una aproximacin aceptable.
Figura 13. Ilustracin de la interpolacin de la Figura 11.
Una vez determinado el valor de Pk, se selecciona el juego de curvas correspondiente para los componentes del sistema en consideracin. Cuando la presin de convergencia calculada cae entre dos valores para los cuales
26
Prof. Annys Mrquez
UNIDAD III: COMPORTAMIENTO DE FASES EN SISTEMAS DE HIDROC.
existen constantes K, se recomienda interpolar; sin embargo, esto depende de la diferencia entre la presin de trabajo y la presin de convergencia. Si los valores de K varan poco con Pk (Pk P), puede usarse el juego de curvas ms cercanas al Pk calculado. De lo contrario hay que graficar los valores de K, como funcin de Pk para el valor de presin y temperatura a la que se desea hacer el clculo de fases. Con el valor de presin de convergencia del sistema en consideracin, se determinan las constantes de equilibrio correspondientes. Otros mtodos para determinar constantes de equilibrio. Si se conoce la presin de convergencia, White y Brown desarrollaron un mtodo para construir curvas aproximadas de constantes de equilibrio para un sistema dado, a temperatura constante. Standing discute este mtodo y se describe a continuacin: a) La presin de convergencia es un punto definido del sistema. b) A bajas presiones, los valores de K son independientes de composicin y cualquier grupo de valores de K de la literatura para estas presiones puede usarse. (A falta de estos valores podra trazarse lneas rectas en papel doble-logartmico con pendiente igual a -1), excepto para el metano ya que su temperatura crtica es -116,67 F, y el clculo de K = Po/P no tiene sentido por encima de esta temperatura. Para los dems componentes, etano, propano, etc. esta aproximacin es slo vlida hasta temperaturas alrededor de 150 F y presiones hasta 100 lpca). c) Para temperaturas por debajo de la temperatura crtica, K= 1,0 a la presin de vapor. d) Los valores de K (generalmente a excepcin del metano), pasan por un mnimo y luego aumentan de nuevo hasta llegar a la presin de convergencia. La presin a la que ocurre el valor mnimo de K y este valor mnimo de K, se han correlacionado con la presin de convergencia y la presin de vapor, por medio de las Figs. Nos. 2-52 y 2-53, tomadas de Standing. Estas figuras permiten calcular curvas de constantes de equilibrio hasta una presin de convergencia de 10.000,0 lpca. Con los diferentes puntos para cada componente de los pasos (a) a (d) y por comparacin de la forma de curvas de equilibrio de la literatura, se trazan las mejores curvas posibles para el sistema. Para la curva de metano es para la que generalmente menos datos se determinan; por lo tanto requiere un trazo ms cuidadoso; de all que se recomienda consultar curvas existentes para sistemas similares. Esto es especialmente cierto para la fraccin ms pesada del sistema, generalmente expresada como heptanos y compuestos ms pesados, C7+.
27
S-ar putea să vă placă și
- Psicometría. Principios básicos y protocolos experimentales diversosDe la EverandPsicometría. Principios básicos y protocolos experimentales diversosÎncă nu există evaluări
- Comportamiento de Fases de Los HidrocarburosDocument6 paginiComportamiento de Fases de Los HidrocarburosJorge David Flores DionisioÎncă nu există evaluări
- Ecuación de Balance de MaterialesDocument7 paginiEcuación de Balance de MaterialesDavid AvaloÎncă nu există evaluări
- Metodos de Recuperacion Mejorada No TermicosDocument21 paginiMetodos de Recuperacion Mejorada No TermicosMINA DALIÎncă nu există evaluări
- Descripción de Sistemas de Producción en Campos de AceiteDocument5 paginiDescripción de Sistemas de Producción en Campos de AceiteJONATHAN JESUS HERNANDEZ MARTINEZÎncă nu există evaluări
- Eficiencia de Barrido VolumétricoDocument49 paginiEficiencia de Barrido VolumétricoWaddles Urbina100% (2)
- Variables Que Afectan La Tasa de ProduccionDocument5 paginiVariables Que Afectan La Tasa de ProduccionAntonioRakion100% (1)
- Tipos de Flujo en El Yacimiento.Document6 paginiTipos de Flujo en El Yacimiento.Yimar MÎncă nu există evaluări
- Evaluativo 1 Segundo Lapso Josue ManriqueDocument8 paginiEvaluativo 1 Segundo Lapso Josue ManriqueJosue David Manrrique MoranÎncă nu există evaluări
- Clasificación de Yacimientos en Base A Los Hidrocarburos Que ContienenDocument9 paginiClasificación de Yacimientos en Base A Los Hidrocarburos Que ContienenLilibeth Pamela Arispe Guerra100% (1)
- Empuje HidraulicoDocument10 paginiEmpuje HidraulicoGiovani Alexis Dorado CuellarÎncă nu există evaluări
- Ecuaciones de estado cúbicas de van der Waals, Redlich-Kwong y Peng-RobinsonDocument5 paginiEcuaciones de estado cúbicas de van der Waals, Redlich-Kwong y Peng-RobinsonAna Karen Priego Cruz0% (1)
- Marco Teorico de LodosDocument8 paginiMarco Teorico de LodosChristian Daniel Brito GuerreroÎncă nu există evaluări
- Balance de MateriaDocument3 paginiBalance de MateriaFernando pananaÎncă nu există evaluări
- 6.5 Flujo en La Linea de DescargaDocument9 pagini6.5 Flujo en La Linea de DescargaJoel Alvarado50% (2)
- Flujo de Fluidos Hacia Los PozosDocument15 paginiFlujo de Fluidos Hacia Los Pozosangel jonathan50% (4)
- Curvas de DeclinacionDocument5 paginiCurvas de DeclinacionGaby CarmonaÎncă nu există evaluări
- Flujo Multifasico en Tuberias InclinadasDocument23 paginiFlujo Multifasico en Tuberias InclinadasLucio Garza Miranda75% (4)
- Consideraciones Practicas Durante La Inyeccion de Agua y GasDocument19 paginiConsideraciones Practicas Durante La Inyeccion de Agua y GasGeovanny Andres BriceñoÎncă nu există evaluări
- Yacimientos Con Variación ComposicionalDocument10 paginiYacimientos Con Variación ComposicionalandreaÎncă nu există evaluări
- Propiedades Del Agua de YacimientosDocument28 paginiPropiedades Del Agua de YacimientosMarcos100% (1)
- Especificaciones para Entrega de Aceite Crudo-1Document23 paginiEspecificaciones para Entrega de Aceite Crudo-1Andrea Vanessa Huerta GonzalezÎncă nu există evaluări
- Modelo SedimentológicoDocument13 paginiModelo SedimentológicoGabriel CevallosÎncă nu există evaluări
- Clasificación de yacimientos según diagrama de fasesDocument12 paginiClasificación de yacimientos según diagrama de fasesEstephanny Watsson G. Hz100% (2)
- 5.5. Automatización y TelemediciónDocument2 pagini5.5. Automatización y TelemediciónMaax Collado R100% (1)
- 6.2 Importancia de La Caracterización Del Fluido y El Efecto de LatemperaturaDocument10 pagini6.2 Importancia de La Caracterización Del Fluido y El Efecto de LatemperaturaJuan Carlos Salas ValenciaÎncă nu există evaluări
- La Lee Darcy YacimientosDocument7 paginiLa Lee Darcy YacimientosDaliannis Melendez100% (1)
- Propiedades Del Agua Saturada y BajosaturadaDocument19 paginiPropiedades Del Agua Saturada y BajosaturadaAlejandro Gaspar100% (2)
- Ecuaciones Que Describen El Flujo de Fluidos en Medios PorososDocument12 paginiEcuaciones Que Describen El Flujo de Fluidos en Medios PorososFreddy CachumbaÎncă nu există evaluări
- 1.1 Introduccion A Recuperacion IncrementalDocument8 pagini1.1 Introduccion A Recuperacion IncrementalAc Alejandro14Încă nu există evaluări
- Instrumentos de Control de Un Separador y Procedimientos OperativosDocument21 paginiInstrumentos de Control de Un Separador y Procedimientos OperativoscamiloÎncă nu există evaluări
- Solución línea fuente análisis interferencia pozosDocument5 paginiSolución línea fuente análisis interferencia pozosDuban Hernandez100% (1)
- Requerimientos Del Procesamiento de Acuerdo Con El FluidoDocument13 paginiRequerimientos Del Procesamiento de Acuerdo Con El FluidoVictor Valdés Barajas80% (5)
- CONTROL CALIDAD FLUIDOS INYECCIÓNDocument3 paginiCONTROL CALIDAD FLUIDOS INYECCIÓNlorena hernandez aguilar100% (1)
- UNIDAD 3 Conceptos Petrofisicos y Del Comportamiento de FasesDocument17 paginiUNIDAD 3 Conceptos Petrofisicos y Del Comportamiento de Fasesmiguel100% (1)
- Comportamiento de Los Fluidos en El YacimientoDocument15 paginiComportamiento de Los Fluidos en El YacimientoGuerra YilÎncă nu există evaluări
- Declinación HiperbólicaDocument16 paginiDeclinación HiperbólicaCarlos Martin SanchezÎncă nu există evaluări
- Pruebas de Declinación de Presión000Document26 paginiPruebas de Declinación de Presión000Anyuni Torres100% (7)
- Bombeo 4.6 Identificación y Corrección de Fallas.Document3 paginiBombeo 4.6 Identificación y Corrección de Fallas.Jesus G PerezÎncă nu există evaluări
- Punto de burbujeoDocument4 paginiPunto de burbujeocarlosjosuelaraÎncă nu există evaluări
- Teoria de Desplazamiento de Petroleo y Gas Metodo de Buckley-LeverettDocument37 paginiTeoria de Desplazamiento de Petroleo y Gas Metodo de Buckley-LeverettIvanBaptistaSegovia100% (2)
- EFICIENCIA DE DESPLAZAMIENTO: FACTORES QUE LA AFECTANDocument28 paginiEFICIENCIA DE DESPLAZAMIENTO: FACTORES QUE LA AFECTANrigo100% (2)
- 4.3 Declinacion Armonica CorregidaDocument12 pagini4.3 Declinacion Armonica CorregidaRomero Lazaro Rojas100% (1)
- 4.3 Control de Calidad de Los Fluidos A InyectarDocument8 pagini4.3 Control de Calidad de Los Fluidos A InyectarJuan Carlos Salas ValenciaÎncă nu există evaluări
- Viscosificacion de Un Lodo de Perforacion Pre N°6Document21 paginiViscosificacion de Un Lodo de Perforacion Pre N°6jesus hernandez67% (3)
- CONCEPTOS BÁSICOS de BALANCE VOLUMÉTRICO de FLUIDOS PRODUCIDOS de UN YACIMIENTO La Predicción Sobre El Funcionamiento Del Yacimiento Requiere de Un Conocimiento Auténtico Sobre La Cantidad Original Del Petróleo Que Se Encuentra enDocument25 paginiCONCEPTOS BÁSICOS de BALANCE VOLUMÉTRICO de FLUIDOS PRODUCIDOS de UN YACIMIENTO La Predicción Sobre El Funcionamiento Del Yacimiento Requiere de Un Conocimiento Auténtico Sobre La Cantidad Original Del Petróleo Que Se Encuentra enCyn Carlson100% (3)
- Bajo y Alto EncogimientoDocument8 paginiBajo y Alto Encogimientocameronfreiheit100% (1)
- 2.3 Características y RequisitosDocument15 pagini2.3 Características y RequisitosCARLOS DANIEL LOPEZ LOPEZ0% (1)
- Heterogeneidad Del YacimientoDocument7 paginiHeterogeneidad Del YacimientoVanessa Sandoval AguileraÎncă nu există evaluări
- Fluidos No ConvencionalesDocument16 paginiFluidos No ConvencionalesAlejandro Gil100% (2)
- Factores Que Controlan La Recuperación Por Inyección de Agua y GasDocument4 paginiFactores Que Controlan La Recuperación Por Inyección de Agua y GasTeresa Balderas100% (1)
- Yacimientos de Petróleo NegroDocument4 paginiYacimientos de Petróleo NegroAlexander Lopez'Încă nu există evaluări
- Rsm-2.1 Conservacion de La MateriaDocument14 paginiRsm-2.1 Conservacion de La MateriaIngeniero Angeles Miranda BustamanteÎncă nu există evaluări
- Conducción y Manejo de HidrocarburosDocument26 paginiConducción y Manejo de HidrocarburosAlejandroC.Jimenez100% (2)
- Tema 1 Balance de MaterialesDocument15 paginiTema 1 Balance de MaterialesCarmen Teresa MedranoÎncă nu există evaluări
- (1library - Co) Unidad III Comportamiento de Fases en Sistemas de HidrocarburosDocument27 pagini(1library - Co) Unidad III Comportamiento de Fases en Sistemas de HidrocarburosErica FranciscoÎncă nu există evaluări
- Sesion Iii Parte 1.Document31 paginiSesion Iii Parte 1.Luis MartosÎncă nu există evaluări
- Comportamiento de Los HidrocarburosDocument4 paginiComportamiento de Los HidrocarburosCristhian Gerardo Garcia NavarroÎncă nu există evaluări
- Fase Es Toda Porción de Un Sistema Con La Misma Estructura o Arreglo AtómicoDocument9 paginiFase Es Toda Porción de Un Sistema Con La Misma Estructura o Arreglo Atómicobettyboop413Încă nu există evaluări
- Copia de Práctica 3 y 4 - EH 2015Document26 paginiCopia de Práctica 3 y 4 - EH 2015angelriosvazquez08Încă nu există evaluări
- La Presa de Saelices Los Molinos Del Hierro y La Alcurnia Rafael Del Cerro MalagónDocument1 paginăLa Presa de Saelices Los Molinos Del Hierro y La Alcurnia Rafael Del Cerro Malagónelenitaa000000Încă nu există evaluări
- Manual Servicio PerforadoraDocument431 paginiManual Servicio Perforadorapdiazgodoy100% (1)
- 04 Instructivo UWalletDocument6 pagini04 Instructivo UWalletCLAUDIA XIMENA GRANADOSÎncă nu există evaluări
- Ritual de UnciónDocument5 paginiRitual de UnciónJulio SanchezÎncă nu există evaluări
- Cartelera Del 27 de Octubre de 2022Document45 paginiCartelera Del 27 de Octubre de 2022Juan Esteban Martinez LunaÎncă nu există evaluări
- Sistemas de inecuaciones para resolver problemas de transporte, ventas y fabricaciónDocument1 paginăSistemas de inecuaciones para resolver problemas de transporte, ventas y fabricaciónNicolás FuenteÎncă nu există evaluări
- Hist San Rafael del Yuma fund 1889Document1 paginăHist San Rafael del Yuma fund 1889Michael Perez ReyesÎncă nu există evaluări
- Escuela Ramiro Roa D-758 evaluación lenguajeDocument2 paginiEscuela Ramiro Roa D-758 evaluación lenguajeFrale FraleÎncă nu există evaluări
- Definición de Divorcio SeminarioDocument2 paginiDefinición de Divorcio SeminarioAlejandra RodasÎncă nu există evaluări
- Antologia de Los Documentos Reales de La Dinastia Carlista - Melchor Ferrer (Org.), 1951Document104 paginiAntologia de Los Documentos Reales de La Dinastia Carlista - Melchor Ferrer (Org.), 1951Eduardo CruzÎncă nu există evaluări
- Atemporalidad Omnisciencia y ProvidenciaDocument13 paginiAtemporalidad Omnisciencia y ProvidenciaFelipe Tapia AlfaroÎncă nu există evaluări
- Actividad Estructura de La Industria Semana 8Document6 paginiActividad Estructura de La Industria Semana 8Yobana Romero100% (1)
- Practica 3 Calculos de Parametros Geometricos Indicados y EfectivosDocument6 paginiPractica 3 Calculos de Parametros Geometricos Indicados y EfectivosJuan P LunaÎncă nu există evaluări
- El Entorno en El Que Operan Los Proyectos U1Document20 paginiEl Entorno en El Que Operan Los Proyectos U1karelisÎncă nu există evaluări
- ObjetivoDocument5 paginiObjetivoKarla Dayana AriasÎncă nu există evaluări
- Isaías, figura de espera por la salvaciónDocument2 paginiIsaías, figura de espera por la salvaciónEDMUNDO JIMÉNEZÎncă nu există evaluări
- Consultas Normalizadas de Meddra: Standardised Meddra Queries (SMQS)Document67 paginiConsultas Normalizadas de Meddra: Standardised Meddra Queries (SMQS)Bernal GomezÎncă nu există evaluări
- Informe de Conductividad Eléctrica Del Suelo - Paye Zeballos, FresiaDocument20 paginiInforme de Conductividad Eléctrica Del Suelo - Paye Zeballos, Fresiamelany50% (2)
- Tarea 4 Negocios Internacionales 1Document13 paginiTarea 4 Negocios Internacionales 1mariaÎncă nu există evaluări
- Sempei U3 Elementos Gestion DirectivaDocument20 paginiSempei U3 Elementos Gestion DirectivamelvaÎncă nu există evaluări
- Anuario IECS 2018Document57 paginiAnuario IECS 2018Instituto de Efectividad Clínica y SanitariaÎncă nu există evaluări
- Clase y Guía de HistoriaDocument6 paginiClase y Guía de HistoriaVerónica AndreaÎncă nu există evaluări
- Etnografía. El Sabor de Nuestra Historia.Document78 paginiEtnografía. El Sabor de Nuestra Historia.voloptensesÎncă nu există evaluări
- Cansi - Símbolos y Técnicas de Dramatización para La CatequesisDocument56 paginiCansi - Símbolos y Técnicas de Dramatización para La CatequesisBarakaja CaraviasÎncă nu există evaluări
- Semana 7 Dia 5 MatematicaDocument2 paginiSemana 7 Dia 5 MatematicaWilson FredyÎncă nu există evaluări
- Desarrollo Infantil Primer Año de Vida Interacciones PDFDocument12 paginiDesarrollo Infantil Primer Año de Vida Interacciones PDFMaría Pastor MayorÎncă nu există evaluări
- El Papel Del Estado y La Calidad Del Sector PublicDocument29 paginiEl Papel Del Estado y La Calidad Del Sector PublicJavier Gutierrez AriasÎncă nu există evaluări
- Sociedad Anónima Abierta Articulo 260-264Document6 paginiSociedad Anónima Abierta Articulo 260-264JhosselynÎncă nu există evaluări
- Caso Clinico TBCDocument1 paginăCaso Clinico TBCAngelinho Flores PalominoÎncă nu există evaluări
- TLR 12020 21 IMM FinalDocument113 paginiTLR 12020 21 IMM FinalAndrea BonillaÎncă nu există evaluări