Documente Academic
Documente Profesional
Documente Cultură
Tarea 02
Încărcat de
renatasanchezgarciaDescriere originală:
Titlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Tarea 02
Încărcat de
renatasanchezgarciaDrepturi de autor:
Formate disponibile
Ecuaciones de tensin superficial en funcin de T
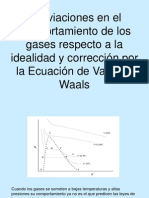
La tensin superficial vara con la temperatura, lo ms comn es que disminuya al aumentar esta. A primera vista, en intervalos de temperatura pequea, la relacin entre la tensin superficial y la temperatura parece lineal, pero en intervalo mayor es, el diagrama de la tensin superficial frente a la temperatura muestra una curvatura. La tensin superficial alcanza un mnimo a la temperatura de ebullicin, se anulan muy cerca del punto crtico, de acuerdo a la ecuacin de Van der Waals:
=K*(tc*pC2)1/3*(1- )n
Ecuaciones empricas que se ajustan a las medidas de a distintas T. Ecuacin de Etvs: = k= 2.1 erg/K Ecuacin de Van der Waals:
k/Vm2/3 (Tc-T) =0 (1-T/Tc)n
n=11/9
(liq)=8 (H2O)=1 (metales lquidos) Para un lquido en equilibrio con su vapor dG= -SdT+VdP+dA suponiendo el sistema cerrado con dn=0. Segn la condicin de equilibrio termodinmico se cumple que: = (dG/dA)>0. De esta ecuacin sacamos que la energa libre de Gibbs disminuye al disminuir el rea superficial de un sistema, tratndose este proceso de un proceso espontneo. Variacin de la tensin superficial con la concentracin y clculo de la adsorcin relativa En las soluciones acuosas de sustancias tensoactivas, la concentracin en la superficie es mayor que en el interior de la solucin. Esto se debe a que la atraccin entre las molculas de soluto y solvente es menor que la atraccin de las molculas entre si, por lo que el soluto es expulsado hacia la superficie. El exceso de concentracin superficial o adsorcin relativa 2,1 puede calcularse mediante la ecuacin de Gibbs, la que para el caso de soluciones muy diluidas toma la forma:
2,1=
La tensin superficial depende de la naturaleza del lquido, del medio que le rodea y de la temperatura. En general, la tensin superficial disminuye con la temperatura, ya que las fuerzas de cohesin disminuyen al aumentar la agitacin trmica. La influencia del medio exterior se comprende ya que las molculas del medio ejercen acciones atractivas sobre las molculas situadas en la superficie del lquido, contrarrestando las acciones de las molculas del lquido. Una de las caractersticas de la tensin superficial es que su valor disminuye cuando se incrementa la temperatura, esto es porque aumenta la agitacin trmica, es decir que las molculas que conforman el lquido aumentan su movimiento, lo que par efectos prcticos resulta en una disminucin de las fuerzas de cohesin que actan sobre las molculas. De esto se puede apreciar que la tensin superficial de un lquido tiende a cero siempre que la temperatura de dicho sistema se acerca a la temperatura critica del sistema, ya que en este punto no hay una clara distincin entre el estado liquido y vapor de una sustancia y en consecuencia no se puede apreciar una interface bien definida o alguna superficie entre ambas. La tensin superficial es inversamente proporcional a la temperatura:
Efecto de la temperatura sobre la tensin superficial
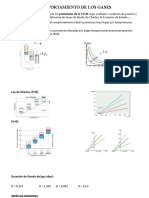
Experimentalmente se observa que la tensin superficial disminuye casi linealmente con la temperatura, por lo tanto, se han propuesto varias ecuaciones que producen comportamiento lineal, entre ellas:
Ecuacin de Etvs: ()V2/3 = k(Tc - T)
donde: V es el volumen molar Tc es la temperatura crtica k es una constante de proporcionalidad con un valor de aprox. 2.1 ergios/K
Ecuacin de Ramsay y Shields: ()[(Mx)/()]2/3 = k(Tc - T - 6) donde: M es la masa molar () es la densidad del lquido x es un factor de asociacin que mide qu tan fuertemente interacta el lquido consigo mismo Tc es la temperatura crtica k es una constante de proporcionalidad con un valor de aprox. 2.1 ergios/K el sumando -6 se introdujo para reproducir la observacin experimental de que la tensin superficial parece hacerse cero un poco por encima de la temperatura crtica. Esto implica que la tensin superficial se anula 6 K por debajo de la temperatura crtica, lo que est de acuerdo con el hecho experimental de que cuando se tiene un lquido en un tubo estrecho, el menisco que separa el lquido de la fase vapor desaparece a unos 6 grados por debajo de la temperatura crtica. La constante k de las ecuaciones de Etvs y de Ramsay y Shields, viene dada por la pendiente de la recta que resulta de representar la energa superficial molar en funcin de la temperatura. Por ello k recibe el nombre de coeficiente de temperatura de la energa superficial molar. Para un gran nmero de sustancias al estado lquido el valor de k es 2,12. Los lquidos para los cuales k tiene este valor se llaman normales.
Ecuacin de van der Waals: () = ()o[1 - (T/Tc)]n donde: ()o es la tensin superficial a temperatura ambiente
T es la temperatura a la cual se quiere determinar la tensin superficial Tc es la temperatura crtica n es un exponente con un valor de: 11/9 para lquidos orgnicos aprox. 1 para metales fundidos
En la figura se observa que la tensin superficial disminuye al aumentar la temperatura, esto se debe a que las fuerzas de cohesin disminuyen al aumentar la agitacin trmica.
Referencias Fisicoqumica de superficies y sistemas dispersos
M.T. TORAL -Editorial UrmoPaginas: 17 23.
Tratado de qumica fsica
S. GlasstonePaginas: 435 446.
http://www.oocities.org/fisicoquimica/tension-superficial.pdf http://es.wikipedia.org/wiki/Tensi%C3%B3n_superficial#Ecuaciones http://fsz.ifas.ufl.edu/surfacetensionandcapillarity/html/diagramas/variacion_ de_ts_con_temperatura.htm
S-ar putea să vă placă și
- Ingeniería química. Soluciones a los problemas del tomo IDe la EverandIngeniería química. Soluciones a los problemas del tomo IÎncă nu există evaluări
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDe la EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesÎncă nu există evaluări
- Calculo de Tuberia de DrenajeDocument36 paginiCalculo de Tuberia de DrenajebetojulioÎncă nu există evaluări
- Punto CríticoDocument8 paginiPunto CríticoSoscyre RiveraÎncă nu există evaluări
- Efecto temperatura tensión superficialDocument2 paginiEfecto temperatura tensión superficialSantiago Fuentes González100% (1)
- Arboles EstriadosDocument7 paginiArboles Estriadoschristian2_12Încă nu există evaluări
- Tensión Superficial y Temperatura, Regla de Eötvös, Guggenheim-KatayamaDocument3 paginiTensión Superficial y Temperatura, Regla de Eötvös, Guggenheim-KatayamaPablo Ramírez100% (11)
- 321o GeopierDocument4 pagini321o GeopierfhbenavidezÎncă nu există evaluări
- Efecto temperatura tensión superficialDocument8 paginiEfecto temperatura tensión superficialDonaldo LeonÎncă nu există evaluări
- Ecuacion de KatayamaDocument2 paginiEcuacion de KatayamaJasmin Yanina Solis Santiago0% (1)
- Fis4 PDFDocument33 paginiFis4 PDFDamianÎncă nu există evaluări
- Termo 3Document36 paginiTermo 3José Emilio GuardiaÎncă nu există evaluări
- Mecanica de FluidosDocument14 paginiMecanica de FluidosVero ValenzuelaÎncă nu există evaluări
- Tensión superficial: fuerzas que actúan en la interfaz líquido-gasDocument6 paginiTensión superficial: fuerzas que actúan en la interfaz líquido-gasricardo reyesÎncă nu există evaluări
- Critico Lo Nesesario de SaberDocument6 paginiCritico Lo Nesesario de Saberfreddy noya plataÎncă nu există evaluări
- Método Du NouyDocument4 paginiMétodo Du NouygumerÎncă nu există evaluări
- (200777508) 62254113 Tension Superficial y Temperatura Regla de Eotvos Guggenheim KatayamaDocument3 pagini(200777508) 62254113 Tension Superficial y Temperatura Regla de Eotvos Guggenheim KatayamaRitter1287Încă nu există evaluări
- Modos de EbulliciónDocument6 paginiModos de EbulliciónCarlos AndresÎncă nu există evaluări
- Laboratorio Tension SuperficialDocument11 paginiLaboratorio Tension SuperficialMarjorieAsenciosSánchezÎncă nu există evaluări
- Tension SuperficialDocument5 paginiTension SuperficialHugo Angel VlrÎncă nu există evaluări
- 1 - 3 - Estados de La Materia - 3Document9 pagini1 - 3 - Estados de La Materia - 3karenÎncă nu există evaluări
- Ecuación de Navier-StokesDocument7 paginiEcuación de Navier-StokesDarwin OviedoÎncă nu există evaluări
- Ebullición y CondensaciónDocument6 paginiEbullición y CondensaciónAioria Leo Sponja100% (1)
- P2. Tensión SuperficialDocument8 paginiP2. Tensión SuperficialammggttÎncă nu există evaluări
- CAPITULO 3 Fenomenos de SuperficieDocument121 paginiCAPITULO 3 Fenomenos de Superficieisabel33% (3)
- Ley de Los Estados CorrespondientesDocument6 paginiLey de Los Estados CorrespondientesLuis Oscar Lopez JuncoÎncă nu există evaluări
- Rayleigh-Bénard Convection ProblemDocument9 paginiRayleigh-Bénard Convection ProblemObnoxious28Încă nu există evaluări
- Dilatación TérmicaDocument10 paginiDilatación TérmicaLeonardo WalterÎncă nu există evaluări
- Fenomeno Crit - Grupo 5Document24 paginiFenomeno Crit - Grupo 5Marcelo TorresÎncă nu există evaluări
- Equilibrio en Sistemas SimplesDocument28 paginiEquilibrio en Sistemas Simplesmiller torreÎncă nu există evaluări
- Ecuación Van der WaalsDocument5 paginiEcuación Van der WaalsCarlos CarhuayoÎncă nu există evaluări
- 2.8 Ley de Estados CorrespondientesDocument7 pagini2.8 Ley de Estados CorrespondientesCarlosCarrilloÎncă nu există evaluări
- Apuntes E. Libre y Eq. Fís. Sust. Puras 2021BDocument5 paginiApuntes E. Libre y Eq. Fís. Sust. Puras 2021BBrenda Lizbeth Guillen SustaitaÎncă nu există evaluări
- Presion de Vapor (Fisica)Document18 paginiPresion de Vapor (Fisica)Avs AlbertoÎncă nu există evaluări
- Transferencia-Unidad 3 - BBPJDocument20 paginiTransferencia-Unidad 3 - BBPJBlanca Pineda JoséÎncă nu există evaluări
- Comportamiento de Los GasesDocument25 paginiComportamiento de Los GasesElsa Marzana SanizoÎncă nu există evaluări
- Comportamiento de los gasesDocument25 paginiComportamiento de los gasesERIKA LOZADA RUSSELÎncă nu există evaluări
- Trabajo Final de Quimica FisicaDocument32 paginiTrabajo Final de Quimica FisicaOliver Curay ZegarraÎncă nu există evaluări
- LabFIQUI-I-"TENSION SUPERFICIAL DE LIQUIDOS"BDocument25 paginiLabFIQUI-I-"TENSION SUPERFICIAL DE LIQUIDOS"BcefiqtÎncă nu există evaluări
- Ecuación de Clapeyron: determinar cambios de fase mediante pendientes de curvas P-TDocument4 paginiEcuación de Clapeyron: determinar cambios de fase mediante pendientes de curvas P-TKatia Michelle ArmentaÎncă nu există evaluări
- DIFUSIVIDAD TÉRMICA CristianDocument3 paginiDIFUSIVIDAD TÉRMICA CristianJavierÎncă nu există evaluări
- Teoría 3 - Equilibrios FísicosDocument6 paginiTeoría 3 - Equilibrios FísicosMiguel HerreraÎncă nu există evaluări
- Cap 6 - Calor TemperaturaDocument47 paginiCap 6 - Calor TemperaturaDecksÎncă nu există evaluări
- 2022-2-Clase 5 Gases Reales y Líquidos- PCHDocument46 pagini2022-2-Clase 5 Gases Reales y Líquidos- PCHsartorigamersÎncă nu există evaluări
- Trabajo Fuerza Motriz T.Document18 paginiTrabajo Fuerza Motriz T.paulÎncă nu există evaluări
- BLEVE: Expansión explosiva de vapor líquidoDocument16 paginiBLEVE: Expansión explosiva de vapor líquidomatiprezzoÎncă nu există evaluări
- UntitledDocument7 paginiUntitledAndrés Méndez EscurraÎncă nu există evaluări
- Clase4 5VIRTFQIDocument40 paginiClase4 5VIRTFQIRichard Antony Alva RuizÎncă nu există evaluări
- TEMA #1 Fisicoquimica I - QMC 213Document67 paginiTEMA #1 Fisicoquimica I - QMC 213Anonymous yEGP9hnÎncă nu există evaluări
- MonografiaDocument19 paginiMonografiaLeydi Torcagua HuamaniÎncă nu există evaluări
- Propiedades ColigativasDocument10 paginiPropiedades ColigativasElectromotrizTorres TorresÎncă nu există evaluări
- Semana 2 - Conceptos y Definiciones Fluidos ViscosidadDocument48 paginiSemana 2 - Conceptos y Definiciones Fluidos ViscosidadSaul Garcia MercadoÎncă nu există evaluări
- Gases IdealesDocument12 paginiGases IdealesCinthya MaldonadoÎncă nu există evaluări
- REALES Punto CriticoDocument15 paginiREALES Punto Criticodenis jesus alcedoÎncă nu există evaluări
- Euaciones de EstadoDocument12 paginiEuaciones de EstadoEsther Ramos GonzalezÎncă nu există evaluări
- 3 Fenómenos de SuperficieDocument112 pagini3 Fenómenos de SuperficieogreoogreoÎncă nu există evaluări
- LabFIQUI-I-"PRESIÓN DE VAPOR DE LÍQUIDOS PUROS"BDocument9 paginiLabFIQUI-I-"PRESIÓN DE VAPOR DE LÍQUIDOS PUROS"Bcefiqt100% (2)
- Ley de Los Estados CorrespondientesDocument7 paginiLey de Los Estados CorrespondientesKaren Soledad Sondor Maza0% (1)
- Capilaridad y Termodinámica de SuperficiesDocument39 paginiCapilaridad y Termodinámica de SuperficiesJulio Camel0% (1)
- Lab 3 Qui-331 Determinacion Tension Superficial, Hecho Por Adrian MVR 100573987Document12 paginiLab 3 Qui-331 Determinacion Tension Superficial, Hecho Por Adrian MVR 100573987Adrian Miguel Valerio Rosario100% (1)
- Apunte - Vapor de AguaDocument7 paginiApunte - Vapor de AguaJuan Pablo IglesiasÎncă nu există evaluări
- Gases RealesDocument6 paginiGases RealesRenato EspinosaÎncă nu există evaluări
- Problemas Resueltos Del CastellanDocument271 paginiProblemas Resueltos Del CastellanrenatasanchezgarciaÎncă nu există evaluări
- Resultados Identificacion Del Grupo CarboniloDocument1 paginăResultados Identificacion Del Grupo CarbonilorenatasanchezgarciaÎncă nu există evaluări
- Tarea 05Document5 paginiTarea 05renatasanchezgarciaÎncă nu există evaluări
- Volume Tris Red Ox 1Document23 paginiVolume Tris Red Ox 1Maria RendonÎncă nu există evaluări
- INFORME Perdidas Secundarias CorregidoDocument9 paginiINFORME Perdidas Secundarias Corregidoganzdes 123Încă nu există evaluări
- Física 02 CNDocument4 paginiFísica 02 CNEsmeraldaÎncă nu există evaluări
- Ejercicio 4.12Document8 paginiEjercicio 4.12Daniela PMÎncă nu există evaluări
- ViscosimetriaDocument21 paginiViscosimetriaLaura CastilloÎncă nu există evaluări
- Guia Clapeyron Calor de EbullicionDocument5 paginiGuia Clapeyron Calor de EbullicionRafael Perez ColmenaresÎncă nu există evaluări
- Informe #3Document7 paginiInforme #3Willian PilataxiÎncă nu există evaluări
- Leyes de Newton: Taller preparación parcialDocument5 paginiLeyes de Newton: Taller preparación parcialWilliam CastroÎncă nu există evaluări
- Cuadros de Dialogo y Ejercicios de Repaso Unidad 4 - Propiedades de La MateriaDocument6 paginiCuadros de Dialogo y Ejercicios de Repaso Unidad 4 - Propiedades de La MateriaJuan Daniel Felix Palomino100% (1)
- Informe Laboratorio Convección NaturalDocument24 paginiInforme Laboratorio Convección NaturalMaría Alejandra CiroÎncă nu există evaluări
- Informe Academico-S13Document17 paginiInforme Academico-S13melquiadesÎncă nu există evaluări
- Hidráulica de Canal TrapezoidalDocument32 paginiHidráulica de Canal TrapezoidalCarhuapoma Mejia AnibalÎncă nu există evaluări
- Upn Dinam S02 HT (2015)Document2 paginiUpn Dinam S02 HT (2015)Luis Verastegui ChuquilinÎncă nu există evaluări
- Solucionario Simulacro A Ev. Final Cálculo IiiDocument4 paginiSolucionario Simulacro A Ev. Final Cálculo IiiElder Edson Paucar RojasÎncă nu există evaluări
- Pendulo FisicoDocument7 paginiPendulo FisicoCAROLINA PINILLA ROJASÎncă nu există evaluări
- Movimientos en 2D y 3DDocument15 paginiMovimientos en 2D y 3DShaina CreationzÎncă nu există evaluări
- Estatica IntroduccionDocument5 paginiEstatica IntroduccionLuis Adalberto Zapata ValdiviezoÎncă nu există evaluări
- Cualidades Del SonidoDocument3 paginiCualidades Del Sonidoapi-402028174Încă nu există evaluări
- Tema N°4Document12 paginiTema N°4melany medinaÎncă nu există evaluări
- Contenido Programático de La Asignatura Mecánica Racional IIDocument8 paginiContenido Programático de La Asignatura Mecánica Racional IIHilario ZambranoÎncă nu există evaluări
- Electricidad y Magnetismo - SampalloDocument137 paginiElectricidad y Magnetismo - SampalloAxeel Burián100% (3)
- Practn°1 Fisica 2 Paralelo GDocument4 paginiPractn°1 Fisica 2 Paralelo Gjose antonio0% (1)
- Informe 2 - Constante Elã¡stica Del ResorteDocument11 paginiInforme 2 - Constante Elã¡stica Del ResorteKaterin BurgoaÎncă nu există evaluări
- Tablas Perdidas CRANEDocument7 paginiTablas Perdidas CRANEJesús davidÎncă nu există evaluări
- Memoria DescriptivaDocument20 paginiMemoria DescriptivaLeandro LazcanoÎncă nu există evaluări
- Fuerzas electrostáticas entre cargas puntualesDocument2 paginiFuerzas electrostáticas entre cargas puntualesJuan David OspinoÎncă nu există evaluări
- 2do Experimento de Informe N°4 de FisicoquimicaDocument3 pagini2do Experimento de Informe N°4 de FisicoquimicahermelindaÎncă nu există evaluări