Documente Academic
Documente Profesional
Documente Cultură
06 Molecules Rep Cor
Încărcat de
hhedfiDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
06 Molecules Rep Cor
Încărcat de
hhedfiDrepturi de autor:
Formate disponibile
Seconde TP Chimie n6
Eric DAINI Lyce Paul Czanne Aix en Provence - http://labotp.org
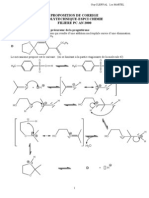
LES MOLECULES: REPRESENTATION CORRECTION
I REPRESENTATION DE LEWIS DES MOLECULES 1) Les atomes Les atomes sont reprsents conventionnellement par des boules de couleur. A chaque lment chimique
correspond une
couleur: Elment Hydrogne Blanc Couleur Carbone Noir Azote Bleu Oxygne Rouge Soufre Jaune Chlore Vert
Les liaisons entre atomes sont matrialises par des tiges.
a) lment Hydrogne Carbone Azote Oxygne Soufre Chlore
Symbole
H 1 (K) 1
1
C 6 (K) (L) 4
2 4
N 7 (K) (L) 5
2 5
O 8 (K) (L) 6
2 6
S 16 (K)2(L)8(M)
6
Cl 17 (K)2(L)8(M)
7
Z Formule lectronique Nombre d'esur couche externe Nombre d'emanquant pour obir aux rgles du et de l'octet Nombre de doublets liants: nl Nombre de doublets non liants: nnl
Seconde TP Chimie n6
Eric DAINI Lyce Paul Czanne Aix en Provence - http://labotp.org
b) Rgle de l'octet: les atomes cherchent acqurir la structure lectronique externe en octet des gaz rares. Rgle du duet: les atomes de numro atomique voisin de celui de l'hlium (Z = 2) cherchent acqurir la structure lectronique externe en duet de l'hlium. c) Ajout au tableau de la ligne indiquant le nombre d'lectrons manquant sur la couche externe de l'atome pour obir aux rgles du duet ou de l'octet. 2) Les molcules Une molcule est une association lectriquement neutre d'atomes. a) La molcule d'thanol C2H6O molcule contient: 2 atomes de carbone 6 atomes d'hydrogne 1 atome d'oxygne
b) La molcule d'eau H2O contient: 2 atomes d'hydrogne 1 atome d'oxygne La molcule de dioxyde de carbone CO2 contient: 1 atome de carbone 2 atomes d'oxygne thanol dioxyde de carbone
eau
3) Liaison covalente a) Ajout au tableau de la ligne indiquant le nombre de doublets liants not nl b) Ajout au tableau de la ligne indiquant le nombre de doublets non liants not nnl de chaque atome. 4) Reprsentation de Lewis d'une molcule
II ETUDE DE QUELQUES MOLECULES 1) Etude de molcules simples a) Dihydrogne H2: nt = 1 + 1 = 2 donc nd = 2 /2 = 1 doublet pour la molcule H2 Atome H: nl = 1 nnl = 0 chaque atome d'hydrogne ralise un doublet liant et ne possde pas de doublet non liant. Schma de Lewis:
Modle compact Modle clat
Chaque atome d'hydrogne est entour d'un doublet d'lectrons et satisfait donc la rgle du duet. b) Dichlore Cl2: nt = 7 + 7 = 14 donc nd = 14 /2 = 7 doublets pour la molcule Cl2 Atome Cl: nl = 1 nnl = 3 chaque atome de chlore ralise un doublet liant et trois doublets non liants. Schma de Lewis:
Cl
Cl
Cl
Cl
Chaque atome de chlore est entour de quatre doublets d'lectrons et satisfait donc la rgle de l'octet.
c)
Chlorure d'hydrogne: HCl.
Seconde TP Chimie n6
Eric DAINI Lyce Paul Czanne Aix en Provence - http://labotp.org
nt = 1 + 7 = 8 donc nd = 8 /2 = 4 doublets pour la molcule HCl Atome H: nl = 1 nnl = 0 Atome Cl: nl = 1 nnl = 3 Schma de Lewis:
Cl
Cl
L'atome H vrifie vrifie la rgle du duet et l'atome Cl vrifie la rgle de l'octet. d) Eau H2O nt = 2 1 + 6 = 8 donc nd = 8 /2 = 4 doublets pour la molcule H2O Atome H: nl = 1 nnl = 0 Atome O: nl = 2 nnl = 2 Schma de Lewis:
Ammoniac NH3 nt = 5 + 3 1 = 8 donc nd = 8 /2 = 4 doublets pour la molcule NH3 Atome H: nl = 1 nnl = 0 Atome N: nl = 3 nnl = 1 Schma de Lewis:
N H
N H
e)
Dioxygne O2 : nt = 6 + 6 = 12 donc nd = 12 /2 = 6 doublets pour la molcule O2 Atome O: nl = 2 nnl = 2 Schma de Lewis:
Chaque atome d'oxygne est entour de deux doublets liants et deux doublets non liants donc la rgle de l'octet est satisfaite. Diazote N2 : nt = 7 + 7 = 14 donc nd = 14 /2 = 7 doublets pour la molcule N2 Atome N: nl = 3 nnl = 1 Schma de Lewis:
Chaque atome d'azote est entour de trois doublets liants et un doublet non liant donc la rgle de l'octet est satisfaite Dihydrogne Chlorure d'hydrogne Dichlore Eau
Ammoniac Dioxygne Diazote
Seconde TP Chimie n6
Eric DAINI Lyce Paul Czanne Aix en Provence - http://labotp.org
2) Molcules contenant l'lment carbone a) Mthane CH4: nt = 4 + 4 1 = 8 donc nd = 8 /2 = 4 doublets pour la molcule CH4 Atome H: nl = 1 nnl = 0 Atome C: nl = 4 nnl = 0 Schma de Lewis:
H H C H H H
H C H H
L'atome de carbone tablit 4 liaisons covalentes simples et satisfait la rgle de l'octet. b) Ethylne C2H4: nt = 2 4 + 4 1 = 12 donc nd = 12 /2 = 6 doublets pour la molcule C2H6 Atome H: nl = 1 nnl = 0 Atome C: nl = 4 nnl = 0 Schma de Lewis:
H H C
H C H H
H C
H C H
Chaque atome de carbone tablit deux liaisons simples et une liaison double: donc 4 doublets. Il satisfait la rgle de l'octet. c) Dioxyde de carbone CO2: nt = 4 + 2 6 = 16 donc nd = 16 /2 = 8 doublets pour la molcule CO2 Atome O: nl = 2 nnl = 2 Atome C: nl = 4 nnl = 0 Schma de Lewis:
L'atome de carbone tablit 2 liaisons covalentes doubles, donc 4 doublets. Il satisfait la rgle de l'octet. d) Acide cyanhydrique HCN: nt = 1 + 4 + 5 = 10 donc nd = 10 /2 = 5 doublets pour la molcule HCN Atome H: nl = 1 nnl = 0 Atome C: nl = 4 nnl = 0 Atome N: nl = 3 nnl = 1 Schma de Lewis:
L'atome de carbone tablit 1 liaison covalente triple et une liaison simple: donc 4 doublets. Il satisfait la rgle de l'octet.
Seconde TP Chimie n6
Eric DAINI Lyce Paul Czanne Aix en Provence - http://labotp.org
III ETUDES DE QUELQUES MOLECULES ORGANIQUES a) Le mthanal: CH2O nt = 4 + 2 1 + 6 = 12 donc nd = 12 /2 = 6 doublets pour la molcule CH2O Atome H: nl = 1 nnl = 0 Atome C: nl = 4 nnl = 0 Atome O: nl = 2 nnl = 2 Schma de Lewis:
H H C O
b) La mthylamine: CH5N nt = 4 + 5 1 + 5 = 14 donc nd = 14 /2 = 7 doublets pour la molcule CH5N Atome H: nl = 1 nnl = 0 Atome C: nl = 4 nnl = 0 Atome N: nl = 3 nnl = 1 Schma de Lewis:
H H C H N H H
c) Le mthanol: CH4O nt = 4 + 4 1 + 6 = 14 donc nd = 14 /2 = 7 doublets pour la molcule CH4O Atome H: nl = 1 nnl = 0 Atome C: nl = 4 nnl = 0 Atome O: nl = 2 nnl = 2 Schma de Lewis:
H H C H
d) Perchlo: C2Cl4 nt = 2 4 + 4 7 = 36 donc nd = 36 /2 = 18 doublets pour la molcule C2Cl4 Atome Cl: nl = 1 nnl = 3 Atome C: nl = 4 nnl = 0 Schma de Lewis:
Cl Cl C
Cl C Cl
e) Phosgne: COCl2 nt = 4 + 6 + 2 7 = 24 donc nd = 24 /2 = 12 doublets pour la molcule COCl2 Atome Cl: nl = 1 nnl = 3 Atome C: nl = 4 nnl = 0 Atome O: nl = 2 nnl = 2 Schma de Lewis:
Cl Cl C O
S-ar putea să vă placă și
- Annales de Mathématiques, Baccalauréat C et E, Cameroun, 2008 - 2018: Sujets et CorrigésDe la EverandAnnales de Mathématiques, Baccalauréat C et E, Cameroun, 2008 - 2018: Sujets et CorrigésEvaluare: 4.5 din 5 stele4.5/5 (4)
- Aide Memoire TextileDocument26 paginiAide Memoire TextileBoubker Kharchafi100% (1)
- Exercices de Physique Nucléaire et de la MatièreDe la EverandExercices de Physique Nucléaire et de la MatièreÎncă nu există evaluări
- Chimie OrganiqueDocument37 paginiChimie Organiquemehdi100% (1)
- Cours Chimie OrganiqueDocument60 paginiCours Chimie OrganiqueFarah BahriÎncă nu există evaluări
- TD AtomistiqueDocument8 paginiTD AtomistiqueMoustapha BelmoudenÎncă nu există evaluări
- 01 Resume Algebre Lineaire SupDocument5 pagini01 Resume Algebre Lineaire SupSalah MrhÎncă nu există evaluări
- SCHMITZ SmartBoard FRDocument60 paginiSCHMITZ SmartBoard FRhocine gherbi100% (2)
- Manual Remote GEU401 ControlDocument20 paginiManual Remote GEU401 ControlJeisson Andres Cortes0% (2)
- La Geometrie de Quelques Molecules Exercices Non Corriges 3Document3 paginiLa Geometrie de Quelques Molecules Exercices Non Corriges 3maryam.zagririÎncă nu există evaluări
- TD Structure de LewisDocument9 paginiTD Structure de LewisMourad RabahÎncă nu există evaluări
- TP Edifice LewisDocument4 paginiTP Edifice LewisMohamed Ali MahjoubÎncă nu există evaluări
- 1S Chimie Chap1 M La Structure Des MoléculesDocument7 pagini1S Chimie Chap1 M La Structure Des MoléculesAlban SavinoÎncă nu există evaluări
- 3 ActiviteCHONDocument3 pagini3 ActiviteCHONMustafa HuyukÎncă nu există evaluări
- 4 Liaison ChimiqueDocument8 pagini4 Liaison ChimiqueAzumi ChanÎncă nu există evaluări
- Les moléculesDocument4 paginiLes moléculesralph.b.chedidÎncă nu există evaluări
- Examen Finaux Et Corrigé - 230516 - 232706Document37 paginiExamen Finaux Et Corrigé - 230516 - 232706bensalimyoussef94Încă nu există evaluări
- DS05Document11 paginiDS05baatoutmbÎncă nu există evaluări
- Chimie Première LDocument49 paginiChimie Première LRichard GotorayeÎncă nu există evaluări
- Seconde CONTROLE N°2 (1h)Document2 paginiSeconde CONTROLE N°2 (1h)FallouÎncă nu există evaluări
- Atomistique 01Document36 paginiAtomistique 01Joan Jean Jephthé BaboÎncă nu există evaluări
- 2009 Examen de Chimie Mai SolveDocument7 pagini2009 Examen de Chimie Mai SolvekarimovÎncă nu există evaluări
- 4454863Document160 pagini4454863AbdelOuahidSenhadjiÎncă nu există evaluări
- Resume Chimie ConcoursDocument24 paginiResume Chimie ConcoursAdora FrailletÎncă nu există evaluări
- DS6 SolDocument6 paginiDS6 SolYahya El GueddariÎncă nu există evaluări
- Concours 2013 (+sol.) Proposition EPSTTDocument19 paginiConcours 2013 (+sol.) Proposition EPSTTNidal BestÎncă nu există evaluări
- MP CHIMIE CCP 1 2005.extrait PDFDocument4 paginiMP CHIMIE CCP 1 2005.extrait PDFkmeriemÎncă nu există evaluări
- Travaux Dirigés Chapitre 1 - BDocument9 paginiTravaux Dirigés Chapitre 1 - BaloulagairmaineÎncă nu există evaluări
- TPC11 CorrigeDocument6 paginiTPC11 CorrigeYounes BenjouÎncă nu există evaluări
- Ely Mahmoud RapportDocument8 paginiEly Mahmoud RapportAbdellahi TaherÎncă nu există evaluări
- Corrig de E1 Chimie 3eDocument2 paginiCorrig de E1 Chimie 3ePaul Eric EkoaÎncă nu există evaluări
- Architecture Moléculaire Et StéréochimieDocument5 paginiArchitecture Moléculaire Et StéréochimielucatelliÎncă nu există evaluări
- Série 4 SolutionDocument9 paginiSérie 4 SolutionAtg YounesÎncă nu există evaluări
- 2013 CtresEtrangers Exo2 Correction Esters 8ptsDocument3 pagini2013 CtresEtrangers Exo2 Correction Esters 8ptsHaman Bello OumarouÎncă nu există evaluări
- Chimie Premiere CdeDocument30 paginiChimie Premiere CdeHans René Nkwinga NgokoÎncă nu există evaluări
- EVALUATION BLANCHE 3 jeieeDocument9 paginiEVALUATION BLANCHE 3 jeieendd2vcp4ptÎncă nu există evaluări
- MP Chimie CCP 1 2007.extraitDocument4 paginiMP Chimie CCP 1 2007.extraitkmeriemÎncă nu există evaluări
- Chapitre IDocument9 paginiChapitre ISamira MossaddikÎncă nu există evaluări
- Document Sans TitreDocument3 paginiDocument Sans Titreayoub zineÎncă nu există evaluări
- Intro Chimie OrganiqueDocument46 paginiIntro Chimie OrganiqueSam H. SalehÎncă nu există evaluări
- Série C3 Liaisons Chimiques 2nde S WWW - Axloutoth.snDocument2 paginiSérie C3 Liaisons Chimiques 2nde S WWW - Axloutoth.snDaouda FallÎncă nu există evaluări
- TD Liaisons 2021 LSLL WahabDiopDocument1 paginăTD Liaisons 2021 LSLL WahabDiopNdiasse FamÎncă nu există evaluări
- ALCENESDocument8 paginiALCENESHadjer zitÎncă nu există evaluări
- Chimie Organique Et Chimie Des Solutions AqueusesDocument10 paginiChimie Organique Et Chimie Des Solutions AqueusesbangnhatquangquangÎncă nu există evaluări
- Corrigé Du DM Physique SecondeDocument4 paginiCorrigé Du DM Physique SecondeSofiane Km100% (1)
- Alcenes Et AlcynesDocument8 paginiAlcenes Et AlcynesMohamed Aly SawadogoÎncă nu există evaluări
- ExtraitDocument8 paginiExtraitLewis HamiltonÎncă nu există evaluări
- Conductimetrie Ex4Document3 paginiConductimetrie Ex4Gueye OusmaneÎncă nu există evaluări
- Serie 3correctionDocument7 paginiSerie 3correctionkiritosunny30100% (1)
- Ex Chap7 CorrectionDocument20 paginiEx Chap7 Correctionvg2thrr8rfÎncă nu există evaluări
- Cours Equation Bilan (Mars 2023)Document7 paginiCours Equation Bilan (Mars 2023)riwanlonguetÎncă nu există evaluări
- 1er Cours de Chimie OrganiqueDocument6 pagini1er Cours de Chimie Organiquesalah100% (1)
- PC1 Chimie Introduction EssentielDocument2 paginiPC1 Chimie Introduction EssentielMAX YTBÎncă nu există evaluări
- C 00 XP 1 CDocument13 paginiC 00 XP 1 CMihnea GamanÎncă nu există evaluări
- Solution TD2 Part2.ppsxDocument32 paginiSolution TD2 Part2.ppsxMassinissa MakhloufiÎncă nu există evaluări
- Chimie1an31 OrganiqueDocument153 paginiChimie1an31 Organiquejack rousouÎncă nu există evaluări
- Fiche Methode Modele LewisDocument23 paginiFiche Methode Modele LewisEl Mehdi AkhatarÎncă nu există evaluări
- 18chi3e c3Document4 pagini18chi3e c3fateh bouzianeÎncă nu există evaluări
- Exercice I: Chimie I: Structure de La Matière Série N°4 TDDocument2 paginiExercice I: Chimie I: Structure de La Matière Série N°4 TDnouhad.chan23Încă nu există evaluări
- L'électrochimieDocument46 paginiL'électrochimieSeçil ÖzdemirÎncă nu există evaluări
- 1ER PC CHAP 04 ExercicesDocument66 pagini1ER PC CHAP 04 Exerciceskady cdÎncă nu există evaluări
- Correction TD Chimie Générale Fiche1Document6 paginiCorrection TD Chimie Générale Fiche1comboudriÎncă nu există evaluări
- DS4 CorrigeDocument16 paginiDS4 CorrigeNadia Ait AhmedÎncă nu există evaluări
- Exercices Stat InferentielleDocument11 paginiExercices Stat InferentiellesjaubertÎncă nu există evaluări
- Toc 001Document4 paginiToc 001hhedfiÎncă nu există evaluări
- Cel 36Document84 paginiCel 36hhedfiÎncă nu există evaluări
- Unites ConcentrationDocument3 paginiUnites ConcentrationhhedfiÎncă nu există evaluări
- Identification D'une Loi de Comportement Biaxiale en Grandes Déformations Pour Des Tricots Élas-TomériquesDocument7 paginiIdentification D'une Loi de Comportement Biaxiale en Grandes Déformations Pour Des Tricots Élas-TomériqueshhedfiÎncă nu există evaluări
- Bts InnovationtextileDocument146 paginiBts InnovationtextilehhedfiÎncă nu există evaluări
- CODEDocument38 paginiCODEAs MaÎncă nu există evaluări
- A 6de2qts2Document8 paginiA 6de2qts2hhedfiÎncă nu există evaluări
- Apprends LaTeXDocument209 paginiApprends LaTeXCygne NoirÎncă nu există evaluări
- 1 MMCD CoursDocument0 pagini1 MMCD CourshhedfiÎncă nu există evaluări
- Unites ConcentrationDocument3 paginiUnites ConcentrationhhedfiÎncă nu există evaluări
- Avant ProposDocument2 paginiAvant ProposhhedfiÎncă nu există evaluări
- 1S D03Document2 pagini1S D03hhedfiÎncă nu există evaluări
- Cours+ +Informatique+Chap+1+Tableur+ +Bac+Economie++Gestion+ (2008 2009) +Mr+GHAITHDocument13 paginiCours+ +Informatique+Chap+1+Tableur+ +Bac+Economie++Gestion+ (2008 2009) +Mr+GHAITHhhedfiÎncă nu există evaluări
- 02 Le Second DegreDocument21 pagini02 Le Second DegreEmma SamÎncă nu există evaluări
- Coopération Euro-Méditerranéenne de La Tunisie, Dans Le Domaine de La RechercheDocument1 paginăCoopération Euro-Méditerranéenne de La Tunisie, Dans Le Domaine de La RecherchehhedfiÎncă nu există evaluări
- Cours ProbaDocument32 paginiCours ProbaLegobbobÎncă nu există evaluări
- Exercice SDocument21 paginiExercice ShhedfiÎncă nu există evaluări
- Cours 2Document26 paginiCours 2Ghani BoulghebÎncă nu există evaluări
- Poly SVTEDocument13 paginiPoly SVTEhhedfiÎncă nu există evaluări
- Exo Mat 482009Document32 paginiExo Mat 482009hhedfi0% (1)
- Feuille TageDocument30 paginiFeuille TageBachar BoumehdiÎncă nu există evaluări
- Poly Exo PSDocument12 paginiPoly Exo PShhedfiÎncă nu există evaluări
- (A. - Bouziad, - J. - Calbrix) Théorie de La Mesure Et de L'intégrationDocument58 pagini(A. - Bouziad, - J. - Calbrix) Théorie de La Mesure Et de L'intégrationhhedfiÎncă nu există evaluări
- Cours ProbaDocument32 paginiCours ProbaLegobbobÎncă nu există evaluări
- Exercice SDocument21 paginiExercice ShhedfiÎncă nu există evaluări
- 2009 Roots Rennes - PrintDocument30 pagini2009 Roots Rennes - PrinthhedfiÎncă nu există evaluări
- 50 Problèmes D'analyseDocument233 pagini50 Problèmes D'analysehhedfiÎncă nu există evaluări
- Whirlpool Awe 2214 (ET)Document26 paginiWhirlpool Awe 2214 (ET)flenkyÎncă nu există evaluări
- 2016Document68 pagini2016Lee Wai Leong50% (2)
- Dossier Rayon XDocument12 paginiDossier Rayon XJesus AcuñaÎncă nu există evaluări
- ELE1409 H20 Cours - 1 ExercicesDocument6 paginiELE1409 H20 Cours - 1 Exercicesjeefmatanga5Încă nu există evaluări
- TD1 Ordonancement PDFDocument2 paginiTD1 Ordonancement PDFEl Biach Fatimazhra50% (2)
- Num BDAN 2011 Cours Complet 20111128Document84 paginiNum BDAN 2011 Cours Complet 20111128jmmermetÎncă nu există evaluări
- Les Appareils de MesureDocument13 paginiLes Appareils de Mesuresalhi mohamedÎncă nu există evaluări
- 3 Livret Malt 2018 CompressDocument21 pagini3 Livret Malt 2018 CompressLOWE JOUONANG NARCISSEÎncă nu există evaluări
- STEP 7 - de S5 A S7 PDFDocument148 paginiSTEP 7 - de S5 A S7 PDFRata IonÎncă nu există evaluări
- TP 2 AutomatismeDocument10 paginiTP 2 AutomatismeKawtar FelkiÎncă nu există evaluări
- S1 - TD3 Sur Les Circuits en AC - 2021-2022Document2 paginiS1 - TD3 Sur Les Circuits en AC - 2021-2022OuattÎncă nu există evaluări
- RKN Régulateur Documentation Sommaire PDFDocument4 paginiRKN Régulateur Documentation Sommaire PDFe-genieclimatique.comÎncă nu există evaluări
- Notice Sepam Serie80 Fonctions FR PDFDocument324 paginiNotice Sepam Serie80 Fonctions FR PDFOmar UrreaÎncă nu există evaluări
- Boss RC 50 FrenchDocument108 paginiBoss RC 50 FrenchSebastien RibyÎncă nu există evaluări
- TD Chapitre 3 Traitement Min PDFDocument5 paginiTD Chapitre 3 Traitement Min PDFFrancolain AndríÎncă nu există evaluări
- 2265-BD-001 RevP0Document4 pagini2265-BD-001 RevP0Salvador Fayssal100% (1)
- Offre de Formation BTS CamerounDocument453 paginiOffre de Formation BTS CamerounGeorges Le Mignon OleÎncă nu există evaluări
- Initiation À La Conception RobotiqueDocument24 paginiInitiation À La Conception RobotiqueOucema AbÎncă nu există evaluări
- TP1 3L EltDocument5 paginiTP1 3L EltReggani MbarekÎncă nu există evaluări
- Série: Détection Stable Améliorée Capteur de Déplacement À LaserDocument20 paginiSérie: Détection Stable Améliorée Capteur de Déplacement À LasercampolucciÎncă nu există evaluări
- TP CapteurDocument4 paginiTP CapteurZehaf AboubakerÎncă nu există evaluări
- 2FI 15-16 RatDocument4 pagini2FI 15-16 RatEl GhafraouiÎncă nu există evaluări
- Disjoncteur DifférentielDocument5 paginiDisjoncteur DifférentielCocoÎncă nu există evaluări
- Cours Asservissement L2Document81 paginiCours Asservissement L2Naoufel FaresÎncă nu există evaluări
- Cours Dimenssionement Éclairage + PublicDocument62 paginiCours Dimenssionement Éclairage + PublicElmondo KkffÎncă nu există evaluări
- 110 FM Puissances Electriques en Courant TriphaseDocument2 pagini110 FM Puissances Electriques en Courant TriphaseYounis MolayÎncă nu există evaluări
- Tr22ah PDFDocument6 paginiTr22ah PDFkhakadamÎncă nu există evaluări
- M10 Analyse de Circuits À Semi ConducteursDocument178 paginiM10 Analyse de Circuits À Semi Conducteursaden.91Încă nu există evaluări