Documente Academic
Documente Profesional
Documente Cultură
Gouesnard, J.P. Reaction of Sodium Nitrite On Variou
Încărcat de
pmcmenamy010 evaluări0% au considerat acest document util (0 voturi)
52 vizualizări7 paginiTitlu original
Gouesnard, J.P.; Reaction of Sodium Nitrite on Variou
Drepturi de autor
© Attribution Non-Commercial (BY-NC)
Formate disponibile
PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Attribution Non-Commercial (BY-NC)
Formate disponibile
Descărcați ca PDF, TXT sau citiți online pe Scribd
0 evaluări0% au considerat acest document util (0 voturi)
52 vizualizări7 paginiGouesnard, J.P. Reaction of Sodium Nitrite On Variou
Încărcat de
pmcmenamy01Drepturi de autor:
Attribution Non-Commercial (BY-NC)
Formate disponibile
Descărcați ca PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 7
88
Ractivit du nitrite de sodium. V. Action
sur les amino-acides, peptides et protines
Manuscrit reu le 13-06, accept le 02-12- 1988
.JEAN-PAUL GOUESNARD
1
L'action du nitrite de sodium sur divers amino-acides a t rexamine dans des conditions voisines de celles du milieu biologique. La RMN
13
C
met en vidence l'existence de cyclisations intramolculaires et formation de cycles 5 atomes avec l'ornithine, la citrulline et l'arginine. La raction
de la cystine montre l'ouverture du pont disulfure tandis que la cystine conduit l'obtention de carboxy-thiiranne et d' acide sulfo-3 lactique.
L'hydrolyse des liaisons amide de l'asparagine et de la glutamine est complte tandis que les peptides tudis - carnosine et aspartame- ne montrent
aucune hydrolyse de la liaison peptidique. Cependant, avec le glutathion (y-Glu-Cys-Gly), la premire dsamination induit une coupure de la liaison
peptidique Glu-Cys et une cyclisation avec formation de lactone. Une seconde dsamination a lieu sur le rsidu cystinyle libr et permet la formation
d'un thiiranne par cyclisation intramolculaire avec la fonction thiol. L'obtention du thiiranne est galement observe avec le glutathion oxyd qui
prsente un pont disulfure. Enfin la formation de nitrosamines est dtecte par RMN
15
N lors de la raction du nitrite de sodium avec deux produits
commerciaux (( grand public .
Summary. - The action of sodium . on various amino-acids
was re-examined in conditions approximating to a biological medium.
13
C-NMR provides evidence of the existence of intramolecular ri ng
closures and the formation of 5-membered ri ngs with ornithine,. citrulline
and arginine. The reaction of cystine shows the opening of the sulphur
bridges, whereas cysteine leads to the formation of carboxy-thiiran and
3-sulpho-lactic acid. The hydrolysis of the amide bonds of asparagine and
glutamine is complete whereas the peptides studied - carnosine and
aspartam - do not undergo hydrolysis of the peptide linkage. However,
the first deamination of glutathion (y-Giu-Cys-Giy) induces the peptide
link to be broken and a cyclization with the formation of lactone to occur.
A second deamination takes place on the cysteinyl residue released and
allows the formation of a thiiran by intramolecular cyclization with the
thiol group. The formation of thiiran was also observed with oxidized
glutathion which hasan S-S bridge. Finally, the formation of ni t rosami nes
was detected by
15
N-NMR during the reaction of sodium nitrite with two
commercial products available to the general public.
L' action du nitrite de sodium sur les constituants des aliments
et de la viande en particulier prsente un grand intrt puisque
ct de son pouvoir bactriostatique, il peut conduire la
formation de nitrosamines cancrognes. Diffrentes tentatives
ont t 1<&11<<pour tudier les interactions du nitrite avec des
protines purifies (1). Cependant les difficults rencontres,
souvent lies la taille des protines, ont conduit nombre
d'auteurs s' intresser aux peptides ou leurs drivs (2) ainsi
qu'aux acides ami ns pris sparment (3). Dans ce dernier
cas, les conditions opratoires employes (concentration, pH,
temprature, acide utilis ... ) varient souvent considrablement
d'une exprience l'autre et rendent les rsultats difficilement
comparables.
Aussi cette tude - acides amins + nitrite de sodium -
a-t-elle t reprise dans des conditions exprimedtales identiques
pour tous les acides amins envisags : ces conditions restent si
possible les plus proches de celles du milieu biologique.
A ct des acides amins, quelques composs d'intrt biologi-
que, prsents dans le tissu musculaire (cratine, carnitine et
carnosine) ou utiliss dans l'alimentation (aspartame et bouillon
de buf commercial) ont galement t envisags. Une attention
particulire a t porte au glutathion. Ce tripeptide (L-y-
glutamyl-L-cystinyl-glycine) est un produit naturel inoffensi f
prsent en quantits importantes dans de nombreux tissus ani-
maux, notamment le foie. Il joue un rle de coenzyme dans divers
systmes enzymatiques en tant qu'agent rducteur du systme
NADP-NADPH et est galement utilis comme antioxydant dans
les produits pharmaceutiques (4). Son action anticancrogne a
t reporte (5) et attribue au pigeage de radicaux libres (6).
Bien que l'action du nitrite sur ce peptide ait t envisage (7),
les produits forms n'ont pas t identifis l'exception de l'acide
a-hydroxyglutarique mis en vidence lors de l'hydrolyse du
glutathion dsamin.
Lors de la raction du nitrite de sodium en solution aqueuse
sur le glutathion oxyd ou rduit, la RMN
13
C fait apparatre
des mlanges complexes pour lesquels se pose le problme de
l' identification des produits forms. Il tait donc indispensable
d'envisager a u pralable la raction du nitri te sur les amino-acides
constitutifs pris sparment.
La RMN
1 3
C est une sonde bien adapte pour suivre les
transformations ventuelles des acides amins et identifier les
produits obtenus par raction du nitrite de sodium. Elle a permis
en particulier de montrer la ralit de certaines cyclisations
1111&1<1<<11&11<, suivant une hypothse avance mais non vri-
fie (3), entre le carbocation primaire form par la nitrosation
d'une fonction amine primaire et un deuxime centre ractif de
la molcule. Toutefois, avec des milieux complexes comme le
bouillon de buf, elle s'est avre inefficace et nous avons prfr
avoir recours la RMN
15
N ; dans ce cas, s'il n'est pas possible
d'identifier tous les composs forms, la RMN
15
N permet la
mise en vidence de nitrosamines.
1. Action sur les acides amins
15 acides amins, y compris la carnitine et la cratine ont t
examins. Les produits forms et leurs dplacements chimiques
13
C sont indiqus dans les tableaux 1 et 2. Le tableau 1 regroupe
en fonction de la longueur de chane, les
13
C des composs
linaires et le tableau 2 ceux des composs htrocycliques obte-
nus.
La raction du nitrite de sodium aqueux sur les amino-acides
dans des conditions voisines de celles du mjlieu biologique
(pH = 4-5) conduit la dsamination nitreuse bien connue et
utilise pour doser les groupements amines primaires (estimation
de Van Slyke). Cependant diffrents cas peuvent se prsenter
suivant la substitution et la longueur de la chane carbone.
a) Les acides-amins tudis possdent tous une chane latrale
fonctionnelle l'exception de la glycine 1, de l'acide y-amino
butyrique (GABA)4 et de son ester mtbyl 5. Ces deux derniers
composs opposs au nitrite de sodi um aqueux conduisent
respectivement l'hydroxyacide 4a et l'hydroxyester Sa. Le
compos 4a se lactonise spontanment et le spectre
13
C montre
l'quilibre classique entre forme cyclique 4b et forme ouverte
4a. A ct du compos 5a, apparat un produit minoritaire
l. Laboratoire de RMN et Ractivit Chimique, U.A. C.N.R.S. 472, 2, rue de la Houssinire, 44072 Nantes Cedex, France.
GOUESNARD J.-P. 89
TABLEAU 1
Dplacemenrs chimiques IJC des produirs linaires forms lors de la raction du nirrite de sodium sur divers amino-acides
Ami no-acide A.A.
RI
de dpart modifi
1 Gly la H
2 Asp (a) 2a OH
3 Cys 3a OH
4GABA 4a H
5 GABA-OMe 5a H
6 Glu (b) 6a OH
7a OH
7 Oin 7b NH2
7c OH
8 Arg 8a OH
9 Citr 9a OH
l Oa OH
10 Lys lOb NH2
lOc OH
11 Carnitine 11 H
12 Cratine 12 H
(a) Asn 2' donne un spectre identique Asp 2
(b) Gln 6' donne un spectre identique Glu 6
n
0
1
1
2
2
2
3
3
3
3
3
4
4
4
(c)
0
R2- (CH2)n- CH(Rl)- COOH
2 1
R2 % Cl C2 Ca/R2 CR2 .
OH lOO 178.0 59.8
COOH 100 178.2 67.7 39.2 175.6
S03H 40 176.9 67.3 53.5
OH 30 182.2 30.0 60.1
OH 80 176.1 29.5 60.0
COOH 0 179.1 70.0 30.2 179.1
NH2 80 178.0 69.2 38.0
OH 20 173.0 52.7 59.5
OH . 25 69.9 60.1
NH-C= NH 75 178.9 70.0 39.6 155.3
NH2
NH-C=O 20 179.4 70.5 38.4 159.9
NH2
NH2 80 178.4 69.7 38.0
OH 20 173.0 53.1 60.1
OH lOO 179.0 70.1 60.1
N-CH3
+
0 173.9 39.6 68.3 52.6
N-C=NH
\
0 172.5 52.0 155.7
CH3 NH2 35.5
(c) n = - CH
2
-CH(OH)-: les attributions ont t faites grce aux couplages
1
J I4N-13C = 3.3 et 2.5 Hz et
3
J I4N-13C = 1,5 Hz (8)
- 20%- de structure cyclique d une hydrolyse
de la fonction ester.
b) Une raction analogue conduisant un hydroxydiacide,
lui-mme pouvant se lactoniser, est attendue avec l' acide
glutamiqu 6 et la RMN
13
C montre que la lactone 6b se forme
quantitativement. Toutefois le chauffage pendant 24 heures
du mlange ractionnel fait apparatre 30-40 %de forme linaire
6a. La glutamine 6' manifeste un comportement similaire et
l'obtention de la lactone 6b est en accord avec l'hydrolyse de la
fonction amide. L'action du NaNO2sur les acides glutamiques
D ou L permet d'obtenir des lactones optiquement actives qui
sont le point de dpart pour la synthse de composs biologiques
(9).
L' acide aspartique 2 et l'asparagine 2' <<1<11<11 au mme
hydroxydiacide 2a mettant en vidence l'hydrolyse de la fonction
amide de 2'.
c) Les acides-amins possdant une seconde fonction amine
sont susceptibles de prsenter un comportement diffrent puis-
qu'ils prsentent deux fonctions ractives.
* Avec la lysine 10, la dsamination de la fonction a-NH2 est
plus rapide que celle du NH2 situ en bout de chane et un
mlange 80/20 de lOa et lOb est observ lorsque la raction est
effectue mole mole. Trois quivalents de nitrite conduisent
une dsamination complte avec formation du dihydroxyacide
lOc.
* L'ornithine 7 possde galement deux fonctions amines et
un rsultat similaire est obtenu (7af7b 80/20) lorsque le nitrite de
sodium ragit de faon quimolculaire. Cependant un excs de
nitrite (3 fois) permet de dtecter dans le mlange ractionnel
3 composs: 7a 25 %, 7c 25 % et 7d 50%. Le produit 7b est
sans doute galement prsent mais en trop faible quantit pour
tre mis en vidence.
Une structure cyclique (acide ttrahydrofurannecarboxylique-
2) a t attribue au compos 7d grce aux dplacements
chimiques
13
C. La formation de cet acide 7d pourrait s'expliquer
sur la base d'une hypothse spculative propose par Bonnett (3)
pour lequel le carbocation primaire, form lors de la dsamina-
tion, serait susceptible de ragir de faon intramolculaire.
-
CH
2
+ NH
3
7b
+ -
CH
2
\
-
7d
J
7c
+
-
coo
Schma 1
90
BULLETIN DE LA SOC1T CHIMIQUE DE FRANCE 1989 N 1
TABLEAU 2
Dplacements chimiques
13
C des hrocyc/es forms lors de la raction du nitrite de sodium aec diuers amino-acides
Htrocycle
%
form
3b s 60
4b 70
\
Sb 20
6b 100
7d 50
8b 25
N
1
HN=C-NH2
9b 80
N
1
Il _semble donc que cette cyclisation soit effective sur l' oxygne
du OH. Par contre, il n'y a pas de cyclisation entre le carbocation
et l'azote qui se trouve proton au pH utilis. De plus, la
cyclisation ne se fait que pour l'obtention de cycle 5 atomes
puisque la lysine ne conduit aucun compos cyclique.
* La citrulline 9 est un acide amin possdant une fonction
ure en bout de chaine. L'action du nitrite de sodium provoque
la dsamination de la fonction amine primaire et l'alcool 9a est
obtenu en petite quantit 20 %. Un second produit dont les
dplacements chimiques
13
C sont proches de ceux de la proline
est galement prsent environ 80 %. Ce compos majoritaire,
la N-carbamoyl-proline 9b serait d (voir schma de l'ornithine)
la cyclisation intramolculaire du carbocation intermdiaire
avec l'azote de la fonction ure comme l'hypothse en a t
avance (3). Contrairement au rsultat observ pH = 2 en
prsence d'acide sulfurique, aucune nitrosation de la fonction
ure n'est dtecte (10).
* Le produit majoritaire 70-80 % obtenu avec l' arginine 8 est
l'hydroxyacide Sa. Les spectres
13
C font galement apparatre un
second compos auquel la structure de la N-amidino-proline SL
pourrait tre attribue par analogie avec la citrulline.
d) La nitrosation de la cystine 3 et la formation de cystine
par l'intermdiaire de la S-nitroso-cystine, ont t abondamment
tudies (11, 12, 13). La prparation avec un rendement de
55 % de l'acide pithio-2,3 propionique (carboxythiiranne) 3b a
galement t dcrite sans prciser les produits secondaires
forms (14). Dans des conditions exprimentales similaires 3
quivalents de NaN02 et pH = 5 -,la RMN
13
C nous permet
.
Cl C2 C3 C4 C5
176.2 30.6 22.4
182.2 27.1 20.7 69.8
.
175.7 77.9 24.5 26.3 180.1
179.4 76.8 28.7 23.4 67.2
178.9 60.3 30.8 22.6
178.7 60.0 29.1 22.3 45.2
de dtecter. au bout de 6 heures, dans le mlange ractionnel
environ 60 % de l'acide cyclique 3b et un second compos
3a
13
C = 53,5: 67,3 et 176,9 ppm) 40 %. Abandonn 4 jours
temprature ambiante, le mlange fait apparatre une inversion
des pourcentages ce qui suggre que 3a se forme, au moins en
partie, partir du thiiranne 3b et rsulte d'une dsamination de
la cystine. Le mcanisme de formation du thiiranne 3b a t
discut et attribu une N-attaque (14).
NH
2
CH
2
- CH-
3a
Schma 2
-
Cl N = N
CH
2
- CH -
3b
L'identification de l'acide sulfo-3 lactique 3a a t ralise par
comparaison des dplacements chimiques
13
C. Le pic 67,3 ppm
suggre un CH d'acide lactique par analogie avec la form par
la dsamination de Asp. La raie de rsonance 53,5 ppm est
attribue au CH2 voisin du groupe sulfonyle grce l'tude
effectue sur la nitrosation des N-actylcystine et N-actylcys-
tine : dans ce cas un acide N-actylcystique est mis en vidence
et compar l'acide cystique (15).
H03S-CH2 CH2- CH(
51 ,3 50,6 171,1 53,5 67,3 176,9
acide cystique 3a
GOUESNARD J.-P. 91
Les diffrences de dplacement chimique observes sur le CH2
et le CH et qui sont dues au remplacement de NH3 + par OH se
comparent favorablement aux rsultats de la littrature (16). Il
faut galement noter que la raction de l'acide cystique avec
NaN02 donne un compos X dont les paramtres
13
C sont
identiques 3a.
Compos X CH2 CooH
pH = 1 7
'
65,9 52,55 174,2
3,0 66,8 53,2 175,97
4,0 67,26 53,58 176,77
5,0 67,26 53,52 176,94
7,0 67,40 53,70 176,96
La cystine 3' est trs peu soluble dans l'eau (0,1 g/L 298 K)
et l'action du nitrite de sodium sur cet amino-acide ne semble
pas avoir t tudie. Le spectre
13
C obtenu montre trois raies
de rsonance (22,2-30,5-175,9 ppm) attribuables la formation
du carboxy-thiiranne 3b (tableau 2). Bien que 3b soit prsent en
faible concentration, ce rsultat indique que le nitrite en solution
aqueuse est susceptible de couper le pont disulfure : un rsultat
similaire a dj t report avec la N-actylcystine ( 15).
e) Dans les conditions que nous avons utilises (voir partie
exprimentale), la carnitine 11 et la cratine 12 ne ragissent pas
avec NaN0
2
et les dplacements chimiques
13
C correspondent
aux deux composs de dpart. Cependant l'action du nitrite de
sodium sur 12 en milieu trs acide (HCl 25 %) a t reporte
et conduit la formation de N-nitroso sarcosine avec un
rendement de 23 % (17).
L'intrt de cette tude sur les amino-acides ralise dans des
conditions comparables celles du milieu biologique a t de
montrer la ralit des cyclisations entre le carbocation et un
htroatome de la molcule. De telles cyclisations avaient dj
t reportes mais les rendements en composs cycliques taient
trs faibles (18).
De plus, l'identification des composs obtenus doit faciliter
l'tude de l'interaction du nitrite avec des produits plus complexes
comme le glutathion (L-y-glutamyl-L-cystinyl-glycine) (III).
II. Action sur les peptides
Le plus simple des peptides-Gly-Gly-13 subit la dsamination
lors de l'action du nitrite de sodium. Le mme rsultat est observ
avec la carnosine 14, dipeptide prsent
naturellement dans les muscles de nombreux animaux. Les
dplacements chimiques
13
C des produits obtenus sont les
suivants :
59,5 137,1 41,0 174,3
13a
Imidazolyl-4-CH
2
CH2 NH-CH
56,3 36,7 172,2 25,3 173,8
51,7
14a
Le troisime dipeptide tudi est l'aspartame qui est l'ester
mthylique de la N-L-a-aspartyl-L-phnylalanine 15. Cet dulco-
rant de synthse possde un pouvoir sucrant 200 fois suprieur
celui du saccharose et est utilis comme suci. )) dans les
rgimes hypocaloriques et hypoglucidiques ( 19). Depuis sa dcou-
verte en 1965, ce compos a suscit de nombreuses recherches
qui tmoignent de son grand intrt scientifique et industriel :
sur une priode de 20 ans, les Chemical Abstracts recensent
environ 500 publications, 250 brevets et 60 mises au point dont,
pour la seule anne 1985, 110 articles, 50 brevets et 27 mises au
point.
Les dplacements chimiques
13
C de l'aspartame sont les
suivants (solvant H20, pH = 6,0) :
CH(NH2)- NH - C6Hs)- 15
34,7} 2CH2
35,5
127,1} CH(C6Hs)
127,5
49,1 CH(Asp) 134,7 C(C6Hs)
51,4 CH3 167,9
52,9 CH(phe) 171 ,4
174,1
Aprs addition de nitrite de sodium mole mole et 8 jours de
raction, le spectre
13
C du compos 15a obtenu apparat comme
suit (pH = 4,5) :
CH
2
(phe)
(Asp)
51,4 CH3
} CH(phe)
*52 2 ,
CH(Asp)
67,3
127, 1
CH(C6Hs)
127,6
127,65
134,7 }
*
134 8
C(C6Hs)
,
171,8
174,2 3
176,7
Les raies de rsonance 67 ppm confirment la dsamination
de la molcule et la formation d' alcool. Le ddoublement observ
sur un certain nombre de raies est en accord avec une racmisation
du compos et formation de deux diastroisomres dtectables en
RMN
13
C (40-60 %). L'astrisque indique l'isomre majoritaire
(L- Lou D-L).
Dans les trois cas envisags, l'action du NaN02 se manifeste
par la substitution du NH2 par une fonction alcool mais ne
provoque pas d'hydrolyse de la liaison amide comme cela est
observ avec l'asparagine 2' et la glutamine 6' .
III. Raction du glutathion
Ce peptide peut exister sous les formes rduite GSH 16 et
oxyde GSSG 16' (schmas 3 et 4) qui ont fait l'objet de diverses
tudes par RMN
13
C (20) et
15
N (21). Sous sa forme rduite, il
prsente deux fonctions ractives NH2 et SH mais la fonction
NH2 seule subsiste deux fois dans la molcule de glutathion
oxyd.
D'autre part, peu de choses taient connues sur la raction du
nitrite de sodium sur les ponts disulfure et en particulier sur la
cystine et ses drivs. Oae et coll. (22) ont tudi l'action de N204
sur des disulfures aromatiques dissymtriques mais avec des
conditions opratoires trs diffrentes (CC14 : 0 de celles
utilises ici. Cependant l'tude effectue sur la cystine (cf. Id)
et la N actyl-cystine (15) montre que la liaison disulfure est
susceptible de s'ouvrir lors de la raction de NaN02 : dans ces
conditions, une molcule de GSSG 16' pourra prsenter 4 sites
ractifs.
A. GSSG 16'. Dans un premier temps, nous avons examin un
mlange aqueux (pH = 4,5) contenant autant de nitrite que de
fonction NH2 ractive soit un rapport molaire 2/ 1. Le spectre
13
C
obtenu A, est trs complexe et les produits prsents difficilement
identifiables. Cependant, l' addition au bout de 5 jours d'une
quantit quivalente de NaN02 supplmentaire ne laisse plus
subsister que deux systmes aisment analysables par comparai-
son avec les produits obtenus partir des amino-acides ; l' un
d'eux est la lactone 6b forme par le rsidu glutamyle et l'autre
correspond un thiiranne 16c d au rsidu cystinyl-glycine. Il
devenait alors possible de mettre en vidence dans le spectre
initial A, ct de ces composs 6b et 16c prcdemment
92
BULLETIN DE LA SOCIT CHIMIQUE DE FRANCE 1989 1
identifis, le peptide de dpart GSSG 16' 55 % et le disulfure
du peptide Cys-Gly (tabl. 3). Les dplacements chimiques
13
C de
ces composs sont indiqus dans le schma 4.
Pour expliquer la formation de ces diffrents produits, le
mcanisme suivant pourrait tre propos (schma 3). D'abord,
une attaque du NaN02 sur les fonctions NH des rsidus
glutamyle; le carbocation form se cyclise alors avec l'oxygne
du carbonyle ce qui entrane la rupture de la liaison peptidique
avec formation de lactone 6b et du disulfure 16b. La nouvelle
fonction NH
2
prsente dans 16b ragit son tour sur le nitrite
et une rupture de la liaison disulfure suivie d'une cyclisation
expliquerait l'obtention de thiiranne 16c comme cela a t montr
pour la cystine.
H
2
N- NH NH-
16'
NaN0
2
o
c- NH- c- NH-
. \
-
6b
-
6b
-
-
H
2
N- NH -
16b
NaN02
s
16c
3
'
- -
N
16d H
A l'appui de ce mcanisme, on peut avancer les arguments
suivants:
Le glutathion est un compos naturel et stable en milieu aqueux
dans une gamme de pH variant de 0 13 (20) et une hydrolyse
importante de la liaison Glu-Cys est exclure. De plus, l'absence
de raie de rsonance
13
C 59-60 ppm montre que la liaison
Cys-Gly n'est pas ouverte : dans le cas contraire, en effet, la
glycine libre subirait une dsamination rapide conduisant
l'acide glycolique (hydroxyactique) caractris par un dplace-
ment chimique
13
C voisin de 60 ppm (cf. la tableau 1).
Dans les conditions douces utilises, la coupure de la liaison
peptidique est donc attribuable la prsence du nitrite de sodium.
Dans une note spculative, Bonnett (3) avait avanc l'hypothse
que le carbocation primaire, form lors de la nitrosation d'une
fonction amine primaire sur une chane latrale de protine,
pouvait ragir de faon intramolculaire avec une liaison peptidi-
que voisine. La raction du nitrite de sodium avec les amino-acides
a montr que de telles cyclisations se produisaient effectivement
pour donner des cycles 5 atomes et ce travail apporte pour la
premire fois une confirmation trs nette cette hypothse dans
le cas d'un tripeptide.
Il faut galement remarquer que le nitrite de sodium induit des
ractions en chane avec le glutathion et sans doute aussi avec
les protines. En effet, cette coupure-cyclisation intramolculaire
se traduit par la libration d'une deuxime fonction amine qui
pourra ragir nouveau sur NaNO2. Le nouveau carbocation
form sera susceptible d 'attaquer un autre centre ractif dans la
molcule c'est--dire une liaison peptidique ou une chane latrale
comme le montre l'exemple du glutathion.
Enfin cette tude apporte une confirmation supplmentaire
l'ouverture des ponts disulfure par le nitrite de sodium.
B. Lorsque le nitrite de sodium est oppos au glu ta thion rduit
GSH 16, les deux fonctions amine et thiol sont susceptibles de
ragir. Toutefois la fonction SH a t reporte comme la .plus
ractive vis--vis de la nitrosation (11) (13) et le nitrosothiol
form se dcompose rapidement pour donner le disulfure (12).
Avec un tel mcanisme ractionnel, le principal produit form
serait alors le glutathion oxyd 16' qui pourrait conduire ensuite
aux ractions dcrites ci-contre. Cependant, la raction de 16'
lui-mme( A) est lente puisqu'il en reste des quantits importan-
-
-
-
H2N- NH-
16a
H
2
N- NH-
s
16e
16b
16c
4
GOUESNARD J.-P. 93
tes n'ayant pas ragi ( 50 %). Une N-nitrosation conduisant
la formation de lactone 6b et de Cys-Gly 16a doit galement tre
envisage (schma 4).
Les rsultats obtenus divers pH pour deux concentrations de
nitrite sont rassembls dans le tableau 3. La raction mole mole
de GSH 16 avec NaN02 conduit la formation de glutathion
oxyd 16' 80 %. Avec une quantit double de nitrite, les
pourcentages forms varient avec le pH ractionnel.
Les rsultats obtenus avec GSH 16 dpendent donc de la
concentration en nitrite et du pH. Avec un dfaut de nitrite (1/1),
la premire attaque concerne la fonction thiol et formation de
16' majoritairement. Un rsultat similaire avec la cystine donnant
80 % de cystine a t report (11). La seconde attaque sur la
cystinyl glycine 16a se fera galement sur le thiol donnant le
disulfure (pourcentage double de celui du thiiranne). Dans les
mmes conditions (pH = 3,8) mais avec une quantit double de
nitrite, l'attaque sur l'azote devient prpondrante (14) comme
le montre la formation de lactone 65 % et de thiiranne 40 %.
Cependant si le pH augmente l'attaque du nitrite redevient plus
facile sur l'atome de soufre.
Les problmes deN- ou de S- nitrosation ne semblent pas
encore bien rsolus et diverses interprtations ont t proposes
faisant intervenir des espces nitrosantes diffrentes en fonction
notamment du pH. En milieu acide, l'ion nitrosonium NO+ ou
ses drivs serait form et favoriserait une $-nitrosation tandis
qu'un milieu acide dilu favorise l'acide nitreux non proton et
N
2
0
3
et une attaque sur l'atome d'azote. Cependant, la nitrosa-
tion de la thioure en milieu peu acide ferait intervenir une
attaque du soufre. Ces rsultats ont galement t discuts dans
le cas du lvamisole qui possde ces deux sites de raction (23).
Notons enfin que, dans certains cas, de petites quantits de
l'ordre de 10 % des composs 16d et 16e sont dtectes dans les
spectres
13
C. La formation de ces produits serait attribuable
des ractions accidentelles d'hydrolyse.
l.
.
l
!
. \
'
T
'
\
. .
ppm + 230 + 160
TABLEAU 3
Produits forms par raction du nitrite de sodium sur le glutathion
Produits
GSSG 16' GSH 16
de dpart
Produits pH
4.5 4.5 7.0 3-4-4.5 3.8 6.0 7.0
forms
GSSG 16' 55 - 40 80 35 50 65
Lactone 6b 45 lOO 60 20 65 50 35
Disulfure 16b 30 - 40 10 - 15 25 25 25
Thiiranne 16c 15 100 20 5-10 40 25 10
[Glutathion]/[NaNOz] l/2 l/4 1/4 1/1 1/2 1/2 1/2
mole mole
IV. Etude de produits commerciaux
Deux produits commerciaux grand public )) ont galement
t tests vis--vis du nitrite de sodium : Viandox et bouillon de
buf Maggi. La complexit des spectres
13
C a conduit envisager
la RMN
15
N comme sonde pour dtecter les produits forms.
Avec Viandox, l'addition de Na
15
N02 se traduit par l'appari-
tion de 2 pics en azote 15. Le premier trs fin
+ 228,6 ppm/CH3N02 peut tre attribu sans ambigut au
nitrite en excs. Le second est trs large et centr + 160 ppm
( 10 ppm). Cette zone de dplacements chimiques
15
N qui
varient de + 150 + 170 ppm est caractristique de la fonction
N = 0 des nitrosamines (24) (25). Les raies de rsonance
15
N
sont en gnral trs fines et la largeur observe + 160 ppm est
l'indice de la prsence d'un grand nombre de nitrosamines.
Viandox contiendrait alors de nombreuses amines secondaires :
.
sa composition indique des extraits amins, extrait de viande,
N-N =
Ref.
,
0 120 - 330 ppm
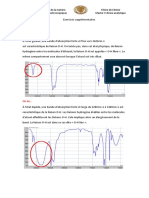
Figure 1. Spectre
15
N du Bouillon de buf Maggi en tablettes et de 50 mg de nitrite de sodium en solution dans 7 mL d' eau.
94 BULLETIN DE LA SOCIT CHIMIQUE DE FRANCE 1989 1
glutamate, etc. Au bout d'un mois, le mlange montre la
disparition totale du nitrite mais les nitrosamines sont toujours
presentes.
Le bouillon de buf commercial possde une . composition
similaire (extrait de viande de buf - 20 % - , extraits amins
vgtaux, extrait de levure, glutamate, etc.). Le spectre
1 5
N du
mlange obtenu par adjonction de 50 mg de Na
15
N02 (voir
fig. 1) montre la prsence de pitrite n'ayant pas ragi
( + 228,1 ppm), de nitrosamines N = [ + 160 ppm et
- 120 ppm] et d'amines [- 330 ppm]. Le pic + 160 ppm est
large (environ 15 ppm) et celui - 120 ppm est encore plus
large (environ 50 ppm). Dans une srie de nitrosamines, les
dplacements chimiques
15
N de l'atome d'azote varient
de - 105 - 155 ppm (24) (25).
Grce la RMN
15
N, cette tude met clairement en vidence
la formation de nitrosamines lors de la mise en contact de
produits alimentaires commerciaux avec le nitrite de sodium.
Celui-ci peut tre prsent naturellement dans l'alimentation
(pinards, betteraves) ou ajout pour son pouvoir bactriostatique
(salaisons) : la salive en contient galement des quantits non
ngligeables (18 mg/jour).
Partie exprimentale
- Des solutions aqueuses quimolculaires en nitrite de sodium et
acide amin sont ralises une concentration de 0,5 M ou 1 M suivant
la solubilit des acides amins. Le pH de la solution est ajust la valeur
dsire (pH = 4-5) avec HCI 2N. Le mlange est agit temprature
ambiante pendant 24 heures afin que le dgagement gazeux soit termin.
Puis la solution rsultante est analyse par RMN
13
C.
- Avec les acides amins 3, 7 et 10 qui prsentent deux sites ractifs,
trois quivalents de nitrite ont galement t employs.
- Un mlange de cystine 3' (600 mg : 2,5 mmol) et de NaN0
2
(345 mg;
5 mmol) est ralis dans 5 mL d'eau pH 4,5. La cystine ne se dissout
qu'en partie mais le mlange est agit 6 jours temprature ambiante
avant d'tre filtr et tudi par RMN
13
C.
- Pour l'aspartame 15, on dissout 75 mg (0,26 mmol) de dipeptide
dans 5 mL d'eau puis 18 mg de NaN02 (0,26 mmol) sont ajouts et le pH
est ajust 4,5 avec HCI 2N. Le spectre
13
C est enregistr 8 jours aprs.
- 1 g (3,2 mmol) de glutathion rduit GSH 16 est mlang avec 230 mg
(3,2 mmol de nitrite de sodium dans 3 mL d'eau. Le pH est ajust et
maintenu constant la valeur dsire par addition de HCl 2N. Aprs
5 jours de raction temprature ambiante, la solution est analyse par
RMN
13
C.
La mme manipulation est ralise avec une quantit doble (460 mg)
de NaN02.
- Le glutathion oxyd GSSG 16', 500 mg (0,8 mmol), et le nitrite de
sodium, 125 mg (1 ,6 mmol) sont dissous dans 2 mL d'eau et le pH ajust
4,5. Au bout de 5 jours temprature ambiante, le mlange est analys
par RMN
13
C (spectre A) puis on ajoute 125 mg de NaN0
2
et aprs une
attente de 5 jours, le mlange est nouveau analys en RMN.
- 5 mL de solution de Viandox commercial sont additionns de
50 mg de NaN0
2
marqu
15
N 95 %. Le pH est &j11< 5,0 puis le
mlange est analys par RMN
15
N au bout de 24 h.
- 1 tablette de (( bouillon de buf Maggi 9 g est mlange avec 7 mL
d'eau. La partie non soluble est limine et la solution rsultante est traite
comme ci-dessus.
- Les spectres
13
C ont t enregistrs avec un spectromtre Bruker
WH 90 en abondance naturelle. Paramtres utiliss : SW = 6 000 Hz ; AT
= 0,679 sec; PW = 25 o; vo = 22,365 MHz; nombre d'accumulations
1 000 5 000. Avec un spectromtre Bruker WM 250, les paramtres
utiliss sont les suivants : SW = 15 000 Hz; AT = 0,541 sec ; PW =
30 o ; vo = 62,896 MHz. Les dplacements chimiques sont mesurs par
rapport au TMS externe dans C
6
D
6
. Les dplacements chimiques
13
C de
GSH 16 et de GSSG 16' (0,3 M dans H20 et pH = 3,5) sont tirs de la
rf. (20).
- Les spectres
1 5
N ont t enregistrs avec un spectromtre Bruker
WH 250. Paramtres utiliss : SW = 22 500 Hz ; AT = 0,360 sec; PW
50 ; vo = 25,349 MHz ; dcouplage large bande (2W) ; nombre
d' accumulations 100 000 ; temprature 298 K. Les dplacements chimiques
ont t reprs par rapport une solution de CH
3
15
N0
2
enrichi dans
CD3N02 : cette solution est contenue dans un tube coaxial de 4 mm centr
dans le tube chantillon de 15 mm.
BIBLIOGRAPHIE
(1) KNOWLES M. E., McWEENY D. 1., COUCHMAN L. et THOROGOOD
M., Nature, 1974, 247, 288. KUBBEROD G., CASSENS R. G. et GREASER M.
L., J. Food Sc, 1974, 39, 1228. WooLFORD G., CASSENS R. G. , GREASER
M. L. et SEBRANEK J. G., J. Food Si., 1976, 41, 585. ITo T., CASSENS R.
G. et GREASER M. L. , J. Food Si., 1979, 44, 1144. lTo T., CASSENS R. G.,
GREASER M. L., LEE M. et lZUMI K., J. Food Si., 1983, 48, 1204.
(2) KlROSKY A. et HoFMANN T., Can. J. Biochem., 1972, 50, 1282 . .
BoNNETT R., HoLLEYHEAD R., J0HNSON B. L. et RANDALL E. W., J. Chem.
Soc. Perkin !, 1975, 2261. CHALl1S B. C., M!LLIGAN J. R. et MITCHELL
R. C. , .J. Chem. Soc. Chem. Comm., 1984, 1050.
(3) BONNETT R. et NICOLAIDOU P., Heterocycles, 1977, 7, 637.
(4) AKERS M. J., J. Chem. Educ., 1985, 62, 325.
(5) NOVI A. M., Science, 1981, 212, 541.
(6) NuDD R. et WILKIE D., Chem. Brit., 1983, 911.
(7) QlASTEL J. H., STEWART C. P. et TuNNICLIFFE H. E., Biochem. J.,
1923, 17, 586.
(8) BLUNDEN G., G0RDON S. M. , CRABB T. A., RocH O. G., RowAN
M. G. et Wooo B., Magn. Res. Chem., 1986, 24, 965.
(9) LARCHEVQUE M. et LALANDE J., Bull. Soc. Chim. Fr., 1987, 116.
(10) MJRVISH S. S.,]. Nat/. Cancer Inst., 1971, 46, 1183.
(11) SCHULZ U. et McCALLA D. R., Can. J. Chem., 1969, 47, 2021.
(12) BoNNETT R. et NICOLAIDOU P., J. Chem. Soc. Perkin !, 1979, 1969.
(13) WILLIAMS D. L. H ., Chem. Soc. Re v., 1985, 2, 171.
(14) MAYCOCK C. D. et STOODLEY R. J., J. Chem. Soc. Chem. Comm.,
1976, 234.
(15) MELLET P., NoEL P., MECHIN B. et DORIE J., ]. Chem. Res., 1988,
30.
(16) WEHRLI F. W. et WIRTHLIN T., Interpretation ofCarbon-13 NMR
Spectra )), Heyden, Londres, 1976, p. 37.
(17) ARCHER M. C., CLARK S. D., THILLY J. E. et TANNENBAUM S. R.,
Science, 1971, 174, 1341.
(18) WARTHESEN J. J., SCANLAN R. A., BILLS D. D. et LIBBEY L. M.,
J. Agric. Food Chem., 1975, 23, 898.
(19) BEERENS H., Ann. Fals. Exp. Chim., 1981, 74, 261. MAZUR R. H.,
Food Si. Technol., 1984, 12, 3. ScHIFFMAN S. S., Food Si. Technol., 1984,
12, 207.
(20) JUNG G., BREITMAIER E., VOELTER W., KELLER T. et TANZER C.,
Angew Chem. !nt. Ed. Engl., 1970, 9, 894. JuNG G., BREITMAIER E. et
VOELTER W., Eur. ]. Biochem., 1972, 24, 438. FEENEY J. , PARTINGTON P.
et ROBERTS G. C. K., J. Magn. Res., 1974, 13, 268.
(21) ATTEGNO D., HAWKES G. E. et RANDALL E. W., J. Chem. Soc.
Perkin II, 1976, 1528.
(22) 0AES., KIM Y. H., FUKUSHIMA D. et SHINKAMA K., J. Chem. Soc.
Perkin 1, 1978, 913. 0AE S., FUKUSHIMA D. et KIM Y. H., Chem. Lett.,
1978, 279.
(23) G0lESNARD J. P., J. Chem. Soc. Perkin !, 1986, 1901.
(24) MARTIN G. J., MARTIN M. L. et G0lESNARD J. P.,
15
N NMR
Spectroscopy )), Springer-Verlag, Berlin, 1981, p. 163.
(25) GOUESNARD J. P. et MARTIN G. 1., Org. Magn. Res., 1979, 12, 263.
S-ar putea să vă placă și
- Polycopié de Cours Bentabet NesrineDocument90 paginiPolycopié de Cours Bentabet NesrineJoseph 27Încă nu există evaluări
- Fascicule C3309-C3340 - NewDocument19 paginiFascicule C3309-C3340 - NewIssa CharkawiÎncă nu există evaluări
- Cours RMN PDFDocument46 paginiCours RMN PDFTito100% (1)
- 05 Spectroscopie Par Resonance Magnetique Nucleaire (RMN 1H) PDFDocument27 pagini05 Spectroscopie Par Resonance Magnetique Nucleaire (RMN 1H) PDFMohamed DahmaneÎncă nu există evaluări
- Ressources RMN - Exploiter Un Spectre RMN Du ProtonDocument16 paginiRessources RMN - Exploiter Un Spectre RMN Du Protonazeddine najimÎncă nu există evaluări
- C5 - Structure Et Caractérisation Des Molécules OrganiquesDocument4 paginiC5 - Structure Et Caractérisation Des Molécules OrganiquesloukaÎncă nu există evaluări
- Introduction Sur LDocument5 paginiIntroduction Sur LKarim EL HAJJIÎncă nu există evaluări
- Résumé: OH LibreDocument5 paginiRésumé: OH LibreLINDA CHABANEÎncă nu există evaluări
- Cours RMN Proton 2021-ConvertiDocument11 paginiCours RMN Proton 2021-ConvertiKamer BourahlaÎncă nu există evaluări
- THESE Farid ErrassifiDocument266 paginiTHESE Farid ErrassifiFay Rouz Taleb EpTahriÎncă nu există evaluări
- Chapitre 16 RMN1314 CoursDocument32 paginiChapitre 16 RMN1314 CoursZouhair GharboubÎncă nu există evaluări
- Cour Exercice SpectroscopieDocument67 paginiCour Exercice SpectroscopieChk YahyaÎncă nu există evaluări
- TD Spectro L1 UDSNDocument7 paginiTD Spectro L1 UDSNLoïc ITOUAÎncă nu există evaluări
- RMN Ch.2.Corrige Spectro Total 21-01-09 Avec Noms - 2Document30 paginiRMN Ch.2.Corrige Spectro Total 21-01-09 Avec Noms - 2adama nacanaboÎncă nu există evaluări
- Wa0002Document4 paginiWa0002AhmedÎncă nu există evaluări
- IR ExercitiiDocument19 paginiIR ExercitiiAdelina96Încă nu există evaluări
- Examen Corrige SN 2015Document5 paginiExamen Corrige SN 2015Yc YacineÎncă nu există evaluări
- Cours de RMN ÉtudiantDocument37 paginiCours de RMN ÉtudiantfernandÎncă nu există evaluări
- Chapitre 8 - Analyse Par Spectroscopie - ExercicesDocument10 paginiChapitre 8 - Analyse Par Spectroscopie - ExercicesMarius MissiÎncă nu există evaluări
- TP09 RMNDocument4 paginiTP09 RMNBrahim ABAGHOUGHÎncă nu există evaluări
- RMN Chap6Document8 paginiRMN Chap6davsou100% (1)
- Coursl3 2014 RMNDocument50 paginiCoursl3 2014 RMNKalianaÎncă nu există evaluări
- Ch4 Analyse SpectraleDocument7 paginiCh4 Analyse SpectraleLahoucine GhourchaneÎncă nu există evaluări
- RMN Molecules Organiques PDFDocument162 paginiRMN Molecules Organiques PDFHamza BoulikaÎncă nu există evaluări
- Exam B RMN 2001Document0 paginiExam B RMN 2001Ganiyou AdenidjiÎncă nu există evaluări
- Examen Spectroscopie Ait Melloul - 2021 - 2022 - M32Document4 paginiExamen Spectroscopie Ait Melloul - 2021 - 2022 - M32abd samad100% (1)
- Memoire CompletDocument55 paginiMemoire Completعيسى عيسىÎncă nu există evaluări
- Hee Patricia 2014Document247 paginiHee Patricia 2014Ayoub GhannamiÎncă nu există evaluări
- Exercices RMN CorrectionDocument7 paginiExercices RMN CorrectionMelainine TounsyÎncă nu există evaluări
- Spectres RMN Du Proton: I. Présentation D'un Spectre de RMNDocument4 paginiSpectres RMN Du Proton: I. Présentation D'un Spectre de RMNKaouther JouiniÎncă nu există evaluări