Documente Academic
Documente Profesional
Documente Cultură
Quimica Resueltos
Încărcat de
Amaro IgnacioTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Quimica Resueltos
Încărcat de
Amaro IgnacioDrepturi de autor:
Formate disponibile
1 Explique:
a) Si las estructuras de Lewis justifican la forma geomtrica de las molculas o si esta se debe determinar
experimentalmente para poder proponer la representacin correcta
b) Si cada molcula se representa en todos los casos por una nica frmula estructural
c) Representar las estructuras de Lewis de las siguientes especies: H
2
O y NO
3
.
d) Justifican las representaciones de las molculas anteriores la estabilidad de las mismas?
Solucin.
a) Las estructuras de Lewis no justifican la geometra de las molculas, solo ilustran de manera
cuantitativa cmo comparten electrones los distintos tomos que forman los enlaces covalentes que dan lugar
a la formacin de las molculas. La geometra de las molculas se determina experimentalmente midiendo las
longitudes de enlace y los ngulos de enlace. Mediante las teoras de enlace qumico se explica la geometra
de las molculas, recurriendo para ello a la teora de hibridacin de orbitales atmicos.
b) Falso. Las molculas que presentan resonancia, se representan con ms de una formula estructural;
su estructura se puede describir con ms de un diagrama de Lewis
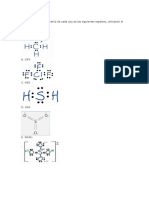
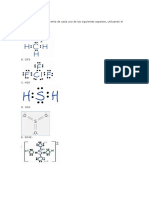
c) La molcula de agua segn Lewis tiene la siguiente estructura:
El oxgeno comparte dos electrones, uno con cada tomo de hidrgeno, quedando dos pares de
electrones sin compartir
Para el in nitrato(NO
3
) se representan tres estructuras resonantes:
las tres uniones nitrgenooxgeno son idnticas, por lo que la estructura real es un promedio de las tres.
d) Justifican el hecho de que en ambas especies todos los tomos tienen los octetos completos. Los
tomos se han unido formando enlaces aumentando su estabilidad.
2
a) Ordene segn polaridad creciente, basndose en los valores de las electronegatividades de la tabla
adjunta, los enlaces siguientes: HF, HO, HN, HC, CO y CCl
Elemento F O Cl N C S H
Electronegatividad 40 35 30 30 25 25 21
b) La polaridad de la molcula de CH
4
Ser igual o distinta que la del CCl
4
?. Justifique las respuestas.
Solucin.
a) La polaridad de un enlace depende directamente del valor de la diferencia de electronegatividad de
los tomos enlazados. El enlace es ms polar cuanto mayor sea la diferencia de electronegatividad de los
tomos enlazados. Los enlaces propuestos se pueden clasificar estudiando la diferencia de electronegatividad
entre los tomos que lo forman:
ENLACE DIFERENCIA DE
E
H F 40 21 = 19
H O 35 21 = 14
H N 30 21 = 09
H C 25 21 = 04
C O 35 25 = 10
C Cl 30 25 = 05
El orden de los enlaces segn su polaridad creciente es:
H C < C Cl < H N < C O < H O < H F
b) El momento dipolar de un enlace es una medida cuantitativa de la polaridad del mismo. El momento
dipolar, y por tanto la polaridad, de una molcula poliatmica depende de dos factores, de la polaridad de
cada enlace y de la disposicin espacial de estos enlaces, debido esto ltimo al carcter vectorial del momento
dipolar.
La molcula de CH
4
es apolar a pesar de tener cuatro enlaces polares y lo mismo ocurre con la
molcula de CCl
4
. El momento dipolar de la molcula resulta de la suma vectorial de los momentos dipolares
de los enlaces existentes. En el caso de estas dos molculas el resultado es un momento dipolar nulo, ya que
los momentos dipolares de cada enlace se anulan entre s por geometra. Ambas molculas presentan una
geometra tetradrica con el C ocupando el centro geomtrico de un tetraedro regular. Su representacin en el
plano puede ser de la siguiente forma:
0 :
4 3 2 1 i 4 3 2 1
= + + + = = = =
3 Considerando las sustancias Br
2
, SiO
2
, Fe, HF y NaBr, justifique en que funcin de sus enlaces:
a) Si son o no solubles en agua.
b) Si conducen la corriente elctrica a temperatura ambiente.
Solucin.
a) El agua es una molcula polar, y por tanto disuelve fcilmente a sustancias polares.
Br
2
: Molcula covalente apolar. Ms solubles en disolvente apolares tipo benceno (C
6
H
6
) , que en polares
(H
2
O).
SiO
2
: Slido covalente, hibridacin sp
3
en el tomo central (Si) para formar una red tridimensional(cuarzo).
Los momentos dipolares del enlace Si O se compensan por geometra. Apolar, no se disuelve en H
2
O.
Fe : Metal. Insoluble en H
2
O.
HF : Molcula covalente polar. Soluble en agua.
NaBr : Slido inico cristalino. Soluble en agua.
b) La conductividad de la corriente elctrica en las sustancias depende de la movilidad de los electrones
o cargas. A mayor localizacin(posicin fija sin posibilidad de movimiento) de los e
menor conductividad.
Br
2
: Molcula covalente. Mal conductor. e
localizados.
SiO
2
: Slido covalente. Mal conductor. e
localizados
Fe : Slido metlico. Muy conductor. e
deslocalizados
HF : Molcula covalente. Mal conductor.
NaBr : Slido inico. Conductor de 2 clase. (Fundido disuelto) a T ambiente slido. e
localizados. No
conductor
4. Dadas las siguientes sustancias: CS
2
(lineal), HCN (lineal), NH
3
(piramidal) y H
2
O (angular).
a) Escriba sus estructuras de Lewis.
b) Justifique su polaridad.
Solucin.
a) D e
disponibles; N e
necesarios; C e
compartidos; S e
solitarios
S C S :
8 8 16 C D S
8 16 24 D N C
8 3 N
16 6 2 4 D
: CS
2
= =
= = =
= = =
=
= + =
N C H :
2 6 8 C D S
8 10 18 D N C
18 8 2 2 N
10 5 4 1 D
: HCN
= = =
= = =
= + =
= + + =
:
2 6 8 C D S
6 8 14 D N C
18 8 2 2 N
8 1 3 5 D
: NH
3
= = =
= = =
= + =
= + =
H O H :
4 4 8 C D S
4 8 12 D N C
12 8 2 2 N
8 6 1 2 D
: O H
2
= = =
= = =
= + =
= + =
b) La polaridad de una molcula se cuantifica mediante el momento dipolar de la misma. El momento
dipolar es una magnitud vectorial, que para una molcula se obtiene como suma de los momentos dipolares de
todos los enlaces que formen la molcula. Es funcin de la diferencia de electronegatividad de los tomos que
forman el enlace y de la disposicin espacial de estos enlaces y de la existencia de pares de e
no compartidos.
CS
2
: Molcula covalente apolar en la que el C(tomo central) sufre una hibridacin del tipo sp(lineal). El
enlace CS no est polarizado ya que los dos tomos tienen igual electronegatividad.
HCN: Molcula covalente apolar en la que el C(tomo central) sufre una hibridacin del tipo sp(lineal). La
molcula est polarizada ya que el N tiene mayor electronegatividad que el C y este mayor que el H. Los
momentos dipolares de los enlaces no se anulan entre s, generando un momento dipolar permanente en la
molcula al que tambin contribuye la presencia de un par de e
no compartidos en el nitrgeno.
+ = = 0
2 1 i
NH
3
: Molcula covalente polar en la que el N(tomo central) sufre hibridacin sp
3
(tetradrica), ocupando el N
uno de los vrtices del tetraedro, tres de los orbitales hbridos los utiliza para formar enlaces con el hidrgeno
y el cuarto est ocupado por un par de e
no compartido. El enlace NH esta polarizado, y adems, el par de
e
no compartido contribuye a aumentar la polaridad de la molcula.
= 0
i
H
2
O: Molcula covalente polar en la que el O(tomo central) sufre hibridacin sp
3
(tetradrica), empleando
dos orbitales hbridos para forman enlace con los hidrgenos, y los otros dos estn ocupados por pares de e
sin compartir. El enlace HO est polarizado y los momentos dipolares que generan se suman a los momentos
que generan los pares de e
no compartidos.
= 0
i
5. Teniendo en cuenta la estructura y el tipo de enlace, justifique:
a) el cloruro de sodio tiene un punto de fusin mayor que el bromuro de sodio
b) el carbono (diamante) es un slido muy duro
c) el nitrgeno molecular presenta una gran estabilidad qumica
d) el amonaco es una sustancia polar.
Solucin.
a) Para fundir slidos cristalinos hay que aportar la energa reticular, a mayor energa reticular mayor
punto de fusin. La energa reticular, y por tanto el punto de fusin, son inversamente proporcionales al radio
inico(Suma del radio del catin ms el radio del anin), por lo que al aumentar el radio inico, disminuye la
energa reticular y por tanto el punto de fusin.
R
i
(Cl
) < R
i
(Br
) E
R
(NaCl) > E
R
(NaBr) P.F. (NaCl) > P.F. (NaBr)
b) La dureza es la dificultad que ofrece un cuerpo a ser rallado. Como para rallar a un slido hay que
romper enlaces, a mayor fuerza de enlace mayor dureza. El C(diamante) es un slido atmico covalente en el
que cada tomo de carbono sufre hibridacin sp
3
(tetradrica) que le permite unirse a otros cuatro tomo de C
mediante un enlace (frontal), el de mayor fortaleza, de hay que para rallar un diamante halla que romper
enlaces covalentes del tipo , y por tanto sea muy duro.
c) El nitrgeno molecular(N
2
) tiene una gran estabilidad debido a que para que reaccione hay que
romper un doble triple enlace ( ) N N , por lo que su reactividad se puede comparar con la de los gases
nobles, para que reaccione hay que suministrar gran cantidad de energa.
d) NH
3
: Molcula covalente polar en la que el N(tomo central) sufre hibridacin sp
3
(tetradrica),
ocupando el N uno de los vrtices del tetraedro, tres de los orbitales hbridos los utiliza para formar enlaces
con el hidrgeno y el cuarto est ocupado por un par de e
no compartido. Debido a la diferencia de
electronegatividad, el enlace NH esta polarizado, no anulndose los momentos dipolar por geometra,
adems, el par de e
no compartido contribuye a aumentar la polaridad de la molcula.
= 0
i
6. Cuatro elementos diferentes A, B, C, D tienen nmero atmico 6, 9, 13 y 19 respectivamente. Se
desea saber:
a) El nmero de electrones de valencia de cada uno de ellos
b) Su clasificacin en metales y no metales
c) La formula de los compuestos que B puede formar con los dems ordenndolos del ms inico al
ms covalente.
Solucin.
a) Se denominan e
de valencia a los electrones situados en la ltima capa de un tomo.
Z = 6(C): 1s
2
; 2s
2
p
2
. e
de Valencia = 4
Z = 9(F): 1s
2
; 2s
2
p
5
. e
de Valencia = 7
Z = 13(Al): 1s
2
; 2s
2
p
6
; 3s
2
p
1
. e
de Valencia = 3
Z = 19(K): 1s
2
; 2s
2
p
6
; 3s
2
p
6
; 4s
1
. e
de Valencia = 1
b) Z = 6(C) No-metal
Z = 9(F) No-metal
Z = 13(Al) Metal
Z = 19(K) Metal
c) AB
4
Tetrafluoruro de carbono CF
4
.
CB
3
Trifluoruro de aluminio AlF
3
.
DB Fluoruro de potasio KF
El carcter inico aumenta a medida que aumenta la diferencia de electronegatividad entre los
tomos que forman el enlace.
DB (KF) > CB
3
(AlF
3
) > AB
4
(CF
4
)
7. Disee un ciclo de BomHaber para el MgCl
2
. Defina al menos cuatro de los siguientes conceptos:
energa de ionizacin, energa de disociacin, afinidad electrnica, energa reticular, calor de formacin y
calor de sublimacin.
Solucin.
a. El ciclo de BornHabr es un mtodo emprico que permite relacionar la energa reticular de un
compuesto cristalino con datos tabulados. Para el MgCl
2
:
( ) ( ) ( ) ( )
R 2 2 D S R
E Cl . E . A 2 Cl H Mg . I . P Mg H H + + + + =
b. Energa de ionizacin. Energa necesaria para arrancar un electrn a un tomo en estado gaseoso y
fundamental.
A + Energa A
+
+ 1e
Energa de disociacin. Es la energa necesaria para descomponer un mol de una sustancia en estado
gaseoso en sus tomos correspondientes.
A
2
+ Energa 2A
Afinidad electrnica. Energa que desprende un tomo en estado gaseoso cuando capta un e
para
formar un in negativo.
A + 1e
+ Energa
Energa reticular. Es la energa que se desprende cuando el nmero necesario de iones positivos y
negativos se condensa en un cristal inico para formar un mol de un compuesto.
A
n+
(g) + B
m
(g) A
m
B
n
(s) + E
R
Calor de formacin. Es la energa que se absorbe o libera cuando se forma un mol de compuesto en
su estado normal, a partir de sus correspondientes elementos tambin en estado normal.
Calor de sublimacin. Calor necesario para que un elemento pase de estado slido a estado gaseoso.
A(s) + Energa A(g)
8. Dados los siguientes elementos: flor, helio, sodio, calcio y oxgeno.
a) Justifique en funcin de los posibles enlaces entre tomos; cules forman molculas homonucleares y
cules no, as como su estado de agregacin en condiciones normales de presin y temperatura.
b) Formule cuatro de los compuestos que puedan formar entre s, indicando la naturaleza del enlace
formado.
Solucin.
a) F: forma molculas homonucleares diatmicas por ser tomos muy electronegativos que se unen por
enlace covalente con orden de enlace 1 y de est forma completar el octeto. F
2
segn Lewis Fuerzas
intermoleculares del tipo Van der Waals de dispersin (F
2
apolar) muy dbiles. Gas.
He: Gas noble no forma molculas. Fuerzas intermoleculares del tipo Van der Waals de dispersin
extraordinariamente dbiles. Gas.
Na: Metal alcalino, los ncleos metlicos se une mediante en redes entre las que puedan circular los
e
en O. A. solapados que forma bandas. No forma molculas. Slido Metlico.
Ca: Metal alcalinotrreo. Enlace metlico. Slido.
O
2
: Formado por molculas homonucleares diatmicas por ser tomos muy electronegativos que se
unen por enlace covalente, con un orden de enlace 2 y de est forma completar el octeto. O
2
segn Lewis
O O = . Fuerzas intermoleculares del tipo Van der Waals de dispersin (O
2
apolar) muy dbiles. Gas.
b) NaF, CaF
2
Slidos cristalinos inicos.
OF
2
Oxido covalentecomportamiento cido en agua
)
`
inicos Oxidos
CaO
O Na
2
comportamiento bsico en agua
9. Responda a las siguientes cuestiones referidas al CCl
4
, razonando las respuestas:
a. Escriba su estructura de Lewis.
b. Qu geometra cabe esperar para sus molculas?
c. Por qu la molcula es apolar a pesar de que los enlaces C-C1 son polares?
d. Por qu, a temperatura ordinaria l CCl
4
, es lquido y, en cambio, l CI
4
es slido?
Solucin.
a. La molcula de CCl
4
est formada por cuatro enlaces, del tipo covalente polar, Carbono-Cloro, de tal
forma que los cinco tomos adquieren configuracin de octete electrnico.
b. La geometra de la molcula es tetradrica debido a la hibridacin sp
3
que sufre el tomo central(C)
El carbono ocupa la posicin del tetraedro, situndose los tomos de cloro en los vrtices del
tetraedro, formando ngulos de 109.
c. La polaridad de la molcula se mide por su momento dipolar, siendo este una magnitud vectorial. En
la molcula de tetracloruro de carbono los momentos dipolares de los enlaces carbono-cloro se anulan por
geometra obtenindose un momento dipolar total nulo.
d. Siendo las dos molculas apolares, las nicas fuerza de cohesin intermolecular sern del tipo de
dispersin. Son las menos conocidas y las ms dbiles. Aumentan con la masa de la molcula, siendo por
tanto ms importantes en el CI
4
, debido a su mayor masa molecular, que en el CCl
4
.
10. Sabiendo que las temperaturas de 3550, 650, 107 y 196 C corresponden a las temperaturas de
fusin de los compuestos nitrgeno, aluminio, diamante y tricloruro de boro:
a) Asigne a cada compuesto el valor que le corresponde a su temperatura de fusin y justifique esta
asignacin.
b) Justifique los tipos de enlaces y/o las fuerzas intermoleculares que estn presentes en cada uno de los
compuestos cuando se encuentran en estado slido.
Solucin.
a. El punto de fusin de los compuestos es una propiedad fsica caracterstica de cada uno de ellos, y
depende del tipo de fuerza que mantiene unidas las partculas(tomo, iones molculas) que lo forman. Estos
tipos de fuerzas se pueden dividir en dos tipos:
-De carcter atmico
Metlicas
Ionicas
Covalentes
-De carcter molecular
der Waals Van de Fuerza
hidrogeno de Enlace
De mayor a menor se ordenara de la siguiente forma:
Covalente>Inico>Metlico>Enlace de hidrgeno>Fuerza de Van der Waals
Por lo que en el mismo orden irn sus puntos de fusin.
COMPUESTO
FUERZAS DE COHESIN
T
f
(C)
C(Diamante) Covalentes 3350
Al Metlicas 650
BCl
3
F de Van der Waals 107
N
2
F de Van der Waals 196
En molculas apolares como el BCl
3
y N
2
, las Fuerzas de Van der Waals son del tipo de dispersin, las cuales,
aumentan con la de masa molecular:
M (BCl
3
) > M (N
2
)
Por lo que el nitrgeno tendr un punto de fusin ms bajo que el tricloruro de boro.
b.
- Diamante: Slido covalente macromolecular, est formado por tomos de C que emplean un orbital
hbrido sp
3
para unirse mediante un enlace con cada uno de los cuatro carbonos contiguos
formando una estructura cristalina tridimensional.
- Aluminio: Enlace metlico. Los ncleos del metal se unen en una especie de estructura o red
compacta que genera un campo elctrico uniforme, los e
se sitan en bandas(orbitales atmicos
solapados) en forma de nube gas electrnico alrededor de la red manteniendo unidos los ncleos.
- BC1
3
: Molcula covalente apolar formada por enlaces covalentes polares. Los momentos dipolares
formados en los enlaces BCl se anulan entre s por simetra ya que la molcula presenta una
geometra trigonal plana debido a una hibridacin del tipo sp
2
en el tomo central(B). Las fuerzas de
cohesin que mantienen unidas las molculas son del tipo de Van der Waals dispersin debido a la
no-polaridad de la molcula.
- N
2
: Molcula covalente apolar formada por un triple enlace (un y dos ). Las fuerzas de cohesin
del slido son de dispersin muy dbiles, prcticamente despreciables.
11. Teniendo en cuenta el tipo de slido y las fuerzas intermoleculares, ordena en orden creciente de
su punto de fusin las siguientes sustancias; Xe, LiF, AlN, CCl
4
Solucin.
Xe: Gas noble Fuerzas intermoleculares del tipo de Van der Waals de dispersin(muy dbiles)
LiF: Slido inico cristalino. Las fuerzas que mantienen unidos a los tomos son del tipo reticular.
AlN: Slido inico cristalino. Las fuerzas que mantienen unidos a los tomos son del tipo reticular.
CCl
4
: Liquido covalente apolar. Fuerzas intermoleculares del tipo de Van der Waals de dispersin(dbiles)
La E
R
del nitruro de aluminio es mayor que la del fluoruro de litio debido a que los productos de
cargas son respectivamente 9 y 1, siendo el producto Z
1
Z
2
directamente proporcional a la E
R
, y est tambin
directamente proporcional al punto de fusin.
Las fuerzas de Van der Waals de dispersin aumenta con la masa molecular, por lo que teniendo en
cuenta que M(CCl
4
) > M(Xe) el punto de fusin del tetracloruro de carbono ser mayor que el del xenn.
P.F. (Xe) < P.F. (CCl
4
) < P.F. (LiF) < P.F. (AlN)
12. El porcentaje de carcter inico del HCl y del HF es del 4% y del 17% respectivamente. Cul
tiene momento dipolar mayor?
Solucin.
El carcter inico aumenta con el momento dipolar de la molcula, ya que se puede entender el
enlace inico puro como un dipolo extremo, los e
se han desplazado totalmente del menos
electronegativo(metal) al ms electronegativo(no-metal) generando dos cargas de distinto signo(+, ) en cada
uno de ellos, por lo que a mayor carcter inico mayor momento dipolar.
(HF) > (HCl)
13. Calcular l % de carcter inico del HCl sabiendo que su momento dipolar es 1,03 D y que la
distancia de enlace es 127 Amstrong. Realiza el mismo clculo para el CO, en el que
d
=0,3 D y que la
distancia de enlace es 113 Amstrong.
Solucin.
El % de carcter inico de una sustancia se puede cuantificar comparando el momento dipolar real de
la molcula con el momento dipolar terico de la misma suponiendo la formacin de un dipolo.
100 inico %
T
R
=
donde
R
es el momento dipolar real de la molcula y
T
es el terico ( ) d q
T
=
( )
( )
=
= = =
=
=
=
=
D 08 ' 6 m C 10 03 ' 2 m 10 27 ' 1 C 10 6 ' 1
D 03 ' 1
100 HCl inico %
T
m C 10 34 ' 3 D 1 29 10 19
T
R
T
R
30
% 95 ' 16 100
08 ' 6
03 ' 1
= = de carcter inico
( )
( )
=
= = =
=
=
=
=
D 83 ' 10 m C 10 62 ' 3 m 10 13 ' 1 C 10 6 ' 1 2
D 3 ' 0
100 CO inico %
T
m C 10 34 ' 3 D 1 29 10 19
T
R
T
R
30
% 77 ' 2 100
83 ' 10
3 ' 0
= = de carcter inico
14. Estructura de Lewis para CO NO, NO
+
y CN
. Indicar el orden de enlace y si sern
diamagnticas paramagnticas las especies indicadas.
Solucin.
O C :
2 6 10 C D S
6 10 16 D N C
16 8 2 N
10 6 4 D
: CO
= = =
= = =
= =
= + =
. O.e. = 3. Diamagntica. Sin e
desapareados
O N :
7 4 11 C D S
5 11 16 D N C
16 8 2 N
11 6 5 D
: NO =
= = =
= = =
= =
= + =
. O.e. = 2. Paramagntica. Con e
desapareados
| |
+ +
= = =
= = =
= =
= + =
O N :
6 4 10 C D S
6 10 16 D N C
16 8 2 N
10 1 6 5 D
: NO . O.e. = 3. Diamagntica. Sin e
desapareados
| |
= = =
= = =
= =
= + + =
N C :
4 6 10 C D S
6 10 16 D N C
16 8 2 N
10 1 5 4 D
: CN . O.e. = 3. Diamagntica. Sin e
desapareados
15. Qu tipo de fuerzas han de romperse para hervir el agua? Y para fundir el Cl
2
Ca?
Solucin.
Para hacer hervir el agua hay que aportar la energa necesaria para romper los enlaces entre las
molculas de agua que son del tipo de enlace de hidrgeno.
Para fundir Cl
2
Ca hay que aportar la energa reticular para romper las fuerzas electrostticas que
mantienen unidos a los iones en la red, ya que se trata de un slido inico.
16. A qu se debe la gran solubilidad del HCI en agua, si el Cl
2
y H
2
son muy poco solubles en
ella?
Solucin.
El HCl es muy soluble en agua debido a que es una molcula polar, mientras que Cl
2
y H
2
son
molculas apolares, no solubles en disolventes polares como el agua.
17. Cul de estas dos molculas debe disolverse mejor en agua: N
2
, NH
3
? Por qu?
Solucin.
El Amoniaco(NH
3
) por ser una molcula polar y por tanto soluble en disolventes polares como el
agua. El N
2
por el contrario es una molcula apolar, no soluble en disolventes polares como el agua.
18. Los tomos de S y de O tienen la misma estructura electrnica externa, no obstante presentan en
sus compuestos puntos de ebullicin muy distintos, por ejemplo, SH
2
, 60,75C y H
2
O, 100,0C A qu se
debe? Explcalo.
Solucin.
Para pasar de estado lquido a estado gaseoso hay que aportar la energa necesaria para romper los
enlaces que mantienen unidas a las molculas en el lquido. En el caso del agua estas uniones son del tipo
enlace de hidrgeno mucho mayores que las fuerzas de Van der Waals orientacin(dipolo permanente) que
son las que mantienen unidas las molculas de SH
2
. Los nicos tomos capaces de generar enlace de
hidrgeno son el flor, l oxgeno y el nitrgeno. Los dems elementos, o carecen de la electronegatividad
necesaria(el enlace de hidrgeno requiere que el elemento sea muy electronegativo), el tamao no es el
adecuado(el enlace de hidrgeno requiere que el tomo sea lo suficientemente pequeo como para permitir
acercarse al hidrgeno hasta una distancia donde poder interaccionar con l).
19. Dadas las sustancias siguientes: CCl
4
, Fe, C(grafito) y CsCl, justifique razonadamente:
i. El estado fsico en que se halla cada una de ellas a 25C y 1 atm.
ii. El tipo de enlace que presentan.
iii. Su conductividad elctrica.
iv. Su solubilidad en agua.
Solucin.
i. CCl
4
: Lquido covalente apolar. Fuerzas intermoleculares de tipo de Van der Waals.
Fe: Slido metlico.
C(grafito): Slido covalente.
CsCl. Slido inico.
ii. CCl
4
. Enlace covalente con hibridacin sp
3
(tetradrica) del carbono(tomo central) para la formacin
de cuatro enlaces (solapamiento frontal) con los cuatro cloros.
Fe: Enlace metlico. Los ncleos de hierro forman una red y los electrones se distribuyen alrededor
de esta en orbitales atmicos solapados que han formado bandas.
C(grafito): Enlace covalente con hibridacin sp
2
(trigonal plana) del carbono para formar tres enlaces
(solapamiento frontal) con otros tres tomos de carbono que a su vez han sufrido la misma hibridacin. En
cada tomo de carbono queda un e
en un orbital p perpendicular al plano, por combinacin de estos, se
obtienen orbitales moleculares , donde el e
est deslocalizado. La red plana se desarrolla indefinidamente.
CsCl: Enlace inico. El Cesio cede su e
de valencia al Cloro, originndose dos iones de distinto
signo que se atraen por fuerza electrosttica.
iii. La conductividad de la corriente elctrica en las sustancias depende de la movilidad de los electrones
o cargas. A mayor localizacin(posicin fija sin posibilidad de movimiento) de los e
menor conductividad.
CCl
4
: Enlace covalente. e
localizados. No conductor
Fe: Enlace metlico. e
deslocalizados. Conductor
C(grafito) Enlace covalente. e
deslocalizados. Conductor(excepcin).
CsCl: Conductor de 2 clase. (Fundido disuelto) a T ambiente slido. e
localizados. No conductor.
Fundido disuelto deja libre iones capaces de conducir la electricidad.
iv. Son solubles en agua las sustancias polares por ser esta el disolvente polar por excelencia.
CCl
4
: Apolar. No soluble en agua
Fe: Slido metlico. No soluble en agua.
C(grafito). Apolar. No soluble en agua
CsCl. Inico. Soluble en agua.
20. Los puntos de ebullicin de los haluros de hidrgeno HX son para X =F, Cl, Br y I, +195,
842, 671 y 35,1C, respectivamente. Justifique las diferencias observadas.
Solucin.
Los puntos de fusin de los haluros de hidrgeno son bastante bajos debido a que las fuerzas que
mantienen unidas a las molculas apolares(la polaridad disminuye al descender en el grupo)son del tipo de
Van der Waals de dispersin, que aumentan al descender en el grupo debido al aumento de la masa de la
molcula.
El comportamiento anmalo del HF es debido a que en este compuesto aparece enlace de hidrgeno
entre las molculas, lo cual hace aumentar desproporcionadamente su punto de fusin.
21. Tomando como referencia la expresin de la energa reticular, justificar los valores de los puntos
de fusin de CaO (2570C) y de KF (858C), as como la variacin que tendrn otras propiedades
relacionadas con el tipo de enlace (solubilidad, dureza, etc.)
Solucin.
La E
R
, es la energa que se desprende cuando el nmero necesario de iones positivos y negativos se
condensa en un cristal inico para formar un mol de un compuesto. Su expresin es:
|
.
|
\
|
=
n
1
1
r
e Z Z A N
E
o
2
2 1 o
r
N
o
Numero de Avogadro n Exponente de Born
A Constante de Madelung r
o
distancia de equilibrio
Z
1
, Z
2
Carga de los iones e carga del electrn
Para las sustancias CaO y KF, el radio inico es parecido al fin y al cabo en los dos caso son radios
parecidos o similares a los del Ne(F
, O
2
) y Ar(K
+
, Ca
2+
), pero se diferencian bastante en las cargas de los
iones:
)
`
=
=
1 Z Z : KF
4 Z Z : CaO
2 1
2 1
por lo que la energa reticular del CaO es del orden de cuatro veces mayor que la
del KF.
Teniendo en cuenta que en la fusin de un slido cristalino se debe de aportar la E
R
para poder
desmoronar la red cristalina, a mayor energa reticular mayor punto de fusin.
Solubilidad. Disminuye al aumentar la E
R
.
Dureza. Aumenta al aumentar la E
R
.
22. Explique la geometra molecular de etino, tricloruro de boro y eteno.
Solucin.
Etino: HCCH
Molcula lineal en la que los dos tomos de carbonos forman dos orbitales hbridos del tipo sp, que utilizan
para formar dos enlaces tipo (solapamiento frontal), uno con el otro carbono y otro con el hidrgeno. Los
dos e
restante quedan en orbitales atmicos tipo p que forman con sus homlogos del otro tomo de carbono
dos enlaces tipo (solapamiento lateral) quedando formando el triple enlace de la molcula.
Tricloruro de Boro: BCl
3
. El boro presenta octeto incompleto. Hipovalencia.
Molcula trigonal plana. El B(tomo central) forma tres orbitales hbridos del tipo sp
2
, que utiliza para formar
tres enlaces (solapamiento frontal) con orbitales atmicos tipo p del Cl y ngulo de enlace de 120.
Eteno: CH
2
=CH
2
Molcula plana. Cada tomo de C forma tres orbitales hbridos del tipo sp
2
, que utiliza para formar tres
enlaces (solapamiento frontal) dos de ellos con H y el tercero con el otro tomo de C. Queda un e
que esta
situado en un orbital atmico tipo p que forma con su homologo del otro tomo de carbono un enlace tipo
(solapamiento lateral) quedando formado el doble enlace.
23. La variacin de las energas de enlace para cloro, bromo y yodo sigue el orden Cl
2
>Br
2
>I
2
,
mientras que para los puntos de fusin es I
2
>Br
2
>Cl
2
Razone este comportamiento
Solucin.
La energa de enlace es inversamente proporcional a la distancia entre los ncleos, a mayor distancia
menor energa. Teniendo en cuenta que R (Cl
2
) < R (Br
2
) < R (I
2
) sus energas seguirn el siguiente orden
E
D
(Cl
2
) > E
D
(Br
2
) > E
D
(I
2
)
Los puntos de fusin dependen de las fuerzas intermoleculares que mantienen unidas las molculas,
en este caso molculas apolares, por lo que sern del tipo de Van der Waals de dispersin, las cuales
aumentan con la masa, teniendo en cuenta que las masas moleculares aumentan al descender en el grupo del
mismo modo aumentaran las fuerzas de interaccin y por consiguiente sus puntos de fusin.
24. Determine para las siguientes especies de nitrgeno, amoniaco e in nitrato:
i. Sus estructuras de Lewis.
ii. El tipo de hibridacin de su tomo central.
iii. Su geometra molecular.
iv. Si alguna de ellas presenta resonancia.
Solucin.
i. N
2
: ( ) N N
NH
3
:
NO
3
:
ii. N
2
: No forma orbitales hbridos, los enlaces(2 y 1) se producen por interaccin de orbitales
atmicos tipo pp
NH
3
: El N(tomo central) forma orbitales hbridos del tipo sp
3
. Tres de los orbitales hbridos los
utiliza para unirse a los hidrgenos, el cuarto queda ocupado por el par de e
no compartidos
NO
3
: El N(tomo central) forma orbitales hbridos del tipo sp
2
.
iii. N
2
: Molcula lineal.
NH
3
: Piramidal de base triangular, ocupando el N uno de los vrtices.
NO
3
: Trigonal Plana.
iv. Si el NO
3
S-ar putea să vă placă și
- 2 ENLACE QUIMICO. Parte 2 Complemento A La Teoría de Lewis-1 PDFDocument24 pagini2 ENLACE QUIMICO. Parte 2 Complemento A La Teoría de Lewis-1 PDFAlexa MartinezÎncă nu există evaluări
- Ejercicios Resueltos de EnlacesDocument24 paginiEjercicios Resueltos de EnlacesJunior Jose Namoc DiazÎncă nu există evaluări
- Enlace Quimico SOLUCIONESDocument20 paginiEnlace Quimico SOLUCIONESAlejandro Muñoz EstradaÎncă nu există evaluări
- Unidad 5 Enlace QuímicoDocument9 paginiUnidad 5 Enlace QuímicosilviagarciasepulvedÎncă nu există evaluări
- Solucion A Algunos Problemas Del Libro Quimica Organica McmurryDocument7 paginiSolucion A Algunos Problemas Del Libro Quimica Organica McmurryClaudiia TereezaÎncă nu există evaluări
- Ex - 4 - Con SolucionDocument3 paginiEx - 4 - Con SolucionEmilio VeirasÎncă nu există evaluări
- Enlace Quimico IIDocument6 paginiEnlace Quimico IIzarceloÎncă nu există evaluări
- Tarea Bloques 4 y 5Document7 paginiTarea Bloques 4 y 5Carlos “Charly” Gómez LópezÎncă nu există evaluări
- 17 21Document3 pagini17 21DogCoinsÎncă nu există evaluări
- CTM Clase 11-2019-1Document43 paginiCTM Clase 11-2019-1Joel GarcíaÎncă nu există evaluări
- Teorias de EnlaceDocument7 paginiTeorias de Enlacevquispeasc100% (4)
- Enlace QuimicoDocument12 paginiEnlace QuimicoMiguel Angel Criado AlonsoÎncă nu există evaluări
- Sol Enlace 2Document9 paginiSol Enlace 2malvarezplataÎncă nu există evaluări
- Enlace - Actividades Con Solucion PDFDocument16 paginiEnlace - Actividades Con Solucion PDFEl Mostajo El MostajoÎncă nu există evaluări
- El Enlace QuímicoDocument16 paginiEl Enlace QuímicoAMYNNXXXXÎncă nu există evaluări
- Enlace Químico. Soluciones Ejercicios1Document19 paginiEnlace Químico. Soluciones Ejercicios1Mirian VivarÎncă nu există evaluări
- Ejercicios de Enlace Quimico 2022Document8 paginiEjercicios de Enlace Quimico 2022CRISTIAN MEIER UGAS SALDAÑAÎncă nu există evaluări
- TAREA Quimica Terminada, Geometría Molecular y CompuestosDocument14 paginiTAREA Quimica Terminada, Geometría Molecular y CompuestosLuisa AranaÎncă nu există evaluări
- Estructura MolecularDocument79 paginiEstructura Molecularverofranco983Încă nu există evaluări
- TAREA 2 Quimica Inorganica PDFDocument6 paginiTAREA 2 Quimica Inorganica PDFYuli GuzmánÎncă nu există evaluări
- TAREA 2 Quimica InorganicaDocument6 paginiTAREA 2 Quimica InorganicaYuli GuzmánÎncă nu există evaluări
- Ejercicios de QuimicaDocument29 paginiEjercicios de QuimicatucacheriomasnaÎncă nu există evaluări
- Enlace y Geometria Molecular IDocument7 paginiEnlace y Geometria Molecular IkjgÎncă nu există evaluări
- 04 Excepciones Lewis y Geometria MolecularDocument35 pagini04 Excepciones Lewis y Geometria MolecularEve ValdesÎncă nu există evaluări
- CTM Clase 11-2019-2Document37 paginiCTM Clase 11-2019-2Julio GiraldoÎncă nu există evaluări
- Geometria Molecular PresentarDocument61 paginiGeometria Molecular Presentaralexisdario100% (2)
- Enlace Quimico COVALENTE para ImprimirDocument52 paginiEnlace Quimico COVALENTE para ImprimirAlejandro RecioÎncă nu există evaluări
- Tema 2Document42 paginiTema 2TonyFontanaÎncă nu există evaluări
- Tema 5 EnlaceDocument8 paginiTema 5 EnlaceLuisa Gallo Martínez100% (3)
- ENLACE Selectividad Quimica Eva y JulianDocument46 paginiENLACE Selectividad Quimica Eva y JulianfiquimiguelcatalanÎncă nu există evaluări
- Enlace IonicoDocument37 paginiEnlace IonicoJangel RMÎncă nu există evaluări
- Capítulo 10 - 2023Document71 paginiCapítulo 10 - 2023jnsjsÎncă nu există evaluări
- 2 EnlacecovDocument13 pagini2 EnlacecovVictor Valdés AlvarezÎncă nu există evaluări
- Folleto Diego MuñozDocument136 paginiFolleto Diego MuñozRomel ToledoÎncă nu există evaluări
- Q3 PAU EnlaceQuimicoPropiedadesSustancias SolucDocument28 paginiQ3 PAU EnlaceQuimicoPropiedadesSustancias SolucFlicpunker 84Încă nu există evaluări
- Guia 2º Enlace Estereoquímica REVISIONDocument3 paginiGuia 2º Enlace Estereoquímica REVISION2doK50% (4)
- Puntos 4-6Document4 paginiPuntos 4-6alejo uribeÎncă nu există evaluări
- Ejercicios Eq 1Document36 paginiEjercicios Eq 1Danny GutierrezÎncă nu există evaluări
- Puntos 4-6Document4 paginiPuntos 4-6alejo uribeÎncă nu există evaluări
- EnlaceDocument12 paginiEnlaceAlba Megías MartínezÎncă nu există evaluări
- Cuestiones y Problemas Del Tema 3: Enlace Químico y Propiedades de Las SustanciasDocument19 paginiCuestiones y Problemas Del Tema 3: Enlace Químico y Propiedades de Las SustanciasjujujujuuajajjajajjsjajajÎncă nu există evaluări
- Solucionario Enlace QuímicoDocument5 paginiSolucionario Enlace QuímicoJavier A. MontoyaÎncă nu există evaluări
- Ejer Atomo Cuantico ResueltosDocument4 paginiEjer Atomo Cuantico Resueltoslacaya2Încă nu există evaluări
- Taller de Quimica GeneralDocument6 paginiTaller de Quimica GeneralMaria CedeñoÎncă nu există evaluări
- Solucionario EnlaceDocument4 paginiSolucionario EnlaceCristian ArayaÎncă nu există evaluări
- InorganicaDocument17 paginiInorganicaKevin Duban Aguilar VargasÎncă nu există evaluări
- Enlace CovalenteDocument10 paginiEnlace CovalenteAMYNNXXXX100% (1)
- Química (Temas 9-10)Document13 paginiQuímica (Temas 9-10)mgc00191Încă nu există evaluări
- BancoEjerciciosRepaso - Parcial 1Document6 paginiBancoEjerciciosRepaso - Parcial 1Juan Camilo Camacho100% (1)
- Enlaces QuimicosDocument76 paginiEnlaces QuimicosGrc MrthÎncă nu există evaluări
- Uniones Químicas - Enlace CovalenteDocument49 paginiUniones Químicas - Enlace CovalenteJudith SinghÎncă nu există evaluări
- Ejercicios Tema II EnlaceDocument6 paginiEjercicios Tema II EnlaceAnonymous vmuFYr31100% (1)
- Seminario 1 - Soluciones PDFDocument10 paginiSeminario 1 - Soluciones PDFAntonio OrdoñezÎncă nu există evaluări
- Quimica Ejercicios Resueltos Soluciones El Enlace QuimicoDocument16 paginiQuimica Ejercicios Resueltos Soluciones El Enlace QuimicoManuel Sanchez Quispe100% (1)
- Introducción a la química de los metales de transiciónDe la EverandIntroducción a la química de los metales de transiciónÎncă nu există evaluări
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaDe la EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaEvaluare: 5 din 5 stele5/5 (1)
- Introducción a la Física Nuclear y de PartículasDe la EverandIntroducción a la Física Nuclear y de PartículasÎncă nu există evaluări
- Mecánica Cuántica Relativista y No Relativista: las dos a la vez: Parte I: Estados estacionariosDe la EverandMecánica Cuántica Relativista y No Relativista: las dos a la vez: Parte I: Estados estacionariosÎncă nu există evaluări
- Ejercicios de Examen Quimica. Tema1. La Materia y Su Medida. 3º EsoDocument1 paginăEjercicios de Examen Quimica. Tema1. La Materia y Su Medida. 3º EsoAmaro IgnacioÎncă nu există evaluări
- R1 FluidosDocument2 paginiR1 FluidosAmaro IgnacioÎncă nu există evaluări
- Ejercicios de Trigonometria.4º EsoDocument14 paginiEjercicios de Trigonometria.4º EsoAmaro IgnacioÎncă nu există evaluări
- Ejercicios de ProbabilidadDocument7 paginiEjercicios de ProbabilidadAmaro IgnacioÎncă nu există evaluări
- Iniciacion A La Quimica 1Document433 paginiIniciacion A La Quimica 1Amaro Ignacio100% (1)
- Numeros Complejos 2Document24 paginiNumeros Complejos 2Amaro IgnacioÎncă nu există evaluări
- EJERCICIOS DE QUIMICA - Tema 1 y 2. 2º BachillerDocument2 paginiEJERCICIOS DE QUIMICA - Tema 1 y 2. 2º BachillerAmaro IgnacioÎncă nu există evaluări
- Ejercicios de Enlace QuimicoDocument8 paginiEjercicios de Enlace QuimicoquiscarÎncă nu există evaluări
- Relacion de Geometria 2Document4 paginiRelacion de Geometria 2Amaro IgnacioÎncă nu există evaluări
- 8 ElectromagnetismoDocument33 pagini8 ElectromagnetismoAmaro IgnacioÎncă nu există evaluări
- Sistema de Ecuaciones 2º BachDocument2 paginiSistema de Ecuaciones 2º BachAmaro IgnacioÎncă nu există evaluări
- 14 Ecuaciones Exponenciales, Logarítmicas y TrigonométricasDocument1 pagină14 Ecuaciones Exponenciales, Logarítmicas y TrigonométricasAmaro IgnacioÎncă nu există evaluări
- Ejercicios Pau Campo Magnetico e Induccion MagenticaDocument12 paginiEjercicios Pau Campo Magnetico e Induccion MagenticaAmaro IgnacioÎncă nu există evaluări
- Cartilla Ciencias NaturalesDocument19 paginiCartilla Ciencias NaturalesZulema ChipanaÎncă nu există evaluări
- 1.caracteristicas de Los Seres Vivos PDFDocument36 pagini1.caracteristicas de Los Seres Vivos PDFJulian GalvanÎncă nu există evaluări
- Documento Sin Título-1Document18 paginiDocumento Sin Título-1Jose FernandezÎncă nu există evaluări
- Biofisica Agua y PHDocument17 paginiBiofisica Agua y PHDANIELA ALEJANDRA ORTIZ ALVAREZÎncă nu există evaluări
- Guía 1°Document16 paginiGuía 1°FLOR KAMILAH MALDONADO CHEROÎncă nu există evaluări
- 2-Quim. Inorg. Huhey 4ta ed-OCR-ESPAÑOL PDFDocument1.150 pagini2-Quim. Inorg. Huhey 4ta ed-OCR-ESPAÑOL PDFJesus Buenaventura78% (9)
- Libro - Propiedades de La MateriaDocument264 paginiLibro - Propiedades de La MateriaLevy Inzunza100% (1)
- Deber 2 TinturaDocument32 paginiDeber 2 Tinturaedwinrr7100% (1)
- Flotación - Marco TeóricoDocument5 paginiFlotación - Marco TeóricoJulían CamachoÎncă nu există evaluări
- Tema 1. - IntroducciónDocument7 paginiTema 1. - IntroducciónBrayan YalánÎncă nu există evaluări
- UntitledDocument49 paginiUntitledoscar floresÎncă nu există evaluări
- El Agua Es Una Sustancia Compuesta Por Dos Átomos de Hidrógeno y Un Átomo de OxígenoDocument3 paginiEl Agua Es Una Sustancia Compuesta Por Dos Átomos de Hidrógeno y Un Átomo de OxígenoGina ValdezÎncă nu există evaluări
- Shampoo CalidadDocument15 paginiShampoo Calidadkate vilcapaza CharcaÎncă nu există evaluări
- Clase 5 y 6 Drogas de AbusoDocument18 paginiClase 5 y 6 Drogas de AbusoMatías Flores LobosÎncă nu există evaluări
- PDF M1 QuímicaDocument25 paginiPDF M1 Químicamiguel angel rodriguez gambaÎncă nu există evaluări
- Polimerizacion Parte 1Document100 paginiPolimerizacion Parte 1Jorge OrdoñezÎncă nu există evaluări
- Ensayo Sobre Los 100 Mas Importantes Inventos de La QuímicaDocument2 paginiEnsayo Sobre Los 100 Mas Importantes Inventos de La QuímicaAlejandroHigueraÎncă nu există evaluări
- Fundamentos de QuímicaDocument3 paginiFundamentos de QuímicaIvan CastañedaÎncă nu există evaluări
- AluminosilicatosDocument55 paginiAluminosilicatosSHKNEN_86_554957371100% (2)
- Plan de Area en Ciencias Naturales - Grados 6°, 7°, 8° y 9°Document39 paginiPlan de Area en Ciencias Naturales - Grados 6°, 7°, 8° y 9°lilianatamayom67% (3)
- Alotropos de CarbonoDocument8 paginiAlotropos de Carbonoangel nuñezÎncă nu există evaluări
- Guía TAP 4 (1035) - 202110Document6 paginiGuía TAP 4 (1035) - 202110CatalinaÎncă nu există evaluări
- Tercer Grado. Aprendizajes Fundamentales. Ciclo 2021-2022.Document10 paginiTercer Grado. Aprendizajes Fundamentales. Ciclo 2021-2022.Ana Laura MGÎncă nu există evaluări
- 1.0. - Fisica Basica IntroduccionDocument8 pagini1.0. - Fisica Basica IntroduccionLorianny paloma VásquezÎncă nu există evaluări
- Biología RobertisDocument456 paginiBiología Robertisjudith100% (1)
- Piedras CurativasDocument12 paginiPiedras CurativasRosa_Maria_Sua_9500Încă nu există evaluări
- Tema 3. Propiedades de Las Moléculas OrgánicasDocument57 paginiTema 3. Propiedades de Las Moléculas OrgánicasErnesto RuizÎncă nu există evaluări
- Balance de Energia Sistema Abierto 1docxDocument35 paginiBalance de Energia Sistema Abierto 1docxBlanca ChoqueÎncă nu există evaluări
- Cuestionario Sobre Teoria y Estructura AtomicaDocument2 paginiCuestionario Sobre Teoria y Estructura AtomicaEsther Adriana Garrido Zuñiga100% (4)
- NOMENCLATURADocument6 paginiNOMENCLATURAOscar DavidÎncă nu există evaluări