Documente Academic
Documente Profesional
Documente Cultură
Clase Cinetica
Încărcat de
Jamir NaranjoDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Clase Cinetica
Încărcat de
Jamir NaranjoDrepturi de autor:
Formate disponibile
17/11/2011
CINETICA QUMICA
Combustin de madera: proceso rpido
Estudio de las velocidades de reaccin
Oxidacin de hierro: proceso lento
Lavelocidaddeunareaccinseexpresacomoelcambiodelas concentracionesenfuncindeltiempo.
Hidrgeno (reactivo)
Hidrgeno (reactivo)
Concentracin mola ar
N2 + 3H2
Nitrgeno (reactivo) Amonaco (producto)
te
2NH3
Amedidaqueseformanproductos, comienzaaproducirselareaccin inversa. aA+bBcC+dD
Conce entracin molar
Nitrgeno (reactivo) Amonaco (producto)
Tiempo te
velocidadneta=velocidaddirecta velocidadinversa. Consideremoselcasodondesloesimportantelavelocidaddela reaccindirecta.
Tiempo
NO+O3 NO2 +O2
v= d [O 3 ] d [NO 2 ] d [O 2 ] d [NO] = = = dt dt dt dt
aA+ bBcC+ dD
v=
2 HI(g) I2(g) + H2(g)
1 d [HI] d [H 2 ] d [H 2 ] = = dt 2 dt dt
1 d [A] 1 d [B] = = b dt a dt
1 d [C] = c dt
1 d [D] d dt
v=
17/11/2011
(concentracin)
aA+ bBcC+ dD
tangente
v=
Conc. molar de produ uctos
Concentracin n molar
1 d [C] = c dt
1 d [D] d dt
Velocidad a e (tangente a e)
(tiempo)
Tiempo Tiempo
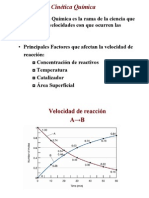
La velocidad de una reaccin depende de:
La velocidad de una reaccin depende de:
La concentracin de los reactivos. La temperatura a la cual se lleva a cabo. La presencia de un catalizador.
La concentracin de los reactivos. La temperatura a la cual se lleva a cabo. La presencia de un catalizador.
A temperatura constante, la velocidad de una reaccin depende de las concentraciones de los reactivos:
aA+ bBcC+ dD
1 d [A] 1 d [C] v= = = k [A]m [B]n a dt c dt
m: orden de reaccin respecto a A n : orden de reaccin respecto a B m + n : orden total de reaccin k: constante de velocidad
I2(g) + H2(g) 2 HI(g)
Br2(g) + H2(g) 2 HBr(g)
d [H 2 ] = k[H 2 ] [I 2 ] dt
d [H 2 ] = k[ H 2 ] [Br2 ]1/ 2 dt
m y n no son necesariamente los coeficientes estequiomtricos de A y B en la reaccin global El orden de la reaccin debe determinarse experimentalmente.
17/11/2011
LEYES INTEGRADAS DE VELOCIDAD Reacciones de orden cero A productos
C - C 0 = k t
dC =k dt
Concentracin de reactivo
C0 pendiente = -k
dC = kdt
C0
dC = k
dt
0
C - C 0 = k t
Reaccin de orden cero
Tiempo
Tiempo medio de reaccin: tiempo requerido para que la concentracin del reactivo sea la mitad de su concentracin inicial. C = C0 R Reaccin i d de orden d cero
Reacciones de primer orden
N2O5(g) 2 NO2(g) + O2(g)
1 C 0 - C 0 = k t1/ 2 2 t1/ 2 = C0 2k
1 C0 = k t1/ 2 2
d [N 2 O 5 ] = k[ N 2 O 5 ] dt
A productos
ln C = ln C 0 k t
dC = k dt C
dC =kC dt
C0
dC = k C
dt
0
C0
ln C0 pendiente = -k
ln
C = k t C0
Concentracin
Reaccin de primer orden
Tiempo
ln C
Tiempo
17/11/2011
Tiempo medio
C0
ln
Concentracin molar d de A, [A]
1/2 C 0 = k t1/ 2 C0 1 = k t1/ 2 2
ln
k pequea t1/2 largo
Concentracin �
C0
t1/2 corto k grande
ln 1 ln 2 = k t1/ 2
Reaccin de primer orden
C0 C0
t1 / 2 =
ln 2 k
Tiempo
Tiempo (unidades arbitrarias) �
Reacciones de segundo orden A productos C4H6(g) C8H12(g)
dC = k C2 dt
dC = k dt C2
d [C 4 H 6 ] = k [ C 4 H 6 ]2 dt
C0
dC = k C2
dt
0
1 1 = kt C C0
Reaccin de segundo orden
1 1 = +kt C C0
Tiempo medio
1 1 = k t1/ 2 1 / 2C 0 C 0 2 1 = k t1/ 2 C0 C0
C0
1/C �
pendiente = k
1 = k t1/ 2 C0 t1/ 2 = 1 k C0
Concentracin �
C0
C0 C0 Tiempo (unidades arbitrarias) �
1/C0
Reaccin de segundo orden
Tiempo �
17/11/2011
DETERMINACIN EXPERIMENTAL DE LAS LEYES DE VELOCIDAD
Orden Ecuac. de veloc. Ecuac. integrada tiempo medio
Mtodo de ensayo.
Cero v=k
C - C0 = k t
t1/ 2 =
t1 / 2 =
C0 2k
ln 2 k
Se determina la concentracin de reactivo a distintos intervalos de tiempo. Ejemplo: en la reaccin
+ Br2(ac) 2( ) + HCOOH(ac) ( ) 2 Br (ac) ( ) + 2 H (ac) ( ) + CO2(g) 2( )
Uno
v=kC
ln
C = k t C0
Dos
v = k C2
1 1 = kt C C0
1 1 2 = 2k t C 2 C0
t1/2 =
1 k C0
3 2 2 k C0
se coloca un gran exceso de cido frmico y se mide la concentracin de Br2 en funcin del tiempo:
tiempo / s 0 50 100 150 200 250 300 350 400
[Br2] 0,0120 0,0101 0,00846 0,00710 0,00596 0,00500 0,00420 0,00353 0,00296
Tres
v = k C3
t1/ 2 =
Unidades de k
tiempo / s 0 50 100 150 200 250 300 350 400
[Br2] 0,0120 0,0101 0,00846 0,00710 0,00596 0,00500 0,00420 0,00353 0,00296
Orden cero:
C - C0 = k t
tiempo / s 0 50 100 150 200 250 300 350 400
[Br2] 0,0120 0,0101 0,00846 0,00710 0,00596 0,00500 0,00420 0,00353 0,00296 Primer orden:
ln
C = k t C0
0,0101 0,0120 = - k x 50
k = 1,98x10-4 M/s
ln
0.0101 = k 50 0.0120 0.00596 = k 200 0.0 0120 0 0.00296 = k 400 0.0120
k = 3.4 10 3 s 1 k = 3.5 10 3 s 1
0,00596 0,0120 = - k x 200
k = 3,02x10-5 M/s
ln
0,00296 0,0120 = - k x 400
0.014 0.012 0.010
k = 2,26x10-5 M/s
-4
ln
k = 3.5 10 3 s 1
ln [Br2]
[Br2]
-5
0.008 0.006 0.004 0.002 0 100 200 300 400 500
-6 0 100 200 300 400 500
t / seg
t/s
tiempo / s 0 50 100 150 200 250 300 350 400
400 350 300 250 200 150 100 50 0 0
[Br2] 0,0120 0,0101 0,00846 0,00710 0,00596 0,00500 0,00420 0,00353 0,00296
Tiempo medio de reaccin.
1 1 Segundo orden: = kt C C0
1 1 = k 50 0.0101 0.0120 1 1 = k 200 0.00596 0.0120
1 1 = k 400 0.00296 0.0120
t1/ 2 = cte
k = 0.31 k = 0.42
k = 0.64
1 n 1 C0
Ejemplo: En la descomposicin del acetaldehido gaseoso a 528C se encontr que el tiempo necesario para descomponer la mitad del material era 410 s cuando la presin inicial era 363 torr y 880 s para una presin inicial de 169 torr. Cul es el orden de la reaccin?. Cunto vale la constante de velocidad?
1 / [Br2]
100 200 300 400 500
t/s
17/11/2011
Mtodo de las velocidades iniciales.
t1/ 2
1 = k C0
1 k= t1/ 2 C 0
Se determina la velocidad inicial a diferentes concentraciones iniciales de reactivo. Se determina el orden a travs de la ecuacin de velocidad v = k [A]m [B]n
k= k=
1 = 6.7 10 6 torr 1s 1 410 s 363 torr
A+ 2 B C
vinicial /Ms-1 5.50 x 2.20 x 10-5 1.65 x 10-5 10-6
[A]0 0.10 0.20 0.10
[B]0 0.10 0.10 0.30
1 = 6.7 10 6 torr 1s 1 880 s 169 torr
v1 5.50 10 6 M/s 1 k (0.10 M ) m (0.10 M ) n = = = v 2 2.20 10 5 M/s 4 k (0.20 M ) m (0.10 M ) n 1 1 = 4 2
m
m=2
Mecanismos de reaccin.
v1 5.50 10 6 M/s 1 k (0.10 M) m (0.10 M) n = = = v 3 1.65 10 5 M/s 3 k (0.10 M) m (0.30 M) n 1 1 = 3 3
n
n =1
NO + O3 NO2 + O2
k=
5.50 10 6 Ms M -1 = 5.50 10 4 M -2s -1 (0.10 M) 2 0.10 M
2 N2O5 4 NO2 + O2
v = 5.50 x 10-3 M-2s-1 [A]2 [B]
NO2 + CO � NO + CO2
2 N2O � 2N2 + O2
NO3: intermediario de la reaccin
17/11/2011
Molecularidad: nmero de molculas de reactivo que intervienen en un proceso elemental.
Proceso bimolecular:
NO + O3 NO2 + O2
Proceso unimolecular: O + N 2 + O2 N 2 + O3
Proceso termolecular:
Mecanismo y leyes de velocidad.
NO(g) + O3(g) NO2 (g)+ O2(g) O(g) + N2(g) + O2(g) N2(g) + O3(g)
d [NO] = k [NO][O 3 ] dt
d [O] = k [O][N 2 ][O 2 ] dt
d O* 3 = k O* 3 dt
3A+ 2BC+ D A+B E+ F A+E H A+F G H+G+B C+D 3A+2BC+D
O3*(g) O(g) + O2(g)
[ ]
[ ]
La molecularidad coincide con el orden de reaccin del proceso elemental.
3A+ 2BC+ D A+B E+ F A+E H A+F G H+G+B C+D 3A+2BC+D Si la primer etapa es la ms lenta,
1 d [A] = k1[A ] [B] 3 dt
La velocidad de una reaccin que se produce en etapas est determinada por la velocidad de la etapa ms lenta.
17/11/2011
Efecto de la temperatura sobre la velocidad de reaccin. La velocidad de una reaccin depende de: 2 N2O5 4 NO2 + O2 La concentracin de los reactivos. La temperatura a la cual se lleva a cabo. La presencia de un catalizador. Temp / C 25 45 65 k 3.46 x 10-5 4 19 x 10-4 4.19 4.87 x 10-3
k = AeEa / RT
Ecuacin de Arrhenius
Teora de las colisiones.
k = Ae
Ea / RT
La velocidad de una reaccin depende de:
Pendiente = -Ea/R
Concentracin de reactivos Temperatura v nmero de colisiones / segundo A + B productos
ln k = ln A kT2 kT1 =
Ea RT
ln
Ea 1 1 R T2 T1
MA + MB colisiones = 2 n A nB 8RT M M cm 3 s A B
1/ 2
MA + MB colisiones = 2 n A nB 8RT M M cm 3 s A B
2 HI (g) I2(g) + H2(g) 556 K, [HI] = 1 M
1/ 2
n molculas que chocan entre s = 6 x 1031 molc/(ml s) n molculas que reaccionan = 2 x 1014 molc/(ml s) es efectivo 1 choque de cada 1017.
Collis11.swf
17/11/2011
HI + Cl � HCl + I
Reaccin
Sin reaccin
Cono de reaccin
Estado de transicin Energa de activacin, Ea Barrera de activacin
Energa po otencial
(Estado de transicin) Reactivos
Energa potencial �
(Reactivos) (Productos)
Productos
Progreso de la reaccin
activa2[1].swf
Progreso de la reaccin �
Estado de transicin
Estado de transicin
velocidad de colisin T1/2
2 N2O5 4 NO2 + O2
Ea (inversa)
Ea (inversa)
Ea (directa)
Ea (directa)
Temp / C 25 45 65
Veloc. especfica 3.46 x 10-5 4.19 x 10-4 4.87 x 10-3
Energa potenc cial �
Productos
Energa potencial �
Reactivos
Endotrmica a
Exotrmica a
Reactivos
Productos Progreso de la reaccin �
318 298
1/ 2
= 1.033
4,19 10 4 = 12,11 5 3,46 10
Progreso de la reaccin �
17/11/2011
CATLISIS
Temperatura baja
CATALIZADORES
Fraccin de molcul las
Temperatura alta
Sustancias que cambian velocidad de una reaccin Acelera: catlisis positiva Retarda: catlisis negativa
Energa cintica
CATALIZADORES
Se recuperan al final de la reaccin Bastan pequeas cantidades Sufren cambios fsicos pero no qumicos
kinetics1.swf
Catlisis homognea:
Catlisis heterognea:
10
17/11/2011
Bibliografa P. Atkins, L. Jones, Principios de Qumica. Los caminos del descubrimiento, 3 Edicin, Buenos Aires, Editorial Mdica Panamericana (2006). B. Mahan, Qumica. Curso Universitario, Fondo Educativo Interamericano, USA (1977) S. Glasstone y D. Lewis, Elementos de Qumica Fsica, 2 edicin, Editorial Mdico Quirrgica Buenos Aires (1962) Quirrgica, (1962).
11
S-ar putea să vă placă și
- Ingeniería química. Soluciones a los problemas del tomo IDe la EverandIngeniería química. Soluciones a los problemas del tomo IÎncă nu există evaluări
- Problemas resueltos de Hidráulica de CanalesDe la EverandProblemas resueltos de Hidráulica de CanalesEvaluare: 4.5 din 5 stele4.5/5 (7)
- Cinetica QcaDocument19 paginiCinetica QcamirazelÎncă nu există evaluări
- C Práctica#05Document8 paginiC Práctica#05Fernando MoragaÎncă nu există evaluări
- Cinética química: órdenes de reacciónDocument35 paginiCinética química: órdenes de reacciónPatricia Emperatriz LopezaguirreÎncă nu există evaluări
- Cinética química ecuaciones de velocidadDocument6 paginiCinética química ecuaciones de velocidadEdwar MarquezÎncă nu există evaluări
- Cinetica Quimica-GeneralidadesDocument27 paginiCinetica Quimica-GeneralidadesEdgar Esteban Espinoza CabreraÎncă nu există evaluări
- Cinética Química - Unidad 2Document46 paginiCinética Química - Unidad 2Corazon ContentoÎncă nu există evaluări
- Solucionario Evaluación Parcial Quimica - PRUEBA 1Document3 paginiSolucionario Evaluación Parcial Quimica - PRUEBA 1ARNALDO ELARD HUILLCA HUARCAÎncă nu există evaluări
- Ecuaciones de velocidad y órdenes de reacciónDocument26 paginiEcuaciones de velocidad y órdenes de reacciónAnabel HernándezÎncă nu există evaluări
- Cinetica 2013Document30 paginiCinetica 2013JuliÎncă nu există evaluări
- Guia Problemas Resueltos Cinetica Reactores 141210194618 Conversion Gate01 PDFDocument51 paginiGuia Problemas Resueltos Cinetica Reactores 141210194618 Conversion Gate01 PDFLiz MartínezÎncă nu există evaluări
- 2019-I Taller Cinética QuímicaDocument4 pagini2019-I Taller Cinética Químicacarlos cuervoÎncă nu există evaluări
- Cinética de lixiviaciónDocument16 paginiCinética de lixiviaciónJersonPajueloCaballeroÎncă nu există evaluări
- Quimica General Cinetica QuimicaDocument31 paginiQuimica General Cinetica QuimicaFederico David FloresÎncă nu există evaluări
- Calculos Basicos QuimicosDocument28 paginiCalculos Basicos QuimicosDiego Joel100% (1)
- Cinetica TallerDocument10 paginiCinetica TallerStiven SofanÎncă nu există evaluări
- Guia Problemas Resueltos Cinetica ReactoresDocument51 paginiGuia Problemas Resueltos Cinetica Reactoresbarbaroj83% (23)
- Serie FisicoquímicaDocument12 paginiSerie FisicoquímicaMaría Fernanda López DíazÎncă nu există evaluări
- Introducción a la cinética químicaDocument48 paginiIntroducción a la cinética químicaJuan Villalobos Nuñez100% (1)
- Semana 9 - Cinética - Química GeneralDocument55 paginiSemana 9 - Cinética - Química GeneralSandra Gabriela Cordova VillodasÎncă nu există evaluări
- Semana 9 QG - VDocument55 paginiSemana 9 QG - Vjeydro689Încă nu există evaluări
- Reacciones químicas cinéticasDocument4 paginiReacciones químicas cinéticasKatharinneÎncă nu există evaluări
- Cinetica Quimica 1Document5 paginiCinetica Quimica 1MoMoÎncă nu există evaluări
- Aq 4Document5 paginiAq 4Manuel Almansa MontejanoÎncă nu există evaluări
- Físico Química II Semana13 Cinética Químicas 09-11-23Document20 paginiFísico Química II Semana13 Cinética Químicas 09-11-23Victor Hugo Rejas QuevedoÎncă nu există evaluări
- CinÉtica QuÍmicaDocument23 paginiCinÉtica QuÍmicaapi-372036475% (4)
- Guía Cinético Química III Medio Química. RevDocument5 paginiGuía Cinético Química III Medio Química. Revprofesorcienciaslab67% (3)
- Seminario Cinética Química - AlumnosDocument3 paginiSeminario Cinética Química - Alumnosabelix2005Încă nu există evaluări
- Problemas Tema 13-Cinética QuimicaDocument7 paginiProblemas Tema 13-Cinética Quimicavictor lebronÎncă nu există evaluări
- Bloque 1 Primera ParteDocument31 paginiBloque 1 Primera PartejaiderÎncă nu există evaluări
- Ejercicios de QuimicaDocument7 paginiEjercicios de QuimicaPaul Andres Mendoza VecinoÎncă nu există evaluări
- EJER cinetica U2Document4 paginiEJER cinetica U2Daniela Gordillo EspinosaÎncă nu există evaluări
- GRUPO 3 - Ejercición de CatalizadoresDocument14 paginiGRUPO 3 - Ejercición de CatalizadoresWalter HernandezÎncă nu există evaluări
- Cinetica QuimicaDocument53 paginiCinetica QuimicaOrlando Alvarez CubillosÎncă nu există evaluări
- Semana N°5 Cinetica Química 2023Document22 paginiSemana N°5 Cinetica Química 2023SEBASTIAN YAROTH MATOS HUAMANÎncă nu există evaluări
- Ejecicios de CinéticaDocument12 paginiEjecicios de CinéticaMAUREEN CECILIA OSORIO DIAZÎncă nu există evaluări
- 6 Reacción Quim, Tipos y Velocidad de ReacciónDocument18 pagini6 Reacción Quim, Tipos y Velocidad de Reaccióngrcv2001Încă nu există evaluări
- Ejercicios Reactores (2 Parcial)Document5 paginiEjercicios Reactores (2 Parcial)Rolando Torrez locoÎncă nu există evaluări
- Cinética Química - FQ 2016-IDocument26 paginiCinética Química - FQ 2016-IAndrea Real NúñezÎncă nu există evaluări
- Serie Unidades 1 y 2Document4 paginiSerie Unidades 1 y 2Emilio ZendejasÎncă nu există evaluări
- Tarea 1 Velocidad de Reacciã NDocument3 paginiTarea 1 Velocidad de Reacciã NElfra CasoÎncă nu există evaluări
- Química II: Evaluación parcial de reacciones químicas y equilibrio químicoDocument3 paginiQuímica II: Evaluación parcial de reacciones químicas y equilibrio químicoKevin Keith Manrique Acuña67% (6)
- Cinetica QuimicaDocument49 paginiCinetica QuimicaNicolas AristizabalÎncă nu există evaluări
- Solucionario - Guía de Ciencias QuímicaDocument31 paginiSolucionario - Guía de Ciencias QuímicaWalter Raul CulquiÎncă nu există evaluări
- Urzua Cinetica 2009 090717021227 Phpapp02Document48 paginiUrzua Cinetica 2009 090717021227 Phpapp02Cristian HernandezÎncă nu există evaluări
- Sesiã N 14 - UV - Cinã©tica de Las ReaccionesDocument39 paginiSesiã N 14 - UV - Cinã©tica de Las ReaccionesMiyaray LecarosÎncă nu există evaluări
- 1.cinética QuímicaDocument9 pagini1.cinética QuímicaDiego HerreraÎncă nu există evaluări
- Problemas de Cinetica QuimicaDocument16 paginiProblemas de Cinetica QuimicaCarlos AlmendarizÎncă nu există evaluări
- Ejercicios de CineticaDocument51 paginiEjercicios de Cineticamachomen1864635Încă nu există evaluări
- Capítulo 13 Cinética QuímicaDocument18 paginiCapítulo 13 Cinética QuímicaAcademia InternacionalÎncă nu există evaluări
- Cinetica - Quimica Unal 2013Document51 paginiCinetica - Quimica Unal 2013jesus ordoñezÎncă nu există evaluări
- Problemas de Quimica FisicaDocument4 paginiProblemas de Quimica FisicatorpedoluisÎncă nu există evaluări
- Materiales para ingeniería 1: Introducción a las propiedades, las aplicaciones y el diseñoDe la EverandMateriales para ingeniería 1: Introducción a las propiedades, las aplicaciones y el diseñoEvaluare: 5 din 5 stele5/5 (3)
- Modelado fenomenológico del proceso de combustión por difusión diéselDe la EverandModelado fenomenológico del proceso de combustión por difusión diéselÎncă nu există evaluări
- Introducción Al BazoDocument2 paginiIntroducción Al BazoJamir NaranjoÎncă nu există evaluări
- Hipertensión PortalDocument2 paginiHipertensión PortalJamir NaranjoÎncă nu există evaluări
- Introducción A Los Trastornos de Las PlaquetasDocument2 paginiIntroducción A Los Trastornos de Las PlaquetasJamir NaranjoÎncă nu există evaluări
- Introducción A Los Trastornos de Los Glóbulos Blancos (Leucocitos)Document2 paginiIntroducción A Los Trastornos de Los Glóbulos Blancos (Leucocitos)Jamir NaranjoÎncă nu există evaluări
- Ictericia en AdultosDocument3 paginiIctericia en AdultosJamir NaranjoÎncă nu există evaluări
- Proceso de Donación de SangreDocument6 paginiProceso de Donación de SangreJamir NaranjoÎncă nu există evaluări
- Linfoma de HodgkinDocument4 paginiLinfoma de HodgkinJamir NaranjoÎncă nu există evaluări
- Introducción A Los Trastornos de Las Células PlasmáticasDocument1 paginăIntroducción A Los Trastornos de Las Células PlasmáticasJamir NaranjoÎncă nu există evaluări
- Introducción A Los Trastornos MieloproliferativosDocument1 paginăIntroducción A Los Trastornos MieloproliferativosJamir NaranjoÎncă nu există evaluări
- Introducción A La Transfusión de SangreDocument3 paginiIntroducción A La Transfusión de SangreJamir NaranjoÎncă nu există evaluări
- Coagulación ExcesivaDocument2 paginiCoagulación ExcesivaJamir NaranjoÎncă nu există evaluări
- Generalidades Sobre La FarmacocinéticaDocument2 paginiGeneralidades Sobre La FarmacocinéticaJamir NaranjoÎncă nu există evaluări
- Introducción A Los LinfomasDocument3 paginiIntroducción A Los LinfomasJamir NaranjoÎncă nu există evaluări
- HemoderivadosDocument4 paginiHemoderivadosJamir NaranjoÎncă nu există evaluări
- Cómo Coagula La SangreDocument3 paginiCómo Coagula La SangreJamir NaranjoÎncă nu există evaluări
- Anomalías Testiculares y Escrotales PDFDocument2 paginiAnomalías Testiculares y Escrotales PDFJamir NaranjoÎncă nu există evaluări
- Generalidades Sobre El Sistema Endocrino - Trastornos Endocrinológicos y MetabólicosDocument5 paginiGeneralidades Sobre El Sistema Endocrino - Trastornos Endocrinológicos y MetabólicosJamir NaranjoÎncă nu există evaluări
- Componentes de La SangreDocument3 paginiComponentes de La SangreJamir NaranjoÎncă nu există evaluări
- TularemiaDocument4 paginiTularemiaJamir NaranjoÎncă nu există evaluări
- ShigelosisDocument3 paginiShigelosisJamir NaranjoÎncă nu există evaluări
- Introducción A Los Conceptos FarmacoterapéuticosDocument1 paginăIntroducción A Los Conceptos FarmacoterapéuticosJamir NaranjoÎncă nu există evaluări
- Generalidades Sobre La FarmacodinámicaDocument1 paginăGeneralidades Sobre La FarmacodinámicaJamir NaranjoÎncă nu există evaluări
- Reacciones Adversas A Los FármacosDocument3 paginiReacciones Adversas A Los FármacosJamir NaranjoÎncă nu există evaluări
- CóleraDocument3 paginiCóleraJamir NaranjoÎncă nu există evaluări
- Anomalías RenalesDocument3 paginiAnomalías RenalesJamir NaranjoÎncă nu există evaluări
- Anomalías Testiculares y EscrotalesDocument2 paginiAnomalías Testiculares y EscrotalesJamir NaranjoÎncă nu există evaluări
- Anomalías VesicalesDocument1 paginăAnomalías VesicalesJamir NaranjoÎncă nu există evaluări
- CriptorquidiaDocument3 paginiCriptorquidiaJamir NaranjoÎncă nu există evaluări
- CriptorquidiaDocument3 paginiCriptorquidiaJamir NaranjoÎncă nu există evaluări
- Síntomas causas ChagasDocument3 paginiSíntomas causas ChagasJamir NaranjoÎncă nu există evaluări
- Presa Chonta-Hidrologia PDFDocument299 paginiPresa Chonta-Hidrologia PDFKarina DávilaÎncă nu există evaluări
- TRYPPLAIDocument18 paginiTRYPPLAITairochi Huansi AlvanÎncă nu există evaluări
- INFORME DE LABORATORIO INORGANICA AVANZADA L CromoDocument4 paginiINFORME DE LABORATORIO INORGANICA AVANZADA L CromoJESÚS DAVID LÓPEZ JULIO ESTUDIANTE ACTIVOÎncă nu există evaluări
- Guía Rápida Cuarto LavadoDocument4 paginiGuía Rápida Cuarto LavadoRamiro MauricioÎncă nu există evaluări
- Impacto AmbientalDocument55 paginiImpacto AmbientalAnonymous g1AD9OÎncă nu există evaluări
- Examen de AdmisiónDocument19 paginiExamen de AdmisiónDiego Mamani CoriÎncă nu există evaluări
- 120.3 REFRACCIÓN DE LA LUZ, Ley de Snell PRIMERA EDICIONDocument75 pagini120.3 REFRACCIÓN DE LA LUZ, Ley de Snell PRIMERA EDICIONroodrigoooh0% (1)
- TEG KatherinDocument94 paginiTEG KatherinProfesor de Quimica General UCÎncă nu există evaluări
- Evaporadores 1Document16 paginiEvaporadores 1juangabrielmatiascasÎncă nu există evaluări
- Explosivos y Sistemas de IniciacionDocument48 paginiExplosivos y Sistemas de IniciacionCristian Zapata100% (1)
- Electro Fenton Con Hierro Galvanizado y PeroxidoDocument4 paginiElectro Fenton Con Hierro Galvanizado y PeroxidoJose L CamaÎncă nu există evaluări
- Método lavado fino 75 μm agregadosDocument1 paginăMétodo lavado fino 75 μm agregadosedelia delgadoÎncă nu există evaluări
- Soncco Soncco Carmelo FaustoDocument147 paginiSoncco Soncco Carmelo Faustoalbert castilloÎncă nu există evaluări
- Fuentes de Contaminación Fijas y MóvilesDocument5 paginiFuentes de Contaminación Fijas y MóvilesJavier Paez0% (1)
- Guia Regulares Prepa PDFDocument28 paginiGuia Regulares Prepa PDFAntonio Tonatiuh Garcia CoronadoÎncă nu există evaluări
- Laboratorio Virtual S Guia - LEY DE PROUSTDocument3 paginiLaboratorio Virtual S Guia - LEY DE PROUSTVader DarkÎncă nu există evaluări
- 2 NTDocument1 pagină2 NTJuan Enrique MatuteÎncă nu există evaluări
- Diluciones-laboratorio-técnicasDocument5 paginiDiluciones-laboratorio-técnicascarlea16Încă nu există evaluări
- El Efecto SeebeckDocument3 paginiEl Efecto SeebeckRosmeri Gonzalez GomezÎncă nu există evaluări
- Haccp Seco Salado de TolloDocument22 paginiHaccp Seco Salado de TolloFlor De Maria Ticona100% (1)
- Estudios de Parámetros en La Lixiviación en Pilas para Optimizar La Extracción de Oro PDFDocument93 paginiEstudios de Parámetros en La Lixiviación en Pilas para Optimizar La Extracción de Oro PDFJhoel SenjuÎncă nu există evaluări
- Resolucion 18-1682. Reglamento de TransporteDocument96 paginiResolucion 18-1682. Reglamento de TransportehenjisuÎncă nu există evaluări
- Clase de Bebidas GasiificadasDocument25 paginiClase de Bebidas GasiificadasNAYBEAÎncă nu există evaluări
- 331634477 Obtencion del eter β naftil metilico NEROLINADocument7 pagini331634477 Obtencion del eter β naftil metilico NEROLINAGoniÎncă nu există evaluări
- Sga Empresa MineraDocument28 paginiSga Empresa MineraCARLOS ALBERTO NICASIO SANCHEZÎncă nu există evaluări
- 05.protocolo Tintes Penetrantes ESCalera 3Document5 pagini05.protocolo Tintes Penetrantes ESCalera 3Carlos Alberto Leyva Giraldo100% (4)
- Folleto Postes PRFV - EscarsaDocument2 paginiFolleto Postes PRFV - Escarsaedward condori riveraÎncă nu există evaluări
- Brochure GacoRoof Benefits Flyer Spanish WDocument2 paginiBrochure GacoRoof Benefits Flyer Spanish WRonald AyasoÎncă nu există evaluări
- EXAMEN Reacciones Ideales.Document4 paginiEXAMEN Reacciones Ideales.ANA LUISA MEJIA ZULUAGA0% (1)
- Obtención de resina fenólica IPN MéxicoDocument25 paginiObtención de resina fenólica IPN MéxicoEduardo GonzalezÎncă nu există evaluări