Documente Academic
Documente Profesional
Documente Cultură
5 - Propiedades Periodicas PDF
Încărcat de
mksilvareyes100%(1)100% au considerat acest document util (1 vot)
795 vizualizări12 paginiTitlu original
5 - Propiedades Periodicas.pdf
Drepturi de autor
© Attribution Non-Commercial (BY-NC)
Formate disponibile
PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Attribution Non-Commercial (BY-NC)
Formate disponibile
Descărcați ca PDF, TXT sau citiți online pe Scribd
100%(1)100% au considerat acest document util (1 vot)
795 vizualizări12 pagini5 - Propiedades Periodicas PDF
Încărcat de
mksilvareyesDrepturi de autor:
Attribution Non-Commercial (BY-NC)
Formate disponibile
Descărcați ca PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 12
PROPIEDADES PERIDICAS
TABLA PERIDICA DE LOS ELEMENTOS QUMICOS
En 1869 Dmitri Ivnovich Mendeleiev publica su versin del sistema peridico en Alemania. En
1870 lo hace Lothar Meyer, justificando la periodicidad de los elementos respecto del volumen
atmico.
El criterio de Mendeleiev para la asignacin de los 63 elementos hasta esa fecha conocidos fue el
siguiente:
1. Elementos ordenados crecientemente de acuerdo con su masa atmica.
2. Elementos agrupados a partir de propiedades comunes como la valencia.
La clasificacin peridica de Mendeleiev no tuvo buena recepcin en un comienzo. Luego de
diversas modificaciones public en 1872 una nueva Tabla Peridica constituida por 8 columnas
desdobladas en dos grupos cada una, que al cabo de los aos se conoci como familia A y B.
CURSO: QUMICA COMN
MATERIAL QC N 04-B
2
INTRODUCCIN
El gran nmero de elementos conocidos y sustancias sintetizadas gener la necesidad urgente de
clasificarlos. Se descubre y enuncia como consecuencia, la ley peridica de los elementos qumicos
y producto de ella el ao 1869 se conforma la tabla peridica. Lothar Meyer en 1864 publica la
primera versin de la tabla peridica. En 1869 los trabajos realizados por el qumico ruso Dmitri
Ivanovich Mendeliev rinden frutos y es l quien con justicia la historia menciona como creador de
lo que hoy conocemos como "tabla peridica.
La capacidad visionaria de Mendeliev fue brillante; no slo enunci la ley de periodicidad
qumica, tambin orden los elementos encontrados y guard espacio para aquellos que an no
haban sido descubiertos, incluso predijo las propiedades fsicas y qumicas de stos.
LA TABLA PERIDICA
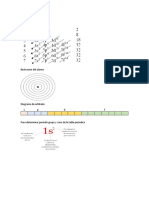
El comportamiento de los tomos est determinado por su configuracin electrnica, siendo la
distribucin de los electrones en el nivel ms externo la que determina su reactividad y naturaleza
qumica. Por esta razn, aquellos elementos que poseen una distribucin electrnica similar
presentarn propiedades qumicas similares.
Las propiedades de los tomos se repiten peridicamente si los elementos qumicos se
ordenan segn su nmero atmico creciente (Z).
Antiguamente la periodicidad en la clasificacin de los elementos fue concebida como funcin de
su masa atmica. Hoy se sabe ciertamente que la periodicidad; como propiedad, es funcin del
nmero atmico, vale decir, depende exclusivamente de la configuracin electrnica.
CLASIFICACIN PERIDICA DE LOS ELEMENTOS
Entre las muchas clasificaciones que otorgamos a los elementos de la naturaleza, debemos
destacar la ms importante; la clasificacin peridica, trabajo realizado por J. Lotear Meyer y
Dimitri Mendeleiev en el ao 1869, que entre otras cosas predijeron la existencia de elementos
an no encontrados.
Inicialmente la periodicidad en la clasificacin de los elementos fue concebida de la siguiente
forma: "muchas de las propiedades fsicas y qumicas de los elementos son funcin peridica de
sus masas atmica, en otras palabras, son dependientes de la masa de los elementos. Hoy
sabemos que esto no es as, ms an la periodicidad como propiedad es funcin del nmero
atmico y por lo tanto, de su configuracin electrnica.
La clasificacin de los elementos que en la actualidad estudiamos est presentada en forma de
tabla, donde los elementos estn dispuestos segn orden creciente de sus nmeros atmicos,
ubicndose en columnas y filas respectivas. Las columnas son llamadas GRUPOS, en tanto las filas
son denominadas PERODOS. Los elementos con nmero atmico superior a 92 son llamados
transurnicos (Uranio, Z= 92) y todos son artificiales.
3
PERODO
La tabla peridica presenta 7 perodos, y cada uno de ellos ubica elementos con nmero atmico
creciente de izquierda a derecha. El perodo para cada elemento indica la cantidad de niveles de
energa que presenta. As entonces, si un elemento presenta nmero atmico igual a 6, su
configuracin electrnica sera 1s
2
, 2s
2
2p
2
, por lo tanto debemos ubicarlo en el perodo 2
(segunda fila), puesto que posee slo 2 niveles de energa donde ubica estos 6 electrones. Si
presenta Z= 16, su configuracin es, 1s
2
, 2s
2
2p
6
, 3s
2
3p
4
y por tanto, queda ubicado en el
perodo 3.
GRUPO
La tabla peridica presenta 18 columnas, cada una de ellas ubica elementos con nmero atmico
creciente de arriba hacia abajo. Los elementos qumicos en una misma columna tienen
comportamiento qumico similar, esto significa que presentarn el mismo tipo de reaccin frente
a otro elemento y por tanto enlazarn de manera similar. Los grupos se designan con nmero
romano y van del I al VII, existe un grupo muy particular llamado grupo VIII o grupo 0 y
corresponde a la familia de los gases inertes. Para el resto de los grupos existe una
subclasificacin llamada "familia de grupos.
Grupo A: ELEMENTOS REPRESENTIATIVOS.
Grupo B: ELEMENTOS DE TRANSICIN EXTERNA.
NATURALEZA DE LOS ELEMENTOS
GRUPO NOMBRE
I - B METALES DE ACUAR
I - A METALES ALCALINOS
II - A METALES ALCALINO - TRREOS
III - A TRREOS
IV - A CARBONOIDES
V - A NITROGENOIDES
VI - A ANFGENOS O CALCGENOS
VII - A HALGENOS
0 GASES INERTES
4
ELEMENTOS METLICOS
Son casi todos slidos, a excepcin del mercurio (Hg) y galio (Ga).
Son muy buenos conductores de la corriente elctrica.
Tienen brillo metlico.
Son dctiles, lo que permite que bajo la accin de una fuerza puedan deformarse sin
romperse (confeccin de hilos o alambres metlicos).
Son muy buenos conductores de calor.
Son maleables, es decir, su capacidad de deformacin permite su uso para la confeccin de
lminas de grosor mnimo (un ejemplo es el oro).
ELEMENTOS NO METLICOS
Carecen de brillo metlico.
No son dctiles ni maleables.
Son malos conductores de la corriente elctrica y calor.
Corresponden ntegramente a los elementos del grupo VI y VII -A del sistema peridico.
ELEMENTOS METALOIDES
Poseen propiedades intermedias entre metales y no metales. Un ejemplo es el silicio,
metaloide semiconductor, con amplios usos tecnolgicos.
Ejercicio resuelto:
Resolvamos una configuracin electrnica y ubiquemos al elemento dentro de un grupo:
Z = 14
Configuracin electrnica:
1s
2
, 2s
2
2p
6
, 3s
2
3p
2
Perodo y grupo al que pertenece:
P = 3; G=IV
Clasificacin del elemento:
Representativo (IV - A)
Naturaleza del elemento:
CARBONOIDE (SILICIO)
Electrones de valencia:
4
Electrones desapareados:
2
5
LAS PROPIEDADES PERIDICAS
Anteriormente, hemos visto que la configuracin electrnica de los elementos indica una clara
periodicidad con el aumento del nmero atmico, por consiguiente otras propiedades mostrarn
tambin variaciones peridicas definiendo el comportamiento qumico del elemento.
Para una mayor compresin, es conveniente separarlas en dos grupos;
Las primeras se refieren a relaciones de tamao y son:
los radios atmicos y los radios inicos o cristalinos.
la densidad
el punto de fusin y ebullicin
Las segundas; son de carcter energtico y se denominan propiedades magnticas, entre
ellas destacan:
el potencial de ionizacin o energa de ionizacin.
la afinidad electrnica o electroafinidad.
la electronegatividad.
Cabe mencionar que una propiedad no es peridica cuando los valores que presenta son
siempre crecientes o decrecientes a medida que aumenta el nmero atmico. Ejemplo de
stas son la masa atmica y el calor especfico.
PROPIEDADES RELACIONADAS CON EL TAMAO
Variacin de los Radios Atmicos en el Sistema Peridico.
En los perodos, el radio atmico disminuye desde los metales alcalinos (Grupo I-A) hasta
el grupo de los halgenos (Grupo VII-A) y luego aumenta en el grupo de los gases inertes.
El factor que condiciona la disminucin de los radios atmicos es el aumento de la carga
nuclear efectiva (Zef), es decir, los electrones ms externos son atrados fuertemente
hacia el ncleo debido a que los electrones internos no apantallan muy bien a los
electrones externos contra la carga positiva del ncleo, haciendo que el tomo sea menor.
As, por ejemplo: en el perodo 2 se observa que; Li = 1,52 ; Be = 1,11 ; B = 0,77 y
C = 0,77 .
En los grupos, al aumentar Z, el tamao de los tomos aumenta gradualmente. Cuanto
mayor es el nmero cuntico principal de una capa, su radio es ms grande.
De este modo: en el grupo I-A los radios observados son Li = 1,52 ; Na = 1,86 ; K = 2,31 ;
Rb = 2,44 .
6
En general el Radio atmico vara en el sistema peridico de acuerdo con:
Radios Inicos
Los tomos pueden aceptar o perder electrones quedando entonces especies qumicas cargadas a
las cuales se les denomina iones. Por lo tanto, el radio inico, es el tamao de los iones, sea ste
catin o anin.
Podemos preguntarnos como es el radio de un catin y de un anin con respecto al elemento
neutro.
Por ejemplo:
Na:
10
[Ne] 3s
1
Na
+
:
10
[Ne] (tiene 2 niveles de energa)
Se deduce r Na
+
r Na
Cl:
10
[Ne] 3s
2
3p
5
Cl
-
:
18
[Ar] (al llegar un electrn, la nube electrnica se expande).
Se deduce r Cl
-
> r Cl
Sintetizando:
"El radio de un catin es menor que el radio del tomo neutro, para un mismo
elemento"
"El radio de un anin es mayor que el radio del tomo neutro, para un mismo elemento"
Iones Isoelectrnicos
Son aquellos que poseen el mismo nmero de electrones, por tanto, la misma configuracin
electrnica.
La tabla siguiente muestra algunos iones isoelectrnicos pertenecientes a la serie del Ne (z=10) y
sus respectivos radios inicos.
F
-1
Na
+
Mg
+2
Al
+3
1.36 0.95 0.65 0.50
Para lo anterior se cumple que:
r
Al
+3
r
Mg
+2
r
Na
+
r
F
-1
7
Densidad en la tabla peridica
En un perodo (fila) la densidad aumenta desde los extremos hacia el centro. En el caso de los
grupos, la densidad aumenta con el aumento del nmero atmico. Los elementos ms densos
estn en el centro inferior de la tabla peridica.
Los Puntos de Fusin y Ebullicin
Las tendencias en los puntos de fusin y ebullicin se justifican en parte por la medida de las
fuerzas de atraccin entre tomos o molculas.
Tomando como ejemplo el grupo de los halgenos en el sistema peridico, los 2 primeros (flor y
cloro) son gases a temperatura ambiente, el bromo (con mayor nmero atmico) es un lquido
rojizo y el yodo es un slido de color oscuro. La tendencia observada de gas a lquido y luego a
slido permite concluir que la atraccin entre los tomos es mayor conforme aumenta el nmero
atmico (Z). La tendencia general para el aumento de ambas propiedades es la que sigue
MAYOR DENSIDAD
8
Energa de Ionizacin
PROPIEDADES MAGNTICAS
Energa de Ionizacin o Potencial de Ionizacin (P.I.)
La energa de ionizacin de un tomo, corresponde a la energa mnima necesaria para sacar un
electrn desde el estado fundamental o in gaseoso. A diferencia de los tomos en los lquidos y
en los slidos, los que estn en estado gaseoso no son influidos por los tomos vecinos.
Para un tomo cualquiera como el sodio la energa de la primera ionizacin del tomo de Na est
dada por el proceso siguiente:
+ -
(g) (g)
Na + P.I. Na + e
"El valor de la energa de primera ionizacin depende de una combinacin de la carga
nuclear efectiva, el radio atmico y la configuracin electrnica".
El segundo P.I., ser la energa requerida para quitar el segundo electrn, y as para la
eliminacin sucesiva de electrones adicionales.
Variacin de la energa de ionizacin en el sistema Peridico
En los perodos el PI aumenta al aumentar Z, sin embargo, se observa una disminucin entre
los grupos IIA y IIIA; grupo VA y VIA por razones de estabilidad entre las configuraciones
electrnicas.
En los grupos, al aumentar Z, el PI disminuye.
Es necesario destacar que los menores valores de PI corresponden a los metales alcalinos y los
mayores valores de PI a los gases nobles.
Grfico de Potenciales de ionizacin para algunos metales y gases nobles
Afinidad Electrnica o Electroafinidad (E.A)
Los tomos no slo pierden electrones para formar iones positivos, sino tambin los ganan para
formar iones negativos. Como su nombre lo indica, la afinidad electrnica es una medida de la
tendencia de un tomo a ganar un electrn. Cuanto mayor es la afinidad electrnica de un tomo,
es ms probable que gane un electrn.
Cuantitativamente, la afinidad electrnica se define, y se determina experimentalmente, como
la energa requerida para separar un electrn de un anin gaseoso.
- -
(g) (g)
A + Energa A + e
9
Tambin se define como la energa liberada cuando un tomo de una muestra gaseosa
capta un electrn en su nivel ms externo.
- -
(g) (g)
A + e A + Energa
Tanto los factores que la condicionan como su variacin en el sistema peridico son homologables
al P.I., esto quiere decir que; al avanzar en los perodos, el radio atmico decrece y el electrn
que se agregue a la capa externa est ms cercano a una carga positiva, por consiguiente, se
libera ms energa cuando se agrega un electrn. En cambio, al bajar por un grupo, los
radios de las capas aumentan porque el nmero cuntico principal es mayor. El electrn agregado
est ms lejos de la carga positiva en el ncleo. En consecuencia, la cantidad de energa
liberada cuando se agrega un electrn es menor.
Electronegatividad (E.N)
La E.N. es la tendencia que ejerce un tomo en una molcula para atraer electrones compartidos
hacia su nube o densidad electrnica.
La E.N. no es una propiedad observable, es ms bien un concepto generalizador que permite
decidir hacia donde estn desplazados los electrones enlazados en una molcula.
La E.N. no tiene unidades. Linus Pauling en 1930, en base a los clculos de energa de enlaces,
postula una escala donde asigna el valor de 4,0 al flor, elemento ms electronegativo, quien
tiene mayor tendencia a atraer un par electrnico enlazado hacia su nube, y un valor de 0.7 para
el cesio elemento que tiene la menor atraccin por un par electrnico enlazado.
En la tabla siguiente se presentan algunos elementos con su correspondiente electronegatividad.
H 2,1
Li 1,0 Be 1,5 B 2,0 C 2,5 N 3,0 F 4,0
Na 0,9 Mg 1,2 Al 1,5 Si 1,8 P 2,1 Cl 3,0
K 0,8 Ca 1,0 Ga 1,6 Ge 1,8 As 2,0 Br 2,8
Variaciones Peridicas de la E.N.
En los Perodos, la E.N. aumenta al aumentar Z.
Al aumentar Z en los grupos, la E.N. disminuye.
Variacin de la Electroafinidad y Electronegatividad en el sistema peridico
10
RESUMEN DE LAS VARIACIONES PERIDICAS
GLOSARIO
Actnidos: Grupo de 15 elementos del periodo 7, todos radiactivos (la
serie parte con el Actinio y termina con el Lawrencio).
Pertenecen a los llamados "Elementos de transicin interna.
Configuracin electrnica: Ordenamiento secuencial de los electrones en un tomo
considerando 3 principios fundamentales de energa (Exclusin,
Mnima energa y Mxima multiplicidad).
Elementos Representativos: Elementos del grupo A. Son la serie que va desde el grupo I-A
al grupo de los gases nobles. Se denominan as porque el
nmero del grupo representa la cantidad de electrones en su
capa de valencia.
Elementos de Transicin: Conjunto de elementos ubicados en la zona central de la tabla
peridica. Todos incluyen en su nivel de valencia orbitales d
incompletos.
Iones isoelectrnicos: Especies qumicas con igual cantidad de electrones distribuidos
en los niveles de energa
Lantnidos: Grupo de 15 elementos del periodo 6. La serie comienza con el
Lantano (Z=57) y termina en el Lutecio (Z=71). Son
elementos que pertenecen al grupo de transicin interna, se
denominan corrientemente tierras raras.
11
TEST DE EVALUACIN MDULO 04-B
1. Un elemento calcgeno pertenece en el sistema peridico al grupo
A) II-A
B) IV-A
C) V-A
D) VI-A
E) VII-A
2. La configuracin electrnica para un tomo neutro permite conocer el (la)
A) radio atmico.
B) energa de ionizacin.
C) valor de electronegatividad.
D) valor de densidad que presenta.
E) cantidad de electrones de valencia que posee.
3. De la siguiente lista de tomos neutros, cul de ellos se ubica en el grupo VII-A?
A)
3
X
B)
9
Y
C)
12
Z
D)
15
W
E)
18
R
4. La siguiente es la configuracin electrnica para un elemento en estado basal
1s
2
, 2s
2
2p
6
, 3s
2
3p
3
De ella es posible inferir correctamente que
I) el elemento es representativo.
II) 3 de sus electrones estn desapareados.
III) presenta 2 niveles de energa completos con electrones.
A) Slo I.
B) Slo II.
C) Slo III.
D) Slo II y III.
E) I, II y III.
5. Un elemento trreo presenta configuracin electrnica del tipo
A) ns
1
B) ns
2
C) ns
2
p
1
D) ns
2
p
2
E) ns
2
p
3
12
6. En un perodo de la tabla, hacia la derecha se predice un aumento en el(la)
I) nmero atmico.
II) electronegatividad.
III) radio atmico.
De las anteriores es (son) correcta(s)
A) slo I.
B) slo II.
C) slo III.
D) slo I y II.
E) I, II y III.
7. El elemento con mayor energa de ionizacin del sistema peridico es el
A)
2
He
B)
10
Ne
C)
18
Ar
D)
19
K
E)
20
Ca
8. El ion
12
X
+2
tiene configuracin electrnica
A) 1s
2
B) 1s
2
, 2s
2
, 2p
6
C) 1s
2
, 2s
2
, 2p
6
, 3s
2
D) 1s
2
, 2s
2
, 2p
6
, 3s
2
, 3p
2
E) 1s
2
, 2s
2
, 2p
6
, 3s
2
, 3p
4
9. Un tomo neutro con 3 niveles de energa y 5 electrones de valencia tiene nmero atmico
igual a
A) 12
B) 14
C) 15
D) 16
E) 17
10. Cul es el tomo con mayor tamao en la siguiente lista?
A)
2
X
B)
9
Y
C)
15
R
D)
18
J
E)
20
L
DMON-QC04-B
Puedes complementar los contenidos de esta gua visitando nuestra web
http://www.pedrodevaldivia.cl/
S-ar putea să vă placă și
- Cuestionario de Tabla PeriodicaDocument11 paginiCuestionario de Tabla PeriodicaWendy RodriguezÎncă nu există evaluări
- Guia Problemas Unidad #4Document3 paginiGuia Problemas Unidad #4lidbetÎncă nu există evaluări
- Guía de Ejercicios Enlace QuímicoDocument4 paginiGuía de Ejercicios Enlace Químicoalguien6297732Încă nu există evaluări
- Balance de Ecuaciones QuimicaDocument8 paginiBalance de Ecuaciones QuimicaMiguel CZÎncă nu există evaluări
- NOMENCLATURADocument14 paginiNOMENCLATURAbaterod3Încă nu există evaluări
- Plan Mejoramiento QuimicaDocument2 paginiPlan Mejoramiento QuimicaJosé Nicolás Díaz Velásquez40% (5)
- Guia 4 Nomenclatura de Ácidos DecimoDocument5 paginiGuia 4 Nomenclatura de Ácidos DecimoalfonsoÎncă nu există evaluări
- Reino Protoctista (Arreglado)Document49 paginiReino Protoctista (Arreglado)Alfredo López100% (1)
- Evaluacion Diagnostica Quimica DecimoDocument2 paginiEvaluacion Diagnostica Quimica DecimomiljomaÎncă nu există evaluări
- Taller Estados de OxidaciónDocument2 paginiTaller Estados de OxidaciónIngri BaronÎncă nu există evaluări
- Balanceo RedoxDocument17 paginiBalanceo RedoxSantiago MacettoÎncă nu există evaluări
- Ejercicio Isotopo Isobaro EtcDocument4 paginiEjercicio Isotopo Isobaro EtcAlejandro AlegriaÎncă nu există evaluări
- Atmomos PDFDocument2 paginiAtmomos PDFVianis AriasÎncă nu există evaluări
- Test Sobre Modelos AtómicosDocument5 paginiTest Sobre Modelos AtómicosCarmen GrefaÎncă nu există evaluări
- EXQ345Document2 paginiEXQ345enrique20Încă nu există evaluări
- Propiedades PeriódicasDocument8 paginiPropiedades PeriódicasEdwis Castañeda VelásquezÎncă nu există evaluări
- Actividades Sobre Tabla Periodica 2doDocument3 paginiActividades Sobre Tabla Periodica 2dokellyisabel50% (2)
- Apunte de Estados de Oxidación y Nomenclatura de Compuestos InorgánicosDocument12 paginiApunte de Estados de Oxidación y Nomenclatura de Compuestos InorgánicosaleinÎncă nu există evaluări
- Evaluacion de QuimicaDocument4 paginiEvaluacion de Quimicamprm2579Încă nu există evaluări
- Evaluación La MateriaDocument3 paginiEvaluación La MateriaCesar Augusto Berdugo MendozaÎncă nu există evaluări
- Taller Enlaces - Números de Oxidación 8º 2020 Semana 3 Julio PDFDocument4 paginiTaller Enlaces - Números de Oxidación 8º 2020 Semana 3 Julio PDFJuan José MontesÎncă nu există evaluări
- Propiedades PeriodicasDocument8 paginiPropiedades PeriodicasRicardoCastilloÎncă nu există evaluări
- Tema 1.2 Enlace Quimico FICHA DE TRABAJO PDFDocument8 paginiTema 1.2 Enlace Quimico FICHA DE TRABAJO PDFJoaquin Rodrigo CuevaÎncă nu există evaluări
- 2° Estructura AtómicaDocument5 pagini2° Estructura AtómicaJaime Fisica Redolfo100% (1)
- Cuestionario de Enlace QuimicoDocument3 paginiCuestionario de Enlace QuimicoErick100% (1)
- 7° Saber Quimica 13 de Junio Estructura Tabla PeriodicaDocument1 pagină7° Saber Quimica 13 de Junio Estructura Tabla PeriodicaHФЛΞЏ ŁФvΞЏÎncă nu există evaluări
- Actividad CRUCIGRAMA CLASIFICACION DE LA MATERIADocument1 paginăActividad CRUCIGRAMA CLASIFICACION DE LA MATERIAcarolina del Pilar Valdiviezo Coveñas100% (1)
- Los Modelos y Teorías AtómicasDocument3 paginiLos Modelos y Teorías AtómicasCB HankÎncă nu există evaluări
- 2 - Ejercicios - Masa Atomica - IsotoposDocument2 pagini2 - Ejercicios - Masa Atomica - IsotoposTatiana CainÎncă nu există evaluări
- TP N 2 Sistemas Materiales 1Document1 paginăTP N 2 Sistemas Materiales 1valkiriaaÎncă nu există evaluări
- Crucigrama Tabla PeriodicaDocument3 paginiCrucigrama Tabla PeriodicaJunta de accion comunalÎncă nu există evaluări
- Alquenos y AlquinosDocument4 paginiAlquenos y AlquinosCarlos Alfonso Jara Benites100% (1)
- 1° - Química - I - Ii BimDocument57 pagini1° - Química - I - Ii BimSami Galicia Mendez100% (1)
- Clasificacion de La Tabla PeriodicaDocument5 paginiClasificacion de La Tabla Periodicachristian de la cruzÎncă nu există evaluări
- Examen de FísicaDocument3 paginiExamen de FísicaUriel PerezÎncă nu există evaluări
- 10 Quimica Guía 1Document6 pagini10 Quimica Guía 1socrates delgadoÎncă nu există evaluări
- Cuestionario de Hidrocarburos 1Document4 paginiCuestionario de Hidrocarburos 1Ignacio Rodriguez Robles100% (1)
- Guia Tabla Periodica Taller 10%Document2 paginiGuia Tabla Periodica Taller 10%Carlos berrios CanalÎncă nu există evaluări
- Taller Tabla Periodica Taller 2Document7 paginiTaller Tabla Periodica Taller 2WilliamAndresAlvarez100% (1)
- Ejercicios de Propiedades PeriodicasDocument2 paginiEjercicios de Propiedades PeriodicasYarara YararaÎncă nu există evaluări
- 5 Configuración Electrónica QUIMICA TERCERODocument5 pagini5 Configuración Electrónica QUIMICA TERCEROluisandersonsotodava100% (2)
- GUÍA 5 Nomenclatura Inorganica (SOLUCION)Document3 paginiGUÍA 5 Nomenclatura Inorganica (SOLUCION)Heber Gamboa Torres50% (2)
- Cta - Tabla PeriodicaDocument3 paginiCta - Tabla PeriodicaJuan Delfín Orbegoso GamboaÎncă nu există evaluări
- Examen Quimica Once Grado Segundo PeriodoDocument4 paginiExamen Quimica Once Grado Segundo PeriodonicolasprofecolecrisÎncă nu există evaluări
- Quimica InorganicaDocument24 paginiQuimica Inorganicamario caleroÎncă nu există evaluări
- Lectura y Actividad Nomenclatura Parte 1Document9 paginiLectura y Actividad Nomenclatura Parte 1María Esther Sandoval TorresÎncă nu există evaluări
- Nomeclatura Nomenclatura InorganicaDocument3 paginiNomeclatura Nomenclatura InorganicamelquiadesÎncă nu există evaluări
- QUIM - GUIA #2 - Peso EquivalenteDocument7 paginiQUIM - GUIA #2 - Peso Equivalenteandres_c4145061Încă nu există evaluări
- Sesión 3 Óxidos-HidróxidosDocument29 paginiSesión 3 Óxidos-HidróxidosKelion Tadeo SantosÎncă nu există evaluări
- 10.quimica 3er Año Guia 6Document8 pagini10.quimica 3er Año Guia 6Karlo TacÎncă nu există evaluări
- Capitulo 1 Quimica (Autoevaluacon)Document3 paginiCapitulo 1 Quimica (Autoevaluacon)Joel Starlin Mateo AraujoÎncă nu există evaluări
- CASOS C y T - JORNADA SABADO 16 OCTUBRE SIN CLAVEDocument7 paginiCASOS C y T - JORNADA SABADO 16 OCTUBRE SIN CLAVEroger LLamosas felixÎncă nu există evaluări
- Clase T.PDocument2 paginiClase T.PYessenia Yakelin Hernandez GutierrezÎncă nu există evaluări
- ACTIVIDADES Soluciones - ResueltasDocument8 paginiACTIVIDADES Soluciones - ResueltasPablo GautoÎncă nu există evaluări
- Guia Noveno FILOGENIADocument16 paginiGuia Noveno FILOGENIAJaime Hernan Cortes RestrepoÎncă nu există evaluări
- Taller de Nivelación Química 2020Document20 paginiTaller de Nivelación Química 2020xÎncă nu există evaluări
- Configuración ElectrónicaDocument21 paginiConfiguración ElectrónicaSofia VargasÎncă nu există evaluări
- Guia de Aprendizaje Tabla Periódica 1eros MediosDocument7 paginiGuia de Aprendizaje Tabla Periódica 1eros Mediosidgd3007Încă nu există evaluări
- Unidad 2 Tabla PeriodicaDocument52 paginiUnidad 2 Tabla Periodicaluis.ramirez8960Încă nu există evaluări
- Manual Acero Refuerzo ArmadurasDocument285 paginiManual Acero Refuerzo ArmadurasCris Anwandter100% (1)
- Lab N°1 MicroparasitologíaDocument14 paginiLab N°1 MicroparasitologíamksilvareyesÎncă nu există evaluări
- Plano Modulacion Cotiz N 6101 CLIENTE - Obra RXX Mxx-Layout1-1Document1 paginăPlano Modulacion Cotiz N 6101 CLIENTE - Obra RXX Mxx-Layout1-1mksilvareyesÎncă nu există evaluări
- Cotizacion N°6101Document1 paginăCotizacion N°6101mksilvareyesÎncă nu există evaluări
- PCR Tec MEDICADocument15 paginiPCR Tec MEDICAmksilvareyesÎncă nu există evaluări
- Unidad 11-Estructura de TechumbreDocument44 paginiUnidad 11-Estructura de TechumbremdoproyectosÎncă nu există evaluări
- Desafi Üo N - 1 Qui ÜmicaDocument2 paginiDesafi Üo N - 1 Qui ÜmicamksilvareyesÎncă nu există evaluări
- Ensayo FM CC 3a JEG 16 11 09Document27 paginiEnsayo FM CC 3a JEG 16 11 09mksilvareyesÎncă nu există evaluări
- Lab Genetica 1Document24 paginiLab Genetica 1mksilvareyesÎncă nu există evaluări
- Mini Ensayo N - 7 Qui ÜmicaDocument9 paginiMini Ensayo N - 7 Qui ÜmicamksilvareyesÎncă nu există evaluări
- Primeros Auxilios Clase GeneralDocument72 paginiPrimeros Auxilios Clase GeneralmksilvareyesÎncă nu există evaluări
- Ensayo Matemática 2013Document32 paginiEnsayo Matemática 2013mksilvareyesÎncă nu există evaluări
- Tips N - 6 Qui ÜmicaDocument4 paginiTips N - 6 Qui ÜmicamksilvareyesÎncă nu există evaluări
- Mini Ensayo N - 4 Qui ÜmicaDocument8 paginiMini Ensayo N - 4 Qui ÜmicamksilvareyesÎncă nu există evaluări
- Quimica 1 Particulas SubatomicasDocument8 paginiQuimica 1 Particulas SubatomicasJuan Matus100% (1)
- Tips N - 3 Qui ÜmicaDocument5 paginiTips N - 3 Qui ÜmicamksilvareyesÎncă nu există evaluări
- Tips #8 QuímicaDocument4 paginiTips #8 QuímicaJoshua Zamorano FuentesÎncă nu există evaluări
- Acidos y BasesDocument16 paginiAcidos y BasesAbraham Olivares CortésÎncă nu există evaluări
- Tips N - 1 Qui ÜmicaDocument4 paginiTips N - 1 Qui ÜmicamksilvareyesÎncă nu există evaluări
- Tips N - 2 Qui ÜmicaDocument4 paginiTips N - 2 Qui ÜmicamksilvareyesÎncă nu există evaluări
- Ensayo Lenguaje 2013Document36 paginiEnsayo Lenguaje 2013mksilvareyesÎncă nu există evaluări
- Apuntes Psu de A 2009 Libro Manual Preuniversitario Victor JaraDocument240 paginiApuntes Psu de A 2009 Libro Manual Preuniversitario Victor JaraBraulio FuentesÎncă nu există evaluări
- PSU Fisica Plan ComunDocument226 paginiPSU Fisica Plan ComunNicolás Melgarejo Sabelle71% (7)
- Giddens, Turner - La Teoría Social Hoy, IntroducciónDocument9 paginiGiddens, Turner - La Teoría Social Hoy, Introducciónnikos3194Încă nu există evaluări
- El Testamento de Dios-1Document5 paginiEl Testamento de Dios-1Daniela EstradaÎncă nu există evaluări
- Conductos de Distribucion de Agua Potable LINEA DE TIEMPODocument15 paginiConductos de Distribucion de Agua Potable LINEA DE TIEMPOIrlanda Yareth De Leon HuertaÎncă nu există evaluări
- Vida y Obre 1ra Parte PDFDocument4 paginiVida y Obre 1ra Parte PDFEctivismo Veracruz Boca del RioÎncă nu există evaluări
- Ensayo - Extorsion y Su ImpactoDocument4 paginiEnsayo - Extorsion y Su ImpactoSulmi MezaÎncă nu există evaluări
- Programas Específicos NOM 004Document2 paginiProgramas Específicos NOM 004EAVÎncă nu există evaluări
- 4 Sem. Tem. Sel. de Hist de La Pedagogia y La Educ. IDocument107 pagini4 Sem. Tem. Sel. de Hist de La Pedagogia y La Educ. IDiego RiveraÎncă nu există evaluări
- Dennis Michael Vega Sotelo - Visita Intima y La Realidad PenitenciariaDocument24 paginiDennis Michael Vega Sotelo - Visita Intima y La Realidad PenitenciariaRuben Yanqui MachacaÎncă nu există evaluări
- Método KonMariDocument9 paginiMétodo KonMariisabel m0% (3)
- Reglamento Interno Eulogio 2015Document47 paginiReglamento Interno Eulogio 2015JOSE DIMAS PINEDA PINEDAÎncă nu există evaluări
- 1 PBDocument39 pagini1 PBLaura GaviriaÎncă nu există evaluări
- Cómo Archivar de Forma Práctica Tus DocumentosDocument2 paginiCómo Archivar de Forma Práctica Tus DocumentosNelson GuillenÎncă nu există evaluări
- Liderazgo de EquiposDocument17 paginiLiderazgo de EquiposMarlon MontenegroÎncă nu există evaluări
- ACTIVIDAD No 13 ELABORACION DOCUMENTOS ORGANIZACIONELESDocument2 paginiACTIVIDAD No 13 ELABORACION DOCUMENTOS ORGANIZACIONELESTATIANA SALAZAR LOPEZÎncă nu există evaluări
- Resumenes de Textos Criticos Sobre PolicialDocument64 paginiResumenes de Textos Criticos Sobre PolicialroxanamaldonadoÎncă nu există evaluări
- Tarea 3 Grupo 102504 - 15Document26 paginiTarea 3 Grupo 102504 - 15javier m ontillaÎncă nu există evaluări
- Empresa Juguetes MagicosDocument3 paginiEmpresa Juguetes MagicosJose TeniÎncă nu există evaluări
- Fisiografia Puebla Inegi PDFDocument3 paginiFisiografia Puebla Inegi PDFNéstor Manuel RezzaÎncă nu există evaluări
- Epicor 10-En Español - Colaboración Social en Los NegociosDocument3 paginiEpicor 10-En Español - Colaboración Social en Los NegociosAB GarciaÎncă nu există evaluări
- Registro de Los Estudiantes: Anramirez35@Poligran - Edu.CoDocument4 paginiRegistro de Los Estudiantes: Anramirez35@Poligran - Edu.CopaulaÎncă nu există evaluări
- Frankenstein Con RespuestasDocument3 paginiFrankenstein Con RespuestasRanita R. Ulloa33% (6)
- Los ManciniDocument4 paginiLos ManciniEmanuel Ortega VidalÎncă nu există evaluări
- Prueba 1 Individual - Semestre 1 2022Document3 paginiPrueba 1 Individual - Semestre 1 2022Valentina RodriguezÎncă nu există evaluări
- Inventario FifoDocument3 paginiInventario FifoMacalu MacaluÎncă nu există evaluări
- Concepto, Sujeto y Objeto de TSDocument4 paginiConcepto, Sujeto y Objeto de TSJuan JarverÎncă nu există evaluări
- Diapositivas GuacamayaDocument16 paginiDiapositivas Guacamayamiguel sanabriaÎncă nu există evaluări
- Sucesion Intestada Via JudicialDocument3 paginiSucesion Intestada Via JudicialFlor Sotelo VillaÎncă nu există evaluări
- 06 SCTR Pension - Trianon Ascensores - Junio 2021 3Document2 pagini06 SCTR Pension - Trianon Ascensores - Junio 2021 3Joan Flores AndradeÎncă nu există evaluări
- Analisis Diagrama de GanttDocument3 paginiAnalisis Diagrama de GanttJessica PaizÎncă nu există evaluări
- Plantilla Propuesta Económica iMPLEMENTACION DE iNVERNADEROSDocument19 paginiPlantilla Propuesta Económica iMPLEMENTACION DE iNVERNADEROSnelsonÎncă nu există evaluări