Documente Academic
Documente Profesional
Documente Cultură
Texto de Fisicoquimica Completo
Încărcat de
Nalyi Maldonado PérezDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Texto de Fisicoquimica Completo
Încărcat de
Nalyi Maldonado PérezDrepturi de autor:
Formate disponibile
UNIVERSIDAD NACIONAL EXPERIMENTAL
FRANCISCO DE MIRANDA
REA DE TECNOLOGA
DEPARTAMENTO DE QUMICA
Compendio terico de Fisicoqumica
Elaborado por:
Br. Colina Luisana
Ing. Arevalo, Jos
Ing. Moreno, Mara
Lic. Prez, Dennis
Ing. Rodrguez, Angela
Ing. Ruiz , Xavier
Ing. Vargas, Alberto
Ing. Acosta, Ivn
Ing. Morn, Emilio
Punto Fijo, Mayo 2007.
INTRODUCCIN
La fisicoqumica es una ciencia que estudia los principios bsicos que determinan las
propiedades fsicas y qumicas de una sustancia o una mezcla, lo cual permite conocer como se
comporta un material o sistema, comprender como ocurre una reaccin bajo determinadas
condiciones, describir cualitativa y cuantitativamente los cambios fsicos y qumicos de
materiales basndose en las ciencias matemticas; todo esto con el objeto de encontrar
aplicaciones en el diseo de materiales, innovadores procesos qumicos, as como tcnicas
analticas modernas.
Esta asignatura proporciona al alumno una base general macroscpica de las principales leyes
que rigen los sistemas fisicoqumicos, por lo que es necesario que el estudiante tenga
conocimientos de los principios bsicos de la qumica general y orgnica, en cuanto a la
estructura, composicin y propiedades de las sustancias, as como el dominio de las leyes
universales de la termodinmica que explican el comportamiento y las propiedades extensivas e
intensivas de los distintos sistemas. Todo esto, con la finalidad de comprender los fundamentos
bsicos de la cintica qumica y la catlisis, adems del comportamiento de las soluciones
electrolticas y no electrolticas, y los sistemas en equilibrio de fases, de tal forma, que adquiera
la habilidad y la destreza en la resolucin de problemas relacionados con reacciones qumicas,
inclusive adquirir los conocimientos previos y en algunos casos complementarios para el curso
de asignaturas como Operaciones Unitarias II y III e Ingeniera de la reacciones, las cuales son
esenciales para todo individuo que desea desarrollarse en el rea de procesos, como es el caso
de los ingenieros qumicos de la UNEFM.
El propsito del siguiente compendio es proporcionarle al estudiante la informacin bsica
necesaria para el curso de la asignatura Fisicoqumica. Para la elaboracin del mismo se
emplearon las bibliografas recomendadas y utilizadas durante el curso, adicionalmente se
incorporaron puntos de vista de los diferentes autores, quienes en su esfuerzo por concentrar en
este trabajo la informacin ms relevante, presentan al final problemas tpicos resueltos para que
el estudiante cuente con un recurso didctico que contribuya con la comprensin del contenido
presentado en este compendio.
Se espera con este trabajo brindarle al estudiante una herramienta ms que le permita entender
el amplio y fascinante mundo de la fisicoqumica.
UNIDAD I
PRINCIPIOS BSICOS DE LAS SOLUCIONES
1) Generalidades de las Soluciones:
Las soluciones son mezclas homogneas de dos o ms substancias, que pueden separarse por
mtodos fsicos en sus diversas substancias componentes.
En una solucin, aquella sustancia que se encuentra en mayor proporcin se conoce como
Solvente y las dems como Solutos, donde la relacin existente en la cantidad de materia
entre el soluto y el solvente se expresa como la concentracin de la solucin y constituye una de
sus principales caractersticas, ya que la gran mayora de las propiedades de estas dependen
exclusivamente de la concentracin.
As mismo, las soluciones verdaderas difieren de las suspensiones y de los sistemas coloidales,
fundamentalmente en el tamao de partcula del soluto o de la fase dispersa y en las
propiedades que derivan de dicha diferencia, en general, las soluciones verdaderas en fase
lquida, no desprenden soluto por decantacin ni tienen la propiedad de dispersar la luz.
Aunque existen soluciones slidas como las amalgamas y las aleaciones, o soluciones gaseosas
como el aire, en lo que respecta al medio ambiente y a la vida diaria, las soluciones ms
frecuentes son las soluciones en fase lquida, y dentro de ellas, las soluciones acuosas. Existen
varios tipos de soluciones, y se pueden agrupar o clasificar tomando en cuenta diferentes
propiedades y aspectos, como la fase de los componentes o la solubilidad del soluto en el
solvente.
Una de las clasificaciones se realiza segn la naturaleza electroltica de los componentes de la
solucin; en donde, existen dos tipos de soluciones, las no electrolticas y las electrolticas. De
estas se estudiarn una serie de propiedades
Termodinmicas y coligativas, tomando en cuenta si son ideales o no segn las leyes de Raoult,
Henry entre otros.
Las propiedades de las soluciones pueden clasificarse en dos categoras: Aquellas que
dependen exclusivamente de la concentracin de partculas en solucin, independientemente de
su naturaleza, (Propiedades Coligativas o Colectivas) y aquellas que dependen
fundamentalmente de la naturaleza de las partculas del soluto, ms que de la cantidad,
(Propiedades No-Colectivas).
Las propiedades No-Coligativas de las soluciones permiten clasificar los diferentes solutos y sus
soluciones, como substancias o soluciones electrolticas y no electrolticas. Las propiedades
coligativas de las soluciones dan origen a fenmenos como la smosis y la reduccin de la
presin de vapor del agua.
1.1) CARACTERSTICAS DE LAS SOLUCIONES.
- Son sistemas ptimamente homogneos formados por una sola fase (monofsicos).
- Sus componentes entran en proporcin variables dentro de ciertos lmites.
- Sus propiedades dependen de la naturaleza de los componentes y de la proporcin en que
estos se encuentren.
- Sus componentes son separables mediante procedimientos fsicos (cambio de fase).
- Si se dejan en reposo durante un tiempo, las fases no se separan ni se observa
sedimentacin, es decir las partculas no se depositan en el fondo del recipiente. (sino ocurre
la evaporacin).
- Cuando se aade un soluto a un solvente, se alteran algunas propiedades fsicas del
solvente, as por ejemplo, al aumentar la cantidad del soluto, sube el punto de ebullicin y
desciende el punto de solidificacin de la solucin en comparacin con el solvente puro.
- Poseen la capacidad de ejercer una presin osmtica.
- Las partculas de soluto tienen menor tamao que en las otras clases de mezclas.
- Sus componentes o fases no pueden separarse por filtracin.
- Las propiedades qumicas de los componentes de una solucin no se alteran.
1.2) PRINCIPALES CLASES DE SOLUCIONES
Las soluciones se pueden clasificar segn varios criterios, tales como:
Fases de los componentes.
La solubilidad del soluto en el solvente.
La relacin soluto solvente o soluto solucin (la concentracin del soluto).
La naturaleza electroltica de los componentes.
a) Segn las fases de los componentes:
La soluciones pueden ser slidas, liquidas o gaseosas, para ello debe considerarse la
apariencia de la solucin una vez que los componentes se han mezclado. Por ejemplo,
cuando se mezcla el jarabe de refresco con el CO
2
para obtener una gaseosa, la solucin, es
considerada en fase lquida por su apariencia a pesar que las sustancias que la componen
una es lquida (jarabe) y la otra gaseosa (CO
2
).
b) Segn la solubilidad del soluto en el solvente.
Para clasificar las soluciones segn la solubilidad del soluto en el solvente, se debe aclarar que
significa solubilidad. La solubilidad de un compuesto en un solvente concreto y a una
temperatura y presin dadas se define como la cantidad mxima de ese compuesto que puede
ser disuelta en la solucin, y esta depende del tipo de molculas que estn involucradas en la
solucin, as, en la medida que los solutos tengan una estructura similar a la del solvente, la
solubilidad de los mismos aumentar. Normalmente, la solubilidad aumenta con la temperatura.
As el agua caliente puede disolver ms sal que el agua fra, aunque si el soluto es un gas,
ocurre justamente lo contrario, al calentarse el agua, el gas se disuelve menos y abandona la
disolucin. Por eso los refrescos calientes pierden su efervescencia con mayor rapidez que los
refrescos fros y las aguas fras suelen ser ricas en pesca, ya que contienen oxigeno disuelto. Al
preparar una solucin de un slido en un lquido, la proporcin de los componentes puede variar
de acuerdo con la temperatura. Al referirse a la solubilidad, es necesario tomar como un punto
de referencia un valor constante, por eso se ha establecido
el llamado coeficiente de solubilidad; el cual se define, como la masa en gramos de una
sustancia pura que se disuelve en 100 gr. de solvente a una temperatura determinada. Si son
calculados los coeficientes de solubilidad de una sustancia a diferentes temperaturas y se llevan
a un sistema de coordenadas cartesianas, colocando la masa de la sustancia pura que se
disuelva en 100 gr. de solvente sobre un eje de las ordenadas y las distintas temperaturas sobre
el eje de las abscisas, obtendremos una serie de puntos que unidos entre si dan una curva
denominada curva de solubilidad.
Las soluciones segn la solubilidad del soluto en el solvente son:
Totalmente solubles (miscibles).
Parcialmente solubles.
Insolubles (inmiscibles).
Las soluciones en donde existe una solubilidad total son aquellas donde el soluto y el solvente
son solubles en cualquier proporcin, y esto es atribuible a la presencia de interacciones
intermoleculares similares entre las sustancias constitutivas (fuerzas intermoleculares). Por otro
lado, en las soluciones parcialmente solubles, la mezcla se comporta slo como una solucin en
una regin de concentraciones especfica, la cual depende de la temperatura y presin del
sistema. Esto se observa cuando las molculas se pueden enlazar utilizando ms de un tipo de
fuerzas intermoleculares, en donde la cantidad de materia juega un papel fundamental, tal es el
caso de los cidos carboxlicos, estos, si poseen una baja masa molar las fuerzas
intermoleculares predominantes son los puentes de hidrgeno y por lo tanto pueden ser
miscibles con otra sustancia cuyo enlaces intermoleculares se den de forma similar (tal como el
agua), en cambio si su masa molar es alta, las fuerzas intermoleculares predominantes son las
fuerzas de Van Der Walls, debido a ello, la solubilidad en el agua disminuir considerablemente
a medida que aumente la masa molecular del cido. Finalmente, cuando el soluto es insoluble en
el solvente, no existe una solucin, sino se forma una mezcla de sustancias, las cuales poseen
caractersticas totalmente diferentes a las descritas anteriormente.
Las soluciones totalmente solubles se dividen en:
Saturadas, aquellas donde existe un equilibrio entre la fase dispersa y el medio
dispersante, ya que a la temperatura que se tome en consideracin, el solvente no
es capaz de disolver ms soluto.
Insaturadas, aquellas en donde la fase dispersa y la dispersante no estn en
equilibrio a una temperatura dada; es decir, estas pueden admitir ms soluto hasta
alcanzar su grado de saturacin.
Sobresaturadas, representan un tipo de disolucin inestable, ya que presenta
disuelto ms soluto que el permitido para la temperatura dada. Para preparar este
tipo de disoluciones se agrega soluto en exceso, a elevada temperatura y luego se
enfra el sistema lentamente. Estas soluciones son inestables, ya que al aadir un
cristal muy pequeo del soluto, el exceso existente precipita; de igual manera
sucede con un cambio brusco de temperatura.
c) Segn la relacin soluto-solvente y/o soluto-solucin lo cual se denomina concentracin, la
clasificacin se puede realizar de forma cualitativa o cuantitativa.
En trminos cualitativos:
Concentrada: son aquellas soluciones donde la cantidad de soluto es grande con
respecto al volumen total de la solucin.
Diluidas; son aquellas soluciones donde la cantidad de soluto es pequea con respecto
al volumen total de la solucin.
Esta terminologa no es recomendable cuando se dispone de ms de dos soluciones, debido a
su relatividad porque dependen de cual solucin se este usando como referencia, y en funcin
de esta se establece como son las dems.
En trminos cuantitativos las soluciones se clasifican de acuerdo a las unidades de
concentracin que expresan la relacin entre la cantidad de soluto y solvente o solucin.
a) Unidades Fsicas:
- Porcentaje en peso (% P/P); se define como la cantidad en gramo de soluto contenido
en 100 gr. de solucin (Ec. 1) Esta forma de expresar la concentracin ,implica al momento de
preparar la solucin, pesar separadamente el soluto y el solvente; aunque este procedimiento
facilita la comprensin de la concentracin y hasta cierto punto su preparacin, la aplicacin de
estas soluciones en el laboratorio se dificulta debido a que obliga a conocer tambin, la densidad
de la solucin. Si a esto se le suma el hecho de que los volmenes de soluto y solvente,
generalmente no son aditivos en las soluciones, las dificultades empeoran. La expresin
porcentual peso a peso en las soluciones se conserva particularmente, para las soluciones
acuosas de los cidos y de las bases cuya presentacin como reactivo, viene disuelta en agua
tal es el caso del HCl, HF, HBr, HNO
3
, H
2
SO
4
, H
3
PO
4
, CH
3
COOH y el NH
3
. Para facilitar el
manejo de estas soluciones, la concentracin peso a peso de la solucin se acompaa con su
densidad a 20 C.
Gramos de Soluto
% PP = -------------------------
100 Gramos de Solucin
- Relacin % Peso Volumen (%P/V); se define como la cantidad en gramos de soluto
disuelto en 100cc o 100ml de solucin (Ec. 2). Esta forma de expresar la concentracin de una
solucin facilita enormemente su preparacin y aplicacin. Desafortunadamente, el porcentaje
peso a volumen suele ser una unidad muy grande para muchos fines analticos. Generalmente
cuando se expresa la concentracin de una solucin en trminos porcentuales, casi siempre la
expresin se refiere al porcentaje peso a volumen.
Gramos de Soluto
% PV = ---------------------------
100 mls de Solucin
- Relacin % Volumen-Volumen (%V/V); se define como la cantidad en cc o mL disuelto
en 100 cc o 100 mL de solucin.
%V/V = mL de soluto Ec. 3
100 mL de solucin
- Relacin Partes por Milln; esta relacin expresa las partes de soluto que se hallan
contenidas en un milln de partes de solucin. As, las partes por milln son equivalentes a los
gramos de soluto por metro cbico de solucin, a los gramos de soluto por tonelada de solucin
o a los miligramos de soluto por kilogramo de solucin (Ec. 4). Ahora, como esta forma de
expresar la concentracin de una solucin se utiliza particularmente para soluciones diluidas y
como un kilogramo de agua equivale a un litro en trminos de volumen, generalmente las partes
por milln se aproximan a los miligramos por litro.
Gramos de Soluto Gramos de Soluto Miligramos de Soluto
ppms = ----------------------- = ----------------------- = --------------------------
Tonelada de Solucin m3 de Solucin Litro de Solucin
Ec. 1
Ec. 2
Ec. 4
Las partes por milln son la forma de expresar normalmente la concentracin de sustancias
como hierro, manganeso, sulfatos, nitratos, grasas y aceites y metales pesados en el agua.
b) Unidades Qumicas:
- Normalidad: se define como el nmero equivalente en gramo de soluto por litro de solucin.
En la actualidad esta unidad de concentracin no se emplea debido a los problemas que se
generan en los clculos por el peso equivalente y por consiguiente a los equivalentes gramos de
soluto
Normalidad (N) = Eq. gr de sto / 1Lt de sol.
- Molaridad: se define como el nmero de moles de soluto presentes en un litro de solucin
Molaridad (M) =numero de moles sto / 1Lt de sol.
- Molalidad: se define como el nmero de moles de soluto que se encuentran disueltos en 1000
gr (1Kg.) de solvente.
Molalidad (m) = num. de moles sto. / 1000 gr solvente
d) Segn la Naturaleza Electroltica de los Componentes de la Solucin, las soluciones son
electrolticas y no electrolticas.
Las Soluciones No Electrolticas son aquellas en las cuales el soluto no se ioniza cuando esta
en solucin, razn por la cual no permiten el flujo libre de los electrones en el seno de la
solucin. Caso contrario son las soluciones electrolticas, las cuales se caracterizan por formar
iones en solucin, aumentando la conductividad trmica y elctrica de la solucin.
1.3) SOLUCIONES NO ELECTROLTICAS
1.3.1) Propiedades Termodinmicas
Las propiedades de la materia que se presentan como evidentes reciben el nombre de
propiedades macroscpicas, y son los primeros caracteres distintivos que se utilizan para
describir una determinada situacin fsica. La termodinmica trata exclusivamente de estas
propiedades, y son estas necesarias y suficientes para la descripcin del sistema. Deben ser
determinadas experimentalmente y son slo observables macroscpicamente. Ya se describi
que son soluciones no electrolticas a continuacin se hablara de sus propiedades
termodinmicas como lo son: Energa libre, entalpa, entropa, potencial qumico, fugacidad y
coeficiente de actividad.
No todas las variables termodinmicas son independientes, ya que una vez definidas algunas de
ellas las otras pueden obtenerse en funcin de estas, mediante una ecuacin de estado.
Las variables termodinmicas pueden clasificarse en:
Extensivas: que dependen de la cantidad de materia, ej. el volumen, la energa.
Intensivas: que son independientes de la cantidad de materia, ej. La presin (P), la
temperatura (T), densidad.
1.3.1.1) Energa Libre:
Segn Maron y Prutton, la energa libre total de una solucin, F, viene dada por la ecuacin:
Ec. 5
Ec. 6
Ec. 7
Donde 1 F , 2 F , etc., son las energas libres molares parciales de los constituyentes de la
solucin y n
1
, n
2
, etc., son los nmeros de moles de los diversos constituyentes presentes.
Anlogamente, la entropa y la entalpa total estn dadas por las relaciones:
Como F= H -TS, se deduce en seguida desde las ecuaciones (7), (8) y (9) que
e igual es vlido para los diversos constituyentes de una solucin. Las ecuaciones:
| |
=
|
\ .
P
F
S
T
| |
=
|
\ .
T
F
V
P
| |
|
=
|
\ .
2
P
F
H
T
T T
se aplican a los constituyentes de la solucin, y as resulta para cada uno de ellos:
En estas ecuaciones, se mantienen constantes las concentraciones de las sustancias. Por medio
de la ecuacin = + ln F F RT a , podemos escribir que la energa libre molar parcial de cada
constituyente de una solucin es igual a:
= + ln i i
i
F F RT a
Donde i F es la energa libre molar parcial del constituyente i, en un estado estndar
conveniente, y a
i
, es su actividad en la solucin a una concentracin dada. El estado particular
elegido como tipo es arbitrario. Al tratar con soluciones de sustancias totalmente miscibles, es
usual tomar como estado tipo el de los componentes de la solucin en estado puro. Bajo estas
condiciones, i F es idntico a
i
F , de la sustancia pura; es decir, =
o
o
i
i
F F . De nuevo, si
empleamos fracciones molares para expresar las concentraciones, la actividad a
i
puede
relacionarse con la fraccin molar N
i
mediante la ecuacin:
Donde
,
i
es un coeficiente de actividad que permite convertir N
i
en a
i
. Sobre sta base, la
ecuacin de i F se transforma en
Ec. 7
Ec. 8
Ec. 9
Ec. 10
Ec. 11
Ec. 12
Ec. 13
Ec. 14
Ec. 15
Ec. 16
Ec. 17
Ec. 18
Ec. 19
Ec. 20
1.3.1.4) Potencial Qumico
El potencial qumico de un componente (en la fase) es una funcin de estado que depende de la
temperatura, presin y composicin de la fase. El potencial qumico es una propiedad intensiva,
ya que es la relacin entre las variaciones infinitesimales de dos propiedades extensivas.
i = G T, P, Nj = i
Ni
Ecuacin de la termodinmica qumica para procesos en equilibrios trmicos y mecnico, pero
no necesariamente en equilibrio qumico y de fases.
1.3.1.6) Coeficiente de Actividad:
Otro mtodo usado frecuentemente para definir los estados tipo emplea la definicin anterior
nicamente para el solvente, es decir, =
o
o
i
i
F F y = =
,
1 1 1
1 a N cuando N
1
1. Al mismo
tiempo, para un soluto que no se disocia, se tiene que:
Ecuac. 25
donde
,
2
es el coeficiente de actividad del soluto y la definicin se completa diciendo que:
Aqu se toma como punto de referencia una solucin cuyo soluto est diluido a infinito de
solvente, y en este estado tenemos que a
2
=N
2
=0 y
,
2
=1. Por lo tanto, la concentracin de la
solucin que tiene a
2
=N
2
-
,
2
=1 se convierte en el estado tipo para el soluto y, en este estado,
= 2 2
o
F F . Ecuaciones anlogas se usan para relacionar a
2
con las concentraciones expresadas
en otras unidades distintas a las fracciones molares. As, si deseamos expresar C en moles por
litro, tendremos:
Aqu f
2
es el coeficiente de actividad del soluto para la concentracin C en moles por litro. De
nuevo, si deseamos usar la molalidad m y el coeficiente de actividad
,
2
, entonces:
En base a estas definiciones = = =
,
2 2 2
1 f en soluciones diluidas a infinito, pero, para otras
concentraciones, los diversos coeficientes de actividad en general tendrn valores diferentes
para una solucin de concentracin dada.
1.4) Proceso de Solucin
Consideremos el proceso
Ecuac. 21
Ecuac. 26
Ecuac. 27
Ecuac. 28
Ecuac. 29
Ecuac. 30
Ecuac. 31
en el cual se mezclan n
1
moles de sustancia pura A
1
con n
2
de A
2
tambin pura y forman una
solucin binaria. El cambio de G
m
en cualquier propiedad termodinmica extensiva de un
sistema a una temperatura y presin dadas es entonces:
Donde G es la propiedad de la solucin, y
1
o
G y
2
o
G los valores de la propiedad por mol para
los dos constituyentes puros. De nuevo, como G est dada por:
Entonces la insercin de la ecuacin (33) en la (32) da:
(34)
Donde:
(35)
Y
(36)
En estas ecuaciones G
m
representa el cambio integral de alguna propiedad termodinmica
como resultado de un proceso de mezcla, mientras que 1 G y 2 G representan las
variaciones en las cantidades molares parciales correspondientes a la propiedad involucrada.
La ecuacin (34) al aplicarse al cambio de energa libre que acompaa al proceso de mezcla nos
da:
(37)
Anlogamente obtenemos para los cambios de calor, entropa y volumen de mezcla
(38)
(39)
(40)
Adems, a una temperatura T, la energa libre, entropa y calor de mezcla estn relacionados
entre s mediante la ecuacin
(41)
La ecuacin (37) se puede escribir de otra manera al tener en cuenta la ecuacin
= + ln i i
i
F F RT a . En base a considerar a los constituyentes puros como estados tipo, esta
ecuacin nos da:
= + ln i
i i
F F RT a (42)
y de aqu tendremos, para los constituyentes de una solucin binaria, que
(43)
(44)
Al sustituir estas expresiones en la ecuacin (37), resulta que F
m
es
(45)
Ecuac. 32
Ecuac. 33
1.5) Condicin de Equilibrio para las soluciones
Consideremos un sistema compuesto de varias fases, cada una de las cuales contiene cierto
nmero de componentes. La energa libre total de cada fase estar dada, en general, por la
ecuacin
Prestemos ahora atencin a dos cualesquiera de las fases presentes, y supongamos que dn
1
,
dn
2
, etc., moles de los diversos constituyentes se transfieran de una fase a otra, manteniendo
constantes la T y P. La disminucin de energa libre de una de ellas ser entonces:
(46)
mientras que el incremento de energa libre en la segunda ser:
El cambio neto de dicha energa debida a esa transferencia, dF, es:
(47)
Sin embargo, cuando hay equilibrio entre las dos fases, tendremos (dF)
T,P
= 0,
(48)
De nuevo, como la transferencia de cada constituyente de una fase a otra pueden hacerse
independientemente, se sigue tambin que cada trmino de la ecuacin (48) debe ser cero, esto
es:
(49)
Adems, como dn
1
, dn
2
etc., no son cero, deben serlo los otros trminos y de aqu que: F
1
=F
1
;
F
2
=F
2
, y as sucesivamente. Finalmente, como el mismo argumento puede repetirse para un par
de fases cualquiera que se elija, el resultado anterior es vlido para todos, es decir, que para las
fases de un sistema en equilibrio resulta:
(50)
La ecuacin (35) establece que para el equilibrio a T y P constantes en un sistema
multicomponente con numerosas fases, la energa libre molar parcial de cada constituyente debe
ser igual en todas las fases. Si una de ellas es una sustancia pura, las deducciones anteriores se
aplican an, excepto que ahora P para esta sustancia en la fase pura se hace igual a F
o
i.
1.6) Equilibrio entre una solucin y su fase de vapor
Consideremos una solucin que contiene componentes voltiles. Si se coloca en un
espacio evacuado, se producir una fase de vapor que contiene los constituyentes de una
solucin. Las condiciones que deben regir en el sistema para que exista equilibrio entre la
solucin y la fase de vapor se obtienen as.
La energa libre molar del constituyente i en la fase de gas est dada por esta ecuacin F= F
o
+
RT
*
Ln f esto es :
(51)
donde el subndice g se refiere al gas. De nuevo la energa libre molar parcial del mismo
constituyente en solucin est dada por la ecuacin:
(52)
Para el equilibrio entre la solucin y la fase gaseosa tendremos =
( ) g
i
F F i . En consecuencia,
de las ecuaciones (51) y (52) resulta:
(53)
Como a una temperatura dada el lado derecho de la ecuacin (53) es constante la cantidad que
abarca el logaritmo debe ser constante tambin, y as resulta:
(54)
Para evaluar K, se utiliza el hecho de que, para un constituyente puro i, a
i
=1 y f
i(g)
=f
o
i(g)
, donde
este ltimo valor representa la fugacidad del vapor sobre el constituyente puro. Al colocar estas
cantidades en la ecuacin (54) vemos que K = f
i(g)
, y de aqu que la ecuacin se convierte en:
(55)
La ecuacin (55) muestra que la actividad de un constituyente voltil de una solucin est dada
por la relacin de la fugacidad del vapor del constituyente en equilibrio con la solucin dividida
por la fugacidad del vapor en equilibrio con el constituyente puro. De nuevo,
donde P
i
es la presin de vapor de un constituyente dado sobre la solucin
y
i(g)
es su coeficiente de actividad. Anlogamente donde P
i
es la presin de
vapor del constituyente puro y
i(g)
su coeficiente de actividad. Al colocar estas identidades en la
ecuacin (55) resulta:
(56)
Finalmente, si los vapores se comportan como gases ideales, entonces y
la ecuacin (41) es simplemente:
(57)
As a
i
se obtiene de las presiones de vapor del constituyente sobre la solucin y cuando es puro.
La sustitucin de la ecuacin (57) en la ecuacin nos da
para la energa libre de mezcla de una solucin binaria:
(58)
Cuando los gases se comportan idealmente, los valores de las se hacen la unidad, y la
ecuacin (58) se simplifica:
(59)
Aqu, todas las cantidades son directamente medibles y por lo tanto F
m
se obtiene fcilmente a
partir de los datos de la presin de vapor.
1.7) Propiedades Coligativas de las Soluciones No Electrolticas-soluto No Voltil
Las propiedades coligativas de las soluciones no electrolticas merecen una seria consideracin
porque nos proporcionan mtodos valiosos de determinacin del peso molecular de las
sustancias disueltas y la posibilidad de evaluar cierto nmero de cantidades termodinmicas de
gran importancia. A continuacin se presentan los principios bsicos comprendidos, y su uso
para la determinacin de los pesos moleculares.
1.7.1) Abatimiento de la Presin de Vapor
Un soluto disuelto hace descender la presin de vapor del lquido solvente en que se encuentra.
Este descenso se comprende fcilmente, si tenemos en cuenta la ley de Raoult. Si designamos
por N
1
a la fraccin molar del solvente, N
2
del soluto, P la presin de vapor del solvente puro y P
la presin de vapor del solvente sobre una solucin dada resulta entonces, segn la ley de
Raoult que P viene dada por:
P = PN
1
(60)
Como N
1
en una solucin es siempre menor que la unidad, P debe ser menor que P. En
consecuencia la solucin de un soluto en un solvente hace descender la presin de vapor de
este ltimo respecto a la del solvente puro. Adems cuando el soluto no es voltil no contribuye
a la presin total de vapor, y por tanto la
ecuacin (60) nos da tambin la presin de vapor por sobre la solucin, que en este caso es
debida al solvente solo y siempre es menor que P.
La magnitud de este descenso, P, es:
P = P - P = P - PN
1
P = P(1-N
1
)
P = PN
2
(61)
De acuerdo con la ecuacin (61) la disminucin de presin de vapor del solvente depende tanto
de la presin de vapor de ste como de la fraccin molar del soluto. Con otras palabras, es
funcin de la naturaleza del solvente y de la concentracin del soluto, pero no de la naturaleza
de ste ltimo. Sin embargo, si consideramos el descenso relativo de presin de vapor, es decir,
la relacin P/P; entonces de a ecuacin (65):
2
P P P
N
P P
= = (62)
Depende solamente de la fraccin molar de soluto y es completamente independiente, tanto de
la naturaleza del soluto, como del solvente. La ecuacin (62), una forma de la ley de Raoult,
para solucione de solutos no voltiles, no muestra que la disminucin que nos ocupa, es una
propiedad coligativa, por que depende nicamente de la concentracin del soluto.
La validez de la aplicacin de la ley de Raoult, en este caso puede juzgarse por los datos de la
tabla 1, correspondiente a soluciones de manita a 20C. Teniendo en cuenta las dificultades de
medir pequeas diferencias de presin de vapor, la concordancia entre la teora y la experiencia
es satisfactoria.
Tabla 1. Descenso de la presin de vapor de las soluciones acuosas de manita a 20C (P =
17.51 mm Hg)
Tanto la ecuacin (61) como la (62), pueden emplearse para calcular el descenso de la presin
de vapor de las soluciones de solutos no voltiles; o bien, conociendo aquel se emplean para
determinar el peso molecular de la sustancia disuelta.
1.7.2) Elevacin del Punto de Ebullicin
Las soluciones que contienen solutos no voltiles, hierven a temperaturas ms elevadas
que las del solvente puro. La diferencia entre los puntos de ebullicin de la solucin y del
solvente para una presin constante establecida, se conoce como elevacin del punto de
ebullicin, que depende de la naturaleza del solvente y la concentracin del soluto, pero es
independiente, por lo menos en soluciones diluidas, de la naturaleza del soluto en tanto este no
se ioniza. Este aumento es fcil de comprender en funcin de la disminucin de la presin de
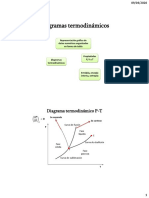
vapor y es una consecuencia directa de ella. Consideremos el diagrama presin temperatura de
la figura 1.
Figura 1. Ascenso del punto de ebullicin debida a los solutos.
La curva AB, representa la presin de vapor del solvente puro como funcin de la temperatura.
Como la presin de vapor de la solucin es, para todas las temperaturas, menor que la del
solvente, la curva de Presin de Vapor - Temperatura de la solucin debe quedar debajo de la
del solvente puro, y de aqu que quedar representada por otra, tal como CD en la figura. A fin
de alcanzar el punto de ebullicin correspondiente a cierta presin externa que se ejerce sobre la
solucin P, debe calentarse a temperaturas a las cuales las presiones de vapor respectivas
igualan la de confinamiento.
Como lo seala el diagrama, el solvente puede alcanzar la presin P a la temperatura T
o
, pero
la solucin debe elevarse a T<T
o
, antes de que se alcance la misma presin. En consecuencia
para la misma presin externa, la solucin debe hervir a una temperatura ms elevada que la del
solvente puro; y, el ascenso del punto de ebullicin de la solucin, Tb, est dado por, Tb = T-
T
o
. Estas consideraciones son completamente generales y se aplican a cualquier solucin de
soluto no voltil.
Al aplicar la ecuacin de Clausius-Clapeyron y la ley de Raoult a las condiciones descritas, es
posible deducir una relacin entre el ascenso del punto de ebullicin de la solucin y su
concentracin.
Como los puntos E y F quedan sobre la curva de la presin de vapor de la solucin, ambos estn
dados por la ecuacin de Clausius-Clapeyron:
ln
v o
o
P H T T
P R T T
| |
=
|
\ .
(63)
Donde P y P, son las presiones de vapor de la solucin a las temperaturas T y T
o
respectivamente. H
v
es el calor de vaporizacin por mol de solvente desde la solucin. Si sta
es diluida, aquel calor equivale esencialmente al de vaporizacin por mol de solvente puro. De
nuevo, cuando la solucin es diluida, T no es muy diferente a T
o
, y de aqu que podemos escribir
TT
o
= T
o
2
. En consecuencia, la ecuacin (63) se transforma en
2
ln ln
v b
o
P P H T
P P R T
= = (64)
P es la presin de vapor de la solucin a T
o
, mientras que P
o
es tambin la del solvente puro a la
misma temperatura.
Cuando la ley de Raoult es aplicable a la solucin, resulta
1 2
1
P
N N
P
= = (65)
donde N
2
es la fraccin molar del soluto en solucin. De aqu, la ecuacin (65) se convierte en
( )
2 2
ln 1
v b
o
H T
N
R T
= (66)
Adems, el desarrollo de ln(1-N
2
) en serie de potencias, de la expresin siguiente:
( )
2 3
2 2
2 2
ln 1 ...
2 3
N N
N N =
Y como se especific que la solucin era diluida, N
2
debe ser pequeo; con lo cual todos los
trminos del desarrollo despus del primero, deben considerarse
despreciables, y podemos escribir N
2
en vez de ln(1-N
2
) en la ecuacin (70), y queda:
2 2
v b
o
H T
N
R T
=
Y por tanto,
2
2
o
b
v
RT
T N
H
=
(67)
La ecuacin (67) nos da el aumento del punto de ebullicin de una solucin en funcin del punto
de ebullicin y calor de vaporizacin del solvente, y de la fraccin molar del soluto en la solucin.
Como para un solvente dado, T
o
y H
v
son constantes, el aumento del punto de ebullicin en
soluciones diluidas, es proporcional a la fraccin molar de soluto nicamente y no es
dependiente de la naturaleza del soluto, por tanto, es una propiedad coligativa.
Es prctica comn en el estudio de esta propiedad, expresar la concentracin no en fraccin
molar, sino en moles de soluto por 1000g de solvente, es decir, molalidad m. Si ahora
designamos con N
1
el nmero de moles de solvente en 1000g, entonces,
2
1 1
m m
N
n m n
=
+
Puesto que en las soluciones diluidas, m es pequeo en relacin con n
1
, y puede despreciarse.
Por lo tanto:
2
1
o
b
v
RT
T m
H n
| |
=
|
\ .
(68)
Para un solvente dado, todas las cantidades en el parntesis de la ecuacin (68) son constantes,
y el trmino total. Escribiendo
2
1
o
b
v
RT
K
H n
=
(69)
La ecuacin (70) se reduce finalmente a:
b b
T K m = (71)
De acuerdo con la ecuacin (71), el ascenso del punto de ebullicin de una solucin diluida es
directamente proporcional a la amoralidad e la solucin. La constante de proporcionalidad K
b
se
denomina constante molal de elevacin del punto de ebullicin o constante ebulloscpica, y
significa el incremento del punto de ebullicin de la solucin 1molal de un soluto en un solvente
cuando son aplicables las leyes de las soluciones diluidas a dichas concentraciones.
La validez de la ecuacin (71) se comprueba de varias formas. En primer lugar, la ecuacin
exige que para un solvente dado, el ascenso del punto de ebullicin sea proporcional a la
molalidad independientemente de su naturaleza, y adems que la constate de proporcionalidad
resulte independiente tambien de la naturaleza o concentracin del soluto.
En ambos casos, dicha ecuacin se muestra de acuerdo con los resultados experimentales de
las soluciones diluidas. An es posible realizar una prueba ms crtica, al comparar los valores
observados de K
b
con los predichos por la ecuacin (71). Si esta es vlida, debe ser factible
calcular la constante de ascenso del punto de ebullicin por mol por un conocimiento del punto
de ebullicin normal y del calor de vaporizacin del solvente. Por ejemplo, T
o
=373.2K en el caso
del agua, y 539Cal/g es el calor de vaporizacin. Al aplicar la ecuacin (71) resulta:
( )
( )
2
1
2
1.987 373.2
1000
18.02 539
18.02
0.513
o
b
v
b
b
RT
K
H n
K
K
=
=
=
Este valor es muy bueno en relacin con el observado experimentalmente de K
b
=0.52.
La tabla 2 muestra los puntos de ebullicin normales y las constantes ebulloscpicas observadas
de buen nmero de solventes, y as mismo se incluyen las de ascenso molar calculadas de la
ecuacin (71), para facilitar la comparacin. La concordancia entre los valores observados y
calculados es muy satisfactoria, si tenemos en cuenta la incertidumbres de algunas
determinaciones de los puntos de ebullicin: en vista de lo cual, se utiliza la ecuacin (71) al
calcular calores de vaporizacin del solvente, a partir de los valores experimentales de K
b
.
Tabla 2. Constantes de ascenso del punto de ebullicin molal
1.7.4) Presin Osmtica
Existe una serie de membranas semipermeables que solo permiten el paso de
determinadas especies qumicas a travs de ellas. Imaginaremos un recipiente dividido en dos
cmaras por una membrana rgida, diatrmica y semipermeable, que permite el paso del
disolvente A, pero no el del soluto B. En la cmara de la izquierda situamos el disolvente A puro
y en la cmara de la derecha una disolucin de B en A.
Figura 2. Presin osmtica de las soluciones.
Imponemos la restriccin de que A no sea un electrolito. Supongamos que inicialmente, llenamos
ambas cmaras de forma que la altura de los lquidos en los dos tubos capilares sean iguales.
Por tanto las cmaras se encuentran inicialmente a la misma presin: P
I
= P
D
, donde los
subndices indican izquierda y derecha. Como la membrana es diatrmica, el equilibrio trmico
se mantiene constantemente: T
I
=T
D
=T.
El potencial qumico de A en la cmara izquierda es *
A
. Como P y T son iguales en los dos
lquidos, la presencia del soluto D en la disolucin de la derecha hace que
A
en la cmara de la
derecha sea menor que *
A
.
Las sustancias fluyen desde las zonas con mayor potencial qumico, hacia aquellas donde el
potencial qumico es menor, y en nuestro caso *
A
=
A
,
I
>
A,D
. Por lo tanto la sustacia A fluir a
travs de la membrana de izquierda a derecha. El lquido asciende en el tubo de la derecha, por
lo que aumenta la presin en la cmara de la derecha. Sabemos que
A
A
T
V
P
| |
=
|
\ .
.
Como A V suele ser positivo en una disolucin diluida, el aumento de la presin da lugar a un
aumento de
A,D
, hasta que alcanza finalmente el equilibrio cuando
A,D
=
A,I
. Como la
membrana es impermeable al paso de B, no swe puede formular la ecuacin de equilibrio para
B. Si la membrana fuera permeable tanto para A como para B, las condiciones de equilibrio
implicaran concentraciones iguales de B y presiones iguales en las dos cmaras.
Sean P y P+ las presiones de equilibrio en las cmaras izquierda y derecha, respectivamente.
Llamamos a presin osmtica. Es la presin adicional que es necesario aplicar a la
disolucin para que
A
de la disolucin
sea igual a *
A
de forma que se alcance el equilibrio para la especie A a travs de la membrana
que separa la disolucin de la sustancia pura.
1.8) SOLUCIONES ELECTROLTICAS
1.8.1) Caractersticas:
Las soluciones de los no electrlitos en agua y otros solventes no conducen la
electricidad, presentando las propiedades coligativas descritas anteriormente. Las relaciones
establecidas en aquellos casos, se cumplen tambin por las soluciones que dan para las
sustancias disueltas pesos moleculares normales, o mltiplos sencillos de los mismos.
Por otra parte, existen sustancias, especialmente sales, cidos inorgnicos y bases, que
al disolverse en agua o un solvente apropiado originan soluciones que conducen la electricidad
en mayor o menor proporcin, y se denominan electrlitos, los cuales tambin presentan
propiedades coligativas de descenso de presin de vapor, aumento del punto de ebullicin,
descenso del punto de congelacin y presin osmtica, pero no obedecen las relaciones simples
deducidas para los no electrlitos.
Los efectos coligativos observados son siempre mayores que los que cabra esperar de la
concentracin correspondiente. Podemos establecer lo dicho de otra manera, las soluciones de
electrlitos se comportan como si el soluto tuviera un peso molecular menor que el
correspondiente a la frmula ms simple de la sustancia.
1.9) Propiedades Coligativas Factor de Vant-Hoff
Como se indic antes, el descenso del punto de congelacin, aumento del punto de
ebullicin, disminucin de la presin de vapor, y la presin osmtica de los electrlitos es
siempre mayor que la que corresponde a las soluciones no electrolticas de igual concentracin
total. Los datos mostrados en la tabla 6 son una muestra tpica de la naturaleza de las
desviaciones.
Esa tabla presenta las relaciones del descenso del punto de congelacin observado T
f
, con la
molalidad, m, a distintas concentraciones para buen nmero de electrlitos en solucin acuosa.
De acuerdo con los argumentos expuestos antes, esta relacin debe aproximarse para
soluciones acuosas diluidas al valor de K, del agua, esto es 1.86 por mol en 1000 g de solvente.
La inspeccin de la tabla revela, sin embargo, que los valores lmite obtenidos en varios
electrlitos discrepan considerablemente de 1.86, siendo mucho mayores. Aun ms, el lmite
que se obtiene no es siempre el mismo sino que vara desde aproximadamente 2 x 1.86 = 3.72
para sustancias como el cido clorhdrico y cloruro de amonio, a 3 x 1.86 = 5.58 en el caso del
cloruro de cobalto y 4 x 1.86 = 7.44 para el ferricianuro de potasio.
Tabla 3. Valores de de las soluciones acuosas de los electrlitos
Para representar las propiedades coligativas de los electrlitos por medio de relaciones
obtenidas con los no electrlitos, Vant Hoff sugiri el uso de un factor i, que se define como la
razn del efecto coligativo producido por una concentracin m de electrlito dividida por el efecto
observado para la misma concentracin de un no electrlito. Al utilizar esta definicin de i para la
depresin del punto de congelacin de las soluciones no electrolticas, se deduce que
(72)
donde T
f
, es el descenso del punto de congelacin del electrlito y (T
f
)
o
el correspondiente a
un no electrlito de la misma concentracin. Como, de acuerdo con la ecuacin
entonces:
(73)
Los valores de i deben calcularse de los datos experimentales para cada electrlito a varias
concentraciones. Se ha encontrado, sin embargo, que una vez que se conoce i para una
concentracin particular de un electrlito en una de sus propiedades coligativas, ese mismo valor
con una pequea correccin por temperatura, es esencialmente vlido para otras propiedades a
igual concentracin. En consecuencia escribiremos:
(74)
donde las cantidades sin subndices se refieren al electrlito y las que los poseen son no
electrlitos de la misma concentracin. Al sustituir una serie de ecuaciones en la (3.2.3), las
expresiones del descenso de presin de vapor,
aumento del punto de ebullicin, y presin osmtica de las soluciones de los electrlitos son:
(72), (73), (74)
Estas ecuaciones son aplicables nicamente a soluciones diluidas. La lectura cuidadosa de esta
tabla revela que en soluciones diluidas i incrementa cuando disminuye la molalidad, y se
aproxima a un lmite de dos en electrlitos como el cido clorhdrico, ntrico, cloruro de amonio y
sulfato de cobre, un lmite de tres para electrlitos del tipo del cido sulfrico, cloruro de cobalto,
y sulfato de potasio, y finalmente un lmite de cuatro para el ferricianuro de potasio. En
soluciones ms concentradas, por otra parte, i pasa por un mnimo y entonces se incrementa,
con frecuencia hasta un valor que excede los lmites establecidos en soluciones diluidas.
Tabla 4. Factores i, de Vant Hoff de diversos electrlitos
1.10) Clasificacin de los electrolitos
Segn Maron y Prutton
l
, los clculos del grado de disociacin de diversos electrlitos en solucin
acuosa muestran que prcticamente todas las sales se encuentran muy disociadas en iones. Lo
mismo es cierto con los cidos y bases.
Como era de esperar, debido a su elevado grado de disociacin, las soluciones acuosas de
estas sustancias son buenas conductoras de la electricidad, pero por otra parte, hay muchas
sustancias tambin, cuyas soluciones acuosas exhiben relativamente poca conductividad, y cuya
conducta coligativa indica que estn solo ligeramente disociadas, an en concentraciones
bastante bajas. Entre ellas se incluye un gran nmero de cidos orgnicos como el actico,
propinico, y benzoico; cidos inorgnicos como el carbnico, hidrosulfrico, hidrocinico, orto-
arsnico, brico, y cido hipocloroso; y bases como el hidrxido de amonio, de cinc, y plomo. Las
soluciones de las sustancias que presentan buena conductancia e indican un alto grado de
disociacin en su solucin se denominan electrlitos fuertes, y por el contrario las que muestran
una conductancia pobre y un grado bajo de disociacin, se llaman electrlitos dbiles.
Pero no todos los electrlitos se clasifican claramente en dbiles o fuertes. Hay algunos que en
solucin acuosa, como los cidos o-clorobenzoico, o-nitrobenzoico, 3,5-dinitrobenzoico, y
cianoactico, tienen una conducta tal que se clasifica en un grupo intermedio. Su nmero no es
grande, y, de ah que no se estudien con ms detenimiento.
Con frecuencia, es conveniente subdividir los electrlitos fuertes, de acuerdo con la carga de los
iones que producen. As un electrlito que origina dos iones con una sola carga, se le conoce
como un electrlito del tipo 1-1, aqul que produce iones positivos univalentes y negativos
divalentes, como el sulfato de potasio o el cido sulfrico, se llama electrlito del tipo 1-2,
mientras que si ocasiona iones positivos divalentes y univalentes negativos, como el cloruro de
bario o el nitrato de magnesio, se denomina electrlito del tipo 2-1. Anlogamente el sulfato de
cobre e un electrlito del tipo 2-2, mientras que el ferricianuro de potasio es un
electrlito del tipo 1-3. En este mtodo de clasificacin de electrlitos fuertes, se designa primero
la carga de los iones positivos y a continuacin la de los negativos.
Segn Levine
, un electrlito es una sustancia que produce iones en disolucin, lo cual se pone
de manifiesto por el hecho de que la disolucin presenta conductividad elctrica. Un
polielectrlito es un electrlito que es un polmero Para un disolvente dado, un electrlito se
clasifica en fuerte o dbil, segn que la disolucin a concentraciones moderadas sea un buen o
mal conductor de la electricidad para el agua como disolvente, NH
3
, CO
2
y CH
3
COOH son
ejemplos de electrlitos dbiles, mientras que NaCI, HCI y MgSO4 son electrlitos fuertes.
Otra forma de clasificacin, basada en la estructura, es dividir los electrlitos en verdaderos y
potenciales. Un electrlito verdadero est formado por iones en estado puro. La mayora de las
sales son de este tipo. Un cristal de NaCl, CuSO
4
o MgS est formado por iones positivos y
negativos Cuando un cristal inico se disuelve en un disolvente, se rompe en iones que estn
solvatados en la disolucin. El trmino solvatado indica que, en la disolucin, cada ion est
rodeado de una envoltura formada por unas pocas molculas de solvente, las cuales estn
enlazadas al ion por fuerzas electrostticas y se mueven con l a travs de la disolucin. Cuando
el disolvente es agua, la solvatacin recibe el nombre de hidratacin (Fig. 3).
Figura 3. Hidratacin de Iones en Solucin. (Levine, 1991)
Algunas sales de ciertos metales de transicin y de Al, Sn y Pb presentan enlaces con un alto
porcentaje de covalencia y no son electrlitos verdaderos. As, el caso del HgCI2 las distancias
interatmicas en el cristal indican la presencia de molculas de HgCI2 (en vez de iones Hg2 y CI-
), y esta sal en disolucin acuosa presenta un carcter molecular (como evidencia su baja
conductividad elctrica). En cambio, HgSO4, Hg(N03)2 y HgF2 son inicos.
Un electrlito potencial est formado por molculas sin carga en puro, pero cuando se disuelve,
partes de l reaccionan qumicamente con el disolvente, dando ione. As, el cido actico
reacciona con el segn HC2H302 + H20 H3O + C2H3O, produciendo iones hidronio y acetato. El
cloruro de hidrgeno reacciona con agua segn HCI + H20 H3O + CI
-
. En el caso del electrlito
fuerte HCl, equilibrio est muy desplazado hacia la derecha. Para el cido actico, es un
electrlito dbil, el equilibrio est muy desplazado hacia la izquierda, excepto en disoluciones
muy diluidas. En el estado lquido puro, un electrlito verdadero es un buen conductor de la
electricidad. Por el contrario, un electrlito potencial es mal conductor en su estado puro.
1.11) Leyes de Faraday:
1.11.1) Primera ley de Faraday.
La masa de un elemento depositada en una clula electroltica es independiente de la
composicin qumica del electrolito, con la condicin de que funcione siempre con la misma
valencia.
Si se conectan en serie varias celdas conteniendo soluciones de sales de diferentes metales
como por ejemplo CuSO
4
y AgNO
3
se puede comprobar que las cantidades depositadas son
qumicamente equivalentes, lo cual significa que estn en la misma relacin de los equivalente
qumicos, o sea, el cociente entre el peso atmico y la valencia del metal.
Para el caso anterior se tiene:
Pesos atmicos:
Cu: 63,57 [gr/mol]
Ag: 107,88 [gr/mol]
Valencias:
Cu: +2
Ag: +1
Si se denota por M
1
al equivalente qumico del Cu y M
2
al de la plata, se cumple:
M
1
/M
2
= (63,57/2)/(107,88/1)=0.2947
Relacin que se cumple siempre y cuando no existan fenmenos secundarios como dilucin de
las especies depositadas reacciones qumicas posteriores.
Si se depositan elementos distintos en los electrodos de la misma clula se verifica algo similar
lo cual puede enunciarse mediante la segunda ley de Faraday.
1.11.2) Segunda Ley de Faraday.
Las masas de diversos elementos depositados en un mismo circuito son proporcionales
a sus pesos atmicos e inversamente proporcionales a la valencia. As se tiene:
Se deduce luego que las cantidades depositadas son proporcionales a los equivalentes qumicos
de modo que se cumple:
M
1
/M
2
=(P.A
1
/v
1
)/(p.A
2
/v
2
) (75)
Donde P.A. es el peso atmico, M es el equivalente qumico y v es la valencia.
1.11.3) Tercera ley de Faraday.
La masa de un elemento depositado en una celda electroqumica, depende de la cantidad total
de electricidad que circule por ella y es proporcional a sta.
Se tiene:
M= E .q (76)
Donde E es una constante para cada elemento conocida como equivalente electroqumico y
representa la masa del elemento depositada por unidad de electricidad y q es la cantidad de
electricidad.
Si la corriente es de intensidad constante se tiene:
Q= i. t (77)
M=t. i. E (78)
Donde q se mide en coulombs, t es el tiempo en segundos e i se mide en amperes
(C/s).
Se cumple adems:
M
1
/M
2
=(E
1
.q)/( E
2
.q)= E
1
/ E
2
(79)
De este modo los equivalentes qumicos son proporcionales a los equivalentes electroqumicos.
Luego:
E
1
/ E
2
=(P.A
1
/v
1
)/ (P.A
2
/v
2
) (80)
Finalmente:
E/(P.A./v)=ctte (81)
Se denomina por peso equivalente a una cantidad del elemento qumico que cumple con la
condicin de que el peso expresado en gramos sea igual a su equivalente qumico.
Por lo tanto, la cantidad de electricidad necesaria para depositar un peso equivalente de un
elemento es:
M = q. E
q=M/ E
M=[ ( P. A)/ v ]. (gr)
M=[( ( P. A)/ v )/E ]= (F) (82)
Donde F es la conocida constante de Faraday.
Luego:
E=1/F. [(P.A)/v]q
1.12.1) Conductividad Especifica:
La conductividad especfica (K) se define como la conductancia (o conductividad) de una
columna de solucin comprendida entre dos electrodos metlicos separados uno del otro 1 cm y
de 1 cm 2 de superficie.
Para la medida de la conductividad especfica K, se mide la conductividad C de una columna de
solucin entre dos electrodos de A cm 2 y separados 1 cm. Por definicin:
C=K*(A/1) (83)
Entonces:
K=C*(1/A)=C*K (84)
Siendo:
K' = 1/A = constante de la celda (cm -1 ).
C = conductividad medida experimentalmente (ohm -1 ).
K = conductividad especfica (ohm -1 cm -1 ).
Los valores de conductividad especfica slo son funcin de la temperatura y de la concentracin
de electrolitos en la solucin.
Al suministrar los resultados de la medida de conductividad, se debe indicar la temperatura a la
que se realiz la medicin (es bastante frecuente expresar los resultados a 20 C o 25 C).
1.12.2) Conductividad Equivalente:
Es la conductividad de un equivalente gramo de disolucin de electrolito, por tanto, a diferencia
de la K, donde K= Conductividad especfica. Representa la conductividad de 1cm
3
de
disolucin de electrolito (S=1cm
2
, l=1cm), no depende de la concentracin.
= 1000K/N (85)
Sera la conductividad de una disolucin que se encuentra entre dos electrodos separados 1cm y
cuya superficie fuese tan grande como para albergar un volumen de disolucin que contenga
1equiv. gramo. Por tanto, por definicin la es de esperar que no dependa de la concentracin
sino del tipo de electrolito. Sin embargo podemos ver en la siguiente grfica que esto no es as:
C C = Electrolito ideal
A A = HCl
B B = HAc
0
Conc.
Dos fenmenos explican por lo menos el comportamiento de un electrolito fuerte como el HCl:
1. Efecto de atraccin interinica de atmsfera inica
H
+
H
+
Cl
Cl
c
H
+
H
+
Cl
Cl
Este efecto obstaculiza la migracin y hace que al aumentar la concentracin baje la
2. Efecto electrofortico: debido a que la migracin de cationes hidratados hacia el ctodo es
retardada por el mivimiento de los aniones hidratados en la direccin del nodo.
Fig. 4
3. En el caso de electrolitos dbiles hay un tercer fenmeno como principal causante de la
bajada de y es que al aumentar la concentracin de elctrolito dbil disminuye la
disociacin de manera muy sealada.
Si se extrapola a dilucin infinita o sea concentracin cero se obtiene la llamada
conductividad equivalente lmite (
0
) que representa el valor de la conductividad
equivalente si el soluto tuviera comportamiento ideal.
En el caso de los electrolitos dbiles no es factible la extrapolacin, pero puede calcularse la
0
a partir de las conductividades equivalentes de los iones en los que se disocia. En este
sentido, uno de los conceptos ms importantes en la teora de la conductividad inica es el
enunciado de que la conductividad total de una disolucin que contiene un nmero
cualquiera de electrolitos es igual a la suma de todas las contribuciones de todas las
especies presentes por separado.
A dilucin infinita, las atracciones entre iones se anulan desprecian y la conductividad total
sera para un electrolito fuerte como el NaCl:
0 0
0
) (
+
+ =
Cl Na
NaCl
(86)
Para un electrolito dbil como el HAc sera:
NaCl HCl NaAc HAc
) ( ) ( ) ( ) (
0 0 0 0
+ =
(87)
Las diferencias que existen en la conductividad inica equivalente de varias especies, se debe
principalmente a diferencias de tamao y a su grado de hidratacin.
1.12.3) Conductividad Inica:
Una solucin inica conduce la corriente elctrica debido al movimiento de esos iones cuando
estn sometidos a la accin de un campo elctrico. En este sentido es posible analizar la
situacin de manera similar al caso de un conductor metlico (donde los portadores de carga son
los electrones). Al igual que en un metal, habr una resistencia asociada a esa solucin,
resistencia que se har evidente cuando se introducen dos electrodos en la solucin y se aplica
un campo elctrico. Esta resistencia depender de distintos factores:
- reas superficiales de los electrodos
- Forma de los electrodos (las que influirn en las lneas de campo)
- Las posiciones de los electrodos (distancia entre ellos)
- El tipo de especie inica que se tenga
- Concentracin
- Temperatura
Para un conductor elctrico la ley de Ohm establece que hay una relacin directa entre el
potencial aplicado y la corriente que circula por el mismo, donde la constante de proporcionalidad
es la resistencia de la solucin:
(88)
Los trminos conductividad y resistividad parecer hablar de lo mismo...pero al contrario!, es decir
una solucin que tenga una resistividad muy baja implica que tendr una conductividad muy alta.
De igual modo ocurre con las palabras "resistencia" y "conductancia". Veamos las relaciones:
Para un conductor se cumple que
(89)
Donde R es resistencia y se mide en Ohm
es la resistividad con unidades de Ohm x cm ( x cm)
l es la longitud del conductor
A es el rea del conductor
De igual manera puede plantearse una expresin similar para el caso de la conductancia
teniendo en cuenta que se trata de una magnitud inversa a la primera
(90)
Donde C es la conductancia y se mide en -1 (mho) = S (Siemens)
es la conductividad del conductor y tiene unidades de -1 x cm-1
A el rea del conductor
l la longitud del conductor
Dado que la conductividad de una solucin depender del tipo y cantidad de todos los iones
presentes en la misma, es conveniente considerar el aporte individual de cada in, es decir
cuanto aporta a la conductividad total, es as que
se plantea el concepto de conductividad equivalente, representada por la letra , corresponde a la
conductividad por equivalente de cada in, esta conductividad equivalente individual para el in i
se la representa como i. Como la conductividad total de la solucin ser simplemente la suma de
las contribuciones, se cumple que:
(91)
Dada la geometra de las celdas que se emplean para las determinaciones conductimtricas es
difcil conocer el valor exacto del cociente A/l. Este cociente, denominado "constante de la celda"
depender de cada celda en cuestin y por lo tanto es mas conveniente determinarlo midiendo la
conductancia de una solucin de un electrolito cuya conductividad sea conocida (a una dada
temperatura). Se elige para este propsito soluciones de KCl cuyas conductividades para
diversas concentraciones se encuentran tabuladas. La siguiente tabla se reportan algunos de
estos valores: (I.N.Levine, FisicoQumica, McGrawHill/Interamericana de Espaa, S.A.1991)
Concentracin(mol./l) Conductividad (Ohm
-1
cm
-1
)
0 0
0.001 0.000147
0.01 0.00141
0.1 0.0129
1 0.112
Al igual ocurre en un conductor metlico, la conductividad de una solucin depender de la
temperatura de la misma, por ejemplo para el caso de una solucin 0,1M de KCl se observa lo
siguiente:
Temperatura /
o
C Conductividad /S x cm
-1
19 0.01143
20 0.01167
21 0.01191
Por otra parte existe una dependencia importante de acuerdo a la concentracin y al tipo de in
que se tiene en la solucin como lo muestra la siguiente tabla donde se reportan valores de
conductividad equivalente (en mS) para distintos compuestos en varias concentraciones:
Electrolito 0,001(eq/l) 0,01(eq./l) 0,1(eq./l)
KCl 146.95 141.27 128.96
HCl 421.36 412.00 391.32
KOH 234 228 213
KNO
3
141.84 132.82 120.40
Se verifica que tanto el H+ como el OH- son varias veces mas eficientes en conducir la
electricidad que los dems cationes y aniones. Esto es importante para todos los experimentos
que se realicen en soluciones acuosas y donde estos iones sufran cambios en su concentracin.
Para realizar una determinacin conductimetrica se emplean celdas de conductividad que
pueden tener diversa geometra, en general podemos describirlas como un par de electrodos de
platino con idntica geometra, montados de manera que la distancia que los separa no se
modifique durante las determinaciones. En esencia se trata de aplicar una diferencia de potencial
y analizar la resistencia de la solucin.
En las medidas de conductividad se debe evitar que al polarizar los electrodos no se produzcan
reacciones de transferencia de carga ni acumulacin selectiva de iones en las cercanas de los
electrodos, esto conducira a que la determinacin se debe realizar en tiempos cortos de modo
de no perturbar demasiado la solucin. Una alternativa que se emplea es adems aplicar una
diferencia de potencial en los electrodos pero como seal alterna, para evitar las mencionadas
polarizaciones por concentracin.
1.13) TEORIA DE LA DISOCIACION ELECTROLITICA (ARRHENIUS )
En 1844, Svante Arrhenius comunic su teora de la disociacin electroltica, y naci la teora de
Arrhenius de las reacciones cido-bsicas. Segn ella, un cido se define como una sustancia
que contiene hidrgeno y produce H
+
en disolucin acuosa. Una base es una sustancia que
produce iones hidrxido, OH
-
, en la disolucin acuosa. La NEUTRALIZACIN se define como la
combinacin de iones hidrxido e iones hidrgeno para formar molculas de agua:
H+ (ac) + OH- (ac) H2O (l) (neutralizacin)
Arrhenius estableci la teora de la disociacin electroltica para los electrolitos.
Se basa en lo siguiente:
1) Los electrolitos en solucin o fundidos se disocian parcialmente en iones con cargas
elctricas, de tal forma que las cargas positivas totales sean iguales a las cargas negativas
totales.
2) Los iones son tomos o grupos de tomos con carga elctrica positiva para los metales y
carga elctrica negativa para los no metales o radicales no metlicos. Estos radicales
permanecen sin modificaciones para compuestos qumicamente anlogos (por ejemplo: Cl
para todos los cloruros).
3) Los iones actan independientemente unos de otros y de las molculas no disociadas. Y son
diferentes en sus propiedades fsicas y qumicas.
4) La disociacin electroltica es un proceso reversible, es decir, los iones pueden reagruparse
para formar nuevamente la molcula. A mayor dilucin de la solucin el reagrupamiento de los
iones se hace ms difcil, porque estn ms alejados.
En soluciones muy diluidas, prcticamente todas las molculas se han disociado y esto explica el
hecho de que el factor i tome valores enteros positivos en estas soluciones.
1.13.1) Grado de disociacin de la constante de equilibrio termodinmica (Arrhenius)
El grado de disociacin (a) es la relacin entre la conductividad molar a una determinada
concentracin y la conductividad molar a dilucin infinita
(92)
0
=
Tambin es una medida de la fraccin del electrolito disociado a esa concentracin, tiene
valores cercanos a 1 para los electrolitos fuertes y del orden de 0.1 - 0.001 para los
electrolitos dbiles.
1.14) Actividad de los Electrolitos.
La ecuacin de Gibbs-Duhem ha sido usada para calcular el coeficiente de actividad de un soluto
no voltil y no electroltico a partir de valores conocidos del coeficiente de actividad del
disolvente. Un procedimiento similar se aplica en el caso de una disolucin de un electrlito no
voltil. Restringiremos la discusin a una disolucin de un solo electrlito fuerte no voltil i, de
frmula . El potencial qumico del disolvente puede escribirse como
donde se usa la escala de fracciones molares. Se cumple para el
disolvente en la disolucin de un electrlito:
(93)
Dado que el soluto electroltico se supone no voltil, PA es igual a la presin de vapor de la
disolucin, y (93) permite calcular la actividad y coeficiente de actividad del disolvente a partir de
medidas de la presin de vapor. La sustitucin de las diferenciales y a T y P constantes
en la ecuacin de GibbsDuhem, seguida de integracin nos permite obtener el coeficiente de
actividad estequiomtrico del electrlito como una funcin de la composicin a partir del
conocimiento del coeficiente de actividad del disolvente en funcin de la composicin. Los
coeficientes de actividad de electrlitos pueden tambin determinarse en clulas galvnicas.
Algunos valores de para disoluciones acuosas de electrlitos a 25 C y 1 atm (m 1 mol/kg)
se dan en la Tabla 9 y se representan en la Figura 5. Incluso a m
i
= 0,001 mol/kg, los
coeficientes de actividad del electrlito se desvan sustancialmente de 1, debido a las fuerzas
interinicas de largo alcance. De cara a establecer una comparacin, para el soluto no
electroltico CH3(CH2)20H en agua a 25 C y 1 atm, = 0,9999 a m
i
= 0,001 mol/kg,
Figura 5. Coeficientes de actividad estequiomtrlcos para electrlitos en disoluciones
acuosas a 25 C.
= 0,09988 a m
i
= 0,01 mol/kg y = 0,988 para m
i
= 0,1 mol/kg. En disoluciones
concentradas, pueden darse tanto valores muy grandes de como valores muy pequeos.
Por ejemplo, en disolucin acuosa a 25 C y 1 atm, = 1510 para m
i
= 5,5 mol/kg,
y = 0,017 para m
i
=2,5mol/kg.
Tabla 5. Coeficientes de actividad estequiometricos
i
de electrolitos en agua a 25C y 1 atm.
1.15) Teora de las Atracciones Interinicas de Debye-Huckel.
Teora de Debye- Hckel (1923)
Postulados:
1. Los electrolitos fuertes se disocian por completo en iones.
2. Las desviaciones observadas respecto del comportamiento ideal de las soluciones se
atribuyen a las interacciones elctricas entre los iones.
3. El postulado bsico de la teora es el concepto de que cada in est rodeado por una
atmsfera inica de iones de carga opuesta.
4. La desviacin del comportamiento ideal del in i se debe a sus interacciones elctricas con
otros iones.
5. La desviacin se expresa como diferencia de potencial qumico.
-
+
+ +
- -
- + +
+
+
-
-
-
+
-
i (ideal) = i + RT ln ci (94)
i (real) = i + RT ln ai = i + RT ln ci + RT ln i
mi = RT ln a i - RT ln ci = RT ln i (95)
El trabajo elctrico (potencial x carga; .zi.ec) es igual a la diferencia de potencial qumico (RT ln
gi):
.zi.ec = RT ln gi (96)
(97)
Donde:
: potencial elctrico derivado del in central i
zi: nmero de carga del in i
ec: carga del electrn
: constante dielctrica en el vacio (o) y del solvente (r)
r: radio de influencia de i
b: distancia (radio) de Debye-Huckel (atmsfera inica)
Esta ecuacin permite calcular el trabajo elctrico de introducir una carga elctrica en el
radio de influencia del in central i.
(98)
Esto ocurre para r = b, y 2 iones de carga opuesta (Atkins 37, pg. 254)
(99)
Resolviendo b, agrupando constantes y para H2O a 298 K
Ley lmite de Debye-Huckel. (100)
= e
-r/b
z
i
. e
c
4
o
r
r
E Ec cu ua ac ci i n n d de e D De eb by ye e- - H Hu uc ck ke el l
z
i
2
. e
c
2
4
o
r
k T b
ln
=
|z
+
z
-
| F
2
8 N
R T b
ln
=
log
= |z
+
z
-
| A I
log
= |z
+
z
-
| 0.51 I
1.16) Fuerza Inica.
Se define la Fuerza Inica (I) como:
(101)
La fuerza inica es adimensional (ci es la relacin c/c) y su definicin es esencial en la
electroforesis y en los estudios de las propiedades elctricas de las clulas.
Sales 1-1: M = 1, I = 1 Sales 1-2: M = 1, I = 3
Sales 2-2: M = 1, I = 4 Sales 1-3: M = 1, I = 6
Para I de hasta 10-1 M, se usa la ecuacin de Hckel-Bronsted
(102)
El radio de Debye (b) es el radio de la esfera donde slo se encuentran contraiones alrededor del
in central.
Fuerza inica, I (x 1000). Fig 6
I I = = 1 1/ /2 2 z z
i i
2 2
c c
i i
0 5 10 15
-
-
1:1,
1:2,
2:2,
|z
+
z
-
| 0.51 I
1 + B I
log
=
Log
La Ley lmite de Debye-
Huckel se cumple para
I < 0.01
El aumento de la fuerza inica (I) disminuye b
RADIO DE DEBYE (b) en nm
Concentracin
(M) Sales: 1:1 1:2 2:2
10
-1
0.96 0.55 0.48
10
-2
3.04 1.76 1.52
10
-3
9.6 5.55 4.81
10
-4
30.4 17.6 15.2
1:1 (NaCl); 1:2 (CaCl
2
, Na
2
SO
4
; 2:2 (MgSO
4
)
-
-
-
-
+
b
UNI DAD II:
EQUILIBRIO DE FASES
A travs del estudio del equilibrio entre fases se puede conocer el comportamiento de una
sustancia pura o en una mezcla, para fines de separacin de mezclas de componentes o para
simplemente saber el estado de un sistema a determinadas condiciones.
Para dar inicio al estudio de los equilibrios de fases es necesario definir y explicar previamente
algunos trminos que se usan frecuentemente.
2.1) SISTEMA
Un sistema es un conjunto de elementos interrelacionados y que presentan un cierto carcter de
totalidad ms o menos organizada.
De este modo, podemos hablar de tres caractersticas estructurales bsicas de todo sistema:
uno, los elementos que lo componen, dos, las relaciones entre esos elementos, y tres, los
lmites del propio sistemas que determinan que elementos pertenecen al mismo y cules no
(Martnez y Requena, 1986)..
A partir de este concepto ahora si podemos dar una definicin ms clara de lo que son Sistemas
abiertos cerrados y aislado.
2.1.1) SISTEMA ABIERTO: Es un sistema que realiza transferencia de masa hacia adentro
y hacia afuera del sistema.
2.1.2) SISTEMA AISLADO: Es aqul que no tiene ninguna interaccin con el cosmos. No
existen sistemas aislados en el Universo.
2.1.3) SISTEMA CERRADO: Es un sistema en el que no puede haber transferencia de
masa a travs de sus lmites (sistema con masa constante). Slo existen como
modelos hipotticos, por ejemplo un recipiente cerrado, con cualquier contenido en
su interior, intercambia temperatura con el exterior (energa), pero no materia.
Otras definiciones segn (E. Barrull, 1994, Termodinamica basica) son:
SISTEMA AISLADO es el sistema que no puede intercambiar materia ni energa con su
entorno.
SISTEMA CERRADO es el sistema que slo puede intercambiar energa con su
entorno, pero no materia.
SISTEMA ABIERTO es el sistema que puede intercambiar materia y energa con su
entorno.
Fig. 7. Ejemplos de lo que sucede en los distintos tipos de sistema.
2.2) FASE: Parte homognea de un sistema que est en contacto con otras partes del
mismo pero separada de ellas por una frontera bien definida.
2.3) COMPONENTE: Agrupacin de elementos que hace parte de un subsistema.
2.4) POTENCIAL QUMICO: El potencial qumico es la variable termodinmica ms
importante, a partir de la cual se deducen todas la dems:
"Por definicin, se llama potencial qumico, , a: (dG/dni)T,P. Por ser la derivada parcial de
una funcin de estado, el potencial qumico es tambin una funcin de estado, y por tanto
=f (T,P,V,n i). Es una propiedad intensiva, y sus unidades sern (julios/mol). Para una
sustancia pura el potencial qumico es la energa de Gibbs molar. "
2.5) Condicin de equilibrio entre fases.
Tipos de equilibrio (verdadero, metaestable e inestable).
El concepto de equilibrio estable es de fundamental importancia. Podemos definir distintos
tipos de equilibrio. El equilibrio mecnico es la condicin que se alcanza cuando todas las
partculas estn en reposo y la energa potencial total del sistema es mnima. Una buena
analoga es la de la caja de fsforos. Cuando sta se apoya sobre una de sus caras mayores
(Figura La) est en equilibrio mecnico estable. Cuando se balancea sobre uno de sus
cantos est en equilibrio inestable (Figura L b). Ntese que cuando la caja se apoya sobre
una de sus caras ms estrechas (Figura L c), la caja no est en equilibrio mecnico estable
ya que puede reducir su energa potencial pasando a la posicin a. La posicin c
corresponde a equilibrio mecnico metaestable.
Figura 8: Equilibrio mecnico. (a) Estable, (b) inestable y (c) metaestable
EQUILIBRIO METAESTABLE: Se habla de equilibrio metaestable cuando el cuerpo
vuelve a su posicin de equilibrio si no ha sido desplazado demasiado, adems para
recuperar la posicin original es necesario aplicar una fuerza superior a la utilizada para
sacar al objeto de su equilibrio.
2.6) Grados de libertad o varianza. (F)
Corresponde al numero mnimo de variables intensivas independientes de la masa (T,P,X).
Existen varios tipos de sistemas de acuerdo al grado de libertad de los mismos, estos son:
Invariantes: Aquellos donde F es igual a cero, por lo que no se requiere especificar alguna
variable para identificar cierta condicin del sistema. Ej. El equilibrio trifasico en el sistema
agua donde T y P son fijas.
Monovariante: Cuando F es igual a 1, por consiguiente es suficiente una variable. Ej.
Cualquier punto sobre las lneas de equilibrio bifsico en el sistema agua.
Bivariante: Aquellos donde F= 2 esto quiere decir que se necesitan dos variables del
sistema para definir la condicin de la fase. Ej. Cualquier punto del diagrama de fases,
excepto las lneas de equilibrio.
2.7) Regla de las fases de Gibbs
Esta regla nos define los grados de libertad que posee el sistema dependiendo del
tipo de variables que consideremos. Establece la siguiente relacin:
F = C - P + 2 (103)
Donde:
F = nmero de grados de libertad
C = nmero de componentes
P = nmero de fases presentes
2 = es el nmero de variables de estado del sistema (temperatura y presin)
En los casos experimentales que nosotros trataremos, el efecto de la variacin de la
presin es despreciable, as establecemos que: P = 1 atm. As pues, la regla de las fases queda
establecida para nuestros propsitos empricos como:
F = C - P + 1 (104)
Veamos con un ejemplo la gran utilidad de esta ecuacin:
1. Si tenemos un metal puro y nos situamos en su punto de fusin: C=1, P=2 (slido + lquido).
As, F=0, con lo que podemos deducir que el punto de fusin es un punto fijo que se da a una
temperatura y presin fijas.
2. Si nos situamos en el punto donde coexisten dos fases: C=2, P=2, obtenemos que F=1.
Tenemos un nico grado de libertad, es posible mantener la microestructura de 2 fases mientras
se modifica la temperatura del material (en un rango limitado).
3. Cuando nos situamos en la regin donde hay una sola fase a una composicin intermedia:
C=2, P=1, es por esto que: F=2, tenemos dos grados de libertad,podemos variar tanto la
temperatura como la composicin en un rango limitado manteniendo la microestructura.
2.7.1) Reglas de las fases para sistemas reaccionantes.
Cuando en el sistema ocurre reacciones qumicas cada reaccin qumica independiente
proporciona una relacin entre los potenciales qumicos, cada una de las tales relaciones pueden
utilizares para eliminar una de las variables T,P y las fracciones molares. Si hay r reacciones
qumicas independientes, l numero de variables intensiva independiente se reduce en r y las
reglas de las fases se transforman en:
F= C-P+2-R (105)
Nota: entindase por reacciones independientes el hecho el hecho de que ninguna reaccin se
puede como combinacin de las otras
2.7.2) reglas de las fases en sistemas adicionales:
En un sistema adems de las relaciones de equilibrio qumico, puede haber otras restricciones
en las variables intensivas. Ej. En disolucin tomica la condicin de neutralidad elctrica
proporciona una relacin adicional.
Entonces si adems de la r condiciones de equilibrio qumico (reacciones independiente), hay
restricciones adicionales sobre las variables intensivas (que surgen de las condiciones de
estequiometria electroneutralidad),el numero de grados de libertad quedan reducidos en a y las
reglas de las fases viene a ser:
F=C-P+2-R-A
1.3) Diagramas de fase:
Son representaciones grficas de las fases que estn presentes en un sistema de
materiales a varias temperaturas, presiones y composiciones. La mayora de los diagramas de
fase han sido construidos segn condiciones de equilibrio (condiciones de enfriamiento lento),
Fig. 9
siendo utilizadas por ingenieros y cientficos para entender y predecir muchos aspectos del
comportamiento de los materiales. Los diagramas de fases ms comunes involucran temperatura
versus composicin.
Informacin que podemos obtener de los diagramas de fase:
1. Conocer que fases estn presentes a diferentes composiciones y
temperaturas bajo condiciones de enfriamiento lento (equilibrio).
2. Averiguar la solubilidad, en el estado slido y en el equilibrio, de un
elemento (o compuesto) en otro.
3. Determinar la temperatura a la cual una aleacin enfriada bajo
condiciones de equilibrio comienza a solidificar y la temperatura a la cual ocurre
la solidificacin.
4. Conocer la temperatura a la cual comienzan a fundirse diferentes fases.
1.3.1 Diagrama de fases de sustancias puras:
Una sustancia pura como el agua puede existir en las fases slidas, lquidas y gaseosa,
dependiendo de las condiciones de temperatura y presin. Un ejemplo familiar para todos de dos
fases de una sustancia pura en equilibrio es un vaso de agua con cubos de hielo. En este caso el
agua, slida y lquida, da lugar a dos fases distintas separadas por una fase lmite, la superficie
de los cubos de hielo. Durante la ebullicin del agua, el agua lquida y el agua vapor son dos
fases en equilibrio. Una representacin de las fases acuosas que existen bajo diferentes
condiciones de presin y temperatura se muestra en la Figura.
Fig.10 Diagrama de equilibrio de fases aproximado presin-temperatura (PT)
para el agua pura. (Los ejes del diagrama se encuentran algo distorsionados.)
En el diagrama de fases presin-temperatura (PT) del agua existe un punto triple a baja
presin (4579 torr) y baja temperatura (0,0098 C) donde las fases slida, lquida y gaseosa
coexisten. Las fases lquida y gaseosa existen a lo largo de la lnea de vaporizacin y las fases
lquida y slida a lo largo de la lnea de congelacin, como se muestra en la Figura. Estas lneas
son lneas de equilibrio entre dos fases.
1.4) Equilibrio de fases en sistemas monarios.
Como ejemplo consideremos un sistema de una fase constituido por agua pura liquida, al
tomar o no en cuenta la disolucin de H2O, se tienen un componente independiente y dos
grados de libertad.
Si el componente independiente es 1 las reglas de las fases quedan F = 3-P, el valor mximo de
F es 2, el cual se obtiene cuando se considera la disolucin deH2O que incluye una solucin de
equilibrio y una condicin de electroneutralidad. Por lo tanto en un sistema de un componente la
especificacin de al menos dos variables intensivas define el estado. As entonces se puede
representar cualquier estado de un sistema de un componente por un punto en un diagrama de
fases.
1.4.1) Diagrama de fases para el agua
P E D
Liquido
Slido C punto triple
Gas
A
T
Diagrama de fases del agua
A lo largo de las lnea AC, CD, CE existen dos fases en equilibrio por lo tanto F = 1. La lnea AC
corresponde al equilibrio slido gas. La curva CD es la lnea del equilibrio liquido gas donde
una vez fijada la presin de vapor se obtiene la temperatura y viceversa, el punto ebullicin
normal del agua es 100 % (temperatura a la cual la presin de vapor es 1 atm). El punto CE
corresponde al equilibrio slido liquido y permite obtener para determinar la presin el punto de
fusin del hielo el cual decrece a medida que T aumenta; esto origina que la pendiente de la
lnea CE sea negativa con respecto a la de la mayora de las sustancias para las en el punto d.
El sistema de dos fases se transforma en uno de una sola fase. Este punto se conoce como
punto critico; la temperatura y la presin critica (Tc y Pc) para el agua son 647 K 218 ATM
respectivamente. A cualquier temperatura por encima de Tc las sustancias se denominan fluidos
supercritico, pues que el gas no puede ser liciupicador (conservase por compresin)
Cuales dichas curvas posee una pendiente positiva esto se debe principalmente a que le agua
es menos densa en el estado slido que en el liquido debido a los enlaces de los hidrgenos que
separan mas las molculas de agua cuando estn en fase slida que en fase liquida.
1.4.2) Diagrama del dixido de carbono.
En la figura se muestra el diagrama de fases para el CO2. La lnea slida liquida (BD) s
inclina ligeramente a la derecha lo que indica que un incremento de la presin aumenta el punto
de fusin. La presin del punto triple del CO2 es1.5 atm el CO2 sublimara cuando se caliente en
lugar de fundirse de ah el nombre de hielo seco.
Fig. 11
P D C
liq
sol
gas
5atm B
A
T
Diagrama de fases del dixido de carbono
1.4.3) Diagrama de fase para el azufre.
El azufre existe en dos formas slidas, la rombica establece temperaturas ordenaras y una
atmsferas depresin, y la nonoclinica variedad estable a temperaturas mas elevadas, la
segunda forma se obtiene calentando lentamente la primera. Estas dos fases slidas junta con la
liquida y vapor da la posibilidad de existencias de cuatros fase nica.
Debido a que las transformaciones cristalinas en otra a menudo es muy lenta si el azufre
rombico se calienta lentamente se funde 114 C sin transformares en monoclinico. Esta
temperatura de funcin se funde se ilustra en la funcin de la presin como en Tb en la figura el
equilibrio Sromb Smono es un ejemplo de un metal estable (aquel que se pierde por una
variacin repentina en el sistema)., Pues la lnea cae en la regin estabilidad del azufre
monoclinico (ver lnea punteada), en esta regin pueden presentarse las transformaciones:
Sromb Smono y S liq Smono S: azufre
Ambas con disminucin de la energa libre de Gibbs.
Los puntos B,C, y E representan los tres equilibrios trifasicos.
P E
liquido D
sol
C
B
A
T
Diagrama de fases del azufre
Fig. 12
Fig. 13
UNIDAD III
CINTICA DE LAS REACCIONES QUMICAS
3.1 Cintica qumica
Este campo estudia las velocidades de los procesos qumicos en funcin de la concentracin de
las especies que reaccionan, de los productos de reaccin, de los catalizadores e inhibidores, de
los diferentes medios disolventes, de la temperatura, y de todas las dems variables que pueden
afectar a la velocidad de una reaccin. La cintica qumica busca la relacin entre la forma
precisa en que vara la velocidad de reaccin con el tiempo, y la naturaleza de las colisiones
intermoleculares (que controlan la velocidad) implicadas en la generacin de los productos de
reaccin.
En la prctica se requiere la medicin de la concentracin de los sustratos en funcin del tiempo.
Las mediciones incluyen efectos de pH, temperatura, presin, solvente, substitucin isotpica,
fuerza inica, etc.
La importancia de las mediciones cinticas radica en la informacin que aportan para la
deduccin de mecanismos de reaccin.
Otro inters es el conocimiento del tiempo de vida de materiales y sustancias. Ej.: determinacin
de la vida til de un alimento, medicamento, entre otros.
3.2 Mecanismo de reaccin
La mayora de las reacciones implican una serie de procesos o etapas, cuya suma corresponde
a las proporciones (o estequiometra) en que se combinan los reactivos y se forman los
productos. Sin embargo, slo una de ellas es generalmente la etapa determinante de la
velocidad (EDV), siendo las otras mucho ms rpidas. Esta serie de pasos elementales a travs
de los cuales los reactivos se convierten en productos, se denomina mecanismo de reaccin.
Este representa lo que hipotticamente ocurre a nivel atmico-molecular y se postula basndose
en resultados experimentales.
La estequiometra de la reaccin no da ninguna informacin sobre el mecanismo, tal es el caso
de la reaccin de formacin del agua:
2H
2
+ O
2
2H
2
O G = - 198 Kj / mol
de esta ecuacin qumica slo se puede conocer las relaciones molares, as como la extensin
con la que dicha reaccin se produce a travs del clculo de la constante de equilibrio. Sin
embargo, para saber con cuanta rapidez se produce, se ha postulado el siguiente mecanismo:
H
2
+ O
2
HO
2
+ H
H + O
2
OH + O
OH + H
2
H
2
O + H
H
2
+ HO
2
H
2
O + OH
Cada etapa o reaccin del mecanismo se denomina reaccin elemental. En las distintas
reacciones elementales aparecen especies relativas (HO
2
, H, OH y O) que no aparecen en la
reaccin qumica balanceada, estas especies se conocen como intermediarios.
3.2.1 Molecularidad
Es el nmero de molculas (radicales, tomos y/o iones) que participan como reactivos en una
reaccin elemental .Dicho nmero debe ser entero positivo y de acuerdo a este las reacciones
elementales pueden clasificarse en unimoleculares, bimoleculares y trimoleculares, aunque estas
ltimas son muy escasas. La molecularidad de la etapa ms lenta (etapa determinante) en un
proceso cintico, se denomina orden total de una reaccin, este se determina a partir de datos
experimentales.
3.3 Velocidad de reaccin
Es la rapidez con que se transforma una sustancia reaccionante en producto. Bsicamente
corresponde al cambio de concentracin de un reactante o de un producto en la unidad de
tiempo. Al graficar la concentracin con respecto al tiempo (fig. 1) se observa la variacin que
sufre esta, en el caso de los
reactantes la concentracin disminuye a diferencia de los productos los cuales presentan un
aumento de la misma.
Figura 14. Grfica concentracin reactivos y productos contra tiempo
Por tanto la velocidad instantnea de consumo de reactivos debe ser igual a la de formacin de
los productos:
(106)
3.4 Factores que afectan la velocidad de reaccin
La velocidad de una reaccin depende de la composicin de las sustancias reaccionantes as
como tambin de una serie de otros factores. Entre ellos destacan, su forma fsica, del nivel de
mezcla de los reactivos, del tamao y concentracin de los reactivos, de la temperatura, de la
presin, de las concentraciones de los reactivos, de sustancias que afecten la reaccin sin ser
ellas un reactivo o producto (catalizadores) y de algunas condiciones especiales propias del
sistema como pueden ser la radiacin de luz visible, UV, RX, neutrones u otras.
a) Naturaleza de los reactivos
La velocidad de reaccin depende de la reactividad de las sustancias que participan en la
reaccin, es decir, de la habilidad que estas tengan de romper enlaces para formar otros.
b) La temperatura a la cual se lleva a cabo la reaccin
La rapidez de las reacciones qumicas aumenta conforme se eleva la temperatura. Esto se debe
a que al aumentar la temperatura, la energa de las molculas aumenta alcanzando as la
energa mnima requerida para reaccionar. Por ejemplo: las reacciones bacterianas que
conducen a la descomposicin de la leche se llevan a cabo con mayor rapidez a temperatura
ambiente que a temperaturas bajas. La medicin de velocidades de reaccin debe efectuarse a
C productos
Creactantes
t
Co
temperaturas constantes porque el calentamiento las modifica. Se estima con gran aproximacin
que un aumento de 10C en la temperatura provoca la duplicacin de la velocidad de reaccin.
c) La presencia de catalizadores
La rapidez de muchas reacciones se puede aumentar agregando una sustancia que se conoce
como catalizador. Esta sustancia es capaz de afectar la velocidad de reaccin, bien sea
aumentndola o disminuyndola, eso depende de la naturaleza qumica de la sustancia, la cual
se caracteriza por recuperarse al final de la reaccin sin sufrir un cambio apreciable.
d) La concentracin de los reactivos
Casi todas las reacciones qumicas avanzan con ms rapidez si se aumenta la concentracin de
uno o ms de los reactivos. Esto es debido, a que mientras mayor es el nmero de molculas, es
decir la concentracin, mayor es la cantidad de choques que se producen entre estas para la
formacin de nuevas molculas y por lo tanto aumenta la velocidad de reaccin, por ejemplo, la
lana de acero arde con dificultad en el aire el cual contiene 20% de oxgeno, pero enciende con
llama blanca y brillante en oxgeno puro. Es decir, que al variar la concentracin de oxgeno se
manifiesta un comportamiento diferente. La velocidad de reaccin disminuye conforme se reduce
la concentracin de los reactivos, y a la inversa, la velocidad aumenta cuando se incrementa la
combinacin de los reactivos. Una forma de estudiar el efecto de la concentracin
sobre la velocidad de reaccin es determinar de que forma la velocidad al comienzo de una
reaccin depende de las concentraciones iniciales. Por ejemplo:
NH4+(ac) + NO2- (ac) N2(g) + 2 H2O
Se podra estudiar la velocidad de esa reaccin midiendo la concentracin de NH4+ o NO2- en
funcin del tiempo o midiendo el volumen de N2 que se produce. Una vez que se ha
determinado la velocidad inicial de la reaccin (en t = 0) para diversas concentraciones iniciales
de NH4+ y NO2-, se pueden calcular las velocidades con diferentes concentraciones de NH4+ y
NO2-. A continuacin se muestran valores de concentraciones de reactivos experimentales, para
los cuales se presenta la velocidad inicial observada.
Tabla N6. Velocidades de reaccin para distintas concentraciones iniciales de NH4+ y NO2-
Concentracin inicial de
NH4+
Concentracin inicial de
NO2-
Velocidad inicial
observada
0.0100 M 0.200 M 5.4 x 10-7
0.0200 M 0.200 M 10.8 x 10-7
0.0400 M 0.200 M 21.5 x 10-7
0.200 M 0.0202 M 10.8 x 10-7
0.200 M 0.0404 M 21.6 x 10-7
0.200 M 0.0606 M 32.4 x 10-7
Estos datos indican que al variar la concentracin de NH4+ y NO2- la velocidad cambia. Puede
observarse que al duplicarse la concentracin de NH4+ y se mantiene constante la
concentracin de NO2-, la velocidad se duplica. Cuando se hace variar la concentracin de NO2-
de forma similar mientras se mantiene constante la concentracin de NH4+, la velocidad se ve
afectada de la misma manera.
3.5 Mtodos para medir experimentalmente la velocidad de una reaccin qumica.
Para medir la velocidad de reaccin por unidad de volumen, es necesario determinar la
concentracin de un reactivo o producto en funcin del tiempo. Esta, se determina
experimentalmente empleando mtodos qumicos en donde se toman muestras de recipientes
de reaccin que se analizan cuantitativamente para conocer la cantidad de reactivo
transformado, o mtodos fsicos basados en cambios de pH, resistencia elctrica, ndice de
refraccin, conductividad trmica, entre otros. A continuacin se describen brevemente estos dos
mtodos.
En el mtodo qumico, se colocan varios recipientes de reaccin, con la misma composicin
inicial en un bao a temperatura constante, A determinados intervalos de tiempo se extraen
muestras del bao, se disminuye o paraliza la reaccin y rpidamente y se hace el anlisis
qumico de la mezcla. Entre los mtodos para inhibir la reaccin cabe citar el enfriamiento de la
muestra a una temperatura inferior, quitar un catalizador, diluir abundantemente la mezcla y
aadir especies que rpidamente se combinan con uno de los reactivos. En el casos de las
muestras gaseosas, es recomendable analizarlas con un espectrmetro de masas o por
cromatografa gaseosa.
Los mtodos fsicos son generalmente ms exactos y menos laboriosos que los qumicos. Se
suele medir una propiedad fsica del sistema reactivo en funcin del tiempo. Esto permite seguir
la reaccin continuamente. Las reacciones en fase gaseosa, que tienen lugar con un cambio en
el nmero total de moles, pueden seguirse midiendo la presin del sistema, el inconveniente de
este procedimiento es que si ocurren reacciones en la superficie interna del recipiente, la presin
total no indicar correctamente el progreso de la reaccin. En una reaccin en fase lquida
donde tiene lugar un cambio de volumen, V, puede medirse con un dilatmetro (recipiente con un
tubo capilar graduado). Si una especie presenta una banda caracterstica de absorcin
espectroscpica, puede conocerse la velocidad a partir de la intensidad de dicha absorcin. Si
por el contrario, es
ptimamente activa, puede usarse su rotacin ptica. Las reacciones inicas en disolucin
pueden estudiarse midiendo su conductividad elctrica. Tambin el ndice de refraccin de una
disolucin lquida puede medirse en funcin del tiempo.
Generalmente los reactivos se mezclan y se mantienen en un recipiente cerrado; es el llamado
mtodo esttico. En el mtodo de flujo, los reactivos fluyen continuamente en el recipiente de
reaccin (que se mantiene a temperatura constante) al igual que los productos. Despus que la
reaccin ha tenido lugar durante cierto tiempo, se alcanza, en el recipiente de reaccin, un
estado estacionario y las concentraciones a la salida, permanecen constantes con el tiempo. La
ecuacin cintica y la constante de velocidad pueden hallarse midiendo las concentraciones
finales para diferentes concentraciones iniciales y velocidades de flujo (los mtodos de flujo se
usan ampliamente en la industria qumica).
Los mtodos de cintica "clsicos', descritos anteriormente, se aplican a reacciones con tiempo
de vida media inferiores a varios segundos. El tiempo de vida media (t1/2) es el tiempo necesario
para que la concentracin de un reactivo descienda a la mitad de su valor inicial. Muchas
reacciones qumicas importantes tienen tiempos de vida media (suponiendo concentraciones
tpicas para los reactivos) en el rango 100 a 10-11seg, y suelen denominarse reacciones rpidas.
3.6 LEY DE VELOCIDAD
La velocidad de una reaccin no es constante, pues a medida que se consumen los reactivos
disminuye la probabilidad de choque entre tomos y/o molculas, as como la formacin de
especies intermedias para la formacin de productos. Por esta razn, es expresada en funcin
del instante en que se mezclan los reactivos, por lo que depende de la concentracin inicial de
estos. La expresin
que relaciona la velocidad de reaccin con las concentraciones de los reactivos se denomina ley
de velocidad o ley de accin de masas.
Para una reaccin homognea: aA + bB + ... dD + e E + ...
a volumen constante, la velocidad de reaccin es:
v = k[A]
[B]
... (107)
Donde la constante de proporcionalidad k que se conoce como constante de velocidad
especfica, es una funcin de la temperatura e independiente de la concentracin; y , ... son
valores no necesariamente enteros, llamados orden parcial de la reaccin, la suma de ellos ( +
+...), constituye el orden total de la reaccin.
Los rdenes de reaccin no deben confundirse o coincidir con los coeficientes estequiomtricos
a, b, .., x.
De acuerdo a lo anterior se puede expresar la dependencia respecto de la concentracin con la
siguiente ecuacin para el primer dato de la tabla N 6:
Velocidad = k (NH
4
+
) (NO
2
-
)
5,4 x 10
-7
M/s = k (0.0100 M) (0.200 M), despejando la contante se obtiene
k = 5,4 x 10
-7
M/s / 0,002M
k = 0.00027 M
-1
s
-1
2.7 x 10
-4
M
-1s-1
de esta manera puede determinarse el valor de k a partir de datos experimentales.
3.6.1 Determinacin experimental de la ecuacin de velocidad
Cuando se aborda el estudio cintico de una reaccin, el primer objetivo es establecer la
ecuacin de velocidad. Lo cual supone la determinacin de los ordenes de reaccin y de la
constante de velocidad. As, si se estudia una reaccin de la forma:
a A + bB P
como primera aproximacin, se considera la ley de velocidad:
v = k[A]
[B]
...
Para determinar los ordenes de reaccin se puede hacer uso del mtodo de las velocidades
iniciales, el cual se basa en la medida de la velocidad inicial, v
o
, para diversas mezclas de
reaccin en las que se mantienen constantes todas las concentraciones excepto una. En esas
condiciones, la velocidad aparece como una funcin de la nica concentracin variable y, por lo
tanto, se puede determinar fcilmente el orden de reaccin respecto a dicha especie. As, en la
reaccin anterior, para determinar se mantendra constante la concentracin de B y se hara
uso de la expresin:
v
o
= k' [A]
o
(108)
donde k' incluye el trmino constante de concentracin de B. Tomando logaritmos resulta la
ecuacin de una recta.:
log v
o
= log k' + n log [A]
o,
(109)
Una serie de experiencias realizada para diversas concentraciones iniciales de A permiten
obtener diversos puntos de la recta. El orden de reaccin, , es la pendiente de la recta, que
puede obtenerse ajustando por mnimos cuadrados. Experimentalmente, la determinacin de la
velocidad inicial se lleva a cabo tomando medidas de la concentracin dentro de un intervalo de
tiempo suficientemente pequeo al comienzo de la reaccin. As por ejemplo, si se toman una
serie de medidas de la concentracin de A a diferentes valores del tiempo t desde el instante
inicial donde t = 0, la velocidad inicial se puede calcular como:
v
o =
(1/a)
*
{( [A]
t
- [A]
o
) / t}
(110)
las series de medidas de v
o
permitirn calcular el orden de reaccin respecto a A. Las medidas
de la concentracin del reactivo se toman haciendo uso de un mtodo analtico suficientemente
sensible, rpido y selectivo. Una vez determinado el orden de la reaccin respecto a una
especie, se procede a determinar el orden respecto a otra y as sucesivamente. En el caso de
reacciones complejas es necesario estudiar el orden de reaccin respecto a las concentraciones
de los productos, puesto que en numerosas ocasiones tambin
estn incluidos en la ley de velocidad. Cuando se conocen todos los ordenes se puede
determinar la constante de velocidad de la forma:
k = v
o
/ [A]
o
[B]
o
... (111)
Alternativamente se puede ajustar la recta (6) y obtener k de la ordenada en el origen:
log v
o
= log k + log ([A] [B]
...) (112)
3.6.2 Integracin de leyes de velocidad sencillas
En general para una reaccin homognea: aA + bB + ... eE + fF + ... donde a, b, e,
f, ... son los coeficientes estequiomtricos y A, B, E, F, ... las especies qumicas, se puede
expresar matemticamente la velocidad de esta reaccin como:
v = -1/a
*
(dC
A
/dt) = -1/b
*
(dC
B
/dt) = ... = 1/e
*
(dC
E
/dt) = 1/f
*
(dC
F
/dt) (113)
Donde dC
i
/dt corresponde a la variacin de la concentracin de la especie i con respecto al
tiempo. Tal expresin es til para la clasificacin de las reacciones de acuerdo a su orden de
reaccin, puesto que la ecuacin cintica de cada reaccin surge de la integracin de las
expresiones anterior, considerando en todos los casos que:
La temperatura y el volumen son constantes.
La reaccin es irreversible (constante de equilibrio muy grande).
La Ley Integral de Velocidad desarrolla la ley diferencial de velocidad mostrada (113). Para ello,
debe conocerse el orden de reaccin, el cual no necesariamente coincide con la estequiometra
de la reaccin. Por ejemplo:
Para la reaccin: aA + bB cC
la ley de velocidad es v = k [A]
[B]
,
donde, y son el orden con respecto a A y B respectivamente; y + es el orden global de la
reaccin, el cual no necesariamente coincide con el coeficiente estequiomtrico, excepto en las
reacciones elementales. Si se tiene el siguiente mecanismo de reaccin:
A + 2B C v
1
= k [A] [B]
2
C + 3X 2D v
2
= k [C] [X]
3
D + E F v
3
= k [D] [ E]
Estas son reacciones elementales con sus respectivas ley de velocidades que darn lugar a la
reaccin global: A + 3x + 2B + 2E 2F
A la cual ahora NO se lo conoce el orden de la reaccin, este no debe confundirse con los
coeficientes estequiomtricos, puesto que, esta reaccin ya no es elemental.
A partir de la integracin de la ecuacin cintica de una reaccin puede determinarse el orden de
la misma, de acuerdo a esto existen los siguientes tipos de reaccin:
- Reaccin de orden uno
- Reaccin de orden dos
a. Para un slo reactante.
b. Para dos reactantes con igual estequiometra y concentracin inicial.
c. Para dos reactantes con distinta estequiometra y concentracin inicial.
- Reacciones de tercer orden.
- Reaccin de orden cero.
- Reacciones seudomoleculares.
3.6.2.1. Reacciones de primer orden:
Corresponden a procesos elementales unimoleculares, las reacciones del tipo:
A P
Es decir, aquellas reacciones donde la velocidad en cualquier instante t es proporcional a la
concentracin de uno de los reactivos, esto es:
v = -dC
A
/dt = - k [A]
(114)
La integracin de esta ecuacin conduce a una expresin logartmica:
Ln C
A
= - k t + Ln C
Ao
(115)
Representando ln C
A
frente al tiempo se obtiene una recta de pendiente igual a -k y con
ordenada en el origen igual a ln C
Ao
.
Grficamente: Ln C
A
- Ln C
Ao
= - k t (116)
Figura 15. Grfica de Ln C
A
Vs t
En procesos gobernados por leyes de primer orden la concentracin de reactivo, A, disminuye
exponencialmente y, de manera simultnea, la concentracin de producto aumenta tambin
exponencialmente:
C
A
= C
Ao
e
- k t
(117)
El tiempo que debe transcurrir para que la concentracin inicial se reduzca a la mitad de su valor
(perodo de semireaccin o tiempo de vida media, t
), en el caso de una reaccin de primer
orden resulta:
C
Ao
/ 2 = C
Ao
e
- k t/2
(118)
y por tanto, la vida media viene dada por:
t
1/2
= ( Ln 2) / k (119)
t = 0,693/ k (120)
Ln C
A
Pendiente = -k
Unidades de k: (t
1
); seg.
1
, min.
1
, etc.
Ln C
Ao
t
El tiempo de vida media en una reaccin de primer orden no depende de la concentracin inicial.
Algunos ejemplos de reacciones de primer orden son:
-La isomerizacin del ciclopropano: (CH
2
)
3
CH
3
- CH=CH
2
-La descomposicin del pentxido de dinitrgeno: 2 N
2
O
5
4 NO
2
+ O
2
Esta ltima es una reaccin compleja, pero globalmente sigue una cintica de primer orden.
3.6.2.2 Reacciones de segundo orden:
Pueden darse dos casos, dependiendo de si la ecuacin de velocidad es funcin de la
concentracin de un solo reactivo o de dos.
a) El primer caso corresponde a una reaccin elemental del tipo:
2 A P A + B P ;
[A] =[B] que podr describirse mediante la ecuacin de velocidad de segundo orden siguiente:
v = dC
A
/ dt = - k [A]
2
(173)
La velocidad es proporcional a la segunda potencia de uno de los reactivos, la integracin de
esta ley de velocidad conduce a:
1 / C
A
= k t + 1 / C
Ao
(174)
y por tanto, la representacin de 1/C
A
frente al tiempo da lugar a una recta de pendiente k y
ordenada en el origen 1/C
Ao
.
Grficamente: 1 / C
A
= k t + 1 / C
Ao
Figura 16. Grfica de 1/C
A
Vs t
La concentracin de A experimenta una variacin hiperblica con el tiempo:
C
A
= C
Ao
/ (1 + C
Ao
k t ) (175)
El tiempo de vida media para este tipo de reacciones tiene la expresin:
t
1/2
= 1 /( C
Ao
k ) (176)
b) Cuando la reaccin de segundo orden viene representado por el proceso elemental:
A + B P
El cual esta gobernado por la ecuacin de velocidad:
v = dC
A
/ dt = - k [A] [B] (177)
De acuerdo a esto, la velocidad es proporcional al producto de las concentraciones de ambas
especies reaccionantes. Si se denomina x a la concentracin de A que ha reaccionado en el
tiempo t, la ley de velocidad integrada ser:
[1/ (C
Bo
- C
Ao
)]
*
Ln [C
Bo
(C
Ao
- x )/ C
Ao
(C
Bo
- x )] = - k t (178)
Donde:
(C
Ao
- x ) = C
A
(C
Bo
- x ) = C
B
Entonces la expresin puede simplificarse a:
1/ (C
Bo
- C
Ao
)]
*
Ln [C
Bo
C
A
/ C
Ao
C
B
] = - k t (179)
Pendiente = k
Unidades de k = c
1
t
1
1 / C
Ao
1 /C
A
t
Un caso particular importante se encuentra cuando la concentracin de uno de los reactivos es
muy grande en comparacin a la concentracin del otro. En tal caso, la concentracin del
reactivo en exceso puede considerarse constante con el tiempo, por lo que la ley de velocidad
quedar:
v = k' C
A
(180)
Es decir, la ecuacin de velocidad se transforma en una ecuacin de seudo-primer orden.
Algunos ejemplos de reacciones de segundo orden son:
- Disociacin del cido iodhdrico: 2 HI I
2
+ H
2
-Sntesis del cido iodhdrico: I
2
+ H
2
2 HI
-Hidrlisis de un ster: RCO
2
R' + NaOH RCO
2
Na + R'OH
-Dimerizacin de hidrocarburos: 2 C
4
H
6
C
8
H
12
3.6.2.3 Reacciones de tercer orden
En la prctica son muy pocas las reacciones de este tipo. En general, todos los estudios se
realizan de acuerdo a la siguiente reaccin: 3A P,
con las condiciones iniciales: [A]=[B]=[C] para la cual,
v = dC
A
/dt = kC
A
3
(181)
cuya integracin resulta:
k = 1/2t
*
[1/C
A
2
1/C
Ao
2
] (182)
y el tiempo de vida media se expresa:
t
1/2
= 3/(2kC
Ao
2
) (183)
3.6.2.4 Reacciones de orden cero:
Corresponde a aquellas reacciones donde la rapidez de reaccin es independiente de la
concentracin de los reactivos. En este caso la velocidad de formacin del producto viene dada
por una ecuacin del tipo:
d C
P
/ dt = k (184)
cuya integracin conduce a:
C
P
= C
Po
+ k t (185)
y por tanto a una variacin lineal de la concentracin con el tiempo. Reacciones de orden cero se
encuentran frecuentemente en catlisis heterognea, cuando la reaccin se lleva a cabo sobre
una superficie saturada de reactivo. Y en reacciones catalizadas con suficiente exceso de
substrato para saturar el catalizador.
3.6.2.5. Reacciones seudomoleculares
Son aquellas reacciones cuyas ecuaciones no corresponden al real orden de la reaccin.
3.6.2.7 consecutivas y competitivas (paralelas)
Reacciones del tipo A B C D ....... se denominan consecutivas o en serie.
Por otra parte, reacciones del tipo A B
A C
A D
A ...
Se denominan competitivas o paralelas.
En un sistema real, ambos tipo de reacciones podran conformar un sistema y generar por
ejemplo configuraciones como la que se presenta a continuacin:
A C D
E F
Existe una gran cantidad de ejemplos en que es apreciable distinguir ejemplos de este tipo pero
sern abordados en este texto en el tema referente a mecanismos de reaccin.
3.6.2.8 Reacciones reversibles o equilibradas
Los clculos termodinmicos indican que, en principio, ninguna reaccin es imposible o completa
al cien por cien. En la prctica, sin embargo, la constante de equilibrio (que traduce la posicin
de equilibrio) toma para ciertos sistemas reactivos valores tales que el grado de avance mximo
de la reaccin puede ser considerado como nulo o total.
Para otras reacciones, y algunas de ellas constituyen los pilares de la industria qumica, el
rendimiento viene limitado por un estado final de equilibrio algunas veces muy desfavorable. En
estos casos se necesita conocer los parmetros que permitan hacer progresar la reaccin de
manera que resulte lo suficientemente significativa.
En las reacciones reversibles el grado de avance de la reaccin se encuentra limitado por el
hecho de que los reactivos transformados por la reaccin directa son, a medida que sta avanza,
regenerados en proporcin cada vez ms importante por la reaccin inversa. Transcurrido cierto
tiempo se alcanza, por tanto, un estado de equilibrio que ha sido calificado como dinmico. Este
estado
puede alcanzarse de formas muy diversas: puede resultar de la oposicin de reacciones del
mismo orden (entero o fraccionario), de reacciones de orden distinto e incluso resultar de la
oposicin de reacciones que no responden a ningn orden. Nosotros solo vamos a considerar
aquellas reacciones reversibles que resultan de la oposicin de reacciones que responden a un
orden (entero para mayor simplicidad). Una reaccin de este tipo puede simbolizarse en la forma
responden a ningn orden. Nosotros solo vamos a considerar aquellas reacciones reversibles
que resultan de la oposicin de reacciones que responden a un orden (entero para mayor
simplicidad). Una reaccin de este tipo puede simbolizarse en la forma
(186)
donde kd es la constante de velocidad de la reaccin directa y ki la de la reaccin inversa.
Si representamos por vd y vi las velocidades de las reacciones enfrentadas (directa e inversa),
de acuerdo con la hiptesis que hemos hecho (acerca de que ambas responden a un orden),
tendremos:
(187)
la velocidad neta de transformacin ser la diferencia entre la velocidad de la reaccin directa y
la de la reaccin inversa. Es decir,
(188)
En el equilibrio se igualan las velocidades vd y vi, por lo que la velocidad neta de transformacin
resulta cero1. De acuerdo con lo anterior y segn la ecuacin (188) tendremos
(189)
La ecuacin (189) refleja la relacin existente entre la constante de equilibrio, KC, y las
constantes de velocidad de las reacciones directa e inversa, kd y ki.
La ecuacin de Arrenius se cumple para cada una de las dos reacciones enfrentadas (la directa
y la inversa). As, podemos escribir
(190)
donde Ea,d y Ea,i son las energas de activacin de las reacciones directa e inversa,
respectivamente.
A continuacin vamos a estudiar algunos casos particulares de reacciones reversibles.
Caso 1. Reacciones reversibles de orden uno para las reacciones directa e inversa
(con coeficientes estequiomtricos iguales a 1) de primer orden en las dos direcciones, directa e
inversa, de modo que vd = kd [A] y vi = ki [B].
Si inicialmente solo est presente la especie qumica A con una concentracin [A]0 = a,
transcurrido un cierto tiempo t, las concentraciones de A y de B sern:
[A] = a x y [B] = x con lo cual la ley de velocidad podemos escribirla en la forma
(191)
Fig. 17
En el equilibrio (dx/dt = 0) la ec. (12.3) quedar en la forma 0 = kd (a xe ) kixe . De donde
despejando ki y llevndola de nuevo a la ecuacin (12.3) obtenemos
Los rdenes p, q, r, etc. pueden ser cualquier nmero entero o fraccionario,
ejem.: (0, entero, fraccionario) y deben determinarse experimentalmente ya que la ecuacin
estequiomtrica global no tiene informacin cintica.
Por otro lado las unidades de la constante de velocidad kn dependen del valor de n:
3.7 Mtodos Para La Determinacin De Parmetros Cinticos
3.7.1 Mtodo integral. Se selecciona una ecuacin especfica del modelo cintico en base a un
orden de reaccin supuesto, se integra y si en la representacin grfica del tiempo frente a una
funcin de la concentracin, los datos experimentales se ajustan a una recta, la constante
cintica se evala con la pendiente de dicha recta (mtodo grfico). Tambin se puede obtener
esta constante al despejarla directamente del modelo supuesto y calcular sus diferentes valores
usando los datos experimentales (mtodo de sustitucin o
Fig. 18
Cuadro N7
analtico), si la constante cintica presenta valores muy similares sin ninguna tendencia, el
modelo cintico supuesto es el adecuado.
El mtodo integral de anlisis de datos cinticos es fcil y sencillo de aplicar y se recomienda
cuando se prueban mecanismos especficos o expresiones cinticas relativamente sencillas
correspondientes a reacciones elementales, o cuando los datos experimentales estn tan
dispersos que las velocidades de reaccin no se pueden calcular con suficiente exactitud en
forma grfica para aplicar el mtodo diferencial.
El mtodo integral pierde su atractivo de sencillez cuando la ecuacin cintica particular en
estudio no se puede integrar fcilmente, adems debido a su naturaleza iterativa, puede resultar
lento si la reaccin es no elemental.
El mtodo integral requiere siempre de la integracin de la expresin cintica seleccionada. Para
las reacciones irreversibles se puede seguir el procedimiento general descrito a continuacin:
1. Transformar los datos experimentales ya sea a concentracin molar o conversin del reactivo
limitante empleando las ecuaciones descritas anteriormente.
2. Determinar el tipo de sistema, densidad constante o variable, tomando en cuenta la
estequiometra, tipo de reaccin y condiciones de operacin, y seleccionar la forma de la
expresin de velocidad de reaccin a emplear:
3. Suponer el orden de reaccin n (0 n 3). Es recomendable iniciar las iteraciones
considerando que la reaccin es elemental.
4. Sustituir el orden de reaccin supuesto en las ecuaciones segn sea el caso.
5. Separar variables e integrar desde el estado inicial (t=0, CA=CAo, xA=0) hasta el estado final
(t, CA, xA).
6. Verificar si el orden de reaccin supuesto es el correcto, mediante cualquiera de los siguientes
mtodos:
- Mtodo de sustitucin o analtico. Despejar y calcular la constante cintica k de la ecuacin
integrada en el punto 5. Si la constante k presenta valores muy similares sin ninguna tendencia,
es decir, las ks calculadas muestran valores alternados o sin mucha diferencia entre ellos, el
orden de reaccin supuesto es el correcto y la constante cintica se evala como el promedio de
todos los valores calculados.
- Mtodo grfico. Transformar la ecuacin integrada en el punto 5 a una forma lineal, de tal forma
que el eje de las abscisas sea el tiempo (t) y el eje de las ordenadas una funcin de la
concentracin o conversin f(CA) f(xA). Graficar los datos experimentales y si stos se ajustan
a una recta, el orden de reaccin supuesto es el correcto y la constante cintica se obtiene con la
pendiente de dicha recta.
7. Si con cualquiera de los procedimientos anteriores no se logra un buen ajuste, se regresa al
punto 3 a resuponer el orden de reaccin.
3.7.2 METODO DE AISLACIN
Si en la mezcla de reaccin la concentracin de uno de los sustratos es mucho menor, este se
comporta como reactivo limitante. En esas condiciones, si las concentraciones de los otros
reactivos se mantiene constante durante el transcurso de la reaccin, se cumple que:
(1
93)
Experimentalmente se determina por algn mtodo analtico la variacin de
[A] vs. t. El procedimiento se repite para cada sustrato en condiciones de reactivo limitante.
El orden p, q, r,.... se determina al tanteo por algn mtodo de integracin o de las velocidades
iniciales.
En este mtodo se aplica a sustratos aislados, determinando la velocidad inicial de consumo del
reactivo:
Para no cometer error en la determinacin grfica de la derivada inicial, conviene aplicar el
mtodo a conversiones de sustrato <5% (parte lineal). El mtodo puede presentar incertidumbre
debido a la influencia de los productos en vo.
3.7.3 Mtodo del tiempo de vida media. A diferencia de los otros mtodos, que emplean datos
experimentales de tiempo y alguna propiedad fsica del sistema, para el mtodo del tiempo de
vida media se requiere conocer el tiempo que transcurre para que la concentracin inicial del
reactivo disminuya a la mitad de su valor. Es decir, la informacin experimental se debe obtener
con diferentes concentraciones iniciales del reactivo.
El tiempo de vida media o periodo medio de reaccin (t1/2) es el tiempo necesario para que la
concentracin inicial de los reactivos disminuya a la mitad de su valor. Para aplicar este mtodo
se requiere de una serie de datos de tiempo de vida media a diferentes concentraciones iniciales
de reactivo.
Fig. 19
El procedimiento para la obtencin del orden de reaccin y la constante cintica es similar al
mtodo integral, nicamente que al momento de hacer la integracin en la ecuacin de velocidad
de reaccin, los lmites de la integral son desde el estado inicial
(t=0 y CAo) hasta el tiempo de vida media (t=t1/2 y CA=CAo/2).
Partiendo de la ecuacin de velocidad de reaccin para reacciones irreversibles de un
componente a densidad constante
3.8 Estudio De Mecanismos Complejos (Determinacin De La Ecuacin Cintica Mediante
Aproximacin Del Estado Estacionario)
El mecanismo complejo ms sencillo es el formado por dos reacciones consecutivas de primer
orden (aquellas que proceden de los reactivos a los productos a travs de etapas intermedias):
k
1
k
2
A B C
Las ecuaciones de velocidad para las especies A y B son:
dC
A
/ dt = - k
1
C
A
(194)
dC
B
/dt = k
1
C
A
- k
2
C
B
(195)
La primera reaccin est gobernada por una ley de primer orden:
C
A
= C
Ao
e
- k1 t
(196)
La segunda reaccin obedece a la ecuacin diferencial siguiente:
dC
B
/dt = k
1
C
Ao
e
- k1 t
- k
2
C
B
(197)
esta indica que B se forma a medida que A se destruye y, al mismo tiempo, B se descompone
siguiendo una reaccin de primer orden. Si se considera que inicialmente C
Bo
= 0 y C
Co
= 0, la
integracin de la ecuacin diferencial conduce a:
C
B
= [C
Ao
k
1
/ k
2
- k
1
] ( e
- k1 t
- e
- k2 t
) (198)
y como C
C
= C
Ao
- C
A
- C
B
, resulta:
C
C
= C
Ao
[ 1 ( k
2
e
- k1 t
/
k
2
- k
1
)
+ ( k
1
e
- k2 t
/ k
2
- k
1
)] (199)
A partir de esta expresin se puede deducir que si k
1
>> k
2
entonces:
C
C
= C
Ao
(1 - e
- k2 t
) (200)
Igualmente, si k
2
> > k
1
resulta:
C
C
= C
Ao
(1 - e
- k1 t
) (201)
A partir de esto se puede concluir que cuando uno de los procesos es claramente ms lento que
los otros se produce un efecto de "cuello de botella", y la velocidad total de la reaccin resulta
controlada por este proceso. Esta etapa ms lenta que controla la velocidad del proceso global,
se llama etapa limitante de la velocidad. Una situacin de particular inters se encuentra cuando
la especie intermedia B es muy reactiva (k
2
>> k
1
). En este caso, su velocidad de destruccin
igualar a la de formacin, siendo su concentracin muy pequea y adems, mientras la
concentracin de A se mantenga relativamente alta se podr suponer que la concentracin de B
es constante con el tiempo. Cuando estos requisitos se cumplen se dice que se ha alcanzado el
estado estacionario. En este momento se tiene:
dC
B
/dt = k
1
C
A
- k
2
C
B
= 0 (202)
De donde:
C
B
= (k
1
/ k
2
)
*
C
A
= ( k
1
/ k
2
)
*
C
Ao
e
- k1 t
(203)
La concentracin de C con el tiempo aumentar segn la ley:
Cc = C
Ao
(1 - ( 1 + k
1
/ k
2
) e
- k1 t
(204)
que coincide aproximadamente con la ecuacin original no simplificada cuando se cumplen las
dos condiciones necesarias para alcanzar el estado estacionario, esto es, que k
2
>> k
1
y
que t >> 1/k
2
. La primera condicin asegura la presencia de un proceso muy rpido en el cual el
intermediario se destruye a medida que se forma, lo que mantiene su concentracin constante.
La segunda condicin implica que se requiere un cierto tiempo durante el cual la
concentracin del intermediario aumente desde cero hasta alcanzar la concentracin
estacionaria. Este tiempo se conoce como perodo de induccin. Cuando se propone un
mecanismo para una reaccin compleja, hay que comprobar que las reacciones elementales se
combinan para dar la reaccin global. En algunos casos existen sustancias que no aparecen en
la reaccin global pero si participan en la reaccin como especies intermedias. En el mecanismo
siguiente:
2 NO
2
NO
3
+ NO
NO
3
+ CO NO
2
+ CO
2
Cuya reaccin global es:
NO
2
+ CO NO + CO
2
La especie NO
3
es un intermediario de la reaccin. En algunos mecanismos complejos aparecen
etapas que son equilibrios rpidos, este caso, puede suponerse que la velocidad de la reaccin
directa iguala a la de la reaccin inversa con el fin de simplificar el estudio del mecanismo. Un
ejemplo de como se puede hacer uso de estas simplificaciones lo constituye la reaccin de
descomposicin del ozono, para la cual el mecanismo propuesto es:
O
3
O
2
+ O (equilibrio rpido)
O
3
+ O O
2
(etapa lenta)
La velocidad de la reaccin global estar determinada por la velocidad de la etapa ms lenta:
v = k
2
[O
3
] [O] (205)
En esta expresin aparece la concentracin de un intermedio, interesa poner la velocidad en
funcin de las concentraciones de los reactivos. Como el equilibrio primero es rpido se puede
suponer que la velocidad de la reaccin inversa es igual a la de la reaccin directa:
k
1
[O
3
] = k
-1
[O
2
] [O] (206)
Por lo tanto:
[O] = k
1
[O
3
]/ k
-1
[O
2
] (207)
Sustituyendo se obtiene la ecuacin de la velocidad de la reaccin global:
v = k
1
k
2
/ k
1
= k{ [O
3
]
2
[O
3
]
2
/ [O
2
] [O
2
]} (208)
3.9 Teora de Arrhenius sobre la dependencia de la temperatura
Existen reacciones que a temperatura normal poseen una velocidad de reaccin imperceptible
que aumenta notablemente a temperaturas elevadas. Experimentalmente se ha demostrado que
la velocidad de reaccin es directamente proporcional a la temperatura, es decir, que al
aumentar esta la velocidad tambin aumenta, de all que se considere, como uno de los factores
que afecta la rapidez de una reaccin qumica.
La constante de velocidad k as como otras constantes proporcionales (ejemplo, la constante de
equilibrio), depende sustancialmente de la temperatura, aumentando casi siempre con ella. Una
regla aproximada, vlida para muchas reacciones de disolucin, es que cerca de la temperatura
ambiente, k se duplica o triplica por cada aumento de 10 C.
Arrhenius fue el primero en proporcionar la base cuantitativa de la relacin entre la temperatura y
la energa de activacin con la constante de velocidad.
Para la mayora de estas reacciones qumicas se ha encontrado que el factor dependiente de la
temperatura se ajusta a la ecuacin de Arrhenius.
k = A e
Ea/RT
(209)
donde A es el factor de frecuencia, llamado tambin factor de Arrhenius o factor exponencial, el
cual es independiente de la temperatura a menos que el intervalo de esta sea muy grande y
cuyas unidades son iguales a la de k; Ea es la energa de activacin de la reaccin; T, la
temperatura y R, la constante de los gases. Esta expresin se ajusta bien a los resultados
experimentales en un amplio rango de temperaturas y se considera como una primera
aproximacin adecuada para el estudio del efecto de la temperatura sobre la ecuacin cintica.
Esta expresin
se ajusta bien a los resultados experimentales en un amplio rango de temperaturas y se
considera como una primera aproximacin adecuada para el estudio del efecto de la temperatura
sobre la ecuacin cintica.
De la expresin 209 puede verse que a temperatura constante cuanto mayor es la Ea, ms
pequea ser la constante de velocidad y por lo tanto ms lenta ser la velocidad de reaccin.
Por el contrario, velocidades de reaccin rpida tendrn una Ea pequea. Al llevar dicha
ecuacin a una forma logartimica, se tiene que:
Log k = Log A (Ea/2,303 RT) (210)
Si la ecuacin de Arrhenius se cumple la grfica del Log k contra 1/T debe dar una lnea recta,
cuya interseccin en el eje de las ordenadas proporciona el factor preexponencial como Log A y
la pendiente permite calcular el valor de la energa de activacin por medio de la expresin; m = -
Ea/2,303RT.
En las figuras se muestra la relacin de k y T para la reaccin:
2N
2
O
5
4NO
2
+ O
2
a) Relacin exponencial entre k y T
b) Representacin de Arrhenius para la
reaccin
Figura 20. Representaciones de la influencia de T sobre la constante de velocidad (k)
T
K
1/ T (K
-1
)
LogK
LogA
A= 3,16
*
10
13
m = -Ea/2,303 = -5500 K
Ea = 25 Kcal/mol
Figura 21. Curva de energa potencial Vs. Avance de la
reaccin para reaccin exotrmica y endotrmica
3.10 Energa de Activacin
Para que ocurra una reaccin entre dos molculas, stas deben colisionar en la orientacin
correcta y poseer una cantidad de energa mnima. Esa energa que necesita un sistema para
iniciar un determinado proceso se denomina energa de activacin (Ea). Esta suele utilizarse
para denominar la energa mnima necesaria para que se produzca una reaccin qumica dada.
A medida que las molculas
se aproximan, sus nubes de
electrones se repelen. Esto
requiere energa (energa de
activacin) y proviene del
calor del sistema, es decir
de la energa traslacional,
vibracional, etc. de cada
molcula. Si la energa es
suficiente, se vence la
repulsin y las molculas se
aproximan lo suficiente para
que se produzca una
reordenacin de los enlaces
de las molculas.
Puede deducirse de acuerdo a la grfica de la energa potencial de las especias reactivas contra
el avance de la reaccin, si el proceso de transformacin es exotrmico o endotrmico, es decir,
si este libera o absorbe energa respectivamente. En la figura 4 se muestran las grficas para
cada tipo de reaccin, en las que se observa que cuando la reaccin es exotrmica los reactivos
poseen una mayor energa potencial que las especies producidas, por lo tanto la variacin en la
entalpa es menor que cero, mientras que, en la reaccin endotrmica los reactivos muestran
una menor energa potencial que los productos al final de la reaccin. En ambas grficas, se
observa una cima en la curva de energa potencial, la diferencia de energa que existe entre el
punto ms alto de la curva y la energa de los reactivos corresponde a la energa de activacin,
la cual es requerida para que estos puedan transformarse en productos.
Para la mayora de las reacciones la energa de activacin est en el rango de 0 a 80 Kcal/mol; y
de acuerdo a esta puede establecerse, si la reaccin es unimolecular, bimolecular o de radicales
libres, puesto que cada tipo posee un rango definido de energa.
3.10.1 Determinacin del tipo de reaccin de acuerdo a la energa de activacin
3.6.1.1 Reacciones unimoleculares
Aquellas donde una molcula de una sustancia se descompone y se rompe en fragmentos
A Productos
Generalmente las descomposiciones unimoleculares con enlaces fuertes tienen valores altos de
Ea, por ejemplo, la descomposicin gaseosa del dixido de carbono (CO
2
) posee una energa de
activacin de 100 Kcal/mol.
3.6.1.2 Reacciones bimoleculares
Aquellas donde dos molculas reaccionan para formar otras especies.
A + B Productos
Para una reaccin bimolecular, la velocidad de reaccin depende del nmero de colisiones por
unidad de tiempo. Estas reacciones tienden a tener una Ea ms baja que las unimoleculares, un
ejemplo de esto es:
H
2
+ I
2
2HI Ea = 75 Kcal/mol
3.6.1.3 Reacciones con radicales libres
Existen molculas independientes que contienen uno o ms electrones sin aparear, los
cuales ocupan una rbita atmica o molecular de forma individual. Estas molculas se
denominan radicales libres y pueden considerarse como fragmentos de molculas, muy
reactivos, y en consecuencia de vida media muy corta.
La formacin de enlaces covalentes simples en los que un electrn de enlace proviene de (o va
a) cada reactivo reciben el nombre de reacciones de radicales libres, como en:
H + H H H.
La recombinacin de radicales libres para formar una molcula poliatmica estable no requiere la
ruptura de enlaces y la mayora de dichas reacciones tienen una Ea nula (Ea = 0 Kcal/mol).
3.11 Cintica Molecular
3.11.1 Teora de colisiones
Esta teora conocida tambin como, teora de las colisiones de esferas rgidas, explica la cintica
observada en funcin del comportamiento de los sistemas que reaccionan. De acuerdo con esta,
las molculas son esferas rgidas que para poder reaccionar deben chocar y poseer una energa
de colisin suficiente para activarse y la velocidad de reaccin es proporcional al nmero de
colisiones Z, el cual a su vez es proporcional al cuadrado de la concentracin de las molculas.
Las reacciones en fase lquida han sido las ms investigadas desde un punto de vista
experimental, ya que la tcnica de medida es ms sencilla que la de las reacciones en fase
gaseosa. Sin embargo desde un punto de vista terico a escala molecular, es ms sencillo tratar
con reacciones gaseosas, no slo por las dificultades tericas del estado lquido a nivel
molecular, sino por las fuertes interacciones entre las molculas de reactivo entre s y con el
disolvente. Por lo tanto, se estudiar el caso de las reacciones gaseosas en especial
bimoleculares, que son las ms sencillas de tratar.
La teora de colisiones para reacciones bimoleculares se basa en las siguientes suposiciones:
a) La reaccin se produce por choque entre dos molculas.
b) Slo son eficaces las colisiones cuya energa sea superior a un cierto valor.
c) En el momento del choque, las molculas han de tener una orientacin determinada.
Se va a estudiar la teora de colisiones usando sucesivamente cada una de las suposiciones
anteriores, con objeto de ver cmo la comparacin con las medidas experimentales es la que ha
obligado a ir introduciendo cada vez ms hiptesis.
Si se supone que cada choque da lugar a una reaccin y se hace uso de los resultados
obtenidos en la teora cintica de los gases se puede demostrar que la velocidad de reaccin
para el sistema
A +B Productos
es la siguiente
(211)
siendo Z
AB
, el nmero de choques por segundo que tienen lugar en 1 cm
3
de gas (expresin
dado por la teora cintica de gases) y n
i
el nmero de molculas por cm
3
de la especie i. El valor
de Z
AB
es el siguiente
(212)
por lo que se puede escribir
(212)
al multiplicar y dividir el contenido de la integral por el nmero de Avogadro se obtiene
(213)
por lo tanto el valor de la constante queda
(cm
3
molcula
-1
seg
-1
)
(214)
o tambin en unidades diferentes
(litro mol
-1
seg
-1
)
(215)
donde
ab
es la distancia ms corta a la que pueden acercarse los centros de las dos molculas.
(216)
a
y
b
son los dimetros moleculares de las especies a y b
K es la constante de Boltzman
T temperatura absoluta
es la masa reducida del sistema
(217)
Hay que considerar el hecho de que no todas las colisiones entre la especies A y B en este
sistema bimolecular que se esta tratando, originan productos ( porque
no todas son efectivas), a pesar de esto, la velocidad de reaccin por unidad de volumen (por lo
tanto , la constante de velocidad),es proporcional al nmero de colisiones de A - B por segundo
por unidad de volumen (ZAB). Esto es:
(218)
donde, p es el factor estrico que compensa el hecho de que se requiera una cierta orientacin
en los choques intermoleculares para que ocurra la reaccin; R es igual a 8,3
*
10
7
erg K/mol; es
el dimetro molecular ;N
corresponde al nmero de molculas de A y e
(Ea/RT)
es el factor de
Boltzman.
En el caso de tener el siguiente sistema
2 A productos
la expresin que se obtiene es
(219)
la velocidad de reaccin tiene la expresin:
(54)
y la constante de velocidad corresponde a la expresin
(220)
o tambin
(221)
La teora simple de las colisiones en las reacciones bimoleculares proporciona una visualizacin
desde el punto de vista cintico de este tipo de reacciones, y es satisfactoria para reacciones en
solucin a base de iones simples. Sin embargo, en muchos casos, las velocidades que se
predicen con este mtodo son muy altas. Las predicciones de factores de frecuencia estn
situadas en un intervalo estrecho de 1012 a 1014, mientras que los valores medidos pueden ser
de varios rdenes de magnitud menores. Parece ser que la desviacin aumenta con la
complejidad de las molculas reaccionantes. Adems, no proporciona los medios para el clculo
de la energa de activacin y el factor estrico.
Figura 22. Representacin del
proceso de activacin para una
COMPLEJO
ACTIVADO
REACTIVOS
PRODUCTO
S
3.11.2 Teora del estado de transicin
Esta teora tambin llamada teora del complejo activado o velocidades absolutas, representa
otra aproximacin a la cintica de las reacciones. De acuerdo con esta teora, se sigue
suponiendo que la reaccin se verifica como resultado de colisiones entre las molculas
reaccionantes. El postulado de esta teora consiste en la formacin de un complejo activado (o
estado de transicin) a partir del reactante, y que este complejo se descompone posteriormente
para formar los productos. Se supone que el complejo activado est en equilibrio termodinmico
con los reactantes. La etapa que controla la velocidad es la descomposicin del complejo
activado.
Esta teora parte de la hiptesis de que cualquier reaccin elemental, no lo es completamente,
pues hay una reaccin parcial primera que transcurre en equilibrio y en donde los reactivos en
sus choques forman
un complejo, llamado complejo activado, el
cual se descompone totalmente en una
segunda
reaccin dando productos. Es decir si:
A + B (A.B*) productos
complejo activado
En la figura 22, se observa como el complejo
(A.B*) no es estable, puesto que existe a un
mximo de energa potencial.
En esta teora se considera que el complejo
activado es un agregado de tomos similar a una molcula ordinaria con vibracin especial que
lo hace inestable y que conduce a su descomposicin, para la formacin de productos.
k
UNIDAD IV
CATALISIS DE LAS REACCIONES QUIMICAS
4.1) Catalizadores:
Los catalizadores son animadores de la fiesta pueden definirse como sustancias simples o
compuestos de origen orgnico o inorgnico que poseen la propiedad de acelerar o retardar una
reaccin qumica in-situ modificando su mecanismo y por ende su energa de activacin,
permaneciendo inalterados qumicamente al final del proceso.
El catalizador no altera la condicin de equilibrio ya que sta depende nicamente de la
diferencia de energa libre estndar G f (k). Adicional a las caractersticas mencionadas, estas
sustancias tienen un efecto orientador que se relaciona con las trayectorias termodinmicamente
permitidas y tambin reducen las reacciones colaterales.
Aunque los catalizadores no modifiquen la constante de equilibrio, un catalizador homogneo
puede cambiar la composicin de equilibrio de un sistema, ya que la constante est en funcin
de las fracciones molares K=
i
(a
i,eq
)
v
i
, y a
i
=
i
x
i
, donde: a
i
(actividad), (coeficiente de actividad),
V
i
(coeficiente estequiometrico de la especie i). Puesto que los catalizadores en el sistema
generalmente estn en pequeas cantidades entonces afectar escasamente la composicin de
equilibrio. Algunos conceptos iniciales de catalizador fueron publicados por Ostwald en el ao
1902. Una reaccin puede llevarse a cabo en una, dos o tres etapas denominadas elementales,
durante las cuales participan las molculas de los reactivos. En general, existir una etapa ms
lenta que las otras y ser sta la que determine la velocidad global de la transformacin.
Catalizar una reaccin implica reemplazar este paso por varias etapas ms rpidas que se llevan
a cabo slo en presencia del catalizador. Esto significa que la intervencin del catalizador abre
un camino nuevo a la reaccin, compuesto de reacciones elementales con energa de activacin
menor (Figura 23).
Figura 23. Curva de la energa potencial a lo largo de la coordenada de la reaccin para un
proceso cataltico
4.3) Propiedades de los catalizadores:
La actividad es la consecuencia directa del efecto acelerador, y se define como una velocidad de
reaccin en moles transformados por segundo y por gramo de catalizador. En el caso de algunos
catalizadores se prefiere dar esta velocidad corregida por el rea del catalizador o mejor an
normalizada por el nmero de tomos de catalizador que estn en contacto con la reaccin
(turnover number). Esta ltima expresin de la velocidad ha sido muy til para establecer una
clasificacin de las reacciones catalticas. Reacciones "fciles" o insensibles a la estructura y
reacciones "exigentes" o sensibles a la estructura. En el primer tipo de reacciones la velocidad
depende tan slo del nmero total de tomos de catalizador en contacto con el fluido, mientras
que en el segundo caso depende de slo algn tipo de tomo en particular, como por ejemplo
tomos en las esquinas de los cristales de catalizador, un arreglo geomtrico de tomos (dos o
tres), etctera.
En este tipo de expresin de la velocidad, la determinacin del nmero de tomos superficiales
de catalizador es la etapa crtica. Si bien en el caso de los metales es relativamente fcil evaluar
ese nmero a partir de la quimisorcin de hidrgeno, en otros compuestos catalticos como los
xidos y los sulfuros esta determinacin no est an bien clarificada.
La selectividad de un catalizador est relacionada con el efecto orientador de la reaccin en una
direccin preferente. Esta cualidad es debida a que el catalizador abre nuevos caminos de
reaccin con menor energa de activacin, los cuales desembocan en una mayor cantidad del
producto o en nuevos productos. Un catalizador es ms selectivo mientras da mayor cantidad del
producto deseado. La selectividad se puede definir como la cantidad de producto constituido en
funcin de la velocidad total de formacin de productos.
En la reaccin:
A B + C
la selectividad hacia B ser:
(222)
La estabilidad de un catalizador es la variable final a optimizar en su aplicacin industrial y la que
se relaciona directamente con la vida til del catalizador. La vida de operacin de un catalizador
debe ser evaluada en funcin de la cantidad de productos formados, de manera que en el
mnimo de tiempo debe permitir amortizar el costo del catalizador y la operacin del proceso. Si
bien en las condiciones de uso de los catalizadores en la actualidad casi todos stos sobrepasan
largamente este mnimo de vida til, se requiere de una serie de prevenciones para evitar que el
catalizador se desactive prematuramente.
El fenmeno de la desactivacin est ntimamente ligado a la estabilidad del catalizador. Las
principales causas de desactivacin son:
1) Envenenamiento de la superficie cataltica por una molcula que se adsorbe fuertemente.
2) Coquificacin (formacin de carbn) de la superficie por deshidrogenacin de algunos
hidrocarburos cclicos.
3) Reconstruccin trmica de la superficie con disminucin del rea activa (sinterizacin).
4) Prdida de la fase activa por desgaste del catalizador. Cuando algunos catalizadores se
desactivan pueden ser regenerados para recuperar sus propiedades (totalmente o en parte). El
proceso de regeneracin est ligado al proceso de desactivacin. Algunos catalizadores de
procesos como el de desintegracin cataltica se desactivan muy rpido por la formacin de
carbn en su superficie y deben ser continuamente regenerados. El proceso de fluidizacin de la
desintegracin cataltica obedece a la necesidad de trasladar continuamente el catalizador del
reactor al regenerador y viceversa (Figura 24).
Figura 24. Esquema de un reactor de lecho fluidizado
4.4) Componentes de un catalizador:
-La fase activa, como su nombre lo indica, es la directamente responsable de la actividad
cataltica. Esta fase activa puede ser una sola fase qumica o un conjunto de ellas, sin embargo,
se caracteriza porque ella sola puede llevar a cabo la reaccin en las condiciones establecidas.
Sin embargo, esta fase activa puede tener un costo muy elevado, como en el caso de los metales
nobles (platino, paladio, rodio, etc.) o puede ser muy sensible a la temperatura (caso de los
sulfuros de molibdeno y cobalto), por lo cual se requiere de un soporte para dispersarla,
estabilizarla y proporcionarle buenas propiedades mecnicas.
-El promotor es aquella substancia que incorporada a la fase activa o al soporte en pequeas
proporciones, permite mejorar las caractersticas de un catalizador en cualquiera de sus
funciones de actividad, selectividad o estabilidad. Se conocen dos tipos de promotores: texturales
los que contribuyen a dar mayor estabilidad a la fase activa, y electrnicos, los que aumentan la
actividad. Los casos ms conocidos como promotores son el potasio (electrnico) y la almina
(textural) en el catalizador de hierro para la sntesis del amoniaco.
-El soporte es la matriz sobre la cual se deposita la fase activa y el que permite optimizar sus
propiedades catalticas. Este soporte puede ser poroso y por lo tanto presentar un rea
superficial por gramo elevada (ver tabla 8).
TABLA 8
No porosos
vidrio - Al
2
O
3
SiC
porosos
kieselguhr piedra
pmez
rea superficial
baja (
10m
2
/gr)
No porosos
SiO
2
- AL
2
O
2
carbn
TiO
2
ZnO Gran rea
superficial (
10m
2
/ gr )
porosos ( 0.2 cm
1
/gr)
arcillas naturales Al
2
O
3
MgO SiO
2
Esto es importante si la reaccin qumica es suficientemente lenta; el soporte tambin debe tener
resistencia mecnica elevada si se usan flujos muy rpidos, o tener resistencia trmica si la
reaccin es llevada a cabo en altas temperaturas. En algunos casos como en la reformacin de
gasolinas el soporte acta tambin como una fase activa la cual sumada a la del platino permite
el proceso completo de deshidroci-clizacin (transformacin de molculas lineales de bajo
octanaje como el hexano o el heptano en molculas cclicas aromticas como el benceno o el
tolueno).
La forma fsica de este soporte tambin est definida por las condiciones de reaccin (diseo del
reactor) y puede ser en forma de esferas, palitos, anillos, mallas, hojuelas e inclusive monolitos
en forma de panal (Figura 25).
b)
a)
Figura 25. Aspecto fsico de soportes para catalizadores. (a) y (b).
Los soportes pueden ser amorfos (SiO
2
, carbn), o cristalinos, como las zeolitas o la almina.
Algunos de los soportes ms utilizados son:
alminas
slicas
Carbn
zeolitas
slice-alminas
4.5.1) Las principales caractersticas que distinguen a un catalizador son:
a) Un catalizador no puede actuar en reacciones termodinmicamente imposibles (G
o
>0). Esto
literalmente significa que un catalizador no hace milagros. De la misma forma que la
termodinmica establece que no puede existir la mquina de movimiento perpetuo, tambin
delimita el campo de accin de los catalizadores.
b) Para una reaccin en equilibrio, A + B C el catalizador no modifica el valor de la
constante de equilibrio Ke= k
1
/k
2
. Como consecuencia de lo anterior, un aumento de la velocidad
en una direccin es acompaado por un aumento similar en la constante de velocidad de la
reaccin inversa (k2). En un sentido prctico esto quiere decir que un catalizador de una reaccin
lo es igualmente para la reaccin inversa.
Esta condicin se aplica igualmente al mecanismo cataltico bajo el principio de
microrreversibilidad que dice que la reaccin debe seguir los mismos pasos en un sentido o en el
otro.
c) El catalizador puede tener uno o dos efectos sobre un sistema, un efecto acelerador o un
efecto orientador. En el segundo caso, la funcin cataltica se observa en la variacin de los
valores de selectividad de un proceso cuando varias direcciones son termodinmicamente
posibles. As por ejemplo, el alcohol etlico puede descomponerse segn las reacciones
siguientes
I
II
La utilizacin de xido de zinc como catalizador conduce casi exclusivamente a la reaccin I. Si
se emplea cobre como catalizador, la reaccin II se produce en mayor extensin.
El hecho de que el catalizador abra una nueva ruta de reaccin tambin se puede traducir en
que la reaccin llegue a otro lugar diferente del que desebamos!
En general esto se corrige estudiando muchos catalizadores de los cuales escogemos el que
mejor nos rinde el producto deseado.
K
2
K
1
d) El catalizador tiene una vida limitada, sin embargo, en lapsos cortos, se puede decir que
permanece inalterado; esta caracterstica es de suma importancia para estudios cinticos.
4.5.3.1) catlisis homognea:
La catlisis homognea tiene lugar cuando los reactivos y el catalizador se encuentran en la
misma fase, sea lquida o gaseosa. En la catlisis homognea se tiene un acceso ms fcil al
mecanismo de reaccin y por consecuencia se puede dominar mejor el proceso cataltico
correspondiente. Otra ventaja no menos despreciable de este tipo de catlisis es la ausencia de
efectos de envenenamiento tan frecuentes en la catlisis heterognea, y que obliga a
tratamientos costosos de eliminacin de impurezas. Finalmente, el ltimo impulso que han dado
los complejos organometlicos a la catlisis homognea ha sido decisivo en su aplicacin
industrial a gran escala.
Tanto en el estudio como en la aplicacin de una catlisis homognea en solucin no se debe
perder de vista que la velocidad no depende directamente de sus concentraciones sino de sus
actividades, ya que la presencia de especies ajenas al acto cataltico puede influenciarlas. As
por ejemplo se observa a menudo que al cambiar el solvente la velocidad de reaccin se ve
afectada esto se explica muy a menudo por un efecto de solvatacin o interacciones
electroestticas.
Uno de los inconvenientes de la catlisis homognea es la dificultad de separar el catalizador del
medio reaccionante, lo que presenta un mayor costo que el de los procesos heterogneos
convencionales. Con base en esta inconveniencia se han intentado disear "catalizadores
homogneos soportados", en los cuales se desea inmovilizar el complejo metlico activo sobre
un soporte como slice, almina o carbn. Sin embargo en muchos casos esto no es posible, ya
que la entidad cataltica activa no es el complejo inicialmente introducido a la reaccin, sino una
especie derivada de l. La catlisis homognea en solucin (fase lquida) ha sido objeto de
numerosos estudios y dentro de ella la catlisis cido-base tiene un lugar muy importante.
La catlisis cido-base fue de los primeros fenmenos catalticos observados por
investigadores como Ostwald, Arrhenius, Brnsted, Euler, etc. La constatacin de que la
presencia de un cido aceleraba u orientaba ciertas reacciones qumicas fue el inicio para una
serie de investigaciones realizadas a fines del siglo pasado e inicios de ste, que se tradujeron
en una serie de numerosas aplicaciones industriales como la esterificacin, la saponificacin, la
hidrlisis, la halogenacin, la condensacin, etc.
En la catlisis cido-base se agrupan todas las observaciones relacionadas con la presencia en
el medio acuoso de algunas especies como protones (H
+
), oxhidrilos (OH
-
), molculas de cido,
etctera.
Cuando se disuelve un cido como el clorhdrico (que es la base del muritico) en agua, se
produce una disociacin como la siguiente:
HCL + H
2
0 H
3
0
-
+ CL
-
En la cual la molcula de agua atrapa el tomo de hidrgeno del cido (al cual llamamos protn
por haber perdido un electrn a favor del cloro) producindose iones. Una situacin equivalente
se produce cuando ponemos en solucin una base como hidrxido de sodio:
NaOH Na
-
+ OH
-
Producindose iones sodio y oxhidrilos.
En una reaccin en solucin algunas de estas especies pueden estar presentes y jugar un papel
como catalizadores, dependiendo del tipo de reaccin. Cuando alguna reaccin es catalizada por
el ion (H
-
o H3O
-
) se le llama una catlisis cida, por el contrario cuando el ion (OH-) es el
catalizador se le llama catlisis bsica. Para poner en evidencia esta dependencia es suficiente
llevar a cabo experimentos en los cuales se trabaje con cantidades crecientes de cido o de
base, y la reaccin debe seguir un aumento de velocidad lineal con la concentracin de cido o
de base. En trminos cinticos esto se escribe:
Velocidad observada = k
o
+k[H
3
0
+
] + [H
3
0+], para el cido,
y velocidad observada = k
o
+ k[OH-] [OH
-
], para la base
En estas dos ecuaciones ko representa la velocidad de la reaccin en ausencia de especies
catalticas. Si tenemos una reaccin en la cual no sabemos cual es la especie cataltica,
podemos llevar a cabo experiencias para determinar la contribucin de cada especie en solucin,
esto corresponde en la prctica a cambiar el pH de la reaccin.
Se puede proponer que tenemos una ecuacin general de velocidad que agrupa a todas las
especies:
Velocidad = k
o
+ k
H3O
+ [H30
+
] + k
0H
-
[OH
-
] + k
AH
[AH] + k
BOH
[BOH]
Y de la cual iremos evaluando los trminos separadamente.
El valor de ko se determina frecuentemente por la habilidad que el solvente (agua) tiene para
catalizar la reaccin. Para evaluar las constantes de velocidad de la ecuacin II, se hacen
experimentos en condiciones tales que algunos de los trminos de la ecuacin II sean
despreciables. De esta manera variaciones sistemticas de [HA], [A
-
], [H
3
O
-
], [OH
-
], etc.,
conducen a la evaluacin de cada constante de velocidad.
Por ejemplo, si trabajamos en condiciones cidas (pH<7) utilizando un cido fuerte (totalmente
disociado) y cuyo anin no interfiera apreciablemente, la ecuacin II toma la forma:
k
obs
= k
o
+ k
H3O
+ [H
3
0
+
] III
Cuando la reaccin es catalizada nicamente por una base (PH>7), la ecuacin II se transforma
en
k
obs
= k
o
+ k
0H
-
[OH
-
] IV
El comportamiento de estos experimentos puede ser representado en forma grfica en un
diagrama de pH contra log de la velocidad, como se muestra en la figura 26:
Figura 26. Dependencias tpicas de constantes de velocidad de reacciones
catalizadas por cidos o bases, en funcin de la concentracin de protones.
a) Caso general, donde la reaccin es catalizada tanto por cidos como por bases. La horizontal
AB corresponde a la reaccin no catalizada o bien catalizada por el solvente. Ejemplo de este
caso son la mutorrotacin de la glucosa y la hidrlisis de los steres.
b) En este caso el segmento AB no existe, lo que implica que la reaccin no cataltica (k
o
) no
existe, es decir, no hay efecto del solvente. Como ejemplos podemos citar la hidrlisis de amidas,
y la halogenacin de cetonas.
c y d) Reacciones catalizadas nicamente por cidos (c) o bases (d). Ejemplos para (c): la
hidrlisis de orto-sales y (d) hidrlisis de B-lactonas.
e y f) El mismo caso de (c) y (d) slo que en ausencia de la influencia del solvente, ejemplos: la
hidrlisis del ster diazoactico y la plimerizacin de nitrosoacetonamina.
En los casos en que existe catlisis especfica por el protn o el oxhidrilo, se ha propuesto que el
mecanismo cataltico comprende la transferencia de esos iones a las molculas de reactivo, de
forma similar a como se transfieren en presencia de agua.
Por ejemplo, para un cido su ecuacin de disociacin sera:
K
A
AH + H
2
O H
3
O
+
+ A
-
En esta ecuacin la constante de equilibrio K
A
, tambin llamada de disociacin, es una medida
de la facilidad de ceder el protn; esta constante est definida por la ley de accin de masas o de
equilibrio dinmico como:
(223)
De manera que mientras ms se disocia el cido AH, mayor es la constante, y mayor la fuerza
cida.
De forma similar para el caso de una base tendremos una constante de equilibrio K
B
que nos
representar la fuerza bsica.
La confirmacin del mecanismo cataltico como una transferencia inica de especies H
+-
o OH
-
del catalizador a los reactivos fue dada por los experimentos de Brnsted que demostraron para
diferentes reacciones una sola ecuacin que relaciona la velocidad con la fuerza cida o bsica.
La ecuacin de Brnsted tiene la forma
K
HA
= G
A
k
A
Donde Ga y a son constantes, a pudiendo tomar valores de 0 a 1. De manera similar para una
reaccin catalizada por una base tenemos,
(224)
Donde k
B
, G
B
y son constantes que dependen del sustrato, es decir, del reactivo y del solvente.
Muchos experimentos han mostrado que las relaciones de Brnsted, sin ser completamente
generales, dan cuenta de gran nmero de hechos experimentales que abarcan un gran intervalo
de valores constantes de disociacin en diferentes solventes.
Un ejemplo de reacciones catalizadas en fase homognea involucra sistemas Redox (reduccin-
oxidacin). El proceso llamado Wacker para oxidar etileno a acetaldehdo es un buen ejemplo. La
reaccin se lleva a cabo en una solucin acuosa que contiene cloruro de paladio y cloruro
cprico. La especie cataltica es el in Pd2*: Las reacciones que llevan a cabo son las siguientes:
C
2
H
4
+ PdCl
2
+ H
2
O CH
3
CHO + Pd + 2HCl
Etileno +cloruro de paladio11111 acetaldehdo1111 + paladio
V
Esta reaccin es el paso cataltico de oxidacin en el cual el cloruro de paladio oxida al etileno,
pero se reduce el mismo a paladio cero. Por lo tanto se requiere regenerar el Pd2* por lo cual se
introduce la siguiente etapa:
1H
2
O11
2CuCl
2
+ Pd 2CuCl + PdCl
2
cloruro cprico111111111cloruro cuproso11
VI
En esta reaccin el mayor potencial de oxidacin del paladio (Pd) hace que tome cloro del
cloruro cprico, generando cloruro cuproso. Sin embargo, la presencia de
cloruro cprico tambin tiene un efecto cataltico sobre el etileno dando lugar a la etapa:
PdCl
2111111111111
C
2
H
4
+ 2CuCl
2
+ H
2
O CH
3
CHO + 2CuCl + 2HCl
III
Finalmente se debe regenerar el cloruro cprico en presencia del HCl:
2CuCl + 2HCl + 1/2O
2
2CuCl
2
+ H
2
O
IV
La reaccin global se representa C
2
H
4
+ O
2
CH
3
CHO
La reaccin I involucra la formacin de un complejo de paladio intermediario con el etileno.
A priori no existen lineamientos para indicar cuando un proceso cataltico homogneo en fase
lquida ser ms econmico que un proceso cataltico heterogneo en fase gas para un mismo
producto de reaccin. Algunos factores como la selectividad, el control mismo de la reaccin y la
separacin de productos y catalizador son tomados en cuenta para decidirse por uno u otro
proceso.
4.5.3.2) Catlisis enzimtica:
La mayora de las reacciones que ocurren en los sistemas vivos son catalizadas por protenas
conocidas con el nombre de enzimas. Cientos de enzimas han sido aisladas y probablemente
existen cientos de miles en la naturaleza. Su estructura es muy compleja, y puede ser
representada como se muestra en la figura 1.
Las enzimas reciben su nombre en funcin de su actividad especfica, as, por ejemplo, la enzima
"ureasa" cataliza con eficiencia la hidrlisis de la urea, las proteasas actan sobre las protenas,
las amidasas sobre las amidas, etc. Todas las enzimas desde el punto de vista qumico son
protenas, pero pueden asociarse con substancias no protenicas, llamadas coenzimas o grupos
prostticos, que son esenciales para la accin de la enzima. A veces las enzimas son inactivas
catalticamente, si no se encuentran en presencia de ciertos iones metlicos. A la luz de muchos
estudios se ha logrado establecer que no toda la molcula de protena presenta actividad
cataltica, sino nicamente una regin relativamente pequea, la cual se denomina centro activo.
Los mecanismos de reaccin de las enzimas son muy complejos, implicando un nmero de
etapas elementales cada una de las cuales puede incluir interacciones complejas entre varios
grupos de las molculas de la enzima y el sustrato. En las reacciones catalizadas por enzimas
las velocidades de reaccin, as como los mecanismos se ven afectados por cambios en la
concentracin, el pH y la temperatura.
Figura27. Estructura cristalina de la carboxipeptidasa A.
En la elucidacin de los mecanismos de reaccin de las enzimas, y principalmente aquellas que
involucran un Ion-metlico o mtaloenzimas, se requiere conocer:
La afinidad de los reactantes, las coenzimas y los cofactores.
Las constantes de velocidad para cada paso.
Las relaciones geomtricas tridimensionales entre los reactantes, las coenzimas en
relacin a los sitios catalticamente importantes de la enzima.
El mecanismo de cada paso, es decir los arreglos atmicos y electrnicos. El mecanismo
qumico est determinado por el tipo de rompimiento y formacin de enlaces que lleva a
cabo la enzima.
Se ha propuesto que las enzimas contienen en sus "centros activos" cidos (AH) o bases (B) de
manera que se puede calcular su fuerza cida o bsica. As la pepsina, enzima que cataliza la
hidrlisis de ciertos enlaces ppticos en el estmago, tiene un valor de fuerza cida (pK) de 2.2.
El nico grupo orgnico que puede dar este valor es el COOH
-
. Tambin hay enzimas con
carcter bsico como la quimotripsina y la colinesterosa con un pK=7.2.
El hecho de que puedan existir esos dos tipos de grupos cidos y bsicos al mismo tiempo es
posiblemente la explicacin qumica del efecto tan selectivo observado en la catlisis por
enzimas, ya que el ataque simultneo por las dos especies cida y bsica debe traducirse en una
mejora muy notable de la velocidad y la selectividad, con un mecanismo que podra llamarse de
"estira y afloja". El equivalente en catlisis heterognea podra ser un mecanismo bifuncional
(que comprende dos funciones con dos tipos de sitios diferentes), con la salvedad de que en la
enzima los dos activos pueden actuar sobre la misma molcula al mismo tiempo y en la
heterognea esto no es posible.
b) Las velocidades de las reacciones catalizadas por enzimas son en general proporcionales a la
primera potencia de la concentracin de la enzima (son de primer orden respecto a la enzima).
Sin embargo, es frecuente encontrar una dependencia de la concentracin del sustrato (sobre el
que acta la enzima). La velocidad vara linealmente con la concentracin de sustrato a
concentraciones bajas (primer orden respecto al sustrato) y se hace independiente de la
concentracin de ste (orden cero) a concentraciones elevadas.
Este tipo de comportamiento fue explicado por Michaelis y Menten en funcin del mecanismo
siguiente:
1. Interaccin de la enzima con el substrato (reactivo), para formar un complejo intermediario
11 k1
E1+1S1 1ES
xxxk-1
2. Descomposicin del complejo intermediario para dar los productos y regenerar la enzima
k2111
E1S E + P
E es la enzima, S el sustrato, ES un complejo y P es el producto. Aplicando el tratamiento
cintico denominado del estado estacionario, en el que se asume que la concentracin del
complejo intermediario es constante obtenemos
K
1
[E] S - k_
1
[ES] - K
2
[ES] = 0
I
Si la concentracin total de la enzima [E]o es igual a la suma de la concentracin en enzima libre
[E], ms la concentracin de enzima que forma el complejo [ES]:
[E]
o
= [E] + [ES]
II
Introduciendo [E] de la ecuacin II en la ecuacin I, tenemos:
K1 ([E]
o
- [ES]) [S] - (K_
1
+ K
2
)[ES] = 0
De donde podemos obtener la concentracin de enzima que est formando el complejo
(225)
Se asume que la etapa determinante de la reaccin es la descomposicin del complejo, entonces
la velocidad de la reaccin es v=k
2
[ES] en donde se substituye [ES]
Que rearreglando nos da:
III
Donde k
m
= se denomina constante de Michaelis.
De la ecuacin III se deduce que cuando [S] es suficientemente pequea,
(227)
Lo que indica primer orden respecto a la concentracin de sustrato. Por el contrario, cuando [S]
es mucho mayor que K
m
,
v = k
2
[E
o
]
Y la cintica es orden cero respecto al sustrato. En ambos casos el orden es 1 para la
concentracin de enzima. La ecuacin III da cuenta entonces del comportamiento observado en
la figura 28.
Figura 28. Dependencia tpica de la velocidad de una reaccin enzimtica como funcin
del sustrato S.
Muchas reacciones obedecen la ley de Michaelis (ecuacin III), sin embargo, el mecanismo
queda an en la duda ya que a travs de otro mecanismo complejo es posible llegar a la misma
ecuacin cintica.
Ecuacin de de Michaelis
El efecto del cambio de pH en las velocidades de las reacciones catalizadas por enzimas se
puede observar en la figura 29. Se tiene un mximo y la primera explicacin de este hecho fue
dada por Michaelis. La idea bsica es que el centro activo de la enzima puede existir en tres
estados de ionizacin dependiendo de la fuerza cida,
zzzKb ka
EH
2
EH E
Las constantes de disociacin se representan por kb y ka. Cada una de las tres formas de la
enzima puede interaccionar con el sustrato,
zzzKb ka
EH2 EHS ES
Si se postula que slo EHS puede dar productos, el esquema de reaccin queda entonces
EH
2
EH E
EH
2
S EHS
ES
K
2
EH + P
As, en solucin cida, la enzima estar en la forma EH
2
y formar con el reactivo el complejo
EH
2
; este complejo se descompone para dar otro complejo EHS, el cual a su
vez se descompone para dar los productos y luego entonces la velocidad ser pequea. Si la
solucin es bsica predominan las formas E y ES y la velocidad ser tambin pequea. A cierto
pH intermedio, llamado pH ptimo, se observar la concentracin mxima de EHS y ser por lo
tanto el mximo de la velocidad.
Los estudios sobre velocidades de reacciones catalizadas por enzimas a diversos valores de
concentraciones y pH han permitido obtener los valores de las constantes de disociacin ka, kb,
k'a y k'b. Las dos primeras corresponden a informacin sobre la naturaleza del centro activo.
Figura 29. Variacin de la velocidad en funcin del pH, para una reaccin enzimtica.
Los valores de k'a y k'b proporcionan informacin respecto de la forma en que los grupos
ionizantes del centro activo tienen interaccin con el sustrato.
La influencia de la temperatura en la velocidad ha suministrado informacin valiosa acerca de los
mecanismos enzimticos. Sin embargo, una complicacin surge del hecho de que las enzimas
por s mismas experimentan un proceso de desactivacin que tiene una energa de desactivacin
muy alta, por lo que a 35C o ms (dependiendo de la enzima) se puede observar una
desactivacin muy rpida. Por ello es frecuente encontrar que las velocidades catalizadas por
enzimas pasan por un mximo al ir subiendo la temperatura. A 60C por ejemplo, muchas
propiedades de la enzima se alteran, algunas de ellas irreversiblemente. Estos cambios se
conocen con el nombre de desnaturalizacin y son los responsables del decrecimiento de la
actividad de la enzima.
4.5.3.3) catlisis heterognea:
En la catlisis heterognea el catalizador es insoluble en los sistemas qumicos en los cuales
provoca la transformacin y forma una fase distinta muy a menudo slida, adems existen dos
fases y una superficie de contacto y la reaccin se lleva a cabo en esta superficie de contacto y el
fluido es una reserva de molculas por transformar o que ya reaccionaron.
En la catlisis heterognea el fenmeno cataltico est relacionado con las propiedades
qumicas de la superficie del slido que se ha elegido como catalizador, siendo estas
propiedades superficiales un reflejo de la qumica del slido.
Tipos de slidos Reacciones Catalizadores
Metales
(Conductores)
Hidrogenacin
Deshidrogenacin
Hidrlisis
Fe, Ni, Pt, Pd, Ag,
Rh, Ru
xidos y
Sulfuros
(Semiconductore
Deshidrogenacin
Oxidacin
Desulfuracin
NiO, ZnO, Cr
2
O
3
,
MnO
2
, Bi
2
O
3
-
MoO
3
WS
2
, MoS
2
Oxidos
(Aislantes)
Deshidratacin
Al
2
O
3
, SiO
2
, MgO
Acidos
Isomerizacin
Polimerizacin
Craqueo
H
3
PO
4
H
2
SO
4
SiO
2
, AL
2
O
3
,
zeolitas
Cuadro 9. Sustancias y sus catalizadores
E Et ta ap pa as s e en n e el l p pr ro oc ce es so o c ca at ta al l t ti ic co o h he et te er ro og g n ne eo o: :
1. Adsorcin de reactivos
2. Difusin superficial de reactivos
3. Reaccin en la superficie
4. Difusin superficial de productos
5. Desorcin de productos.
La catlisis requiere un balance entre la adsorcin, la reaccin, y la desorcin
- Catalizadores fuertemente adsorbidos > no rxn.
- Catalizadores dbilmente adsorbidos > no rxn.
4.5.3.3.1) Definicin de Adsorcin:
Proceso por el cual las molculas de un gas, de un lquido o de una sustancia disuelta se
fijan a la superficie de un slido por una unin qumica o fsica.
Adsorbato: Sustancia que se adsorbe
Adsorbente: Material Sobre El Cual Ocurre La Adsorcin
4.5.3.3.2) Tipos de Adsorcin
Fisisorcin
Quimisorcin
Precursor
Reaccin
Superficial
Adsorci
C
O
2
Difusin
superficia
Desorci
2
C
Fig. 30 Esquema del proceso de reaccin cataltica heterognea
Adsorcin Qumica Quimisorcin:
Se produce por una reaccin qumica en la superficie del slido.
El gas se mantiene unido a la misma a travs de enlaces qumicos relativamente fuertes
(enlaces covalentes).
Adsorcin Fsica Fisisorcin:
Interaccin fsica
Las molculas del gas se mantienen unidas a la superficie del slido por fuerzas de Van
der Waals relativamente dbiles (fuerzas tipo dipolo-dipolo, dipolo- dipolo inducido o
fuerzas de dispersin).
Caractersticas
A.) Caractersticas de La Quimisorcin:
Entalpas superiores a la de fisisorcin (entre -10 a -200 kcal/ mol).
Menos frecuente y ocurre a temperaturas elevadas.
Interacciones de tipo qumico entre adsorbente y adsorbato.
Gran influencia de la temperatura.
No reversible.
Carcter muy especifico (depende de las caractersticas qumicas del slido y el gas)
Cuando una monocapa del gas adsorbido cubre toda la superficie del slido, no se
producen ms reacciones qumicas entre el gas y el slido.
B.) Caractersticas de La Fisisorcin:
Entalpas de adsorcin relativamente bajas (entre -1 a -10 kcal/ mol).
Interacciones tipo Van der Waals.
Se produce a temperaturas bajas preferentemente, prximas o inferiores al punto de
ebullicin del gas.
Fenmeno reversible.
Cuando la monocapa esta completa, las interacciones intermoleculares pueden conducir
a la formacin de una segunda capa de gas adsorbido.
Figura 31. (a) Adsorcin de una monocapa. (b) Adsorcin en multicapas.
B.) Tipos de Isotermas de Adsorcin:
Definicin: La relacin entre la cantidad de un gas adsorbido por un slido determinado
y la presin del gas, a una temperatura constante, se representa mediante las isotermas
de adsorcin.
TIPOS ISOTERMA
LANGMUIR
FREUNLICH
B. E. T
Figura 32. Tipos de isotermas de adsorcin fsica.
El tipo I es de la forma de la isoterma de Langmuir y se observa para slidos microporosos
4
incluyendo zeolitas.
El tipo II es el ms comn y aplicando la ecuacin BET (Brunauer, Emmett y Teller) que tiene la
forma:
(228)
Se puede obtener la capacidad de formacin de una monocapa x
max
. P
o
es la presin de vapor
de saturacin del gas que se adsorbe y C es una constante que involucra el calor de adsorcin
de la primera capa, con el calor liberado al formarse una segunda y subsecuentes capas. La
formacin de la monocapa se localiza en el punto B de la isoterma tipo II. Los tipos III y V son de
poco inters pero el tipo IV es de importancia ya que presenta el fenmeno de histresis, es decir
la isoterma no sigue el mismo camino durante la desorcin. La razn para
esto es que la evaporacin del gas condensado en los poros finos no ocurre tan fcilmente como
la condensacin, ya que una molcula que se evapora de una superficie curva (menisco) tiene
mayor probabilidad de recondensar que una molcula que se evapora de una superficie plana.
Este fenmeno permite de hecho determinar las distribuciones de tamao de poro en slidos
porosos.
Isoterma De Langmuir:
Se basa en:
La rapidez con que las fuerzas intermoleculares disminuyen al aumentar la distancia.
Se produce quimisorcin monomolecular.
La adsorcin es localizada.
El calor de adsorcin es independiente del recubrimiento de la superficie.
32
Q
C
QK q
C
A
A
A
+ =
1
C
A
: concentracin de equilibrio del soluto en el lquido.
q A: capacidad de intercambio en el equilibrio.
Q: constante relacionada con los lugares ocupados y libres en la superficie del sorbente.
K: constante de equilibrio de la reaccin.
Isoterma de Freunlich:
Este tipo de isotermas se encuentran en la adsorcin de disoluciones lquidas a
concentraciones relativamente bajas, sobre slidos.
Es un proceso de quimisorcin
Esta isoterma representa la cantidad de gas adsorbido en funcin de la presin
del gas (a presiones relativamente bajas).
Log c n K
m
X
log log + = ecua.229
Fig. 33
-- X/ m: volumen del gas adsorbido.
-- K y n: constantes.
-- C: presin
Isoterma B. E. T.
Se basa en dos hiptesis principales:
1- La superficie del adsorbente es uniforme y no porosa.
2- Las molculas del gas se adsorben sobre la superficie en capas sucesivas, completas o no,
en equilibrio dinmico entre s y con las molculas del gas (proceso de fisisorcin).
0 max max 0
*
1 1
) ( P
P
C X
C
C X P P X
P
+ =
(230)
-- X: adsorcin especifica (m n especifica (m
3
de gas adsorbido por kg de adsorbato).
-- P: presin del gas.
-- P
0
: presin de vapor saturado.
-- C: constante que involucra el calor de adsorcin de la primera capa, con el calor liberado al
formarse una segunda y subsecuentes capas.
-- Xmax: adsorcin mxima correspondiente a la formacin de una monocapa.
4.7 Aplicaciones de la catlisis en la industria:
La aplicacin industrial de un catalizador heterogneo requiere de la optimizacin de las tres
principales caractersticas de un catalizador: actividad, selectividad y estabilidad.
La actividad es la consecuencia directa del efecto acelerador, y se define como una velocidad de
reaccin en moles transformados por segundo y por gramo de catalizador. En el caso de algunos
catalizadores se prefiere dar esta velocidad corregida por el rea del catalizador o mejor an
normalizada por el nmero de tomos de catalizador que estn en contacto con la reaccin
(turnover number). Esta ltima expresin de la velocidad ha sido muy til para establecer una
clasificacin de las reacciones catalticas. Reacciones "fciles" o insensibles a la estructura y
reacciones "exigentes" o sensibles a la estructura. En el primer tipo de reacciones la velocidad
depende tan slo del nmero total de tomos de catalizador en contacto con el fluido, mientras
que en el segundo caso depende de slo algn tipo de tomo en particular, como por ejemplo
tomos en las esquinas de los cristales de catalizador, un arreglo geomtrico de tomos (dos o
tres), etctera.
La Catlisis Y El Petrleo
Sobre el origen del petrleo existen las ms variadas teoras que intentan explicar el problema,
sin embargo, hasta la fecha no se ha llegado a aclarar esta cuestin de manera definitiva y
satisfactoria. Cierta corriente de pensamiento supone para el petrleo una procedencia de tipo
mineral (inorgnico) explicando su formacin a travs de un proceso de descomposicin de
carburos metlicos existentes en el interior de la Tierra. Hoy en da la opinin general se inclina a
aceptar una teora de formacin del petrleo de tipo orgnico. Segn esta teora, el petrleo se
ha originado a partir de restos de plantas y animales inferiores, los cuales en el transcurso de
millones de aos, en ausencia de aire y sometidos al calor de la Tierra y a presiones elevadas,
as como quiz tambin a determinados tipos de bacterias, catalizadores e incluso a la accin de
sustancias radiactivas, se han transformado en hidrocarburos.
Los petrleos crudos que se extraen de los diferentes campos petrolferos de la Tierra, incluso
los que son extrados de distintas profundidades de un mismo campo petrolfero, son de
naturaleza muy variada incluso en su apariencia externa. Aparte de las diferencias externas, los
petrleos qumicamente se asemejan unos a otros ya que son fundamentalmente mezclas de
hidrocarburos, es decir, combinaciones de carbono (C) e hidrgeno (H), de naturaleza muy
variada. El petrleo bruto es entonces una mezcla de diferentes hidrocarburos (la mayor parte
saturados) que pueden ser agrupados por un lado en una de las tres familias siguientes:
parafinas (e isoparafinas), naftenos y aromticos, y por otra parte tambin pueden agruparse
segn el nmero de tomos de carbono que existen en la molcula o segn el punto de ebullicin
o voltilidad que depende fundamentalmente del tamao de la molcula y de su conformacin.
El gas natural por ejemplo, consiste en molculas ligeras como el metano (CH
4
) de un tomo de
carbono (C
1
), el etano (C
2
H
6
) de dos tomos de carbono (C
2
), el propano (C
3
H
8
) que es un (C
3
) y
butano (C
4
H
10
) que contiene cuatro tomos de carbono (C
4
). La composicin tpica del gas
natural es la siguiente: C
1
79%, C
2
6.5%, C
3
6.2%, C
4
2.3%, iC
4
1.4% e iC
+
5
3%.
El gas natural viene acompaado de cido sulfhdrico (H
2
S) que es corrosivo, por lo que es
necesario una purificacin para eliminarlo. Tradicionalmente el gas natural es utilizado como
combustible para uso domstico (estufas) e industrial (generadores de vapor para turbinas). En la
ltima dcada sin embargo, su consumo para la produccin de hidrgeno se ha elevado. El
hidrgeno tiene mucha demanda en diferentes procesos de una refinera. La reaccin tpica del
metano con vapor de agua es:
CH
4
+ H
2
O CO + 3H
2
El hidrgeno se separa del CO y puede ser utilizado para la sntesis del amoniaco a travs de la
reaccin:
Estas dos reacciones requieren de catalizadores para su aplicacin industrial.
El tamao de las molculas de hidrocarburo que componen el petrleo vara desde C
1
hasta C
40
-
C
50
o aun mayores, de ah que tambin se le pueda clasificar en crudos ligeros o pesados. El
contenido de impurezas como azufre (S), nitrgeno (N) y vanadio (V) de un petrleo tambin es
muy importante ya que determina la calidad y el precio del mismo.
El petrleo, una vez extrado, es enviado por oleoductos hacia las refineras. All se almacenan y
mezclan los diferentes tipos de crudos con el objeto de cumplir con las especificaciones para las
cuales fue construida la refinera. El crudo mexicano pesado (tipo maya) requiere de
instalaciones ms complejas. Las cargas (crudos) son separadas inicialmente por destilacin
(previo lavado para eliminar las sales incrustantes). En este proceso aproximadamente 75% de
los compuestos son voltiles quedando un residuo llamado asfltico en el fondo.
La fraccin voltil se separa como sigue, en orden decreciente de punto de ebullicin:
1) hidrocarburos gaseosos (metano o butano),
2) gasolina ligera,
3) gasolina pesada o nafta;
4) kerosina,
5) gasleo ligero,
6) gasleo pesado.
Generalmente los productos obtenidos en este proceso no son suficientes en calidad ni cantidad
para los requerimientos actuales. Por lo tanto se requiere transformar estos productos en otros
de uso ms conveniente. La mayor parte de estos procesos son catalticos (90%).
En relacin a la aplicacin de sus productos, el petrleo puede ser separado en:
1) combustible para automviles, aviones y mquinas diesel,
2) combustibles para calefaccin e industrias (calderas),
3) materia prima para la obtencin de hidrgeno y gas para cocina,
4) materia prima para productos qumicos y petroqumicos,
5) aceites lubricantes y grasas, sin olvidar un objetivo contemplado una dcada anterior y que fue
6) obtener alimentos (protenas).
Procesos Catalticos Del Petrleo
El objetivo de estos procesos es el de modificar las fracciones del petrleo para la obtencin de
productos en cantidad y calidad acorde con los requisitos del mercado. Podemos clasificarlos en
la siguiente forma:
a) Desintegracin. Este proceso permite transformar molculas pesadas en combustibles
livianos y materias primas para la industria petroqumica. Industrialmente se conoce como
proceso FCC (Fluid Catalytic Cracking) y varias reacciones tienen lugar en el proceso, cada
una con diferente grado de importancia. Algunas de ellas son: rompimientos de enlaces
carbono-carbono, formacin de olefinas y ciclizacin. Dichas reacciones transcurren va
mecanismos por ion carbonio. Un ion carbonio (o carbocatin) es un grupo de tomos que
incluyen a un tomo de carbono compartiendo seis electrones y una carga positiva.
R
|
R - C +
|
R
Ion carbonio
Inicialmente, los catalizadores utilizados en estos procesos eran arcillas acidificadas, pero en la
actualidad han sido reemplazadas por aluminosilicatos microcristalinos sintticos, denominados
zeolitas o mallas moleculares. Estos slidos se caracterizan por tener una acidez elevada y una
estructura porosa bien definida (Figura 16).
b) Reformacin de gasolinas. Este proceso permite aumentar el rendimiento de gasolinas as
como el nmero de octano
5
en ellas. El contenido original de gasolinas que proviene del
petrleo es insuficiente para cubrir la alta demanda del mercado, por lo que se hace necesario
transformar en gasolinas algunas fracciones del petrleo de menor valor. Las molculas a las
que se les asigna en mayor ndice de octano son las siguientes: alcanos ramificados y
aromticos. Los alcanos lineales y naftenos tienen menor ndice de octano, y es deseable
transformarlos en ismeros (ramificados) y en aromticos respectivamente. Durante el proceso
de reformacin se libera como producto hidrgeno.
Los catalizadores utilizados en este proceso son a base de platino (Pt) cuya concentracin es del
orden de 0.3% ms un segundo metal (renio, iridio, estao) ambos soportados en una almina
(Al
2
O
3
) de transicin ( o n).
Este proceso, con ciertas modificaciones y un catalizador diferente, conduce a una planta
productora de aromticos, comnmente conocida como BTX (Benceno, Tolueno, Xilenos) para la
obtencin de productos petroqumicos.
c) Hidrotratamientos. Los procesos denominados de hidrotratamiento tienen como finalidad la
eliminacin de impurezas como azufre, nitrgeno, oxgeno, nquel o vanadio que acompaan a
las molculas de hidrocarburo que componen el petrleo. Estos tratamientos permiten eliminar
problemas de "envenenamiento del catalizador" utilizado en otros procesos de refinacin, se
aumenta la calidad de los productos y se evita la contaminacin atmosfrica.
Los catalizadores utilizados son sulfuros de molibdeno y cobalto o nquel, los cuales se soportan
en una almina de transicin ( o n). Este proceso ha venido aplicndose cada vez con ms
frecuencia ya que el uso de petrleo pesado que contiene muchas impurezas se ha
incrementado.
d) Hidrogenacin-deshidrogenacin. Estos procesos se utilizan generalmente para obtener
olefinas para petroqumicos o como procesos de purificacin. Los catalizadores que se usan
son a base de nquel, platino u xidos de cromo y hierro.
e) Oxidacin. Mediante este proceso, las olefinas y aromticos se transforman en aldehdos,
alcoholes, cetonas, perxidos y xidos que tienen gran demanda en petroqumica. Los
catalizadores son xidos de algn metal que tiene la propiedad de ceder o incorporar oxgeno
en su superficie fcilmente.
f) Alquilacin. El trmino alquilacin se aplica generalmente a reacciones catalizadas entre el
isobutano y varias olefinas ligeras. El producto es un hidrocarburo saturado altamente
ramificado que se utiliza para incrementar el ndice de octano de la gasolina. La reaccin de
alquilacin involucra la adicin de un protn H
+
, a un doble enlace de una olefina para formar
un ion carbonio. El catalizador debe ser de tipo cido para favorecer la formacin de cationes
(ion carbonio) y los ms utilizados son el tricloruro de aluminio con cido clorhdrico, as como
el cido sulfrico y el cido fluorhdrico.
g) Isomerizacin. La isomerizacin es una parte pequea pero importante de los procesos de una
refinera. El butano se isomeriza a isobutano para luego ser utilizado para la alquilacin del
isobutileno y otras olefinas. La fraccin de 5 y 6 tomos de carbono que viene naturalmente en
la gasolina, se isomeriza para dar productos de gran octanaje que despus se mezclarn con
gasolinas de bajo ndice de octano.
El proceso de isomerizacin del butano fue desarrollado durante la segunda Guerra Mundial. El
catalizador utilizado fue AlCl
3
. En la actualidad, se prefiere utilizar un catalizador dual como por
ejemplo platino en zeolitas. Las dos funciones que tienen lugar son la funcin cida (zeolitas) y la
funcin hidrogenante-deshidrogenante en el metal.
Hidrogenacin De Grasas Y Aceites
La naturaleza nos proporciona una gran variedad de productos grasos vegetales y animales con
valor nutricional. Las aplicaciones de esos productos son muy variadas como por ejemplo en
pasteles y galletas, aceites para freir, margarinas, alimentos enlatados, etctera.
Esos aceites y grasas vegetales son mezclas complejas de tristeres de glicerol que pueden ser
representados con la frmula:
CH
2
O. CO. R
1
|
CHO. CO. R
2
|
CH
2
O. CO. R
3
Los grupos R
1
, R
2
, R
3
, contienen 15, 17 u ocasionalmente algn nmero ms alto de tomos de
carbono.
Por desgracia, algunos de los aceites tal como son extrados no son directamente aplicables para
su uso en alimentos. Algunas de las razones son: su falta de sabor, su consistencia inapropiada y
un alto contenido de grupos difciles de digerir. Adicionalmente, debido a su alta concentracin de
dobles enlaces, los aceites al natural fcilmente se oxidan en el aire produciendo un sabor cido,
o como comnmente se dice, el aceite se vuelve rancio. Este proceso reduce la vida til de los
aceites, lo cual limita enormemente su aplicacin industrial. Despus de algunos aos, la
demanda de un producto slido barato, substituto de la mantequilla ha sido notable y actualmente
es una parte importante del consumo de aceites (la margarina).
La composicin qumica de un aceite se da normalmente en trminos de los cidos grasos que
resultan de una hidrlisis. Por ejemplo:
CH
2
O. CO. R
1
+ H
2
O
|
CHO. CO. R
2
+ H
2
O
|
CH
2
O. CO. R
3
+ H
2
O
ster de glicerilo
CH
2
COOH + R
1
OH
|
CHCOOH + R
2
OH
|
CH
2
COOH + R
2
OH
cido + alcohol
En la siguiente tabla se ilustran ejemplos de cidos compuestos de una cadena de 18 tomos de
carbono R. CO
2
H, donde R = 17
De estas frmulas qumicas observamos que el nmero de dobles enlaces va disminuyendo del
cido linolnico al linoleico, al oleico, etc., hasta llegar al esterico que est completamente
saturado. Adicionalmente hay diferencias entre el cido oleico (el ms importante) y el elidico
debido a la posicin de la doble ligadura (posicin cis o trans, dependiendo de que los dos
carbonos que la comparten estn en el mismo lado o alternados).
Con productos de alto grado de insaturacin (dobles enlaces) como los que contiene el cido
linolnico se tiene una oxidacin muy rpida (rpidamente se obscurece y se arrancia) por lo que
es necesario disminuir su concentracin. Con productos que contengan poco grado de
insaturacin como el esterico, el punto de fusin es tan alto que se solidifica a temperatura
ambiente y por lo tanto ser ms apropiado para producir margarinas. Sin embargo en la
margarina el cido esterico no es de fcil digestin y es deseable tener adicionalmente cido
linoleico en alguna proporcin ya que se piensa que juega un papel importante en la prevencin
del colesterol.
Por lo tanto, dependiendo del producto buscado, se debe hacer un ajuste entre los diferentes
componentes cidos de un aceite. El aceite de soya tiene aproximadamente la siguiente
composicin: cido linolnico 8%, cido linoleico 50%, cido oleico 27%, cido esterico 4%,
cido plamtico 10% (este cido tiene 16 carbonos y est completamente saturado). Para su
mejor aprovechamiento se desea disminuir al mnimo la cantidad de linolnico, disminuir un poco
la de linoleico, aumentar la de oleico, sin pasar mucho elidico a esterico. En trminos qumicos
se desea obtener una hidrogencin parcial controlada de los dobles enlaces (para obtener cido
oleico) sin una excesiva isomerizacin cis-trans (de oleico a elidico) y sin excesiva
hidrogenacin a esterico). Estas caractersticas hacen necesaria la presencia de un catalizador.
La reaccin se lleva a cabo utilizando un catalizador de nquel soportado o nquel Raney a
temperaturas situadas entre 150 y 200C y 0.1 a 0.7 MPa de hidrogeno puro. Casi todos los
aceites aun cuando son purificados contienen compuestos de azufre que envenenan al
catalizador por lo que es necesario cambiarlo frecuentemente. La mayora de los procesos se
llevan a cabo en esttico, en autoclaves agitadas. Un hecho notable es que la reaccin se
efecta mejor con limitaciones difusionales del hidrgeno. Esto se logra con presiones de
hidrgeno bajas, agitacin moderada, alta temperatura y alta concentracin de catalizador. Esto
trae como consecuencia una concentracin baja de hidrgeno en la superficie del catalizador y
por lo tanto no se produce una hidrogenacin excesiva. Como las molculas de reactivos son
muy grandes se desean poros grandes que eviten un proceso limitado por difusin de reactivos o
productos.
En muchos casos el nquel es introducido como formiato de nquel disperso en una grasa, el que
se descompone dentro del reactor en el momento de la reaccin.
Unidad I PRINCIPIOS BSICOS DE LAS SOLUCIONES.
1.1-Cul es el punto de congelacin de un vaso de agua de 250 cm
3
endulzada con
cinco cubos de azcar (7.5 g de sacarosa C
12
H
22
O
11
)?.
Respuesta:
Masa molar Sacarosa: 342 g /mol.
m Kf Tf
T T Tf
*
=
=
mol x
g
mol
g O H MolesC
2
11 22 11
10 193 . 2
342
1
* 5 . 7
= =
molal x
Kg
mol x
Kgsolvente
molsoluto
Molalidad
2
2
10 772 . 8
25 . 0
10 193 . 2
= = =
C C Tf T T
C x m C Tf
163 . 0 ) 163 . 0 0 (
163 . 0 10 772 . 8 * / 86 . 1
2
= = =
= =
1.2.- Una solucin contiene 5 g de rea por 100 g de agua. Cul ser la presin de vapor
de esta disolucin a 25C ? La presin de vapor del agua pura a esta temperatura es
23.756 mm Hg.
Respuesta:
Masa molar rea: 60.05 g/mol
Masa molar Agua: 18 g/mol
mol
mol g
g
MolesUrea 083 . 0
/ 05 . 60
5
=
mol
mol g
g
O MolesH 56 . 5
/ 18
100
2
= =
( )
0147 . 0
083 . 0 56 . 5
083 . 0
2
2
=
+
= =
mol
mol
MolTotal
O molesH
N
O H
mmHg mmHg mmHg N P P P
N P P P P N P P
O H
O H O H O H
40 . 23 ) 01470 . 0 * 756 . 23 ( 756 . 23 *
* *
2
2 2 2
= = =
= = =
1.3.- Qu peso de glicerina debe agregarse a 1000 g de agua a fin de hacer descender su
punto de congelacin 10 C?.
Respuesta:
Masa molar glicerina (C
3
H
8
O
3
)=92 g/mol
Kf H
2
O=1.86 C/m
g
m C
mol g g C
Kf
M W Tf
W
M W
W
Kf Tf 62 . 494
/ 86 . 1 * 1000
/ 92 * 1000 * 10
* 1000
* *
*
* 1000
*
2 1
2
2 1
2
= =
= =
1.4.- Una solucin de 1 g de un soluto no voltil en 100cc de solucin acuosa dio una
presin osmtica de 1.18 atm a 0C . Calcular la Masa Molar del soluto.
Respuesta:
L mol
K
K mol
atm L
atm
T R
C T R C / 0526 . 0
15 . 273 *
*
*
082054 . 0
18 . 1
*
* * = =
= =
. / 94 . 189
00526 . 0
1
000526 . 0 1 . 0 * / 0526 . 0
mol g
mol
g
mol
masa
Masamolar
mol L L mol ovoltil Molsoluton
= = =
= =
1.5. -A 300 K El lquido A Tiene una presin de vapor de 280 mm Hg y el lquido B una de
170 mm Hg. Cuando se prepara una solucin que contiene 2 moles de cada uno de los
lquidos, la presin de vapor es 380 mm Hg y el vapor contiene 60% moles de A.
Suponiendo que los vapores se comportan de manera ideal, hallar:
a) Las actividades de A y B en la solucin.
b) Los coeficientes de actividad de A y B en la solucin.
c) La energa libre de mezcla de la solucin.
d) La energa libre que cabe esperar en la disolucin ideal correspondiente.
Solucin:
a) Para determinar las actividades de cada uno de los lquidos utilizamos la relacin
737 . 0
380
280
= = =
mmHg
mmHg
P
P
a
A
A
A
447 . 0
380
170
= = =
mmHg
mmHg
P
P
a
B
B
A
b) Determinamos el coeficiente de actividad para cada uno de los lquidos por medio de la
ecuacin:
i
i
i i i i
N
a
N a = =
' '
*
Fraccin molar de A: N
A
= 2 mol / 4 mol = 0.5 mol; como moles de A = moles de B => N
A
=N
B
Para el lquido A 474 . 1
5 . 0
737 . 0
'
= = =
A
A
A
N
a
Para el lquido B 894 . 0
5 . 0
447 . 0
'
= =
B
c) La energa libre de mezcla vendr dada por:
Fm= n
A
* R* T* Ln a
A
+ n
B
* R* T* Ln a
B
Fm= 2*1.9872*300*Ln 0.737 + 2*1.9872*300* Ln 0.447
Fm= -1323.91
d)Para una disolucin ideal a=N por lo que:
Fm= n
A
* R* T* Ln N
A
+ n
B
* R* T* Ln N
B
Fm= 2*1.9872*300*Ln 0.5 + 2*1.9872*300* Ln 0.5
Fm= -1652.9
1.6. -A 140 C la presin de vapor del C
6
H
5
Cl es 939.4 mm y la del C
6
H
5
Br es 495.8 mm.
Suponiendo que estos dos lquidos forman una disolucin ideal, Cul ser la
composicin de la mezcla de los dos que hierve a 140 C bajo una presin de una
atmsfera? Cul ser la composicin del vapor a esta temperatura?
Solucin:
P
T
= P
1
+P
2
760 mm Hg= N
1
*P
1
+ N
2
*P
2
760 mm Hg= (1-N
2
)* P
1
+ N
2
*P
2
=> 760mmHg= P
1
- N
2
*P
1
+ N
2
*P
2
760mmHg= P
1
- N
2
(P
1
-P
2
) => 760+ N
2
(P
1
-P
2
)= P
1
N
2=
P
1
-760/ P
1
- P
2
=> N
2
= (939.4 760) / ( 939.4 495.8) = 0.404
N
1
= 1 0.404 = 0.596.
La composicin del vapor esta dada por:
Y
2
= P
2
* N
2
/ (P
2
P
1
) N
2
+ P
1
Y
2
= 0.2635
1.7.- Una solucin acuosa 0.2 molal de KCl solidifica a 0.680C. Calcular i y la presin
osmtica a 0C. Supngase que el volumen es el del agua pura.
Respuesta: m Kf i Tf * * =
Datos: T T Tf =
T=0C
Kf
H2O
= 1.86 C/m
m Kf
T T
i
*
= , sustituyendo los valores
83 . 1
2 . 0 * / 86 . 1
) 680 . 0 ( 0
=
=
m m C
C C
i
La presin osmtica de la solucin ser:
atm
L
K
K mol
atm L
mol
V
T R n i
18 . 8
1
15 . 273 *
*
*
0821 . 0 * 2 . 0 * 83 . 1
* * *
2
= = =
1.8.- Una solucin 0.01 molal de K
3
Fe(CN)
6
congela a 0.062C. Cul es el porcentaje de
disociacin aparente?
Respuesta:
Reaccin de disociacin: K
3
Fe(CN)
6
3K
+
+ Fe(CN)
6
3-
m Kf i Tf * * =
33 . 3
01 . 0 * / 86 . 1
) 062 . 0 ( 0
*
=
=
=
m m C
C C
m Kf
T T
i
% 7 . 77 777 . 0
1 4
1 33 . 3
1
1
=
=
v
i
1.9.- Una solucin de 2,5 molal de HCl congela a -8,86 C. Calcule el porcentaje aparente
de disociacin
Datos:
Tf= -8,86 C
Molalidad: 2,5 molal
% & = ?
Tf H
2
O = 0 C
Kf H
2
O = 1,86 C kg/mol
& = i 1
v -1
Tf = i . Kf . m
Tf - Tf = i . Kf. M
i = - Tf = - (-8,86 C)
Kf.m 1,86C.kg/mol . 2,5 mol/kg
i = 1,905
HCl H
+
+ Cl
-
& = 1,905 1 = 0,905
2-1
1.10.-Se prepar una solucin agregando 5 g de KCl y 5 g de FeCl
3
a 100 g de agua Cul
es la fuerza inica de la solucin?
Datos:
m
KCl
= 5 grs de KCl
m
FeCl3
= 5 grs de FeCl
3
ste= 100 grs de H
2
O
= Ci . Z
2
m = n sto/ Kg ste
PM KCl= 39,098
35,453
74,551
PM FeCl
3
= 55,847
35,453
126,753
Moles = n= m/PM = 5 gr/74,551 gr/mol = 0,0670 mol KCl
N=m/PM = 5 gr/ 126,753 g/mol = 0,0394 mol de FeCl
3
Molalidad = M=m sto/ Kg ste = 0,067 mol KCl /0,1 Kg = 0,67 m KCl
m= n sto/Kg ste = 0,0394 mol/0,1 Kg = 0,394 m FeCl
3
=1/2 Ci . Z
2
= [0,67. (1)
2
+0,67(-1)
2
+0,394.(3)
2
+3.0,394.(-1)
2
]
=3,034
1.11.- Una solucin contiene 5 gr. de Urea (MM = 60.05 gr. / mol) por 100 gr. de agua.
Cual es la presin de vapor de esta solucin a 25 C? La presin de vapor del agua a esta
temperatura es 23.756 mm.
Razonamiento:
En el problema se pide determinar el descenso de la presin de vapor de la solucin
respecto a la presin del solvente en estado puro, por lo tanto se debe hacer uso de la siguiente
ecuacin:
Ec. (1)
Donde:
0
P : Presin de vapor del solvente en estado puro
P
: Descenso de la presin de vapor
La magnitud del descenso de la presin de vapor se determina a su vez por la ecuacin:
Ec. (2)
Donde 2
X
es la fraccin molar del soluto.
Los datos que provee el problema son los siguientes:
Masa del soluto: 5 gr. de Urea
Masa Molar del Soluto: 60.05 gr./mol
Masa del solvente: 100 gr. de Agua
Masa Molar del Solvente: 18 gr. / mol
Presin de vapor del solvente puro: 23.756
mm
Temperatura de la solucin: 25 C
P P P =
0
2
0
X P P =
Se determinan los moles de soluto y solvente:
Soluto:
moles Nsto 083 . 0 =
Solvente:
moles Nsto 556 . 5 =
Se calcula la fraccin molar del soluto:
El valor del Descenso de la presin de vapor es:
Finalmente la presin de vapor de la solucin es:
Fuente: Fundamentos
de Fisicoqumica
Autor: Maron E.
Problema 1 /Pg.
gr
gr
MMsto
Msto
Nsto
05 . 60
5
= =
gr
gr
MMste
Mste
Nste
18
100
= =
Nste Nsto
Nsto
X Xsto
+
= =
2
mol mol
mol
X
556 . 5 083 . 0
083 . 0
2
+
=
015 . 0
2
= X
mm P
mm X P P
350 . 0
) 015 . 0 )( 756 . 23 (
2
0
=
= =
mm P
mm P P P
406 . 23
) 350 . 0 756 . 23 (
0
=
= =
1.12.- Una solucin acuosa contiene 20 gr. de Glucosa (MM = 180 gr. / mol) por Litro.
Suponiendo que la solucin es ideal, Cual es la presin osmtica de esta solucin a 25 C.
Razonamiento:
La solucin se considera ideal, por lo tanto se determinar la Presin osmtica haciendo uso
de la ecuacin de gas ideal:
Ec. (1)
Donde:
: Presin Osmtica
M
: Molaridad de la solucin.
R
: Constante Universal de los gases
T
: Temperatura de la solucin.
- ) El problema indica la concentracin msica de la solucin la cual puede llevarse a concentracin
molar (molaridad) tal y como
se muestra a continuacin:
- ) La temperatura se transforma a grados Kelvin para que haya consistencia con las unidades al
momento de determinar la presin osmtica.
- ) Finalmente la presin de vapor de la solucin es:
Fuente: Fundamentos
de Fisicoqumica
Autor: Maron E.
Problema 12 /Pg.
MRT RT
V
n
= =
mol
a grGlu
a molGlu
x
L
a grGlu
M 111 . 0
cos 180
cos 1
1
cos 20
=
|
|
.
|
\
|
=
K C T K T 15 . 298 ) 15 . 273 25 ( 15 . 273 ) ( ) ( = + = + =
( ) K
mol K
atm L
L
mol
15 . 298
.
.
0821 . 0 111 . 0 |
.
|
\
|
|
.
|
\
|
=
atm 70 . 2 =
1.13.-A 20 C la presin de vapor del alcohol metlico es de 94 mm y la presin de vapor
del alcohol etlico es de 44 mm. Por ser compuestos muy parecidos forman un sistema
de dos componentes que se ajusta estrechamente a la ley de Raoult en todo el intervalo
de concentraciones. Si se mezclan 20 g de alcohol metlico con 100 g de alcohol etlico,
determine la presin total de la disolucin as como la composicin del vapor que est
encima de esta.
Solucin:
En una disolucin ideal de dos lquidos, no existe diferencia entre soluto y solvente por lo que la Ley
de Raoult es vlida para cada componente de dicha solucin. De aqu, que cuando dos lquidos se
mezclan para dar una disolucin ideal, la presin parcial de cada liquido es igual a su presin de
vapor multiplicada por su fraccin molar en disolucin y la presin total segn la Ley de Dalton de la
mezcla gaseosa es la suma de las presiones parciales de todos los componente. Esto es:
Ley de Raoult (Presin parcial del componente) P1= P1 * N1
P
2
= P
2 *
N
2
Donde,
P
1
y P
2
= presin de vapor de los componentes puro 1 y 2 respectivamente
N
1
y N
2
= fraccin molar de los componentes puro 1 y 2 respectivamente
Ley de Dalton (Presin total de la mezcla) P
T
=P
sto
+ P
ste
Masa molar de CH3OH: 32 g/mol
Masa molar de CH
3
CH
2
OH: 46 g/mol
Se calculan las presiones parciales para luego determinar la presin total:
mm mm
OH CH CH mol g g OH CH mol g g
OH CH mol g g
mm
21 22 . 0 * 94
) . / 46 / 100 ( ) . / 32 20 (
. / 32 20
* 94 P
2 3 3
3
OH CH
3
=
=
|
|
.
|
\
|
+
=
mm mm
OH CH CH mol g g OH CH mol g gr
OH CH CH mol g g
mm
34 78 . 0 * 44
) . / 46 / 100 ( ) . / 32 20 (
. / 46 / 100
* 44 P
2 3 3
2 3
OH CH CH
2 3
=
=
|
|
.
|
\
|
+
=
Entonces, P
T
= 21 mm + 34 mm P
T
= 55 mm.
La ley de Dalton tambin establece que la fraccin molar de cualquier componente de una mezcla
gaseosa es igual a su presin relativa, es decir a su presin parcial dividida por la presin total.
=
2
2
P
Y
P
Donde, Y2 es la fraccin molar de A2 (que puede ser el solvente o el soluto) en el vapor sobre una
solucin de composicin N
2
mm
mm
Total presin
OH CH del parcial presin
55
21
Y
3
OH CH
3
=
|
|
.
|
\
|
=
Y
CH3OH
= 0.38
mm
mm
55
34
Y
OH CH CH
2 3
=
YCH3CH2OH = 0.62
1.14.-La conductividad equivalente del LiCl a solucin infinita es 115,03*10
-4
S m
2
/mol. El
nmero de transferencia del catin es 0,336.
a) Calclese la movilidad del catin
b) Calclese la velocidad del catin si se aplican 6 V a travs de los electrodos separados 4
cm.
Solucin
a) Segn Castellan (1998), el nmero de transferencia de un in se define como la fraccin de
corriente transportada por ese in. En una solucin que slo contiene un electrolito, los nmeros de
transferencia t+ y t-, estn definidos por:
t
-
-
-
Y
t
+
+
+
Donde:
=
=
t
+
+ t
-
= 1
, es la conductividad molar del electrolito (equivalente para algunos autores) y se define segn la
Ley de Kohlrausch de la migracin independiente de iones como =
+
+
+
-
-
siempre que la
solucin est infinitamente diluida.
+ ,
y
- ,
son las conductividades molares del catin y anin respectivamente y se expresan
+
=
+
z
+
u
+ ,
y
-
=
-
z
-
u
- .
(u es la movilidad y se define como la velocidad adquirida por un portador en un
campo de intensidad igual a la unidad; u =v/E)
Como la electroneutralidad del compuesto requiere que,
+
z
-
=
-
z
-,
al sustituir los valores de
+
y
-
en las ecuaciones de t+ y t-, estas se reducen a u+= t+ y u-= t- que son las movilidades
del catin y el anin respectivamente, de las cuales slo se usar la primera puesto que esta
permitir conocer la movilidad del Li
+
en una solucin de LiCl que est infinitamente diluida.
u+ = 0.336 * (115.03*10
-4
)
u+ =38.65*10
-4
S m
2
/mol (Este valor se puede obtener directamente de tablas reportadas en la
bibliografa especializada ya que, es un valor constante por ser a dilucin infinita)
Nota: algunos autores denotan la movilidad de anin y el catin como l- y l+ respectivamente.
b) La velocidad del catin se obtiene a partir de la expresin de movilidad:
u =v/E v = u* E
Como se calcul previamente la movilidad del catin slo resta conocer el valor del Campo elctrico
E por la ecuacin E =V/d (donde V es el voltaje y d la distancia entre los electrodos). Entonces, al
sustituir el voltaje (6V) y la distancia en metros (4cm*1m/100cm) en la ecuacin se tiene que,
E = 6V/ 0.04m E =150 V/m
v = 38.65
*
10
-4
*
150
v = 0.5798 m/s
Unidad II EQUILIBRIO DE FASES
2.1. Dado el siguiente diagrama de fases binario
Determine: a) La fase o fases estables en cada regin del diagrama
b) Los grados de libertad de cada zona del diagrama.
c) La composicin de la fase lquida y vapor a la temperatura Q.
d) Cul es el principio fsico del diagrama. Explique.
Solucin
a) La fase o fases estables en cada regin del diagrama
b) Los grados de libertad de cada zona del diagrama
Como L = C-F+2
Para la regin de estabilidad de vapor, L = 1 1 + 2 = 2
Para la regin de estabilidad del lquido, L = 2 1 + 2 = 3
Para la regin lquido-vapor, L = 2- 2 + 2 = 2
0 X
B,2
X
B, 4
1
X
B
T
0 X
X
B
1
X
P cte
Tc
T
B
TQ
0 1
X
B
T
1
X
P cte
Vapor (v)
Lquido (l)
l-v
c) La composicin de la fase lquida y vapor en el punto Q.
La curva superior presente en la grfica T vs X representa la regin donde ocurre la evaporacin de
la ultima gota de lquido (estabilidad del vapor). En TQ la composicin del vapor, XB,4, se obtiene
interpolando hasta llegar a la interseccin con sta, como se muestra en la grafica.
La curva inferior representa la zona donde comienza la evaporacin del lquido y por debajo de
sta el lquido es estable. En TQ la composicin del lquido es, XB,2.
d) Cul es el principio fsico del diagrama. Explique
El principio fsico del diagrama se basa en la separacin de sustancias de diferentes puntos de
ebullicin. A medida que se aumenta la temperatura se vencen las fuerzas intermoleculares de la
mezcla de sustancias, es decir; una sustancia de bajo punto de ebullicin posee fuerzas
intermoleculares dbiles o baja masa molar, debido a esto se evapora en primer lugar y
posteriormente por condensacin se obtiene esta sustancia pura (proceso de destilacin)
2.2. Dadas las siguientes condiciones a 25 C y 1 atm
Soluto en agua molalidad sln acuosa
LiBr 0,965 0,001
CuSO
4
0,740 0,001
LiBr 0,803 1
CuSO4 0,043 1
Realice un anlisis de las diferentes soluciones y determine que soluto afecta en mayor
grado la presin de vapor del agua, cuando se realizan las correspondientes soluciones
acuosas, considerando el efecto de la concentracin. Pv agua = 23,8torr.
Justifique su respuesta, basados en fundamentos a nivel molecular.
En primer lugar se deben calcular las presiones de vapor del agua en cada disolucin.
0 XB,2
X
B, 4
1
X
B
T
0 X
B
1
X
P cte
Tc
T
B
TQ
a) Para la disolucin acuosa de LiBr 0,001m
Aplicando la Ley de Raoult, Pv,agua, dis = a agua x Pv agua, se obtiene la presin de vapor del agua en
la solucin. La actividad, a, se calcula de la ecuacin = a/Xi, transformando la molalidad a
fraccin molar del agua. Posteriormente, se comparan las presiones de vapor del agua en cada
solucin y el efecto del soluto y concentracin se refleja en la disminucin de la presin de vapor
respecto a la del agua pura.
Transformacin de molalidad a fraccin molar
m = 0,001mol/Kg de solvente, es decir; hay en la solucin 0,001 mol de LiBr en 1Kg de solvente.
Tenemos moles de LiBr = 0,001
Los moles de agua los calculamos segn, mol = 1000 g x 1mol = 55,55 mol de agua (constante para
cada solucin) 18 g
Calculamos la fraccin molar del agua, X
agua
Xagua = molagua = 55,55 = 0,99
mol
LiBr
+ mol
agua
0,001 + 55,55
Calculamos ahora la actividad, a agua
aagua = x Xagua = 0,956 x 0,99 = 0,94
Calculamos la presin de vapor del agua en esta solucin de LiBr 0,001m
Pv,
agua, dis
= a
agua
x
Pv
agua
= 0,94
x
23,80torr = 22,37torr
b) Para la disolucin acuosa de CuSO4 0,001m
Procedemos de igual manera
Calculamos la fraccin molar del agua, X
agua
Xagua = molagua = 55,55 = 0,99
mol
CuSO4
+ mol
agua
0,001 + 55,55
Calculamos ahora la actividad, a agua
aagua = x Xagua = 0,740 x 0,99 = 0,73
Calculamos la presin de vapor del agua en esta solucin de CuSO
4
0,001m
Pv,
agua, dis
= a
agua
x
Pv
agua
= 0,73
x
23,80torr = 17,37torr
c) Para la disolucin acuosa de LiBr 1m
Procedemos de igual manera
Calculamos la fraccin molar del agua, Xagua
Xagua = molagua = 55,55 = 0,98
molLiBr + molagua 1 + 55,55
Calculamos ahora la actividad, a agua
aagua = x Xagua = 0,803 x 0,98 = 0,78
Calculamos la presin de vapor del agua en esta solucin de LiBr 1m
Pv,agua, dis = a agua x Pv agua = 0,78 x 23,80torr = 18,56torr
d) Para la disolucin acuosa de CuSO
4
1m
Procedemos de igual manera
Calculamos la fraccin molar del agua, Xagua
X
agua
=
mol
agua
=
55,55
=
0,98
molCuSO4 + molagua 1 + 55,55
Calculamos ahora la actividad, a
agua
a
agua
=
x
X
agua =
0,043
x
0,98
=
0,042
Calculamos la presin de vapor del agua en esta solucin de CuSO4 1m
Pv,
agua, dis
= a
agua
x
Pv
agua
= 0,042
x
23,80torr = 0,99torr
Ahora comparamos las presiones calculadas para cada disolucin acuosa con la presin de vapor
del agua, 23,8torr.
Soluto en agua molalidad sln acuosa Pv
agua,dis
(torr)
a) LiBr 0,965 0,001 22,37
b) CuSO
4
0,740 0,001 17,37
c) LiBr 0,803 1 18,56
d) CuSO
4
0,043 1 0,99
Si comparamos las soluciones acuosas 0,001 m de bromuro de litio con sulfato de cobre
observamos que el efecto sobre la presin de vapor del agua es mayor cuando se prepara la
solucin con CuSO
4
.
Explicacin
Al hacer referencia a las propiedades coligativas sobre la cantidad de soluto presente y no su
forma o interaccin intermolecular con el agua, se evidencia que el CuSO4 es el que afecta
(disminuye) mayormente la presin de vapor del agua debido que tiene mayor masa molar, 160
g/mol, comparada con LiBr que tiene una masa molar igual a 87 g/mol, lo que manifiesta que exista
una mayor cantidad de sustancia (gramos) segn:
g = mol x Masa molar
Este efecto colectivo se evidencia tambin en las disoluciones acuosas de LiBr de diferentes
concentraciones.
Sin embargo, estas soluciones no son ideales como lo muestran sus coeficientes de actividades,
diferentes de uno. Lo que indica que adems del efecto colectivo la forma y las interacciones
intermoleculares tambin producen un efecto sobre la presin de vapor. Dicho efecto se basa en
las fuerzas intermoleculares ion-dipolo producida por los iones de estas sales que se disocian
completamente en agua, evitando que escapen las molculas del agua en forma de vapor.
2.3. Qu representa el factor i de Vant Hoff en la ecuacin Teb = m. Keb. i y como se
determina?
El factor i de vant Hoff representa la correccin de la no idealidad, se determina
experimentalmente,
i = Teb/ Teb,
donde Teb representa la variacin de temperatura de ebullicin de la solucin del electrolito y
Teb el de un no electrolito a la misma concentracin.
2.4 Explique brevemente cual es el efecto del tamao, forma, grado de disociacin y
concentracin de los componentes de una solucin electroltica sobre la conductividad
elctrica. Basado en estas caractersticas indique el orden creciente de conductividad
elctrica de los siguientes solutos en disolucin acuosa.
a) KBr, b) KI, c) HCN, d) CCl
3
COOH, e) H
2
SO
4
Tamao: Mientras ms grande el in menor ser la movilidad inica y por ende su conductividad.
Forma: Si es un ion ramificado dificultad su movilidad, mientras que si es aproximadamente
esfrico aumenta su movilidad y su conductividad.
Grado de disociacin: La disociacin favorece la formacin de iones y por ende su
conductividad.
Concentracin: Altas concentraciones de iones no favorecen la movilidad inica porque aumenta
la nube inica y disminuye su movilidad, mientras que, bajas concentraciones favorecen la
conductividad
H
2
SO
4
> KI >`KBr > HCN > CCl
3
COOH
El cido sulfrico se disocia completamente y el efecto de resonancia estabiliza la carga
negativa, le sigue el ioduro de potasio por ser una sal que se disocia completamente, por
tamao le sigue el bromuro de potasio, luego el cido cianhdrico que se disocia parcialmente y
por ultimo el cido tricloroactico que tiene gran tamao, se disocia parcialmente y es algo
impedido.
2.5. Dadas las siguientes condiciones a 25 C y 1 atm
Soluto en agua molalidad sln acuosa
LiBr 0.965 0.001
CuSO
4
0.740 0.001
LiBr 0.803 1
CuSO4 0.043 1
Realice un anlisis de las diferentes soluciones y determine que soluto afecta en mayor
grado la presin de vapor del agua, cuando se realizan las correspondientes soluciones
acuosas, considerando el efecto de la concentracin Pv agua = 23.8 torr. Justifique su
respuesta, basados en fundamentos a nivel molecular.
a) Para la disolucin acuosa de LiBr 0,001m
Aplicando la Ley de Raoult, Pv,agua, dis = a agua x Pv agua, se obtiene la presin de vapor del agua en
la solucin. La actividad, a, se calcula de la ecuacin = a/Xi, transformando la molalidad a
fraccin molar del agua. Posteriormente, se comparan las presiones de vapor del agua en cada
solucin y el efecto del soluto y concentracin se refleja en la disminucin de la presin de vapor
respecto a la del agua pura.
Transformacin de molalidad a fraccin molar
m = 0,001mol/Kg de solvente, es decir; hay en la solucin 0,001 mol de LiBr en 1Kg de solvente.
Tenemos moles de LiBr = 0,001
Los moles de agua los calculamos segn, mol = 1000 g x 1mol = 55,55 mol de agua (constante para
cada solucin) 18 g
Calculamos la fraccin molar del agua, Xagua
X
agua
=
mol
agua
=
55,55
=
0,99
molLiBr + molagua 0,001 + 55,55
Calculamos ahora la actividad, a
agua
aagua = x Xagua = 0,956 x 0,99 = 0,94
Calculamos la presin de vapor del agua en esta solucin de LiBr 0,001m
Pv,agua, dis = a agua x Pv agua = 0,94 x 23,80torr = 22,37torr
b) Para la disolucin acuosa de CuSO4 0,001m
Procedemos de igual manera
Pv,agua, dis = a agua x Pv agua = 0,73 x 23,80torr = 17,37torr
c) Para la disolucin acuosa de LiBr 1m
Pv,
agua, dis
= a
agua
x
Pv
agua
= 0,78
x
23,80torr = 18,56torr
d) Para la disolucin acuosa de CuSO4 1m
Pv,agua, dis = a agua x Pv agua = 0,042 x 23,80torr = 0,99torr
Explicacin
Se evidencia que el CuSO4 es el que afecta (disminuye) mayormente la presin de vapor del agua
debido que tiene mayor masa molar, 160 g/mol, comparada con LiBr que tiene una masa molar igual
a 87 g/mol, lo que manifiesta que exista una mayor cantidad de sustancia (gramos) Este efecto
colectivo se evidencia tambin en las disoluciones acuosas de LiBr de diferentes concentraciones.
Sin embargo, estas soluciones no son ideales como lo muestran sus coeficientes de actividades,
diferentes de uno. Lo que indica que adems del efecto colectivo la forma y las interacciones
intermoleculares tambin producen un efecto sobre la presin de vapor. Dicho efecto se basa en
las fuerzas intermoleculares ion-dipolo producida por los iones de estas sales que se disocian
completamente en agua, evitando que escapen las molculas del agua en forma de vapor.
2.6. Dada la siguiente grfica de solubilidad, asgnele a cada soluto presente en el recuadro
una curva, presente en dicha grfica, a 30 C. Justifique dicha asignacin
Explique el efecto de la temperatura (60 C) sobre la solubilidad de las disoluciones presentes
en dicha grfica.
Explicacin:
La mayor solubilidad la presenta el HCl debido a su bajo masa molar, polaridad y grado de
disociacin en agua, generando iones que aumentan su interaccin. Le sigue el cido tricloroactico
que a pesar de ser una molcula orgnica presenta cierto grado de disociacin, adems de su grupo
polar OH que fcilmente interacciona con el agua. Posteriormente, el butil metil ester que a pesar de
ser un compuesto poco polar y muy grande es ms soluble que el compuesto insoluble AgCl.
Al aumentar la temperatura vemos que en trminos generales aumenta la solubilidad, debido que
esto debilita o vence las fuerzas intermoleculares soluto-soluto y favorece el proceso de mezclado.
g/
10
0
m
L
H
2
O
T C
30
AgCl
CH
3
CH
2
CH
2
CH
2
COOCH
3
HCl
CCl
3
COOH
60
g/
10
0
m
L
H
2
O
30 60
HCl
CCl
3
COOH
CH
3
CH
2
CH
2
CH
2
COOCH
3
AgCl
2.7. Represente el diagrama de fases monario del azufre y explique cuales son sus principales
caractersticas. Qu representa el punto triple en dicho diagrama y cuantos grados de libertad
presenta.
Caractersticas principales:
Presenta tres puntos triples; A, B y C
Presenta dos fases slidas; Rombico y monoclnico
Qu representa el punto triple:
El punto triple representa las condiciones de P y T especficas donde coexisten tres fases en
equilibrio. Ej. A: Slido rombito, slido monoclnico y gas.
Grados de libertad en dicho punto:
L= C-F+2, L= 1- 3 + 2 = 0; invariante
2.8. Dado el diagrama de fases binario de agua trietilamina:
Diga:
2.8.1las fases estables y sus respectivas
composiciones a 30 C y X= 0,4.
2.8.2 2.8.2Las caractersticas principales del diagrama
2.8.3Explique el comportamiento de dicho
diagrama
T C
0 1
X(C6H15N)
30
0,4
2.8.1 las fases estables y sus respectivas composiciones a 30 C y X= 0,4.
2.8.2 Las caractersticas principales del diagrama
El diagrama presenta una temperatura de codisolucin inferior, es decir, a baja temperatura se
alcanza la solubilidad a cualquier composicin. Mientras que a temperaturas elevadas se obtiene
solubilidad parcial debido a factores estricos y electrnicos.
2.8.3 Explique el comportamiento de dicho diagrama
Este diagrama alcanza la solubilidad total a baja temperatura, debido que la molcula de trietil
amina es ramificada. La interaccin se obtiene a partir de enlaces de fsicos formados por el
nitrgeno con hidrgenos del agua. A bajas temperaturas la separacin entre las molculas de la
amina es corta, mientras que, a temperaturas elevadas aumenta la separacin y el movimiento de
las molculas, dificultando la interaccin con el agua y disminuyendo as su solubilidad.
2.9. Construya el diagrama de fases binario slido-lquido de naftaleno benceno, usando los
datos que se presentan a continuacin:
Temperatura, C 80 60 40 20 40 50
Fraccin molar, Xben 0 0.2 0.4 0.6 0.8 1
Por debajo de 20 C existe equilibrio slido-slido, represente los equilibrios en las tres zonas
restantes.
a) Resalte las caractersticas ms importantes de dicho diagrama, en funcin de las
zonas de equilibrio que presenta.
b) Qu representa el punto eutctico en dicho sistema binario?
T C
0 1
X(C6H15N)
30
0,4
2 Fases
1 Fases
A B
Composiciones cualitativas:
A = Solucin saturada de trietil amina en agua
B = Solucin saturada de agua en trietil amina
0
10
20
30
40
50
60
70
80
90
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1
Xbenceno
T
e
m
p
e
r
a
t
u
r
a
,
C
a) Resalte las caractersticas ms importantes de dicho diagrama, en funcin de las
zonas de equilibrio que presenta:
La linea A-D representa la solubilidad del naftaleno en benceno
La curva C-D representa el descenso del punto de congelacin del benceno por la presencia del
naftaleno.
D representa el punto eutctico
b) Qu representa el punto eutctico en dicho sistema binario?
El punto eutctico representa la temperatura donde el naftaleno y el benceno congelan al mismo
tiempo, debido que sus potenciales qumicos se hacen iguales.
2.10.- Del diagrama Fe-C que se adjunta se puede extraer la siguiente informacin:
c) A 960 C el carbono puede disolverse en la austenita hasta un 1,5%.
b) A 600C el carbono puede disolverse en la ferrita hasta un 0,067%.
Se desea saber las fases presentes y su composicin:
a) en una aleacin con un 1% de carbono, a las temperaturas de 600 y 960 C.
b) en una aleacin con un 2% de carbono, a la temperatura de 960 C.
D
A
C
Solucin
naf-ben slidos
Solucin + naf
Solucin + ben
SOLUCIN:
a) en una aleacin con 1% de carbono, a la temperatura de 600 C, nos encontramos con hierro
(ferrita) y cementita Fe
3
C (punto a
1
)
% 87 , 85 100 .
067 , 0 70 , 6
1 70 , 6
% =
= Fe
% 1 , 14 100 .
067 , 0 70 , 6
067 , 0 1
%
3
=
= C Fe
Fe
0,067%
1%
Fe
3
C
6,67%
A 960 C nos encontramos con 100 % de austenita pura (punto a
2
)
b) en la aleacin con el 2% de carbono, a la temperatura de 960 C, nos encontramos con austenita
y cementita (punto b)
% 38 , 90 100 .
5 , 1 70 , 6
2 70 , 6
% =
= Austenita
% 62 , 9 100 .
5 , 1 70 , 6
5 . 1 2
% =
= Cementita
a
1
a
2 b
2.11.- Identifique la cantidad de componentes y fases en cada sistema. Suponga que n hay
ms componentes en el sistema que los indicados.
a) Un sistema que contiene hielo y agua
b) Una solucin 50:50 de agua y etanol (C
2
H
5
OH)
c) Un tanque presurizado de dixido de carbono que contiene lquido y gas
d) Un calormetro de bomba con bolita de acido benzoico (C6H5COOH)
Resolucin
Para identificar los componentes y fases se requiere tener clara la definicin de cada uno de ellos.
Ball (2004) define como componente, una sustancia qumica nica con propiedades definidas y que
a pesar de estar conformada por dos o ms elementos se considera qumicamente homognea en
vista que cada uno de estos pierde su individualidad al formar la molcula del compuesto. Ahora
bien, se denomina fase a la porcin homognea de un sistema separado de otro por limites
definidos ( Maron y Prutton, 2001). Una vez clara las definiciones se tienen que:
a) El agua congelada contiene H2O en estado slido y lquido los cuales se diferencian muy bien
incluso visualmente, as que hay un solo componente y dos fases.
b) Tanto el agua como el etanol son lquidos, as que slo ayuna fase y dos componentes.
c) Como en el caso del agua congelada, el dixido de carbono con lquido y gas en un tanque consta
de un solo componente qumico en dos fases.
d) En un calormetro de bomba que no ha explotado, la blita slida de cido y el oxigeno,
constituyen dos componentes y dos fases.
e) Despus de la explosin, el cido benzoico se quema para formar gas de dixido de carbono y
agua en estado lquido. En la presencia de exceso de oxgeno, hay por lo tanto, tres componentes y
dos fases.
Unidad III CINTICA DE LAS REACCIONES QUMICAS
3.1. Dada la siguiente informacin cintica, determine la ecuacin cintica. Las sustancias A,
B, C son reactivos. Explique
0
0,5
1
1,5
2
2,5
3
3,5
4
4,5
5
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21
t, min
C
o
n
c
e
n
t
r
a
c
i
n
, m
o
l/L
Experimento [A] [B] [C] V instantnea
1 3.5 2 1.5
2 4.5 2 1.5
3 3.5 4 1.5 3.1
4 3.5 4 3 3.1
La velocidad instantnea de los experimento 1 y 2 se obtienen de la grfica. En primer lugar se
traza una tangente al inicio de cada curva y, posteriormente, se calculan las pendientes
correspondientes. Luego se aplica el mtodo de aproximacin de las velocidades iniciales para
obtener los ordenes parciales de reaccin y en base a esto se escribe la ecuacin cintica.
0
0,5
1
1,5
2
2,5
3
3,5
4
4,5
5
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21
t, min
C
o
n
c
e
n
t
r
a
c
i
n
, m
o
l/L
Exp. 1
Exp. 2
Exp. 1
Exp. 2
Se utiliza la ecuacin de la pendiente, m = Y
2
Y
1
/X
2
X
1
= V = - Conc/t
Para el experimento 1
V = - (3 - 2,5)/(2 3) = 0,5
Para el experimento 2
V = - (1,4 0,8)/(1 2) = 0,6
Experimento [A] [B] [C] V instantnea
1 3,5 2 1,5 0,5
2 4,5 2 1,5 0,6
3 3,5 4 1,5 3,1
4 3,5 4 3,0 3,1
Determinacin de orden parcial de A, experimento 1 y 2.
Aplicamos la ecuacin (V2/V1) = (Conc. 2/Conc.1)
(0,6/0,5) = (4,5/3,5)
1,20 = (1.28)
log1,20 = log1,28
=0,73
La velocidad depende de la concentracin de A de forma fraccionaria
Determinacin de orden parcial de B, experimento 1 y 3.
Aplicamos la ecuacin (V
3
/V
1
) = (Conc. 3/Conc.1)
(3,1/0,5) = (4,0/2,0)
6,20 = (2.00)
log6,20 = log2,00
=2,63
La velocidad depende de la concentracin de B de forma fraccionaria
Determinacin de orden parcial de C, experimento 3 y 4.
Aplicamos la ecuacin (V3/V1) = (Conc. 3/Conc.1)
(3,1/3,1) = (3,0/1,5)
1,00 = (2.00)
log1,00 = log2,00
=0
La velocidad de la reaccin no depende de la concentracin de C, pero l debe estar presente en la
reaccin
La ecuacin de velocidad es la siguiente, V = K [A]
0,73
[B]
2,63
[C]
0
3.2. Dada la siguiente informacin cintica:
t, seg. 0 2 6 15 43 90
[A] 2 1.95 1.88 1.76 1.46 1.19
Demuestre que K = 2.5 x 10
-3
. Justifique su respuesta
Basado en los datos cinticos, primero se debe realizar el clculo analtico de la constante de
velocidad, se utilizan las ecuaciones de diferentes rdenes hasta obtener el valor de K, luego se
realiza la correspondiente grfica para demostrar dicho orden de reaccin.
Primer orden
Ln[A] = - KA. t + Ln[A]
0
, resolviendo para K
K = -(Ln[A] -Ln[A]0)/t = -(Ln1,95 Ln2)/2 = 0,015
La constante calculada no es la esperada, de forma que la reaccin no es de primer orden.
Segundo orden
1/[A] = KAt + 1/[A]0, resolviendo para K
K = (1/[A]-1[A]
0
)/t = (1/1,95 1/2)/2 = 5x10
-3
La constante calculada no es la esperada, de forma que la reaccin no es de segundo orden.
Tercer orden
1/[A]
2
= 2 KA. t + 1/[A]
2
0, resolviendo para K
K
A
= (1/[A]
2
1/[A]
2
0
)/2
x
t = (1/(1,95)
2
1/(2)
2
)/2
x
2 = 2,5 x 10
-3
Para el tercer orden se obtiene la constante esperada, ahora se grfica 1/[A]
2
contra t para obtener
una lnea recta de pendiente igual a 2 Ka = 2,5 x10
-3.
Reaccin orden 3
0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
0 20 40 60 80 100
Tiempo, seg
1
/
(
A
)
2
A partir de esta grfica se justifica el orden de reaccin y la constante calculada.
3.3. Demuestre que la ecuacin cintica,
r = K
1 .
K
2
[ML
5
X] . [Y]/K
-1
+ k
2
Justifica el siguiente mecanismo:
ML5X + Y ML5XY
ML5XY ML5Y + X
Utilice el mtodo ms adecuado para demostrar dicha ecuacin. Justifique el mtodo utilizado
Solucin
Existen dos mtodos de aproximacin para determinar la ecuacin cintica a partir del mecanismo
de la reaccin, para justificar el mtodo se debe utilizar ambos y ver cual satisface la ecuacin
cintica.
Mtodo de aproximacin del estado de equilibrio
K
2
K
1
K
-1
En este mtodo se toma r igual a la velocidad de la etapa limite y se eliminan las []
usando las constantes de equilibrios de los equilibrios anteriores a la etapa limite.
r = K2[ML5XY] (1)
ML
5
XY es un intermedio, I, se elimina con la expresin de equilibrio.
Kc = K1 = [ML5XY]
K-
1
[ML
5
X][Y]
Se despeja [ML5XY]
[ML
5
XY] = K
1
[ML
5
X][Y]/K
-1
(2)
Se sustituye en (2)
r = K
2
K
1
[ML
5
X][Y]/K
-1
Como se aprecia por este mtodo no se obtiene la ecuacin deseada
Mtodo de aproximacin del estado de estacionario
Se toma la velocidad de reaccin, r, igual a la velocidad de formacin de los productos de la
ultima etapa en el mecanismo y se elimina [] mediante d[]/dt = 0.
r = K2[ML5XY] (1)
Velocidad de aparicin del intermedio, ML
5
XY
d[ML5XY]/dt = K1[ML5X][Y] (2)
Velocidad de desaparicin del intermedio, ML5XY
d[ML
5
XY]/dt = K
-1
[ML
5
XY] + K
2
[ML
5
XY] (3)
Como d[ML
5
XY]/dt = 0 se igualan las ecuaciones 2 y 3 y se despeja [ML
5
XY]
K1[ML5X][Y] = K-1[ML5XY] + K2[ML5XY]
K
1
[ML
5
X][Y] = (K
-1
+ K
2
)[ML
5
XY]
[ML
5
XY] = K
1
[ML
5
X][Y]/(K
-1
+ K
2
)
Se sustituye [ML5XY] en la ecuacin 1
r = K
1 .
K
2
[ML
5
X] . [Y]/K
-1
+ k
2
A travs de este mtodo se justific el mecanismo puesto que se obtuvo la ecuacin cintica
esperada.
3.4 Considere el mtodo de aproximacin de estado estacionario para demostrar el siguiente
mecanismo,
Etapa 1 H
+
+ HNO2 H2NO2
+
Etapa 2 H2NO2
+
+ Br
-
ONBr + H2O
Etapa 3 ONBr + C
6
H
5
NH
2
C
6
H
5
N
2
+
+ H
2
O + Br
H
+
+ HNO
2
+ C
6
H
5
NH
2
C
6
H
5
N
2
+
+ 2H
2
O
La ecuacin cintica observada para la reaccin catalizada por Br
-
es r = K H
+
HNO2 Br
-
Solucin
r = d C6H5N2
+
/dt = k3 ONBr C6H5NH2
Intermediarios
ONBr y H2NO2
+
(no aparecen en la ecuacin balanceada)
Se produce
(d ONBr /dt)
2
= K
2
H
2
NO
2
+
Br
-
Se consume
(d ONBr /dt)3 = K3 ONBr C6H5NH2
Igualar y despejar ONBr
ONBr = K2 H2NO2
+
Br
-
/K3 C6H5NH2
Sustituir ONBr en la expresin de velocidad, r
r = K
2
H
2
NO
2
+
Br
-
Para eliminar H2NO2
+
hacemos d H2NO2
+
/dt = 0
Br
-
K
1
K
2
K
3
K-
1
Resolviendo
r = K
2
K
1
H
+
HNO
2
Br
-
/K
-1
+ K
2
Br
-
Suponiendo K-1 K2 Br
-
tenemos K1 K2/K-1 K
Nos queda la expresin de velocidad observada
r = K H
+
HNO2 Br
-
3.5. Expresar la velocidad de la siguiente reaccin qumica en funcin de la concentracin de
cada una de las especies implicadas en la reaccin:
4 NH
3(g)
+ 3 O
2(g)
2 N
2(g)
+ 6 H
2
O
(g)
Solucin
3.6. Determina los rdenes de reaccin total y parcial de las reacciones anteriores:
a) H2(g) + I2(g) 2 HI(g) v=kx[H2]x[I2]
b) H
2(g)
+ Br
2(g)
2 HBr
(g)
v = k x [H
2
] x [Br
2
]
1/2
Solucin
a) Reaccin de segundo orden (1 + 1)
De primer orden respecto al H2 y de primer orden respecto al I2.
b) Reaccin de orden
3
/
2
(1 + )
De primer orden respecto al H2 y de orden respecto al Br2.
Si por ejemplo, al doblar la concentracin de un reactivo la velocidad se multiplica por cuatro,
podemos deducir que el orden parcial respecto a ese reactivo es 2.
3.7. Determinar el orden de reaccin:
CH3-Cl(g) + H2O(g) CH3-OH(g) + HCl(g) usando los datos de la tabla.
En las experiencias 1 y 2 vemos que no cambia [H
2
O] luego el cambio de v se debe al cambio de
[CH3-Cl ]. Como al doblar [CH3-Cl] se dobla la velocidad podemos deducir que el orden de reaccin r
especto del CH
3
-Cl es 1.
En las experiencias 1 y 3 vemos que no cambia [CH3-Cl] luego el cambio de v se debe al cambio
de [H
2
O]. Como al doblar [H
2
O] se cuadruplica la velocidad podemos deducir que el orden de
reaccin respecto del H
2
O es 2.
Por tanto, la ecuacin de velocidad en este caso se expresar:
Y el orden total de la reaccin es 3. El valor de k se calcula a partir de cualquier experiencia y
resulta 181,4 mol
2
L
2
s
1
.
Para determinar los rdenes de reaccin, tambin puede usarse logaritmos:
log v = log k + n x log [CH3-Cl ] + m x log [H2O]
Aplicamos dicha expresin a cada experimento:
(1) log 2,83 = log k + n x log 0,25 M + m x log 0,25 M
(2) log 5,67 = log k + n x log 0,50 M + m x log 0,25 M
(3) log 11,35 = log k + n x log 0,25 M + m x log 0,50 M
Si restamos dos ecuaciones en las que se mantenga constante uno de los reactivos, podremos
obtener el orden de reaccin parcial del otro. As, al restar (1) (2) eliminamos k y [H2O]:
log (2,83/5,67) = n x log (0,25/0,50)
Experiencia [CH
3
-Cl] (mol/l) [H
2
O] (mol/l) v (moll
1
s
1
)
1 0,25 0,25 2,83
2 0,50 0,25 5,67
3 0,25 0,5 11,35
Anlogamente restando (1) (3) eliminamos k y [CH
3
-Cl]
log(2,83/11,35)= m x log (0,25/0,50)
3.8. Cual es el valor de la energa de activacin para una reaccin si la constante de
velocidad se duplica cuando la temperatura aumenta de 15 a 25 C?
Solucin
Sabemos que k2 (298 K) = 2 x k1 (288 K)
(1) ln k1 = ln A Ea/RT1; (2) ln 2 k1 = ln A Ea/RT2
Sustituyendo R = 8,31 Jmol
1
K, T
1
= 288 K y T
2
= 298 K y restando (2) (1):
Despejando E
A
se obtiene:
EA = 4,95x10
4
Jxmol
-1
3.9 Las constantes de velocidad para las reacciones en fase gaseosa
H2 +I2 2HI a varias temperaturas son:
T (K) 599 629 647 666 683 700
10
3
K
(Lt/mol.seg)
0,54 2,5 5,2 14 25 64
Determine Ea y A grficamente
Log 10
3
K (Lt/mol.seg) 1/T (10
-3
)
2,73 1,7
3,39 1,59
3,72 1,55
4,15 1,5
4,40 1,46
4,80 1,43
Se grafica log K vs 1/T (10
-3
)
Y se obtiene una recta de pendiente negativa.
- E a = . m . = - 8,44 . = 1844,38 Kcal/mol
k. 2,303 1,987.10
-3
. 2,303
log K = 4,81
log K = log A
A= 64565,4229 Lt/mol.seg
3.10 .- El mecanismo propuesto ara la descomposicin de N2O5 es:
N2O
5
NO
2
+ NO
3
rpida
NO2 + NO3 N2O5 lenta
NO2 + NO
3
2NO
2
rpida
NO + NO
3
2 NO
2
rpida
Encuentra la expresin ara la velocidad de desaparicin de N
2
O
5
, basada en la aproximacin
de estado estacionario para la concentracin NO
3
y NO.
1) d [N
2
O
5
] = - K
1
[N
2
O
5
] + K
-1
[NO
2
][NO
3
]
dt
2) d [NO3] = K1 [N2O5] - K-1 [NO2][NO3] - K-2 [NO2][NO3] - K-3 [NO][NO3]
dt
3) d [NO] = K
-2
[NO
2
][NO
3
] - K
-3
[NO][NO
3
]
dt
d [NO] = 0
dt
K
-2
[NO
2
][NO
3
] - K
-3
[NO][NO
3
] = 0
K
1
K-
1
K
2
K
3
K
-2
[NO
2
][NO
3
] = K
-3
[NO][NO
3
]
[NO] = K
-2
[NO
2
]
K-3
en la ec. 2 despejamos [NO
3
]
d [NO3] = O
dt
K1 [N2O5] - K-1 [NO2][NO3] - K-2 [NO2][NO3] - K-3 [NO][NO3]= 0
[NO3]= K1 [N2O5] .
K
-1
[NO
2
] + K
2
[NO
2
]+ K
-3
[NO]
Sust en [NO3] en la ec. de [NO] = - k3 [NO][NO3]
Respuesta:
- d [N2O5] = 2 - K1 . K3 . [N2O5]
dt ( K
-1
+ 2 K
3
)
[NO3]= K1 [N2O5] .
K
-1
[NO
2
] + K
2
[NO
2
]+ K
-3
K
2
[NO
2
]
K
3
Sust en 1:
d [N
2
O
5
] = - K
1
. [N
2
O
5
] + K-
1
. [NO
2
] . K
1
[N
2
O
5
] .
dt [NO2] ( K-1 + K2 + K3)
d [N
2
O
5
] = - K
1
. [N
2
O
5
] + K-
1
. K
1
[N
2
O
5
] .
dt ( K-1 + K2 + K3)
d [N
2
O
5
] = [N
2
O
5
] - K
1
+ K-
1
. - K
1
.
dt ( K-1 + 2K2 )
d [N2O5] = [N2O5] K1 K-1 . - K1 ( K-1 + 2K2 ) .
dt ( K-1 + 2K2 )
d [N
2
O
5
] = [N
2
O
5
] K
1
K-
1
. - K
1
K
-1
- 2 K
2
K
1
) .
dt ( K-1 + 2K2 )
d [N
2
O
5
] = [N
2
O
5
] - 2 K
2
K
1
.
dt ( K-1 + 2K2 )
- d [N
2
O
5
] = [N
2
O
5
] 2 K
2
K
1
.
dt ( K-1 + 2K2 )
3.11.- A 600 K, la descomposicin del NO2 es de segundo orden, con una velocidad de 2,0x10
-
3
mol L
-1
s
-1
cuando la concentracin de NO2 es 0,080 M. a) Escribir la ecuacin de velocidad.
b) Calcular la constante de velocidad. c) Cul ser la velocidad cuando la concentracin de
NO2 sea 0,020 M?
SOLUCIN:
Reaccin: 2NO2 2NO + O2
a) Ecuacin de velocidad:
| |
2
2
NO k r =
b) Constante de velocidad:
| |
2
1 1 3
2
2
) 08 , 0 (
. . 10 0 , 2
M
s L mol x
NO
r
k
= =
1 1
. . 31 , 0
= s mol L k
c)
| |
2
2
NO k r =
2 1 1
) 02 , 0 .( . . 31 , 0 M s mol L r
=
1 1 4
. . 10 25 , 1
= s L mol x r
3.12.-En el estudio de la reaccin de hidrlisis alcalina de acetato de etilo segn la ecuacin:
CH
3
COO-CH
2
CH
3
+ OH
-
CH
3
COOH + CH
3
CH
2
OH se han obtenido los siguientes datos:
Experimento [CH3COOCH3CH3]inic (M) [OH-]inic (M) Vinicial (mol L
-1
s
-1
)
1 1,0 x 10
-3
1,0 x 10
-2
1,3 x 10
-6
2 1,0 x 10
-3
5,0 x 10
-3
6,5 x 10
-7
3 5,0 x 10
-2
1,0 x 10
-3
6,5 x 10
-6
4 1,0 x 10
-2
1,0 x 10
-2
1,3x10
-5
Determinar: a) El orden total de la reaccin. b) La ley de velocidad. c) La constante especfica
de la reaccin. d) la velocidad inicial si [CH
3
COOCH
2
CH
3
]inic = 3,0x10
-3
M y [OH
-
]inic = 6,0x10
-2
M.
SOLUCIN:
Tomando: CH
3
COO-CH
2
CH
3
+ OH
-
CH
3
COOH + CH
3
CH
2
OH
A + B C
| | | |
B A k r . . =
Para determinar los rdenes de reaccin se puede emplear el mtodo de la velocidad inicial ya que
se cuenta con valores de 0
r
para varios experimentos.
Se toman dos experimentos en los que se pueda mantener constante la concentracin de uno de los
reactivos, a partir del cociente de velocidades iniciales de estos experimentos se puede obtener
.
Con el cociente de las velocidades iniciales de los experimentos 1 y 2 se obtiene
:
| | | |
1 , 0 1 , 0 1 , 0
. . B A k r =
| | | |
2 , 0 2 , 0 2 , 0
. . B A k r =
| | | |
| | | |
1 , 0 1 , 0
2 , 0 2 , 0
1 , 0
2 , 0
. .
. .
B A k
B A k
r
r
=
| |
| |
1 , 0
2 , 0
1 , 0
2 , 0
B
B
r
r
=
| |
| |
|
|
.
|
\
|
=
1 , 0
2 , 0
1 , 0
2 , 0
B
B
r
r
|
|
.
|
\
|
=
2
3
6
7
10 0 , 1
10 0 , 5
10 3 , 1
10 5 , 6
x
x
x
x
( )
5 , 0 5 , 0 =
1 =
Con el cociente de las velocidades iniciales de los experimentos 1 y 4 se obtiene
:
| | | |
1 , 0 1 , 0 1 , 0
. . B A k r =
| | | |
4 , 0 4 , 0 4 , 0
. . B A k r =
| | | |
| | | |
1 , 0 1 , 0
4 , 0 4 , 0
1 , 0
4 , 0
. .
. .
B A k
B A k
r
r
=
| |
| |
1 , 0
4 , 0
1 , 0
4 , 0
A
A
r
r
=
| |
| |
|
|
.
|
\
|
=
1 , 0
4 , 0
1 , 0
4 , 0
A
A
r
r
|
|
.
|
\
|
=
2
2
6
5
10 0 , 1
10 0 , 1
10 3 , 1
10 3 , 1
x
x
x
x
( )
10 10 =
1 =
4. Orden total de la reaccin:
2 = +
5.
| || |
= OH CH CH COO CH k r
3 2 3
6.
| | | | ) 10 0 , 1 )( 10 0 , 1 (
10 3 , 1
.
2 3
6
1 , 0 1 , 0 2 8 4
1 , 0
= =
x x
x
OH O H C
r
k
1 1
. . 13 , 0
= s mol L k
d)
| || |
= OH CH CH COO CH k r
3 2 3
1 1 2 3
. . 34 , 2 ) 10 6 )( 10 3 .( 13 , 0
= = s L mol x x r
3.13.- La ecuacin cintica observada para la siguiente reaccin qumica catalizada por: Br
-
O H N H C NH H C HNO H
Br
2 2 5 6 2 5 6 2
2 + + +
+ +
Es:
| || || |
+
= Br HNO H K r
2
Un mecanismo propuesto es:
(Equilibrio rpido)
(Etapa lenta)
(Etapa Rpida)
Deduzca la ecuacin cintica observada.
Razonamiento:
La etapa Nro. # 3 es mucho ms rpida que la etapa Nro. #2, por lo tanto esta ultima es la
etapa limitante y se puede tomar la velocidad de desaparicin del
+
2 2
NO H
igual a la velocidad
de formacin del
ONBr
.
La cintica quedara:
| |
| || |
+
+
= = Br HNO K
dt
NO H d
r
2 2
2 2
Ec. (1)
+
+
+ +
+ + +
+ +
+
Br O H N H C NH H C ONBr
O H ONBr Br NO H
NO H HNO H
K
K
K
2 2 5 6 2 5 6
2 2 2
2 2 2
3
2
1
La reaccin es elemental puesto que ocurre en una sola etapa. La especie
| |
+
2
HNO
es un
intermedio de la reaccin y se debe expresar en trminos de reactivos y productos. Es evidente que
la etapa Nro. 1 esta cerca del equilibrio por lo tanto se realiza la igualacin de las velocidades de
Reaccin Directa e Inversa como se muestra a continuacin:
( ) ( )
1 , 1 1 , 1
= K r K r
INVERSA DIRECTA Ec. (2)
Entonces:
| || | | |
+
= = =
2 2 1 1 2 1 1
NO H K r HNO H K r
Reordenando:
| |
| || |
1
2
2 2
1
1
C
K
HNO H
NO H
K
K
= =
+
+
Ec. (3)
Despejando el intermediario:
| | | || |
2 1 2 2
HNO H K NO H
C
+ +
=
Ec. (4)
Substituyendo la Ec. (4) en la Ec. (1) se tiene:
| |
| || | | || || | { }
+ +
+
= = = Br HNO H K K Br HNO K
dt
NO H d
r
C 2 1 2 2 2
2 2
| |
| || || |
+
+
= = Br HNO H K K
dt
NO H d
r
C 2 1 2
2 2
Fuente: Fisicoquimica Vol. 2
Autor: Ira Levine
Ejemplo 17.4/Pg. 681
3.14.- La reaccin exotrmica:
D B A 2 2 +
(I)
Es prcticamente irreversible a bajas temperaturas y la ley de velocidad es:
| | | | B A K r
A A
2
1
=
Ec. (1)
Sugiera una ley de velocidad que sea valida a altas temperaturas, donde la reaccin
sea reversible:
D B A 2 2 +
(II)
Razonamiento:
La ley de velocidad para una reaccin reversible debe satisfacer los siguientes criterios:
d) Satisfacer las Relaciones Termodinmicas en el equilibrio.
e) Reducirse a la Ley de velocidad irreversible cuando la concentracin inicial de uno
de sus productos es cero.
Se sabe por la Termodinmica que la relacin de equilibrio para la reaccin (I) es:
| |
| | | |
2
2
e e
e
C
B A
D
K =
, con
| |
mol
dm
K
C
3
=
Ec.(2)
El subndice e indica Estado de Equilibrio. Reacomodando la Ec. (2) de la siguiente
manera:
Reacomodando los miembros:
| | | | | |
2 2
e e e C
D B A K =
Multiplicando por el inverso de C
K
:
| | | | | |
2 2
1 1
e
C
e e C
C
D
K
B A K
K
|
|
.
|
\
|
=
|
|
.
|
\
|
Igualando a cero:
| | | | | | 0
1
2 2
=
|
|
.
|
\
|
e
C
e e
D
K
B A
Esta ltima expresin sugiere que se puede probar una ley de velocidad reversible de la forma:
| || |
| |
)
`
=
C
A A
K
D
B A K r
2
2
Ec. (3)
La ecuacin satisface las condiciones de equilibrio pero no se simplifica a la velocidad
irreversible inicial (es decir, a la Ec. (1)) puesto que al sustituir
| | 0 = D
en la Ec. (3) se obtiene:
| || |
2
B A K r
A A
=
Ec. (4)
Evidentemente la Ec. (4) no coincide con la Ec. (1), as que la ley de velocidad dada por la Ec.
(4) no es vlida.
En la Ec. (1) se observa la concentracin del reactivo limitante elevada a la media potencia, la
cual sugiere que se debe extraer la raz cuadrada de la Ec. (2):
| |
| | | |
2
2
e e
e
C
B A
D
K =
Extrayendo raz cuadrada:
| |
| | | |
2
2
e e
e
C
B A
D
K =
Extrayendo raz cuadrada:
| |
| | | |
e e
e
C
B A
D
K =
2
, con
| |
2
1
3
2
|
|
.
|
\
|
=
mol
dm
K
C Ec. (5)
Reordenando la Ec. (5) tal y como se hizo con la Ec. (2) se obtiene:
| | | | | | 0
1
2
2
1
=
|
|
.
|
\
|
e
C
e e
D
K
B A
Ec. (6)
Utilizando la nueva constante de equilibrio, 2 C
K
, se puede formular otra sugerencia para la
expresin de la velocidad de reaccin:
| | | |
| |
)
`
=
2
2
1
C
A A
K
D
B A K r
Observe que esta expresin satisface la Relacin Termodinmica en el Equilibrio y tambin
se reduce a la ley de velocidad irreversible cuando
| | 0 = D
. La forma de la ley de velocidad
irreversible es una pista importante respecto a la forma de la expresin para la velocidad de reaccin
de reversible.
UNIDAD IV. CATALISIS DE LAS REACCIONES QUIMICAS.
4.1. a) Los catalizadores son utilizados principalmente en la industria para obtener un producto
deseado, bajo condiciones de reaccin y costos favorables. Cules son los criterios que se utilizan
para catalogar un catalizador como eficiente, en trminos de reaccin y costos. Justifique su
respuesta.
b) Cul es la principal diferencia que existe entre las reacciones que se llevan a cabo
utilizando la catlisis homognea y la catlisis heterognea, en base a su interaccin a nivel
molecular con el sustrato. Justifique su respuesta.
Solucin
A) En trminos de reaccin los criterios que se utilizan son:
- Alta actividad cataltica
- Alta estabilidad trmica
- Baja desactivacin con el tiempo
- Alta especificidad
Bajo estos criterios se desea generar una gran cantidad de producto esperado con baja o ninguna
formacin de subproductos a condiciones de temperatura y presin moderadas, durante un periodo
de tiempo suficiente para producir la mayor conversin posible de reactivos a productos.
En trminos de costos
Las condiciones de reaccin o los criterios antes mencionados conllevan a disminuir los costos de
operacin y produccin, es decir; un catalizador especfico genera el producto esperado con alto
rendimiento, esto implica un proceso menos debido a posible separacin de subproductos o
purificacin y lavado del producto. Adems, si el catalizador presenta alta conversin elimina el
proceso o paso de extraer el reactivo restante o volver a cargar catalizador para empezar de nuevo
la reaccin, lo cual es perdida de tiempo que se refleja en perdida de dinero.
_ Bajo costo del catalizador y preferiblemente de manufactura nacional
-- Pocos procesos para obtener el producto
B) En la catlisis Heterognea la interaccin con el sustrato ocurre en su superficie del
catalizador, es decir; en la interfase de dos fases distintas, generalmente, slido-gas o slido-lquido.
Esta interaccin se produce por procesos de fisisorcin y/o quimisorcin. Mientras que, en la
catlisis homognea las molculas o compuestos de coordinacin que forman al catalizador son
solubles en el solvente y la interaccin puede ocurrir en cualquier lugar de la fase, respetando los
sitios activos del catalizador y sus estructuras.
4.2.En la descomposicin de (CH
3
)
2
O a 777 K el tiempo necesario para que la concentracin
inicial se reduzca a la mitad es:
10
3
[(CH3)2O] (mol/dm
3
) 8.13 6.44
tiempo (seg.) 590 665
Determine orden de reaccin. (Valor: 3 Pts)
Aplicando el mtodo de la vida media para dos concentraciones diferentes
2
3
5 . 1 5 . 0 1
91 . 3 81 . 3
82 . 2 77 . 2
1
10 13 . 8 log 10 44 . 6 log
665 log 590 log
1
1 log 2 log
2 log 1 log
1
3 3
= + =
+ =
+ =
+ =
x x a a
t t
n
4.3. La constante de velocidad de la reaccin A B es 0.23 seg.
-1
. Si la concentracin inicial
de A es 0.60 M, calcule: (Valor: 4 pts)
a) La vida media.
Al observar las unidades de la constante de velocidad deducimos que se trata de una ecuacin de
primer orden, se aplica la ecuacin de tiempo de vida media para reacciones de primer orden
seg
seg K
t 01 . 3
23 . 0
693 . 0 693 . 0
1
2 / 1
= = =
b) la concentracin de A despus de un minuto.
| | | | ( )
( )
| | M x A
seg seg
M
t K
A
7 21 . 6
1
0
10 109 . 6 10
21 . 6
303 . 2
60 * 23 . 0
60 . 0 log
303 . 2
*
log log
= =
= = =
c) El tiempo necesario para que la concentracin de A sea 0.10 M.
| | | | ( ) ( )
seg
K
A A
t 79 . 7
23 . 0
303 . 2 * 60 . 0 log 10 . 0 log 303 . 2 * log log
0
=
=
4.4. Los datos de velocidad de descomposicin del NOCl a 100 C se indican a continuacin:
tiempo (seg.) [NOCl] M
0 0.50
10 0.36
20 0.28
30 0.23
Determine grficamente el orden de reaccin y el valor de la constante de velocidad
Al graficar ln[NOCl]vs. tiempo no se obtiene una linea recta, luego se grafica 1/[NOCl]vs. tiempo se
obtiene una linea recta de pendiente positiva asumimos entonces que el orden de la reaccion es 2 y
determinamos la pendiente por la ecuacin de pendiente de una recta.
1 1 2
10 83 . 7
0 30
2 35 . 4
1 2
1 2
=
= seg M x
x x
y y
m para una reaccin de segundo orden la pendiente
de
la recta es igual a la constante de velocidad K.
4.5 En la reaccin 2A+B C + 2 E , los datos cuando [A]
o
= 800 m mol dm-3 y [B]
o
= 200 m mol
dm
-3
son:
[B]/[B]
o
1 0,836 0,745 0,68 0,582 0,452 0,318
T (seg) 0 8000 14000 20000 30000 50000 90000
Y los datos cuando [A]o = 6,00 m mol dm-3 y [B]o = 2, 00 m mol dm
3
Aplicando Line-weaver Burk:
1 = Km . 1 + 1
o
K
2
[E]
o
[S]
o
K
2
[E]
o
Ln
[NOCl]
tiempo
(seg.)
-0.69 0
-1.02 10
-1.27 20
-1.47 30
1/[NOCl] tiempo
(seg.)
2 0
2.78 10
3.57 20
4.35 30
T= 0,5 C [E]o= 2,8.10
-9
mol dm
-3
(x) 1/ [CO2]o (m mol dm
-3
) 0,8 0,4 0,2 0,05
(y) 1/
o
(mmol dm
-3
seg
-1
) 35,71 20,83 12,5 6,66
Se grafica 1/
o
vs
1/ [CO
2
]
o
Se obtiene una recta de pendiente positiva.
1 = b b=4
K2 [E]o
K2 = . 2,8.10
-9
mol dm
-3
= 8,92.10
7
Km = m
K2.[E]o
m = Y2 Y1 = 20,83 - 35,71
X
2
X
1
0,4 - 0,8
Km = m1. K2 [E]o
Km = 37,2 . 8,92.10
7
. 2,8.10
-9
Km= 9,29
4.6.-La adsorcin del butano sobre un polvo de NiO se midi a 0C. Los volmenes de butano
a STP adsorbidos por gramo de NiO son:
P (Kpa) 7,543 11,852 16,448 20,260 22,959
V (cm
3
/g) 16,46 20,72 24,38 27,13 29,08
a) Utilizando la isoterma de BET, calclese el volumen STP adsorbido por gramo cuando
el polvo est cubierto por una monocapa P= 103,24 Kpa
b) Si el rea de la seccin transversal de una molcula de butano es 44,6x10
-20
m
2
. Cul
es el rea por gramo del polvo?
P/V(P-P) 0,00478 0,00625 0,00777 0,0089 0,0098
P/Po 0,073 0,114 0,159 0,196 0,222
m = 0,0077- 0,00625 = 0,0334 = (C-1)
0,159 0,114 Vm.C
1/Vm = b = 0,00239
(C-1) . 1 . = 0,0344 = (C-1) = 0,0344
Vm.C 0,00239
C= 0,0344 + 1 C = 15,39
0,00239
1/Vm.C = 0,00239
Vm= 1/C.0,00239 Vm = 1/15,39. 0,00239
Vm = 27,2 cm
2
/g
m = Y
2
-Y
1
= 0,009 0,0078 = 0,0324 g/cm3
X
2
-X
1
0,196-0,159
1) 1/Vm = b
2) C-1 = m
Vm.C
De 1)
3) Vm= 1/b.C
3) en 2)
C-1 = m C-1 = m
(1/b.c).c 1/b
B(C-1) = m b.c b = m
C= m+b = (0,0324+0,0023) g/cm
3
C= 15,087
b 0,0023 g/cm
3
1/Vm.c = b b.c b = m
C= m+b = (0,0324 + 0,0023 ) g/cm3 C= 15,087
b 0,0023 g/cm
3
1/Vm.c = b Vm = 1/ b.c
Vm = 1/ ( 0,0026 g/cm
3
. 13,462) = 28,57 cm
3
/g
c) A= 44,6.10
-20
m
2
A= ? (m
2
/g) R= 82,02 m
3
.atm
K.mol
= (P. Vb) N.S
R.To
= ( 1,019 atm . 28,57.10-6 m
3
/g ) . 6,02.10
23
mol . 44,6.10
-20
m
2
= 349,15 m
2
/g
( 8,2.10
-5
m
3
.atm . 273,15 K )
K.mol
4.7.- La reaccin CO
2(ac)
+ H
2
O H
+
+ HCO
3
-
, catalizada por una enzima, se
estudio en un aparato de flujo esttico a PH 7,1 y temperatura de 0,5 C. Para una
concentracin inicial de enzima de 2,8x10
-9
mol.dm
-3
, las velocidades iniciales en funcin de
| |
2
CO
son (en donde
3 0
/ 1 dm mol c
):
10
3
.
| |
2
CO
/c
1,25 2,50 5,0 20,0
10
4
.
( )
1 0
0
/
s c r
0,28 0,48 0,8 1,55
Calcule k
2
y Km a partir de un grafico Lineweaver-Burk.
SOLUCIN:
La representacin de Lineweaver-Burk viene dada por la expresin
| || | | |
0 2 0 0 2 0
1 1
E k E S k
Km
r
+ =
Donde:
0
r
: Velocidad inicial
| |
0
S
: Concentracin inicial de sustrato
| |
0
E
: Concentracin inicial de enzima
2
k
: Constante
Km
: Constante de Michaelis-Menten
Como se tienen valores de 0
r
para varios valores de
| |
0
S
y
| |
0
E
es conocida, a partir de una
representacin de 0
/ 1 r
frente a 1/
| |
0
S
se obtienen las constantes k2 y Km.
1/
| |
2
CO
800 400 200 50
1/ 0
r
35714,28 20833,33 12500,00 6451,61
y = 39,002x + 4736,5
0,0E+00
5,0E+03
1,0E+04
1,5E+04
2,0E+04
2,5E+04
3,0E+04
3,5E+04
4,0E+04
0,00E+00 1,00E+02 2,00E+02 3,00E+02 4,00E+02 5,00E+02 6,00E+02 7,00E+02 8,00E+02 9,00E+02
Del corte con la ordenada se obtiene k
2
:
| |
5 , 4736
.
1
0 2
=
E k
) . 10 8 , 2 ).( . . 5 , 4736 (
1
3 9 3 1
2
=
dm mol x s dm mol
k
1 4
2
10 54 , 7
= s x k
Y de la pendiente de la recta se obtiene Km:
| |
s
S k
Km
39
0 2
=
) 10 54 , 7 ).( . 10 8 , 2 .( 39
1 4 3 9
= s x dm mol x s Km
3 3
. 10 23 , 8
= dm mol x Km
4.8.-La enzima catalasa cataliza la descomposicin del H2O2, los datos son:
[H2O2] mol/L 0.001 0.002 0.005
Velocidad inicial
(mol/s) 0.00138 0.00267 0.006
Si la concentracin de la catalasa es 0.000000004 mol/L, determine grficamente Vmx,
Km y el nmero de inversin k2
SOLUCIN
Para resolver este problema es necesario contar con la ecuacin de Michaelli Menten escrita de
la forma siguiente:
1/Vo = km/Vmax +
1/Vmax
a partir de la cual se determina k
2
ya que,
Vmax= k
2
.[concentracin enzima catalasa]
Entonces, la Tabla de datos de la grafica es
1/[H
2
O
2
] 1000 500 200
1/[Vo] 724.6 374.5 166.7
Al graficar en Excel la tabla anterior, se traza la lnea de tendencia, para as obtener la ecuacin
de la misma. De esta, se obtiene la pendiente m (km/Vmax) y el corte en y (1/Vmax), valores
mostrados a continuacin (ver lado derecho grafica 1/Vo vs 1/H2O2.
Xo= 1000.0
yo= 724.6
m= (km/Vmax)= 0.7
700.2
b= 1/Vmax 24.4
Vmax 0.041003254
Km 0.028710958
k
2
= 10250813.59
4.9.- La mutarrotacin de la Glucosa catalizada por cidos y bases, es de primer orden
respecto a la concentracin de la glucosa cuando se emplea cido perclrico como
catalizador, las siguientes constantes de velocidad, fueron obtenidas por Bronsted y
E.A. Guggenheim a 18 C
HClO4
(mol/L) 0.001 0.0048 0.0099 0.0192 0.03 0.04
K(1/min) 0.00012 0.00013 0.00015 0.00019 0.00021 0.00025
Calcule los valores de las constantes de la ecuacin de
velocidad
SOLUCIN
La constante total (K) es de primer orden y viene dada por:
K=Ko + KH[H3O] + Ka[HAC] + KOH [OH] + Kb
[AC] (Maron y Prutton (2000)
o de manera general
K = Ko + Ki[Ci]
Cuando se emplea acido como catalizador la ecuacin se
reduce a
K=Ko + KH[H3O]
se grafican los valores de la tabla y = K ; x = [HClO4]
los valores de K para cada concentracin son
HClO4
(mol/L) 0.001 0.0048 0.0099 0.0192 0.03 0.04
K*10-4
(1/min) 0.0001532 0.00016536
0.0001816
8 0.00021144 0.000246 0.000278
b = Ko = 0.00015 m = K
H
= 0.0032
4.10Los siguientes datos corresponden a la adsorcin de CO sobre carbn vegetal a
273K. Confirme que los datos reportados siguen una isoterma de Lagmuir, determnese el
valor de la constante.
V /cm
3
10.2 18.6 25.5 31.4 36.9 41.6 46.1
P (mmHg) 100 200 300 400 500 600 700
Resolucin:
De la ecuacin:
Se hace donde es el volumen correspondiente al recubrimiento completo. La ecuacin
se convierte en:
Rearreglando se obtiene:
S , entonces
Por lo tanto, se construye la siguiente tabla:
1/V (cm
-3
) 0,09804 0,05376 0,03922 0,03185 0,02710 0,02404 0,02169
1/P (mmHg
-1
) 0,01000 0,00500 0,00333 0,00250 0,00200 0,00167 0,00143
Y la grfica 1/V vs 1/P cuyo corte de la recta a la ordenada dar y la pendiente ser
De la grfica se obtiene la expresin:
Por lo tanto el volumen correspondiente al volumen completo ser:
Y el valor de la constante b ser entonces:
; donde b=0,00976909 mmHg
-1
Para los mismos datos y aplicando la isoterma de Freudlich, cuya ecuacin es:
Y aplicando de igual manera el concepto manejado anteriormente sobre , queda
Reacomodando queda:
En cuyo caso se fijado una nueva constante:
Y aplicando el logaritmo natural se obtiene la expresin:
En este caso se grafica LnV vs LnP, obtenindose los siguientes resultados:
lnV 2,32 2,92 3,24 3,45 3,61 3,73 3,83
lnP 4,61 5,30 5,70 5,99 6,21 6,40 6,55
Se puede observar que el factor de correlacin es mucho menor que el de la isoterma de lagmuir,
por lo tanto ha de ser lagmuir la que represente mejor esta adsorcin.
S-ar putea să vă placă și
- Yogurt y ConejosDocument8 paginiYogurt y ConejosGabriel Zeballos AcuñaÎncă nu există evaluări
- Diagramas termodinámicos PVTDocument6 paginiDiagramas termodinámicos PVTRamiro Biscardi AlvarezÎncă nu există evaluări
- Problemas Rtac 2019081210Document12 paginiProblemas Rtac 2019081210Rodrigo DalenceÎncă nu există evaluări
- Seleccion Del Reactor IDocument29 paginiSeleccion Del Reactor IWalter NolascoÎncă nu există evaluări
- CSTRDocument61 paginiCSTRJimmy Hurtado ValerioÎncă nu există evaluări
- Problema-Final 1Document7 paginiProblema-Final 1Grecia Alejandra Ramirez RicoÎncă nu există evaluări
- HIDROISOMERIZACION DE n-PARAFINAS CONDocument12 paginiHIDROISOMERIZACION DE n-PARAFINAS CONErik Said Laiho0% (1)
- UTN TP - 01 Equipos de Transferencia de Calor, Simulacion Con HysysDocument3 paginiUTN TP - 01 Equipos de Transferencia de Calor, Simulacion Con HysysSthayler RamirezÎncă nu există evaluări
- Acidez y Basicidad en Los Aldehidos PDFDocument4 paginiAcidez y Basicidad en Los Aldehidos PDFcarlos kantunÎncă nu există evaluări
- Balance de MateriaDocument23 paginiBalance de MateriaDaniel Moroco RiveraÎncă nu există evaluări
- Reactor Tubular Oficial 02-07Document50 paginiReactor Tubular Oficial 02-07Flor Andrea Linares VasquezÎncă nu există evaluări
- ProyectoDocument20 paginiProyectoDaniela VanegasÎncă nu există evaluări
- Deber FoglerDocument7 paginiDeber FoglerDanny LemaÎncă nu există evaluări
- Medición de La Difusividad de Gases en Aceites PesadosDocument6 paginiMedición de La Difusividad de Gases en Aceites PesadosDaniel MediÎncă nu există evaluări
- Lecho Empacado Practica No 1Document19 paginiLecho Empacado Practica No 1Sebastián Cabrera SegoviaÎncă nu există evaluări
- Polimerizaciones EspecialesDocument66 paginiPolimerizaciones EspecialesEdward Ernesto Asencios BuriackÎncă nu există evaluări
- Resolución Del Taller OrgánicaDocument22 paginiResolución Del Taller OrgánicaCarmen MesirowÎncă nu există evaluări
- LixiviaciónDocument5 paginiLixiviaciónValeria PunzoÎncă nu există evaluări
- Cortes de Petróleo: Análisis y CaracterizaciónDocument2 paginiCortes de Petróleo: Análisis y CaracterizaciónLaura Torres100% (1)
- Hoffman-Lecture Nobel, Analogia Isolobal - En.es TraducciónDocument33 paginiHoffman-Lecture Nobel, Analogia Isolobal - En.es TraducciónAnonymous jMZOOysÎncă nu există evaluări
- 8-Agl-Bme-2022-Guia D-2 - Prob. 8Document3 pagini8-Agl-Bme-2022-Guia D-2 - Prob. 8carlos marroquinÎncă nu există evaluări
- Trabajo CumenoDocument11 paginiTrabajo CumenoAnonymous zhDyxFqeZÎncă nu există evaluări
- Acido Acetico-1Document22 paginiAcido Acetico-1Anthony Quispe CarbajalÎncă nu există evaluări
- 02 Guión Práctica 2. ENSAYOS DE DUREZA Y DE IMPACTO 2018Document13 pagini02 Guión Práctica 2. ENSAYOS DE DUREZA Y DE IMPACTO 2018cassyÎncă nu există evaluări
- Transferencia de Masa - BSLN - 4T1QDocument9 paginiTransferencia de Masa - BSLN - 4T1QyolandaÎncă nu există evaluări
- Analisis de Reemplazo, Sensibilidad e InflacionDocument20 paginiAnalisis de Reemplazo, Sensibilidad e InflacionLuis TovarÎncă nu există evaluări
- Laboratorio Virtual Ensayo de Tensión o TracciónDocument6 paginiLaboratorio Virtual Ensayo de Tensión o TracciónSebastianSierraÎncă nu există evaluări
- Segunda Serie de Equilibrio y Cinética Grupo 01 2019-1Document2 paginiSegunda Serie de Equilibrio y Cinética Grupo 01 2019-1Luigi HernándezÎncă nu există evaluări
- Extraccion Liquido-LiquidoDocument24 paginiExtraccion Liquido-LiquidoMax Lewiss Mafaldo DavilaÎncă nu există evaluări
- Tema 4.balance ElementalDocument36 paginiTema 4.balance ElementalWilsonÎncă nu există evaluări
- Guia Adsorcion 2004Document9 paginiGuia Adsorcion 2004Cristhoper MeraÎncă nu există evaluări
- Heurísticas para El Diseño de Procesos Químicos Respecto A La Materia PrimaDocument2 paginiHeurísticas para El Diseño de Procesos Químicos Respecto A La Materia PrimaCarlosÎncă nu există evaluări
- Practica 6 Precipitacion y CristalizacionDocument9 paginiPractica 6 Precipitacion y CristalizacionXiomara Ortega BetancoÎncă nu există evaluări
- Analisis Experimental Con Intercambiadores de Calor de Tubos y CorazaDocument22 paginiAnalisis Experimental Con Intercambiadores de Calor de Tubos y CorazaJavierÎncă nu există evaluări
- Cine TicaDocument18 paginiCine Ticaanthony zelada100% (1)
- Practica No 1 Propiedades Molares ParcialesDocument11 paginiPractica No 1 Propiedades Molares ParcialesArturo Dominguez AdriaoÎncă nu există evaluări
- PFR ODE45.en - Es PDFDocument4 paginiPFR ODE45.en - Es PDFMAYCON MOISES CAJIA QUISPEÎncă nu există evaluări
- Metodo Margules, Van Lar y WilsonDocument15 paginiMetodo Margules, Van Lar y WilsonCenteno Bustillos HectorÎncă nu există evaluări
- Calculo de Coeficientes de Fugacidad Sustancia PuraDocument1 paginăCalculo de Coeficientes de Fugacidad Sustancia PuraNicolas NustesÎncă nu există evaluări
- Grados de Libertad HenleyDocument7 paginiGrados de Libertad HenleyDavid M GaytanÎncă nu există evaluări
- Ejercicio 2b222Document7 paginiEjercicio 2b222yolandaÎncă nu există evaluări
- Taller Calculos Variables de ProcesosDocument4 paginiTaller Calculos Variables de ProcesosMaria Mercedes MontesdeOca Escobar0% (2)
- Debye HuckelDocument23 paginiDebye Huckeluli12345678Încă nu există evaluări
- Manual Herramienta - Reactor BatchDocument12 paginiManual Herramienta - Reactor BatchSebastian GaitanÎncă nu există evaluări
- Características de Los Tipos de YacimientosDocument7 paginiCaracterísticas de Los Tipos de YacimientosCriss Dave Ruiz100% (1)
- Examen 2do Parcial MNADocument2 paginiExamen 2do Parcial MNAAlfredo AzcorraÎncă nu există evaluări
- Informe Tamizado y Molienda Operaciones IIDocument12 paginiInforme Tamizado y Molienda Operaciones IIPedro MedinaÎncă nu există evaluări
- Equilibrio de Fases Condesadas - Diaz RoigDocument22 paginiEquilibrio de Fases Condesadas - Diaz RoigGauss RiverosÎncă nu există evaluări
- Apunte Tema 2Document36 paginiApunte Tema 2Pablo AlbornozÎncă nu există evaluări
- Caracterizacion, Antecedentes y Propiedades Del EstirenoDocument2 paginiCaracterizacion, Antecedentes y Propiedades Del EstirenoGeorgina MartinezÎncă nu există evaluări
- Medición Del Coeficiente de Difusión Gaseosa Mediante El Tubo de StefanDocument9 paginiMedición Del Coeficiente de Difusión Gaseosa Mediante El Tubo de StefanhitomitsukiÎncă nu există evaluări
- Diseño reactor flujo pistónDocument6 paginiDiseño reactor flujo pistónMartha Arano RosalesÎncă nu există evaluări
- Separacion Solido-LiquidoDocument22 paginiSeparacion Solido-LiquidoJOSE ANGEL CARRASCO100% (1)
- Práctica 5. CristalizaciónDocument9 paginiPráctica 5. CristalizaciónDiana R SanchezÎncă nu există evaluări
- 73534-8464-Proyecto TransversalDocument11 pagini73534-8464-Proyecto TransversalJenniÎncă nu există evaluări
- Reacción iónica efecto catalizadorDocument18 paginiReacción iónica efecto catalizadorAlejandro MartínezÎncă nu există evaluări
- Reactores PDocument68 paginiReactores PLuis ZavalaÎncă nu există evaluări
- Extracción ácido benzoicoDocument4 paginiExtracción ácido benzoicoFabian SigchaÎncă nu există evaluări
- Fisicoquímica CompendioDocument142 paginiFisicoquímica CompendioDiegoCortézÎncă nu există evaluări
- Química para escuelas pedagógicasDe la EverandQuímica para escuelas pedagógicasÎncă nu există evaluări
- QBP Carrera Químico Bacteriólogo ParasitólogoDocument5 paginiQBP Carrera Químico Bacteriólogo ParasitólogoYaquelin Hinojosa BalderasÎncă nu există evaluări
- LajitDocument3 paginiLajitFrancisco PortillaÎncă nu există evaluări
- Tres Aportes Educacion Popular Latinoamericana Pedagogia ActualDocument11 paginiTres Aportes Educacion Popular Latinoamericana Pedagogia ActualJose Alex Moron100% (1)
- Materiales AdsorbentesDocument10 paginiMateriales AdsorbentesJulian AldanaÎncă nu există evaluări
- Medicina NuclearDocument5 paginiMedicina NuclearsandyÎncă nu există evaluări
- AlexandraDocument2 paginiAlexandraOlen MirandaÎncă nu există evaluări
- Informe de Neuropsi - ModeloDocument2 paginiInforme de Neuropsi - ModeloAldo QuevedoÎncă nu există evaluări
- Radiologia ForenseDocument20 paginiRadiologia ForenseAlejandro Linares71% (7)
- Folleto El Plan de Salvacion - DDocument24 paginiFolleto El Plan de Salvacion - Dkittys201Încă nu există evaluări
- Láminas 1º Cónica 2018 PDFDocument21 paginiLáminas 1º Cónica 2018 PDFestherÎncă nu există evaluări
- Toolkit para Agentes de Cambio - Mov-2811 PDFDocument110 paginiToolkit para Agentes de Cambio - Mov-2811 PDFAlejandra BedoyaÎncă nu există evaluări
- Sistemas de Casas-SignoDocument7 paginiSistemas de Casas-SignoEzequiel SanchezÎncă nu există evaluări
- ProblemarioDocument17 paginiProblemarioQuique OrozcoÎncă nu există evaluări
- 7.prueba de PotenciometríaDocument3 pagini7.prueba de PotenciometríaGyse LemaÎncă nu există evaluări
- RamosNaravez MarthaLeticia M2S1AI1Document6 paginiRamosNaravez MarthaLeticia M2S1AI1Martha Leticia Ramos NarvaezÎncă nu există evaluări
- LecturaDocument15 paginiLecturaJerry Escobar Pinto0% (1)
- Libro de Comprensión LectoraDocument66 paginiLibro de Comprensión LectoraAndrea Silva Inostroza0% (1)
- Novela RegionalistaDocument13 paginiNovela RegionalistasakriÎncă nu există evaluări
- Crítica Al Fundamento de La Complicidad en El Delito Establecido en La Casación #367-LambayequeDocument9 paginiCrítica Al Fundamento de La Complicidad en El Delito Establecido en La Casación #367-LambayequeBranko YvancovichÎncă nu există evaluări
- Autoevaluación2017 BuenaDocument2 paginiAutoevaluación2017 Buenarodrifis1000100% (1)
- Antecedentes Del HumanismoDocument3 paginiAntecedentes Del HumanismoAlejandro León50% (2)
- Accion Psicosocial y FamiliaDocument10 paginiAccion Psicosocial y FamiliaMireya Orjuela MartinezÎncă nu există evaluări
- Resumen Capitulo 1 y 2 CengelDocument3 paginiResumen Capitulo 1 y 2 CengelHerald LopezÎncă nu există evaluări
- Practica #1 Matemática AplicadaDocument3 paginiPractica #1 Matemática AplicadaNatt GutiérrezÎncă nu există evaluări
- Carta de Compromiso 5to SecDocument3 paginiCarta de Compromiso 5to SecJorge Alejandro Cano BellidoÎncă nu există evaluări
- Concepto y Elementos Del MemorandumDocument6 paginiConcepto y Elementos Del MemorandumAngelXtÎncă nu există evaluări
- Terremoto de Cariaco Trabajo OriginalDocument25 paginiTerremoto de Cariaco Trabajo OriginalJose SalazarÎncă nu există evaluări
- Iniciativa Mundial Sobre Tendencias de La Lactancia Materna - Wbti Cuestionario ExplicadoDocument70 paginiIniciativa Mundial Sobre Tendencias de La Lactancia Materna - Wbti Cuestionario ExplicadoAlexei OchoaÎncă nu există evaluări
- S2 Sesion 3Document14 paginiS2 Sesion 3DiegoÎncă nu există evaluări
- REGLAS ORTOGRÁFICAS PARA DISTINGUIR SIGNIFICADOSDocument27 paginiREGLAS ORTOGRÁFICAS PARA DISTINGUIR SIGNIFICADOSlarucaÎncă nu există evaluări