Documente Academic
Documente Profesional
Documente Cultură
Acide Base Exercices
Încărcat de
chaari abdelouahadDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Acide Base Exercices
Încărcat de
chaari abdelouahadDrepturi de autor:
Formate disponibile
Exercice 1
Le pH d'une solution aqueuse d'acide thanoque de concentration c=2,0.10
-3
mol.L
-1
est gal 3,9.
1. L'acide thanoque est-il un acide partiellement ou totalement dissoci dans leau ? J ustifier votre rponse.
2. Ecrire l'quation de la raction de cet acide avec l'eau.
3. Dterminer le taux d'avancement final de cette raction ; en dduire la constante de raction
Exercice 2
On examine dans cet exercice la prcision que l'on peut attendre sur la dtermination de la concentration des
ions oxonium [H
3
O
+
] en solution aqueuse lorsqu'on utilise un ph-mtre donnant deux dcimales (deux chiffres
aprs la virgule).
On mesure le pH d'une solution acide et on trouve: pH=4,30 0,05 (l'incertitude pH=0,05 est donne par le
constructeur).
1. Calculer la concentration molaire en ions oxonium.
2. valuer l'encadrement de la concentration en ions oxonium.
3. valuer la plus grande erreur que l'on peut faire sur cette concentration.
4. En dduire la prcision sur la dtermination de la concentration des ions oxonium ralise l'aide de ce pH-
mtre.
Exercice 3
On introduit une masse m=8,0g de phosphate de calcium solide dans un volume V=50,0mL d'eau distille.
Aprs agitation, on obtient une solution sature et il reste une masse m'=0,7g de ce solide non dissout.
1. Donner l'quation de la raction de dissolution du phosphate de calcium dans l'eau.
2. Dterminer la quantit de matire initiale de phosphate de calcium introduite dans l'eau.
3. Dresser le tableau d'avancement de la raction.
4. Dterminer l'avancement final de la transformation.
5. Dterminer le taux d'avancement final de la raction.
6. Calculer la concentration molaire finale des ions phosphate et des ions calcium.
Donne: la formule du phosphate de calcium est : Ca
3
(PO
4
)
2
.
Exercice 4
On dissout un comprim d'aspirine (note AH dans la suite) de masse m=500mg dans un volume V=100mL
d'eau distille. La mesure du pH de la solution obtenue donne pH=2,6.
1
1. Ecrire l'quation de la raction acido-basique entre l'aspirine et l'eau.
2. Dterminer la concentration finale des ions oxonium H
3
O
+
dans la solution.
3. Dterminer la quantit de matire d'aspirine initiale contenue dans un comprim, sachant que la masse
molaire est M=180g.mol
-1
.
4. Dresser le tableau d'avancement de la raction de l'aspirine avec l'eau.
5. Dterminer l'avancement final de la transformation.
6. Dterminer la concentration molaire de l'aspirine l'quilibre.
Exercice 5
A 20C la solubilit dans l'eau de l'acide pentanoque, de formule CH
3
CH
2
CH
2
CH
2
COOH (ou
C
4
H
9
COOH), est t=20g.L
-1
.
On prpare V=100mL d'une solution sature de cet acide. Son pH est 2,5.
1. Donner l'quation de la raction de cet acide avec l'eau.
2. Calculer la solubilit de l'acide pentanoque, 20C, en mol.L
-1
.
3. Dresser le tableau d'avancement de la raction de l'acide avec l'eau.
4. Dterminer l'avancement final de cette raction.
5. Dterminer le taux d'avancement final de ce systme.
Exercice 6
Le pentachlorure de phosphore PCl
5
est un gaz qui se dcompose en donnant du trichlorure de phosphore PCl
3
et du dichlore.
1. Donner l'quation de la raction de cette transformation.
2. Soit un tat initial du systme compos de 8,7.10
-3
mol de pentachlorure de phosphore et de 0,298mol de
trichlorure de phosphore. L'tat final contient, entre autres, 2,00.10
-3
mol de dichlore.
a. Dresser le tableau d'avancement de la raction.
b. Dterminer la composition du systme dans l'tat final.
c. Dterminer le taux d'avancement final de la transformation.
Exercice 7
Dans cet exercice, on se propose d'tudier l'influence de la dilution d'une solution d'acide sur le taux
d'avancement final de sa raction avec l'eau. On considre d'abord une solution aqueuse d'acide faible (acide
thanoque) de concentration c
1
=1,0.10
-1
mol.L
-1
. Son pH est pH
1
=2,9. On dilue cette solution 10 fois pour
obtenir une solution de concentration c
2
, son pH est alors pH
2
=3,4.
On considre ensuite une solution aqueuse d'acide fort (acide chlorhydrique) de concentration
c
3
=1,0.10
-2
mol.L
-1
. Son pH est pH
1
=2,0. On dilue cette solution 10 fois pour obtenir une solution de
concentration c
4
. Son pH est alors pH
2
=3,0.
1. Dterminer le taux d'avancement final
1
de la raction de l'acide thanoque avec l'eau dans la solution de
concentration c
1
.
2. Dterminer le taux d'avancement final
2
de la raction de l'acide thanoque avec l'eau dans la solution de
concentration c
2
.
3. Quel est l'influence de la dilution d'une solution d'acide faible sur le taux d'avancement final de la raction de
cet acide avec l'eau?
4. Dterminer le taux d'avancement final
1
de la raction de l'acide chlorhydrique avec l'eau dans la solution de
concentration c
3
.
5. Dterminer le taux d'avancement final
2
de la raction de l'acide chlorhydrique avec l'eau dans la solution de
concentration c
4
.
6. Quel est l'influence de la dilution d'une solution d'acide fort sur le taux d'avancement final de la raction de
cet acide avec l'eau?
2
Exercice 8
1. On prpare une solution aqueuse S
1
de chlorure d'hydrogne de concentration c
1
=1,0.10
-2
mol.L
-1
. La
conductivit de cette solution est
1
=0,43S.m
-1
.
a. Donner l'quation de la raction du chlorure d'hydrogne avec l'eau.
b. Donner l'expression de la conductivit
1
de la solution S
1
en fonction des conductivits
molaires ioniques et des concentrations des ions prsents dans la solution.
c. Dterminer, alors, les concentrations des ions en solution.
d. Que peut-on en conclure quant la raction du chlorure d'hydrogne avec l'eau?
2. On prpare une solution aqueuse S
2
d'acide thanoque de concentration c
2
=1,0.10
-2
mol.L
-1
. La conductivit
de cette solution est
2
=1,6.10
-2
S.m
-1
.
a. Donner l'quation de la raction de l'acide thanoque avec l'eau.
b. Donner l'expression de la conductivit
2
de la solution S
2
en fonction des conductivits
molaires ioniques et des concentrations des ions prsents dans la solution.
c. Dterminer, alors, les concentrations des ions en solution.
d. Que peut-on en conclure quant la raction de l'acide thanoque avec l'eau?
e. Dterminer la constante d'quilibre associe l'quation de la raction de l'acide thanoque avec
l'eau.
Donnes: les conductivits molaires ioniques sont exprimes en S.m
2
.mol
-1
(H
3
O
+
)=34,97.10
-3
; (Cl
-
)=7,63.10
-3
;(CH
3
COO
-
)=4,09.10
-3
Exercice 9
On dissout une masse m=0,44g d'acide ascorbique (vitamine C), de formule C
6
H
8
O
6
dans un volume d'eau
V=500mL.Le pH de la solution obtenue est pH=3,2.
1. Calculer la concentration molaire en solut apport de la solution d'acide ascorbique.
2. Donner l'quation de la raction de l'acide ascorbique avec l'eau.
3. Dresser le tableau d'avancement de cette raction et dterminer l'avancement maximal.
4. En utilisant la valeur du pH de la solution, dterminer l'avancement final de la raction.
5. En dduire si la raction considre correspond une transformation totale ou un quilibre et dterminer le
taux d'avancement final.
6. Dterminer la constante d'quilibre de la raction.
Exercice 10
On tudie une solution aqueuse d'acide fluorhydrique (HF), de volume V=500mL et de concentration molaire
en solut c=2,0.10
-2
mol.L
-1
. Son pH est 2,5.
1. Ecrire l'quation de la raction de l'acide fluorhydrique avec l'eau.
2. Donner l'expression de la constante d'quilibre de la raction.
3. Dterminer la quantit de matire initiale de fluorure d'hydrogne et dresser le tableau d'avancement de la
raction.
4. Dterminer la composition du systme lorsque l'avancement est x=1,0.10
-3
mol.
5. Dterminer alors le quotient de raction Qr.
6. Calculer la constante d'quilibre.
7. Le systme est-il l'quilibre lorsque x=1,0.10
-3
mol? J ustifier la rponse.
3
Exercice 11
On prpare V=50,0mL d'une solution aqueuse en mlangeant n
1
=2,50.10
-3
mol d'acide mthanoque et
n
2
=5,00.10
-3
mol d'thanoate de sodium.
A l'quilibre, la conductivit de la solution obtenue est =0,973S.m
-1
.
1. Donner l'quation de la raction entre l'acide mthanoque et les ions thanoate. On ne fera pas figurer les
ions sodium qui ne jouent pas de rle ici, mais on en tiendra compte dans l'expression de la conductivit.
2. Dresser le tableau d'avancement de la raction.
3. tablir alors une relation entre les concentrations l'quilibre des ions mthanoate et thanoate.
4. tablir une expression de la conductivit en fonction de [HCOO
-
]
q
.
5. Dterminer les concentrations l'quilibre des espces prsentes dans le mlange.
6. Dterminer la constante d'quilibre.
Donnes: Les conductivits molaires ioniques sont exprimes en S.m
2
.mol
-1
.
(HCOO
-
) =5,46.10
-3
=
1
; (CH
3
COO
-
) =4,09.10
-3
=
2
; (Na
+
) =5,01.10
-3
=
3
Remarque: Dans cet exercice il faut faire trs attention aux units de mesure de volume et de concentration.
Dans le calcul de , les concentrations doivent tre exprimes en mol.m
-3
et dans le calcul de la constante
d'quilibre K, elles doivent tre exprimes en mol.L
-1
.
Exercice 12 Mlange de solution d'acide chlorhydrique et de potasse
On dispose au laboratoire des solutions suivantes :
Solution A : solution aqueuse d'acide chlorhydrique de concentration molaire C
a
.
Solution B : solution aqueuse d'hydroxyde de potassium de concentration molaire C
b
.
Un volume V
a
de la solution A est obtenu en mettant en solution un volume V'
A
de chlorure d'hydrogne
gazeux. Le volume molaire gazeux est not V
m
dans les conditions de l'exprience.
Le volume V
B
de solution B est obtenu en mettant en solution une masse m
B
d'hydroxyde de potassium.
Donnes : V
A
=100 L ; V'
A
=100 L ; m
B
=11,2 g ; V
B
=10 L ; V
m
=25 L/mol.
Masse atomique ( g/mol) K=39 ; O=16 ; H=1.
Produit ionique de l'eau K
e
=10
-14
25C.
1. Exprimer littralement puis calculer C
A
.
2. Exprimer littralement puis calculer C
B
.
3. On mlange le tiers de V
A
au quart de V
B
.
- Ecrire les quations de mise en solution aqueuse du solide et du gaz, soluts des solutions A et B puis
l'quation bilan de la raction se produisant dans le mlange.
- Dfinir l'quivalence acido-basique. Le mlange est-il l'quivalence ? J ustifier.
- Ce mlange 25c est-il acide ou basique ? J ustifier.
4
4. Mlangeons cette fois un volume V
1
de la solution A et un volume V
2
de la solution B tels que :
V
2
= x V
1
et que le pH du mlange soit 12 25C.
- Calculer x.
- Dans le cas de cette dernire prparation quel est le plus grand volume de mlange possible ?
5
Exercice 13 Dosage d'un produit caustique
Deux lves de terminale, Antoine et Sophie disposent d'une solution commerciale d'un produit caustique, une
solution d'hydroxyde de sodium S
a
portant les indications suivantes :
Densit d=1,03 ; pourcentage massique en hydroxyde de sodium : 15 %.
Ils se proposent de doser cette solution en ralisant un suivi pH mtrique de la raction entre l'acide fort (l'acide
nitrique HNO
3
) et cette solution. Il reste leur charge l'laboration d'un protocole exprimental.
Pour les questions 3 7 on prendra la valeur C
0
= 4 mol/L
1. Ecrire l'quation bilan de la raction de dosage qu'ils veulent utiliser.
2. Sophie affirme" la concentration molaire volumique de cette solution d'hydroxyde de sodium vaut
environ 4 mol/L". - -
Dterminer prcisment cette concentration volumique C
0
. H=1 ; O=16 ; Na=23 g/mol
3. Antoine dit " il vaudrait mieux diluer cette solution avant de la doser"
- Pourquoi est-ce ncessaire ?
- Ils choisissent de la diluer 50 fois, ils obtiennent une nouvelle solution appele S
b
. Rappeler les
prcautions prendre lors de cette dilution.
- Dterminer la concentration C
b
.
4. Les lves dcident de doser un volume V
b
=10 mL de S
b
. Ils disposent d'une solution d'acide nitrique
S
a
de concentration C
1
=0,8 mol/l, d'une burette gradue de 25 mL, d'un bcher de 100 mL, d'un
agitateur magntique, d'un pHmtre.
- Faire un schma lgend du montage.
- Sophie dclare " en utilisant une telle solution d'acide nitrique, on ne russira pas dterminer de
faon prcise le point quivalent par suivi pHmtrique ".
J ustifier en calculant le volume V
1
d'acide vers l'quivalence, la dclaration de Sophie.
5. Ils dcident alors de diluer S
a
. Pour cela ils disposent pour prlever la solution mre d'une pipette jauge
de 15 mL et pour obtenir la solution fille, d'une fiole jauge de 200 mL ou une autre de 500 mL. Ils ne
sont autoriss utiliser qu'une seule fois la pipette.
- Dterminer pour les deux dilutions possibles les nouvelles concentrations C
a
et C'
a
.
6. Prvoir pour chacune des solutions d'acide dilu le volume d'acide l'quivalence ainsi que le pH
l'quivalence. En dduire que l'une des deux dilutions est rejeter. Pourquoi ?
7. Antoine au moment de commencer les manipulations fait la rflexion suivante " je ne peux pas utiliser
l'agitateur magntique, il n'y a pas assez de liquide, le turbulent percute la sonde ".
Sophie : " alors rajoute suffisamment d'eau"
Antoine " Tu n'y pense pas, cela va fausser le dosage "
Sophie " mais non le volume l'quivalence ne sera pas modifi "
Qui a raison et pourquoi ?
Exercice 14 Comparaison de solution
On considre trois solutions aqueuses de mme pH =2,7. La premire est une solution d'acide mono
chlorothanoque de concentration 5 10
-3
mol/L, la seconde une solution d'acide thanoque de concentration
0,25 mol/L et la troisime une solution d'acide chlorhydrique de concentration 2 10
-3
mol/L.
1. Ecrire les formules semi dveloppes de l'acide mono chlorothanoque et de l'acide thanoque.
2. Calculer la concentration molaire volumique des ions H
3
O
+
dans chacune des trois solutions acides.
3. A partir des rsultats prcdents et en justifiant votre rponse, classer par force croissante ces trois
acides.
4. Calculer le pKa du couple correspondant l'acide mono chlorothanoque.
5. Le pKa du couple correspondant l'acide mthanoque a pour valeur 4,8.
- Le classement effectu en 3/ est-il en accord avec les valeurs des pKa des couples acide/base ? J ustifier
la rponse.
6
- Donner la formule dveloppe de l'acide mono chlorothanoque et prciser l'influence de la prsence
de l'atome de chlore dans la molcule sur les proprits acides de cette molcule.
Exercice 14 Solutions commerciales
Un flacon d'acide sulfurique concentr porte les indications :1 L ; H
2
SO
4
; masse molaire 98 g/mol ;
pourcentage massique 95%; densit d=1,84.
1. Dtailler le calcul conduisant la valeur approximative Cc =18 mol.L
-1
de la concentration molaire de
la solution commerciale.
2. A partir de cette solution commerciale, vous devez prparer 2 L de solution d'acide sulfurique 0,1
mol.L
-1
. Quel volume Vc de la solution commerciale allez-vous prlever ?
3. Quelle est la verrerie ncessaire pour raliser cette dilution ?
4. On dose par conductimtrie 10 mL de cette solution dilue avec une solution titre 0,1 mol.L
-1
d'hydroxyde de sodium.
- Quelle est la grandeur lectrique mesure par un conductimtre ? Prciser son unit.
- En l'absence de conductimtre, quel circuit lectrique faut-il raliser ? Le schmatiser.
- Tracer l'allure de la courbe de ce dosage conductimtrique. Prciser les grandeurs mesures le long des
axes et indiquer la valeur du volume atteint l'quivalence.
Exercice 15 Dosage de l'acide lactique
Masse molaire de l'acide lactique : 90 g/mol
Couples acide base de l'eau H
2
O / HO
-
: pKa =14 ; H
3
O
+
/ H
2
O pKa =0.
Sous l'action de ferments lactiques, le lactose du lait se transforme progressivement en acide lactique
CH
3
-CHOH-COOH.
1. Ecrire la formule semi dveloppe de cet acide, puis encadrer et nommer les groupes fonctionnels
prsents dans la molcule.
2. La molcule est-elle chirale ? J ustifier la rponse. Dans l'affirmative reprsenter dans l'espace les deux
nantiomres.
3. Moins le lait est frais, plus il contient d'acide lactique. On se propose de doser l'acide lactique prsent
dans un lait qui n'a subit aucun traitement, par une solution aqueuse d'hydroxyde de sodium (soude) de
concentration C
b
=0,05 mol/L. On verse un volume V
a
=20 mL de lait frais dans un bcher et on suit
l'volution du pH lors d'une addition progressive de solution de soude.
V soude
(mL
0 2 4 6 8 10 11 11,5 12 12,5 13 14 16
pH 2,9 3,2 3,6 3,9 4,2 4,6 4,9 6,3 8 10,7 11 11,3 11,5
- Quelle verrerie faut-il utiliser pour mesurer les 20 mL de lait et pour additionner progressivement la
solution de soude ?
4. Tracer sur une feuille de papier millimtr le graphe de la variation du pH en fonction du volume de
soude ajout. On adoptera l'chelle suivante : 1 cm correspondant 1 mL en abscisse, 1 cm
correspondant une unit de pH en ordonne.
- En dduire par une construction graphique d'usage les coordonnes du point d'quivalence, la valeur
du pKa de l'acide lactique.
5. Ecrire l'quation bilan de la raction qui se produit lors du mlange de la solution d'acide lactique et de
la soude.
- Calculer la constante Kr de cette raction. Cette raction peut-elle tre considre comme totale ?
J ustifier.
- Calculer la masse d'acide lactique dans un litre de lait.
6. Dans l'industrie alimentaire, l'acidit du lait s'exprime en degr Dornic, not D. Un degr Dornic
correspond l'acidit qu'apporterait la prsence de 0,1 g d'acide lactique dans un litre de lait. Un lait
frais a une acidit comprise entre 15 et 18D. Le lait tudi peut-il tre considr comme frais ?
Exercice 16 Comprim contenant de la vitamine C
Donnes : acide ascorbique C
6
H
8
O
6
, acide faible not HA
Ion ascorbate, base conjugue de l'acide ascorbique not A
-
. pKa du couple AH/A
-
: 4,1 25C
Masse molaire en g/mol : acide ascorbique : 176 ; ascorbate de sodium : 198.
Delphine prend un comprim de "500 mg" de vitamine C. Elle sait que la vitamine C est l'acide ascorbique.
Dosage :
Elle dcide de procder un dosage par une solution de soude ou hydroxyde de sodium pour vrifier
l'indication de masse de l'acide ascorbique. Elle prpare tout d'abord un volume V
0
=200 mL de solution
aqueuse avec la totalit du comprim. Soit S la solution obtenue.
1. Ecrire l'quation bilan de la raction qui a lieu entre une solution d'acide ascorbique et une solution de
soude.
2. En dduire l'expression de la constante K
r
puis calculer la valeur de cette constante.
3. J ustifier l'utilisation de cette raction pour le dosage.
4. Dfinir en une phrase l'quivalence acido-basique.
5. Delphine procde au dosage pHmtrique d'un volume V=50 mL de la solution S par une solution de
soude de concentration C
b
=0,02 mol/L.
- En dduire la valeur de la concentration C en acide ascorbique de la solution S puis la valeur de la
masse d'acide ascorbique prsent dans le comprim.
Euh ??
Interprtation :
Delphine s'tonne de la valeur de la masse obtenue. Elle dcide alors de lire plus attentivement la notice. Elle y
trouve les renseignements suivants : Vitamine C tamponne, acide ascorbique : 247 mg, ascorbate de sodium :
284 mg, acide ascorbique total : 500 mg. Elle constate donc la prsence simultane dans le comprim des deux
formes acide et base conjugue du couple AH/A
-
.
1. Calculer partir des indications de la notice, les quantits (mol) d'acide ascorbique et d'ion ascorbate
prsents dans le comprim.
2. On admet que les quantit d'acide ascorbique et d'ion ascorbate prsents l'quilibre chimique dans la
solution obtenue sont les mmes que dans le comprim.
- Ecrire la relation liant le pH de la solution au pKa du couple et en dduire la valeur prvisible du pH
de la solution S. La comparer avec la valeur exprimentale donne par la courbe.
- Quelles sont les proprits de cette solution ?
7
3. Sachant que le pH l'intrieur de l'estomac est voisin de1, indiquer quelle est la forme prdominante du
couple HA/A
-
dans l'estomac.
- J ustifier par le calcul, l'indication "acide ascorbique total : 500 mg" porte par la notice.
Exercice 17 Les antiacides
Donnes :
formule pKa
H
3
O
+
/H
2
O 0
CO
2
, H
2
O/HCO
3
-
6,4
HCO
3
-
/CO
3
2-
10,3
H
2
O/HO
-
14
Lacide chlorhydrique dans l'estomac : Lensemble des scrtions gastriques constitue le suc gastrique. Parmi
celles-ci, le mucus, l'acide chlorhydrique et le pepsinogne ont un rle particulier dans la digestion des
aliments. La forte acidit du suc gastrique (pH=1 2) est donne par l'acide chlorhydrique. Un deux litres
d'acide chlorhydrique peuvent tre produits chaque jour.
1. L'acide chlorhydrique peut tre produit en laboratoire par la dissolution du chlorure d'hydrogne dans
l'eau
-Ecrire l'quation de la raction entre le chlorure d'hydrogne et l'eau.
-Pourquoi l'acide chlorhydrique en solution est-il qualifi d'acide fort ?
2. L'acide chlorhydrique dans l'estomac peut tre considr comme une solution d'acide dilu. Rappeler
l'expression du pH d'une solution d'acide fort dilu en fonction de sa concentration. Dans quelles limites
de concentration cette relation est-elle applicable ?
L'effet des antiacides sur l'hyperacidit et leur composition chimique : Pour contrecarrer la surproduction
d'acide chlorhydrique, on intgre des mdicaments appels antiacides qui neutralisent le surplus d'acide. Ils
sont forms de substances basiques.
1. Donner la dfinition d'une base de Bronstd.
2. L'effet des antiacides se manifeste sur le surplus d'acidit de l'estomac afin de maintenir le pH entre 1 et
2. Ces antiacides doivent tre lgrement basiques pour empcher la neutralisation totale. On considre
un antiacide particulier, l'Alka Seltzer, form essentiellement d'hydrognate de sodium (bicarbonate de
sodium) NaHCO
3
. Cette substance est aussi secrte par des cellules de la membrane stomacale pour
abaisser l'acidit.
- Ecrire l'quation de la dissolution du bicarbonate de sodium solide en milieu aqueux.
3. Le principal inconvnient caus par l'utilisation de ce sel est le dgagement de gaz carbonique dans
l'estomac. On avale un verre d'eau contenant le sachet dissout.
- Ecrire l'quation de la raction prpondrante qui se produit au niveau de l'estomac, en la justifiant.
- Calculer la constante d'quilibre de cette raction et en dduire que celle-ci est quantitative.
4. L'Alka Seltzer solide contient en plus de l'hydrognocarbonate de sodium, de l'acide actylsalicylique
CH
3
COO-C
6
H
4
-COOH / ion actylsalicylate : pKa =3,5.
- Donner la formule semi dveloppe de la base conjugue de cet acide actylsalicylique.
- Dans la suite ce couple sera not AH/A
-
. Lorsqu'on dissout un comprim d'Alka Seltzer dans l'eau, les
espces HCO
3
-
et AH sont prsentes dans la solution. Qu'observe-t-on ? J ustifier.
8
9
Exercice 18 Acide benzoque- ion benzoate
La solubilit s dans l'eau d'une substance la temprature t est la masse maximale de substance que l'on peut
dissoudre dans un litre d'eau cette temprature t. Elle s'exprime en g /L.
Acide benzoque : C
6
H
5
COOH solide blanc aspect soyeux ; monoacide faible peu soluble dans l'eau (3g/L 25
C) ; masse molaire : 122 g/mol ; conservateur alimentaire utilis dans les boissons rafrachissantes sans alcool
(code E 210).
Benzoate de sodium : C
6
H
5
COONa solide ionique blanc ; masse molaire 144 g/ mol ; solubilit dans l'eau 25
C : 650 g/L
Valeur du pKa du couple acide benzoque / ion benzoate : pKa =4,2.
Zone de virage du rouge de crsol [7,2 ; 8,8] ; jaune en milieu acide; rouge en milieu basique.
Partie 1 :
1. Ecrire l'quation bilan de la raction entre l'acide benzoque et l'eau.
2. Donner, dans le cas gnral, l'expression de la constante d'acidit ; en dduire les domaines de
prdominance dans le cas de l'acide benzoque et de sa base conjugue ; les reprsenter sur une chelle
de pH.
3. Sur l'tiquette d'une bouteille de soda, on note la prsence du conservateur E 210. On mesure le pH pour
la boisson : pH =3,5. En dduire le rapport [C
6
H
5
COOH] / C
6
H
5
COO
-
]
Partie 2 :
1. On met disposition la verrerie suivante :
- bchers de 50, 100 et 250 mL ; prouvettes gradues de 50, 100 et 200 mL ; pipettes jauges de 5, 10
et 20 mL ; fioles jauges de 50, 100 et 200 mL
On se propose de prparer une solution S de benzoate de sodium de concentration C=0,2 mol/L partir
d'une solution S
0
de benzoate de sodium de concentration C
0
=0,5 mol/L.
- Comment procder ? ; nommer la verrerie utilise.
2. A 10 mL de la solution S on ajoute un peu d'acide chlorhydrique concentr. On note l'apparition d'un
prcipit blanc.
- Ecrire l'quation bilan de la raction mise en jeu.
- Calculer la constante de la raction et conclure.
- Prciser le nom du prcipit et justifier qualitativement sa formation.
Partie 3 :
On se propose de dterminer la solubilit de l'acide benzoque 25 C. On pse environ 0,4 g d'acide benzoque
et on l'introduit dans un bcher contenant environ 100 mL d'eau distille. Aprs quelques minutes d'agitation,
de petits grains restent en suspension. Une filtration permet d'obtenir la solution sature en acide benzoque de
concentration C
A
.
On introduit dans un erlenmeyer V
A
=10 mL de cette solution ; on y ajoute quelques gouttes de rouge de crsol
et on dose par une solution d'hydroxyde de sodium (soude) de concentration C
B
=0,01 mol/L. Le rouge de
crsol change de couleur pour un volume de soude ajout de 19,6 mL.
1. Pourquoi reste-t-il des "grains en suspension" dans le mlange prpar avant filtration ?
2. Faire un schma annot du dispositif exprimental utilis lors du dosage.
3. Prciser les changements de couleur observs.
4. Ecrire l'quation bilan de la raction de dosage.
5. Dfinir l'quivalence de cette raction et en dduire la concentration C
A
de la solution d'acide
benzoque.
6. Calculer la valeur de la solubilit s de l'acide benzoque.
Exercice 19 Dioxyde de carbone dans l'air
Le dioxyde de carbone est prsent dans l'air atmosphrique raison de 0,63% en volume. Il peut ragir avec les
ions hydroxyde ; l'quation- bilan de cette raction est : CO
2
+2HO
-
-->CO
3
2-
+H
2
O
Prparation et dosages d'une solution aqueuse d'hydroxyde de sodium ou soude :
On rappelle que la soude (ou hydroxyde de sodium) a pour formule NaOH. Pour en prparer une solution
aqueuse de concentration connue, on ne dispose que d'un flacon de pastilles de soude, la masse d'une pastille
tant approximativement gale 0,1g. On commence donc par prparer une solution de concentration voisine
de 0,01mol/L ; pour connatre prcisment la concentration de la solution prpare, on ralise ensuite un
dosage.
Liste du matriel et des solutions disponibles au laboratoire :
- agitateur magntique et barreau aimant ;
- fioles jauges portant les mentions "50 mL", "100 mL", "200 mL", "1 L" ;
- pipettes jauges portant les mentions "1 mL", "5 mL", "10 mL", "20 mL" ;
- burettes gradues portant les mentions "20 mL", "25 mL", "50 mL" ;
- pipettes gradues portant les mentions "1 mL", "5 mL", "10 mL" ;
- prouvettes gradues portant les mentions "10 mL", "50 mL", "100 mL ;
- erlenmeyers et bchers portant les mentions "50 mL", "100 mL", "200 mL" ;
- poire aspirante ou pro pipette ;
- solutions d'acide chlorhydrique 1 mol/L, 0,10 mol/L, 0,010 mol/L ;
- indicateur color : phnolphtaline.
Donnes : masses molaires atomiques : M(H) =1 g/mol ; M(O) =16 g/mol ; M(Na) =23 g/mol
1. Quelle masse de soude utiliser pour prparer V =1L de concentration voisine de c =0,01 mol/L ?
2. On remarque que le laboratoire ne dispose pas de balance. Comment faire pour prparer cette solution
avec les produits et le matriel disponibles, indpendamment des conditions de scurit ?
3. Pourquoi n'a-t-on pas prpar seulement 100 mL de cette solution ? J ustifier.
4. Prciser, en justifiant la rponse quelle solution choisir dans la liste des solutions disponibles au
laboratoire, pour doser 10 mL de la solution prpare prcdemment. Dans la suite de l'exercice, on
appelle S cette solution choisie.
5. Faire le schma annot du dispositif du dosage.
6. On ralise le dosage : le volume de solution S verse l'quivalence est V. Trois jours aprs, on
s'aperoit que le rcipient contenant la solution de soude n'a pas t rebouch. On refait le dosage dans
les mmes conditions : le volume de solution verse l'quivalence est alors V' infrieur V. On dit que
la soude est carbonate : une petite quantit d'ions hydroxyde a ragi avec le dioxyde de carbone pour
donner des ions carbonate selon l'quation- bilan donne en introduction.
Sachant que le virage de l'indicateur color choisi permet de doser les ions hydroxyde provenant de la
soude et les ions carbonate forms qui se comportent comme une monobase, justifier la diminution du
volume de solution S verse l'quivalence.
Exercice 20 Farces et attrapes : la tache qui disparat...
10
Dans les magasins de farces et attrapes est propose une solution bleue, appele "encre anti-tache". Lorsque l'on
verse un peu de cette solution sur un vtement, une tache bleue apparat, mais.... disparat en quelques minutes.
Voil comment fabriquer la solution "encre anti-tache" :
- Produits et solutions ncessaires avec quelques indications
Solution de soude 1 mol/L : corrosive.
Thymophtaline : indicateur color de zone de virage : 9.3 - 10.5 ;
Constante d'acidit du coulpe associ : Ka =10
-10,3
soluble dans l'eau et l'thanol.
11
- Mode opratoire
Ajouter quelques gouttes de solution de thymolphtaline dans un mlange d'eau et d'alcool, la solution
est alors incolore.
Ajouter ensuite goutte goutte juste assez de soude de manire obtenir une solution bleue : "l'encre
anti-tache".
On admet que la solution se comporte comme une solution aqueuse.
1. La forme acide de la thymophtaline, note AH est incolore. La forme basique sera note A
-
. Placer sur
un axe gradu en pH la zone de virage de la thymophtaline. Indiquer en dehors de cette zone les
espces prdominantes.
2. Lors de la prparation de la solution, avant l'addition de la solution de soude, le pH est-il infrieur 9,3
ou suprieur 10,5 ? J ustifier la rponse.
3. Ecrire l'quation- bilan de la raction entre la thymolphtaline et la soude.
4. Exprimer la constante de cette raction. En dduire que cette raction peut tre considre comme quasi-
totale.
5. Quelle est la teinte de la forme basique de la thymolphtaline ? J ustifier la rponse.
6. Pour expliquer la disparition de la tache bleue, on peut supposer que l'vaporation de l'alcool et la
recristallisation de la thymolphtaline jouent un rle. En vous aidant de l'introduction de l'exercice (et de
la premire partie), indiquer quel autre facteur pourrait galement intervenir pour expliquer la
disparition de la tache sur le vtement ?
Exercice 21 tude de l'acide borique
L'acide borique est un antiseptique lger, peu irritant, utilis par exemple en solution aqueuse dilue dans le
"lave-oeil " que l'on trouve dans les laboratoires de chimie. L'acide borique sera considr comme un
monoacide faible. Son dosage direct par l'hydroxyde de sodium ou soude est dlicat en pH-mtrie ou avec un
indicateur color.
Par contre, en prsence d'un excs de polyol, le comportement de l'acide borique en solution aqueuse est
modifi. On reprsente par HA la molcule constitue partir de l'acide borique et du polyol. L'acide HA est un
monoacide faible.
Donnes : pKa
1
(H
3
O
+
/H
2
O) =0,0 ; pKa
2
(H
2
O/HO
-
) =14,0 ; pKa
3
(H
3
BO
3
/H
2
BO
3
-
) =9,2 ; pKa
4
(HA/A
-
) =6,5.
Tous les rsultats numriques seront exprims sous la forme 10
n
(n tant un nombre rel).
Etude de l'acide borique et de l'acide HA :
1. Ecrire l'quation-bilan de la raction, note raction (1), entre l'acide borique H
3
BO
3
et l'eau.
2. Donner l'expression littrale de la constante de la raction (1) et prciser sa valeur.
3. Cette valeur justifie-t-elle le qualificatif d'acide faible pour l'acide borique ?
4. L'acide HA est-il plus ou moins fort que l'acide borique ? J ustifier brivement.
Etude comparative des dosages :
1. Ecrire l'quation-bilan de la raction, note raction (2), entre une solution d'acide borique et une
solution de soude.
Exprimer littralement puis calculer la constante de cette raction (2).
2. Rpondre aux mmes questions que pour l'acide HA.
3. En utilisant une mme solution de soude de concentration C
b
, on ralise successivement les dosages pH-
mtriques :
- d'un volume Va d'une solution aqueuse d'acide borique de concentration C
0
;
- d'un mme volume Va d'une solution aqueuse d'acide HA de mme concentration C
0
.
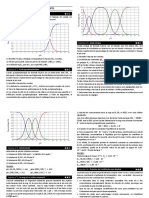
Les courbes obtenues pH =f(Vb) o Vb est le volume de soude vers, sont reprsentes sur la figure ci-
dessous.
- Pour chacune des courbes, identifier l'acide dos. La rponse doit tre justifie par deux arguments.
- J ustifier qu'en prsence de phnolphtaline on peut doser l'acide HA mais pas l'acide borique.
La zone de virage de la phnolphtaline est comprise entre pH =8,2 et pH =10,0.
- J ustifier l'utilisation du polyol pour doser l'acide borique.
12
Bleu ?
Rouge ?
J aune ?
Exercice 22 Comparaison de solutions acido-basiques
I - Premire partie : identification des solutions
1. Utilisation d'indicateurs colors
On dispose de 3 flacons A, B, C contenant chacun l'une des solutions suivantes,
de mme concentration molaire volumique C
0
, dans les 3 cas :
Solution d'acide thanoque
Solution d'hydroxyde de sodium (ou soude)
Solution d'acide chlorhydrique
On cherche identifier le contenu de chaque flacon. On dispose de tubes essais et de deux indicateurs
colors : le bleu de bromothymol [jaune 6-7,6 bleu] et l'hliantine [rouge 3,1 - 4 ,4 jaune].
On ralise des tests colorimtriques dans les tubes essais avec ces trois solutions :
BBT hlianthine
A jaune rouge
B jaune rouge
C bleu jaune
Dans quels domaines de valeurs se situe le pH de chacune des solutions ? Quelle(s) solution(s) peut-on
identifier ? Pourquoi, lors des tests, ne doit-on verser dans chaque tube que quelques gouttes de l'indicateur
color utilis ?
2. Utilisation d'un pH mtre:
a) Pour permettre d'identifier ces trois solutions, on les dilue cent fois de faon prcise et on mesure le pH des
solutions dilues. Choisir, dans la liste suivante, la verrerie pour obtenir 100 mL de chacune des solutions
dilues.
13
Burette gradue 25 mL ;
Erlenmeyers 100mL, 200mL ;
Pipette jauge 1mL, 2mL, 5mL, 10mL, 20mL ;
Bchers 100mL, 500mL;
Fioles jauges 50mL, 100mL, 500mL.
b) La mesure du pH des trois solutions dilues donne : pH
A
=2,0 ; pH
B
=2,9 ; pH
C
=12,0. Montrer comment
ces rsultats permettent d'identifier les 3 solutions A, B et C.
c) Quelle tait la concentration C
0
des solutions initiales ?
II - Deuxime partie : comparaison de deux acides faibles
On dispose de deux solutions d'acides faibles notes 1 et 2 et d'un certain nombre de renseignements concernant
chaque solution :
Solution 1 : Acide thanoque : pKa
1
=4,75 ; C
1
=3,0.10
-2
mol/L ; pH
1
=3,1
Solution 2 : Acide AH : pKa
2
=? ; C
2
=? ; pH
2
=2,9
On se propose d'effectuer des mesures qui permettent de savoir par deux mthodes diffrentes lequel de ces
deux acides est le plus fort.
1 - Premire mthode : Dtermination de C
2
.
On dose la solution 2 par une solution d'hydroxyde de sodium de concentration C
B
=2,0.10
-2
mol/L.
Le volume doser est V
2
=20,0 mL. L'quivalence est repre par le virage d'un indicateur color, la
phnolphtaline, dont on rappelle la zone de virage [incolore 8,2- 10 rose]. Le volume de solution d'hydroxyde
de sodium vers l'quivalence est V
Be
=10,0 mL.
a) Faire le schma annot du dispositif de dosage.
b) Quel changement de couleur a-t-on observ l'quivalence ?
c) crire l'quation bilan de la raction de dosage, dfinir l'quivalence et calculer C
2
.
d) Comment peut-on alors comparer la force de deux acides ?
2 Deuxime mthode : Dtermination du pKA du couple de la solution 2
20,0 mL de la solution 2, on ajoute le volume de solution d'hydroxyde de sodium ncessaire pour obtenir la
demi-quivalence. On mesure le pH et on trouve pH =3,75.
a) Quel volume de solution d'hydroxyde de sodium a-t-on vers ?
b) Que reprsente la valeur trouve du pH dans ce cas ?
c) Comment peut-on alors comparer la force des deux acides ?
Exercice 23 Lacide propanoque
L'acide propanoque C
2
H
5
-COOH appartient au couple acide base : acide propanoque/ion propanoate
pKa =4,87. L'tiquette d'un flacon contenant une solution d'acide propanoque propose deux valeurs de
concentration molaire, C
1
=0,028 mol/L et C
2
=0,03 mol/L.
1. Un oprateur teste cette solution S
1
en mesurant son pH. Le pH-mtre indique pH
1
=3,4. Cette mesure
permet-elle d'affirmer que l'acide propanoque est un acide faible ? J ustifier.
Ecrire l'quation bilan de la raction entre l'acide propanoque et l'eau.
Donner l'expression de la constante d'acidit du couple acide propanoque/ ion propanoate.
2. On ajoute la solution S
1
quelques gouttes d'une solution d'hydroxyde de sodium. Le pH prend alors la
valeur pH
2
=5,4.
Indiquer, sans calcul, quelle est l'espce du couple qui prdomine dans la solution ainsi obtenue ?
Faire l'inventaire des couples acide base qui interviennent dans la solution S
1
et dans la solution de
soude. Les classer sur une chelle des pKa.
Prvoir et crire l'quation bilan de la raction acide-base qui se produit lors du mlange de la solution
S
1
et de la solution de soude.
Calculer la constante de cette raction. La raction est-elle totale? J ustifier.
3. L'oprateur veut dterminer la concentration molaire relle de la solution S
1
. Pour cela, il introduit dans
un bcher un volume V =20 mL de la solution S
1
. Il verse progressivement dans ce bcher une solution
de soude de concentration 0,05 mol/L et relve rgulirement le pH.
Donner la dfinition de l'quivalence acido-basique.
Dterminer les coordonnes du point quivalent E.
En dduire la concentration molaire C de la solution S
1
.
A partir de la courbe, retrouver la valeur du pKa du couple acide propanoque / ion propanoate. J ustifier
la mthode.
Exercice 24 Dosage d'un vinaigre
On se propose de doser par pH-mtrie un vinaigre afin d'en dterminer la concentration molaire volumique en
acide thanoque. Pour cela, on prpare V =100 mL dune solution dilue 10 fois du vinaigre.
Puis on prlve un volume V
1
=10 mL de la solution dilue que l'on verse dans un bcher, auquel on ajoute
suffisamment d'eau distille pour immerger correctement la cellule du pH-mtre. On ralise le dosage avec une
solution d'hydroxyde de sodium de concentration molaire volumique c
2
=0,1 mol.L
-1
. Le pH est relev en
fonction du volume V
2
de solution d'hydroxyde de sodium et on obtient la courbe pH =f(V
2
).
Toutes les solutions considres sont prises 25C.
Donnes : pKa du couple CH
3
COOH / CH
3
COO
-
25 C=4,8 et pKe =14.
1. Ecrire l'quation chimique associe la transformation chimique tudie.
2. Exprimer le quotient de raction Qr de cette raction.
Quelle valeur particulire ce quotient de raction prend-il dans ltat d'quilibre du systme ? Calculer
cette valeur.
Cette valeur dpend-elle de la composition initiale du systme ?
14
3. Quelle hypothse faut-il faire sur la nature de la transformation chimique pour que la raction puisse
servir de support au dosage ?
4. Dterminer graphiquement les coordonnes du point d'quivalence.
Quelles sont les espces chimiques majoritaires l'quivalence ?
On note n
1
la quantit de matire de ractif titr initialement apport dans le bcher et n
2,q
la quantit de
matire de ractif titrant vers l'quivalence. tablir la relation liant n
1
et n
2,q
.
En dduire la concentration volumique c
1
en acide thanoque apport dans la solution dilue, puis la
concentration molaire volumique c en acide thanoque du vinaigre.
5. On se place dans la situation o on a vers un volume d'hydroxyde de sodium reprsentant la moiti du
volume vers l'quivalence.
Quelles sont les quantits d'hydroxyde de sodium et d'acide thanoque introduites ?
A l'aide d'un tableau descriptif de l'volution du systme, dterminer la quantit d'ion thanoate alors
forms, ainsi que la quantit d'acide thanoque restant dans le milieu ractionnel.
En dduire la valeur du pH en ce point.
Comparer la valeur du pH ainsi trouve avec la valeur du pH lue sur la courbe de dosage. Commenter.
Exercice 25 Quelques proprits de l'acide salycilique
L'acide salycilique est utilis dans la synthse de l'aspirine ; l'acide benzoque est un conservateur alimentaire.
A Etude de la fonction acide
On se propose partir de mesures conductimtriques de comparer les acidits de l'acide salicylique et de l'acide
benzoque.
1. Etude thorique : On dispose d'un volume V d'une solution aqueuse d'un acide HA de concentration c.
La transformation mettant en jeu la raction de l'acide HA avec l'eau n'est pas totale.
- Ecrire l'quation de la raction de HA avec l'eau.
- Dresser le tableau d'avancement du systme. Exprimer les concentrations des espces prsentes
l'quilibre en fonction de c et de la concentration en ion oxonium [H
3
O
+
]
q
. En dduire l'expression du
quotient de raction Q
r,q
en fonction de [H
3
O
+
]
q
. et c.
2. L'tude de la solution l'quilibre est effectue par conductimtrie. Exprimer la conductivit de la
solution HA l'quilibre en fonction de [H
3
O
+
]
q
et des conductivits molaires ioniques des ions
prsents.
3. Etude exprimentale : conductivits molaires ioniques 25C en S m mol
-1
.
1
=( ion oxonium) =35 10
-3
;
2
=(ion salicylate)=3,62 10
-3
.
pKa (acide salicylique / ion salicylate) =3 ; pKa (acide benzoque/ ion benzoate) =4,2.
On dispose du matriel suivant : bchers de 50, 10 et 250 mL ; prouvettes gradues de 10, 20, 50 et 100
mL ; fioles jauges de 50, 100 et 250 mL; pipettes gradues de 10 mL +ou - 0,1 mL; pipette jauge de
10 mL +ou - 0,05 mL; pipeteur.
On veut prparer une solution S de l'acide HA de concentration c=10
-3
mol/L partir d'une solution
mre S0 de concentration 10
-2
mol/L. Comment procde t-on ? Nommer la verrerie utilise.
4. Mesures de conductivit : on a effectu un ensemble de mesures de conductivit pour des solutions
d'acide salicylique et d'acide benzoque de diverses concentrations 25C.
15
c(mol/L) (Sm
-1
) [H
3
O
+
]
q
mol/L Q
r,q
-logQ
r,q
ac. salicylique 10
-3
2,36 10
-2
6,11 10
-4
9,6 10
-4
3,01
ac. salicylique 5 10
-3
7,18 10
-2
ac. salicylique 10 10
-3
10,12 10
-2
2,62 10
-3
9,3 10
-4
3,03
ac. benzoque 10
-3
0,86 10
-2
2,25 10
-4
6,53 10
-5
4,19
ac. benzoque 5 10
-3
2,03 10
-2
5,31 10
-4
6,31 10
-5
4,2
ac. benzoque 10 10
-3
2,86 10
-2
7,47 10
-4
6,03 10
-5
4,22
Complter le tableau. Prsenter les calculs sous forme littrale avant d'effectuer les applications
numriques.
A partir de valeurs de [H
3
O
+
]
q
comparer le comportement concentration gale de l'acide salicylique et
de l'acide benzoque en solution dans l'eau.
Donner la dfinition de la constante d'acidit Ka. Expliquer comment les rsultats de cette tude
exprimentale permettent de retrouver les valeurs respectives des pKa des deux acides.
B Synthse de l'aspirine :
1. Entourer et nommer les fonctions chimiques prsentes dans la formule de l'aspirine.
2. Le groupement OH de l'acide salicylique se comporte comme une fonction alcool dans la transformation
tudie.
Donner les formules semi dveloppes et les noms des espces chimiques A et B sachant qu'ils ne
contiennent pas d'autres lments que C, H et O.
Nommer cette raction chimique et citer deux de ses caractristiques.
Exercice 26 Acide hypo iodique
L'acide hypo iodique HIO appartient au couple acide base HIO / IO
-
de pKa
1
=10,6. L'ammoniac NH
3
est la base
du couple acide base NH
4
+
/ NH
3
de pKa
2
=9,2. On prpare V
1
=10 mL d'une solution aqueuse S
1
d'acide hypo
iodique de concentration c
1
=0,15 mol/L. On ajoute rapidement cette solution V
2
=5 mL d'une solution
aqueuse d'ammoniac S
2
de concentration c
2
=0,1 mol/L. On suppose que les ractions de HIO et NH
3
avec l'eau
sont ngligeables.
1. Ecrire l'quation de la raction acido-basique susceptible de se produire lors du mlange des solutions S
1
et S
2
et calculer la constante d'quilibre associe K.
2. Calculer les quantits de matire des ractifs en prsence l'tat initial.
Exprimer puis calculer le quotient de raction initial Q
r,i
.
En dduire le sens d'volution spontane du systme chimique.
3. Exprimer Q
r,q
, quotient de raction l'quilibre et donner sa valeur. Dpend-il des conditions initiales ?
4. Dresser le tableau d'avancement du systme chimique et calculer la valeur de l'avancement l'quilibre
x
q
.
16
17
Calculer le taux d'avancement final. La raction est-elle totale ?
Calculer les concentrations des espces chimiques prsentes en solution l'tat final.
Exercice 27 Acide ascorbique et hydroxyde de sodium
L'acide ascorbique, couramment dnomm vitamine C, est un rducteur naturel que l'on qualifie usuellement
d'antioxydant. On le trouve dans de nombreux fruits et lgumes. Une carence prolonge en vitamine C favorise
le scorbut. On a montr que la vitamine C peut prvenir des petits maux quotidiens tels que le rhume ainsi
qu'aider dans le traitement de certains cancers.
En pharmacie il est possible de trouver l'acide ascorbique, par exemple sous forme de comprims "de vitamine
C 500".
Pour simplifier, l'acide ascorbique, de formule brute C
6
H
8
O
6
, sera dsign par HA dans la suite de l'exercice.
Dans cette tude, on envisage la raction trs rapide entre une solution aqueuse d'acide ascorbique de
concentration molaire en solut apport C
A
=1,00 10
-2
mol.L
-1
et une solution aqueuse d'hydroxyde de sodium
de concentration molaire en solut apport C
B
=2,00 10
-2
mol.L
-1
. Le volume initial de la solution aqueuse
d'acide ascorbique est V
A
=20,0 mL et on note V
B
le volume de la solution aqueuse d'hydroxyde de sodium
verse.
1. Ecrire l'quation traduisant cette raction.
2. On tudie le mlange, 25C, lorsque l'on a vers V
B
= 5,0 mL de solution aqueuse d'hydroxyde de
sodium. Le pH du mlange est alors gal 4,0.
En dduire la concentration en ions oxonium H
3
O
+
dans ce mlange. Calculer la concentration en ions
hydroxyde dans ce mlange. En dduire la quantit n
f
(HO
-
)d'ions hydroxyde prsents l'tat final dans
ce mlange. On donne le produit ionique de l'eau 25C : Ke =1,0 10
-14
.
La transformation est-elle totale ? La raction associe cette transformation peut-elle servir de support
au dosage d'une solution aqueuse d'acide ascorbique par une solution aqueuse d'hydroxyde de sodium ?
3. Dosage colorimtrique d'un comprim de vitamine C : On crase un comprim de "vitamine C 500"
dans un mortier. On dissout la poudre dans un peu d'eau distille et on introduit l'ensemble dans une
fiole jauge de 100,0 mL ; on complte avec l'eau distille. Aprs homognisation, on obtient la
solution S. On prlve un volume V
A
= 10,0 mL de la solution S que l'on dose avec une solution aqueuse
d'hydroxyde de sodium de concentration molaire en solut apport C
B
= 2,00 10
-2
mol.L
-1
en prsence
d'un indicateur color convenablement choisi. L'quivalence est obtenue pour un volume de solution
aqueuse d'hydroxyde de sodium V
BE
= 14,4 mL.
Reprsenter un schma annot du dispositif pour raliser ce tirage.
Quel indicateur color doit-on choisir parmi les trois proposs ci-aprs ? On donne la zone de virage de
quelques indicateurs colors :
indicateur color zone de virage
rouge de mthyle 4,2 - 6,2
bleu de bromophnol 3 - 4,6
rouge de crsol 7,2 - 8,8
4. Dfinir l'quivalence.
Calculer la quantit d'acide ascorbique dans les10,0 ml de solution tire en utilisant les donnes
introductives de la question 2.
En dduire la masse en m, en mg, de l'acide ascorbique contenu dans un comprim. Expliquer
l'indication du fabricant "vitamine C 500".
On donne les masses molaires atomiques en g.mol : M(C) =12,0 ; M(H) =1,0 ; M(O) =16,0
5. Etude de la molcule de l'acide ascorbique : La formule semi dveloppe de l'acide ascorbique est la
suivante :
Les proprits acido-basiques de cette molcule sont dues l'hydrogne du groupe caractristique (ou
fonctionnel) entour par un cercle. Cette molcule possde d'autres groupes caractristiques.
A quelle famille de composs correspondent respectivement les groupes caractristiques (ou
fonctionnels) encadrs dans la formule de l'acide ascorbique et nots (1) et (2) ?
Exercice 28 Identification d'un couple acide base
Donnes :
formule pKa masse molaire de AH (g/mol)
HCOOH / HCOO
-
3,75 46
H
3
C-COOH / H
3
C-COO
-
4,75 60
HN
3
/N
3
-
4,72 43
H
5
C
2
-COOH / H
5
C
2
-COO
-
4,87 74
HClO / ClO
-
7,3 52,5
Dtermination du pKa du couple acide / base
Afin de dterminer le pKa d'un couple acide base, not AH / A
-
, on mesure le pH de solutions contenant les
deux espces conjugues de ce couple. On utilisera une solution S
1
contenant l'espce A
-
de concentration
molaire c
1
=0,1 mol/L et une solution S
2
contenant l'espce AH, de concentration c
2
=0,1 mol/L.
Avec un pHmtre, on mesure le pH de plusieurs mlanges raliss dans des bchers. V
1
reprsente le volume de
S
1
et V
2
celui de S
2
.
mlange 1 2 3 4 5 6 7 8
pH 3,8 4,2 4,5 4,7 4,9 5,1 5,4 5,8
V
1
mL 4 10 20 30 40 40 40 40
V
2
mL 40 40 40 40 30 20 10 4
1. Complter le tableau suivant :
mlange 1 2 3 4 5 6 7 8
pH
V
1
/V
2
log(V
1
/V
2
)
2. Tracer la courbe pH =f(log(V
1
/V
2
))
3. En admettant que, pour chaque mlange, [A
-
] / [AH]=V
1
/V
2
dduire de la courbe la relation qui existe
entre le pH et log ([A
-
] / [AH])
4. Ecrire l'quation bilan associe la raction entre l'acide AH et l'eau. En dduire la constante d'acidit
Ka du couple AH / A
-
puis la relation liant le pH de la solution et le pKa de ce couple.
5. Dduire des questions prcdentes une valeur approche du pKa de ce couple.
18
Identification du couple acide base :
1. Quels sont les couples acide base du tableau que l'on peut liminer l'issue de l'tude prcdente ?
2. On a pes 1,87 g d'acide AH pour raliser 250 mL de solution S
2
de concentration 0,1 mol/L.
Dterminer la masse molaire du compos HA. Identifier le couple AH / A
-
.
Exercice 29 Lacide propanoque
L'acide propanoque C
2
H
5
-COOH appartient au couple acide base: acide propanoque/ion propanoate
pKa =4,87. L'tiquette d'un flacon contenant une solution d'acide propanoque propose deux valeurs de
concentration molaire C
1
=0,028 mol/L et C
2
=0,03 mol/L.
1. Un oprateur teste cette solution S
1
en mesurant son pH. Le pH-mtre indique pH
1
= 3,4.
Cette mesure permet-elle d'affirmer que l'acide propanoque est un acide faible ? J ustifier.
Ecrire l'quation bilan de la raction entre l'acide propanoque et l'eau.
Donner l'expression de la constante d'acidit du couple acide propanoque/ ion propanoate.
2. On ajoute la solution S
1
quelques gouttes d'une solution d'hydroxyde de sodium. Le pH prend alors la
valeur pH
2
= 5,4.
Indiquer, sans calcul, quelle est l'espce du couple qui prdomine dans la solution ainsi obtenue ?
Faire l'inventaire des couples acide base qui interviennent dans la solution S
1
et dans la solution de
soude. Les classer sur une chelle des pKa.
Prvoir et crire l'quation bilan de la raction acide-base qui se produit lors du mlange de la solution
S
1
et de la solution de soude.
Calculer la constante de cette raction. La raction est-elle totale? J ustifier.
19
3. L'oprateur veut dterminer la concentration molaire relle de la solution S
1
. Pour cela il introduit dans
un bcher un volume V = 20 mL de la solution S
1
. Il verse progressivement dans ce bcher une solution
de soude de concentration 0,05 mol/L et relve rgulirement le pH.
Donner la dfinition de l'quivalence acido-basique.
Dterminer les coordonnes du point quivalent E.
En dduire la concentration molaire C de la solution S
1
.
A partir de la courbe, retrouver la valeur du pKa du couple acide propanoque / ion propanoate. J ustifier
la mthode.
Exercice 30
On simule le titrage de 20 mL d'une solution aqueuse d'un acide not AH, de concentration en solut apport
C
A
=10
-2
mol/L, par une solution de soude de concentration C
B
=0,01 mol/L. Le document ci-dessous est le
rsultat de la simulation. Le logiciel a trac simultanment :
- les variations de pH en fonction du volume de soude vers au cours du titrage.
- Les variations des concentrations molaires (en millimoles /L) de l'acide AH et de sa base conjugue
20
Oh, la la la !!!!
1. Identifier sans justification chacune des courbes reprsentes par les nombres 1, 2, 3.
2. Graduer l'axe des abscisses. Noter sur la copie la valeur de V
B
correspondant une division sur l'axe des
abscisses.
3. On tudie la solution d'acide AH avant l'addition de soude :
Ecrire l'quation chimique de la raction de l'acide AH avec l'eau et dresser le tableau d'avancement.
Calculer l'aide des courbes de simulation, le taux d'avancement final de cette raction.
Rappeler la dfinition de la constante d'acidit du couple AH / A
-
. Exprimer cette constante en fonction
du taux d'avancement final de la raction de AH avec l'eau.
Si on recommence une simulation avec une solution de concentration C
A'
suprieure C
A
la raction de
l'acide avec l'eau sera-t-elle plus ou moins avance ?
4. On tudie la raction du titrage :
Ecrire l'quation chimique de la raction de titrage.
Quelle est la valeur du pKa du couple AH / A
-
?
Etablir le tableau d'avancement de cette raction quand on a ajout 5 mL de soude.
Quel est le taux d'avancement final d'une raction de titrage ?
En dduire la concentration attendue en A
-
quand on a ajout 5 mL de soude.
21
Exercice 31 Acide base
1. L'hlianthine est un indicateur color qui met en jeu un couple acide/base du type HIn/In
-
de pKa = 3,8
25C. La zone de virage de l'hlianthine est [3,1 - 4,5]. La forme acide est rouge, la forme base
conjugue est jaune. Parmi les affirmations suivantes combien y en a t-il d'exactes ?
a) Une solution aqueuse d'hlianthine de pH=5,8 est jaune.
b) L'hlianthine peut tre utilis lors du titrage d'une solution d'acide thanoque par une solution
d'hydroxyde de sodium.
c) L'hlianthine apparat jaune en prsence d'une solution d'acide chlorhydrique obtenue par la mise en
solution de 10 mL de chlorure d'hydrogne dans 250 mL d'eau pure (volume molaire =24 L/mol)
Rappel : HCl +H
2
O-->H
3
O
+
+Cl
-
.
d) Une solution aqueuse d'hlianthine telle que 3[HIn]=[In
-
] a un pH de 3,8.
2. On dispose d'une solution d'acide chlorhydrique commerciale. Sur l'tiquette on lit : densit = 1,19 ;
pourcentage massique en chlorure d'hydrogne 36% ; masse molaire HCl : 36,5 g/mol.
Quel volume (en mL) de la solution commerciale doit-on prlever pour prparer 3L de solution
d'acide chlorhydrique 0,02 mol/L ?
5 ; 26 ; 65 ; 85 ; 96 ; 112
3. On fait ragir 10 mL d'acide sulfurique sur de la poudre d'aluminium. Il se forme 240 mL de
dihydrogne. Les couples mis en jeu sont : H
+
/ H2 et Al
3+
/ Al. Le volume molaire vaut : 24 L/mol.
Dterminer la masse (mg) d'aluminium ayant ragi :
2 ; 30 ; 75 ; 120 ; 158 ; 180.
4. On ralise le titrage de 20 mL d'une solution de dioxyde de soufre par une solution de diiode 0,08
mol/L. Il faut verser un volume de 14,2 mL de diiode pour obtenir l'quivalence. Les couples mis en jeu
sont : SO
4
2-
/ SO
2
et I
2
/ I
-
. Volume molaire = 24 L/mol.
Dterminer le volume en mL de dioxyde de soufre que l'on a dissout dans 500 mL d'eau pour
obtenir la solution prcdente.
148 ; 245 ; 432 ; 542 ; 682 ; 726.
5. On verse 14,2 g d'acide propanoque et 8,1 g de 3-mthylpentan-1-ol dans un ballon. On ajoute 2 mL
d'acide sulfurique concentr et quelques grains de pierre ponce. On effectue un chauffage reflux
pendant 50 min. On dtermine par un titrage appropri qu'il s'est form 4,8 g d'ester.
Parmi les propositions suivantes combien y en a-t-il d'exactes ?
a) La pierre ponce permet de rguler l'bullition lors du chauffage reflux.
b) L'acide sulfurique permet d'augmenter le rendement lors de la synthse de l'ester.
c) L'acide propanoque a t introduit en excs par rapport l'alcool.
d) La formule semi-dveloppe de l'ester s'crit : CH
3
-CH
2
-CH
2
-COO -CH
2
-CH
2
-CH(CH
3
)-CH
2
-CH
3
.
Exercice 32 Acide benzoque, benzoate de sodium.
La solubilit s( en g/L) dans l'eau d'une substance est la masse maximale de substance que l'on peut dissoudre
dans 1 L d'eau.
- Acide benzoque C
6
H
5
COOH, solide blanc, monoacide faible peu soluble dans l'eau; masse molaire M=122
g/mol.
- Benzoate de sodium C
6
H
5
COONa solide ionique blanc ; masse molaire M=144 g/mol
- couple acide base : C
6
H
5
COOH /C
6
H
5
COO
-
pKa =4,2.
- indicateur color: rouge de crsol : zone de virage jaune [7,2 - 8,8] rouge. Donne : 10
0,7
=5.
1. Ecrire l'quation bilan entre l'acide benzoque et l'eau.
Rappeler la dfinition de la constante d'acidit du couple acide benzoque / ion benzoate et en dduire
les domaines de prdominance.
On mesure le pH d'une solution d'acide benzoque: pH=3,5. En dduire le rapport [C
6
H
5
COOH] /
[C
6
H
5
COO
-
]
2. On se propose de prparer une solution S de benzoate de sodium de concentration c=0,2 mol/L partir
d'une solution S
0
de benzoate de sodium de concentration C
0
=0,5 mol/L. Indiquer la procdure suivre.
3. A 10 mL de la solution S on ajoute un peu d'acide chlorhydrique concentr. On note l'apparition d'un
prcipit blanc.
22
Ecrire l'quation bilan de la raction mise en jeu. Calculer la constante de raction et conclure.
Prciser le nom de ce prcipit et justifier qualitativement de sa formation.
4. On se propose de dterminer la solubilit de l'acide benzoque 25C.. On pse environ 0,4 g d'acide
benzoque et on l'introduit dans un bcher contenant 100 mL d'eau distille. Aprs quelques minutes
d'agitation, des petits grains restent en suspension. Une filtration permet d'obtenir la solution sature
en acide benzoque de concentration C
a
. On introduit un volume V
A
=10 mL de cette solution; on y
ajoute quelques gouttes de rouge de crsol et on dose par une solution de soude de concentration
C
B
=0,01 mol/L. Le rouge de crsol change de couleur pour un volume de soude vers gal 20 mL.
Expliquer la prsence de grains en suspension dans le mlange avant la filtration.
Ecrire l'quation bilan de la raction de dosage.
Dfinir l'quivalence de cette raction et en dduire la concentration molaire C
A
de la solution d'acide
benzoque.
Dterminer la valeur de la solubilit s de l'acide benzoque
Exercice 33 Conductimtrie et raction acido-basique
1. Ecrire l'quation d'autoprotolyse de l'eau et calculer la conductivit
0
de l'eau pure 25C.
2. A 25C la conductivit d'une solution aqueuse d'acide fluorhydrique de concentration c=0,1 mol/L est
= 0,324 S/m.
Ecrire l'quation de la raction entre l'acide fluorhydrique et l'eau. Donner l'expression de la constante
d'acidit K
a
correspondante.
Comparer et
0
et conclure.
Calculer le taux d'avancement , l'quilibre de la raction de l'acide fluorhydrique avec l'eau.
Quel est le pH de la solution d'acide fluorhydrique ?
Calculer le pK
a
du couple HF/ F
-
.
Donnes : conductivit molaire ionique (mS m mol
-1
). H
3
O
+
: 35 ; HO
-
: 19,9 ; F
-
:
3. Dtermination d'une constante d'acidit par conductimtrie
Conductance et conductivit sont proportionnelles G=k avec k=2,5 10
-3
m.
H3O+
=35 10
-3
S m
2
mol
-1
;
CH3COO-
=4,1 10
-3
S m
2
mol
-1
;
Dans un bcher on verse V
0
= 100 mL d'une solution d'acide thanoque de concentration apporte c
0
= 10
-3
mol/L. La conductance vaut G= 11 S.
Questions :
1. La conductance de la solution est-elle change si on modifie lun des paramtres suivants, les autres
restant identiques :
la concentration C
0
; le volume V
0
de la solution ; la temprature ? J ustifier.
2. Ecrire l'quation bilan de la raction entre l'acide et l'eau.
3. Donner l'expression du quotient de raction et en dduire l'expression de la constante d'quilibre en
fonction de x
q
, V
0
et C
0
.
4. Donner l'expression de la conductance G et en dduire une relation entre G et x
q
. Calculer x
q
en mol.
5. Calculer le taux d'avancement final. La transformation peut-elle tre considre comme totale ?
6. Calculez la constante d'acidit et le pKa du couple acide actique / ion actate.
Cette constante est-elle modifie si on utilise une solution plus dilue ? J ustifier.
Exercice 34 Ammoniac
Le pH d'une solution aqueuse S
0
d'ammoniacNH
3
de concentration apporte c
0
=0,01 mol/L vaut 10,6 25C.
1. Ecrire l'quation de la raction de l'ammoniac avec l'eau.
2. Exprimer puis calculer le quotient de raction l'tat d'quilibre Q
r,q
et le taux d'avancement final
0
.
3. A partir du systme l'quilibre on envisage diffrentes situations :
- On ajoute une pointe de spatule de chlorure d'ammonium solide.
- On ajoute une goutte d'une solution dilue d'acide chlorhydrique (sans variation de volume)
- On chauffe la solution (la solubilit du gaz volue en sens inverse de la temprature)
Prciser le sens d'volution du systme dans les trois situations.
4. On dilue 10 fois la solution S
0
prcdente et on mesure le pH de la solution dilue note S
1
:
pH=10.Calculer le taux d'avancement final
1
de la raction dans cette nouvelle solution.
- Comparer
0
1
et conclure.
Donnes : 10
-0,4
=0,4 ; 1/6 =0,17.
Exercice 35 Acide benzoque
Lacide benzoque C
6
H
5
COOH est un solide blanc 25C; sa solubilit est gale 0,02 mol/L et son pKa =4,2.
On donne C=12, H=1, O=16 g/mol. La solubilit est la quantit maximale d'acide que l'on peut dissoudre dans
un litre d'eau.
1. Parmi les affirmations suivantes lesquelles sont fausses ?
a- Lorsqu'on acidifie suffisamment une solution de benzoate de sodium C
6
H
5
COO
-
Na
+
il se forme un
solide blanc.
b- L'acide thanoque de pKa =4,8 est un acide plus fort que l'acide benzoque.
c- Si le pH d'une solution aqueuse contenant entre autre de l'acide benzoque est gal 5, l'espce
majoritaire est l'acide benzoque.
a) seule ; b) seule ; c) seule ; a) et b) ; a) et c) ; b) et c) ; toutes; aucune
2. Calculer la masse d'acide benzoque que l'on peut dissoudre sans 100 mL d'eau pure.
2,44 g ; 24,2 mg ; 244 mg ; 2,44 mg ; 24,4 g ; 0,244 mg ; 0 g ; 244 g
3. On ajoute une solution d'hydroxyde de sodium 0,1 mol/L 75 mL d'une solution sature d'acide
benzoque additionne de quelques gouttes de phnolphtaline. Pour quel volume (mL) de la base vers
le virage de l'indicateur se produit-il ?
1 ; 10 ; 15 ; 5 ; 20 ; 25 ; 8 ; 12
4. On mlange maintenant 10 mL d'acide benzoque 0,001 mol/L et 5 mL d'une solution d'thylamine
C
2
H
5
NH
2
0,001 mol/L. On donne pKa(C
2
H
5
NH
3
+
/ C
2
H
5
NH
2
) =10,4. Calculer la constante d'quilibre
de la raction acido-basique.
3,16 10
7
; 3,16 10
-7
; 3,16 10
-6
; 5,01 10
-4
; 3,16 10
6
; 3,16 10
-7
; 1,58 10
-4
; 2000 ; 5 10
10
.
23
5. Sachant que la raction entre l'acide benzoque et l'thylamine est totale calculer la concentration du
benzoate d'thylamonium (mmo / L)
0,55 ; 1 ; 0,15 ; 3,3 ; 0,2 ; 0,33 ; 0,23 ; 0,66.
Pom Pom
Dom. Facile !
24
Exercice 36 Acide base
On dispose des couples acide/base: acide thanoque / ion thanoate pKa =4,8 ; acide mthanoque / ion
mthanoate pKa =3,8. On donne pKe =14. A partir de solutions de mme concentrations C=0,1 mol/L on
prpare les solutions S
1
, S
2
, S
3
, S
4
:
ac mthanoque mthanoate de sodiumac thanoque thanoate de sodium pH
S
1
10 mL 20 mL 4
S
2
25 mL 5 mL 4,1
S
3
1 mL 10 mL 4,8
S
4
10 mL 1 mL 3,8
On mlange ensuite les solutions S
1
et S
2
conduisant une solution M et les solutions S
3
et S
4
conduisant une
solution M'.
1. Montrer partir du calcul du taux d'avancement, que pour la solution S
1
, tout se passe comme si les
entits acido-basiques introduites en solution n'avaient pas ragi avec l'eau. Un calcul analogue montre
que l'eau ne ragit pas avec les entits acido-basiques apportes par les solutions S
2
, S
3
, S
4
.
2. Ecrire l'quation de la raction acido-basique modlisant la transformation susceptible de se produire
dans le mlange M et le mlange M'.
3. Exprimer la constante d'quilibre et calculer sa valeur.
4. Dterminer dans quel sens se produit la transformation dans le mlange M et dans le mlange M'.
Exercice 37
Le calcaire et le tartre contiennent essentiellement du carbonate de calcium CaCO
3
. Ce compos est peu soluble
dans l'eau pure. Cette dissolution se fait selon l'quation : CaCO
3
=Ca
2+
+CO
3
2-
.
Dans une eau calcaire charge en dioxyde de carbone, il se passe une raction dont la constante d'quilibre vaut
K=10
3,9
; l'quation de cette raction est : CO
3
2-
+CO
2
+H
2
O =2HCO
3
-
(1)
1. On donne les couples acide/base suivants avec leur constante d'acidit : HCO
3
-
/CO
3
2-
; K
a1
= 10
-10,3
;
CO
2
+ H
2
O /HCO
3
-
; K
a2
= 10
-6,4
. Montrer comment on peut retrouver la constante K partir des
constantes d'acidit.
2. Des facteurs physiques et physico-chimiques influent sur l'volution de la raction (1). On demande
comment volue le systme {CO
3
2-
; HCO
3
-
} :
- si l'eau subit un apport de sources volcaniques riches en CO
2
dissout.
- si la temprature de l'eau s'lve.
- si les plantes prlvent CO2 par synthse chlorophyllienne
Exercice 38 Ractions acido-basiques
I- Identifier un indicateur color
On dispose d'un flacon d'indicateur color avec la seule indication C
0
= 2,9 10
-4
mol/L. La mesure du pH donne
4,18. On en dduit [H
3
O
+
]=6,6 10
-5
mol/L. Le couple acide base prsent dans l'indicateur color est not Hind
/ Ind
-
. La solution de l'indicateur color a t prpare partir de la forme acide Hind. L'quation de Hind
avec l'eau s'crit : Hind + H
2
O = Ind
-
+ H
3
O
+
(1)
1. Soit un volume V=100 mL de la solution de l'indicateur color, dterminer le taux d'avancement final
de la raction de l'acide Hind avec l'eau. Cet acide est-il totalement dissoci dans l'eau ? J ustifier.
2. Donner l'expression de la constante d'acidit K
a
de la raction (1).
3. Si K
a
=1,9 10
-5
, calculer le pK
a
du couple Hind / Ind
-
et identifier l'indicateur d'aprs les donnes
suivantes :
indicateur couleur acide zone de virage couleur basique pKa
hlianthine jaune orang 3,1 - 4,4 rouge 3,7
vert de bromocrsol jaune 3,8 - 5,4 bleu 4,7
bleu de bromothymol jaune 6 - 7,6 bleu 7
phnolphtaline incolore 8,2 - 10 fuschsia 9,4
II- Dosage d'une solution d'acide chlorhydrique concentr
Sur l'tiquette du flacon on lit 33% minimum en masse d'acide chlorhydrique. On veut connatre la
concentration molaire c
0
de cette solution note S
0
.
- On dilue 100 fois S
0
et on obtient une solution S
1
de concentration C
1
.
- On prlve V
1
=100 mL de S
1
que l'on dose par conductimtrie l'aide d'une solution d'hydroxyde de sodium
de concentration C
B
= 0,1 mol/L. On donne le graphe (a) reprsentant la conductance de la solution en fonction
du volume V de la solution titrante verse
1. Ecrire la raction du dosage.
2. Dterminer (graphe (a)) le volume quivalent V
E
.
3. Donner la relation entre C
1
, C
B
, V
E
et V
1
l'quivalence. Calculer C
1
.
4. En dduire C
0
et calculer la masse m
0
d'acide chlorhydrique HCl dissoute dans un litre de S
0
. Cl=35 ;
H=1 g/mol. Quelle est la masse m d'un litre de solution ?
5. Calculer le pourcentage massique de la solution S
0
. L'indication de l'tiquette est-elle correcte ?
6. Sur le graphe donnant le dosage suivi par pH-mtrie, indiquer la zone de virage de l'indicateur color
identifi ci-dessus. Dcrire le changement de couleur observ lors du dosage.
7. Dans la liste des indicateurs colors y a t il un indicateur color mieux adapt pour reprer l'quivalence
du dosage ?
Exercice 39 acide formique, conductimtrie
Le transfert d'informations par signaux chimiques entre individus s'effectue l'aide de phromones. Par
exemple :
25
Dans une criture topologique, on ne reprsente pas les atomes de carbone ni les atomes d'hydrogne lis aux
atomes de carbone.
1. Entourer et nommer les groupes caractristiques prsents dans les molcules A et B.
2. A appele thanoate de 3-mthylbutyle, peut tre synthtise partir de l'acide thanoque et d'un
alcool D.
- Donner le nom et la formule semi dveloppe de D.
- Ecrire l'quation de la raction associe la transformation chimique de synthse de A partir d'acide
thanoque et de l'alcool D. Comment appelle-t-on cette raction ? Prciser ses caractristiques.
- La mme transformation est ralise en prsence d'acide sulfurique. Les affirmations suivantes qui
dcrivent le rle de l'acide sulfurique sont-elles vraies ou fausses ?
* affirmation 1 : l'acide sulfurique modifie l'tat d'quilibre du systme.
* affirmation 2 : l'acide sulfurique permet d'accrotre le taux d'avancement final.
* affirmation 3 : l'acide sulfurique augmente la vitesse de la raction sans apparatre dans l'quation de
la raction.
3. La synthse de A peut tre ralise en remplaant l'acide thanoque par l'anhydride thanoque. Quels
seront les effets de ce changement de ractif sur la transformation ?
4. On ralise l'hydrolyse basique de C, note R-COOCH
3
.
Ecrire l'quation de la raction associe cette transformation. Prciser ses caractristiques.
5. Les phromones peuvent tre utilises pour piger les insectes. Il suffit de 10
-15
g/L de solution de la
molcule B pour attirer les insectes.
- Calculer la concentration molaire de cette solution. (C:12 ; H: 1 ; O : 16 ; N: 14 g/mol)
- Citer deux avantages des phromones utilises comme insecticide par rapport aux insecticides
classiques utiliss en agriculture
Exercice 40 Dtermination d'une constante d'quilibre
Quelques valeurs numriques : log(2 10
-4
)=-3,7 ; 2/2,3 =0,87 ; 2/2,7 =0,74 ; 2/3 =0,67 ; 1,25=1,56 proche
1,6 ; 4/2,5 =1,6 ; 5/4 =1,25 ; 100/1,25 =80.
1. La transformation chimique tudie : l'acide thanoque CH
3
-CO
2
H, ou acide actique ragit de faon limite
avec l'eau selon: CH
3
-CO
2
H (aq) +H
2
O (l) =CH
3
-CO
2
-
(aq) +H
3
O
+
(aq)
1. Donner la dfinition d'une base de Bronsted
2. Dans l'quation ci-dessus, identifier puis crire les deux couples acide base mis en jeu.
3. Exprimer la constante d'quilibre K associe l'quation de cet quilibre chimique.
2. Etude Phmtrique : une solution d'acide thanoque, de concentration molaire initiale c
1
=2,7 10
-3
mol/L et de
volume v
1
=100 mL a un pH de 3,70 25C.
1. Dterminer la quantit de matire initiale d'acide thanoque n
1
.
2. Complter le tableau d'avancement en fonction de n
1
, x
max
ou x
f
. Exprimer puis calculer l'avancement
maximale thorique x
max
. J ustifier
26
27
avancement CH
3
-CO
2
H (aq) +H
2
O (l) =CH
3
-CO
2
-
(aq) +H
3
O
+
(aq)
initial x=0
final thorique x=x
max
final x=x
f
en excs
3. Dduire de la valeur du pH, la concentration molaire finale en ions oxonium de la solution d'acide
thanoque. Exprimer puis calculer l'avancement final exprimental de la raction not x
f
.
4. Donner l'expression littrale du taux d'avancement
1
de la raction. Vrifier en posant l'opration que
1
=7,4 10
-2
. La transformation tudie est-elle totale ? J ustifier.
5. Exprimer puis calculer la concentration molaire finale en ion thanoate CH
3
-CO
2
-
(aq).
Exprimer la concentration finale effective de l'acide thanoque. Calculer sa valeur.
6. Vrifier en posant l'opration que la valeur de la constante d'quilibre K
1
associe l'quation de cet
quilibre est gale 1,6 10
-5
.
Exercice 41 Etude conductimtrique
I. Etude conductimtrique : on mesure, 25C, la conductivit d'une solution d'acide thanoque de
concentration C
2
=1,0 10
-1
mol/L. Le conductimtre indique =5,00 10
-2
S/m.
1. Citer les espces ioniques majoritaires prsentes dans cette solution. Donner la relation liant leur
concentration molaire.
2. Donner l'expression littrale de la conductivit de la solution en fonction des concentrations molaires
finales en ion oxonium et thanoate.
3. Donner l'expression littrale permettant d'obtenir les concentrations molaires finales ioniques en
fonction de ,
H3O+
,
CH3-CO2-
. Dterminer la valeur de la concentration molaire finale en ion oxonium
et thanoate en mol m
-3
puis en mol/L.
H3O+
=35,9 10
-3
S m mol
-1
;
CH3-CO2-
=4,1 10
-3
S m mol
-1
;
4. L'exprimentateur affirme que dans le cas prsent, la solution d'acide thanoque est suffisamment
concentre pour pouvoir faire les approximations suivantes :
Approximation 1 : la concentration molaire finale en ion thanoate est ngligeable devant la
concentration molaire initiale en acide thanoque. Ceci se traduit par l'ingalit : [CH
3
-CO
2
-
]
f
<C
2
/50.
Approximation 2 : la concentration molaire finale en acide actique est quasiment gale la
concentration molaire initiale en acide actique [CH
3
-CO
2
H]
f
proche de C
2
.
- L'approximation 1 est-elle justifie ?
- En supposant que l'approximation 2 soit vrifie, que peut-on dire de la dissociation de l'acide ? En
dduire si la transformation chimique est totale, limite, ou trs limite ? J ustifier.
- En tenant compte de l'approximation 2, vrifier, en posant l'opration, que la valeur de la constante
d'quilibre K
2
associe l'quation de cet quilibre chimique est gale 1,56 10
-5
.
II. Comparaison des rsultats obtenus : on vient d'tudier deux solutions d'acide thanoque de concentrations
initiales diffrentes.
concentration molaire initiale d'acide
thanoque
constante
d'quilibre
taux d'avancement
final
tude
pHmtrique
C
1
=2,7 10
-3
mol/L K
1
=1,6 10
-5
1
=7,4 10
-2
conductimtrie C
2
=1,0 10
-1
mol/L K
2
=1,56 10
-5
2
=1,25 10
-2
1. La constante d'quilibre dpend-elle de la concentration initiale en acide actique ? J ustifier.
2. Le taux d'avancement final d'une transformation chimique limite dpend-il de l'tat initial du systme
chimique ? J ustifier partir du tableau
3. Un lve propose les deux affirmations suivantes. Prciser si elles sont justes ou fausses et justifier.
Affirmation 1 : plus l'acide est dissoci, plus le taux d'avancement final est grand.
Affirmation 2 : plus la solution d'acide thanoque est dilue, moins l'acide est dissoci.
Exercice 41 A quoi est due la couleur des fleurs d'hortensias ?
Certaines fleurs, comme celles des hortensias, possdent des couleurs varies dues des pigments naturels. Les
couleurs rouge, mauve, violette et bleue viennent de la prsence d'anthocyanines dans les ptales. La couleur
violette est due la molcule suivante que l'on notera HA dans la suite de l'exercice.
1. Introduction : HA peut appartenir deux couples H
2
A
+
/ HA de pKa
1
=4,3 et HA / A
-
de pKa
2
=7.
L'espce H
2
A
+
est rouge, l'espce HA est violette et l'espce A
-
est bleue. On rappelle que pKe =14.
- Donner la dfinition d'un acide selon Brnsted.
- Prciser dans chacun des 2 couples la forme acide et la forme basique.
2. Comportement de HA en tant qu'acide :
- crire l'quation de la raction de HA en tant qu'acide avec l'eau.
- Donner l'expression de la constante d'quilibre de cette raction. Comment appelle-t-on cette
constante? Donner sa valeur.
Le pH d'une solution contenant HA est de 10.
- partir de l'expression de K, valuer littralement, puis calculer le rapport [A
-
]
q
/[HA]
q
.
- En dduire l'espce prdominante. Conclure sur la couleur de la solution.
3. Comportement de HA en tant que base :
- crire l'quation de la raction de HA en tant que base avec l'eau.
- Donner l'expression de la constante d'quilibre K ' de cette raction. Quelle est la relation entre Ka
1
et
K ' ?
4. Conclusion : couleur des hortensias
- Placer sur un diagramme les domaines de prdominance des espces H
2
A
+
, HA et A
-
suivant les
valeurs du pH.
- Pourquoi les fleurs d'hortensias peuvent-elles changer de couleur suivant la nature du sol ?
Exercice 42 Titrage et indicateurs colors
La premire utilisation d'un indicateur color pour les titrages acido-basiques remonte 1767 par W. Lewis. Il
employait un extrait de tournesol (...). On utilisait l'poque des extraits de plantes qui changent de couleur
avec l'acidit du milieu (...). On peut en citer quelques-uns parmi les plus connus et les meilleurs : l'artichaut
(...) , la betterave rouge (...) , le chou rouge, de loin l'extrait le plus intressant car sa couleur change nettement
suivant la valeur du pH :
pH 0 - 3 4 - 6 7 - 8 9 - 12 13 - 14
couleur rouge violet bleu vert jaune
(Daprs Chimie des couleurs et des odeurs. )
1. Des indicateurs colors en cuisine.
28
Le chou rouge est un lgume riche en fibres et en vitamines, qui se consomme aussi bien en salade que cuit.
Mais la cuisson du chou rouge peut rserver des surprises : chou rouge et eau de cuisson deviennent rapidement
bleus. Pour rendre au chou sa couleur violette, on peut ajouter un filet de citron ou du vinaigre. Aprs avoir
goutt le chou, une autre modification de couleur peut surprendre le cuisinier : verse dans un vier contenant
un dtergent, l'eau de cuisson devient verte.
En utilisant les textes ci-dessus :
1. Donner la proprit essentielle d'un indicateur color acido basique.
2. Prciser le caractre acide ou basique du vinaigre et du dtergent.
2. Des indicateurs colors pour les titrages.
De nos jours, les indicateurs colors sont toujours largement utiliss pour les titrages. La pH-mtrie est une
autre technique de titrage acido-basique qui permet en outre de choisir convenablement un indicateur color
acido-basique pour ces mmes titrages. Dans la suite de l'exercice, on s'intresse au titrage de l'acide thanoque
de formule CH
3
-CO
2
H (not par la suite HA) contenu dans un vinaigre commercial incolore. La base conjugue
de cet acide sera note A
-
.
1. Dilution du vinaigre : le vinaigre commercial tant trop concentr pour tre titr par la solution
d'hydroxyde de sodium disponible au laboratoire, on le dilue dix fois. On dispose pour cela de la
verrerie suivante :
prouvette 5 mL 10 mL 25 mL 50 mL 100 mL
pipettes jauges 1,0 mL 5,0 mL 10,0 mL 20,0 mL
fioles jauges 150,0 mL 200,0 mL 250,0 mL 500,0 mL
Choisir dans cette liste la verrerie la plus approprie pour effectuer la dilution. J ustifier.
2. Raction de titrage : on titre un volume V
A
=10,0 mL de la solution dilue de vinaigre par une solution
aqueuse d'hydroxyde de sodium (ou soude) de concentration molaire en solut apport C
B
=1,0 10
-1
mol/L. On ajoute un volume V
eau
=60 mL afin d'immerger les lectrodes du pH-mtre aprs agitation.
Le suivi pH-mtrique de la transformation permet de construire la courbe fournie ci-dessous :
Cette partie a pour but de vrifier que la transformation associe la raction de titrage est totale. Pour
cela, on dterminera son taux d'avancement final pour un volume V
B
=6,0 mL de solution aqueuse
d'hydroxyde de sodium vers.
Donne : produit ionique de l'eau 25C K
e
=10
-14
.
- crire l'quation associe la raction de titrage.
29
- Pour V
B
=6,0 mL, dterminer le ractif limitant.
- Pour V
B
=6,0 mL, dterminer l'avancement maximal x
max
. On pourra s'aider d'un tableau
d'avancement.
- Aprs avoir relev la valeur du pH du mlange obtenu, dterminer la quantit de matire d'ions
hydroxyde restante aprs la transformation dans le volume total de mlange ractionnel.
- Dterminer le taux d'avancement final et conclure.
3. Dtermination par titrage de la concentration molaire en acide thanoque apport du vinaigre :
- Dterminer graphiquement le volume de la solution d'hydroxyde de sodium vers l'quivalence.
Prciser la dmarche utilise.
- Dterminer la valeur de la concentration molaire en acide thanoque apport C
A
dans le vinaigre dilu
et en dduire la valeur de la concentration molaire en acide thanoque apport C
0
du vinaigre
commercial.
4. Retour historique... :
On souhaite raliser un titrage colorimtrique de l'acide thanoque contenu dans le vinaigre dilu avec
un des deux extraits naturels (artichaut et betterave rouge) utiliss au XVIIIe sicle. Pour chaque
indicateur color, on considre que les teintes sont dues la prdominance d'une espce chimique, note
AH pour sa forme acide et A
-
pour sa forme basique. Le pK
A
des couples sera not pK
i
. On donne les
valeurs des pK
i
25C : artichaut : (pK
i
)
1
=7,5 ; betterave rouge : (pK
i
)
2
=11,5
artichaut betterave
pK
i
7,5 11,5
teinte pour HA
ind
dominant incolore rouge
teinte pour A
-
ind
dominant jaune jaune
- En utilisant l'expression de la constante d'acidit K
i
, montrer que la relation suivante est vrifie :
[A
-
ind
]
q
/[HA
ind
]
q
=10
pH-pKi
.
5. On s'interroge sur les couleurs que prendrait le mlange ractionnel lors du titrage calorimtrique de
l'acide thanoque en prsence d'une petite quantit de l'un ou l'autre de ces extraits naturels.
La courbe pH-mtrique montre que, pour V
B
=9,8 mL, le pH de la solution est voisin de 6,5 et que pour
V
B
=10,1 mL, il est voisin de 10,5. Pour chaque extrait naturel et pour chacun de ces deux volumes V
B
,
dterminer la valeur du rapport [A
-
ind
]
q
/[HA
ind
]
q
puis complter la ligne correspondante du tableau.
artichaut betterave
pK
i
V
B
=9,8 mL V
B
=10,1 mL V
B
=9,8 mL V
B
=10,1 mL
[A
-
ind
]
q
/[HA
ind
]
q
couleur
En dduire les couleurs observes dans chaque cas. Complter la ligne correspondante du tableau.
Conclure sur l'indicateur color le plus adapt pour ce titrage.
Pourquoi faut-il choisir un vinaigre incolore pour ce type de titrage ?
30
31
Exercice 43 L'aspirine
L'aspirine reste le mdicament le plus consomm au monde. Elle peut se prsenter sous de multiples formes
(comprims simples ou effervescents, poudre soluble...), chacune renfermant de l'acide actylsalicylique,
principe actif. Par la suite, cet acide est not AH et l'ion actylsalicylate A
-
.
Lexercice qui suit a pour but d'tudier le comportement de la molcule AH en solution aqueuse. La raction
entre la molcule AH et l'eau modlise la transformation tudie.
Les parties 1 et 2. ont en commun le calcul de l'avancement final de cette raction par deux techniques
diffrentes dont la prcision sera discute dans la partie 3.
Donnes : Conductivits molaires ioniques 25 C
Espces chimiques H
3
O
+
HO
-
A
-
en mS.m
2
.mol
-1
35 19,9 3,6
PKa 25 C AH/A
-
: 3,5
Masse molaire molculaire de l'acide actylsalicylique AH : M =180 g.mol
-1
.
Par dissolution d'une masse prcise d'acide actylsalicylique pur, on prpare un volume Vs =500,0 mL d'une
solution aqueuse d'acide actylsalicylique, note S
1
de concentration molaire en solut apport
C
S
=5,55 10
-3
mol.L
-1
.
1. Etude de la transformation chimique par une mesure de pH : A 25 C, la mesure du pH de la solution S
l'quilibre donne 2,9.
- Dterminer l'quilibre, la concentration [H
3
O
+
]
q
en ions oxonium dans la solution S prpare.
- L'acide actylsalicylique AH ragit avec l'eau. Ecrire l'quation de la raction modlisant cette
transformation chimique.
- Dterminer l'avancement final x
f
de la raction (on pourra s'aider d'un tableau descriptif de rvolution
du systme).
- Dterminer l'avancement maximal x
max
de la raction.
- Dterminer le taux d'avancement final de la raction. La transformation tudie est-elle totale ?
2. Dtermination de la constante d'quilibre de la raction par conductimtrie.
A 25 C, on mesure la conductivit de la solution S l 'aide d'un conductimtre. On obtient =44
mS.m
-1
. Dans les conditions de l'exprience, on peut ngliger la contribution des ions HO
-
la
conductivit de la solution.
- Exprimer l'avancement final x
f
de la raction entre l'acide AH et l'eau en fonction de , des
conductivits molaires ioniques utiles et du volume V
S
(on pourra s'aider du tableau descriptif de
l'volution du systme ).
- En dduire la valeur de x
f
.
- Calculer les concentrations molaires l'quilibre des espces AH, A
-
et H
3
O
+
.
- Donner l'expression de la constante d'quilibre associe l'quation de la raction entre l'acide AH et
l'eau, puis la calculer.
3. Prcision des deux techniques utilises : pH-mtrie et conductimtrie. Le pH-mtre utilis donne une
valeur de pH prcise O,1 unit de pH prs, et le conductimtre donne une valeur de conductivit
prcise 1 mS.m
-1
prs. La valeur du pH est donc comprise entre 2,8 et 3,0 et celle de la conductivit
entre 43 mS.m
-1
et 45 mS.m
-1
. Le tableau ci-dessous indique les valeurs de l'avancement final de la
raction calcules pour ces diffrentes valeurs de pH et de conductivit :
pH =2,8 pH =3,0 =43 mS.m
-1
=45 mS.m
-1
x
f
(en mol) 7,9 10
-4
5 10
-4
5,6 10
-4
5,8 10
-4
Conclure brivement sur la prcision des deux techniques, sans procder un calcul d'erreur relative.
32
Exercice 44 tude d'un produit mnager
L'ammoniac, NH
3
est un gaz qui, dissout dans l'eau, donne une solution basique d'ammoniaque. Des solutions
d'ammoniaque sont vendues dans le commerce. Ces solutions aprs dilution, sont utilises comme produit
nettoyant et dtachant. On se propose d'tudier quelques proprits de l'ammoniac dissout puis de dterminer sa
concentration dans un de ces produits.
Donnes : masse molaire de l'ammoniac : 17g/mol ; couple acide base NH
4
+
/ NH
3
: K
a1
=6,3 10
-10
.
I. NH
3
(aq)
1. L'ammoniac est une base en solution aqueuse. --
Donner la dfinition d'une base selon Brnsted.
Ecrire l'quation de la raction entre l'ammoniac et l'eau.
Exprimer puis calculer la constante d'quilibre de cette raction.
2. On dissout dans un volume d'eau V=250 mL une quantit de matire n d'ammoniac gale 2,5 10
-3
mol.
Le pH de la solution S obtenue vaut 10,6. Calculer la concentration C en solut apport.
- Calculer la concentration en ion oxonium H
3
O
+
dans la solution.
- En dduire la concentration en ion hydroxyde HO
-
dans la solution.
- Montrer que le taux d'avancement final peut s'crire =[HO
-
]
f
/ c puis le calculer.
- Que peut-on dire de la transformation ?
II. Dtermination de la concentration en ammoniac de la solution commerciale :
1. Dilution de la solution commerciale. Afin de dterminer la concentration C
0
de la solution commerciale,
on propose de raliser un titrage acido-basique de la solution commerciale. Celle-ci tant trs
concentre, on fabrique par dilution, une solution S
1
de concentration C
1
mille fois plus petite. Parmi les
lots de verrerie proposs, choisir en justifiant, celui que l'on doit utiliser pour raliser au mieux cette
dilution.
lot 1 lot 2 lot 3 lot 4
pipette jauge 1 mL pipette gradue 10 mL pipette jauge 1 mL pipette jauge 10 mL
bcher 100 mL fiole jauge 1 L fiole jauge 1 L fiole jauge 1 L
bcher 50 mL bcher 50 mL bcher 50 mL bcher 50 mL
2. Titrage acido-basique. On ralise un titrage pH-mtrique de V
1
=20,0 mL de solution S
1
par une
solution d'acide chlorhydrique (H
3
O
+
; Cl
-
) de concentration C
A
=1,50 10
-2
mol/L.
L'quation support du titrage est : NH
3
+H
3
O
+
=H
2
O +NH
4
+
.
Pour obtenir l'quivalence il faut verser un volume V
E
=14,3 mL d'acide chlorhydrique. On note que le
pH l'quivalence vaut 5,7.
- Dfinir l'quivalence d'un titrage.
- Etablir la relation l'quivalence entre C
1
, V
1
, C
A
et V
E
.
- En dduire C
1
puis C
0
.
- Parmi les indicateurs colors suivants, choisir en justifiant, celui qui pourrait tre utilis pour raliser
ce titrage de faon colorimtrique.
indicateur color couleur forme acide zone de virage couleur forme basique
hlianthine rouge 3,1 - 4,4 jaune
rouge de chlorophnol jaune 5,2 - 6,8 rouge
bleu de bromothymol jaune 6,0 - 7,6 bleu
phnolphtaline incolore 8,2 - 10 rose
Exercice 45 L'apparition d'une crampe
pH du sang et maintien de sa valeur : Le sang peut tre assimil une solution aqueuse ionique dont le pH
(valeur voisine de 7,4) est quasiment constant et ne peut subir que de faibles fluctuations. Le maintien de la
valeur du pH se fait par deux processus :
- Le premier met en oeuvre le couple acide base CO
2
, H
2
O / HCO
3
-
( pKa
1
=6,1 37C)
grce l'quilibre :CO
2
+2 H
2
O =HCO
3
-
+H
3
O
+
(1)
- Le second processus est la respiration.
1. Donner l'expression de la constante d'acidit Ka
1
relatif au couple rgulateur (raction 1). En dduire la
relation entre pH et pKa
1
.
- Calculer le rapport [HCO
3
-
]/[CO
2
, H
2
O] dans le sang artriel normal.
- Lors d'un effort physique la concentration en dioxyde de carbone dissout
dans le sang, au voisinage du muscle, augmente. Comment devrait varier le pH du sang ?
2. Pour viter cette variation du pH du sang, l'hmoglobine contenue dans le sang et la respiration
interviennent pour liminer l'excs de dioxyde de carbone. Le transport des gaz dissout dans le sang
peut tre modlis par l'quilibre : HbO
2
+CO
2
=HbCO
2
+O
2
(2) o Hb reprsente l'hmoglobine.
- Au voisinage des poumons la quantit de O
2
dissout augmente. Dans quel sens est dplac l'quilibre
(2) ?
- Au voisinage des muscles la quantit de CO
2
dissout augmente. Dans quel sens est dplac l'quilibre
(2) ?
- Expliquer comment la respiration permet de maintenir constante la valeur du pH sanguin ?
Exercice 46 L'acide lactique : CH
3
-CHOH-COOH / CH
3
-CHOH-COO
-
1. Entourer et nommer dans la formule de l'acide lactique les diffrents groupes fonctionnels de la
molcule.
2. Donner la dfinition d'un acide.
3. Ecrire la raction de l'acide lactique avec l'eau.
4. Dans la cellule musculaire, l'acide lactique est form partir de l'acide pyruvique CH
3
-CO-COOH. La
transformation est une oxydorduction faisant intervenir le couple acide pyruvique / acide lactique.
Ecrire la demi quation lectronique associe au couple. S'agit-il d'une oxydation ou d'une rduction de
l'acide pyruvique ?
Variation locale du pH du sang en l'absence de processus de maintien : Lorsque l'acide lactique produit dans la
cellule musculaire est en partie transfr dans le sang, il ragit avec les ions hydrognocarbonate selon : CH
3
-
CHOH-COOH +HCO
3
-
=CH
3
-CHOH-COO
-
+CO
2
, H
2
O (3)
A 37 pour le sang avant l'effort : [HCO
3
-
]
i
=2,7 10
-2
mol/L ; [CO
2
, H
2
O]
i
=1,4 10
-3
mol/L ; pKa
2
( acide lactique
/ ion lactate) =3,6.
On considre un volume V=100 mL de sang aprs l'effort dans lequel apparat n
0
=3 .10
-4
mol d'acide lactique.
1. Calculer la constante d'quilibre de la raction (3)
2. En supposant la transformation totale, tablir un tableau d'avancement.
3. Calculer alors [HCO
3
-
]
f
, [CO
2
, H
2
O]
f
et le pH du sang aprs l'effort.
Exercice 47 tude d'un produit d'entretien
Sur l'tiquette d'une solution commerciale d'ammoniac (NH
3
) on lit : % massique en ammoniac =20 %.
On prpare 100 mL d'une solution dilue, not S au 20
me
de la solution commerciale, note S
0
.
Donnes : H: 1,00 ; N : 14,0 g/mol ; K
a
=6,3 10
-10
; pKa =9,2 ;
1. La mesure du pH 25C de la solution dilue donne pH=11,2. Indiquer en justifiant la nature de cette
solution.
- Prciser le nom et la formule de son espce conjugue.
33
34
- Ecrire le couple acide base auquel appartient l'ammoniac.
- Donner le diagramme de prdominance, en fonction du pH, des espces chimiques de ce couple et en
dduire l'espce prdominante dans la solution S d'ammoniac.
2. Pour vrifier les indications de l'tiquette on titre un volume V=10,0 mL de la solution S par une
solution d'acide chlorhydrique de concentration C
A
=5,00 10
-1
mol/L en prsence de quelques gouttes de
BBT. Le changement de teinte de la solution a lieu pour un volume V
A q
=10,8 de solution titrante.
- Ecrire l'quation de la raction support du dosage en prcisant les caractristiques de cette
transformation chimique.
- Etablir l'expression de la constante d'quilibre K en fonction de la constante d'acidit K
a
. Calculer sa
valeur et conclure.
- Dterminer la concentration molaire C de la solution S ; en dduire la concentration C
0
de la solution
commerciale.
- La mesure de la masse volumique de la solution commerciale donne =920 g/L. Dterminer
l'expression du pourcentage massique de la solution commerciale en fonction de C
0
, M et . Calculer sa
valeur et conclure.
3. Lors de ce titrage, la mesure du pH de la solution lorsqu'on a vers un volume V
A
=6,0 mL d'acide
chlorhydrique donne pH=9,0.
- Dterminer les quantits de matire n
1
d'ammoniac et n
2
d'acide chlorhydrique introduites.
- Dterminer l'avancement final, l'avancement maximal l'aide d'un tableau descriptif de l'volution du
systme chimique.
- Montrer en calculant le taux d'avancement final que la transformation est quasi-totale
Exercice 48 Transformations associes des ractions acido-basiques
I. On prpare une solution en mettant une masse m=0,32g de chlorure d'ammonium dans un volume V=100mL
d'eau sans variation de volume. Le pH de la solution obtenue est pH=5,2.
1. Donner l'quation de dissolution du chlorure d'ammonium.
2. Montrer que l'ion ammonium est un acide faible.
3. Donner l'quation de la raction entre l'ion ammonium et l'eau.
4. Dfinir la constante d'quilibre associe l'quation de cette raction et calculer sa valeur.
5. En dduire l'espce prdominante dans la solution (on ne tiendra pas compte des ions chlorure).
II. On ajoute une solution d'hydroxyde de sodium la solution prcdente.
1. En justifiant votre rponse l'aide des pK
A
des couples mis en jeu, indiquer quelle raction a lieu
principalement lors du mlange de ces deux solutions.
2. Dterminer la constante d'quilibre associe l'quation de cette raction. Que peut-on en
conclure?
3. Dterminer le volume V
b
de solution aqueuse d'hydroxyde de sodium de concentration
C
b
=0,20mol.L
-1
qu'il faut ajouter la solution initiale de chlorure d'ammonium pour obtenir une
solution de pH=9,2.
Donnes: Pour le couple H
2
O / HO
-
:
pK
A1
=14
Pour le couple H
3
O
+
/ H
2
O: pK
A2
=0
Pour le couple NH
4
+
/ NH
3
: pK
A3
=9,2
Les ions chlorure et les ions sodium sont indiffrents vis--vis de l'eau
Exercice 49 L'eau de Javel
L'eau de Javel est une solution aqueuse de chlorure de sodium et d'hypochlorite de sodium. L'ion hypochlorite
est le constituant actif de l'eau de Javel (dcolorant, dsinfectant). Cet ion est la base conjugue de l'acide
hypochloreux (HClO). Cet acide est instable et faible et se forme lorsqu'on ajoute un acide l'eau de Javel.
1. Donner le couple auquel appartient l'agent actif de l'eau de J avel.
2. On considre qu'une espce A est ultra-majoritaire par rapport une espce B si: [A]/[B]>100. A partir de
quelle valeur du pH peut-on considrer que l'agent actif de l'eau de J avel est ultra-majoritaire?
3. Le pH de l'eau laquelle on a ajout quelques gouttes d'eau de J avel est pH=7,5. Dterminer le rapport
[ClO
-
]/[HClO] dans un tel milieu.
4. On constate que le gaz carbonique (CO
2
) de l'air favorise la formation de l'acide hypochloreux.
Donner les ractifs qui interviennent dans cette raction. Ecrire l'quation de cette raction et dterminer la
valeur de la constante d'quilibre associe. La valeur trouve justifie-t-elle l'affirmation prcdente? Pourquoi?
5. On ajoute de l'acide chlorhydrique de l'eau de J avel de telle faon que son pH soit pH=2,0. On peut alors
envisager une raction dont l'quation est HClO +H
3
O
+
+Cl
-
Cl
2(g)
+2H
2
O
Quelle est l'espce ultra-majoritaire dans l'eau de J avel pH=2?
6. Expliquer pourquoi il est dangereux de mlanger un produit mnager contenant un acide de l'eau de J avel.
Donnes: Couple: HClO / ClO
-
pK
A1
=7,3
Couple CO
2
,H
2
O / HCO
3
-
pK =6,4
A2
Exercice 50 L'tiquette dune bouteille d'eau minrale courante.
Ltiquette colle sur une bouteille deau minrale courante indique: Minralisation caractristique en mg/L:
Hydrognocarbonate =403 ; pH=7,0.
Donnes: Couple CO
2
,H
2
O / HCO
3
-
pK
A1
=6,4
Couple HCO
3
-
/ CO
3
2-
pK
A2
=10,3
zone de virage du vert de bromocrsol: 3,8 - 5,4
zone de virage du violet de bromocrsol:5,2 - 6,8
zone de virage du bleu de bromothymol: 6,0 - 7,6
1. Donner le diagramme de prdominance des espces mises en jeu dans les deux couples auxquels appartient
l'ion hydrognocarbonate.
2. Quelle est l'espce prdominante dans l'eau minrale tudie?
3. Un volume V
1
=20,0mL de cette eau est titre par une solution de chlorure d'hydrogne de concentration
C
2
=1,0.10
-2
mol.L
-1
. On note V
2
le volume d'acide ajout. Les courbes donnant pH=f(V
2
) et dpH/dV
2
=f(V
2
)
sont
donnes ci-contre.
Ecrire l'quation de la raction de dosage des ions hydrognocarbonate.
4. Dterminer les coordonnes du point d'quivalence E.
5. Parmi les indicateurs colors proposs, quel est le mieux adapt? Le titrage sera-t-il alors prcis?
6. Dterminer la concentration des ions hydrognocarbonate dans cette eau. Correspond-elle celle donne sur
l'tiquette?
35
Exercice 51 Le lactose du lait
Le lactose du lait (sucre du lait) se dgrade sous l'action de bactries en acide lactique (CH
3
CHOH
COOH). Dans la suite de l'exercice, l'acide lactique sera not AH et sa base conjugue A
-
. La teneur d'un lait en
acide lactique est donc un indicateur de fracheur de ce lait. On admet qu'un lait est consommable si cette teneur
en acide lactique reste infrieure 1,8g.L
-1
.
On dose un volume V=20,0mL de lait par une solution de soude de concentration C
b
=0,10mol.L
-1
. Le volume
de soude vers l'quivalence est V
q
=8,5mL.
1. Donner la formule de la base conjugue de l'acide lactique.
2. Dterminer la concentration de l'acide lactique dans ce lait.
3. Ce lait est-il consommable?
4. On donne les zones de virage de deux indicateurs colors : Hlianthine: 3,1-4,4; phnolphtaline: 8,2-10,0.
Quel est l'indicateur le mieux adapt pour ce dosage? J ustifier la rponse.
5. La solution dans le bcher n'est pas incolore. Quelle prcaution d'ordre exprimentale, faut-il prendre lors de
ce dosage colorimtrique?
Exercice 52
Sur l'tiquette d'une bote de mdicament on lit: m=200mg d'ibuprofne par glule (l'ibuprofne est un acide qui
sera not AH dans la suite). On dsire vrifier cette indication par un dosage acido-basique.
On limine l'excipient et on ajoute l'ibuprofne un volume V
B
=200,0mL de solution aqueuse d'hydroxyde de
sodium de concentration C
B
=9,00.10
-3
mol.L
-1
. La solution de soude est en excs par rapport l'acide. La
solution limpide S obtenue a un volume V=200,0mL.
1. Dresser le tableau d'avancement de la transformation, suppose totale, qui a lieu entre l'ibuprofne et les ions
hydroxyde lors de ce mlange. On notera n(AH)
0
la quantit de matire initiale dans la glule et x l'avancement
de cette transformation.
2. On ralise le titrage colorimtrique des ions HO
-
en excs dans la solution S par une solution aqueuse de
chlorure d'hydrogne de concentration C
A
=5,00.10
-2
mol.L
-1
. L'quivalence est atteinte pour un
volume V
q
=16,8mL d'acide chlorhydrique vers.
Quel indicateur color doit-on choisir pour reprer l'quivalence? J ustifier la rponse.
3. Dresser le tableau d'avancement de la raction de titrage. On notera x' l'avancement de cette transformation.
4. Dterminer x'
q
l'quivalence puis x
f
pour la raction entre l'ibuprofne et les ions hydroxyde.
5. Dterminer la valeur exprimentale m' de la masse d'ibuprofne contenu dans une glule. Comparer ce
rsultat l'indication porte sur l'tiquette.
Donnes: Masse molaire de l'ibuprofne:M =206,0 g.moL
-1
Rouge de bromophnol: zone de virage: 5,2 - 6,8
Bleu de bromothymol: zone de virage: 6,0 - 7,6
Phnolphtaline: zone de virage: 8,2 - 10,0
36
S-ar putea să vă placă și
- Couple Acide - Base: ExercicesDocument16 paginiCouple Acide - Base: ExercicesAhamadi ElhouyounÎncă nu există evaluări
- Série D'exercices 5, Transformations Associées À Des Réactions Acido-Basiques en Solution - Dosage, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument12 paginiSérie D'exercices 5, Transformations Associées À Des Réactions Acido-Basiques en Solution - Dosage, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDboudhar mohamed0% (1)
- 2-Cinetique ChimiqueDocument5 pagini2-Cinetique ChimiqueAnis Dahnen0% (1)
- Sciences Physiques - Cinetique Chimique-Gazzah MahmoudDocument3 paginiSciences Physiques - Cinetique Chimique-Gazzah MahmoudMahmoud GazzahÎncă nu există evaluări
- Acide BaseDocument10 paginiAcide BaseAmeni Slimen100% (1)
- Les Reactions D - Esterification Et D'hydrolyse PDFDocument8 paginiLes Reactions D - Esterification Et D'hydrolyse PDFAzizElheni100% (1)
- Transformations Associés A Des Reactions Acido Basiques en Solution AqueusesDocument8 paginiTransformations Associés A Des Reactions Acido Basiques en Solution AqueusesJosé Ahanda NguiniÎncă nu există evaluări
- Seriesphys BacDocument174 paginiSeriesphys Bacbessama84Încă nu există evaluări
- Série Chimie Cinétique Chimique 2011 2012 (Dahmani Lotfi)Document4 paginiSérie Chimie Cinétique Chimique 2011 2012 (Dahmani Lotfi)Aicha DaouÎncă nu există evaluări
- DS1 (11 12 09)Document8 paginiDS1 (11 12 09)Seif Souid100% (5)
- Esterification HydrolyseDocument5 paginiEsterification HydrolyseAnis Dahnen100% (1)
- Devoir Corrigé de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2015-2016) MR TRAYIA NABILDocument9 paginiDevoir Corrigé de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2015-2016) MR TRAYIA NABILwalidÎncă nu există evaluări
- RLC ForceeDocument9 paginiRLC Forceebelbel4321100% (1)
- Serie #8 Determination D Une Quantite de Matiere A L Aide D Une Reaction ChimiqueDocument2 paginiSerie #8 Determination D Une Quantite de Matiere A L Aide D Une Reaction ChimiqueMahmoud Essahbi Sahbi Daghsni67% (3)
- DS2 (05 03 10)Document9 paginiDS2 (05 03 10)Seif Souid100% (5)
- Examen Blanc Physique Chimie Bac DDocument4 paginiExamen Blanc Physique Chimie Bac Dkouassi hermann ulrich koffi100% (1)
- Série A. Fort A. Faible B.Forte. B. FaibleDocument2 paginiSérie A. Fort A. Faible B.Forte. B. FaibleJalel Belfelah0% (1)
- C2Chim Vitesse Reaction Exercices PDFDocument8 paginiC2Chim Vitesse Reaction Exercices PDFAzizElheniÎncă nu există evaluări
- Bac Math Pysh Acide Base Serie 4Document1 paginăBac Math Pysh Acide Base Serie 4Nourhene Jlassi33% (3)
- 2-Série Acide Base + CorrigéDocument14 pagini2-Série Acide Base + Corrigémimi mimiÎncă nu există evaluări
- Decroissance Radioactive Exercices Non Corriges 6Document6 paginiDecroissance Radioactive Exercices Non Corriges 6Karroum MohamedÎncă nu există evaluări
- Série D'exercices N°2 - Sciences Physiques Cinétique Chimique - Bac Sciences Exp (2013-2014) MR Alibi AnouarDocument6 paginiSérie D'exercices N°2 - Sciences Physiques Cinétique Chimique - Bac Sciences Exp (2013-2014) MR Alibi AnouarKais GuesmiÎncă nu există evaluări
- Serie Tableau AvancementDocument5 paginiSerie Tableau AvancementkkkkÎncă nu există evaluări
- Devoir de Synthese: FerchiouDocument4 paginiDevoir de Synthese: Ferchioufethi10% (1)
- Série D'exercices Vitesse de RéactionDocument4 paginiSérie D'exercices Vitesse de Réactionothmane GbÎncă nu există evaluări
- Un Récipient Contient Un Gaz Dont La Pression Est de 1Document5 paginiUn Récipient Contient Un Gaz Dont La Pression Est de 1alphadzoÎncă nu există evaluări
- Chute Libre Verticale D Un Solide Exercices Non Corriges 4Document5 paginiChute Libre Verticale D Un Solide Exercices Non Corriges 4S Bouhmid100% (1)
- DC3 (19 04 08)Document6 paginiDC3 (19 04 08)Seif Souid100% (3)
- 5 Suivi D'une Transrormation Chimique PDFDocument16 pagini5 Suivi D'une Transrormation Chimique PDFbrini med100% (2)
- Exam 2022 Baba El Houssine End HHHHHDocument7 paginiExam 2022 Baba El Houssine End HHHHHsine abdellah100% (2)
- Cours - Chimie - Cinétique Chimique - Vitesse D'une Réaction - Bac Sciences Exp (2018-2019) MR Sfaxi Salah PDFDocument6 paginiCours - Chimie - Cinétique Chimique - Vitesse D'une Réaction - Bac Sciences Exp (2018-2019) MR Sfaxi Salah PDFmohamed amine hattayÎncă nu există evaluări
- Cours - Chimie Dosage - Bac Technique (2010-2011) Elève RadhouaneDocument5 paginiCours - Chimie Dosage - Bac Technique (2010-2011) Elève RadhouaneTawfiq Weld EL ArbiÎncă nu există evaluări
- Série Dexercices Corrigés N°2Document7 paginiSérie Dexercices Corrigés N°2chada100% (1)
- Extrait de Cours Sciences Physiques TerminaleDocument15 paginiExtrait de Cours Sciences Physiques TerminaleAmine schoolÎncă nu există evaluări
- Cours Dosage Acide Base 3Document8 paginiCours Dosage Acide Base 3Boussetta ZouhaierÎncă nu există evaluări
- Série D'exercices - Chimie Série Loi de Modération Et Loi D'action de Masse - Bac Math (2013-2014) MR Afdal AliDocument6 paginiSérie D'exercices - Chimie Série Loi de Modération Et Loi D'action de Masse - Bac Math (2013-2014) MR Afdal AliOussémaM'solli0% (1)
- Preparz Votre Baccalaureat Cinetique ChimiqueDocument4 paginiPreparz Votre Baccalaureat Cinetique ChimiquesdirianisÎncă nu există evaluări
- Corrige Ex Dipole RCDocument10 paginiCorrige Ex Dipole RCHiippy Peacawii100% (3)
- Série D'exercices Lycée Pilote - Sciences Physiques Oscillations Électriques en Régime Forcé - Bac Mathématiques (2010-2011) MR Sfaxi SalahDocument10 paginiSérie D'exercices Lycée Pilote - Sciences Physiques Oscillations Électriques en Régime Forcé - Bac Mathématiques (2010-2011) MR Sfaxi SalahIsmail Jarboui100% (2)
- Physique Chimie 2eme Bac Evaluation Diagnostique 6Document2 paginiPhysique Chimie 2eme Bac Evaluation Diagnostique 6Ťăhã Êìî100% (2)
- Exercices Corrigés RLC Forcés-Gazzah MahmoudDocument38 paginiExercices Corrigés RLC Forcés-Gazzah MahmoudDavies Dronda100% (2)
- Dipôles RL - RC - RLC - 2012 - LSLL PDFDocument7 paginiDipôles RL - RC - RLC - 2012 - LSLL PDFAnis DahnenÎncă nu există evaluări
- Série+d'exercices - Sciences Physiques Préparation Bac+2011 - Bac+Mathématiques (2010-2011) MR Benaich PDFDocument21 paginiSérie+d'exercices - Sciences Physiques Préparation Bac+2011 - Bac+Mathématiques (2010-2011) MR Benaich PDFBen Salem Noureddine0% (2)
- Série 2 - Quantité de MatièreDocument4 paginiSérie 2 - Quantité de MatièreHafid TaziÎncă nu există evaluări
- Série de Révision 2021 Sciences Corrigé Ma ClasseDocument72 paginiSérie de Révision 2021 Sciences Corrigé Ma ClasseSamir LoqmaneÎncă nu există evaluări
- Devoir de Contrôle N°2 2007 2008 (Nabeul)Document3 paginiDevoir de Contrôle N°2 2007 2008 (Nabeul)AliMchirgui100% (3)
- Mouvement de Projectiles Dans Un Champ de Pesanteur UniformeDocument3 paginiMouvement de Projectiles Dans Un Champ de Pesanteur Uniformestefan50% (2)
- Bac PCDocument56 paginiBac PCOumar Traoré100% (2)
- Exercices d'optique et d'électromagnétismeDe la EverandExercices d'optique et d'électromagnétismeEvaluare: 5 din 5 stele5/5 (1)
- Transformations Chimiques S Effectuant Dans Les 2 Sens Exercices Non Corriges 1 1Document4 paginiTransformations Chimiques S Effectuant Dans Les 2 Sens Exercices Non Corriges 1 1boufdili0% (2)
- Série 1 - équilibre Chimique (WWW - Pc1.ma)Document6 paginiSérie 1 - équilibre Chimique (WWW - Pc1.ma)b01554837Încă nu există evaluări
- Série 1 - Équilibre ChimiqueDocument6 paginiSérie 1 - Équilibre ChimiqueMed RT100% (1)
- EquilibreQoutionReactionExercices 16-17 PDFDocument4 paginiEquilibreQoutionReactionExercices 16-17 PDFالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Ex0 C3 Reactions Totales Ou LimiteesDocument1 paginăEx0 C3 Reactions Totales Ou LimiteesMed BriniÎncă nu există evaluări
- Maths FichesDocument29 paginiMaths FichesyassineÎncă nu există evaluări
- Chap03 FONCDocument7 paginiChap03 FONCchaari abdelouahadÎncă nu există evaluări
- Kiyal CoursDocument1 paginăKiyal Courschaari abdelouahadÎncă nu există evaluări
- 5q0v3 Doc1Document2 pagini5q0v3 Doc1chaari abdelouahadÎncă nu există evaluări
- Resume MP MathDocument147 paginiResume MP MathamenzouÎncă nu există evaluări
- Cours (Edition3) TypesetDocument398 paginiCours (Edition3) Typesetchaari abdelouahadÎncă nu există evaluări
- 7 Pdfsam (Jean-Claude Dupin, Jean-Luc Valein) IntroductionDocument137 pagini7 Pdfsam (Jean-Claude Dupin, Jean-Luc Valein) Introductionchaari abdelouahadÎncă nu există evaluări
- M.chapitre 1Document24 paginiM.chapitre 1chaari abdelouahadÎncă nu există evaluări
- M.chapitre 1Document24 paginiM.chapitre 1chaari abdelouahadÎncă nu există evaluări
- TD Thermodynamique Serie1Document1 paginăTD Thermodynamique Serie1chaari abdelouahadÎncă nu există evaluări
- CPGE OrganisAnneeScolaireDocument6 paginiCPGE OrganisAnneeScolairechaari abdelouahadÎncă nu există evaluări
- Filière MPDocument5 paginiFilière MPchaari abdelouahadÎncă nu există evaluări
- Phys StatDocument139 paginiPhys Statchaari abdelouahadÎncă nu există evaluări
- Phy 2 (Electmag) Tom1Document89 paginiPhy 2 (Electmag) Tom1chaari abdelouahadÎncă nu există evaluări
- Chapitre 3Document26 paginiChapitre 3chaari abdelouahadÎncă nu există evaluări
- Thermo PSICh 1Document17 paginiThermo PSICh 1chaari abdelouahadÎncă nu există evaluări
- Tableaux DeriveesDocument2 paginiTableaux Deriveeschaari abdelouahadÎncă nu există evaluări
- D3AP -كراس تعليم الحروف الفرنسية PDFDocument20 paginiD3AP -كراس تعليم الحروف الفرنسية PDFDjamel MousÎncă nu există evaluări
- Exercice Cinetique Chimique en Phase Gaz CopDocument1 paginăExercice Cinetique Chimique en Phase Gaz Copchaari abdelouahadÎncă nu există evaluări
- Problemes D Analyse 2Document389 paginiProblemes D Analyse 2Cherboub Eifore100% (4)
- Synthese Sonores UltrasonoresDocument2 paginiSynthese Sonores Ultrasonoreschaari abdelouahadÎncă nu există evaluări
- DS N°8 2011 - RLC - CompletDocument11 paginiDS N°8 2011 - RLC - Completchaari abdelouahadÎncă nu există evaluări
- 2010 Asie Exo1 Sujet Ondes Marees 4ptsDocument2 pagini2010 Asie Exo1 Sujet Ondes Marees 4ptschaari abdelouahadÎncă nu există evaluări
- Devoir de Synthèse N°1 Lycée Pilote - Physique - Bac Math (2008-2009) Elève MarwaDocument5 paginiDevoir de Synthèse N°1 Lycée Pilote - Physique - Bac Math (2008-2009) Elève Marwachaari abdelouahad67% (3)
- Nombres Réels - Borne Supérieure, Borne InférieureDocument3 paginiNombres Réels - Borne Supérieure, Borne Inférieurechaari abdelouahad80% (5)
- TdmatDocument7 paginiTdmatchaari abdelouahadÎncă nu există evaluări
- Dossier Candidature CNC 2013Document6 paginiDossier Candidature CNC 20132ste3Încă nu există evaluări
- Mode Operatoire - Teneur en CarbonateDocument1 paginăMode Operatoire - Teneur en Carbonateyao alexÎncă nu există evaluări
- TP Syn These AspirineDocument2 paginiTP Syn These AspirinePrince AbdooÎncă nu există evaluări
- 9782340002081Document11 pagini9782340002081msabÎncă nu există evaluări
- Devoir de Revision2 2023bac Math DefDocument5 paginiDevoir de Revision2 2023bac Math DefNour NessahÎncă nu există evaluări
- Injection Des FondationsDocument43 paginiInjection Des FondationsBenlala Aghiles AzzedineÎncă nu există evaluări
- BD Cours9 TransactionsDocument75 paginiBD Cours9 Transactionsabdelmadjid redjechtaÎncă nu există evaluări
- Les Solutions Acides Et Basiques Resume de Cours 1Document3 paginiLes Solutions Acides Et Basiques Resume de Cours 1jaoudsÎncă nu există evaluări
- PH SolutionDocument5 paginiPH SolutionBelgasem AsselÎncă nu există evaluări
- Alodine 1200Document4 paginiAlodine 1200Khalil AOUADÎncă nu există evaluări
- Synthèse Dun ConservateurDocument3 paginiSynthèse Dun Conservateurnguyen.htd42Încă nu există evaluări
- Procedure Gestion Prod Chimique TREDI v10 Et CourrierDocument4 paginiProcedure Gestion Prod Chimique TREDI v10 Et CourrierAdnen GuedriaÎncă nu există evaluări
- Exercice de Physique Chimie (Avec Correction) 1ère SpéDocument9 paginiExercice de Physique Chimie (Avec Correction) 1ère SpéRania. mtp100% (1)
- Extraction Et Purification Des GlucidesDocument20 paginiExtraction Et Purification Des GlucidesbagnenaÎncă nu există evaluări
- Cours Analyses Des Huiles PDFDocument45 paginiCours Analyses Des Huiles PDFBrahim AmiatafaÎncă nu există evaluări
- (C5) TDDocument4 pagini(C5) TDMeneÎncă nu există evaluări
- Cinet PDFDocument10 paginiCinet PDFLilMalcÎncă nu există evaluări
- Lexique PhysiqueDocument3 paginiLexique PhysiqueRataxÎncă nu există evaluări
- Cours Chimie 1h 5emeDocument39 paginiCours Chimie 1h 5emepiulita gabiÎncă nu există evaluări
- PyriteDocument4 paginiPyritealejo2705Încă nu există evaluări
- Exo TDDocument8 paginiExo TDBassirou YacoubaÎncă nu există evaluări
- Controle n2 Model3Document2 paginiControle n2 Model3el ghallouch mohamed amine100% (2)
- SUJET BAC Blanc Série D 2024Document5 paginiSUJET BAC Blanc Série D 2024saraakoa637Încă nu există evaluări
- Synthese Des Especes Chimiques Exerc2Document4 paginiSynthese Des Especes Chimiques Exerc2said khachouÎncă nu există evaluări
- Equi LibresDocument17 paginiEqui LibresBahous NasriÎncă nu există evaluări
- Série D'exercices N°10 - Sciences Physiques Dosage Acido Basique - Bac Sciences Exp (2011-2012) MR ALIBI ANOUAR 3Document8 paginiSérie D'exercices N°10 - Sciences Physiques Dosage Acido Basique - Bac Sciences Exp (2011-2012) MR ALIBI ANOUAR 3Tawfiq Weld EL Arbi75% (4)
- Chapitre4 BDADocument21 paginiChapitre4 BDASyliaÎncă nu există evaluări
- Devoir de Synthèse N°1 - Physique - 3ème Technique (2016-2017) MR Rahali ChawkiDocument2 paginiDevoir de Synthèse N°1 - Physique - 3ème Technique (2016-2017) MR Rahali Chawkiymokdad773Încă nu există evaluări
- Chimie: Devoir de Controle FerchiouDocument3 paginiChimie: Devoir de Controle Ferchioufethi1Încă nu există evaluări
- Chimie SuiteDocument29 paginiChimie SuiteProost N'guessanÎncă nu există evaluări
- Serie D'extractionDocument2 paginiSerie D'extractionbrahimza61Încă nu există evaluări