Documente Academic
Documente Profesional
Documente Cultură
Clase 15
Încărcat de
Luis Cesar Gutierrez Medrano0 evaluări0% au considerat acest document util (0 voturi)
32 vizualizări22 paginiDrepturi de autor
© © All Rights Reserved
Formate disponibile
PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca PDF, TXT sau citiți online pe Scribd
0 evaluări0% au considerat acest document util (0 voturi)
32 vizualizări22 paginiClase 15
Încărcat de
Luis Cesar Gutierrez MedranoDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 22
UNIVERSIDAD NACIONAL DE INGENIERIA
FACULTAD DE INGIENIERIA QUIMICA Y TEXTIL
CLASE 15
ING. MBA MARIO R. DE LA CRUZ AZABACHE
Junio 2014
BALANCE DE MATERIA Y ENERGIA
PI-111B
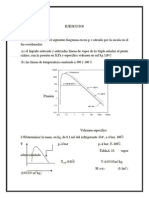
sobreenfriado
sobrecalentado
vapor
saturado
TABLAS TERMODINAMICAS
CAMINOS HIPOTETICOS
Cambios en presin con temperatura y estado de
agregacin (fase)constante.
Cambios en temperatura con presin y estado de
agregacin(fase) constante
Cambios de fase con presin y temperatura constantes
Mezclas de fases con temperatura y presin constante
Reaccin qumica con temperatura y presin constante
Cv Capacidad calorfica a volumen constante.
(Se configura un sistema cerrado)
U =
T2
T1
Cv(T) d T
Considerando un proceso de (T1, v1) a (T2, V2) esto es;
asumiendo que el volumen tambin vare. Se evala el proceso en
dos pasos.
U = U1 + U2
T1, v1 T2, v2
T1, v2
U1
U
U2
Se demuestra que para gases ideales y en una gran aproximacin
para lquidos y slidos que U depende solo de T, de tal manera que
U1=0 (excepto para gases no ideales) . Por tanto
U =
T2
T1
Cv(T) d T
Para:
Gas ideal: exacta
Slido liquido: buena aproximacin
Gas no ideal: vlida slo si V es cte.
U = U2
U1 = 0
(P1, V2) (P2,V2)
Cp Capacidad calorfica a presin constante
El aumento de temperatura a presin constante implica un
aumento del volumen y por tanto de la entalpa del sistema (se
configura un sistema abierto). De ah que:
H =
T2
T1
Cp(T) d T
Considerando un proceso de (T1, p1) a (T2, p2) esto es;
asumiendo que la presin vare. Se evala el proceso en dos
pasos.
H = H1 + H2
T1, p1 T2, p2
T1, p2
H1
H
H2
H1 = U1 + V p
Se demuestra
H1 = 0 para gas ideal
H1 = V p para lquido y slido
H = H1 + H2 =
T2
T1
Cp(T) d T SLIDO LQUIDO
V P +
H= H1 + H2 =
T2
T1
Cp(T) d T
GAS IDEAL: EXACTA
GAS NO IDEAL : EXACTA SOLO A P CONSTANTE
De donde
H= H1 + H2 =
T2
T1
Cp(T) d T
GAS IDEAL: EXACTA
GAS NO IDEAL : EXACTA SOLO A P CONSTANTE
De donde
rea, a
1
rea, a
2
Q
1
W
s2
INTERCAMBIADOR
DE CALOR
TURBINA
Flujo 1
Flujo 2
x
1
x
2
u
2
u
1
U + E
k
+ E
p
= Q - W
W
s1
BOMBA
REACTOR
CONTNUO
Q
2
TK MEZCLA
Q
3
REACTOR
BATCH
Calor de fusin: Cambio de entalpa por pasar del estado
slido al lquido.
Calor de solidificacin : Cambio de entalpa por pasar del
estado lquido al slido. El calor de fusin de una sustancia es
igual en valor absoluto al calor de solidificacin.
Calor de vaporizacin: Cambio de entalpa por pasar del
estado al lquido al gaseoso.
Calor de condensacin: Cambio de entalpa por pasar del
estado gaseoso al lquido. El calor de vaporizacin de una
sustancia es igual en valor absoluto al calor de condensacin.
Generalmente los valores de los calores latentes se aplican en su punto
normal de fusin o ebullicin; esto es a presin de 1 atmsfera y se
denominan CALORES ESTNDAR. El calor latente puede variar
notablemente con la temperatura, pero rara vez con la presin. TABLA B.1
3. Cambios de fase con presin y temperatura constantes
PROBLEMA.- A que velocidad en kJ/ s debe transferirse calor a una
corriente lquida de metanol a su punto de ebullicin normal para generar
1500 g/min de vapor de metanol saturado.
Q = 27.55 kJ / s
a) De la Tabla B.1 de Felder Hv= 35.27 kJ/ mol @ Teb= 64.7C
^
Q = H = n Hv
= 1500 g CH
3
OH/min x (1mol / 32 g CH
3
OH) x 35.27 kJ/mol x (1 min/60s)
^
Hv = -201.2 (- 238.6) = 36.4 kJ/mol a 25 C y 1 atm nota
H
f
(l) = - 238.6 kJ/mol ( a 25 C y 1 atm)
H
f
(g) = - 201.2kJ/mol ( a 25 C y 1 atm)
Q = 28.43 kJ / s
b) De la Tabla B.1 de Felder
H
f
lquido = - 57.04 kcal/ mol a 25 C, 1 atm
H
f
vapor = - 48.08 kcal/mol a 25 C, 1 atm
Hv = -48.08 - ( - 57.04) = 8.96 kcal/mol
= 37.48 kJ / mol
Q = 1500 g CH
3
OH/min x (1mol / 32 g CH
3
OH) x 37.48 kJ/mol x (1 min/60s)
Q = 29.27 kJ / s
c) De la Tabla 3.202 de Perry 5ta. Ed. Pg. 3-139
PROBLEMA 2.- Determinar la cantidad de calor requerido para
vaporizar 100 mol/h de n-hexano lquido a 25 C y 7 bar y
calentarla a 300 C a presin constante. Despreciar el efecto de la
presin en la entalpa.
A la presin de vapor de 7 bar (101 psia), el n-hexano est a
la temperatura de 295 F (146.1 C), (temperatura a la que
realmente ocurre la vaporizacin-Eq.). Ver diagrama de Cox
Considerando un sistema abierto:
Q = H
Felder, Tabla B.1, p.635 seala el valor de Hv en el punto de
ebullicin normal del n-hexano que es 69C (156.2 F):
Hv = 28.85 kJ/mol a 69 C
Por lo que es necesario; a fin de utilizar esta informacin;
encontrar una trayectoria que lleve al n-hexano, desde el
estado lquido al estado vapor a 69 C, en vez de la
temperatura real de vaporizacin 295 F (146.1 C) a presin
de 7 bar.
Nota.- Si no se cuenta con la informacin respecto a los
puntos inicial y final , entonces se puede construir caminos o
trayectorias hipotticas, cuidando que los puntos inicial y final
correspondan al del proceso.
Como es una funcin de
estado, no interesa el
camino seguido
TRAYECTORIA REAL
ESTADO 4
n-Hexano (v)
25 C, 7 bar
C
F
ESTADO 1
n-Hexano (l)
25 C, 7 bar
ESTADO 3
n-Hexano (v)
300 C, 7 bar
Si se tuviera Hv a 25:
Ruta: CF
Clculo en F a P cte.
H
A
ESTADO 2
n-Hexano (l)
69 C, 1 atm.
ESTADO 5
n-Hexano (v)
69 C, 1 atm
A
D
G
H
D
H
G
Se tiene Hv a 69
Ruta: ADG
Clculo en A y G
(P1,T1) (P2,T2)
ESTADO 3
n-Hexano (l)
146.1 C, 7 bar
ESTADO 6
n-Hexano (v)
146.1 C, 7 bar
B
E
H
Si se tuviera Hv a 146
Ruta: ABEH
Clculo en AB y H a P cte.)
a) Clculo de H
A
Caso: (P1,T1) (P2, T2) para lquidos, entonces
Para el n-hexano lquido
Tabla B.1 Felder S.G. = 0.659 0.659 kg/L
Tabla B.2 Felder Cp = 0.2163 kJ / (mol C)
T
1
= 25 C T
2
= 69 C
P
1
= 7 bar P
2
= 1 atm = 1.013 bar
H
A
= (- 0.0782 + 9.517) kJ / mol
= 9.44 kJ / mol
H = V P +
T2
T1
Cp(T) d T Slido lquido
b) Clculo de H
D
Caso: vaporizacin ( FELDER B.1)
H
D
= Hv (n-hexano a 69C, 1atm)
= 28.85 kJ/mol
H
G
= 47.1 kJ/mol
c) Clculo de H
G
Caso: (P1,T1) (P2, T2) para gases
H =
T1
Cp(T) d T Gas ideal (se asume)
T2
Cp (kJ/mol C) = 0.13744 + 40.85 x 10
5
T 23.92x 10
8
T
2
+ 57.66 x 10
12
T
3
P
1
= 1 atm = 1.013 bar P
2
= 7 bar
T
1
= 69 C T
2
= 300 C
Total por mol: H = 9.44 + 28.85 + 47.1 = 85.5 kJ/mol
Como 1 Kj / s = 1 kW
Q = 2.38 kW
Por 100 mol : Q = H = 100 mol/h x 85.5 kJ/mol = 8 550 kJ / h
PROBLEMA 1.- 10,000 lb/h de aire a 30 C y 10% de humedad relativa, entra a una cmara de
humidificacin adiabtica que opera a 1 atmsfera, saliendo con una humedad relativa del 60%.
Luego de esto pasa a un calentador de serpentn donde se calienta hasta 52 C, para tal efecto
se utiliza vapor sobrecalentado a 5 bar y 300 C. Si se sabe que el vapor sale del calentador a
250 C, determinar:
Agua
Aire
30 C
h
r
= 10%
Vapor sobrecalentado
5 bar, 300 C
Aire
h
r
= 60%
Aire
T = 52 C
a) El punto de roco del aire antes y despus de la cmara de humidificacin.
b) Cantidad de agua suministrada en la cmara de humidificacin.
c) La temperatura de salida y el calor ganado o perdido por el aire en la cmara de
humidificacin.
d) El flujo de vapor y el calor suministrado en el calentador.
TRANSFERENCIA DE CALOR SISTEMA AIRE-AGUA
PUNTO 1
ha = 0.0026 kg agua/kg BDA
Hr = 10 %
T
bs
= 30.0 C
T
bH
= 13.2 C
Tpr = - 4 C
H1 = 37.5 0.385 = 37.115 kJ / kg BDA
18 C
- 4 C
9 C
PUNTO 2
ha = 0.0076 kg agua/kg BDA
Hr = 60%
T
bs
= 18.0 C
T
bH
= 13.2 C
Tpr = 9 C
H2 = 37.5 0.107 = 37.393 kJ / kg BDA
30 C
kg agua / kg BDA
kg agua / kg BDA
37.5 kJ / kg BDA
- 0.0026
- 0.385 kJ / kg BDA
10%
- 0.0076
60%
- 0.107 kJ / kg BDA
1
2
CAMARA DE
HUMIDIFICACION
a) Punto de roco antes de la cmara : -3 C
Punto de roco despus de la cmara : 9 C
b) Cantidad de aire total : 10 000 lb/h = 4 535.97 kg / h
Aire seco : 4 535.97 x (1- 0.0026) = 4 524.18 kg BDA / h
Cantidad de agua suministrada
= 4 524.18 kgBDA / h x (0.0076 0.0026) kg agua / kg BDA
= 22.62 kg agua / h
c) Temperatura de salida de la cmara : 18 C
Como hay un aumento de la entalpa en el aire :
Calor ganado por el aire = 4 524.18 kg BDA / h x (37.393 37.115) kJ/kg
BDA
= 1 257.72 kJ / h
PUNTO 3
ha= 0.0076 kg agua/kg BDA
Hr = 9 %
T
bs
= 52 C
T
bh
= 24.2 C
Tpr = 9 C
H = 73.5 0.185 = 73.315 kJ / kg BDA
PUNTO 2
ha= 0.0076 kg agua/kg BDA
Hr = 60%
T
bs
= 18.0 C
T
bh
= 13.2 C
Tpr = 9 C
H = 37.5 0.107 = 37.393 kJ / kg BDA
30 C
kg agua / kg BDA
37.393 kJ / kg BDA
- 0.0026
18 C
- 4 C
10%
- 0.0076
60%
kg agua / kg BDA
9 C
- 0.107 kJ / kg BDA
1
2
CALENTADOR
52 C
73.315 kJ / kg BDA
3
- 0.185 kJ / kg BDA
d) Calor ganado por el aire en el calentador:
Calor ganado por el aire
= 4 524.18 kg BDA / h x (73.315 37.393) kJ/kg BDA
= 162 517.59 kJ / h ( = calor suministrado por el vapor)
Condiciones de vapor:
Vapor de entrada 300 C , 5 bar H1 = 3 065 kJ / kg
Vapor de salida 250 C, 5 bar H2 = 2 961 kJ / kg
Flujo de vapor
= 162 517.59 kJ/h / 104kJ/kg
= 1 562.67 kg / h
H = H2 H1= 104 kJ / kg
S-ar putea să vă placă și
- Ejercicios Introduccion A La Termodinamica Smith Van Ness AbbottDocument37 paginiEjercicios Introduccion A La Termodinamica Smith Van Ness AbbottRicardo Rosales70% (27)
- Balance de materia orientado a procesosDe la EverandBalance de materia orientado a procesosÎncă nu există evaluări
- Manual técnico de refrigerantesDe la EverandManual técnico de refrigerantesEvaluare: 4 din 5 stele4/5 (4)
- Problemas resueltos de Hidráulica de CanalesDe la EverandProblemas resueltos de Hidráulica de CanalesEvaluare: 4.5 din 5 stele4.5/5 (7)
- Ejercicios Termodinamica BasicaDocument13 paginiEjercicios Termodinamica BasicaNicolas Vasquez36% (11)
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe la EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSEvaluare: 4.5 din 5 stele4.5/5 (7)
- Guia de Ejercicios Certamen 2 II-2015Document4 paginiGuia de Ejercicios Certamen 2 II-2015AlexanderAndresÎncă nu există evaluări
- Trabajo Final TermoDocument69 paginiTrabajo Final TermoCäcilie Buentelo48% (21)
- Ejercicios Sobre La Primera Ley de La Termodinámica-2018Document23 paginiEjercicios Sobre La Primera Ley de La Termodinámica-2018David AriasÎncă nu există evaluări
- Termodinamica EjerciciosDocument9 paginiTermodinamica Ejerciciospincheruby666Încă nu există evaluări
- Parcial 2 PDFDocument50 paginiParcial 2 PDFLizeth Maria lizarazoÎncă nu există evaluări
- Guía de Problemas #2 PDFDocument4 paginiGuía de Problemas #2 PDFCamila CarvalloÎncă nu există evaluări
- Instalaciones I Psicrometria 2012Document27 paginiInstalaciones I Psicrometria 2012JOSE LUIS CANOVASÎncă nu există evaluări
- Informe Práctica 3Document56 paginiInforme Práctica 3Angie Purisaca SalinasÎncă nu există evaluări
- EjerciciosDocument6 paginiEjerciciosDiego Robles Cariaga0% (1)
- Anàlisis Fisico Quimico - Examen PDFDocument25 paginiAnàlisis Fisico Quimico - Examen PDFWilmer Acuña MarínÎncă nu există evaluări
- 07-1 - Práctica Primer PpioDocument3 pagini07-1 - Práctica Primer PpioEmilia TamantiniÎncă nu există evaluări
- Taller I Balance de EnergíaDocument6 paginiTaller I Balance de EnergíaAndres PaipaÎncă nu există evaluări
- Guia de EjerciciosDocument4 paginiGuia de EjerciciosLuis100% (1)
- 1 Sist Termod TecsupDocument34 pagini1 Sist Termod TecsupCharity MossÎncă nu există evaluări
- Segundo ParcialDocument8 paginiSegundo ParcialPasp SPÎncă nu există evaluări
- Calor y TermodinámicaDocument41 paginiCalor y TermodinámicaIng Alcantara RosangelaÎncă nu există evaluări
- Problemas de ENTROPIADocument5 paginiProblemas de ENTROPIAIng Biomédico100% (1)
- Tarea No.1 Transferencia de Masa 2Document9 paginiTarea No.1 Transferencia de Masa 2MercedesVelizÎncă nu există evaluări
- Evaporadores-2 2Document68 paginiEvaporadores-2 2Flavio AgustoÎncă nu există evaluări
- Probtermas de TermodinamicaDocument13 paginiProbtermas de TermodinamicawalterperelmanÎncă nu există evaluări
- Guia2 1 Ley TDDocument5 paginiGuia2 1 Ley TDCis FranÎncă nu există evaluări
- Balance de Materia y EnergiaDocument10 paginiBalance de Materia y Energia25burroÎncă nu există evaluări
- EVAPORACIDocument160 paginiEVAPORACIjuliosan123Încă nu există evaluări
- Trabajo Domiciliario Problemas EntropíaDocument5 paginiTrabajo Domiciliario Problemas EntropíaJesus Tasayco Noriega100% (1)
- Módulo 1-2C2015Document4 paginiMódulo 1-2C2015FranZsRomeroÎncă nu există evaluări
- GUIA DE ESTUDIO PARA EL ETS DE QUÍMICA APLICADA - Smid Santiago PedroDocument4 paginiGUIA DE ESTUDIO PARA EL ETS DE QUÍMICA APLICADA - Smid Santiago PedroJorge CastilloÎncă nu există evaluări
- Ejercicios de Taller Tercer CorteDocument6 paginiEjercicios de Taller Tercer CorteMAIRA ALEJANDRA BARRIOS GAMEZÎncă nu există evaluări
- Evaporador Simple NaOHDocument3 paginiEvaporador Simple NaOHEdgar MeléndezÎncă nu există evaluări
- Taller 2-EntropiaDocument6 paginiTaller 2-EntropiaDaniel NoreñaÎncă nu există evaluări
- Termodina MICADocument8 paginiTermodina MICAJose Fernando Cdlm100% (1)
- Fisica Semana 11Document7 paginiFisica Semana 11Hj Gh Leopoldo VilcaÎncă nu există evaluări
- Asignacion Ii de Principios 1-2024Document4 paginiAsignacion Ii de Principios 1-2024miguel2002rbÎncă nu există evaluări
- Problemas 1Document3 paginiProblemas 1Pablo De Lera RodríguezÎncă nu există evaluări
- Problem A Rio para Quimica2Document18 paginiProblem A Rio para Quimica2Minerva Mine0% (1)
- Ejercicios BEDocument6 paginiEjercicios BEAleyda Fernández LescanoÎncă nu există evaluări
- Problem As Min AsDocument17 paginiProblem As Min AsClaudio Pincheira RozasÎncă nu există evaluări
- FINMALDocument13 paginiFINMALAlexandraParedesPuertaÎncă nu există evaluări
- 1 Bloque de Ejercicios SF IDocument4 pagini1 Bloque de Ejercicios SF Iesteban castañeda ariasÎncă nu există evaluări
- Termod Practica N - 2 - 2014Document12 paginiTermod Practica N - 2 - 2014Manu GarcesÎncă nu există evaluări
- Problemario de TermodinamicaDocument3 paginiProblemario de TermodinamicaAdal Sebastián Rodríguez LunaÎncă nu există evaluări
- Relaciones TdsDocument3 paginiRelaciones TdsHJayMb100% (1)
- Termodinamica 2 C 15Document8 paginiTermodinamica 2 C 15Giovani Butron BordaÎncă nu există evaluări
- Serie de Problemas2 - Termo-MasterDocument3 paginiSerie de Problemas2 - Termo-MasterAltair PerezÎncă nu există evaluări
- Guía 9 - MaxwelDocument2 paginiGuía 9 - MaxwelMatii VegaÎncă nu există evaluări
- Ciclo de Refrigeración Por Compresión A Vapor en Una Cámara de RefrigeraciónDocument12 paginiCiclo de Refrigeración Por Compresión A Vapor en Una Cámara de RefrigeraciónKevin VasquezÎncă nu există evaluări
- Taller TermodinamicaDocument5 paginiTaller Termodinamicaapi-241769574Încă nu există evaluări
- Hoja Tema 8 Primer PrincipioDocument2 paginiHoja Tema 8 Primer PrincipioManolo EldelbomboÎncă nu există evaluări
- Ingeniería química. Soluciones a los problemas del tomo IDe la EverandIngeniería química. Soluciones a los problemas del tomo IÎncă nu există evaluări
- Psicometría. Principios básicos y protocolos experimentales diversosDe la EverandPsicometría. Principios básicos y protocolos experimentales diversosÎncă nu există evaluări
- El Mejor Libro de Preparación Para Tu Examen De Licencia De Operador De CalderaDe la EverandEl Mejor Libro de Preparación Para Tu Examen De Licencia De Operador De CalderaÎncă nu există evaluări
- Fundamentos de Comportamiento de Fases de GasDocument55 paginiFundamentos de Comportamiento de Fases de GasLuis Cesar Gutierrez Medrano100% (1)
- Analisis de LaboratorioDocument11 paginiAnalisis de LaboratorioLuis Cesar Gutierrez MedranoÎncă nu există evaluări
- 2 - MC MPP LixiviacionDocument19 pagini2 - MC MPP LixiviacionLuis Cesar Gutierrez MedranoÎncă nu există evaluări
- Trabajo PI-426B Acido AceticoDocument15 paginiTrabajo PI-426B Acido AceticoLuis Cesar Gutierrez MedranoÎncă nu există evaluări
- SeguridadDocument157 paginiSeguridadLuis Cesar Gutierrez MedranoÎncă nu există evaluări
- 6 - MC MPP ElectrolisisDocument11 pagini6 - MC MPP ElectrolisisLuis Cesar Gutierrez MedranoÎncă nu există evaluări
- PI-225/A Tercera Practica Calificada 2017-IDocument5 paginiPI-225/A Tercera Practica Calificada 2017-ILuis Cesar Gutierrez MedranoÎncă nu există evaluări
- Perdidas de Carga en Elementos de Un Sistema de Tuberias LabDocument27 paginiPerdidas de Carga en Elementos de Un Sistema de Tuberias LabYoee MendozaÎncă nu există evaluări
- Informe 4 EvaporacionDocument16 paginiInforme 4 EvaporacionLuis Cesar Gutierrez MedranoÎncă nu există evaluări
- Bombas LOU IDocument45 paginiBombas LOU ILuis Cesar Gutierrez MedranoÎncă nu există evaluări
- Primer Trabajo DomiciliarioDocument8 paginiPrimer Trabajo DomiciliarioLuis Cesar Gutierrez MedranoÎncă nu există evaluări
- Perchero ADocument5 paginiPerchero ALuis Cesar Gutierrez MedranoÎncă nu există evaluări
- Informe 8 FenolesDocument8 paginiInforme 8 FenolesLuis Cesar Gutierrez MedranoÎncă nu există evaluări