Documente Academic
Documente Profesional
Documente Cultură
Reacciones de Eliminacion
Încărcat de
Luis PompillaDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Reacciones de Eliminacion
Încărcat de
Luis PompillaDrepturi de autor:
Formate disponibile
FACULTAD DE
QUMICA
FACULTAD DE
QUMICA
3.1 Eliminacin bimolecular (E
2
)
3.2 Eliminacin monomolecular (E
1
)
3.3 E
2
vs E
1
3.4 Eliminacin vs Sustitucin
C C
sustrato reactivo
productos
+
Z
C C
A B
ZAB
+
C C
sustrato reactivo
productos
+
Z
C C
A B
ZAB
+
2-clorobutano
etanol
+ CH CH CH
3
CH
3
H Cl
CH CH CH
3
CH
3
KOH KCl HOH + +
2-buteno
(mayoritario)
hidrxido de
potasio
2,3-dibromobutano
+ CH CH CH
3
CH
3
Br Br
C C CH
3
CH
3
2 KOH 2 KBr 2 HOH + +
2-butino hidrxido de
potasio
C C
sustrato reactivo
productos
+
Z
C C
A B
ZAB
+
Este tipo de reacciones son llamadas 1,2-eliminacin o -eliminaciones. Y cuando se
elimina un H y un halgeno se llaman dehidrohalogenaciones:
tomo de C que pose el halgeno enumera como y el que soporta el H como .
Ejemplo
Ejemplos.
1.- E2
2.- E1
Mecanismo de Reaccin
Ejemplo
Perfil de Reaccin
Efecto del Sustrato
Importante en el Sustrato:
- Estructura del sustrato. Impedimentico estrico.
Carbocationes que no se puedan estabilizar.
- Que haya un buen grupo saliente. Aunque una E2 es
favorecida con grupos salientes dbiles, por que la
salida del H impulsa la salida el grupo saliente.
- Que hayan H cidos.
Efecto de las condiciones de reaccin. Basicidad
Cuanto ms fuerte sea la base mayor probabilidad habr de que haya una
reaccin de eliminacin.
Cuanto ms impedimento estrico tenga la base mayor probabilidad habr
de que haya una reaccin de eliminacin E2.
Disolventes
que favorezcan
la basicidad de
las bases.
Efecto de las condiciones de reaccin. Basicidad
Estereoqumica
La estereoqumica es la parte de la qumica que trata del estudio de la
disposicin espacial de los tomos que componen las molculas.
Regioqumica
La regioqumica es la parte de la qumica que trata del estudio de las zonas
que reaccionan en una molcula en una determinada reaccin.
Estereoqumica
Regioqumica
Doble enlaces: cis o trans
Los mecanismos concertados necesitan requerimientos estructurales
especficos para que puedan tener lugar. Los orbitales de los enlaces
que se estn formando se tienen que solapar con los orbitales de los
enlaces que se estn rompiendo. Cuando salen el hidrgeno y el
halgeno, los orbitales sp
3
cambian su hibridacin a orbitales p, y para
que stos se puedan solapar los dos orbitales sp
3
deben estar
paralelos. Esto requiere que la conformacin que debe adoptar el
hidrgeno y el grupo saliente sea anti-coplanar:
Los mecanismos concertados necesitan requerimientos estructurales
especficos para que puedan tener lugar. Los orbitales de los enlaces
que se estn formando se tienen que solapar con los orbitales de los
enlaces que se estn rompiendo. Cuando salen el hidrgeno y el
halgeno, los orbitales sp
3
cambian su hibridacin a orbitales p, y para
que stos se puedan solapar los dos orbitales sp
3
deben estar
paralelos. Esto requiere que la conformacin que debe adoptar el
hidrgeno y el grupo saliente sea anti-coplanar:
Los mecanismos concertados necesitan requerimientos estructurales
especficos para que puedan tener lugar. Los orbitales de los enlaces
que se estn formando se tienen que solapar con los orbitales de los
enlaces que se estn rompiendo. Cuando salen el hidrgeno y el
halgeno, los orbitales sp
3
cambian su hibridacin a orbitales p, y para
que stos se puedan solapar los dos orbitales sp
3
deben estar
paralelos. Esto requiere que la conformacin que debe adoptar el
hidrgeno y el grupo saliente sea anti-coplanar:
Los mecanismos concertados necesitan requerimientos estructurales
especficos para que puedan tener lugar. Los orbitales de los enlaces
que se estn formando se tienen que solapar con los orbitales de los
enlaces que se estn rompiendo. Cuando salen el hidrgeno y el
halgeno, los orbitales sp
3
cambian su hibridacin a orbitales p, y para
que stos se puedan solapar los dos orbitales sp
3
deben estar
paralelos. Esto requiere que la conformacin que debe adoptar el
hidrgeno y el grupo saliente sea anti-coplanar:
Se ha planteado que las reacciones de eliminacin E2 pueden tener
lugar mediante un estado de transicin alternativo al anti-coplanar, y
al que se le ha denominado estado de transicin sin-coplanar.
El estado de transicin sin-coplanar est menos favorecido que el
estado de transicin anti-coplanar por que presenta interacciones de
tipo estrico y de tipo electrnico. Las interacciones de eclipsamiento
y las interacciones estricas y electrnicas entre la base y el grupo
saliente no se dan en el estado de transicin anti-coplanar. Por tanto,
el estado de transicin sin-coplanar tiene mucho ms energa que el
estado de transicin anti-coplanar que es el que siguen la gran
mayora de las reacciones E2.
1
2
3
4
1
2
3
4
1 2
3
4
1
2 3
4
1
2
3
4
1 2
3
4
La reaccin E2 tiene lugar con una estereoqumica definida: el grupo
saliente y el hidrgeno sobre el carbono en posicin contigua han de
estar en disposicin antiperiplanar. Segn sea la naturaleza de los R
dar productos E o Z.
Si el doble enlace puede existir como mezcla de ismeros E/Z, la relacin
isomrica depender de las interacciones estricas en el estado de transicin
que conducen a cada ismero. Normalmente, est favorecida la formacin del
ismero con los grupos ms voluminosos situados en lados opuestos del doble
enlace (ismero E).
El producto 1-penteno es obviado por ahora porque se refiere a la Regioqumica
Si el doble enlace puede existir como mezcla de ismeros E/Z, la relacin
isomrica depender de las interacciones estricas en el estado de transicin
que conducen a cada ismero. Normalmente, est favorecida la formacin del
ismero con los grupos ms voluminosos situados en lados opuestos del doble
enlace (ismero E).
Los factores que favorecen una eliminacin u otra son complejos.
Algunas tendencias:
- Syn: dbiles (F o trietilamina) grupos salientes, Para algunos
sistemas cclicos la sin eliminacin llega al 90% debido a la
flexibilidad. Para sustratos muy impedidos estricamente. Base
permanece como par inico y hay un grupo saliente aninico.
Disolventes no disociantes como el benceno. Bases fuertes.
Se plantea un problema cuando hay varios hidrgenos b no
equivalentes, porque se plantea una competicin entre que hidrgeno
se elimina.
Se plantea un problema cuando hay varios hidrgenos b no
equivalentes, porque se plantea una competicin entre que hidrgeno
se elimina.
Cuando el 2-bromobutano se calienta en MeOH en presencia de
NaOMe se obtiene:
Cuando la reaccin de eliminacin E2 proporciona
mayoritariamente el alqueno ms sustituido (el 2-buteno en
este caso) se dice que el proceso transcurre con orientacin
Saytzeff. Esta tendencia es la ms general: la reaccin de
eliminacin E2 con bases poco voluminosas y buenos grupos
salientes proporciona mayoritariamente el alqueno ms
sustituido.
Por el contrario, cuando la reaccin de eliminacin E2
proporciona mayoritariamente el alqueno menos sustituido (el
1-buteno en la reaccin anterior) se dice que el proceso
transcurre con orientacin Hofmann. Se ve favorecido estos
productos con bases muy voluminosas y fuertes, y malos
grupos salientes.
Ejemplo: En el sistema 2-hexil, se observa la siguiente tendencia.
Por una lado, malos grupos salientes favorecen el producto
menos sustituido, al pasar de I a F se observa como aumenta el
% de 1-hexeno. Y por otro lado cuando pasamos de bases menos
voluminosas a bases ms voluminosas y fuertes tambin
aumenta la cantidad de % de 1-hexeno.
Ejemplo: Orientacin de la
eliminacin en funcin de la fuerza
de la base.
Ejemplo: La direccin de la eliminacin
tambin es afectada tanto por efectos
estricos de la base como del sustrato,
eliminndose el H menos impedido.
El alqueno cuanto ms sustituido es ms
estable.
Como se ha visto anteriormente, las eliminaciones E2 requieren que la
disposicin de los enlaces implicados en la reaccin sea anti-coplanar.
Una reaccin de eliminacin E2, sobre un compuesto ciclohexnico en
la conformacin de silla, slo puede tener lugar si el protn que va ser
capturado por la base y el grupo saliente estn en una disposicin
trans-diaxial.
La conformacin ms estable del bromociclohexano es la que sita al
tomo de bromo en posicin ecuatorial. Sin embargo, la reaccin de
eliminacin E2 no tiene lugar sobre el confrmero que presenta al
bromo en posicin ecuatorial sino sobre el otro confrmero, que es
minoritario en el equilibrio conformacional, pero presenta al bromo
en posicin axial.
La conformacin ms estable del bromociclohexano es la que sita al
tomo de bromo en posicin ecuatorial. Sin embargo, la reaccin de
eliminacin E2 no tiene lugar sobre el confrmero que presenta al
bromo en posicin ecuatorial sino sobre el otro confrmero, que es
minoritario en el equilibrio conformacional, pero presenta al bromo
en posicin axial.
La conformacin ms estable del bromociclohexano es la que sita al
tomo de bromo en posicin ecuatorial. Sin embargo, la reaccin de
eliminacin E2 no tiene lugar sobre el confrmero que presenta al
bromo en posicin ecuatorial sino sobre el otro confrmero, que es
minoritario en el equilibrio conformacional, pero presenta al bromo
en posicin axial.
Mezcla de Productos
S-ar putea să vă placă și
- Torsion 2Document30 paginiTorsion 2Juan Andrés Paredes Serrano75% (4)
- Práctica 3-Síntesis de La AspirinaDocument9 paginiPráctica 3-Síntesis de La AspirinaLuis Pompilla50% (2)
- Práctica 3-Síntesis de La AspirinaDocument9 paginiPráctica 3-Síntesis de La AspirinaLuis Pompilla50% (2)
- Precisión de Los Mapas y Planos.Document2 paginiPrecisión de Los Mapas y Planos.Javier Yribarren MondejarÎncă nu există evaluări
- Espectrometría de Infrarrojo - Caracterizacion de HCsDocument17 paginiEspectrometría de Infrarrojo - Caracterizacion de HCsErnesto-Ramos SuarezÎncă nu există evaluări
- QMC 302 Tema I Mecanismos de EliminaciónDocument46 paginiQMC 302 Tema I Mecanismos de EliminaciónAnonymous yEGP9hnÎncă nu există evaluări
- Alquenos y AlquinosDocument26 paginiAlquenos y AlquinosTami FA0% (1)
- Espectroscopia UV-Vis CualitativaDocument8 paginiEspectroscopia UV-Vis CualitativaSebastian OchoaÎncă nu există evaluări
- Diagrama de FlujoDocument5 paginiDiagrama de FlujoCésar Alberto Cansino PérezÎncă nu există evaluări
- Activantes y DesactivantesDocument7 paginiActivantes y DesactivantesEvelin ChandiÎncă nu există evaluări
- Sustitución NucleofílicaDocument19 paginiSustitución NucleofílicaedisonÎncă nu există evaluări
- SN2 SN1 CarbocationesDocument37 paginiSN2 SN1 CarbocationesMauricio Taborda MontañoÎncă nu există evaluări
- Practica 8Document16 paginiPractica 8Walter AndresÎncă nu există evaluări
- Práctica 17 - Led RGBDocument7 paginiPráctica 17 - Led RGBAbimelec GonzalezÎncă nu există evaluări
- Mecanismos de ReaccionDocument30 paginiMecanismos de ReaccionIVAN CISNEROS100% (1)
- SEArDocument40 paginiSEArHugo AlemánÎncă nu există evaluări
- Reporte de Lectura - La NegociaciónDocument7 paginiReporte de Lectura - La NegociaciónDulce María Alcalá VillaÎncă nu există evaluări
- Teoría OndulatoriaDocument13 paginiTeoría Ondulatoriavillalva reyes hilcias ebedÎncă nu există evaluări
- Heterociclos de 6 MiembrosDocument49 paginiHeterociclos de 6 MiembrosDaniel Ryūku Nishimura100% (1)
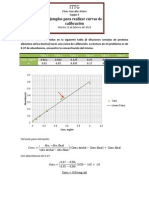
- Curvas de CalibracionDocument7 paginiCurvas de CalibracionArturo OBÎncă nu există evaluări
- Hidrocarburos AromaticosDocument54 paginiHidrocarburos AromaticosTatiana jazmin Neyra vergaraÎncă nu există evaluări
- Seleccion de Reactores Quimicos Curso EspecialDocument75 paginiSeleccion de Reactores Quimicos Curso EspecialRocíoVerásteguiParedesÎncă nu există evaluări
- Lipidos No SaponificablesDocument35 paginiLipidos No Saponificablesapi-3711538100% (1)
- Hidrocarburos AromáticosDocument64 paginiHidrocarburos AromáticosMoco LocoÎncă nu există evaluări
- Naftaleno TrabajoDocument16 paginiNaftaleno TrabajoAldair MedinaÎncă nu există evaluări
- Sustitución NucleofílicaDocument27 paginiSustitución NucleofílicaAlfredo Benjamin Fuentes OrtizÎncă nu există evaluări
- Guia de Cetonas y AldehidosDocument4 paginiGuia de Cetonas y Aldehidoskote_martinÎncă nu există evaluări
- ToxafenoDocument6 paginiToxafenoAntonia SanchezÎncă nu există evaluări
- Electrodos Indicadores de Membrana o Electrodos Selectivos de IonesDocument1 paginăElectrodos Indicadores de Membrana o Electrodos Selectivos de IonesRonalStivenEspañaÎncă nu există evaluări
- Definicion de Virus Hongos y BacteriasDocument4 paginiDefinicion de Virus Hongos y BacteriasNathan PetersonÎncă nu există evaluări
- Absorción AtómicaDocument23 paginiAbsorción AtómicaMaria Chavez JuarezÎncă nu există evaluări
- Practica 9 Grupal-Proteinas, AminoacidosDocument29 paginiPractica 9 Grupal-Proteinas, AminoacidosCynthia GonzalesÎncă nu există evaluări
- Métodos Electroquímicos CombinadoDocument63 paginiMétodos Electroquímicos CombinadoLeandro GarnicaÎncă nu există evaluări
- Apuntes de Quimica Inorgánica Unidad 4 PDFDocument41 paginiApuntes de Quimica Inorgánica Unidad 4 PDFDavid CámaraÎncă nu există evaluări
- Resultados Gama Practica 1 Punto de FusionDocument9 paginiResultados Gama Practica 1 Punto de FusionecvulcanoÎncă nu există evaluări
- Síntesis de Heterociclos Simples Por El Método Del SintónDocument26 paginiSíntesis de Heterociclos Simples Por El Método Del SintónWilbert Rivera MuñozÎncă nu există evaluări
- Compuestos OrganometalicosDocument17 paginiCompuestos OrganometalicosRonaldo RamirezÎncă nu există evaluări
- Cinética Química y Transporte de MembranaDocument33 paginiCinética Química y Transporte de Membranaapi-3802973100% (1)
- Osmómetro de Presión de VaporDocument3 paginiOsmómetro de Presión de VaporAnonymous EktX2tWÎncă nu există evaluări
- RetrosintesisDocument15 paginiRetrosintesisXiomara ACÎncă nu există evaluări
- ElectrolitosDocument10 paginiElectrolitosAmaral CoaguilaÎncă nu există evaluări
- Grupo CarboniloDocument3 paginiGrupo CarboniloDavo El ElegidodeDiosÎncă nu există evaluări
- Enlace Quimico 2016-IDocument62 paginiEnlace Quimico 2016-ILisa100% (1)
- Modificaciones PostraduccionalesDocument2 paginiModificaciones Postraduccionalesdaniel100% (1)
- Sem 12 - Mezcla RacemicaDocument5 paginiSem 12 - Mezcla RacemicaMartin Eduardo Marchena Tirado100% (2)
- Mecanismos de ReacciónDocument4 paginiMecanismos de ReacciónFaustoÎncă nu există evaluări
- Laboratorio PHDocument5 paginiLaboratorio PHSara Atehortua HincapieÎncă nu există evaluări
- AlcanosDocument13 paginiAlcanosYaqueline OrtizÎncă nu există evaluări
- Potenciales de ElectrodoDocument21 paginiPotenciales de ElectrodoArturo EsquivelÎncă nu există evaluări
- Reacciones de Sustitución Electrofílica AromáticaDocument2 paginiReacciones de Sustitución Electrofílica AromáticaKiiafÎncă nu există evaluări
- Unidad 01-C2Document59 paginiUnidad 01-C2Paz Cornejo PereiraÎncă nu există evaluări
- Procesos Enzimaticos Con El Medio AmbienteDocument9 paginiProcesos Enzimaticos Con El Medio AmbienteFernando GutiérrezÎncă nu există evaluări
- Fenomenos InterfacialesDocument28 paginiFenomenos InterfacialesFernando100% (1)
- Transiciones ElectronicasDocument48 paginiTransiciones ElectronicasBC NandoÎncă nu există evaluări
- La Hibridación Consiste en Una Mezcla de Orbitales Puros en Un Estado Excitado para Formar Orbitales Hibridos Equivalentes Con Orientaciones Determinadas en El EspacioDocument7 paginiLa Hibridación Consiste en Una Mezcla de Orbitales Puros en Un Estado Excitado para Formar Orbitales Hibridos Equivalentes Con Orientaciones Determinadas en El EspacioYamil ValenciaÎncă nu există evaluări
- PoliepóxidoDocument13 paginiPoliepóxidoValentina BeltránÎncă nu există evaluări
- PRACTICA DifusionDocument27 paginiPRACTICA DifusionjmedinaunacÎncă nu există evaluări
- Unidad IIDocument49 paginiUnidad IIMARCELO ORELLANA CARTAGENAÎncă nu există evaluări
- TEMA XI - Reacciones de EliminaciónDocument12 paginiTEMA XI - Reacciones de EliminaciónPia AguirreÎncă nu există evaluări
- Clase 4 - Haluros de Alquilo - Reaccion de Eliminación - 2023Document47 paginiClase 4 - Haluros de Alquilo - Reaccion de Eliminación - 2023BelenMinÎncă nu există evaluări
- Efectos de Los SustituyentesDocument7 paginiEfectos de Los SustituyentesPaula EmeryÎncă nu există evaluări
- Unidad 14 EliminacionDocument62 paginiUnidad 14 Eliminacionpepesajdnsahfds100% (1)
- Teoria Reacciones Organicas PDFDocument39 paginiTeoria Reacciones Organicas PDFNicolas DalurzoÎncă nu există evaluări
- 1 G LFQ - Aii 2014 IiDocument43 pagini1 G LFQ - Aii 2014 IiLuis PompillaÎncă nu există evaluări
- Sintesis OrganicaDocument131 paginiSintesis OrganicaSugey AÎncă nu există evaluări
- OndaDocument41 paginiOndaLuis PompillaÎncă nu există evaluări
- Condensacion AldolicaDocument14 paginiCondensacion AldolicaMannuel GuzmanyÎncă nu există evaluări
- Examen de ApTRtitudDocument2 paginiExamen de ApTRtitudLuis PompillaÎncă nu există evaluări
- t4 Reacciones de EliminacionDocument16 paginit4 Reacciones de EliminacionjosselinefÎncă nu există evaluări
- Simetria Inorganica PDFDocument14 paginiSimetria Inorganica PDFMarcelitha DimateÎncă nu există evaluări
- Tema 13Document15 paginiTema 13Jose David CastroÎncă nu există evaluări
- Trabajo Final de Laboratorio de Programación y ComputaciónDocument17 paginiTrabajo Final de Laboratorio de Programación y ComputaciónLuis PompillaÎncă nu există evaluări
- Sistemas de Unidades FísicasDocument117 paginiSistemas de Unidades FísicasJulio Fabián RodríguezÎncă nu există evaluări
- Introduccion A EstereoquimicaDocument90 paginiIntroduccion A EstereoquimicaLuis PompillaÎncă nu există evaluări
- Informe de Derivados de ÁcidoDocument9 paginiInforme de Derivados de ÁcidoLuis PompillaÎncă nu există evaluări
- Espectroscopia IRDocument16 paginiEspectroscopia IRLuis PompillaÎncă nu există evaluări
- Tintes de Plantas CaserasDocument16 paginiTintes de Plantas CaserasLuis Pompilla100% (1)
- BENZALDEHIDO InformeDocument6 paginiBENZALDEHIDO InformeLuis PompillaÎncă nu există evaluări
- Territorio y Ambiente. Aproximaciones MetodológicasDocument4 paginiTerritorio y Ambiente. Aproximaciones Metodológicasamorfo618Încă nu există evaluări
- Liturgía de La Gran Dieta CorregidaDocument55 paginiLiturgía de La Gran Dieta CorregidaJulicornioAzul100% (1)
- 8 Triptico Uso de ExtintoresDocument2 pagini8 Triptico Uso de ExtintoresMarAg KaragozÎncă nu există evaluări
- GitlabDocument5 paginiGitlabVanessa MendozaÎncă nu există evaluări
- Concepto Del Espacio de DisseDocument3 paginiConcepto Del Espacio de DisseWcaro TutiendaÎncă nu există evaluări
- La Estructura Agraria RoxDocument5 paginiLa Estructura Agraria RoxfrankalexisperezÎncă nu există evaluări
- Tema 3 Actividad 8Document2 paginiTema 3 Actividad 8LuzmyÎncă nu există evaluări
- Magic BusDocument11 paginiMagic BusJocimar Yampìer TallaÎncă nu există evaluări
- Con Qué Saberes Cuento LimpioDocument8 paginiCon Qué Saberes Cuento LimpioDavid Mdd JamxÎncă nu există evaluări
- Generalidades de La Motherboard o Tarjeta Madre Taller1Document14 paginiGeneralidades de La Motherboard o Tarjeta Madre Taller1EdierÎncă nu există evaluări
- Residuos Sólidos y Consumo Sustentable PDFDocument100 paginiResiduos Sólidos y Consumo Sustentable PDFYoselin CalderónÎncă nu există evaluări
- Histologia OjoDocument17 paginiHistologia OjoClaudia Barrionuevo MedinaÎncă nu există evaluări
- Tesis Nivel de Conocmiento y Frecuencia De-Retinopatia-Diabetica-2019 CorregidoDocument112 paginiTesis Nivel de Conocmiento y Frecuencia De-Retinopatia-Diabetica-2019 CorregidoMaCleyÎncă nu există evaluări
- Landó y Haene - 1996 - Carpintero Blanco (Melanerpes Candidus) en La ProvDocument3 paginiLandó y Haene - 1996 - Carpintero Blanco (Melanerpes Candidus) en La ProvJuan UrrutiaÎncă nu există evaluări
- Caracteristicas de La MusicaDocument8 paginiCaracteristicas de La Musicaedirley dayanna perez foreroÎncă nu există evaluări
- Mapa Conceptual Aceites EsencialesDocument1 paginăMapa Conceptual Aceites Esencialesnrag94Încă nu există evaluări
- Neuropsicología Del Suicidio Y Del Intento Autolítico. Francisco-José Celada-CajalDocument21 paginiNeuropsicología Del Suicidio Y Del Intento Autolítico. Francisco-José Celada-CajaleliasÎncă nu există evaluări
- Distribución NormalDocument6 paginiDistribución NormalMaricel Anahi Carbajal SantacruzÎncă nu există evaluări
- Noveno, 3 Bimestre. Filosofía.Document2 paginiNoveno, 3 Bimestre. Filosofía.JOHN HERREÑOÎncă nu există evaluări
- El NitrógenoDocument8 paginiEl Nitrógenoelvizito1991Încă nu există evaluări
- PROTOCOLOS SEGO. Trastornos Hipertensivos Del Embarazo PDFDocument10 paginiPROTOCOLOS SEGO. Trastornos Hipertensivos Del Embarazo PDFYusney Ramirez100% (1)
- Trabajo Dirigido para La Infraestructura Del Municipio de CORIPATADocument95 paginiTrabajo Dirigido para La Infraestructura Del Municipio de CORIPATAlizangela Vallejo Ch0% (1)
- La BrujulaDocument42 paginiLa BrujulaFrancisco David Medrano RiveraÎncă nu există evaluări
- Evaporacion WordDocument12 paginiEvaporacion WordAriana JuradoÎncă nu există evaluări
- 1 CacuDocument26 pagini1 CacuJorge Quispe RodasÎncă nu există evaluări
- Comandos de AutocadDocument13 paginiComandos de Autocadtonatiuh blandinoÎncă nu există evaluări
- CC - PPT - SegmentosDocument18 paginiCC - PPT - SegmentosAlejandro CrÎncă nu există evaluări
- Muntu Filosofia Africana en Manuel Zapata OlivellaDocument1 paginăMuntu Filosofia Africana en Manuel Zapata OlivellaMELQUIN ORTEGAÎncă nu există evaluări