Documente Academic
Documente Profesional
Documente Cultură
Roteiro 02
Încărcat de
Marcus LamimTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Roteiro 02
Încărcat de
Marcus LamimDrepturi de autor:
Formate disponibile
Faculdade de Engenharia e Cincias Qumicas
CINTICA QUMICA APLICADA E ELET!QUMICA
"#eir" de Aula Pr$#ica %& Pr"'ess"r Lauri(er#" Paul" )elem
INF!MA*+E, -EAI,.
A reao do acetato de etila em meio aquoso se processa lentamente,
sendo catalisada em soluo bsica ou cida.
O k
1
O
H
3
C C H
!
O H
H
3
C C C
!
H
"
OH H
O C
!
H
"
k
#1
OH
A reao $ re%ers&%el e a %elocidade da 'idr(lise num tempo qualquer $
i)ual * di+erena entre a %elocidade da decomposio e a %elocidade da reao
da reao in%ersa ,saponi+icao-. Assim, sua lei de %elocidade pode ser
escrita como.
# /ac. etila0 k
1
/)ua0 /ac. etila0 k
#1
/etanol0 /ac. ac$tico0
1ara solu2es dilu&das, a concentrao da )ua est em e3cesso e sua
%ariao com o tempo pode ser despre4ada com relao * da concentrao do
$ster. 5nto,
# /ac. etila0 k
1
/ac. etila0 k
#1
/etanol0 /ac. ac$tico0
6os tempos iniciais da 'idr(lise as concentra2es de etanol e cido
ac$tico so muito pequenas, podendo ser despre4adas. Assim, a lei da
%elocidade pode ser reescrita como.
# /ac. etila0 k
1
/ac. etila0
C.78sers7marcus.lamim79o:nloads7roteiro;!.doc
1
dt
d
dt
d
dt
d
s
V M
p
!
!
" "
M
1;;;
M
1;;;
S
V
1;;
M
1;;;
s
V M
p
!
!
!"
que caracteri4a uma reao de pseudo primeira ordem.
C/LCUL! DE 0
O %olume da soluo inicialmente +ormada por uma mistura de 1;;ml
de cido clor&drico, 1 < com " ml de acetato de etila $ desi)nad por =
s
. A
!">C, =
s
$ 1;?,@ ml ,menor que 1;" ml, porque a soluo no $ ideal-. =
3
$ o
%olume do 'idr(3ido de s(dio ;,!" < necessrio para neutrali4ar o cido
clor&drico presente na al"a de " ml do cido clor&drico. O %olume
necessrio para neutrali4ar o cido clor&drico presente na al"a em reao $
dado por =
3
1;;A=
s
, desde que o %olume total da mistura em reao pemanea
constante durante a 'idr(lise.
A massa de " ml de acetato de etila $ "
!
, onde
!
$
a densidade do
acetato de etila, ;,B!?"? )Aml a !">C e ;,B11C3 a 3">C- e o nDmero de mols
em " ml da amostra $ dado por
!
A<
!
, onde <
!
$
a massa molar do acetato de
etila.
O nDmero de moles de acetato de etila inicialmente presente numa
al"a de " ml da mistura em reao $ dado por .
9esde que mililitros de 'idr(3ido de s(dio ,< molAl- so
necessrios para titular o cido ac$tico produ4ido na 'idr(lise de 1 mol de
acetato de etil !" p
!
A<
!
=
s
mililitros so necessrios para titular o cido
ac$tico produ4ido na 'idr(lise completa do acetato de etila inicialmente
contido na al"a de " ml da mistura em reao.
O %olume total da 'idr(lise do s(dio, =
,
necessrio para titular o cido
clor&drico e o cido ac$tico produ4idos na 'idr(lise completa do acetato de
etila contido na al"a de " ml da mistura em reao $ dado por.
=
# =
3
MATEIAL NECE,,/I!.
! bal2es %olum$tricos de ";; ml
1 bureta de "; ml
C.78sers7marcus.lamim79o:nloads7roteiro;!.doc
!
1 pipeta %olum$trica de "; ml
1 pipeta %olum$trica de " ml
1 pipeta )raduada de 1; ml
! erlenmeEers de 1!" ml
1 b$quer de ";; ml
! recipientes para ban'o de )elo
)elo
6aCl ,comercial-
CronFmeto ,ou equi%alente-
Goluo de 6aOH apro3imadamente 1 H
Hcido clor&drico, acetato de etila
Hcido o3lico
Goluo de +enol+tale&na
Iermostato ,ou equi%alente-.
P!CEDIMENT! E1PEIMENTAL.
1reparar ";; ml de uma soluo de 'idr(3ido de s(dio ;,!" <, a aprtir
de uma soluo 1 < padroni4ada. 1reparar tamb$m ";; ml de uma soluo de
cido clor&drico 1 <.
Colocar num alenmeEer uma al"a de " ml da soluo de cido
clor&drico preparada e titular com 'idr(3ido de s(dio ;,!" <, usando como
indicador +enol+tale&na. Jepetir mais uma %e4 e tirar a m$dia dos resultados.
Colocar num erlenmeEer 1;; ml de HCl 1 < que de%e estar a !">C, e
em se)uida adicionar " ml de acetato de etila. Kuando a pipeta com acetato de
etila esti%er pela metade, acionar o cronFmetro e manter o meio reacional
termostati4ado a !">C.
Jetirar al"a de " ml do meio reacional em inter%alos de 1" minutos,
at$ um total de " medidas. Cada al"a de%e ser colocada num arlenmeEer L
contendo um pouco de )ua e +enol+tale&na , pre%iamente dei3ado num ban'o
de )elo picado com um pouco de 6aCl-, para brecar a %elocidade da reao.
5m se)uida, titular rapidamente com o 'idr(3ido de s(dio ;,!" <. O )elo
de%er permanecer at$ o +im da titulao.
O estudo cin$tico de%er ser repetido nas temperaturas de !">C a ?">C.
C.78sers7marcus.lamim79o:nloads7roteiro;!.doc
3
E,ULTAD!,.
1># Ma4er um )r+ico de lo) ,=
# =
t
- em +uno de t para as
temperaturas de !">, 3"> e ?">C, num mesmo papel de )r+ico-
!># Calcular as constantes de %elocidade para os casos acima.
3># Calcular a ener)ia de ati%ao para a 'idr(lise do acetato de etila.
?># Calcular a entalpia e a entropia de ati%ao, utili4ando na 5quao
de 5Erin) , coe+iciente de trans+erNncia-. 9iscutir sobre os %alores obtidos.
"># Comentar sobre a ordem da reao.
EFE2NCIA,.
=er re+erNncias )erais sobre Cin$tica.
C.78sers7marcus.lamim79o:nloads7roteiro;!.doc
?
S-ar putea să vă placă și
- Manual e Guia Do Palhaço de Rua - ChacovacciDocument117 paginiManual e Guia Do Palhaço de Rua - ChacovacciClown e GregorianoÎncă nu există evaluări
- Comprovante de Inscrição Semestral 2008 2Document1 paginăComprovante de Inscrição Semestral 2008 2Ricardo Alexandre Santana da Silva100% (2)
- Mat Olimpiadas2 4anoDocument29 paginiMat Olimpiadas2 4anoceliavenancioÎncă nu există evaluări
- Margem de Segurança e Alavancagem OperacionalDocument4 paginiMargem de Segurança e Alavancagem OperacionalMartinelli Paixao100% (2)
- Guia Do Usuário OTDRDocument248 paginiGuia Do Usuário OTDRCameras ControleÎncă nu există evaluări
- Tese Mobilidade Urbana Bicicletas PDFDocument306 paginiTese Mobilidade Urbana Bicicletas PDFMarcos PrudenteÎncă nu există evaluări
- Eletromagnetismo I - Aula 01 - Histórico + AplicaçõesDocument35 paginiEletromagnetismo I - Aula 01 - Histórico + AplicaçõesLeandro SilvaÎncă nu există evaluări
- 3 Conhecendo As Atitudes Do CoraçãoDocument7 pagini3 Conhecendo As Atitudes Do CoraçãoCesar AraujoÎncă nu există evaluări
- ATIVIDADE DE ESTUDO 01 - ATÉ 07 - 03 - 2024 - Revisão Da TentativaDocument8 paginiATIVIDADE DE ESTUDO 01 - ATÉ 07 - 03 - 2024 - Revisão Da TentativaOlivelton SantosÎncă nu există evaluări
- Mestre Mantak Chia - A Alquimia Interior TaoistaDocument11 paginiMestre Mantak Chia - A Alquimia Interior TaoistaportynsqÎncă nu există evaluări
- AFRICANIDADE: TER OU NÃO TER? As Leis e A Responsabilidade Sociocultural Do Professor de Língua Portuguesa Com A TemáticaDocument14 paginiAFRICANIDADE: TER OU NÃO TER? As Leis e A Responsabilidade Sociocultural Do Professor de Língua Portuguesa Com A TemáticaMARCIAREMEDIOÎncă nu există evaluări
- Protocolo - Sistema Sensorial SomáticoDocument4 paginiProtocolo - Sistema Sensorial SomáticoIsabelle NogueiraÎncă nu există evaluări
- Recheio Mania - Pão Sírio - Árabe CaipiraDocument1 paginăRecheio Mania - Pão Sírio - Árabe CaipiraCandida JoaoÎncă nu există evaluări
- Cetoacidose DiabéticaDocument35 paginiCetoacidose DiabéticaMichella Przybycien50% (2)
- ANTIARRITMICOSDocument54 paginiANTIARRITMICOSFlavio BorgesÎncă nu există evaluări
- Laudos Cap 3 - Noções Básicas Do Direito de FamíliaDocument30 paginiLaudos Cap 3 - Noções Básicas Do Direito de Famíliapatypappacena100% (1)
- Simulado Premiado BNCCDocument13 paginiSimulado Premiado BNCCmelissalima618Încă nu există evaluări
- Ae - Pal10 - Teste2 - Nov - 2019 Após o Casamento de Ines Com o EscudeiroDocument4 paginiAe - Pal10 - Teste2 - Nov - 2019 Após o Casamento de Ines Com o Escudeiro7sÎncă nu există evaluări
- Biomecânica Funcional em PediatriaDocument101 paginiBiomecânica Funcional em PediatriaMARIA EDUARDA DA SILVA SANTOSÎncă nu există evaluări
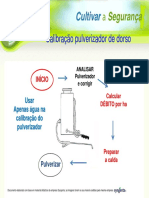
- Calibracao Pulverizador Dorso PDFDocument11 paginiCalibracao Pulverizador Dorso PDFLeonardo VascoÎncă nu există evaluări
- De Como Filosofar É Aprender A MorrerDocument1 paginăDe Como Filosofar É Aprender A MorrerFernando Alencar IsvessiaÎncă nu există evaluări
- 5 - FT - Preparação Teste Avaliação 2Document9 pagini5 - FT - Preparação Teste Avaliação 2alexandre ribeiroÎncă nu există evaluări
- Embriologia Sistema RenalDocument14 paginiEmbriologia Sistema RenalJoao SousaÎncă nu există evaluări
- Loucura (Part. Veigh e MC Cabelinho) - Borges - LDocument1 paginăLoucura (Part. Veigh e MC Cabelinho) - Borges - LpachulinksclounÎncă nu există evaluări
- Dia Da Literatura BrasileiraDocument1 paginăDia Da Literatura BrasileiraCamila Juliana SantanaÎncă nu există evaluări
- 1 SMDocument2 pagini1 SMleandro_freeÎncă nu există evaluări
- Provão 9 AnoDocument5 paginiProvão 9 AnoAdriani Salete Mokfa PanhoÎncă nu există evaluări
- Siter 2Document32 paginiSiter 2folha18Încă nu există evaluări
- Índice-Remissivo (Without Edits)Document28 paginiÍndice-Remissivo (Without Edits)luisacedroÎncă nu există evaluări
- Art 04 - Construir Dique de Contenção para o TQ-310P-0103Document5 paginiArt 04 - Construir Dique de Contenção para o TQ-310P-0103Ivson BrenoÎncă nu există evaluări