Documente Academic
Documente Profesional
Documente Cultură
Reacción Química 4to Félix
Încărcat de
María Luz Avila0 evaluări0% au considerat acest document util (0 voturi)
35 vizualizări9 paginiDrepturi de autor
© © All Rights Reserved
Formate disponibile
DOCX, PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
0 evaluări0% au considerat acest document util (0 voturi)
35 vizualizări9 paginiReacción Química 4to Félix
Încărcat de
María Luz AvilaDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 9
REACCIN QUMICA
Una reaccin qumica es una trasformacin, o cambio qumico en el que
una o ms sustancias, a las que se denominan reactivos, se transforman
en una u otras sustancias llamadas productos.
TIPOS DE REACCIONES DE ACUERDO A LOS PRODUCTOS QUE FORMAN
NOMBRE DESCRIPCIN EJEMPLO
COMBINACIN DIRECTA
Es el tipo ms sencillo de reaccin qumica.
Dos sustancias se combinan para formar una
tercera.
La combinacin puede darse entre:
ELEMENTO+ELEMENTO
ELEMENTO+COMPUESTO
COMPUESTO+COMPUESTO
2Mg+ O
2
-->2MgO
2NO + O
2
--> 2NO
2
NH
3
+ HCl
-->NH
4
Cl
DESCOMPOSICIN
Un compuesto se descompone en partes ms
sencillas.
NH
4
Cl-->NH
3
+ HCl
2HgO-->2Hg + O
2
2H
2
O -->2H
2
+ O
2
DESPLAZAMIENTO SIMPLE
Una sustancia ocupa el lugar de otra.
La desplaza siguiendo una serie de actividad.
Zn+ 2HCl--> ZnCl
2
+ H
2
H
2
+ CuO -->Cu + H
2
O
DESPLAZAMIENTO DOBLE
Las partes de dos componentes se cambian de
lugar.
CuCl
2
+Na
2
S 2NaCl +CuS
QU SE NECESITA PARA QUE OCURRA UNA REACCIN QUMICA? TEORA DE LAS COLISIONES
Segn la Teora de las colisiones, desarrollada en la dcada
de 1920, las partculas de los reactivos( que podran ser
molculas, tomos o iones) deben poseer energa cintica
suficiente como para que, al chocar entre s se rompan
las uniones que mantienen juntos a los tomos que
componen esas partculas, y permitan que se formen
nuevas combinaciones. En otras palabras, para que sea
posible el reordenamiento de tomos.
REACCIONES QUMICAS E INTERCAMBIO DE ENERGA:
Todo cambio, implica un intercambio de energa. Durante
una reaccin qumica, la ruptura y la formacin de enlaces
qumicos, van acompaadas de intercambios de energa. Es
decir, las reacciones qumicas van acompaadas de
intercambios de energa. Es decir, las reacciones qumicas,
intercambian con el ambiente calor, luz y electricidad,
entre otras formas de energa. Al encender una vela,
percibimos luz y calor, porque se producen
transformaciones qumicas en los materiales.
De acuerdo con el tipo de intercambio de energa con el ambiente, las reacciones qumicas se pueden clasificar en endergnicas
y exergnicas.
Una reaccin qumica es exergnica, si se produce con liberacin de energa: en forma de luz, calor y/o electricidad. En
este caso, energa liberada durante la formacin de nuevos enlaces de los productos es mayor a la de los reactivos .
Por ejemplo, en los seres vivos, las reacciones de descomposicin, o catabolismo, como la degradacin de alimentos,
liberan energa. Esta energa est disponible en el organismo para ser usada en otras actividades.
Una reaccin qumica es endergnica, si para producirse requiere energa proveniente del entorno, ya sea como luz,
calor y/o electricidad. La energa consumida para romper los enlaces de los reactivos es mayor que la que se libera en
la formacin de los productos,
Por ejemplo, la variedad de sntesis de molculas complejas que ocurren en un organismo, a partir de otras ms
sencillas, que se denomina anabolismo, forma un conjunto de reacciones que requieren energa del entorno.
LOS INTERCAMBIOS DE CALOR: El calor es una forma de energa, est presente en muchas reaciones qumicas. En funcin del
intercambio de calor, las reacciones pueden clasificarse en reacciones exotrmicas o endotrmicas.
Las reacciones qumicas exotrmicas, se producen con liberacin de calor al ambiente. Ej: La combustin es un tipo de
reaccin exotrmica: a partir de un pequeo aporte inicial de energa, por ejemplo, una pequea chispa, se libera una
gran cantidad de energa en forma de calor que puede ir acompaada de la formacin de energa lumnica.
Las reacciones qumicas endotrmicas: necesitan aporte de calor para poder producirse. El intercambio de calor que
ocurre durante la coccin de un alimento, es un ejemplo de reaccin endotrmica, pues se necesita del aporte de calor
de la combustin que ocurre con los gases que salen por la hornalla de la cocina.
LA ENERGA DE ACTIVACIN
Para que una reaccin qumica pueda iniciarse, es necesario que las partculas que las partculas que forman parte de los
reactivos produzcan choques efectivos. Para ello, deben alcanazar una cierta energa, llamada energa de activacin. Muchas
veces, la energa que proporciona el ambiente es sufieciente para que la reaccin se inicie. Cuando esto ocurre, decimos que la
reaccin es espontnea. Por ejemplo, cuando se produce un incendio en un ambiente rido y caluroso, porque se han
encendido ramas secas.
Pero otras veces, es necesario del aporte de energa extra para que la reaccin comience.
VELOCIDADES DE REACCIN:
Una vez que se desencadena la reaccin Cun rpida es?
La velocidad de reaccin, es la cantidad de producto que se obtiene (o producto que se consume) en un tiempo determinado.
Las cantidades iniciales de los reactivos: cuanto mayor sea la proporcin de reactivos, es ms probable que sus
partculas choquen de manera efectiva, ya que estarn ms cercanas en el espacio.
La superficie de contacto entre los reactivos: los reactivos slidos, cuanto ms finamente divididos son, mayor
superficie de contacto presentan entre s.
La temperatura: por lo general, la velocidad de una reaccin qumica aumenta con la temperatura, ya que cuando
aumenta sta, las partculas se mueven ms y por consiguiente, es ms probable que choquen.
La presin: cuando aumenta la presin en los gases, aumenta la velocidad de reaccin.
Presencia de catalizadores: los catalizadores son sustancias que modifican la velocidad de una reaccin qumica, sin
sufrir alteraciones en su composicin. La presencia de una catalizador altera la energa de activacin de una reaccin.
Existen catalizadores negativos, que retardan la velocidad de la reaccin y catalizadores positivos que aumentan la
velocidad de la reaccin. Los seres vivos, poseen enzimas, catalizadores biolgicos que aceleran los proceso
metablicos, por ejemplo: la ptialina es una enzima presente en la saliva que favorece la digestin de almidones.
EQUILIBRIO QUMICO
Qu es el Equilibrio Qumico?
Es un estado de cualquier sistema en el que exista al menos una reaccin reversible y la concentracin de cada especie no
cambie conforme pase el tiempo.
Para que la concentracin de cada especie que est presente en el sistema no cambie a pesar de la existencia de una o ms
reacciones, en cada reaccin reversible la velocidad de la reaccin que se desplaza hacia la izquierda debe ser igual a la
velocidad de reaccin que se desplaza hacia la derecha.
Por qu se da el equilibrio?
La existencia de las reacciones reversibles es la causa del Equilibrio Qumico, no es posible entender este concepto sin
comprender el fenmeno de reversibilidad.
Qu es una reaccin reversible?
Son dos reacciones en las que intervienen los mismos compuestos. Los reactivos de una reaccin son los productos de la
segunda.
Por qu hay reacciones reversibles?
Para que existan reacciones qumicas, las molculas deben chocar unas con otras, estos choques pueden unir a ms de una
molcula o pueden "desunirla" para dar lugar a la molcula original. Esta explicacin es un acercamiento a la teora de las
colisiones, que es la que mejor describe la causa del por qu de las reacciones reversibles.
Cmo son las reacciones reversibles?
SIMULTNEAS. Las dos reacciones se llevan a cabo al mismo tiempo, normalmente una reaccin es ms rpida que la otra y
por eso no se aprecia la simultaneidad ni el equilibrio.
La mayora del curso consiste en resolver problemas numricos, el caso de "Equilibrio Qumico" no es la excepcin. Esta pgina
contiene las generalidades sobre las expresiones del equilibrio.
Para la reaccin
la constante de equilibrio se escribe:
Los productos se encuentran en el numerador para que la magnitud de la constante indique la magnitud del desplazamiento de
la reaccin hacia la derecha.
TRABAJO PRCTICO:
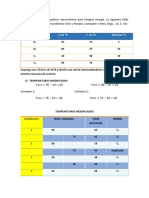
1) Dadas las siguientes reacciones: Clasifcalas de acuerdo a los productos que forman:
NMEROS DE OXIDACIN. El nmero de oxidacin es un nmero entero que representa el nmero de electrones que un
tomo pone en juego cuando forma un compuesto determinado.
El nmero de oxidacin es positivo si el tomo pierde electrones, o los comparte con un tomo que tenga tendencia a
captarlos. Y ser negativo cuando el tomo gane electrones, o los comparta con un tomo que tenga tendencia a cederlos.
En los iones monoatmicos la carga elctrica coincide con el nmero de oxidacin. Cuando nos refiramos al nmero de
oxidacin el signo + o - lo escribiremos a la izquierda del nmero, como en los nmeros enteros. Por otra parte la carga de los
iones, o nmero de carga, se debe escribir con el signo a la derecha del dgito: Ca2+ in calcio(2+), CO32- in carbonato(2-).
REGLAS PARA DETERMINAR EL NMERO DE OXIDACIN:
. Todo elemento en su estado libre (natural o no combinado) tiene como nmero de
oxidacin cero: Fe, Sn, Zn, Na, Ca. Tome en cuenta que hay varias molculas que en su estado libre
existen como molculas diatmicas, ejemplo: F
2
, Cl
2
, Br
2
, I
2
, H
2
, N
2
, O
2
.
2. En los iones monoatmicos el nmero de oxidacin es la carga del ion:
ION nmero de oxidacin
Na
+
+1
Ca
+2
+2
Al
+3
+3
Fe
+3
+3
3. En la mayora de los compuestos, el oxgeno tiene un nmero de oxidacin de -2: Esto se
en el caso de los compuestos covalentes. Una excepcin importante son los perxidos (compuestos
que contienen un grupo O
2
-2
) en los cuales se asigna a cada oxgeno un estado de oxidacin de -1:
COMPUESTO nmero de oxidacin del
oxgeno
Na
2
O -2
CaO -2
Al
2
O
3
-2
Cl
2
O
7
-2
4. El Hidrgeno tiene estado de oxidacin -1 con No Metales y +1 con los Metales.
Ej:
5. La suma algebrica de los nmeros de oxidacin de todos los tomos en la frmula de un
compuesto es cero. Ejemplo, el cido ntrico (HNO
3
)
6. En los iones complejos, la suma algebrica de los nmeros de oxidacin de todos sus
tomos es igual a la carga del ion.
EJERCICIOS
2) Dadas las siguientes reacciones Redox:
a) Determina las especies que se oxidan y se reducen.
b) Balancea las ecuaciones
S-ar putea să vă placă și
- Diseño Curricular Biología-Ciclo BásicoDocument3 paginiDiseño Curricular Biología-Ciclo BásicoMaría Luz AvilaÎncă nu există evaluări
- Ruis Diaz, Rodrigo MarceloDocument2 paginiRuis Diaz, Rodrigo MarceloMaría Luz AvilaÎncă nu există evaluări
- Medios Perseverancia - MagaliDocument26 paginiMedios Perseverancia - MagaliMaría Luz AvilaÎncă nu există evaluări
- Actividades de Apoyo para Alumnos en Riesgo Pedagógico - 1er AñoDocument3 paginiActividades de Apoyo para Alumnos en Riesgo Pedagógico - 1er AñoMaría Luz AvilaÎncă nu există evaluări
- Capítulo 5 - DIARIOS DE FORMACIÓN - Transitar La Formación PedagógicaDocument7 paginiCapítulo 5 - DIARIOS DE FORMACIÓN - Transitar La Formación PedagógicaMaría Luz Avila0% (1)
- Secuencia Didáctica 3° 2017Document20 paginiSecuencia Didáctica 3° 2017María Luz AvilaÎncă nu există evaluări
- La Observación: Educar La Mirada para Significar La ComplejidadDocument13 paginiLa Observación: Educar La Mirada para Significar La ComplejidadMaría Luz Avila100% (1)
- Cambios Sociales y en El Mundo Del Trabajo PDFDocument31 paginiCambios Sociales y en El Mundo Del Trabajo PDFMaría Luz AvilaÎncă nu există evaluări
- Uniones QuímicasDocument3 paginiUniones QuímicasMaría Luz AvilaÎncă nu există evaluări
- La Observación: Educar La Mirada para Significar La ComplejidadDocument13 paginiLa Observación: Educar La Mirada para Significar La ComplejidadMaría Luz Avila100% (1)
- Dinamicas para Catequesis PDFDocument116 paginiDinamicas para Catequesis PDFIngeniero Hernandez100% (2)
- Magnitudes Físicas y Unidades de MedidaDocument4 paginiMagnitudes Físicas y Unidades de MedidaMaría Luz AvilaÎncă nu există evaluări
- Burbujas de Fueg1Document6 paginiBurbujas de Fueg1María Luz AvilaÎncă nu există evaluări
- Magnitudes Físicas y Unidades de MedidaDocument4 paginiMagnitudes Físicas y Unidades de MedidaMaría Luz AvilaÎncă nu există evaluări
- Burbujas de Fueg1Document6 paginiBurbujas de Fueg1María Luz AvilaÎncă nu există evaluări
- Clase Articulación Con SeptimoDocument16 paginiClase Articulación Con SeptimoMaría Luz AvilaÎncă nu există evaluări
- Culturas HibridasDocument1 paginăCulturas HibridasMaría Luz AvilaÎncă nu există evaluări
- Compuestos Binarios OxigenadosDocument5 paginiCompuestos Binarios OxigenadosMaría Luz Avila71% (7)
- Bacterias NitrificantesDocument3 paginiBacterias NitrificantesMaría Luz AvilaÎncă nu există evaluări
- La Energía MecánicaDocument8 paginiLa Energía MecánicaMaría Luz AvilaÎncă nu există evaluări
- Cuadernillo Química IDocument12 paginiCuadernillo Química IMaría Luz AvilaÎncă nu există evaluări
- Buceo BibliográficoDocument3 paginiBuceo BibliográficoMaría Luz Avila0% (1)
- Fórmulas Movimiento Rectilineo Uniformemente VariadoDocument1 paginăFórmulas Movimiento Rectilineo Uniformemente VariadoMaría Luz AvilaÎncă nu există evaluări
- Cestos de BasuraDocument11 paginiCestos de BasuraMaría Luz AvilaÎncă nu există evaluări
- TEORÍAS-PROBLEMAS EPISTEMOLÓGICOS-AVILA-VALDEZdocxDocument17 paginiTEORÍAS-PROBLEMAS EPISTEMOLÓGICOS-AVILA-VALDEZdocxMaría Luz AvilaÎncă nu există evaluări
- Combustión de Una VelaDocument1 paginăCombustión de Una VelaMaría Luz AvilaÎncă nu există evaluări
- Configuración Electrónic1Document1 paginăConfiguración Electrónic1María Luz AvilaÎncă nu există evaluări
- Mar AralDocument9 paginiMar AralMaría Luz AvilaÎncă nu există evaluări
- Quéelemetos Componenen La HarinaDocument3 paginiQuéelemetos Componenen La HarinaMaría Luz Avila100% (2)
- 20 Conferencia Bioenergia Luis BuyoDocument32 pagini20 Conferencia Bioenergia Luis BuyoRichard HolguinoÎncă nu există evaluări
- Azul y Naranja Colorido Hamburguesa Organizador GráficoDocument1 paginăAzul y Naranja Colorido Hamburguesa Organizador GráficoJesus EliasÎncă nu există evaluări
- Prueba de Ciencias Naturales Cadena AlimentariaDocument4 paginiPrueba de Ciencias Naturales Cadena AlimentariaCristian Cortez100% (1)
- CcNn6p U02Document12 paginiCcNn6p U02888Încă nu există evaluări
- Moreno Ibañez - Procesos Formadores - La PodzolizaciónDocument8 paginiMoreno Ibañez - Procesos Formadores - La PodzolizaciónMatías RuizÎncă nu există evaluări
- Deforestacion en El Departamento de ChimaltenangoDocument6 paginiDeforestacion en El Departamento de ChimaltenangoSergio René Roquel MoralesÎncă nu există evaluări
- Bioparque Mancora - ResoluciónDocument10 paginiBioparque Mancora - ResoluciónLin mordÎncă nu există evaluări
- Tesis Maestria Cesar Pol Arevalo ArandaDocument97 paginiTesis Maestria Cesar Pol Arevalo Arandabenedicto maximo requez sanchezÎncă nu există evaluări
- ANEXO #03 - Estudio de Caracterización de Residuos Sólidos MDCC-2012Document130 paginiANEXO #03 - Estudio de Caracterización de Residuos Sólidos MDCC-2012chrystin2009Încă nu există evaluări
- Unam (MX) (ENES-Juniquilla) Ciencias de La Tierra PlanDocument6 paginiUnam (MX) (ENES-Juniquilla) Ciencias de La Tierra PlanDavid RamosÎncă nu există evaluări
- Silabus IngA Ambien 20 1Document7 paginiSilabus IngA Ambien 20 1Niagq GutYesÎncă nu există evaluări
- Proyecto de Honguitos ComestiblesDocument3 paginiProyecto de Honguitos ComestiblesIvanÎncă nu există evaluări
- Corriente Tent°K T Sal °K WCP KW/ °KDocument3 paginiCorriente Tent°K T Sal °K WCP KW/ °KGasersithoOnneÎncă nu există evaluări
- El Potencial ZetaDocument3 paginiEl Potencial Zetalaura7863Încă nu există evaluări
- AyoreódeDocument29 paginiAyoreódevladimir wankar choque morales25% (4)
- Balanceo de Ecuaciones Redox Método Del Ión ElectrónDocument5 paginiBalanceo de Ecuaciones Redox Método Del Ión ElectrónLeonardo Peña FabilaÎncă nu există evaluări
- Primera Practica de Mecanica de Suelos Aplicado A Cimentaciones para Vias de TransporteDocument27 paginiPrimera Practica de Mecanica de Suelos Aplicado A Cimentaciones para Vias de TransporteLuis Gala AcuñaÎncă nu există evaluări
- Evaluación Final Química 01 Pregrado 2023Document4 paginiEvaluación Final Química 01 Pregrado 2023piscina municipalÎncă nu există evaluări
- Problemas - Reactores Act. Ultimos TemasDocument80 paginiProblemas - Reactores Act. Ultimos TemasOskar Zavaleta VilcaÎncă nu există evaluări
- Triptico Panel SolarDocument3 paginiTriptico Panel SolarShirley Estefani Mauricio Pedrañas100% (2)
- 4ta. PRÁCTICA DE LABORATORIO. (Entre El 1 y El 11 de Noviembre) PDFDocument5 pagini4ta. PRÁCTICA DE LABORATORIO. (Entre El 1 y El 11 de Noviembre) PDFMetelo en pleitoÎncă nu există evaluări
- Presentación Final-Gestion AmbientalDocument43 paginiPresentación Final-Gestion Ambientalfrank torrejon chachiÎncă nu există evaluări
- Diversidad y Claseficacion Plan Mejora Grado 10Document9 paginiDiversidad y Claseficacion Plan Mejora Grado 10Alejandra OcampoÎncă nu există evaluări
- Solución Del Taller CIENCIASDocument7 paginiSolución Del Taller CIENCIASJuan andres PiñerosÎncă nu există evaluări
- Calculo de CalderaDocument22 paginiCalculo de CalderaarkjoeÎncă nu există evaluări
- Cuestionario Normas de Gestion AmbientalDocument7 paginiCuestionario Normas de Gestion Ambientalrandy_silvestre_20% (1)
- Saffo 1987 New Light On Seaweeds EsDocument25 paginiSaffo 1987 New Light On Seaweeds EsGabrielaÎncă nu există evaluări
- Plan Limpieza ParedesDocument10 paginiPlan Limpieza ParedesJaime Chavez MÎncă nu există evaluări
- Bio2. Evolución y Selección NaturalDocument11 paginiBio2. Evolución y Selección NaturalCarola JamesÎncă nu există evaluări