Documente Academic
Documente Profesional
Documente Cultură
Depa - Fquim.unam - MX Amyd Archivero Estequimetria 115
Încărcat de
Juan TobónTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Depa - Fquim.unam - MX Amyd Archivero Estequimetria 115
Încărcat de
Juan TobónDrepturi de autor:
Formate disponibile
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
1/45
QUMICA GENERAL
SERIE DE PROBLEMAS
UNIDAD ESTEQUIOMETRA
Conceptos Bsicos.
El peso molecular (PM) de una sustancia es la suma de los pesos atmicos de todos los
tomos en una molcula de la sustancia y se expresa en unidades de masa atmica. Por
ejemplo, el peso molecular del agua, H
2
O, es 18.0 uma.
El peso frmula (PF) de una sustancia es la suma de los pesos atmicos de todos los tomos
en una unidad formular del compuesto, sea molecular o no. Por ejemplo, el cloruro de sodio,
NaCl, tiene un peso frmula de 58.44 uma. Este compuesto es inico, as que estrictamente la
expresin peso molecular de NaCl no tiene significado. El peso molecular y el peso frmula
calculados a partir de la frmula molecular de una sustancia son idnticos.
Un mol (smbolo mol) se define como la cantidad de una sustancia dada que contiene tantas
molculas o unidades formulares como el nmero de tomos en exactamente 12 g de carbono-
12. El nmero de tomos en una muestra de 12 g de carbono-12, se llama nmero de
Avogadro (N
A
) y tiene un valor de 6.023 10
23
. Por lo tanto, un mol de molculas, de tomos,
etctera, contiene el nmero de Avogadro. Por ejemplo, una mol de etanol es igual a 6.023
10
23
molculas de etanol.
La masa molar de una sustancia es la masa de una mol de la sustancia. El carbono-12 tiene,
por definicin, una masa molar de exactamente 12 g/mol. Para todas las sustancias, la masa
molar en gramos por mol es numricamente igual al peso frmula en unidades de masa
atmica.
La frmula emprica (o la frmula ms sencilla) para un compuesto es la frmula de una
sustancia, escrita con los ndices con nmeros enteros ms pequeos. Para la mayor parte de
las sustancias inicas, la frmula emprica es la frmula del compuesto, pero con frecuencia
ste no es el caso de las sustancias moleculares. Por ejemplo, la frmula del perxido de sodio,
un compuesto inico de Na
+
y O
2
2-
, es Na
2
O
2
. Su frmula emprica es NaO. Por lo tanto, la
frmula molecular de un compuesto es un mltiplo de su frmula emprica.
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
2/45
El reactivo limitante es aquel que se encuentra en una proporcin menor a la requerida
estequiomtricamente de acuerdo a la reaccin balanceada, por lo que es consumido
completamente cuando se efecta una reaccin hasta ser completa. El reactivo que no se
consume completamente se denomina reactivo en exceso. Una vez que uno de los reactivos
se agota, se detiene la reaccin, por lo que las moles de producto siempre son determinadas
por las moles presentes del reactivo limitante.
El rendimiento terico de una reaccin es la cantidad mxima de producto que se puede
obtener por una reaccin a partir de cantidades dadas de reactivos y se calcula a partir de la
estequiometra basada en el reactivo limitante. El porcentaje de rendimiento de un producto
es el rendimiento real (determinado experimentalmente) expresado como un porcentaje del
rendimiento terico calculado.
Formas comunes para expresar la concentracin de una disolucin:
Molaridad
Molaridad = No. de moles de soluto ___
VOLUMEN de la disolucin en litros
= g de soluto _________________
PM de soluto/VOLUMEN de la disolucin en litros
Porcentajes
La composicin en porciento indica cmo estn los porcentajes de la masa de cada elemento
en una cantidad dada de un compuesto.
a) Porcentaje peso/peso (% m/m)
%m/m = masa del componente en la disolucin x100
masa total de la disolucin
b) Porcentaje volumen/volumen (v/v)
%v/v= Volumen del soluto en la disolucin x 100
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
3/45
Volumen total de la disolucin
c) Porcentaje peso/volumen (p/v)
%p/v= masa del soluto en la disolucin (g) x 100
Volumen total de la disolucin
Molalidad
Molalidad = No. de moles de soluto =__________g del soluto________
MASA del disolvente en Kg (PM soluto x MASA del disolvente (Kg)
Normalidad
Normalidad =_____No. de equivalentes de soluto______
Volumen de la disolucin en litros
Para la expresin de la concentracin como normalidad se tiene que definir el equivalente de
soluto de acuerdo a la reaccin con la cual se trabaje.
Fraccin molar
F.M. de x = ________No. de moles del componente X________
No. total de mol de los componentes de la disolucin
Partes por milln
En el caso de la primera frmula debemos tener el peso del soluto y de la disolucin en las
mismas unidades (Kg)
ppm= ___Peso del soluto___ x 10
8
ppm = ___mg del soluto___
Peso de la disolucin Kg de la disolucin
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
4/45
I. CONCEPTO DE MOL
Problemas resueltos
El cianuro de hidrgeno, HCN, es un lquido incoloro, voltil, con el olor de ciertos huesos de
frutas (por ejemplo los huesos del durazno y cereza). El compuesto es sumamente
venenoso. Cuntas molculas hay en 56 mg de HCN, la dosis txica promedio?.
0.056 g HCN x
HCN mol 1
molculas 10 6.02
HCN g 27
HCN mol 1
23
= 1.25 x 10
21
molculas de HCN
Cuntos gramos de metano, CH
4
hay en 1.20 x 10
-4
molculas?.
1.20 x 10
-4
molculas CH
4
x
4
23
4
CH mol 1
g 16
x
molculas 10 x 6.02
CH 1mol
= 3.19 x 10
-27
g
Cuntos moles de sulfuro de sodio, Na
2
S corresponden a 2.709 x 10
24
molculas de
sulfuro de sodio y cuntos moles de sodio?.
2.709 x 10
24
molculas Na
2
S x
S Na molculas 10 x 6.02
S Na mol 1
2
23
2
= 4.5 mol Na
2
S
4.5 mol Na
2
S x
S Na mol 1
Na mol 2
2
= 9 mol Na
Cuntos tomos de oxgeno hay en 1 g de O
2
, O
3
y de O?.
1 g O
2
x
O mol
tomos 10 6.02
O mol 1
O mol 2
x
O g 32
O mol 1
23
2 2
2
= 3.76 x 10
22
tomos
1 g O
3
x
O mol 1
tomos 10 6.02
O mol 1
O mol 3
x
O g 48
O mol 1
23
3 3
3
= 3.76 x 10
22
tomos
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
5/45
1 g O x
O mol 1
tomos 10 6.02
O mol 1
mol 1
x
gO 16
O mol 1
23
O
= 3.76 x 10
22
tomos
Cuntos moles de personas hay en el mundo si la poblacin es de diez mil millones?.
10 x 10
9
personas x
personas 10 6.02
mol 1
23
= 1.66 x 10
-14
moles
Problemas a resolver
1. Una muestra de dicromato de amonio, contiene 1.81 x 10
24
tomos de hidrgeno cuntos
gramos de nitrgeno hay en ella?.
2. Cuntas molculas de agua hay en dos mL de una disolucin de HCl , cuya densidad y %
en masa son 1.19 g/mL y 37% en masa respectivamente?.
3. Una planta de produccin de NaOH, concentra una disolucin que contiene 88% en masa
de agua y 12% en masa de NaOH. Si la densidad de esta disolucin es de 1.1309 g/mL:
a) Cuntos iones OH
-
hay por mL de disolucin?
b) Cuntos moles de iones sodio hay por mL de disolucin?
4. Qu volumen (mL) de una disolucin de etanol (C
2
H
6
O) que tiene 94% de pureza en masa,
contiene 0.2 moles de etanol? . La densidad de la disolucin es 0.807 g/mL.
Cuntos tomos de hidrgeno hay en 10 mL de etanol? (considera que es una disolucin
acuosa).
5. Una aleacin que contiene hierro (54.7% en masa), nquel (45.0 %) y manganeso (0.3%)
tiene una densidad de 8.17 gramos sobre cm
3
:
a) Cuntas moles de hierro hay en un bloque de aleacin que mide 10cm x 20cm x
15cm?.
b) Cuntos tomos de manganeso hay en la mitad del bloque que se menciona en el
inciso anterior?.
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
6/45
6. Una muestra de 50 gramos de calcopirita contiene 28 gramos de CuFeS
2
.
Cul es el
porcentaje de cobre en la calcopirita?.
II. FRMULA MNIMA Y MOLECULAR
Problemas resueltos
El nitrato de amonio, NH
4
NO
3
, el cual se prepara a partir de cido ntrico, se emplea como
fertilizante nitrogenado. Calcula los porcentajes de masa de los elementos en el nitrato de
amonio.
% N =
g 80
g 14.0 2
100 = 35 %
% H =
g 80
g 1.01 4
100 = 5%
% O =
g 80
g 16 3
100 = 60%
Una muestra de 3.87 mg de cido ascrbico (vitamina C) por combustin genera 5.80 mg de
CO
2
y 1.58 mg de H
2
O. Cul es la composicin en porciento de este compuesto (el
porcentaje de masa de cada elemento)?. El cido ascrbico contiene solamente C, H y O.
5.8 x 10
-3
g CO
2
x
C mol 1
C g 12
x
CO mol 1
C mol 1
CO g 44
CO mol 1
2 2
2
= 1.58 x 10
-3
g C = 1.58 mg
1.58 x 10
-3
g H
2
O x
H mol 1
H g 1.01
x
H mol 1
H mol 2
H g 18
H mol 1
2 2
2
O O
O
= 1.77 x 10
-4
g H = 0.177 mg
% masa de C =
mg 3.87
mg 58 . 1
x 100 = 40.82%
% masa de H =
mg 3.87
mg 77 . 1
x 100 = 4.57%
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
7/45
% masa de O =
mg 3.87
mg 11 . 2
x 100% = 54.61%
Una muestra de un compuesto que pesa 83.5 g contiene 33.4 g de azufre. El resto es de
oxgeno, Cul es la frmula mnima?.
33.4 g S x
S g 32
S mol 1
= 1.04 mol S
50.1 g O x
g 16
O mol 1
= 3.13 mol O
S=
mol 1.04
mol 04 . 1
= 1 , O =
mol 1.04
mol 13 . 3
= 3
Frmula mnima SO
3
El cido benzoico es un polvo blanco, cristalino, que se emplea como preservativo de
alimentos. El compuesto contiene 68.8% de C, 5.0% de H y 26.2% de O; por masa. Cul
es la frmula mnima?.
68 g C x
C g 12
C mol 1
= 5.66 mol C
5 g H x
H g 1.01
H mol 1
= 4.95 mol H
26.2 g O x
O g 16
O mol 1
= 1.64 mol O
C =
1.64
66 . 5
= 3.45 , H =
1.64
95 . 4
= 3.01 , O =
1.64
66 . 5
= 1
Multiplicado todo por 2
C
7
H
6
O
2
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
8/45
La composicin en porciento del acetaldehdo es 54.5% de C, 9.2% de H y 36.3 de O, y su
peso molecular es 44 uma. Determina la frmula molecular del acetaldehdo.
C = 54.5 g C x
C g 12
mol 1
= 4.54 mol C
H = 9.2 g H x
H g 01 . 1
mol 1
= 9.11 mol H
O= 36.3 g O x
O g 16
mol 1
= 2.27 mol O
1
2.27
2.27
O , 4.01
2.27
9.11
H , 2
2.27
4.54
C = = = = = =
Frmula mnima, C
2
H
4
O
1
Peso frmula, 44 uma
Frmula molecular:
frmula Peso
molecular Peso
n =
Donde
n= No. por el cual se deben multiplicar los subndices de la Frmula mnima para obtener la
molecular.
molecular Frmula mnima Fmula 1
uma 44
uma 44
n = = =
Problemas a resolver
7. El xido de titanio (IV) se calienta en corriente de hidrgeno perdiendo algo de oxgeno. Si
despus de calentar 1.598 g de TiO
2
el peso se reduce en 0.16 g Cul es la frmula del
producto final?.
8. Al quemar una muestra de un hidrocarburo se producen 12.28 g de CO
2
y 5.86 g de
agua.
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
9/45
a) Cuntos gramos de muestra se quemaron?
b) Cul es la composicin porcentual de cada elemento en el compuesto?
c) Cul es la frmula emprica del compuesto orgnico?
9. Hay un oxicido orgnico muy abundante en limones, naranjas y toronjas, cuando se
queman 5 gramos de este cido se producen 6.875 gramos de bixido de carbono y 1.875
gramos de agua, si 0.25 moles de este compuesto equivalen a 48 gramos.
a) Cul es la composicin porcentual del oxicido?
b) Cul es la frmula mnima del cido?
c) Cul es la frmula molecular del compuesto orgnico?
10. El mentol, la sustancia orgnica que podemos oler en las pastillas mentoladas para la tos,
se compone de carbono, hidrgeno y oxgeno. Una muestra de 100.1 mg de mentol se
quema en presencia de oxgeno, produciendo 282.9 mg de bixido de carbono y 115.9 mg
de agua.
a) Determina la composicin porcentual de cada elemento en la sustancia orgnica.
b) Cul es la frmula mnima del mentol?.
c) Si 15.6 gramos son 0.1 moles del compuesto Cul es su frmula molecular?.
11. Se determin que un compuesto orgnico contiene solo 3 elementos: carbono, hidrgeno y
cloro. Cuando se quem por completo en el aire una muestra de 1.5 gramos del
compuesto, se produjeron 3.52 g de CO
2
. En otro experimento, el cloro de una muestra de
un gramo del compuesto, se transform en 1.27 gramos de cloruro de plata.
a) Cul es la masa en gramos que hay de cada elemento en 1.5 gramos de muestra del
compuesto mencionado?
b) Cul es la composicin porcentual de cada elemento en el compuesto?
c) Cul es la frmula mnima para esta sustancia orgnica?
12. La alicina es el compuesto que proporciona el olor caracterstico al ajo. Al realizar un
anlisis de este compuesto se encuentra que tiene la siguiente composicin porcentual:
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
10/45
C:44.4%, H:6.21%, S:39.5%, O:9.86%. Tambin se encuentra que su masa molar es igual
a 162 g/mol. Calcula la frmula emprica y la frmula molecular de este compuesto.
13. En un experimento se obtuvo un compuesto de hierro y oxgeno que tienen 27.65% de
oxgeno y 72.34% de hierro. Obtenga la frmula mnima del compuesto.
14. En una reaccin de combustin se queman 3 gramos de un compuesto orgnico, si se
producen 8 gramos de CO
2
Qu porcentaje en masa del compuesto es carbono?.
15. Determina el porcentaje en masa de hierro que hay en el cloruro frrico hexahidratado.
16. La vitamina E tiene 11.21% en masa de hidrgeno. Si un mol de vitamina E contiene 3.01 x
10
25
tomos de hidrgeno;
a) Cul es la masa molar de la vitamina E?
b) Cuntos tomos de hidrgeno hay por molcula de vitamina E?
III. EXPRESIONES DE LA CONCENTRACIN Y DILUCIONES
Problemas resueltos
Una muestra de cloruro de sodio, NaCl, que pesa 0.0678 g se coloca en un matraz
volumtrico de 25.0 mL y se afora con agua destilada. Cul es la molaridad de la
disolucin resultante?.
0.0678 g NaCl x
NaCl g 58.5
NaCl mol 1
= 0.00116 mol NaCl
L 1
mL 1000
mL 25
mol 0.00116
M = = 0.0464
Cuntos mililitros de NaCl 0.163 M se requieren para obtener 0.0958 g de cloruro de
sodio?
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
11/45
NaCl mol 1
NaCl g 58.5
mL 1000
NaCl mol 0.163
= 0.00954 g/mL
NaCl g 0.00954
disolucin mL 1
NaCl g 0958 . 0 = 10.04 mL
Cuntos moles de cloruro de sodio deben colocarse en un matraz volumtrico de 50 mL
para obtener una disolucin 0.15 M de NaCl? A cuntos gramos de cloruro de sodio
equivalen?.
mL 1000
NaCl mol 0.15
50 mL = 7.5 x 10
3
moles NaCl
7.5 x 10
3
moles NaCl x 58.5 g NaCl = 0.4388 g NaCl
1 mol NaCl
El cido actico glacial, CH
3
COOH tiene una concentracin 99.5% m/m y una densidad de
1.05 g/cm
3
. Determina la concentracin molar, normal y % m/v de este cido.
L 1
mL 1000
mL 1
disolucin g 1.05
disolucin g 100
COOH CH g 99.5
COOH CH g 60
COOH CH mol 1
M
3
3
3
= =17.4125 mol/L
L 1
mL 1000
mL 1
disolucin g 1.05
disolucin g 100
COOH CH g 99.5
COOH CH g 60
COOH CH mol 1
COOH CH mol
COOH CH eq 1
N
3
3
3
3
3
= =
17.4125 eq/L
104.475 100
mL 1
disolucin g 1.05
disolucin g 100
CH g 99.5
v
m
%
3
= =
COOH
Una solucin se prepar disolviendo 16.0 g de cloruro de calcio, CaCl
2
en 72.0 g de agua, y
tiene una densidad de 1.180 g/mL a 20
o
C. Cul es la concentracin % m/m y % m/v, M y m
de la disolucin?
Masa de la disolucin = 16 g CaCl
2
+ 72 g H
2
O = 88 g disolucin
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
12/45
18.18% 100
disolucin g 88
CaCl g 16
m
m
%
2
= =
100 x
disolucin mL 1
disolucin g 1.18
disolucin g 100
CaCl g 18.18
v
m
%
2
= =21.454
mol/L 1.95
L 1
mL 1000
x
mL 1
disolucin g 1.18
disolucin g 100
CaCl g 18.18
x
CaCl g 110
CaCl mol 1
2
2
2
= = M
2.020
kg 1
g 1000
CaCl g 110
mol 1
x
H g 72
CaCl g 16
2 2
2
= =
O
m mol/kg
Calcula la molaridad de una disolucin de agua oxigenada, H
2
O
2
, si se requieren 36.44 mL
de una disolucin de permanganato de potasio, KMnO
4
, M=0.01652 para oxidar
completamente 25 mL de agua oxigenada.
) ( 2 (g) 2
) (
2
) ( 2 2
-
(ac) 4
) ( 8H O 2Mn 5H 2MnO 6
l
ac
ac
ac O O H + + + +
+ +
2 2
3 -
4
2 2 4
H moles 10 x 1.5049
MnO mol 2
H mol 5
x
mL 1000
KMnO mol 0.01652
x 44 . 36 O
O
mL =
mol/L 0.06019
L 1
mL 1000
x
mL 25
mol 10 x 1.5049
-3
= = M
Un qumico titul 25.0 mL de NaOH 0.20 M con una disolucin 0.50 N de H
2
SO
4
. Cuntos
mililitros de la disolucin de cido sulfrico utiliz si la reaccin fue cuantitativa?.
) ( 2 ) ac ( 4 2 (ac) 4 2 (ac)
O H SO Na SO H NaOH 2
l
+ +
4 2
4 2 4 2
4 2 4 2
H de mL 10
H eq 0.5
mL 1000
x
H mol 1
H eq 2
x
NaOH mol 2
H mol 1
x
mL 1000
NaOH mol 0.2
x mL 25 SO
SO SO
SO SO
= =
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
13/45
Problemas a resolver
17 Cuntos gramos de NaOH hmeda* se necesitan pesar para preparar 250 mL de una
disolucin 1.5M?
(*)La sosa contiene 10% en masa de agua.
18. Se quiere preparar un volumen de 8L de una disolucin de KNO
3
al 20% en masa y una
densidad de 1.1326 g/mL a 20C.
a) Qu volumen de agua (*) y qu masa de nitrato de potasio se debe mezclar?
b) Cul es la molaridad y cul es la molalidad de la disolucin preparada?
c) Cul es la fraccin mol del soluto en esta disolucin?
d) En cuntos mL de la disolucin hay 0.0025 moles de nitrato de potasio?
(*) La densidad del agua para este problema es de 1 g/mL.
19. Completa la siguiente tabla para disoluciones acuosas de cido sulfrico.
Densidad
g/mL
Molaridad
M
Molalidad
m
% en masa del
cido sulfrico
% en masa del
agua
1.24 4.08
1.3 39.19
1.6 53.65
1.15 79.18
20. Se preparan las disoluciones A y B.
Para la disolucin A se utilizan 6.00 gramos de metanol en un kilogramo de agua y para la
disolucin B se utilizan 6.00 gramos de metanol en un kilogramo de tetracloruro de carbono.
A 20C la densidad de la disolucin B es mayor que la densidad de la disolucin A.Cules
de las siguientes afirmaciones relativas a estas disoluciones son ciertas? Efecta los clculos
necesarios e indica cuales de las siguentes afirmaciones son ciertas:.
a) Las disoluciones A y B tienen la misma molaridad.
b) Ambas disoluciones tienen la misma molalidad.
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
14/45
c) Las fracciones molares del metanol en A y B son iguales.
d) El % en masa de metanol es igual en A que en B.
21. Dos disoluciones acuosas A y B de nitrato de calcio tiene una concentracin diferente.
a) Cuntos gramos de nitrato de calcio puro hay en 200 mL de la disolucin A?. Se
sabe que la densidad y % en masa para esta disolucin son 1.1636 g/mL y 20%
respectivamente.
b) Cul es la densidad, % en masa, molalidad y molaridad de la disolucin B?. Se
sabe que 400 mL de esa disolucin tienen una masa de 504 gramos y que por cada
kilogramo de disolvente hay 2.61 moles de nitrato de calcio.
22. En una determinacin cuantitativa se utilizan 17.1 mL de Na
2
S
2
O
3
0.1N para que
reaccione todo el yodo que se encuentra en una muestra que tiene una masa de 0.376 g.
Si la reaccin que se lleva a cabo es:
I
2
+ 2Na
2
S
2
O
3
2NaI + Na
2
S
4
O
6
Cul es la cantidad de yodo en la muestra?.
23. En un litro de una disolucin hay 200 g del soluto X. Si la disolucin contiene 18% en
masa de X, Cul es la densidad de la disolucin, expresada en g/mL?.
24. Qu cantidad de fsforo contiene el esqueleto humano, sabiendo que por trmino medio
pesa 11 kilogramos, y que su contenido en fosfato de calcio es 58%?.
25. En los siguientes enunciados indique con una F si la oracin es falsa y con una V si es
verdadera. Justifique su respuesta anexando los clculos realizados.
a) Si se tiene una disolucin con una concentracin 25% m/m, eso quiere decir que se tuvo
que disolver una masa de 25 g del soluto en 100 mL del disolvente (suponga que el
disolvente es agua) _______________________
b) Si se pesaron 0.7 g de NaCl y se disolvieron en 100 mL de agua, la concentracin de la
disolucin es de 0.7% m/v ____________________
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
15/45
c) Se pesaron 14.8 g de acetato de sodio y se disolvieron en 125 mL de agua, por lo tanto
tenemos una concentracin de 11.84% v/v y de 10.59% m/v ______________________
d) Se disolvieron 25 mL de un soluto que tiene una densidad de 1.25 g/mL en 200 mL de
agua. La concentracin es de 15.61% v/v y de 18.5 % m/m ___________________
e) Se disolvieron 3 g de un compuesto lquido que tiene una densidad de 1.31 g/mL en 25
mL de agua. Su concentracin es de 9.15 % v/v _______________________
f) Para calcular la concentracin porcentual no es necesario conocer la masa molar del
soluto. ______________________
26. Complete el siguiente cuadro. Incluya los clculos realizados.
Soluto Masa del soluto
(g)
Vol. de disolucin
(mL)
Molaridad
M
Normalidad
N
H
2
SO
4
250 0.5
HCl 50 0.1
NaOH 30 350
KOH 25 0.01
H
2
CO
3
45 0.75
H
3
PO
4
2500
Ca(OH)
2
350
HBr 75 1000
27. Calcule el volumen de H
2
SO
4
que se necesita para preparar 300 mL de una disolucin
0.75N. Considere que el H
2
SO
4
tiene una densidad de 1.4 g/mL y 80% de pureza.
28. Se tomaron 5 mL de H
2
SO
4
cuya densidad es de 1.8 g/mL y 90% de pureza, y se aforaron
hasta un volumen final de 500 mL, calcule la concentracin de la disolucin en % m/m,
molaridad y normalidad.
29. Se tienen 160 g de una disolucin de NaCl al 11.25% m/m. La disolucin tiene una
densidad de 1.33 g/mL. Calcule:
a) Molaridad
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
16/45
b) Molalidad
c) %p/v
d) Volumen de la disolucin
30. Una disolucin de H
2
SO
4
que contiene 487.6 g de H
2
SO
4
por cada litro de disolucin tiene
una densidad de 1.329 g/mL. Calcule:
a) la molaridad
b) la molalidad
c) la normalidad
d) Qu volumen de la disolucin anterior se debe tomar para preparar 100 mL de una
disolucin 0.1M?.
31. Se disuelven 3 g de nitrato de sodio en agua hasta llegar a 250 mL de disolucin. La
densidad de esta disolucin es igual a 1.12 g/mL. Determine la concentracin:
a) molar
b) normal
c) porciento en peso
d) molal
32. Para preparar la disolucin A se pesa 1 g de NaOH y se afora hasta un volumen final de 20
mL.
Para preparar la disolucin B se toman 10 mL de la disolucin A y se llevan a un volumen
final de 25mL.
Para preparar la disolucin C se toman 10 mL de la disolucin B y se llevan a un volumen
final de 25mL.
Calcule la concentracin de las soluciones A, B y C.
33. El hecho de emplear en la titulacin un volumen igual al de la muestra implica que:
a) La estequiometra de la reaccin es 1:1
b) Las disoluciones son molares
c) En ambos volmenes estn contenidos el mismo nmero de moles
d) Las disoluciones son normales y de la misma concentracin
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
17/45
e) La concentracin de las disoluciones est expresada en % m/v.
34. En el laboratorio se prepara una disolucin (a la que llamaremos disolucin A) pesando 5 g
de cromato de potasio y agregndole agua hasta llegar a 1 L de disolucin. De esta
disolucin A, se toma una alcuota de 100 mL y se coloca en un matraz aforado de 250 mL,
agregndole agua hasta la marca de aforo (disolucin B). Finalmente, de la disolucin B se
toma una alcuota de 25 mL y se coloca en un vaso de precipitado.
a) Cul es la concentracin molar de la disolucin A?
b) Cul es la concentracin normal de la disolucin B?
c) Cul es la concentracin en porcentaje en peso de la disolucin A?
d) Cuntos moles de cromato de potasio hay en la disolucin A, en la disolucin B y en el
vaso de precipitado donde se coloc la alcuota final?
e) Cul es la concentracin molar de la disolucin que se encuentra en el vaso de
precipitado que contiene la alcuota final?
35. El nmero de equivalentes para una sustancia se obtiene de:
a) el tipo de reaccin que se lleva a cabo.
b) el nmero de partculas intercambiadas, de la reaccin que se lleve a cabo y del estado
fsico de la sustancia.
c) el coeficiente estequiomtrico de la sustancia en la reaccin en la que est involucrada.
d) el nmero de partculas intercambiadas en la reaccin y la molaridad.
e) ninguna de las anteriores.
36. Se desean preparar 3 L de una disolucin de un suero que contiene glucosa en
concentracin 2.5 M. Explique cmo debe prepararse esta disolucin.
37. Completar el siguiente cuadro:
Sustancia No.
equiv./mol
Normalidad Molaridad Vol.
(mL)
Moles
HCl 1.0 5 mL
H
2
SO
4
0.2 2
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
18/45
NaOH 1x10-5
KMnO
4
Mn(VII)Mn
2+
0.1 8
H
2
O
2
H
2
O
2
H
2
O
0.2 2x10-5
I
2
0.5 10
Na
2
S
2
0
3
S
2
0
3
2-
S
4
O
6
2-
0.5 1x10-4
38. Qu disolucin es ms concentrada?:
a) Una disolucin 1M de tiosulfato o una 0.1 M.
b) Una disolucin 1M de tiosulfato de sodio o una 1N, considerando que el S
2
0
3
2-
pasa
S
4
O
6
2-
.
c) Una disolucin 0.1M o una 0.5N de KMnO4 en una reaccin de oxido reduccin en
medio cido en el que el Mn pasa a Mn
2+
.
d) Una disolucin 1M y una 1N de cido sulfrico.
39. Seleccione la opcin en que se encuentren indicados correctamente los valores de
concentracin de soluciones de H
2
SO
4
de diferentes concentraciones:
a) 5M < 5 N < 5%
b) 5 M 5 N 5%
c) 5% 5 M 5 N
d) 5% < 5 M 5 N
e) Ninguna de las anteriores
40. La concentracin molar de una substancia puede ser:
a) Mayor a su concentracin normal
b) Igual a su concentracin normal
c) Mayor o igual a su concentracin normal
d) Menor que su concentracin normal
e) Ninguna de las anteriores.
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
19/45
41. Si se tienen 2 mL de disolucin de tiosulfato de sodio 1M y se gastaron para titularlo, el
mismo nmero de mL de yodo Qu normalidad tiene el yodo?
2Na
2
S
2
O
3
+ I
2
Na
2
S
4
O
6
+ 2NaI
42. Si se tiene la siguiente reaccin cido base
NaHCO
3
+ HCl NaCl + H
2
O + CO
2
Indica qu volmenes de cido clorhdrico 0.2M se requieren para titular las siguientes
cantidades de bicarbonato:
a) 10 mL 0.2 M
b) 5 mL 0.2 N
c) 5 mL al 1%
43. Se tiene la siguiente reaccin de oxidorreduccin.
K
2
Cr
2
0
7
+ 14 HCl 2 KCl + 2 CrCl
3
+ 7 H
2
O + 3 Cl
2
a) Indica cuntos equivalentes por mol tiene el dicromato y cuntos el cido clorhdrico.
b) Como prepararas un litro de disolucin 0.1N de dicromato? Qu concentracin molar
tiene esta disolucin?
c) Si reaccionan 10 mL de HCl concentrado (12M) con la cantidad estequiomtrica de
dicromato, Cuntas moles del cloro a condiciones normales vas a obtener y a qu
volumen corresponden?
44. Que concentracin final tiene una disolucin de permanganato de potasio que se prepara
diluyendo 1 mL de disolucin 0.1M a un volumen final de 1L?
Si de la disolucin anterior si se toma una alicuota de 10 mL y se afora con agua a 100 mL.
Qu concentracin obtendrs? Cuntas moles hay en 1 mL de la disolucin final?
45. Qu diferencia existe entre una disolucin 1N de dicromato de potasio utilizada en una
reaccin de xido reduccin (pregunta 48) y otra de igual concentracin utilizada en
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
20/45
reacciones de doble sustitucin en las que no hay cambio en el estado de oxidacin Cul
de ellas es ms concentrada? Qu molaridad tiene cada una de ellas?
46. Se tiene la siguiente reaccin:
2KMnO
4
+ 3Na
2
SO
3
+ H
2
O 2MnO
2
+ 3Na
2
SO
4
+ 2KOH
a) Cuntos electrones por mol intercambia el permanganato y cuntos el sulfito de sodio?
b) Qu concentracin normal tiene una disolucin 0.2M de permanganato?
c) Qu diferencia hay entre una disolucin 1N de permanganato utilizada en esta reaccin
y una de igual concentracin utilizada en la reaccin del permanganato con agua
oxigenada en medio cido? Cul de ellas es ms concentrada? A qu concentracin
molar corresponde cada una de ellas?
47. Cul es el volumen de agua destilada que debe agregarse a 50 mL de cido fosfrico
0.1M, para que la concentracin final de la nueva disolucin sea 0.1N?
48. Se tiene una disolucin A de HNO
3
que tiene una densidad de 1.42 g/mL y una pureza del
70%.
a) Calcula la molaridad de la disolucin A.
b) De la disolucin A se tomaron 5 mL y se llevaron a un volumen final de 500 mL. Calcula
la concentracin de la nueva disolucin.
c) Se requieren preparar 100 mL de una disolucin 0.6 M a partir de la disolucin A.
Calcule el volumen de disolucin A que se debe utilizar para obtener la concentracin
deseada.
49. Se tiene una disolucin A de HCl que tiene una densidad de 1.18 g/mL y una pureza del
37%.
a) Calcula la molaridad de la disolucin A.
b) De la disolucin A se tomaron 16 mL y se llevaron a un volumen final de 0.25 L. Calcula
la concentracin de la nueva disolucin.
c) Se requieren preparar 250 mL de una disolucin 0.75 M a partir de la disolucin A.
Calcule el volumen necesario para obtener la concentracin deseada.
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
21/45
50. Se desea preparar una disolucin 0.2 M de NaOH, pero slo se tienen dos matraces
aforados de 50 mL, una pipeta graduada de 10 mL, 2 g de NaOH previamente pesado. No
se cuenta con una balanza para pesar una menor cantidad de NaOH. Diga como preparar la
disolucin 0.1 M de NaOH en las condiciones anteriores.
51. Las diluciones 10:100, 2.5:25.0, 50:500 son:
a) Todas de la misma molaridad
b) Todas diluciones 1:10
c) Todas de la misma estequiometra
52. Una disolucin de alcohol etlico que tiene 75% de alcohol en peso, se utiliza como
bactericida. La disolucin se prepar agregando agua a una disolucin al 95% en peso de
alcohol. Calcula cuntos gramos de agua y de alcohol al 95% deben usarse para obtener
400 g de bactericida.
53. La soda se vende en dos formas: como sal anhidra de Na
2
CO y como sal decahidratada.
Considerando que el constituyente activo es el Na
2
CO
3
, cul forma resulta ms barata al
consumidor, la sal anhidra a 10 centavos por libra o la sal decahidratada a 5 centavos por
libra?
54. El etilenglicol se adiciona al agua de los radiadores de los automviles pues es un
anticongelante. Calcula la fraccin molar de etilenglicol (C
2
H
6
O
2
) en las soluciones
siguientes:
a) 120 g de etilenglicol disueltos en 120 g H
2
O
b) 120 g de etilenglicol disueltos en 1.20 kg de acetona C
3
H
6
O
IV. LA REACCIN QUMICA
Ejemplos de Clasificacin de la Reaccin Qumica
An cuando en la bibliografa ms utilizada en los cursos de Qumica General se habla
constantemente de la reaccin qumica, en pocos textos se hace explcita su clasificacin y
generalmente se hace en forma parcial como Whitten que enfatiza la clasificacin de las
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
22/45
reacciones desde el punto de vista de sus formas de combinacin y las describe en
disoluciones acuosas de acuerdo a sus caractersticas electrolticas y formas predominantes del
soluto en agua. Algunos otros libros clsicos de Qumica General (Chang, Ebbing y Keenan)
tratan en captulos diferentes las posibles formas de clasificacin lo que impide su
sistematizacin.
En algunas publicaciones sobre trabajo en el laboratorio se encuentran ejemplos de diferentes
tipos de reacciones para un mismo elemento (J.Chem.Ed. 64, 8 1987.. pp 716-717), pero sin
hacer nfasis en su clasificacin y algunas otras se limitan nicamente a un solo tipo de
reacciones: xidorreduccin, cido-base,etc.
En este curso abordamos la clasificacin de las reacciones qumicas tomando en cuenta los
siguientes aspectos:
1.- CAMBIOS ENERGTICOS.
Reacciones exotrmicas
Reacciones endotrmicas.
Esta clasificacin considera si en el proceso el sistema libera o absorbe calor y grupa a las
reacciones como exotrmicas o endotrmicas.
Ejemplos: HN0
3
+ KOH KNO
3
+ H
2
0 + calor (exotrmica)
2 HgO + Calor 2Hg
(s)
+ O
2
(g)
(endotrmica)
2.-COMPORTAMIENTO QUMICO (Clasificacin analtica)
En este tipo de reacciones se considera si hay cambio en los nmeros de oxidacin de los
productos con respecto a los reactivos (combustin, metales y cidos, metales y iones de
metales menos activos, no metales y iones de metales menos activos, combinacin de
elementos y visceversa) , si hay cambios significativos de pH o reacciones que involucren
especies con caractersticas cido-base, si hay formacin de un slido en el seno de un lquido
durante la reaccin, o bien, si hay formacin de compuestos metlicos (generalmente de
transicin y muy coloridos) rodeados de molculas y iones.
Esta clasificacin incluye los siguientes tipos de reacciones:
Oxidorreduccin
cido-base
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
23/45
Precipitacin
Formacin de compuestos de coordinacin
Ejemplos:
2CH
3
OH
(l)
+ 3 0
2
(g)
2CO
2
(g)
+ 4 H
2
0
(l)
Oxidorreduccin.
2Na
(s)
+ H
2
0
(l)
H
2
(g) + 2NaOH
(ac)
Oxidorreduccin
Cu
(s)
+ 2AgNO
3
(ac)
2Ag(s) + Cu( N0
3
)
2
Oxidorreduccin
HNO
3
(ac)
+ KOH
(ac)
KNO
3(ac)
+ H
2
0
(l)
cido-base
Si0
2
(s)
+ CaO
(s)
CaSiO
3
cido-base
AgNO
3
(ac)
+ K
2
CrO
4
(ac)
Ag
2
CrO
4
(s)+ 2KNO
3(ac)
Precipitacin
Co(NO
3
)
2
(ac)
+ 6NH
3(ac)
[ Co (NH
3
)
6
](NO
3
)
2
Coordinacin
3.- NATURALEZA DE LA REACCIN (complejidad entre reactivos y productos).
Esta clasificacin considera si en la reaccin se forma una sustancia de mayor complejidad, que
la de los reactivos, o si el reactivo, se descompone en 2 o ms sustancias, si se reemplaza un
catin , un anin o un ligante o si hay un doble intercambio de especies. Este grupo de
reacciones incluye las siguientes:
Sntesis
Descomposicin
Desplazamiento simple
Doble desplazamiento o mettesis
Ejemplos:
C
(s)
+ 0
2 (g)
CO
2
(g)
Sntesis
2 HgO
(s)
2Hg
(s)
+ 0
2
(g)
Descomposicin
Mg
(s)
+ H
2
SO
4
(ac)
MgSO
4
(ac)
+ H
2
(g)
Desplazamiento simple
[Co(H
2
O)
6
] Cl
2
+ 6 NH
3
(g)
[Co(NH
3
)
6
]Cl
2
+ 6 H
2
0 Desplazamiento simple
3BaCl
2(ac)
+ 2Na
3
PO
4
(ac)
Ba
3
(PO
4
)
2
(s)
+ 6NaCl
(ac)
Doble desplazamiento.
Como puede observarse, una sola reaccin puede ser clasificada desde diferentes puntos de
vista y en ocasiones no resulta tan simple esta clasificacin.
Problemas a resolver
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
24/45
55. Clasifique a las siguientes reacciones segn los siguientes criterios
Cambios energticos: Comportamiento qumico Agrupamiento de los
tomos:
-exotrmicas -cido base -sntesis
-endotrmicas -redox -descomposicin
-precipitacin -sustitucin simple
-formacin de complejos -doble sustitucin
CuCO
3
CuO + CO
2
2 Kl + Cl
2
2 KCl + I
2
K
2
CrO
4
+ Pb(NO
3
)
2
PbCrO
4
+ 2KNO
3
Na
2
SO
3
+ S Na
2
S
2
O
3
NaOH + HCl NaCl + H
2
O
NiCl + 6NH
3
[Ni(NH
3
)
6
]Cl
4
H
2
CO
3
CO
2
+ H
2
O
56. Escriba una ecuacin que represente una reaccin exotrmica y otra que represente una
ecuacin endotrmica
EXOTRMICA
ENDOTRMICA
57. Escriba una reaccin que represente:
NOMBRE REACCIN
a) Una reaccin cido base
b) Una reaccin de precipitacin
c) Una reaccin de formacin de complejos
d) Una reaccin de xido reduccin
58. Qu cambio se presenta en el nmero de oxidacin de manganeso (II) al hacerlo
reaccionar con bismutato de sodio en medio cido y qu color se observa en la disolucin?
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
25/45
59. Qu variacin de pH se observa?:
a) Al burbujear dixido de carbono en agua
b) Al aadir sosa al cido clorhdrico
60. Qu gas se desprende al hacer reaccionar zinc con HCl y cmo lo puede comprobar?
61. Complete las siguientes reacciones, balancelas y clasifiquelas:
a) Na
2
S
2
O
3
+ H Cl
b) Ca(OH)
2
+ C O
2
c) I
2
+ Na Br
d) ZnSO
4
+ Na S
e) Al (NO
3
)
3
+ NaOH
62. De acuerdo con su experiencia en el laboratorio, como obtendra los siguientes productos y
cules son las caractersticas de los mismos en cuanto a estado fsico y color?
a) cloruro de plata
b) sulfato de zinc
c) xido de magnesio
d) carbonato de calcio
e) yodo
63. Indique el nmero de oxidacin de los elementos de cada compuesto y el agente oxidante y
el reductor.
2 Al + 3 F
2
2 Al F
3
Zn O + C Zn + CO
Fe
2
O
3
+ 3 CO 2 Fe + 3 CO
2
Pb S + 4 H
2
O
2
Pb SO
4
+ H
2
O
Co + Cl
2
Co Cl
2
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
26/45
V. BALANCEO DE ECUACIONES. MTODO ION ELECTRN
Reglas generales para asignar el nmero de oxidacin a una especie qumica.
1. A los tomos de los elementos en su estado libre se les asigna un nmero de oxidacin
de cero. As, cada uno de los tomos en H
2
, Br
2
, Na, Be, K, O
2
, y P
4
tiene el mismo
nmero de oxidacin: cero.
2. Para los iones monoatmicos, es decir, iones constituidos por un slo tomo, el nmero
de oxidacin del elemento es igual a la carga del ion entonces, el litio en el ion litio tiene
un nmero de oxidacin de +1; el bario en el ion bario, +2; el oxgeno en el ion oxgeno,
-2, etctera. Todos los iones de los metales alcalinos tienen un nmero de oxidacin de
+1, y todos los iones de los metales alcalinotrreos tienen un nmero de oxidacin de
+2. El aluminio tiene un nmero de oxidacin de +3 en todos sus compuestos.
3. El nmero de oxidacin del oxgeno en la mayora de los compuestos es 2 (MgO y
H
2
O). En los perxidos (O
2
-2
) es 1.
4. El nmero de oxidacin del hidrgeno en la mayora de sus compuestos es +1. Cuando
esta enlazado con los metales en compuestos binarios para formar los hidruros tiene un
nmero de oxidacin de 1.
5. El flor tiene un nmero de oxidacin de 1 en todos sus compuestos. Los otros
halgenos, cloro, bromo y yodo, tienen nmeros de oxidacin negativos cuando existen
como iones halogenuro (Cl
-
, Br
-
, I
-
). Cuando el cloro, el bromo y el yodo estn
combinados con oxgeno, como en los oxicidos y oxianiones, tienen nmeros de
oxidacin positivos.
6. En una molcula neutra, la suma de los nmeros de oxidacin de todos los tomos debe
ser cero. En un ion poliatmico, la suma de los nmeros de oxidacin de todos los
elementos debe ser igual a la carga neta del ion. Por ejemplo, en el ion amonio, NH4
+
,
el nmero de oxidacin del nitrogeno es 3 y el del hidrggeno es +1, por lo tanto, la
suma de los nmeros de oxidacin es 3 +4 (+1) = +1, que es igual a la carga neta del
ion.
Para balancear una ecuacin qumica por este mtodo, es necesario conocer todos los
reactivos y productos que tienen cambios en su nmero de oxidacin, y de ser posible, la
ecuacin qumica completa. Tambin se debe conocer si la reaccin se lleva a cabo en medio
cido o bsico. Existe un procedimiento especfico para balancear ecuaciones en medio
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
27/45
bsico, sin embargo este procedimiento a veces presenta problemas, por lo que se recomienda
hacer el balance en medio cido y despus pasar la ecuacin en medio bsico.
Problemas resueltos
A continuacin se presenta un ejemplo del procedimiento para balancear una ecuacin en
medio cido.
FeSO
4
+ K
2
Cr
2
O
7
+ H
2
SO
4
Fe
2
(SO
4
)
3
+ Cr
2
(SO
4
)
3
+ K
2
SO
4
+ H
2
O
Paso 1: Identificar las especies qumicas que cambian su nmero de oxidacin y escribir la
ecuacin no balanceada en su forma inica. Es necesario utilizar las especies que intervienen
en la reaccin, y no solamente los tomos que cambian su nmero de oxidacin
Fe
2+
+ Cr
2
O
7
2-
Fe
3+
+ Cr
3+
Paso 2: Plantear las semirreacciones de oxidacin y de reduccin. No es necesario asignar los
nmero de oxidacin de los elementos que se oxidan y reducen, pero se pueden identificar y
son tiles para verificar el balance de cargas.
+2 +3
Oxidacin: Fe
2+
Fe
3+
+6 +3
Reduccin Cr
2
O
7
2-
Cr
3+
Paso 3: Hacer el balance de masa en cada semirreaccin.
a) En primer lugar balancear los tomos del elemento que cambia su nmero de oxidacin. al
ltimo balancear los tomos de oxgeno e hidrgeno.
En este caso la semirreaccion de oxidacin est balanceada en cuanto a masa. En la
semirreaccin de reduccin es necesario balancear los tomos de Cr, para lo que se utiliza un
coeficiente de 2 en el Cr
3+
.
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
28/45
Fe
2+
Fe
3+
Cr
2
O
7
2-
2 Cr
3+
b) En las reacciones que se llevan a cabo en medio cido, se agrega H
2
O para balancear los
tomos de oxgeno e hidrgeno para balancear los tomos de hidrgeno.
En este caso, en la ecuacin de reduccin se agregan siete molculas de H
2
O en el lado de los
productos y catorce iones H
+
en el lado de los reactivos:
Fe
2+
Fe
3+
14 H
+
+ Cr
2
O
7
2-
2 Cr
3+
+ 7 H
2
O
Paso 4: Hacer el balance de cargas considerando que toda reaccin qumica debe cumplir el
principio de electroneutralidad. Para ello nicamente se pueden sumar o restar electrones, que
tienen carga negativa. El mismo nmero de electrones que se ganen en la semirreaccin de
oxidacin, debe ser el que se pierda en la semirreaccin de reduccin. para igualar el nmero
de electrones intercambiados se pueden multiplicar una o ambas semirreacciones por los
coeficientes apropiados.
a) Para la semirreaccin de oxidacin se tiene:
Fe
2+
- 1 e
-
Fe
3+
b) En la semirreaccion de reduccin hay doce cargas netas positivas del lado de los reactivos y
slo seis cargas positivas del lado de los productos. Por lo tanto es necesario sumar seis
electrones a la izquierda.
14 H
+
+ Cr
2
O
7
2-
+ 6e
-
2 Cr
3+
+ 7 H
2
O
c) Para igualar el nmero de electrones en ambas semirreacciones, se multiplica por seis la
semirreaccion de oxidacin:
6 Fe
2+
-6e
-
6 Fe
3
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
29/45
14 H
+
+ Cr
2
O
7
2-
+ 6 e
-
2 Cr
3+
+ 7 H
2
O
Paso 5: Se suman las dos semirreacciones. Recuerda, los electrones sumados y restados
deben ser los mismos.
Al sumar las dos semirreacciones se obtiene
14 H
+
+ Cr
2
O
7
2-
+ 6 Fe
2+
2 Cr
3+
+ 7 H
2
O + 6 Fe
3+
Paso 6: Se verifica que la ecuacin cumpla con el balance de masa y con el balance de cargas,
para lo cual debe contener el mismo tipo y nmero de tomos, as como el mismo nmero de
cargas en ambos lados de la ecuacin. La inspeccin final debe mostrar que la ecuacin
resultante est atmica y elctricamente balanceada.
Paso 7: Los coeficientes encontrados se escriben en sus respectivos lugares en la ecuacin
molecular, y si hace falta se hace el balance final por inspeccin.
En este caso:
6 FeSO
4
+ K
2
Cr
2
O
7
+ 7 H
2
SO
4
3 Fe
2
(SO
4
)
3
+ Cr
2
(SO
4
)
3
+ K
2
SO
4
+ 7 H
2
O
Para las ecuaciones que representan reacciones en medio bsico, se puede seguir el
procediento seguido en medio cido hasta el paso 3. Posteriormente por cada ion H
+
que
aparezca, se debe agregar un nmero igual de iones OH
-
en ambos lados de la ecuacin. Si
aparecen iones H
+
y OH
-
en el mismo lado de la ecuacin, se pueden considerar como
molculas de agua al sumar las dos semirreacciones para escribir la ecuacin inica
balanceda.
Ejemplo:
Ecuacin completa. Se lleva a cabo en medio bsico
Cr
2
(SO
4
)
3
+ H
2
O
2
+ NaOH Na
2
CrO
4
+ H
2
O + Na
2
SO
4
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
30/45
Paso 1: Semirreaccines de oxidacin y reduccin
Cr
2
3+
CrO
4
2-
H
2
O
2
H
2
O
Paso 2: Semirreaccin de oxidacin balanceada en cuanto a masa y a carga. Medio bsico
8 H
2
O + Cr
2
3+
-6e- 2 CrO
4
2-
+ 16 H
+
16 OH
-
16 OH
-
Cr
2
3+
+ 16 OH-6e- 2 CrO
4
2-
+ 8 H
2
O
Paso 3: Semirreacciones de reduccin
2 H
+
+ H
2
O
2
+ 2e
-
2 H
2
O
2 OH
-
2 OH
-
H
2
O
2
+ 2e
-
2 OH
-
Paso 4: Igualacin del nmero de electrones y suma de las semirreacciones de oxido-reduccin
balanceadas.
Cr
2
3+
+ 16 OH-6e
-
2 CrO
4
+ 8 H
2
O
3 H
2
O
2
+ 6e
-
6 OH
-
Cr
2
3+
+ 10 OH+3 H
2
O
2
2 CrO
4
2-
+ 8 H
2
O
Ecuacin inica balanceada
Paso 5: Los coeficientes obtenidos se pasan a la ecuacin original
Cr
2
(SO
4
)
3
+ 3 H
2
O
2
+ 10 NaOH 2 NaCrO
4
+ 8 H
2
O + Na
2
SO
4
Paso 6: Se hace el balance final por inspeccin
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
31/45
Cr
2
(SO
4
)
3
+ 3 H
2
O
2
+ 10 NaOH 2 NaCrO
4
+ 8 H
2
O + 3 Na
2
SO
4
Problemas a resolver
64. Determine el nmero de oxidacin de cada elemento presente en las siguientes frmulas:
H
2
O KHCO
3
KMnO
4
KClO
3
CO
2
K
2
Cr
2
O
7
KCl Cl
2
K
2
CO
3
SO
4
2-
O
2
MnO
2
65. Balancea las siguientes ecuaciones por el mtodo del ion-electrn, para ello escribe:
a) Las frmulas de las especies que cambian durante la reaccin.
b) Las ecuaciones balanceadas que representan a las semirreacciones de oxidacin y
reduccin.
c) Los nombres de las siguientes especies: la que se oxida, la que se reduce, la oxidante y
la reductora.
d) La ecuacin inica balanceada.
e) La ecuacin molecular balanceada.
K
2
Cr
2
O
7
+ FeCl
2
+ HCl CrCl
3
+ KCl + FeCl
3
+ H
2
O
HNO
3
+ S NO
2
+ H
2
SO
4
+ H
2
O
HCl + KmnO
4
Cl
2
+ KCl + MnCl
2
+ H
2
O
CrCl
3
+ MnO
2
+ H
2
O MnCl
2
+ H
2
CrO
4
Zn + HNO
3
Zn(NO
3
)
2
+ NH
4
NO
3
+ H
2
O
Kl + H
2
SO
4
+ MnO
2
K
2
SO
4
+ H
2
O + I
2
+ MnSO
4
PbS + O
2
PbO + SO
2
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
32/45
KMnO
4
+ NO + H
2
SO
4
HNO
3
+ K
2
SO
4
+ MnSO
4
+ H
2
O
H
2
S + O
2
H
2
O + S
Cu + H
2
SO
4
CuSO
4
+ H
2
O + SO
2
Cu
2
S + Ce
4+
Cu
2+
+ SO
2-
4
+ Ce
3+
C
3
H
6
O
2
+ Cr
2
O
7
2-
CO
2
+ Cr(OH)
3
Fe(OH)
2
+ MnO
4
MnO
2
+ Fe(OH)
3
Ag + NO
3
-
Ag
+
+ NO
MnO
4
-
+ Fe
2+
Mn
2+
+ Fe
3+
+ H
2
O
KClO
3
+ H
2
SO
4
KHSO
4
+ O
2
+ ClO
2
+ H
2
O
P
4
PH
3
+ H
2
PO
2
(medio bsico)
As
2
S
5
+ HNO
3
H
3
AsO
4
+ H
2
SO
4
+ NO
2
+ H
2
O
FeS
2
+ O
2
Fe
2
O
3
+ SO
2
K
2
NaCo(NO
2
)
6
+ KMnO
4
+ H
2
SO
4
K
2
SO
4
+ Na
2
SO
4
+ CoSO
4
+
+ MnSO
4
+ HNO
3
+ H
2
O
66. La reaccin: 2 Na
2
S
2
O
3
+ I
2
Na
2
S
4
O
6
+ NaI
a) Est balanceada
b) No se lleva a cabo
c) Solo se lleva a cabo en medio cido
d) No se puede balancear
e) Ninguna de las anteriores
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
33/45
67. Balancea las siguientes ecuaciones qumicas por el mtodo del ion electrn.
a) NaOH + Br
2
NaBrO
3
+ NaBr + H
2
O
b) KMnO
4
+ H
2
O
2
+ H
2
SO
4
MnSO
4
+ O
2
+ K
2
SO
4
+ H
2
O
68. Balancea y completa la siguiente ecuacin qumica por el mtodo del ion electrn:
KMnO
4 (ac)
+ MnCl
2 (ac)
+ KOH ------ MnO
2(s)
+ H
2
O
(l)
Balancea, por el mtodo del ion electrn la ecuacin qumica que representa la reaccin de una
disolucin de cloruro ferroso, con permanganato de potasio y cido clorhdrico, para obtener
una disolucin de cloruro frrico, cloruro de manganeso (II), cloruro de potasio y agua lquida.
VI. ESTEQUIOMETRA EN REACCIONES COMPLETAS: BALANCES DE MATERIA Y
REACTIVO LIMITANTE
Problemas resueltos
El sodio es un metal reactivo que reacciona en forma instantnea con agua para dar gas
hidrgeno y una disolucin de hidrxido de sodio, NaOH Cuntos gramos de sodio
metlico se necesitan para obtener 7.81 g de hidrgeno segn la siguiente reaccin?
2(g) (ac) 2 (s)
H NaOH 2 O H 2 Na 2 + +
l
Na g 177.85
Na mol 1
Na g 23
x
H mol 1
Na mol 2
x
H g 2.02
H mol 1
H g 81 . 7
2 2
2
2
=
La esfalerita es un mineral de sulfuro de zinc (ZnS) y una fuente importante del metal zinc.
El primer paso en el procesamiento de la mena consiste en calentar el sulfuro con oxgeno
para obtener xido de zinc ZnO, y dixido de azufre, SO
2
Cuntos kilogramos de gas
oxgeno se combinan con 5.00 x 10
3
g de sulfuro de zinc en esta reaccin?
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
34/45
(g) 2 (s) (g) 2 (s)
2S0 ZnO 2 3O ZnS 2 + +
2
2 2 3
O mol 1
O g 32
ZnS mol 2
O mol 3
x
ZnS g 97.4
ZnS mol 2
x S Zn g 10 x 5
En 1774, el qumico britnico Joseph Priestley prepar el oxgeno por calentamiento del
xido de mercurio (II), HgO. El mercurio metalico tambien es un producto en esta reaccin.
Si se recogen 6.47 g de oxgeno, Cuntos gramos de mercurio metlico se producen
tambin?
) ( (g) 2
Hg 2 O HgO 2
l
+
g 81.11
Hg mol 1
g H g 200.6
O mol 1
Hg mol 2
O g 32
O mol 1
O g 47 . 6
2 2
2
2
= Hg
El sulfato de nquel, NiSO
4
, reacciona con fosfato de sodio Na
3
PO
4
, para dar un precipitado
amarillo-verde de fosfato de nquel Ni
3
(PO
4
)
2
, y una disolucin de sulfato de sodio, Na
2
SO
4
,
segn la siguiente ecuacin:
(ac) 4 2 (s) 2 4 3 ) ac ( 4 3 (ac) 4
SO 3Na ) PO ( Ni PO 2Na NiSO 3 + +
Cuntos mililitros de NiSO
4
0.375 M reaccionan con 45.7 mL de Na
3
PO
4
0.265 M?
4 3
4 3
Na mol 0.0121
mL 1000
Na moles 0.265
mL 7 . 45 PO
PO
=
4
4 3
4
4 3
NiSO mol 0.0182
Na moles 2
NiSO moles 3
Na moles 0121 . 0 =
PO
PO
4
4
4
NiSO de mL 48.44
NiSO moles 375 . 0
mL 1000
NiSO mol 0182 . 0 =
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
35/45
El cloruro de aluminio, AlCl
3
, se utiliza como catalizador en diversas reacciones industriales.
y se prepara a partir del cloruro de hidrgeno gaseoso y viruta de aluminio metlico.
Considerando que un vaso de reaccin contiene 0.15 mol de Al y 0.35 mol de HCl.
2(g) 3(s) (g) (s)
3H 2AlCl 6HCl Al 2 + +
Clacule cuntos moles de AlCl
3
se pueden preparar a partir de esta mezcla?
3
3
AlCl moles 0.15
Al mol 2
AlCl mol 2
Al mol 15 . 0 =
3
3
AlCl moles 0.12
HCl mol 6
AlCl mol 2
HCl mol 35 . 0 =
El HCl es el reactivo limitante y se producen 0.12 moles de AlCl
3
.
Qu cantidad de sulfuro de zinc se produjo en un experimento en el que se calentaron 7.36
g de zinc con 6.45 g de azufre? Considera que estas sustancias reaccionan de acuerdo con
la ecuacin.
(s) (s) 8 ) s (
8ZnS S Zn 8 +
Zn moles 0.113
Zn g 65.4
Zn mol 1
x Zn g 36 . 7 =
S moles 0.200
S g 32.1
S mol 1
x S g 45 . 6 =
El Zn es el reactivo limitante, por lo tanto,
ZnS moles 0.113
Zn moles 8
ZnS moles 8
x Zn 113 . 0 = moles
ZnS g 11.01
ZnS 1moles
ZnS g 97.4
x ZnS 113 . 0 = moles
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
36/45
En plantas industriales nuevas hacen reaccionar metanol lquido con monxido de carbono
en presencia de un catalizador de acuerdo con la siguente reaccin:
) ( 3 2(g) ) ( 3
CH CO
l l
COOH OH CH +
En un experimento se hicieron reaccionar 15.0 g de metanol y 10.0 g de monxido de
carbonoQu masa terica (en g) de cido actico se debe obtener? Si se obtienen 19.1 g,
cul es el rendimiento de la reaccin?
OH CH mol 0.468
OH CH g 32
OH CH mol 1
x OH CH g 15
3
3
3
3
=
O C mol 0.3571
O C g 28
O C mol 1
x CO g 10 =
OH CH mol 0.468
OH CH mol 1
COOH CH mol 1
x OH CH mol 468 . 0
3
3
3
3
=
COOH CH mol 0.357
O C mol 1
COOH CH mol 1
x CO mol 357 . 0
3
3
=
CO el es limitante reactivo el tanto lo Por
COOH CH g 21.42
COOH CH mol 1
COOH CH g 60
x COOH CH mol 357 . 0
3
3
3
3
=
100% x
terico o rendimient
real o rendimient
o rendimient % =
% 89.17 100% x
COOH CH g 21.42
COOH CH g 19.1
o rendimient %
3
3
= =
Problemas a resolver
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
37/45
69. Considere la reaccin entre el nitrato de plomo y el cromato de potasio y conteste las
siguientes preguntas: (Masa molares (g/mol): Pb(207.19), Cr(52), K(39), O(16), N(14).
a) Qu volumen de cromato de potasio 0.1 M se debe agregar a 10 mL de disolucin 0.2 M
de nitrato de plomo para que precipite cuantitativamente el plomo presente?
b) Qu concentracin tiene una disolucin de nitrato de plomo, si al agregar cromato de
potasio en exceso a 10 mL de dicha disolucin se obtienen 0.323 gramos de cromato de
plomo (II)?
c) Qu cantidad de cromato de potasio se debe disolver en 100 mL de agua, para que al
agregar 15 mL de disolucin a 20 mL de nitrato de plomo 0.1M se obtenga una masa total
de 0.485 gramos de cromato de plomo (II)?
d) Cul es el rendimiento de la reaccin, si al agregar 10 mL de disolucin 0.2 M de nitrato
de plomo a 20 mL de disolucin 0.1 M de cromato de potasio se obtienen 0.52 gramos de
precipitado?
70. He aqu los ingredientes para preparar un delicioso platillo mexicano. Se trata de que
expliques el concepto de REACTIVO LIMITANTE utilizando este ejemplo. Si lo haces bien,
de regalo te daremos la receta.
ARROZ CON ELOTE, CREMA Y QUESO Para 6 personas
Ingredientes:
250 g de arroz
3 elotes desgranados
100 g de queso Oaxaca
100 g de crema
2 chiles cuaresmeos
1 taza de caldo de pollo
Quieres hacer arroz para 12 personas, siguiendo exactamente la receta de la abuelita, y
tienes en casa lo siguiente:
1 kg de arroz
6 elotes
200 g de queso Oaxaca
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
38/45
500 g de crema
5 chiles cuaresmeos
4 tazas de caldo de pollo
Utilizando los datos proporcionados, responde las siguientes preguntas, justificando tus
respuestas.
a) Puedes hacer el arroz para 12 personas?
b) Hay reactivo o reactivos limitantes?
c) Si quisieras hacer arroz para 14 personas podras?
d) Si quisieras hacer arroz slo para 3 personas podras?
Ahora basndote en el ejercicio anterior, escribe una ecuacin balanceada que represente
alguna reaccin qumica que te interese. Explica qu representan los coeficientes
estequiomtricos y que relacin tienen con el concepto de reactivo limitante.
71. Qu ocurrir si se hacen reaccionar 8.5 moles de cloro y 6.4 moles de aluminio para
formar cloruro de aluminio.
a) El reactivo limitante es el aluminio.
b) Sobran 0.73 moles de cloro.
c) Se forman como mximo 4.67 moles de cloruro de aluminio.
d) Sobran 0.73 moles de aluminio.
72. Qu ocurrir si se hacen reaccionar 0.2 moles de HCl con 0.2 moles de zinc para
producir gas hidrgeno?
a) El reactivo limitante es el zinc.
b) Sobran 0.1 moles de HCl .
c) Se forman 0.2 moles de hidrgeno.
d) Sobran 0.1 moles de zinc.
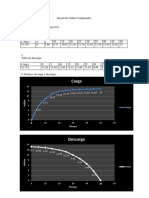
73. En un experimento que se realiz en el laboratorio se obtuvieron diferentes volmenes de
hidrgeno en condiciones normales de temperatura y presin. Utiliza la grfica y la reaccin
propuesta para calcular:
Zn + H
2
SO
4
ZnSO
4
+H
2
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
39/45
B C
A
a) La molaridad de la disolucin del cido sulfrico que se emplea en todo el experimento.
b) La masa en miligramos de zinc que reacciona con el cido sulfrico en el punto A.
c) El reactivo limitante en los puntos A y C.
74. En un experimento que se realiz en el laboratorio, se obtuvieron diferentes volmenes de
bixido de carbono en condiciones normales de temperatura y presin. Utiliza la grfica y la
reaccin propuesta para calcular:
Na
2
CO
3
+ 2 HCl 2 NaCl + CO
2
+ H
2
O
B C
A
a) La molaridad de la disolucin del cido clorhdrico que se emplea en todo el
experimento.
b) La masa en mg de carbonato de sodio que reacciona con HCl en el punto A.
c) El reactivo limitante en los puntos A y C.
75. Uno de los procesos industriales para obtener sosa custica, emplea una disolucin de
carbonato de sodio al 20% en masa y densidad 1.2 g/mL, adems de hidrxido de calcio
(lechada de cal) en exceso. La ecuacin que representa este proceso es:
Na
2
CO
3
+ Ca(OH)
2
2NaOH + CaCO
3
Vol. de H
2
en
condiciones
normales
448 ml
224 ml
1.3074 1.3074 1.3074 g de Zn
10 20 30 ml de H
2
SO
4
M?
Vol. de CO
2
en
condiciones
448 ml
224 ml
1.3074 1.3074 1.3074 g de Na
2
CO
3
20 40 60 ml de HCl M?
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
40/45
a) Cul de los reactivos es el limitante?
b) Cuntos litros de disolucin de NaOH ( 12% en masa y densidad 1.1309 g/mL) se
obtienen cuando se utilizan 100 L de la disolucin de carbonato de sodio?
c) Cuntos gramos de NaOH puros contienen los litros de disolucin de NaOH del inciso
anterior?
d) Cul es el rendimiento del proceso si solo se obtienen 20 kg de carbonato de calcio? (
considera los datos del inciso b)
76. El cido sulfrico se utiliza para producir industrialmente sulfato de amonio. La ecuacin
que representa este proceso es:
2NH
3
(g) + H
2
SO
4
(NH
4
)
2
SO
4
(s)
77. Si se utilizan 500 L de amoniaco gaseoso en condiciones normales y cinco litros de cido
sulfrico ( densidad = 1,3028 g/mL y 40% en masa):
a) Cul de los reactivos es el limitante?
b) Cuntos kilogramos de sulfato de amonio se obtienen?
c) Qu volumen de cido sulfrico 2M sera necesario para que reaccionara
estequiomtricamente con medio metro cbico de amoniaco en condiciones
normales?
78. La ecuacin que representa el proceso comercial para obtener sosa, cloro e hidrgeno es:
2NaCl + 2H
2
O 2NaOH + Cl
2
+ H
2
Si se utilizan 40 kg de NaCl al 93% en masa y 11.5 litros de agua pura (*)
a) Cul de los reactivos acta como limitante?
b) Cuntos gramos de NaOH se producen si el rendimiento del proceso es del 80%?
c) Qu cantidad queda del reactivo que est en exceso?
d) Qu volumen de cloro se obtiene en condiciones normales de T y P?
79. El nitrato de potasio usado como fertilizante se obtiene industrialmente por la reaccin:
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
41/45
KCl + NaNO
3
KNO
3
+ NaCl
Si se agregan 80 kg de KCl slido de 98.5% de pureza a 200L de disolucin caliente de
nitrato de sodio ( densidad = 1.256 g/mL y 35% en masa)
a) Cul de los reactivos es el limitante?
b) En el proceso se separa primero una disolucin concentrada de NaCl (densidad =
1.1697 y 24% en masa). Cuntos litros de disolucin se obtienen?
c) Cuntos gramos de NaCl puros se encuentran en el volumen del inciso anterior?
d) Al enfriar la disolucin cristalizan 75 kg de KNO
3
puro. Cul es el rendimiento o
eficiencia del proceso?
80. Una planta industrial necesita producir 7800 kg de sulfato de calcio. Para ello dispone de
suficiente cantidad de las dos materias primas necesarias, carbonato de calcio y cido
sulfrico. El carbonato de calcio se encuentra en estado puro y el cido sulfrico en
disolucin de densidad 1.2 g/mL y 90% de pureza. Si se sabe que el rendimiento de la
reaccin es del 84%. Qu volumen de la disolucin de cido sulfrico debe emplearse?
La ecuacin que representa al proceso es:
CaCO
3
+ H
2
SO
4
CaSO
4
+ H
2
CO
3
81. Considera la siguiente reaccin:
CaCO
3
+ 2 H Cl Ca Cl
2
+ H
2
O + CO
2
En 10 tubos de ensaye con 1 g de carbonato de calcio se adicionaron diferentes volmenes de
cido clorhdrico 0.1 M
a) Qu volumen de cido se requiere para llegar al punto de equivalencia?
b) Cuntos g de CaCl
2
se obtienen en el punto de equivalencia?
82. El azufre a altas temperaturas se combina con el Fe para producir FeS:
Fe + S Fe S
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
42/45
En un experimento se hicieron reaccionar 8.67 g de S con 7.62 g de Fe.
a) Cul es el reactivo limitante?
b) Qu masa de producto se form?
c) Qu cantidad de reactivo en exceso queda al final de la reaccin?
83. En el laboratorio se lleva a cabo la siguente reaccin:
Mg + 2 HCl MgCl
2
+ H
2
a) Qu molaridad tiene el cido para que reaccionen 20 mL con 4 g de Mg?
b) Qu volumen de hidrgeno se obtiene en condiciones normales de temperatura y
presin?
84. Se hicieron reaccionar 44.47 g de cobre con 189 g de cido ntrico efectundose la siguiente
reaccin:
Cu + 4 HNO
3
Cu (NO
3
)
2
+ 2 NO
2
+ 2 H
2
O
a) Cul es el reactivo limitante y cul el reactivo en exceso?
b) Cuntos gramos de nitrato de cobre se obtuvieron?
c) Qu masa de reactivo en exceso no reaccion?
d) Cul fue el % de rendimiento, si en el laboratorio se formaron 120 g?
85. Para obtener la urea se hicieron reaccionar 637.2 g de amonaco con 1142 g de xido de
carbono, segn la siguiente ecuacin:
2 NH
3
+ CO
2
(NH
2
)
2
CO + H
2
O
a) Cul es el reactivo limitante y cul el reactivo en exceso?
b) Qu masa de producto (urea) se form?
c) Qu masa de reactivo en exceso qued sin reaccionar?
d) Cul fue el % de rendimiento si se sintetiz 1 kg de urea?
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
43/45
86. La aspirina (cido acetil saliclico) se prepara por calentamiento del cido saliclico (C
7
H
6
O
3
)
con el anhdrido actico (C
4
H
6
O
3
).
C
7
H
6
O
3
+ C
4
H
6
O
3
C
4
H
8
O
4
+ C
2
H
4
O
2
Cuando se calientan 2.0 g de cido saliclico con 4.0 g de anhdrido actico
a) Cuntos g de de aspirina se forman?
b) Cul es el % de rendimiento, si experimentalmente se obtuvieron 2.1 g?
87. El disulfuro de carbono arde con oxgeno ds ge acuerdo con la siguiente reaccin:
C S
2
+ 3 O
2
C O
2
+ 2 SO
2
Calcule los gramos de xido de azufre producidos cuando reaccionan 15.0 g de sulfuro de
carbono y 35 g de oxgeno. Cunto de reactivo permanecen sin consumirse?
88. En la elaboracin industrial de galletas es comn que se agreguen crmor trtaro
(KHC
4
H
4
O
6
) y bicarbonato de sodio, ambos en polvo, para que al hornearlas, estos dos
compuestos reaccionen entre s, liberando dixido de carbono gaseoso. El gas queda
atrapado dentro de la galleta horneada y eso hace que se esponje. La ecuacin que
representa la reaccin entre los dos compuestos mencionados, es la siguiente:
KHC
4
H
4
O
6(s)
+ NaHCO
3(s)
KNaC
4
H
4
O
6 (s)
+ CO
2(g)
+ H
2
O
(l)
La industria galletera Lleya, S.A. sabe que la produccin de 7.5 L de CO
2
por cada kg de
galletas es suficiente para obtener un esponjado adecuado. Tomando en cuenta las siguientes
condiciones:
No debe quedar NaHCO
3
en el producto terminado porque altera el sabor.
El crmor trtaro slo se puede conseguir en una mezcla comercial SPONJEX
que por cada 100 g contiene 20 g de crmor trtaro y 80 g de leche descremada.
Se recomienda que en la galleta horneada permanezca un residuo de 0.7% en peso
de crmor trtaro, para mejorar su sabor.
El horneado se realiza a 240C y 0.73 atm de presin, durante 35 min.
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
44/45
a) Cuntos gramos de SPONJEX y de bicarbonato de sodio con 95% de pureza se
deben emplear en la formulacin para preparar 1 kg de galletas de la mejor calidad?
b) Cul ser el porcentaje en peso de ambos en la formulacin?
(Se recomienda tomar como base de clculo 1 kg de galletas).
89. El hierro (II) puede oxidarse a hierro (III) utilizando dicromato de potasio, en presencia de
cido clorhdrico. Esta reaccin se utiliza en los anlisis que se hacen en el laboratorio para
conocer la cantidad de fierro presente en una muestra problema.
A continuacin se presenta una tabla encabezada con la ecuacin qumica balanceada que
representa este proceso, y datos iniciales que se refieren a las cantidades de los reactivos.
Completa la tabla, presentando fuera de sta, los clculos realizados para obtener los
resultados:
6 Fe Cl
2
+ K
2
Cr
2
O
7
+ 14 HCl 6 Fe Cl
3
+ 2 CrCl
3
+ 2 KCl + 7 H
2
O
Datos
iniciales
6 moles 100 mL
3M
300 mL
36 %
d=1.18g/mL
Moles
Iniciales
Reactivo
limitante
Moles
que
reaccionan
Moles que
se
producen
Moles que
quedan
Masa que
queda
Masa que
Qumica General Ejercicios y conceptos de Estequiometra
Facultad de Qumica Junio 2002
45/45
queda, si el
rendimiento
de la
reaccin es
de 90 %
90. Se hacen reaccionar 10 g de perxido de sodio con 10 mL de agua, los productos que se
obtienen son oxgeno molecular e hidrxido de sodio.
Elabora una tabla de variacin de especies indicando cul es el reactivo limitante, cuntos
moles reaccionan, cuntas moles se producen y cuntas moles quedan al final.
91. Si se desean obtener 10 L de oxgeno molecular utilizando los mismos reactivos que se
indicaron en la pregunta (4), y se parte de reactivos con las siguientes caractersticas:
perxido de sodio slido con 95 % de pureza, agua con 90 % de pureza, qu cantidad de
cada uno de estos reactivos se tiene que poner a reaccionar?
92. Una de las reacciones que ocurre en un horno de fundicin cuando un mineral de hierro es
convertido en hierro, se representa por la siguiente ecuacin:
Fe
2
O
3
+ 3 CO --- 2 Fe + 3 CO
2
b) Se hacen reaccionar 2 toneladas de xido frrico con 10 L de monxido de carbono a
temperatura y presin estndar, cuntos kg de Fe se obtienen y cuntos L de bixido
de carbono? Elabore una tabla de variacin de especies, para que indique cuntas
moles de cada reactivo tiene al inicio, cul es el reactivo limitante, cuntas moles de
cada especie reaccionan, cuntas moles de producto se obtienen y cuntas moles de
cada especie se tienen al final de la reaccin, suponiendo un rendimiento del 100 %.
c) Si quieres obtener 1 kg de fierro y tienes monxido de carbono en exceso, cuntos Kg
de xido frrico debes hacer reaccionar?
S-ar putea să vă placă și
- Introduccion A La PNL. O'Connor, Joseph & Seymour JohnDocument157 paginiIntroduccion A La PNL. O'Connor, Joseph & Seymour JohnWilfrido Vysokolan Chaparro96% (27)
- Teoria Del FuegoDocument44 paginiTeoria Del FuegoelrafasaÎncă nu există evaluări
- Ejercicios Ley de OhmDocument10 paginiEjercicios Ley de OhmJose Luis Lopez100% (3)
- Ejercicios Ley de OhmDocument10 paginiEjercicios Ley de OhmJose Luis Lopez100% (3)
- 2 Plan de Leccion QUIMICA DEL FUEGO PDFDocument31 pagini2 Plan de Leccion QUIMICA DEL FUEGO PDFIsabel Bracamonte0% (1)
- Circuitos y Sistemas DigitalesDocument175 paginiCircuitos y Sistemas DigitalesCarlos Espinoza100% (11)
- Cálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaDe la EverandCálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaEvaluare: 5 din 5 stele5/5 (1)
- Potenciales TermodinámicoscalificadoDocument11 paginiPotenciales TermodinámicoscalificadoJESSICA VARGASÎncă nu există evaluări
- Lab.4.equilibrio Líquido Vapor de Un Sistema BinarioDocument4 paginiLab.4.equilibrio Líquido Vapor de Un Sistema BinarioGisselle MoralesÎncă nu există evaluări
- LCBII Mezcla de Aguas y H2SO4Document12 paginiLCBII Mezcla de Aguas y H2SO4Luna CarminaÎncă nu există evaluări
- Curso de Prevención y Combate de IncendiosDocument11 paginiCurso de Prevención y Combate de IncendiosNsh Nsh100% (2)
- Equilibrio Químico en Sistemas Ideales PDFDocument34 paginiEquilibrio Químico en Sistemas Ideales PDFDaniel MeloÎncă nu există evaluări
- Formulario TermodinamicaDocument25 paginiFormulario TermodinamicaPenélope ManzurÎncă nu există evaluări
- Termodinamica de La Evolucic3b3n Biolc3b3gica PDFDocument12 paginiTermodinamica de La Evolucic3b3n Biolc3b3gica PDFMuriel Leandro100% (1)
- Curva de solubilidad HCCl3-CH3COOH-H2ODocument14 paginiCurva de solubilidad HCCl3-CH3COOH-H2OSteevenRafaelPinargoteÎncă nu există evaluări
- FQ AnaliticaDocument3 paginiFQ AnaliticaNancy Belträn RdzÎncă nu există evaluări
- Fenomenos de Transporte en Procesos MicrobianosDocument11 paginiFenomenos de Transporte en Procesos MicrobianosLuyr Sito100% (1)
- Cengel Capitulo+2 SubirDocument22 paginiCengel Capitulo+2 SubirVD0% (1)
- Previo Determinacion Masa MolarDocument4 paginiPrevio Determinacion Masa MolarYamilet Estebanes MuñozÎncă nu există evaluări
- Problemas de Equilibrio y CinéticaDocument42 paginiProblemas de Equilibrio y CinéticaESTEFANY DE LOS SANTOSÎncă nu există evaluări
- Práctica 2Document5 paginiPráctica 2Rodrigo Manuel Bravo PachecoÎncă nu există evaluări
- Equilibrio Quimico2Document36 paginiEquilibrio Quimico2Soledad ColmenarezÎncă nu există evaluări
- Pract.4 Volumetria de Precipitacion Analisis de Plata en AleacionesDocument10 paginiPract.4 Volumetria de Precipitacion Analisis de Plata en Aleacionesjuan carlosÎncă nu există evaluări
- Kinetics of Iodine-Acetone ReactionDocument8 paginiKinetics of Iodine-Acetone Reaction19casiopea89Încă nu există evaluări
- Modelos Teoricos para La Transferencia de Masa enDocument13 paginiModelos Teoricos para La Transferencia de Masa enJorge Eduardo Campos0% (1)
- Práctica 6: Fundamentos de EspectrofotometríaDocument8 paginiPráctica 6: Fundamentos de EspectrofotometríaEduardo Gonzalez Cervantes0% (1)
- L B Volumenes Molares ParcialesDocument7 paginiL B Volumenes Molares Parcialesfabrycio chÎncă nu există evaluări
- P4 Calcio EDTADocument20 paginiP4 Calcio EDTAEscamilla Saldivar Fernanda JillianÎncă nu există evaluări
- Potencial QuimicoDocument33 paginiPotencial QuimicoJose Guillermo Cardenas Murillo100% (1)
- 507Document0 pagini507Oscar E Andela100% (1)
- Practica No. 6. Propiedades ColigativasDocument1 paginăPractica No. 6. Propiedades ColigativasOmar ChávezÎncă nu există evaluări
- Reporte Práctica1Document6 paginiReporte Práctica1Mario VerdeÎncă nu există evaluări
- CINÉTICA ENZIMÁTICA - Biologia y QuimicaDocument12 paginiCINÉTICA ENZIMÁTICA - Biologia y QuimicaWILDER PIZARRO CUNYASÎncă nu există evaluări
- Práctica 07 REPORTE.Document6 paginiPráctica 07 REPORTE.Wendy Joseline100% (1)
- Conservación materia comprobación leyes químicasDocument3 paginiConservación materia comprobación leyes químicasCristian ArámbulaÎncă nu există evaluări
- Practica 6 Final Final1Document18 paginiPractica 6 Final Final1Hugo Armando SerranoÎncă nu există evaluări
- Calibracion de Un TermometroDocument4 paginiCalibracion de Un TermometroPamela MartinezÎncă nu există evaluări
- Practica 5 Masa MolarDocument4 paginiPractica 5 Masa MolarCande FloresÎncă nu există evaluări
- Masa Molar de Un Liquido VolatilDocument8 paginiMasa Molar de Un Liquido VolatilΚάρλος ΠόνσεÎncă nu există evaluări
- Previo 6 Reactivo LimitanteDocument15 paginiPrevio 6 Reactivo LimitanteJose Luis VazquezÎncă nu există evaluări
- Determinación de masa molar mediante presiones parcialesDocument25 paginiDeterminación de masa molar mediante presiones parcialesMelanie Valarg100% (1)
- Tarea7 35711Document2 paginiTarea7 35711VerónicaÎncă nu există evaluări
- Repor Práctica 8 Influencia de La TemDocument3 paginiRepor Práctica 8 Influencia de La TemAlexia LunaÎncă nu există evaluări
- Serie de Problemas - Reactores BiologicosDocument4 paginiSerie de Problemas - Reactores BiologicosAgustin Fabian HaddadÎncă nu există evaluări
- Medida de La Capacidad Calorífica de Un CalorímetroDocument5 paginiMedida de La Capacidad Calorífica de Un CalorímetroNelson Ysmael Chirinos Vielma0% (1)
- Práctica 4. Densidad (Modelo Lineal)Document4 paginiPráctica 4. Densidad (Modelo Lineal)Alan TrejoÎncă nu există evaluări
- Respuestas Previo P3 QGII PDFDocument4 paginiRespuestas Previo P3 QGII PDFJAMJ2001 Two TimerÎncă nu există evaluări
- Ascenso Ebulloscà PicoDocument4 paginiAscenso Ebulloscà Picoalexa2108Încă nu există evaluări
- Practica 2Document16 paginiPractica 2Luis Enrique Duran RosasÎncă nu există evaluări
- NMX-AA-030-SCFI-2001 (Dqo)Document23 paginiNMX-AA-030-SCFI-2001 (Dqo)Fernando Rodriguez100% (1)
- Medir la viscosidad de fluidosDocument7 paginiMedir la viscosidad de fluidosJosh BHÎncă nu există evaluări
- Manual de Prácticas LQI-V 2014Document96 paginiManual de Prácticas LQI-V 2014Rodrigo Chico Merino100% (1)
- Transferencia de MasaDocument6 paginiTransferencia de Masaalc112Încă nu există evaluări
- Cálculos de concentración y cantidades en reacciones de nitrato de cobreDocument2 paginiCálculos de concentración y cantidades en reacciones de nitrato de cobreMónica VargasÎncă nu există evaluări
- Ley de Las Proporciones RecíprocasDocument4 paginiLey de Las Proporciones RecíprocasFrancisco Mego LlerenaÎncă nu există evaluări
- Ley de Enfriamiento de NewtonDocument14 paginiLey de Enfriamiento de NewtonWendy Aguilar CÎncă nu există evaluări
- Propiedades coligativas soluciones electrolitosDocument9 paginiPropiedades coligativas soluciones electrolitosRicardo CruzÎncă nu există evaluări
- Ejercicios de equilibrio químico resueltosDocument30 paginiEjercicios de equilibrio químico resueltosbryan 01.10Încă nu există evaluări
- Practica 4. Diagrama de Fases CiclohexanoDocument6 paginiPractica 4. Diagrama de Fases CiclohexanoAleex CasÎncă nu există evaluări
- Determinación masa molar método presiones parcialesDocument2 paginiDeterminación masa molar método presiones parcialesMemo ManceraÎncă nu există evaluări
- Practica 4. Destilación SimpleDocument4 paginiPractica 4. Destilación Simplej4malandr0 janoÎncă nu există evaluări
- Modelos UnimolecularesDocument15 paginiModelos UnimolecularesAbelardo Guzman LavadoÎncă nu există evaluări
- Cap 2 - Potencial QuímicoDocument13 paginiCap 2 - Potencial QuímicoAndrea Galende0% (1)
- La nanotecnología: El mundo de las máquinas a escala nanométricaDe la EverandLa nanotecnología: El mundo de las máquinas a escala nanométricaÎncă nu există evaluări
- Ejercicios Estequiometria PDFDocument47 paginiEjercicios Estequiometria PDFgyos1Încă nu există evaluări
- Estequiometria 2008-1Document33 paginiEstequiometria 2008-1Marilia Merino Alvan0% (1)
- Atajos en El TecladoDocument10 paginiAtajos en El TecladoJuan TobónÎncă nu există evaluări
- Component EsDocument2 paginiComponent EsJuan TobónÎncă nu există evaluări
- Glosario electrónica generalDocument30 paginiGlosario electrónica generalJuan TobónÎncă nu există evaluări
- Guía para El Desarrollo Del Componente PrácticoDocument7 paginiGuía para El Desarrollo Del Componente PrácticoJuan TobónÎncă nu există evaluări
- Pract 3 Impl Func Logicas 06Document3 paginiPract 3 Impl Func Logicas 06Paula Haydeé PeñaÎncă nu există evaluări
- Ejercicios Practica 2Document3 paginiEjercicios Practica 2Juan TobónÎncă nu există evaluări
- Ficha Técnica Del Proyecto 2008Document3 paginiFicha Técnica Del Proyecto 2008airethamayaÎncă nu există evaluări
- Teoria de Algebra de Boole PDFDocument25 paginiTeoria de Algebra de Boole PDFsilvercachÎncă nu există evaluări
- Practica 2 Carga y Descarga de Un CondensadorDocument3 paginiPractica 2 Carga y Descarga de Un CondensadorJuan TobónÎncă nu există evaluări
- Fase 2Document7 paginiFase 2Juan TobónÎncă nu există evaluări
- Dialnet DeLasQuimerasALaComprensionDeLaRealidad 5234360 PDFDocument18 paginiDialnet DeLasQuimerasALaComprensionDeLaRealidad 5234360 PDFJuan TobónÎncă nu există evaluări
- VenezuelanDocument2 paginiVenezuelanJuan TobónÎncă nu există evaluări
- DSP 27Document6 paginiDSP 27Juan TobónÎncă nu există evaluări
- Éxito personal-EducaciónDocument2 paginiÉxito personal-EducaciónSteve D Blues Haymoss III67% (6)
- Fórmulas para Ahorrar Energía - JPRDocument1 paginăFórmulas para Ahorrar Energía - JPRjorman55Încă nu există evaluări
- Introducción de Un TrabajoDocument1 paginăIntroducción de Un TrabajoJuan TobónÎncă nu există evaluări
- Componentes de Panel Solar FotovoltaicoDocument4 paginiComponentes de Panel Solar FotovoltaicoNano RiscosaÎncă nu există evaluări
- La Primera Salida Natasha BerletDocument9 paginiLa Primera Salida Natasha Berletpaisajf6135Încă nu există evaluări
- Comando Motores ContactoresDocument25 paginiComando Motores ContactoresLeslie BuÎncă nu există evaluări
- LOS QUESOS Pps PDFDocument76 paginiLOS QUESOS Pps PDFPolicena6944Încă nu există evaluări
- Matematica 1Document34 paginiMatematica 1Juan Tobón100% (1)
- Convertidores CAAAADocument4 paginiConvertidores CAAAAJuan TobónÎncă nu există evaluări
- SUICIDIODocument5 paginiSUICIDIOJuan TobónÎncă nu există evaluări
- Motor TrifasicoDocument9 paginiMotor TrifasicoJuan TobónÎncă nu există evaluări
- Sensor EsDocument59 paginiSensor EsJuan TobónÎncă nu există evaluări
- Simbologia Logica CableadaDocument21 paginiSimbologia Logica CableadaDeiby Zuleta RoldanÎncă nu există evaluări
- Determinación del porcentaje de hierro en un concentrado mediante volumetría redoxDocument19 paginiDeterminación del porcentaje de hierro en un concentrado mediante volumetría redoxedgar junior florian mallquiÎncă nu există evaluări
- Anexo - Tarea 3Document8 paginiAnexo - Tarea 3Andres Favian Mendoza FonsecaÎncă nu există evaluări
- Planificacion Anual de QuimicaDocument32 paginiPlanificacion Anual de QuimicaAriel Morales CoronadoÎncă nu există evaluări
- Asfalto OxidadoDocument20 paginiAsfalto OxidadoomarucvÎncă nu există evaluări
- Practica - 5 - Electro - N 1Document17 paginiPractica - 5 - Electro - N 1Pearl GlÎncă nu există evaluări
- Plan de Emergencias CondominioDocument43 paginiPlan de Emergencias Condominioalex merino100% (1)
- Determinación de La Reactividad Entre Alcoholes Primarios, Secundarios, Terciarios y Derivados Mono y PolihidroxiladosDocument9 paginiDeterminación de La Reactividad Entre Alcoholes Primarios, Secundarios, Terciarios y Derivados Mono y PolihidroxiladosDaniel GutiérrezÎncă nu există evaluări
- Anexo 3.5 Química (Corregido)Document9 paginiAnexo 3.5 Química (Corregido)ALBERTO ISMAEL WONG DILLONÎncă nu există evaluări
- Proceso WackerDocument12 paginiProceso WackerMoy Fuentes100% (1)
- Tabla de SolubilidadDocument2 paginiTabla de SolubilidadJenrry MelgarejoÎncă nu există evaluări
- Unidad 5. Procesos Biologicos PDFDocument57 paginiUnidad 5. Procesos Biologicos PDFGar Ara100% (2)
- Micoremediación para El Tratamiento de Efluentes Con Titas Como ContaminantesDocument6 paginiMicoremediación para El Tratamiento de Efluentes Con Titas Como ContaminantesVanessa MarisolÎncă nu există evaluări
- Guia de Laboratorio Piro No 3 TostacionDocument3 paginiGuia de Laboratorio Piro No 3 TostacionAndres Camargo100% (1)
- Proyecto Celdas de CombustibleDocument13 paginiProyecto Celdas de CombustibleMariel RosalesÎncă nu există evaluări
- Informe de Laboratorio Funcion Quimica de Quimica Inorganica 1Document21 paginiInforme de Laboratorio Funcion Quimica de Quimica Inorganica 1LUIS MIGUEL CONSUEGRA VERGARAÎncă nu există evaluări
- Mente FactoDocument4 paginiMente FactoAndres Felipe100% (1)
- Microbiologia Ambiental: Semana 2Document54 paginiMicrobiologia Ambiental: Semana 2Gabriela Vasquez Vargas MachucaÎncă nu există evaluări
- Método QuelatométricoDocument3 paginiMétodo QuelatométricoSharon Yanireth Castro PaganÎncă nu există evaluări
- Apuntes Bioenergetica y MetabolismoDocument12 paginiApuntes Bioenergetica y MetabolismoRubénDaríoÎncă nu există evaluări
- AlgoritmosDocument12 paginiAlgoritmosRandyÎncă nu există evaluări
- Electrólisis y Faraday 2Document3 paginiElectrólisis y Faraday 2Claudia Hernández SánchezÎncă nu există evaluări
- Factores biodegradaciónDocument1 paginăFactores biodegradaciónWily ChavezÎncă nu există evaluări
- Drenaje Acido de RocaDocument50 paginiDrenaje Acido de Roca1394203031100% (2)
- Cuestionario CorroDocument2 paginiCuestionario CorroGabriel Rios CarpioÎncă nu există evaluări
- 414 Eq3 PiaDocument21 pagini414 Eq3 PiaGina RiveraÎncă nu există evaluări
- Redox Química 2o BachilleratoDocument35 paginiRedox Química 2o BachilleratoPilar de la CruzÎncă nu există evaluări