Documente Academic
Documente Profesional
Documente Cultură
Quimica Analitica
Încărcat de
Serzhyo MashaduDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Quimica Analitica
Încărcat de
Serzhyo MashaduDrepturi de autor:
Formate disponibile
INDICE
SEO
DESCRIO
PGINA
1
2
3
3.1
INTRODUO GERAL
METODOLOGIA
RESULTADOS E DISCURSES
Experimento 01: Conhecimento de Vidraarias e definio de
02
03
04
04
3.2
3.3
3.4
3.5
3.6
3.7
4
presso e exatido
Experimento 02: Preparo de solues e Padronizaes
Experimento 03: Ttulometria
Experimento 04: Anlise de gua
Experimento 05: Espectroscopia
Experimento 06: Cromatografia
Experimento 07: Gravimetria
CONCLUSO
05
06
07
09
10
12
14
REFERNCIAS
ANEXOS
15
16
5
6
1 INTRODUO GERAL
a parte da qumica que estuda os princpios tericos e prticos das anlises qumicas.
Tem como objetivo prtico a determinao da composio qumica de substncias puras ou de
suas misturas. A qumica analtica proporciona mtodos para determinar quais elementos e
substncias esto presentes e ou em que quantidades ou propores esto presentes em uma
amostra em questo.
Existem muitas definies para anlise qumica. Isso significa que a qumica analtica
muito abrangente e inclui muitas tcnicas e procedimentos manuais, qumicos e
instrumentais. A qumica analtica encontra-se presente em praticamente todas as atividades
humanas que envolvem a qumica. Por exemplo, agricultura, meio-ambiente, transformao
metalrgica, farmacologia, etc.
A disciplina de qumica analtica engloba as anlises qumicas qualitativas e
quantitativas. Enquanto a anlise qualitativa busca identificar os elementos, ons ou
compostos presentes na amostra, a quantitativa se preocupa com a quantidade de um ou mais
dos constituintes presentes na amostra.
Neste trabalho sero abordados alguns procedimentos experimentais de qumica
analtica executados em laboratrio.
2 METODOLOGIA
Descrever os procedimentos experimentais e resultados obtidos nos testes de qumica
analtica. Aplicar os conhecimentos tericos obtida em sala de aula pelo docente e analisar
criticamente os resultados obtidos. Aprimorar os conhecimentos em qumica analtica a partir
da observao dos resultados obtidos nas aulas prtica.
3- RESULTADOS E DISCURSES
3.1 Experimento 01: Conhecimento de Vidraarias e definio de presso e
exatido
3.1.1 Introduo
Os laboratrios, tanto de Qumica quanto de Fsica e Biologia, fazem uso de vrios
instrumentos, so chamados de vidrarias e equipamentos.
As vidrarias so, em sua maioria, instrumentos de vidro cristal ou temperado, para que
as medidas sejam precisas e o recipiente no reaja com a substncia contida nele. Entretanto,
elas devem ser tratadas com o maior cuidado possvel, principalmente porque o vidro
utilizado nelas mais trabalhado que os de outros vidros quaisquer, assim sendo mais caros,
obviamente. Os materiais de metal podem servir para suporte e manuseamento das vidrarias.
Existem tambm materiais de porcelana, de borracha ou plstico e materiais que so fontes de
aquecimento.
3.1.2 Objetivo
Conhecer as distines dos tipos de instrumentos do laboratrio. Encontrar
experimentalmente as diferenas das medidas entre eles. Reconhecer as funes especficas
de cada instrumento. Aprender a manuse-los.
3.1.3 Equipamentos Utilizados
Vide Laboratrio de Qumica Analtica
3.1.4. Resultados e Discusso
Foi realizado no laboratrio, o manuseio dos equipamentos de vidro, com isso foi
aprendido a associao correta dos materiais ou equipamentos com o seu uso apropriado.
As experincias realizadas pelos alunos em aula, proporcionaram habilidade no
manuseio dos materiais, e familiarizao dos mesmos com cada vidraria utilizada e sua
funo no laboratrio.
3.1.5 Concluses
Com as prticas realizadas, podemos associar corretamente cada material com o seu
uso especfico, facilitando a compreenso de cada experincia e evitando equvocos.
3.2 Experimento 02: Preparo de solues e Padronizaes
3.2.1 Introduo
A padronizao realizada por meio da titulao. O trmino da titulao percebido
por alguma modificao fsica provocada pela prpria soluo ou pela adio de um reagente
auxiliar, como um indicador (vermelho de metila ou fenolftalena). Os resultados da titulao
foram imprescindveis, pois atravs da equao fundamental da anlise volumtrica,
descobrimos qual era a concentrao real do NaOH
3.2.2 Objetivos
Proceder a padronizao de uma soluo de hidrxido de sdio (NaOH)
3.2.3 Equipamentos Utilizados
Vide Laboratrio de Qumica Analtica
3.2.4 Resultados e Discusso
O hidrxido de sdio no pode ser usado como padro primrio, pois, pode reagir com
dixido de carbono existente no ar, formando carbonato de sdio. um slido em forma de
pastilhas branco, deliqescente, inodoro e higroscpico, estvel sob condies comuns de
uso e armazenamento. Entretanto, reage com vidro e dissolve a slica, formando silicatos
solveis. A presena desses silicatos pode causar erros e, por isso, as solues de NaOH
devem ser conservadas em frascos de polietileno.
Em uma titulao de cido e base forte o ponto de equivalncia se d
aproximadamente em pH 7, pois o cido ioniza-se praticamente na totalidade e a base se
dissocia praticamente na totalidade. Quando os ons H3O+ e OH- reagem, formam gua. Na
titulao da soluo de HCl com NaOH:
3.2.5 Concluses
Obtivemos xito na realizao do experimento. Os objetivos foram alcanados, pois,
as solues foram preparadas e padronizadas com sucesso.
3.3 Experimento 03: Titulometria
3.3.1 Introduo
A Titulometria a anlise quantitativa que se realiza para determinar a concentrao
de uma soluo. Mais conhecida como titulao, esta anlise permite dosar uma soluo e
determinar a sua quantidade por intermdio de outra soluo de concentrao conhecida.
Sendo que a soluo padro a que se conhece a concentrao, e a soluo problema aquela
da qual estamos procurando o valor.
A titulao , em geral, realizada em laboratrio, pode ser feita de muitas maneiras,
mas a mais conhecida a titulao cido-base, que empregada em anlises industriais e
subdivide-se em: Acidimetria: determinao da concentrao de um cido e Alcalimetria:
determinao da concentrao de uma base.
3.3.2 Objetivos
Aprender determinar concentraes desconhecidas de solues, atravs de uma
soluo com concentrao conhecida.
3.3.3 Equipamentos Utilizados
Vide Laboratrio de Qumica Analtica
3.3.4 Resultados e Discusso
Constatou-se que a soluo de hidrxido de sdio, inicialmente incolor, tornou-se
rosada ao adicionar o indicador de Fenolftalena devido seu pH alcalino.
Ao iniciar a titulometria com o cido clordrico a soluo gradativamente retomou a
colorao incolor em virtude da perda de suas hidroxilas para o cido. Dessa reao obtm-se
como produto um sal mais gua.
Evidenciou-se que a quantidade da soluo a ser encontrada afeta na quantidade da
soluo conhecida, mas no altera na sua quantidade de mol (concentrao), conforme dados
na planilha acima.
3.3.5 Concluses
Aps mudana de cor da soluo, a torneira da bureta foi devidamente fechada, em
seguida, calcularam-se as concentraes das solues problemas. Com estes procedimentos
conseguimos alcanar o objetivo do experimento, que era determinar a concentrao de uma
soluo desconhecida atravs de uma conhecida pelo processo de titulao.
3.4 Experimento 04: Anlise de gua
3.4.1 Introduo
A gua um elemento composto por dois tomos de hidrognio (H) e um de oxignio
(O), formando a molcula de H2O. uma das substncias mais abundantes em nosso planeta
e pode ser encontrada em trs estados fsicos: slido (geleiras), lquido (oceanos e rios), e
gasoso (vapor dgua na atmosfera).
A gua de fundamental importncia para a vida de todas as espcies.
Aproximadamente 80% de nosso organismo composto por gua. Boa parte dos
pesquisadores concorda que a ingesto de gua tratada um dos mais importantes fatores para
a conservao da sade, considerada o solvente universal, auxilia na preveno das doenas
(clculo renal, infeco de urina, etc.) e proteo do organismo contra o envelhecimento.
3.4.2 Objetivos
O presente trabalho teve por objetivo avaliar a qualidade da gua atravs da anlise de
cloro livre na gua, pH, turbidez, alcalinidade total e dureza total.
3.4.3 Equipamentos Utilizados
Vide laboratrio de Qumica Analtica
3.4.4 Resultados e Discusso
O mesmo autor afirma que, em condies naturais, um rio nunca ser demasiado cido
nem demasiado alcalino, pois o cido carbnico um cido fraco e os carbonatos so tambm
lcalis fracos e rios que percorrem terrenos cidos, sem calcrios, tendem a ser mais cidos
que rios que percorrem terrenos alcalinos e quando a acidez de um rio muito acentuada, ela
no pode ser devida somente ao gs carbnico, portanto, no acidez orgnica e sim mineral
proveniente, sem dvida, de uma fonte estranha. Em ambos os casos, acidez ou alcalinidade
acentuada, a causa provvel uma fonte de poluio industrial.
3.4.5 Concluses
Com a realizao desta prtica foi possvel perceber a importncia de se realizar
anlises para garantir a qualidade da gua tanto para consumo quanto para utilizao para
anlises, pois a mesma se no for bem tratada pode ocasionar em problemas de sade de quem
a consome como tambm erros nas anlises realizadas. E devido a sua dureza pode provocar
incrustaes nos equipamentos e ocasionar na perda dos mesmos. Devido a estas e outras
razes a gua deve ser bem tratada para evitar esses tipos de problemas. Foi possvel tambm
cumprir com os objetivos propostos para esta prtica.
3.5 Experimento 05: Espectroscopia
3.5.1 Introduo
Desde a antiguidade sabia-se que a luz solar poderia ser composta nas cores do arco
ris, mas foi Newton que no sculo XVII, descreveu de forma adequada o fenmeno da
decomposio da luz por um prisma, assim como de sua recomposio por um segundo
prisma, ou seja, Se a luz branca visvel for colimada a um feixe estreito, passado por uma
fenda e depois colidir com um prisma, ao passar por esse prisma ele colide em um anteparo, a
partir da se observa um espectro contnuo semelhante a um arco-ris. O conjunto das cores
obtidas com o prisma conhecido como espectro, e varia do vermelho, numa das
extremidades, ao violeta, na outra extremidade. Este processo conhecido como
espectroscopia.
3.5.2 Objetivos
Aprender o os princpios da espectroscopia e sua utilizao.
3.5.3 Equipamentos Utilizados
Vide laboratrio de Qumica Analtica
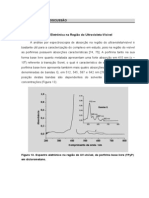
3.5.4 Resultados e Discusso
Em qumica sabe-se que o cloreto de prata um slido branco que escurece por ao
da luz. Este o principio da fotografia em preto e branco. O filme fotogrfico contm uma
suspenso de um composto semelhante, o brometo de prata, que tambm escurece ao ser
atingido pela luz. Este fenmeno, que comum aos dois sais, no se atribui ao brometo ou ao
cloreto mas sim a prata, existentes em ambos compostos qumicos. A reao que promovida
pela luz e pelo processo de revelao, dando origem ao metal finamente dividido, que preto.
3.5.5 Concluses
Em nosso cotidiano, o exemplo mais comum de onda ou oscilao eletromagntica a
luz. Uma observao de grande importncia observar a luz ao atravessar um prisma de
10
vidro. Um feixe de luz branca (luz solar ou de uma lmpada incandescente comum) se
decompe em vrias cores, que formam o chamado espectro luminoso, que vai variando
gradativamente do vermelho ao violeta, fenmeno idntico ocorre na formao do arco-ris,
em que as gotculas de gua no ar agem sobre a luz do mesmo modo que o prisma de vidro. A
diferena entre uma cor e outra reside nos comprimentos de onda e nas freqncias, que
variam para cada cor. Em um espectro completo das ondas eletromagnticas muito mais
amplo do que o da luz visvel, isto , das ondas que podemos perceber por meio da viso. A
maior parte dos nossos conhecimentos sobre tomos molculas e ncleos vem desses estudos
sobre a radiao emitida ou absorvida por eles, Portanto a espectroscopia foi de grande ajuda
nos conhecimentos qumicos e vrias pessoas contriburam para esse longo processo de
descoberta at chegar no que conhecemos hoje.
3.6 Experimento 06: Cromatografia
3.6.1 Introduo
A cromatografia um mtodo empregado de forma ampla e que permite a separao,
identificao e determinao de componentes qumicos em misturas complexas. Nenhum
outro mtodo de separao to poderoso e de aplicao to generalizada como a
cromatografia. Segundo Skoog et al (2008,p. 875) uma tcnica na qual componentes de
uma mistura so separados com base nas diferenas de velocidade nas quais so transportados
atravs de uma fase fixa estacionria por uma fase mvel lquida ou gasosa. Os componentes
da mistura so transportados atravs da fase estacionria pelo fluxo da fase mvel e as
separaes ocorrem com base nas diferenas de velocidade de migrao entre os componentes
da fase mvel. tambm um mtodo muito verstil, podendo utilizar colunas de diferentes
tipos e dimenses, bem como diversas combinaes de diversas fases mveis e estacionrias.
3.6.2 Objetivos
A anlise cromatogrfica, tambm conhecida como cromatografia, uma tcnica de
separao de misturas homogneas que tem como objetivo isolar e identificar os componentes
atravs da colorao dos mesmos
11
3.6.3 Equipamentos Utilizados
Vide laboratrio de Qumica Analtica
3.6.4 Resultados e Discusso
Pode-se observar que os fundamentos bsicos para este tipo de separao dependem
ds fenmenos de adsoro e que acontecem repetitivamente, durante o movimento dos
componentes da amostra, atravs do leito estacionrio. A separao ocorre devido a diferentes
constantes de distribuio destes componentes entre as fases mvel e estacionria, consiste
tambm na partio dos componentes de uma mistura entre a fase mvel e a fase estacionria
que depende da afinidade entre as fases, pois os componentes de uma mistura so separados
com base nas diferenas de velocidade nas quais so transportados atravs de uma fase fixa
estacionria por uma fase mvel lquida ou gasosa.
Os usos mais consagradas da tcnica de cromatografia so: separao, identificao e
determinao de componentes qumicos em misturas complexas. Nenhum outro mtodo de
separao to poderoso e de aplicao to generalizada como a cromatografia. Os mtodos
cromatogrficos servem tambm para fins de identificao e anlise de misturas e de
substncias isoladas; nesse caso, chama-se de cromatografia analtica, enquanto a
cromatografia que visa o isolamento de compostos dita cromatografia preparativa
3.6.5 Concluses
Aps este experimento pode-se concluir que a cromatografia um mtodo eficiente na
identificao de compostos com polaridades distintas, alm de ser uma tcnica eficaz na
classificao do grau de polaridade de compostos desconhecidos, fazendo a separao de mais
de um componente.
No experimento da cromatografia em papel, pode-se observar que os componentes da
tinta tm maior afinidade com uma mistura de lcool, acetona e gua, pode-se dizer que os
compostos so polares, uma vez que os solventes tambm os so. Este solvente apesar de ter
percorrido o menor caminho, conseguiu separar as tintas em mais de uma cor.
Na separao do extrato de folhas verdes foi necessrio o uso de um revelador, uma
vez que a substncia a ser identifica no era visvel a olho n. A placa preparada
manualmente, apesar de no ter ficado perfeita, apresentou uma boa afinidade com o eluente e
12
com a substncia, pois conseguiu realizar um bom transporte e uma boa separao dos
componentes.
O mecanismo de separao dado pela interao da fase estacionria e da fase mvel
com os componentes da mistura, no caso do experimento, o mecanismo de separao o
processo fsico, que denominado de processo de adsoro, que baseado principalmente em
atraes eletrostticas ou dipolares (foras de Van Der Waals), incluindo a formao de ponte
de hidrognio. A adsoro se d na interface entre o slido e a fase mvel, devido presena
de grupos ativos na sua superfcie.
3.7 Experimento 07: Gravimetria
3.7.1 - Introduo
A gravimetria um mtodo analtico quantitativo, que consiste na separao e
pesagem de um elemento ou composto na sua forma mais pura possvel. Existem vrios tipos
de anlises gravimtricas: a gravimetria por precipitao, na qual o composto analisado
separado de uma soluo da amostra como um precipitado e convertido a uma espcie de
composio conhecida e que pode ser pesada; a gravimetria de volatilizao, na qual o
composto analisado isolado dos outros constituintes da amostra pela converso a um gs de
composio qumica conhecida. O peso desse gs serve ento como uma medida da
concentrao do composto. A eletrogravimetria, na qual o composto analisado separado pela
deposio em um eletrodo por meio do uso de uma corrente eltrica, e a massa desse produto
fornece ento uma medida da concentrao do composto; e a titulao gravimtrica, na qual a
massa do reagente, com concentrao conhecida, requerida para reagir completamente com o
composto analisado fornece a informao necessria para determinar a sua concentrao.
3.7.2 Objetivos
Aprender as tcnicas de decantao, filtrao, lavagem e secagem de precipitados,
determinar o rendimento de uma reao de precipitao.
3.7.3 Equipamentos Utilizados
Vide Laboratrio de Qumica Analtica
13
3.7.4 Resultados e Discusso
Ao ser pesado o papel de filtro, antes da filtrao, este apresentou massa igual a
1,09g. Aps a adio do precipitado, e este ter ficado uma semana no dessecador, o
papel de filtro apresentou a massa de 1,19g. Podemos concluir assim que a massa do
precipitado foi de 0,10g.
O precipitado formado foi decorrente da seguinte reao:
Pb(NO3)2 (aq) + 2KI (aq) PbI2 (s) + 2KNO3 (aq)
Precipitado Insolvel
Aps a reao acima, verificou-se que o Iodeto de Chumbo apresentou uma colorao
amarelo brilhante, enquanto o Nitrato de Potssio apresentou-se incolor.
O Iodeto de Potssio se precipita quando a concentrao dos seus ons na soluo
tiverem em quantidade suficiente para ultrapassar o produto de solubilidade do
mesmo.
3.7.5 Concluso
Pode-se concluir que a gravimetria por precipitao um processo
relativamente simples. Entretanto, para se obter um resultado satisfatrio necessrio
ateno e cuidado a todas as etapas do processo, para que no ocorram erros como os
que foram citados nos Resultados e Discusso, pois o objetivo a obteno do
precipitado puro e com alta eficincia.
14
4 CONCLUSO
A Qumica Analtica envolve mtodos voltados para a determinao da composio da
matria. Os mtodos qualitativos geram informaes sobre a identidade das espcies atmicas
ou moleculares ou mesmo grupos funcionais na amostra. J os mtodos quantitativos
proporcionam resultados numricos relacionados quantidade dos componentes na amostra.
No incio do desenvolvimento da Qumica, a maioria das anlises empregavam a
separao dos componentes de interesse (os analitos) por tcnicas como precipitao, extrao
ou destilao. Para anlises qualitativas, os componentes separados eram ento tratados com
reagentes que em contato com o analito produziam compostos identificados pela sua cor,
solubilidade, pontos de fuso e ebulio, etc. Assim as espcies qumicas eram identificadas.
A quantificao dos analitos (elementos de interesse numa anlise) pode ser feita atravs de
tcnicas simples mas muito precisas, que esto em pleno uso at os dias atuais, como a
volumetria (titulaes) e a gravimetria (medidas de massa).
Neste relatrio foi visto a aplicao de algumas das principais fundamentaes tericas
da qumica analtica na pratica em laboratrio.
15
REFERNCIAS
[1] MAHAN, Bruce M.; MAYERS, Rollie J. Qumica um curso universitrio. 4.ed. Rio de
Janeiro; Traduo de Koiti Araki; Denise de Oliveira Silva; Flavio Massao Matsumoto. So
Paulo: Edgard Bluncher, 2003.
[2] RUIZ, Andoni Garritz; GUERRERO, Jose Antonio Chamiso. Quimica. Traduo de
Giovani
S.
Crisi.
Sao
Paulo:
Prentice
Hall,
2002.
[3] VOGEL, A. I. et al. Qumica Analtica Quantitativa. 5 edio. Rio de Janeiro: LTC,
1992. 48
[4] BACCAN, Nivaldo et al. Qumica analtica quantitativa e elementar. 3. ed. rev. ampl.
So Paulo: Edgard Blcher; Campinas
[5] SKOOG, D.H. et al. Fundamentos de Qumica Analtica. 8. ed. So Paulo: Thomson,
2006. 999 p.
[6] HARRIS, Daniel C. Anlise qumica quantitativa. 5. ed. Rio de Janeiro: LTC, 2001. 862
p.
[7] VOGEL, A. Qumica Analtica Qualitativa, So Paulo; Editora Mestre Jou, 1981.
[8] VAITMAN, Delmo S. Ensaios Qumicos Qualitativos, Rio de Janeiro; Intercincia,1995.
[9] http://docs.google.com/gview?a=v&q=cache:pBfOqBweq
[10] www.annq.org/congresso2007/trabalhos_apresentados/
[11] A. J. Hannaford, Vogels, Quimica analitica qualitativa I; Editora KaPELUSZ
S-ar putea să vă placă și
- Prova - Obstetrícia - ENFERMAGEMDocument16 paginiProva - Obstetrícia - ENFERMAGEMSerzhyo MashaduÎncă nu există evaluări
- Chikungunya Manejo Clinico Jun2017Document67 paginiChikungunya Manejo Clinico Jun2017Aglaube AirtonÎncă nu există evaluări
- Aula01 PDFDocument23 paginiAula01 PDFMalick Ramos MonteiroÎncă nu există evaluări
- Saude Populacao Situacao Rua PDFDocument22 paginiSaude Populacao Situacao Rua PDFRodrigo B RodriguesÎncă nu există evaluări
- Ufma 2017Document42 paginiUfma 2017Serzhyo MashaduÎncă nu există evaluări
- Algébra LinearDocument4 paginiAlgébra LinearSerzhyo MashaduÎncă nu există evaluări
- Cadernos Atencao Basica Vigilancia SaudeDocument199 paginiCadernos Atencao Basica Vigilancia SaudeSerzhyo MashaduÎncă nu există evaluări
- TCEDocument4 paginiTCESerzhyo MashaduÎncă nu există evaluări
- Saude Da CriançaDocument15 paginiSaude Da CriançaSerzhyo MashaduÎncă nu există evaluări
- (Enfermagem) Manual Procedimentos Enfermagem - Guia de BolsoDocument203 pagini(Enfermagem) Manual Procedimentos Enfermagem - Guia de BolsoSih Dominski Machado100% (1)
- Cap-04 Cinematic A TraumaDocument14 paginiCap-04 Cinematic A Traumaapi-3704607100% (3)
- Gestão e GerenciamentoDocument11 paginiGestão e GerenciamentoSerzhyo MashaduÎncă nu există evaluări
- Aula Semiologia Aplicação de Calor e Frio PDFDocument21 paginiAula Semiologia Aplicação de Calor e Frio PDFJu Miranda100% (2)
- Relatorio Estagio HUT PDFDocument3 paginiRelatorio Estagio HUT PDFSerzhyo MashaduÎncă nu există evaluări
- O Calor e o Frio Como Agentes TerapeuticosDocument6 paginiO Calor e o Frio Como Agentes TerapeuticosSerzhyo Mashadu100% (1)
- Referncial TeoricoDocument2 paginiReferncial TeoricoSerzhyo MashaduÎncă nu există evaluări
- Mecanismo Do PartoDocument3 paginiMecanismo Do PartoSerzhyo MashaduÎncă nu există evaluări
- Introducao Saude Publica BrasilDocument25 paginiIntroducao Saude Publica BrasilDaniÎncă nu există evaluări
- Referncial TeoricoDocument2 paginiReferncial TeoricoSerzhyo MashaduÎncă nu există evaluări
- Modelo de ProjetoDocument13 paginiModelo de ProjetoSerzhyo MashaduÎncă nu există evaluări
- Gestão e GerenciamentoDocument11 paginiGestão e GerenciamentoSerzhyo MashaduÎncă nu există evaluări
- Trabalho de Bissegurança PDFDocument11 paginiTrabalho de Bissegurança PDFSerzhyo MashaduÎncă nu există evaluări
- Trabalho de Bissegurança PDFDocument11 paginiTrabalho de Bissegurança PDFSerzhyo MashaduÎncă nu există evaluări
- Modelo de Pré-ProjetoDocument5 paginiModelo de Pré-ProjetoPaolaÎncă nu există evaluări
- Fisiologia Do Ciclo Menstrual Da MulherDocument3 paginiFisiologia Do Ciclo Menstrual Da MulherSerzhyo MashaduÎncă nu există evaluări
- Coleta de Material para Exames e Monitorização Cardíaca - FSA - Faculdade Santo Agostinho 2015.1Document54 paginiColeta de Material para Exames e Monitorização Cardíaca - FSA - Faculdade Santo Agostinho 2015.1Serzhyo Mashadu100% (1)
- Coleta de Material para Exames e Monitorização Cardíaca - FSA - Faculdade Santo Agostinho 2015.1Document54 paginiColeta de Material para Exames e Monitorização Cardíaca - FSA - Faculdade Santo Agostinho 2015.1Serzhyo Mashadu100% (1)
- 01 - DefinicioesDocument6 pagini01 - DefinicioesSerzhyo MashaduÎncă nu există evaluări
- Psicofarmacologia Ansiolitico AntidepressivosDocument17 paginiPsicofarmacologia Ansiolitico AntidepressivosSerzhyo MashaduÎncă nu există evaluări
- TarefaDocument1 paginăTarefaSerzhyo MashaduÎncă nu există evaluări
- Fabricação de HidromelDocument11 paginiFabricação de HidromelwelberromeroÎncă nu există evaluări
- Deformação de MateriaisDocument26 paginiDeformação de MateriaisBruno Henrique HoinschyÎncă nu există evaluări
- Química Socioambiental Volume 2Document41 paginiQuímica Socioambiental Volume 2Erica MariaÎncă nu există evaluări
- Apostila Orgânica 4º SemestreDocument16 paginiApostila Orgânica 4º Semestreanon_226130384Încă nu există evaluări
- Tecnologia de Aplicação de Defensivos - UNESPDocument28 paginiTecnologia de Aplicação de Defensivos - UNESPsartooriÎncă nu există evaluări
- AglomeranteDocument272 paginiAglomeranteelisa120Încă nu există evaluări
- Proteg TCC - TriclorocarbanDocument2 paginiProteg TCC - TriclorocarbanallanHF100% (1)
- Salame ArtesanalDocument6 paginiSalame ArtesanalHedge TraderÎncă nu există evaluări
- Betao LeveDocument2 paginiBetao LeveJose Manuel DomingosÎncă nu există evaluări
- Plano de Prevenção e Proteção Contra IncêndioDocument8 paginiPlano de Prevenção e Proteção Contra IncêndioDavi Alves BatalhaÎncă nu există evaluări
- Dicas para Comprar Skate Ou LongboardDocument5 paginiDicas para Comprar Skate Ou LongboardVsa AlforgesÎncă nu există evaluări
- Discussão e Resultados de Experimentos TBQ LaboratorioDocument20 paginiDiscussão e Resultados de Experimentos TBQ LaboratorioWilliam PachecoÎncă nu există evaluări
- Guia Prático Do Pêndulo - D. Jurriaanse - Doc - IlustradoDocument56 paginiGuia Prático Do Pêndulo - D. Jurriaanse - Doc - IlustradoTerezinha Flores Canabarro100% (1)
- Manual Autoclave Vitale PlusDocument34 paginiManual Autoclave Vitale PlusAna Clara Costa50% (4)
- Discussão Dos Resultados - UV - VisDocument5 paginiDiscussão Dos Resultados - UV - VisPatrick Rodrigues BatistaÎncă nu există evaluări
- Revisão Segunda Ava IiDocument8 paginiRevisão Segunda Ava IiImpressões Digitais OrleansÎncă nu există evaluări
- Catálogo de Bombas de Engrenagem - FBIDocument16 paginiCatálogo de Bombas de Engrenagem - FBInrogernÎncă nu există evaluări
- Tairo, Hidroresfriamento e Embalagens Na ConservaçãoDocument10 paginiTairo, Hidroresfriamento e Embalagens Na ConservaçãoThayse RochaÎncă nu există evaluări
- BP Gasolina Ultimate 98 Gasolina Schumbo 98DDocument39 paginiBP Gasolina Ultimate 98 Gasolina Schumbo 98DIsabelDrummondÎncă nu există evaluări
- Feijão EmaterDocument7 paginiFeijão EmaterEzio JuniorÎncă nu există evaluări
- jspuibitstream123456789159261JFSM26092019 PDFDocument61 paginijspuibitstream123456789159261JFSM26092019 PDFRosemeire Santos cruzÎncă nu există evaluări
- Pirometalurgia, Hidrometalurgia, EletrometalurgiaDocument31 paginiPirometalurgia, Hidrometalurgia, EletrometalurgiaMoysés Araújo0% (1)
- Cultura Da CebolaDocument7 paginiCultura Da CebolaMarcos OkunoÎncă nu există evaluări
- Minerais e Rochas - ResumoDocument7 paginiMinerais e Rochas - ResumoVal TeixeiraÎncă nu există evaluări
- FISPQ SGQ VT20 Limpa Estofados PDFDocument6 paginiFISPQ SGQ VT20 Limpa Estofados PDFjsbarcellosÎncă nu există evaluări
- Reciclagem IsoporDocument7 paginiReciclagem IsoporeusebiopÎncă nu există evaluări
- RELATÓRIODocument41 paginiRELATÓRIOeliaszamarkiÎncă nu există evaluări
- Arcelormittal Portugal Catalogo Painel FachadaDocument20 paginiArcelormittal Portugal Catalogo Painel FachadaRui ConceiçãoÎncă nu există evaluări
- 112.025 - Sumazinc s659 Primer Rico em ZincoDocument2 pagini112.025 - Sumazinc s659 Primer Rico em ZincoLaertes JuniorÎncă nu există evaluări
- Estufa de Esterilização e Secagem Solid SteelDocument6 paginiEstufa de Esterilização e Secagem Solid SteelLeandro GonçalvesÎncă nu există evaluări