Documente Academic
Documente Profesional
Documente Cultură
Conductimetría
Încărcat de
Mirian Bellido CasasDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Conductimetría
Încărcat de
Mirian Bellido CasasDrepturi de autor:
Formate disponibile
1
1. Fundamento
Los mtodos conductimtricos estn basados en la conduccin elctrica de los
iones en una disolucin.
La tcnica conductimtrica es una tcnica electroanaltica en la que se mide la
conductancia de la disolucin problema y se relaciona la medida con la
concentracin de las especies en disolucin.
La conduccin de la corriente elctrica a travs de la disolucin de un electrolito
supone la migracin de las especies con carga positiva hacia el ctodo y las de
carga negativa hacia el nodo.
Todos los iones contribuyen al proceso de conduccin, pero la fraccin de
corriente transportada por una especie dada est determinada por su
concentracin relativa y su movilidad intrnseca en ese medio.
La conductividad es una medida de la concentracin inica total que tiene una
disolucin.
1. Fundamento
La conduccin de la corriente elctrica a travs de las disoluciones inicas se
realiza por los iones de la disolucin, los cuales se mueven en distintos sentidos
(de acuerdo con el signo de su carga) bajo la accin del campo elctrico producido
por la diferencia de potencial aplicada entre dos electrodos en ella introducidos.
Para estas disoluciones es vlida la Ley de
Ohm:
V=IR
R es la resistencia del conductor (en Ohm,
),
V es la diferencia de potencial aplicada (en
voltios, V )
I es la intensidad de corriente que circula a
travs de la disolucin (en amperios, A).
Fig. 1
1. Fundamento
Una forma de conocer la capacidad conductora de una disolucin es
poner dos electrodos en la disolucin, aplicar una diferencia de potencial
entre ambos y medir la resistencia, que depende de los siguientes
factores:
a) el rea de la superficie de los electrodos,
b) la forma de los electrodos,
c) la posicin de los electrodos entre s en la disolucin,
d) el tipo de especies en la disolucin entre ellos su carga,
e) la concentracin de las especies y
f)
la temperatura.
4
2. Resistencia, Conductancia y Conductividad
Consideremos la porcin disolucin comprendida entre dos electrodos planos de
una celda de conductividad, la resistencia R correspondiente vendr dada por:
l
R
A
donde es la resistividad (en ohm cm) de la disolucin, l es la distancia entre
los dos electrodos planos (en cm) y A es el rea de los electrodos (en cm2).
Se denomina constante de la celda a la cantidad
l
A
y es especfica para cada celda de conductividad
5
2. Resistencia, Conductancia y Conductividad
La magnitud recproca de la resistencia es la conductancia electroltica
(L), cuya unidad es el Siemens (S)= ohm-1 o mho
1
L
R
Combinando las dos ecuaciones se obtiene:
1 A
A
L
K
l
l
donde K es la conductividad de la disolucin (en S/cm), definida como
la inversa de la resistividad. ( =1/)
La conductividad de una disolucin K es la conductancia de la
misma encerrada en un cubo de 1 cm3 (l = 1cm, A = 1cm2).
6
2. Conductancia molar y equivalente
La conductividad mide la facilidad con que los portadores de carga, cationes y
aniones, migran bajo la accin de un campo elctrico. El valor de la conductividad
depender del nmero de iones presentes.
La conductancia molar (Am), se define como:
K
A m
C
donde K = S/cm y C es la concentracin molar (mol/L) del electrolito totalmente
ionizado.
La cantidad de corriente que pueden transportar los iones, para un tamao inico
dado, aumenta al aumentar la carga.
La conductancia equivalente (Aeq), se define como la conductancia de un
electrolito de concentracin 1 eq. para un volumen de 1 L.
La relacin entre Aeq y Am es:
Am
Aeq
z
donde z representa la carga de la especie considerada.
2. Variacin de la Conductividad con la concentracin
La conductividad K aumenta al aumentar la concentracin de los electrolitos
hasta que a partir de un determinado valor de concentracin empieza a
disminuir, debido a que las interacciones entre los iones dificultan la
conduccin de la corriente
2. Variacin de la conductancia con la concentracin
La conductancia equivalente Aeq disminuye al aumentar la concentracin,
debido a que aumenta la atraccin interinica y disminuye la fuerza de repulsin
de los iones
Kohlrausch demostr que los electrolitos fuertes (KCl, HCl, etc.) muestran una
disminucin lineal de la conductancia con la raz cuadrada de la concentracin:
Am A0 b C
donde A0 es la conductancia molar lmite o conductancia equivalente a dilucin
infinita, y b es un coeficiente que depende de la naturaleza del electrolito, del
disolvente y de la temperatura.
8
2. Ley de la migracin independiente de los iones
A dilucin infinita las atracciones entre los iones se anulan.
La A0 para cualquier electrolito, ser la suma de las contribuciones de las
conductancias inicas de cada una de las especies constituyentes.
Llamando + y a las conductancias molares de los cationes y los
aniones y z+ y z- es el nmero de oxidacin de los cationes y aniones
respectivamente, la Ley de las Migraciones Independientes de los Iones es:
A0 = z+ + + z
De acuerdo con la ley, la conductancia de una disolucin L
L = 1/ Ci 0i
donde es la constante de la celda, Ci y 0i la concentracin y la conductancia molar de
las especies inicas, respectivamente.
9
2. Conductancia a dilucin infinita
Conductancias molares a dilucin infinita
(, Scm2/mol) para distintos iones a 25 C
Catin
Anin
H+
349,8
OH -
199
Na+
50,1
Cl -
76,3
K+
73,5
NO3 -
71,4
Ca2+
119
SO4 2-
160
Las diferencias entre las
de los iones son debidas a la
diferencia en su tamao y su
grado de hidratacin
La es una medida de la movilidad de un in bajo la influencia de un campo de
fuerzas elctricas, siendo as una medida de su capacidad de transporte de
corriente. Ej. para una disolucin de HCl, debido a la mayor movilidad del H+, este
in transporta una mayor fraccin de corriente
Los datos de conductancia inica permiten comparar la conductividad relativa de
varios solutos. As el HCl 0,01 M tendr una mayor conductividad que el NaCl 0,01
M. Estas conclusiones son importantes para las valoraciones conductimtricas
10
3. Medidas de la conductancia
Cmo se mide la conductividad?
Un sistema completo para la medida de conductividad est formado por
los siguientes elementos bsicos:
- Clula de conductividad.
- Sonda de temperatura.
- Instrumento de medida:
Conductmetro
El conductmetro mide la conductividad elctrica de los iones en una
disolucin. Para ello aplica un campo elctrico entre dos electrodos de la
clula y mide la resistencia elctrica de la disolucin.
Para evitar cambios en las sustancias, efectos de capa sobre los
electrodos, etc. se aplica una corriente alterna.
11
3. Unidades para expresin de resultados
Las unidades de medida habituales de la conductividad de una
disolucin son los Siemens/cm (S/cm).
Otras formas alternativas de expresar la conductividad de una disolucin
son la Salinidad y los Slidos Totales Disueltos (STD).
Salinidad
Se refiere a la concentracin de una disolucin terica de NaCl con la
misma conductividad que la muestra en estudio. Se expresa en ppm g/L
de NaCl.
STD (Slidos Totales Disueltos)
La conductividad puede ser utilizada como un indicador de la cantidad de
materias disueltas en una disolucin. Se expresa en ppm g/L de CaCO3.
12
3. Efecto de la temperatura
La conductividad de una disolucin depende de la temperatura. sta tiene
un doble efecto sobre los electrolitos, influye en su disolucin y en la
movilidad inica.
La conductividad de una disolucin aumenta con la temperatura. Este
aumento normalmente se expresa en %/C, y se denomina Coeficiente de
Temperatura (CT).
En general las disoluciones acuosas poseen un CT cercano al 2%/C.
Las medidas de conductividad deben hacerse a temperatura controlada y
expresar los resultados indicndola.
Para poder controlar la temperatura, algunas clulas de conductividad
albergan en su interior un sensor de temperatura, en otros casos es
necesario adquirirlo separadamente.
13
3. Celdas de conductividad
- Clulas con dos electrodos: es el modelo clsico.
Se construyen con dos o tres electrodos metlicos.
Tradicionalmente se representa la clula con dos
electrodos de chapa de Pt de 1 cm2 recubiertos de
Pt finamente divido, fijos al vidrio de la misma y
separados entre s 1 cm.
Fig. 1
Fig. 2
El valor de constante ( l/A ) de la celda caracteriza a la misma. En el caso
descrito = 1 cm-1. Permite medir conductividades en un amplio intervalo.
- Clulas con cuatro o ms electrodos: El nmero, tamao, forma y material de
los electrodos vara segn las caractersticas de las muestras en las que van a
ser introducidos.
- Clulas con sensor de temperatura: Permiten la medida
simultnea de la conductividad y la temperatura para poder
corregir automticamente el efecto de la misma sobre la
conductividad de la muestra.
Fig 3
14
3. Determinacin de la constante de la clula. Calibrado del conductmetro
El valor de constante de la celda caracteriza a la misma.
Como es un factor que refleja una configuracin fsica particular de la celda, el
valor observado de la conductancia de la muestra L, debe ser multiplicado por el
valor determinado de la constante de la celda para obtener la conductividad K
de la disolucin (en S/cm).
Por ejemplo, para una lectura de conductancia de 200 S usando una celda de
constante 0,1 cm-1, el valor de conductividad ser de 200 0,1 = 20 S/cm.
Para poder determinar experimentalmente el valor de , se calibra la
celda midiendo la conductancia L de una disolucin patrn de
conductividad conocida K.
El valor de vendr dado por:
L
15
3. Determinacin de la constante de la clula. Calibrado del conductmetro
Para la calibracin se usan disoluciones de KCl en agua ultrapura
de concentracin exactamente conocida, cuyos valores de
conductividad K se encuentran tabulados
La mayoria de los conductmetros permiten la calibracin con varios
patrones de baja, media y alta conductividad
Patrn
concentracin
Conductividad(K)
KCl
0,001 M
147S/cm
KCl
0,01 M
1413 S/cm
KCl
0,1 M
12,88 mS/cm
16
3. Determinacin de la constante de la clula. Calibrado del conductmetro
Equipo para efectuar las medidas
Conductmetro
Clula
conductividad
con sensor
temperatura
Agitador
Disoluciones KCl patrn (K certificada)
17
4. Aplicaciones
Caractersticas analticas
Selectividad: Las medidas conductimtricas directas tienen poca
selectividad ya que cualquier especie cargada contribuye a la
conductividad total de la disolucin.
No se suelen utilizar para medir la concentracin de un determinado
electrolito. Su principal aplicacin es la medida de la concentracin total
de electrolitos.
Sensibilidad: la sensibilidad es alta, por ello es un importante
instrumento analtico para ciertas aplicaciones como por ejemplo
detectores en cromatografa inica.
Exactitud y precisin: Con los estndares apropiados y un buen control
de la temperatura podemos obtener una alta precisin y exactitud del
orden del 0,1 %.
18
4. Aplicaciones
- La principal aplicacin de las medidas directas es determinacin de la
concentracin total de electrolitos. Esta ltima medida es particularmente
til como un criterio de pureza para el agua destilada
Algunos de los usos de las tcnicas conductimtricas son para control de:
- Contenidos salinos en calderas
- Concentracin de iones a la salida de una columna de cromatografa lquida, es
decir como detector en cromatografa inica se utiliza un equipo conductimtrico
- Concentraciones de disoluciones cidas utilizadas en procesos industriales
- Concentraciones de fertilizante lquido a medida que el fertilizante se aplica
- Contaminacin en arroyos y ros
- Determinacin del punto final de valoraciones cido-base
19
4. Aplicaciones
Control de la pureza del agua
El agua potable suministrada por las caeras posee un contenido de
electrolitos que no es adecuado para su uso en los laboratorios.
Esta agua puede ser purificada por destilacin, intercambio inico o por
mtodos combinados de intercambiadores y membranas para smosis
inversa.
Se puede conocer el grado de purificacin alcanzado midiendo la
conductividad total del agua producida.
El agua desionizada de alta calidad, agua ultrapura tiene una
conductividad de 0,05 S/cm (25 C).
El agua natural (ej. agua potable o agua superficial) se encuentra en
el rango de 100-1000 S/cm.
20
4. Aplicaciones
Valoraciones conductimtricas
Se basan en la medida del cambio de la conductancia de una disolucin a
medida que se agrega el reactivo valorante.
Durante una valoracin, la sustitucin de algunas especies inicas por otras de
diferente conductividad equivalente, como consecuencia de la reaccin de
valoracin, producir un cambio en la conductancia, el cual puede ser
aprovechado para determinar el punto final de una valoracin.
Valoracin conductimtrica de HCl con NaOH
En las valoraciones conductimtricas,
la conductancia de la disolucin a valorar se
mide despus de la adicin de cantidades
determinadas de reactivo valorante.
Se representan los valores de
conductancia en funcin del volumen de
valorante agregado, y se obtiene dos rectas de
pendientes diferentes, cuya interseccin se
corresponde al punto final de una valoracin.
21
5. Aplicaciones en anlisis de alimentos
Las medidas de conductividad tienen muchas
aplicaciones, ya que permiten controlar las
variaciones de concentracin en cualquier
disolucin.
Algunos de los usos de las tcnicas
conductimtricas en la industria alimentaria son el
control de:
- La concentracin total inica de las disoluciones
acuosas
- La calidad del agua destilada o desionizada: la
conductancia especfica del agua pura es solo 5 x10-2
S/cm y vestigios de una impureza inica aumentara
la conductancia en un orden de magnitud o ms
22
Fig. 1
S-ar putea să vă placă și
- SINDROMEDEREALIMENTACIONDocument37 paginiSINDROMEDEREALIMENTACIONMirian Bellido CasasÎncă nu există evaluări
- Consulta - Registro - Sanitario ARROZDocument2 paginiConsulta - Registro - Sanitario ARROZMirian Bellido CasasÎncă nu există evaluări
- Pca 2018 PDFDocument15 paginiPca 2018 PDFDamaso MamaniÎncă nu există evaluări
- Consulta Registro Sanitario SANGRECITADocument1 paginăConsulta Registro Sanitario SANGRECITAMirian Bellido CasasÎncă nu există evaluări
- Consulta - Registro - Sanitario Hojuela de Quinua y AvenaDocument2 paginiConsulta - Registro - Sanitario Hojuela de Quinua y AvenaMirian Bellido CasasÎncă nu există evaluări
- Cons. No AdeudarDocument1 paginăCons. No AdeudarWendyPastorGallardoÎncă nu există evaluări
- Boletin AnemiaDocument8 paginiBoletin AnemiaPedro D. Millán BarrientosÎncă nu există evaluări
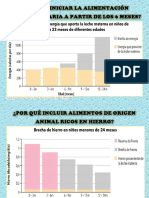
- Porque Iniciar AntesDocument2 paginiPorque Iniciar AntesMirian Bellido CasasÎncă nu există evaluări
- Recetario Sangrecita DHIERRODocument25 paginiRecetario Sangrecita DHIERROMirian Bellido CasasÎncă nu există evaluări
- Modelo de Solicitud de InformacionDocument1 paginăModelo de Solicitud de InformacionMirian Bellido CasasÎncă nu există evaluări
- Consulta - Registro - Sanitario SEMOLADocument1 paginăConsulta - Registro - Sanitario SEMOLAMirian Bellido CasasÎncă nu există evaluări
- Bases Enero CuzcDocument11 paginiBases Enero CuzcMirian Bellido CasasÎncă nu există evaluări
- DJ de No Haber Realizado SerumsDocument1 paginăDJ de No Haber Realizado SerumsMirian Bellido CasasÎncă nu există evaluări
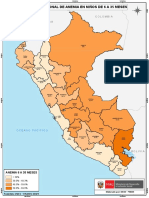
- Desnutricion Cronica Peru 19Document1 paginăDesnutricion Cronica Peru 19Mirian Bellido CasasÎncă nu există evaluări
- Registro - Sanitario AZUCAR RUBIADocument1 paginăRegistro - Sanitario AZUCAR RUBIAMirian Bellido CasasÎncă nu există evaluări
- Anemia Peru 19Document1 paginăAnemia Peru 19Mirian Bellido CasasÎncă nu există evaluări
- Desequilibrio en RedoxDocument39 paginiDesequilibrio en RedoxMirian Bellido CasasÎncă nu există evaluări
- RM 112 2017midisDocument47 paginiRM 112 2017midisJaime Eduardo Muñoz HuamanchumoÎncă nu există evaluări
- Consulta - Autorizacion - Sanitaria - de - Establecimiento FRIJOL CABALLERODocument3 paginiConsulta - Autorizacion - Sanitaria - de - Establecimiento FRIJOL CABALLEROMirian Bellido CasasÎncă nu există evaluări
- Parasitosis Intestinal Capacita en P.Document78 paginiParasitosis Intestinal Capacita en P.Mirian Bellido CasasÎncă nu există evaluări
- R.M #774-2012-Minsa. Modificatoria de La Norma Sanitaria para La Fab. de Alimentos A Base de Granos y Otros Dest. A Psa PDFDocument5 paginiR.M #774-2012-Minsa. Modificatoria de La Norma Sanitaria para La Fab. de Alimentos A Base de Granos y Otros Dest. A Psa PDFMiguel Merino QuispeÎncă nu există evaluări
- Consulta Registro Sanitario FIDEOSDocument1 paginăConsulta Registro Sanitario FIDEOSMirian Bellido CasasÎncă nu există evaluări
- Calculo de La Racion PVLDocument32 paginiCalculo de La Racion PVLRober Hernan Solis Cornejo100% (3)
- Registro - Sanitario ACEITE VEGETAL COMESTIBLEDocument1 paginăRegistro - Sanitario ACEITE VEGETAL COMESTIBLEMirian Bellido CasasÎncă nu există evaluări
- Registro - Sanitario HIGADO DE POLLODocument1 paginăRegistro - Sanitario HIGADO DE POLLOMirian Bellido CasasÎncă nu există evaluări
- Consulta Registro Sanitario FIDEOSDocument1 paginăConsulta Registro Sanitario FIDEOSMirian Bellido CasasÎncă nu există evaluări
- Registro - Sanitario LECHE EVAPORADA X170GDocument1 paginăRegistro - Sanitario LECHE EVAPORADA X170GMirian Bellido CasasÎncă nu există evaluări
- Registro - Sanitario HOJUELA DE QUINUA Y AVENADocument2 paginiRegistro - Sanitario HOJUELA DE QUINUA Y AVENAMirian Bellido CasasÎncă nu există evaluări
- Registro - Sanitario SANGRECITADocument1 paginăRegistro - Sanitario SANGRECITAMirian Bellido CasasÎncă nu există evaluări
- Historia de La FotogrametríaDocument2 paginiHistoria de La FotogrametríaUriel Charaja TorresÎncă nu există evaluări
- Jci Informe OctubreDocument11 paginiJci Informe OctubreGabriel SantanaÎncă nu există evaluări
- La AsertividadDocument1 paginăLa AsertividadDavid Coronado IbarraÎncă nu există evaluări
- 2 Sesion Apx PrimeroDocument3 pagini2 Sesion Apx PrimeroMeche MoralesÎncă nu există evaluări
- REACCIONES QUIMICAS - U9 Clases 25,26 y 27Document44 paginiREACCIONES QUIMICAS - U9 Clases 25,26 y 27Steven OsorioÎncă nu există evaluări
- Proyecto-Final 3.Document4 paginiProyecto-Final 3.Juan Sebastian Botero LezamaÎncă nu există evaluări
- Importancia de La AdministraciónDocument2 paginiImportancia de La AdministraciónAndrés Delgado100% (1)
- Eje 1 Geopolitica - Jose ContrerasDocument8 paginiEje 1 Geopolitica - Jose ContrerasJcontreras JcontrerasÎncă nu există evaluări
- Actividad 1 - La Teoría Del Aprendizaje SocialDocument2 paginiActividad 1 - La Teoría Del Aprendizaje Socialdoris quinayasÎncă nu există evaluări
- Inverosimil PDFDocument29 paginiInverosimil PDFLiliss LuMaÎncă nu există evaluări
- Historia de ChinaDocument42 paginiHistoria de ChinaRebeca De La Quintana RiosÎncă nu există evaluări
- AntibioticosDocument3 paginiAntibioticosVictor VargasÎncă nu există evaluări
- Curio: CaracterísticasDocument2 paginiCurio: CaracterísticasRicardo Lopez100% (1)
- Cap 2. HidrodinámicaDocument23 paginiCap 2. HidrodinámicaPepe EspañaÎncă nu există evaluări
- Matemáticas 1 - S00327 - Edit Pearson - Eduardo Mancera MartínezDocument257 paginiMatemáticas 1 - S00327 - Edit Pearson - Eduardo Mancera MartínezEmilio Perez Jimenez93% (15)
- Grado 9Document42 paginiGrado 9Deivi VelÎncă nu există evaluări
- QUE ES EL Copasst-Vigia-SstDocument42 paginiQUE ES EL Copasst-Vigia-SstPolo Parrasi AndreaÎncă nu există evaluări
- Competencias en La Formacion y Competencias en La Gestion Del Talento Humano Convergencias y DesafiosDocument4 paginiCompetencias en La Formacion y Competencias en La Gestion Del Talento Humano Convergencias y DesafioscarÎncă nu există evaluări
- Investigación Social Lenguajes Del Diseño M CanalesDocument139 paginiInvestigación Social Lenguajes Del Diseño M CanalesNick JamesÎncă nu există evaluări
- TEMA 2 Filosofia Ciencia UNEDDocument9 paginiTEMA 2 Filosofia Ciencia UNEDAlfÎncă nu există evaluări
- Examen Cuarto QuintonDocument4 paginiExamen Cuarto QuintonKeylaÎncă nu există evaluări
- Civ217 U4l8 P, E, y Abs. Agregado GruesoDocument4 paginiCiv217 U4l8 P, E, y Abs. Agregado Gruesogermanoe101Încă nu există evaluări
- Colaboracion Leccion 7Document4 paginiColaboracion Leccion 7DIEGO SALASÎncă nu există evaluări
- Ge 11 FisicaDocument5 paginiGe 11 FisicaRafita Mariño HernandezÎncă nu există evaluări
- Ejercicio de ConocimientoDocument1 paginăEjercicio de ConocimientoOSCAR BENAVENTEÎncă nu există evaluări
- Evaluación Bimestral - Segundo Periodo - Séptimo - Tipo 1Document4 paginiEvaluación Bimestral - Segundo Periodo - Séptimo - Tipo 1Andrés AparicioÎncă nu există evaluări
- Ensayo Inversiones-Juan Mario PeñaDocument3 paginiEnsayo Inversiones-Juan Mario PeñaJuan Mario PeñaÎncă nu există evaluări
- 8vo-1-Plan Microcurricular 2023-2024 - Eplc 1eroDocument18 pagini8vo-1-Plan Microcurricular 2023-2024 - Eplc 1erojdelpezo11Încă nu există evaluări
- El Juicio Del MonoDocument2 paginiEl Juicio Del MonoAlicia Racchi100% (1)
- 1LIBROEMPRESAZAPATAYHERNANDEZ2017 3edDEFINITIVO28012017Document342 pagini1LIBROEMPRESAZAPATAYHERNANDEZ2017 3edDEFINITIVO28012017Doralislimkk SantosÎncă nu există evaluări
- Guias Básica de Álgebra Lineal 2Document80 paginiGuias Básica de Álgebra Lineal 2Michelle OrellanaÎncă nu există evaluări