Documente Academic
Documente Profesional
Documente Cultură
Aplicación Propiedades Químicas de Materiales Metálicos: Resumen
Încărcat de
Alvaro Jesus GarciaTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Aplicación Propiedades Químicas de Materiales Metálicos: Resumen
Încărcat de
Alvaro Jesus GarciaDrepturi de autor:
Formate disponibile
1
APLICACIN PROPIEDADES QUMICAS DE MATERIALES
METLICOS
Sebastian Castro, Alvaro Garcia, Sebastian Rodriguez
smauriciocp@hotmail.com, alvarojesusgarciamurillo@yahoo.es , sebasro9288@hotmail.com
Universidad Manuela Beltrn
Resumen Esta prctica de laboratorio, se pretendi
mostrar las propiedades qumicas que poseen los metales
como fue el caso del aluminio y el cobre. Se hizo una
reaccin qumica que
produjo
energa
elctrica
manifestada en el prender de LEDs. Todo este manifiesto
logrado se hizo gracias al trabajo que realiza la
electroqumica en los metales
Por lo tanto esta prctica hace que los metales
manifiesten todo su potencial que producen una
corriente elctrica y consecuente generacin de
electricidad mediante reacciones qumicas.
II.
PROCEDIMIENTO
ndice de Trminos propiedades qumicas de
los metales, reaccin qumica, energa elctrica.
I.
INTRODUCCIN
Los materiales metlicos poseen aplicaciones de
gran importancia en la sociedad. Lo anterior se debe
a sus diferentes componentes caractersticos por el
cual se puede realizar un buen trabajo con ellos.
En el caso pertinente de la prctica, se encuentra
que los metales hay propiedades caractersticas
como lo es ser buenos conductores de calor y
electricidad. Esto hace que sea interesante la
manipulacin de los metales; ya que con esto, se da
paso al estudio de energas alternas.
Entonces gracias a la manipulacin de los metales y
su reacciona a compuestos, se crea un dispositivo
electroqumico el cual almacena energa en forma
qumica. De lo anterior al conectarse a un circuito
elctrico est energa qumica almacenada se
transforma en energa elctrica, debido al flujo de
electrones de las placas de Aluminio y cobre que
son los electrodos positivo y negativo
respectivamente; y los cuales, sern transportados a
un circuito externo que en este caso son bombillos
LEDs.
*Aplica para el procedimiento NaOH.
Reactivo
Sin
reactivo
NaHCO3
(1g)
NaOH
(0.3g)
NaOH
(0.6g)
NaOH
(0.9g)
III.
RESULTADOS
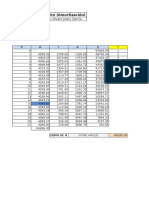
Resistencia
Voltaje
(ohmios)
(V)
950
1.24
1.2k
1.27
500
3.27
881
3.54
883
3.39
Se realiz el montaje correspondiente para generar
un circuito donde tanto el aluminio como el cobre
actuaban como electrodos el primero como negativo
y el segundo como positivo, en el cual al realizar la
medicin de su resistencia y voltaje sin ningn
reactivo para los metales se observa que posee una
resistencia y voltaje generado por la carga presente
en cada material metlico y la humedad relativa del
lugar donde se realiza el experimento.
Tabla 1. Medicin de voltaje y resistencia
Figura 3. Encendido de dos leds
Figura 1. Medicin del voltaje del circuito
Figura 2. Grafica de resistencia vs voltaje obtenidos
Luego se procedi al agregarle una solucin salina
al circuito que se disolviera en el agua como lo es el
bicarbonato de sodio, al esperar que este se
disolviera se observ al medir que su resistencia
aumento de forma considerable mientras que su
voltaje apenas tuvo un leve incremento, teniendo en
cuenta que la resistencia en el circuito se da por el
tipo de superficie del material la separacin entre
las placas de aluminio y cobre adems del ambiente
donde se realiza el experimento en este paso no se
observ que el LED lograra encender.
El siguiente paso fue agregarle hidrxido de sodio a
los vasos con agua y donde se esper ms o menos
un minuto a que los valores que mostraba el
multmetro se estabilizaran se observ un descenso
de casi la mitad de la resistencia original del
circuito y aumento de casi tres veces el voltaje
original ac se observ que al conectar Los LEDS
no solo encendi uno si no que alcanzo a encender
dos con gran luminosidad mientras que el tercero
se vea con baja luminosidad.
Fugura 3. Encendido de 3 leds.
Al agregarle nuevamente otros 0.3 gramos de
NaOH se observ que descendi su resistencia pero
su voltaje aumento un poco, al conectar los LEDS
se observ que solo encendan dos LEDS y el
tercero ya no mostraba ningn iluminacin propia.
Por ltimo se agreg otros 0.3 gr de NaOH
obteniendo en cada vaso una concentracin
aproximada de 0.9gr, al medir su resistencia se
mantuvo casi invariable al igual que su voltaje al
igual que antes solo se lograron encender dos
LEDS.
Figura 4. Encedido de 2 leds con 0.9 gr de NaOH.
Reactivo
Intensidad (mA)
1.305
Sin reactivo
1.058
NaHCO3 (1g)
NaOH (0.3g)
6.54
NaOH (0.6g)
4.018
NaOH (0.9g)
3.839
Tabla 2. Intensidad calculada
Figura 5. Grafica de la intensidad mostrada en el
circuito.
Se realiza una tabla acerca de la intensidad ya que
para poder encender los leds no es dependiente
totalmente del voltaje del circuito si no de la
intensidad que este produce y est dada por I=V/R
lo que realmente da la capacidad de que el led
encienda es la cantidad de corriente que circula por
el circuito. Esto depende directamente de la
reacciones producida al agregar los reactivos en la
cuales se da una oxidacin en el aluminio cediendo
electrones a la disolucin en forma de iones
positivos, mientras que los iones positivos del cobre
tiene una reaccin de reduccin ganan electrones lo
que genera el real funcionamiento de circuito como
una pila.
Como se observ solo se logr encender dos leds de
forma bastante visible u un tercero con poca
luminosidad en el momento en el cual se obtuvo
una mayor intensidad (6.54 mA) correspondiente al
agregar la primera cantidad de NaOH, aunque se
agreg ms de este reactivo no se logr encender
los tres leds de forma igual, esto se pudo deber a la
corrosin de los metales debido al uso de la sal y el
cido lo que depende de la cantidad agregada y del
pH de la disolucin entre ms salina o acida menor
ser su funcionamiento.
IV.
CONCLUSIONES
Los metales en este caso el cobre y el aluminio que
se encontraban en sus respectivos vasos, se les
adiciono bicarbonato de sodio (1g) que fue el la
primera adicin esto mostro con la medida del
multmetro que su voltaje aumentaba un poco pero
de igual forma no lograba encender el primer led,
luego se procedi a adicionar hidrxido de sodio lo
cual genero un aumento a 1.27V luego este aumento
fue poco significativo ya que las muestras que se
tomaron de hidrxido de sodio fueron pequeas, en
corrosin los metales actan como nodo, mientras
que el medio electroltico acta como ctodo. Esta
situacin genera el proceso electroqumico de
corrosin, de esta forma se genera un ambiente
acido en los metales.
En el intercambio de iones metlicos genera una
diferencia de potencial que hace que los iones
metlicos sean depositados en el electrolito, a partir
de esto en el aumento de las adiciones de hidrxido
de sodio se genera un aumento del voltaje llegando
a los 5.54V generando de esta forma que encienda 3
leds, como mximo despus de esto empieza a
descender.
REFERENCIAS BIBLIOGRFICAS
[1] J. U. Duncombe, Infrared navigationPart I: An
assessment of feasibility (Periodical style), IEEE Trans.
Electron Devices, vol. ED-11, pp. 3439, Jan. 1959.
[2]
S. Chen, B. Mulgrew, and P. M. Grant, A clustering
technique
for
digital
communications
channel
equalization using radial basis function networks, IEEE
Trans. Neural Networks, vol. 4, pp. 570578, July 1993.
[3] R. W. Lucky, Automatic equalization for digital
communication, Bell Syst. Tech. J., vol. 44, no. 4, pp.
547588, Apr. 1965.
[4] E. H. Miller, A note on reflector arrays (Periodical style
Accepted for publication), IEEE Trans. Antennas
Propagat., to be published.
[5] S. P. Bingulac, On the compatibility of adaptive
controllers (Published Conference Proceedings style), in
Proc. 4th Annu. Allerton Conf. Circuits and Systems
Theory, New York, 1994, pp. 816.
S-ar putea să vă placă și
- FiltroDocument1 paginăFiltroAlvaro Jesus GarciaÎncă nu există evaluări
- Matemáticas Financieras García HilarionDocument4 paginiMatemáticas Financieras García HilarionAlvaro Jesus GarciaÎncă nu există evaluări
- La Vida Atada A Una MáuinaDocument4 paginiLa Vida Atada A Una MáuinaAlvaro Jesus GarciaÎncă nu există evaluări
- Maquina de HemodialisisDocument15 paginiMaquina de HemodialisisAlvaro Jesus GarciaÎncă nu există evaluări
- RMS 1Document6 paginiRMS 1Alvaro Jesus GarciaÎncă nu există evaluări
- WESCODYNEDocument3 paginiWESCODYNEAlvaro Jesus GarciaÎncă nu există evaluări
- TUTORIAL Teclado MatricialDocument8 paginiTUTORIAL Teclado MatricialAlvaro Jesus GarciaÎncă nu există evaluări
- SEGMENTODocument2 paginiSEGMENTOAlvaro Jesus GarciaÎncă nu există evaluări
- Electronica 1Document4 paginiElectronica 1Alvaro Jesus GarciaÎncă nu există evaluări
- GalgasDocument17 paginiGalgasCaroÎncă nu există evaluări
- JJJDocument2 paginiJJJAlvaro Jesus GarciaÎncă nu există evaluări
- Bioc1Document27 paginiBioc1Alvaro Jesus GarciaÎncă nu există evaluări
- Mapa ConceptualDocument1 paginăMapa ConceptualAlvaro Jesus GarciaÎncă nu există evaluări
- Cambia Tus Habitos de Tu VidaDocument2 paginiCambia Tus Habitos de Tu VidaAlvaro Jesus GarciaÎncă nu există evaluări
- Máquina de Dureza BrinellDocument2 paginiMáquina de Dureza BrinellAlvaro Jesus GarciaÎncă nu există evaluări
- TareaDocument1 paginăTareaAlvaro Jesus GarciaÎncă nu există evaluări
- Maletas y TaconesDocument11 paginiMaletas y TaconesAlvaro Jesus GarciaÎncă nu există evaluări
- Electromedicina DaneriDocument105 paginiElectromedicina DanerisotaquitoÎncă nu există evaluări
- Osciloscopio PreinformeDocument4 paginiOsciloscopio PreinformeAlvaro Jesus GarciaÎncă nu există evaluări
- Ensayo de DurezasDocument42 paginiEnsayo de DurezasNicolas TorresÎncă nu există evaluări
- Anexo 3Document12 paginiAnexo 3Alvaro Jesus GarciaÎncă nu există evaluări
- La HojsrascaDocument2 paginiLa HojsrascaAlvaro Jesus GarciaÎncă nu există evaluări
- Nuestra Mente: EditorialDocument1 paginăNuestra Mente: EditorialAlvaro Jesus GarciaÎncă nu există evaluări
- IntegralDocument4 paginiIntegralAlvaro Jesus GarciaÎncă nu există evaluări
- Ultima de CiruitosDocument16 paginiUltima de CiruitosAlvaro Jesus GarciaÎncă nu există evaluări
- Lab MarchaDocument4 paginiLab MarchaAlvaro Jesus GarciaÎncă nu există evaluări
- La Diabetes y La Importancia de UnaDocument1 paginăLa Diabetes y La Importancia de UnaAlvaro Jesus GarciaÎncă nu există evaluări
- VectorialDocument6 paginiVectorialAlvaro Jesus GarciaÎncă nu există evaluări
- UntitledDocument3 paginiUntitledBENJA .C.MÎncă nu există evaluări
- ABANDONO Y DEJACIÓN TOTAL DE PTAR LEMAYA en GUAMODocument2 paginiABANDONO Y DEJACIÓN TOTAL DE PTAR LEMAYA en GUAMOJhon PaezÎncă nu există evaluări
- Cuentos SufiDocument4 paginiCuentos SufiAnahi ZabalaÎncă nu există evaluări
- Miguel HernandezDocument20 paginiMiguel HernandezLUISAÎncă nu există evaluări
- 2 Mapa EstratégicoDocument8 pagini2 Mapa EstratégicoJessy MayorgaÎncă nu există evaluări
- Articulo Tecnia Igi-Jimmy Mallqui EspinozaDocument9 paginiArticulo Tecnia Igi-Jimmy Mallqui EspinozajimmyÎncă nu există evaluări
- Dioses de Cada MitologiaDocument23 paginiDioses de Cada MitologiaCheroBam SvÎncă nu există evaluări
- Días Internacionales y Mundiales de OctubreDocument14 paginiDías Internacionales y Mundiales de OctubreDorella Valdivia Pons100% (1)
- Guia Estudiantes Semana 1 2p Entrenate en Casa Martha GuerreroDocument9 paginiGuia Estudiantes Semana 1 2p Entrenate en Casa Martha GuerreroJULYÎncă nu există evaluări
- Cuatro Signos de Alarma Del LinfedemaDocument3 paginiCuatro Signos de Alarma Del LinfedemaHospital Ntra. Sra. del RosarioÎncă nu există evaluări
- Clase 2Document15 paginiClase 2profjnapoles100% (1)
- Shakespeare, William - Macbeth PDFDocument64 paginiShakespeare, William - Macbeth PDFMartin Mansilla100% (2)
- Taller N°1Document6 paginiTaller N°1andrea gonzález0% (2)
- Normas API y ASME Aplicables A Equipos RotativosDocument1 paginăNormas API y ASME Aplicables A Equipos RotativosDaniel Puello Rodelo100% (3)
- VibraniumDocument3 paginiVibraniumCamila Andrea UrquizaÎncă nu există evaluări
- Palangre de PescaDocument10 paginiPalangre de PescaMaribi Cruz OrtegaÎncă nu există evaluări
- Dietas HospitalariasDocument7 paginiDietas HospitalariasAnonymous wkodFa6nIÎncă nu există evaluări
- 2015 Selyanin, Boykov, Khabarov Ácido Hialurónico PreparaciónDocument176 pagini2015 Selyanin, Boykov, Khabarov Ácido Hialurónico PreparaciónLeonardo GilÎncă nu există evaluări
- Aguas ResidualesDocument2 paginiAguas ResidualesDavid MartínezÎncă nu există evaluări
- EscargotsDocument11 paginiEscargotsElizabeth Quispe HumpiriÎncă nu există evaluări
- Si U2aa2 Ea5 MatrizDocument8 paginiSi U2aa2 Ea5 Matrizedgar perezÎncă nu există evaluări
- Andersen, Hans Christian - Una Hoja Del CieloDocument2 paginiAndersen, Hans Christian - Una Hoja Del CielowaltariÎncă nu există evaluări
- Precios VerdurasDocument10 paginiPrecios Verduras1029384756zzÎncă nu există evaluări
- Manual de Como Hacer Aspersores de Riego de Bajo CostoDocument2 paginiManual de Como Hacer Aspersores de Riego de Bajo CostoMarcela ChamOrroÎncă nu există evaluări
- El Tiempo de Aníbal QuijanoDocument3 paginiEl Tiempo de Aníbal QuijanoAlonso Marañon Tovar100% (1)
- Tipos y Causas de Errores de MedicaciónDocument29 paginiTipos y Causas de Errores de MedicaciónQF Felipe González0% (1)
- PDF 2dogrado ComputacionDocument98 paginiPDF 2dogrado ComputacionHilder Lozada VasquezÎncă nu există evaluări
- Refuerzo - Recuperación - Horario de Clases 2021 - 2022Document7 paginiRefuerzo - Recuperación - Horario de Clases 2021 - 2022Kléber Daniel Perez BustosÎncă nu există evaluări
- La Constitucion Como Regulacion Del Poder PoliticoDocument26 paginiLa Constitucion Como Regulacion Del Poder PoliticorocioÎncă nu există evaluări
- GRUPO 4 Importancia y Evaluación de Un Plan de Transferencia de Tecnología de Puno (Conclusion)Document13 paginiGRUPO 4 Importancia y Evaluación de Un Plan de Transferencia de Tecnología de Puno (Conclusion)Maicol CahuanaÎncă nu există evaluări