Documente Academic
Documente Profesional
Documente Cultură
Antecedentes p.4 Destilacion Simple y Fraccionada
Încărcat de
Abril SosaTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Antecedentes p.4 Destilacion Simple y Fraccionada
Încărcat de
Abril SosaDrepturi de autor:
Formate disponibile
Fecha de entrega: 24 de Febrero de 2015
Nombre de los integrantes:
Luna Mayo Carlos Alfonso
CLAVE 6
Morales Sosa Abril Hildelid
CLAVE 8
PRCTICA No. 4DESTILACIN SIMPLE Y FRACCIONADA
Antecedentes
1. Caractersticas y diferencias de la destilacin simple y fraccionada
Destilacin simple: S un lquido contiene una impureza voltil, la
separacin de ambos se realiza generalmente por destilacin. Cualquier par
de sustancias que no tenga presiones de vapor idnticas se puede separar
por destilacin.
Como regla general, se puede indicar que una mezcla de dos componentes
con una diferencia de por lo menos 80C puede separarse por una
destilacin simple.
Destilacin fraccionada: La destilacin fraccionada se emplea para para
separar y purificar mezclas de sustancias de punto de ebullicin cercano.
Actualmente se dispone de equipos de destilacin fraccionada muy
eficaces para lograrlo.
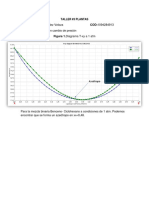
2. Diagramas de composicin lquido-vapor
El diagrama relaciona la composicin del lquido en ebullicin con su vapor
como una funcin de temperatura.
El diagrama de fase para una destilacin fraccionada de un sistema ideal de
dos componentes (A y B), se utiliza para explicar el funcionamiento de una
columna de fraccionamiento. El diagrama relaciona la composicin del lquido
en ebullicin con su vapor como una funcin de la temperatura. La relacin
entre la presin y la temperatura de ebullicin de un lquido est determinada
por su comportamiento presin de vapor-temperatura. Cuando dos o ms
sustancias lquidas se encuentran formando mezclas en proporcin
relativamente parecida, se dice que la destilacin pude usarse para la
separacin de componentes.
3. Cmo funciona una columna de destilacin fraccionada?
Una columna de fraccionamiento, tambin llamada columna de platos o
columna de platillos, es un aparato que permite realizar una destilacin
fraccionada
Al emplear una columna de fraccionamiento que proporciona una gran
superficie para el intercambio de calor, en las condiciones de equilibrio, entre
el vapor ascendente y el condensado descendente. Al trazar una grfica de los
puntos de ebullicin ante volumen de condensado, se observa una buena
separacin donde hay definicin de las fracciones separadas.
4. Concepto de plato terico y nmero de platos tericos
Un plato terico se define como la unidad de la columna que tiene eficacia en
la separacin de compuestos por medio de una destilacin simple y se expresa
a menudo en centmetros de altura de la columna. Un plato terico en muchos
procesos de separacin es una zona hipottica o etapa en la que dos fases,
tales como las fases de lquido y vapor de una sustancia, establecer un
equilibrio entre s.
El nmero de etapas o de platos necesarios para una determinada separacin
se puede calcular tericamente, ya que no es ms que la combinacin de una
serie de destilaciones simples. En la prctica, el nmero de platos reales
necesarios es siempre superior al de platos tericos calculados. De la misma
manera, en funcin del resultado buscado se disean el dimetro de la
columna, el tipo de relleno o de platos, etc.
5. Mezclas azeotrpicas
Un azetropo (o mezcla azeotrpica) es una mezcla lquida de dos o ms
compuestos qumicos que hierven a temperatura constante y que se
comportan como si estuviesen formadas por un solo componente.
Un azetropo, puede hervir a una temperatura superior, intermedia o inferior a
la de los constituyentes de la mezcla, permaneciendo el lquido con la misma
composicin inicial, al igual que el vapor, por lo que no es posible separarlos
por destilacin simple o por extraccin lquido-vapor utilizando lquidos inicos
como el cloruro de 1-butil-3-metilimidazolio.
El azetropo que hierve a una temperatura mxima se llama azetropo de
ebullicin mxima y el que lo hace a una temperatura mnima se llama
azetropo de ebullicin mnima, los sistemas azeotrpicos de ebullicin
mnima son ms frecuentes que los de ebullicin mxima.
Cada azetropo tiene una temperatura de ebullicin caracterstica, el cual
puede ser menor o mayor que las temperaturas de ebullicin de cualquiera de
sus componentes. Los azetropos constituidos por 2 componentes son
llamados azetropos binarios, por tres azetropos ternarios, etc.
6. Ley de Raoult
Esta ley establece que la relacin entre la presin de vapor de cada
componente en una solucin ideal es dependiente de la presin de vapor de
cada componente individual y de la fraccin molar de cada componente en la
solucin. La ley fue enunciada en 1882 por el qumico francs Francois Marie
Raoult (1830-1901). La ley dice:
Si un soluto tiene una presin de vapor medible, la presin de vapor de su
disolucin siempre es menor que la del disolvente puro.
La ley de Raoult (para soluciones ideales) establece que: la presin de Vapor
de un componente de una mezcla es proporcional a la concentracin de dicho
componente y a la presin de vapor del componente puro.
Dnde: Pi=Presin de vapor del componente i.
Pio= Presin de vapor del componente i puro.
Xi= Fraccin molar del componente i
FUENTES DE CONSULTA
Qumica Orgnica Experimentos con Enfoque Ecolgico Gustavo vila
Zrraga 2 edicin E.d Universidad Nacional Autnoma de Mxico.
Qumica la Ciencia Central Theodore L. Brown 7 edicin E.d Pearson
http://docsetools.com/articulos-enciclopedicos/article_86554.html
http://es.wikipedia.org/wiki/Aze%C3%B3tropo
http://es.wikipedia.org/wiki/Ley_de_Raoult
http://www.uv.es/qflab/2009_10/descargas/cuadernillos/qf1_innovacion/c
astellano/7-diagrama_fases.pdf
S-ar putea să vă placă și
- Calidad de GranosDocument9 paginiCalidad de GranosAbril SosaÎncă nu există evaluări
- Análisis de molienda y tamizado de cerealesDocument19 paginiAnálisis de molienda y tamizado de cerealesAbril SosaÎncă nu există evaluări
- Calidad de materia prima hortalizas y frutasDocument3 paginiCalidad de materia prima hortalizas y frutasAbril SosaÎncă nu există evaluări
- P2 Clasificación de AtributosDocument15 paginiP2 Clasificación de AtributosAbril SosaÎncă nu există evaluări
- 2006 01 23 Mat SaludDocument20 pagini2006 01 23 Mat SaludAbril SosaÎncă nu există evaluări
- Tec FermDocument1 paginăTec FermAbril SosaÎncă nu există evaluări
- Seguridad AgroalimentariaDocument2 paginiSeguridad AgroalimentariaAbril SosaÎncă nu există evaluări
- ¿Qué Son Los Suplementos Alimenticios? Contexto GeneralDocument3 pagini¿Qué Son Los Suplementos Alimenticios? Contexto GeneralAbril SosaÎncă nu există evaluări
- EtiquetaDocument1 paginăEtiquetaAbril SosaÎncă nu există evaluări
- Practica No 2 Calor de Combustion de Acido BenzoicoDocument4 paginiPractica No 2 Calor de Combustion de Acido BenzoicoAbril SosaÎncă nu există evaluări
- Práctica 8 Inocuidad AlimentariaDocument6 paginiPráctica 8 Inocuidad AlimentariaEdgar Pérez AparicioÎncă nu există evaluări
- Det. de SalmonellaDocument8 paginiDet. de SalmonellaAbril SosaÎncă nu există evaluări
- Practica 1 EspectrosDocument5 paginiPractica 1 EspectrosAbril SosaÎncă nu există evaluări
- Teorias de La Motivacion (Completa)Document33 paginiTeorias de La Motivacion (Completa)Abril SosaÎncă nu există evaluări
- Teorías motivaciónDocument33 paginiTeorías motivaciónAbril Sosa67% (3)
- Control de Lectura 1Document7 paginiControl de Lectura 1Abril SosaÎncă nu există evaluări
- Cuestionario p2Document2 paginiCuestionario p2Abril SosaÎncă nu există evaluări
- Graficas P de Ebull y Fus Vs Num de CarbonosDocument2 paginiGraficas P de Ebull y Fus Vs Num de CarbonosAbril SosaÎncă nu există evaluări
- Guía de Almacenamiento PDFDocument9 paginiGuía de Almacenamiento PDFFelix Jose CahuaoÎncă nu există evaluări
- Antecedentes p.4 Destilacion Simple y FraccionadaDocument4 paginiAntecedentes p.4 Destilacion Simple y FraccionadaAbril SosaÎncă nu există evaluări
- AE1 Practica 2Document3 paginiAE1 Practica 2Abril SosaÎncă nu există evaluări
- FotosintesisDocument11 paginiFotosintesisAbril SosaÎncă nu există evaluări
- Practica 6 Analitica AntecedentesDocument2 paginiPractica 6 Analitica AntecedentesAbril SosaÎncă nu există evaluări
- Ec Nte 1375 2000Document11 paginiEc Nte 1375 2000calidadagrointeramsacomÎncă nu există evaluări
- Control de Lectura 4 Factores de La ProducciónDocument3 paginiControl de Lectura 4 Factores de La ProducciónAbril SosaÎncă nu există evaluări
- Antecedentes 6Document4 paginiAntecedentes 6Abril SosaÎncă nu există evaluări
- Antecedentes p.5 Punto de Ebullicion: Destilacion Simple y A Presion ReducidaDocument4 paginiAntecedentes p.5 Punto de Ebullicion: Destilacion Simple y A Presion ReducidaAbril Sosa33% (3)
- Protocolo Preliminar ProyectoDocument4 paginiProtocolo Preliminar ProyectoAbril SosaÎncă nu există evaluări
- Control de Lectura 2 Definiciones EconomíaDocument7 paginiControl de Lectura 2 Definiciones EconomíaAbril SosaÎncă nu există evaluări
- Destilador de AguaDocument6 paginiDestilador de AguaDavid Eduardo Balseca JaramilloÎncă nu există evaluări
- Destilacion Torre Empacada EveDocument7 paginiDestilacion Torre Empacada EveVladimirCoelloÎncă nu există evaluări
- Teoría de Exposición Maquinaría y EquiposDocument40 paginiTeoría de Exposición Maquinaría y EquiposjeffersonÎncă nu există evaluări
- Práctica 2Document20 paginiPráctica 2Adry GÎncă nu există evaluări
- AzeotroposDocument5 paginiAzeotroposIrene CuevasÎncă nu există evaluări
- Guia. Determinacion Del Porcentaje de EtanolDocument10 paginiGuia. Determinacion Del Porcentaje de Etanolodey maroufÎncă nu există evaluări
- LABORATORIO1 QMC013 - Montaje y Operaciones Basicas FrecuentesDocument4 paginiLABORATORIO1 QMC013 - Montaje y Operaciones Basicas FrecuentesScarleth AguileraÎncă nu există evaluări
- Proceso de OstwaldDocument4 paginiProceso de OstwaldSinai ArguelloÎncă nu există evaluări
- Semana 3 Mezclas LV No IdealesDocument38 paginiSemana 3 Mezclas LV No IdealesLUIS FERNANDO VASQUEZ SANCHEZÎncă nu există evaluări
- Ejercicios de Balance de Mat IiDocument11 paginiEjercicios de Balance de Mat IiGRISELÎncă nu există evaluări
- Informe de Laboratorio Procesos 4Document21 paginiInforme de Laboratorio Procesos 4Guillermo BaqueroÎncă nu există evaluări
- Destilacion-Etanol Anhidro PDFDocument93 paginiDestilacion-Etanol Anhidro PDFManuel Jimenez EÎncă nu există evaluări
- Dest Extracti - Cam PresionDocument8 paginiDest Extracti - Cam PresionMaria Del Mar MedinaÎncă nu există evaluări
- Ethanol-Water Binary System Vapor-Liquid Equilibrium ExperimentDocument8 paginiEthanol-Water Binary System Vapor-Liquid Equilibrium ExperimentANGIE NATALIA LOPEZ RUIZÎncă nu există evaluări
- Alcoholes y FenolesDocument53 paginiAlcoholes y FenolesValeria CardozaÎncă nu există evaluări
- Diagram de BloquesDocument14 paginiDiagram de BloquesYuLio SolerÎncă nu există evaluări
- Destilación A Presión ReducidaDocument7 paginiDestilación A Presión ReducidaJorge Felibert0% (2)
- Características de Soluciones Ideales y No IdealesDocument5 paginiCaracterísticas de Soluciones Ideales y No IdealescarolinaÎncă nu există evaluări
- Informe DestilaciónDocument18 paginiInforme DestilaciónWilliams LucanoÎncă nu există evaluări
- Aplicabilidad de La Mezcla Cloroformo-Acetona, Equilibro de Fases Con Ecuaciones de EstadoDocument53 paginiAplicabilidad de La Mezcla Cloroformo-Acetona, Equilibro de Fases Con Ecuaciones de EstadoFranky Bedoya Lora100% (4)
- Previo Destilación Simple y FraccionadaDocument6 paginiPrevio Destilación Simple y FraccionadaMike Briseño100% (1)
- REFRIGERANTES - RegrigeracionDocument30 paginiREFRIGERANTES - RegrigeracionCesar TorresÎncă nu există evaluări
- Equilibrio Liquido-Vapor de Una Mezcla BinariaDocument15 paginiEquilibrio Liquido-Vapor de Una Mezcla BinariaCarolina Devia GomezÎncă nu există evaluări
- Destilacion de Un Solvente Volatil EtanolDocument20 paginiDestilacion de Un Solvente Volatil Etanollmrc101Încă nu există evaluări
- Introducción Aspen HYSYSDocument26 paginiIntroducción Aspen HYSYSGuarayo Ormachea AlejandroÎncă nu există evaluări
- Un Procedimiento de Decisión Jerárquica para Síntesis de ProcesosDocument33 paginiUn Procedimiento de Decisión Jerárquica para Síntesis de ProcesosRay AcostaÎncă nu există evaluări
- ANTECEDENTES de La Practica 4Document3 paginiANTECEDENTES de La Practica 4Lino José Ignacio Gaytán Vargas100% (8)
- Informe 4 Básica PDFDocument18 paginiInforme 4 Básica PDFMaricielo CerroÎncă nu există evaluări
- Destilación: Preguntas sobre equilibrio de fases y procesosDocument3 paginiDestilación: Preguntas sobre equilibrio de fases y procesosJulissaÎncă nu există evaluări
- Síntesis de Los Trenes de SeparaciónDocument79 paginiSíntesis de Los Trenes de SeparaciónAlex Agualema100% (1)