Documente Academic
Documente Profesional
Documente Cultură
Propiedades de Los Gases Informe
Încărcat de
Sthefany AlfaroDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Propiedades de Los Gases Informe
Încărcat de
Sthefany AlfaroDrepturi de autor:
Formate disponibile
Universidad de Ingeniera y Tecnologa
Laboratorio de Qumica y Biologa
Informe de Laboratorio N4
Propiedades de los gases
I.
INTRODUCCIN
Este trabajo permite identificar qu son los gases, de dnde surgen y
cules son sus aplicaciones en la vida diaria de los seres humanos.
Un gas es el estado de la materia en la que las sustancias no tienen
volumen ni forma propia sino que se adaptan al recipiente que lo
contiene. Las molculas no tienen fuerza de atraccin, por lo tanto en
cualquier recipiente sin importar su tamao su tamao, el gas lo
ocupar completamente puesto que poseen propiedades por las
cuales se pueden expandir.
II.
OBJETIVOS
III.
Determinar el volumen molar de un gas a condiciones normales.
Comprobar las leyes de los gases a travs de experiencias sencillas.
Analizar si los gases son ms de beneficio o perjuicio para la
humanidad en la actualidad
FUNDAMENTOS TERICOS
Gas
Se denomina gas al estado de agregacin de la materia que no tiene
forma ni volumen propio. Su principal composicin son molculas no
unidas y con poca fuerza de atraccin haciendo que no tengan
volumen y forma definida, provocando que este se expanda para
ocupar todo el volumen del recipiente que la contiene, con respecto a
los gases, las fuerzas gravitatorias y de atraccin entre partculas
resultan insignificantes.
Existen diversas leyes que relacionan la presin, el volumen y la
temperatura de un gas. Adems, los gases tienen una composicin
de molculas muy separadas y tienen diferentes procesos como
condensacin, lquido, slido y otra vez gaseoso.
Ley de los gases ideales
Estudia la relacin proporcional entre presin, volumen,
temperatura y moles.
En condiciones ideales, un gas estara formado por partculas
puntuales que no sufren atraccin ni repulsin entre ellas y cuyos
choques son elsticos. Los nicos gases reales que pueden
aproximarse realmente al comportamiento ideal son los gases
monoatmicos a bajas presiones y temperaturas.
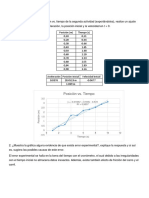
Tabla 1 Presin de vapor del agua a diferentes
temperaturas
Temperatura
(C)
Presin
(mmHg)
19
20
21
22
23
24
25
26
16,48
17,54
18,65
19,89
21,07
22,38
23,76
25,21
La ecuacin general es:
pV = nRT
p --> presin (en atmsferas)
V --> volumen (en litros)
n --> n de moles del gas (en moles)
R --> constante de los gase
T --> Temperatura (en grados Kelvin)
R
R
R
R
R
=
=
=
=
=
8,314472J/K.mol
0,08205746 L.atm/K.mol
8,205746.10-5 m3.atm/L.mol
8,314475 LKPa/K.mol
62,36367 LmmHg/Kmol
Ley de Boyle
A temperatura constante, el volumen de cualquier gas es
inversamente proporcional a la presin que se le aplica.
V = kP
PV = k
P = presin; V = volumen;
k = constante de proporcionalidad.
Esta constante depende de las unidades usadas, la masa del gas y
la temperatura.
P1V1 = P2V2
Ley de Charles
El volumen de un gas es directamente proporcional a la
temperatura cuando la presin y el n son constantes.
Lo anterior se expresa:
V = kT, en donde V = volumen; T = temperatura absoluta;
k = constantes de proporcionalidad que depende de las unidades
usadas y de la masa del gas
Considerando los estados iniciales y finales
Ley de Gay-Lussac
Al aumentar la temperatura, las molculas del gas se mueven ms
rpidamente y por tanto aumenta el nmero de choques contra
las paredes, es decir aumenta la presin ya que el recipiente es de
paredes fijas y su volumen no puede cambiar.
Gay-Lussac descubri que en cualquier momento de este proceso,
el cociente entre la presin y la temperatura siempre tena el
mismo valor:
Ley de Avogadro
El volumen que ocupa un gas, cuando la presin y la temperatura
se mantienen constantes es proporcional al nmero de partculas
Vn (a temperatura y presin constantes)
V= constante x n
V= volumen
n= nmero de mol
IV.
PROCEDIMIENTO
Se llen 100ml de agua en una probeta. Seguidamente,
se coloc un tapn en un vaso de precipitado de 500ml,
tambin lleno de agua. Luego se pas a retirar el tapn.
Se coloc una primera masa de magnesio.
Se realizaron dos pruebas, en la primera con una masa de magnesio
de 0,0464g y en la segunda prueba se utiliz una masa de 0,0460g.
Ambos reaccionaron con el HCl.
V.
RESULTADOS.
Datos
Ensayo 1
Ensayo 2
Promedio
Longitud de cinta de Mg
2cm
2cm
2cm
Masa de Mg
0,0464g
0,0460g
0,0462g
Volumen de H2(g) producido
46ml
47ml
46,5ml
Temperatura
295K
295K
295K
Presin baromtrica
760mmHg
760mmHg
760mmHg
Presin parcial de H2O
19,83mm
19,83mm
19,83mm
Hg
Hg
Hg
Presin del H2(g) producido
740,17mm
740,17mm
740,17mm
(presin baromtrica presin
Hg
Hg
Hg
parcial del vapor de H2O )
VI.
DISCUSIN DE RESULTADOS
1. Cul es la ecuacin de la reaccin?
2HCl + Mg H2 + MgCl2
2. Cul es el nmero de moles tericos?
n=moles
nMg=
0,0460
-3
24,30 = 1,843 x 10 mol
3. Cul es la masa terica que debemos obtener de H 2?
1,843 x 10-3 x 2,07 g/mol = 3,91 x 10-3
4. Cul es el volumen terico que debemos obtener de H 2?
P.V = n.R.T
1 x V= 0,082 x 295K x 1,893 x 10-3
V= 0,045L
Para hallar este resultado se us la leyde los gases ideales.
5. Cul es el volumen obtenido de H2?
46,03ml
6. Cul es el rendimiento de esta reaccin?
R=
R=
Vexp
Vteo x100
45,79 L
46,00 L x 100
R= 99,47%
7. Calcule la presin del gas dentro de la probeta.
P= 19,83mmHg
Para calcular la presin se utiliz la tabla 1.
8. Calcule cuntos moles de H2 corresponde este volumen. (Se
utiliz la ley de los gases ideales)
P.V = n.R.T
760mmHg x 46,00= n x 295 x 62,36
760 x 19,83 x 0,04600 = n x 295 x 62,36
n= 1,60 x 10-3
Para hallar el resultado, se utiliz la ley de los gases ideales.
9. Calcule el error en sus mediciones
( 1,89 x 103 )(1,60 x 103)
(n=moles) % error=
(1,60 x 10 )
x 100
%error (moles)= 14,56%
(volumen) % error:
( 46 )(45,79)
(45,79)
x 100
%error (volumen)= 0,45%
10.Compare este error con el de otros grupos
VII.
N Grupo
% error
24,22%
1,74%
8,15%
15,64%
CONCLUSIONES
Se observ que en la bureta no existe la misma temperatura a la del
ambiente.
Obtuvimos un error en el volumen de 0,45%; el porcentaje de error
en el nmero de moles fue 14,56%
Se estudi los parmetros que gobiernan el comportamiento de los
gases.
Se determin el volumen molar de un gas a condiciones normales.
S-ar putea să vă placă și
- Ejercicio 5Document4 paginiEjercicio 5CARLOS EDUARDO TORRES CASTRO100% (3)
- Calculation of LPG Mixture Vapor Pressure Con Comentarios Rev1Document3 paginiCalculation of LPG Mixture Vapor Pressure Con Comentarios Rev1gemin0204Încă nu există evaluări
- Practica #1 Gases Reales e IdealesDocument12 paginiPractica #1 Gases Reales e IdealesAlbert Solis DiazÎncă nu există evaluări
- Tarea Termo2Document10 paginiTarea Termo2Maria CalleÎncă nu există evaluări
- Laboratorio - CalorimetriaDocument4 paginiLaboratorio - CalorimetriaRodolfo Hualla MontesÎncă nu există evaluări
- Determinación de La Constante Universal de Los Gases R.Document6 paginiDeterminación de La Constante Universal de Los Gases R.Vale Trigueros100% (1)
- Informe Propiedades de Las Sustancias en Funcion de Su Tipo de Enlace y Sus Fuerzas IntermolecularesDocument14 paginiInforme Propiedades de Las Sustancias en Funcion de Su Tipo de Enlace y Sus Fuerzas Intermolecularesjulieth becerraÎncă nu există evaluări
- Informe Ley de La Conservacion de La MateriaDocument4 paginiInforme Ley de La Conservacion de La Materialaura fuentes100% (1)
- Tema #4. - Densidad PDFDocument5 paginiTema #4. - Densidad PDFAraúz YaratzedÎncă nu există evaluări
- Informe Periodicidad Quimica FINALDocument6 paginiInforme Periodicidad Quimica FINALGABRIELA ANDREA VELEZ CERON100% (1)
- Informe de Laboratorio SolubilidadDocument6 paginiInforme de Laboratorio SolubilidadVlado ManriqueÎncă nu există evaluări
- BOLIVIADocument12 paginiBOLIVIARODRIGO FIGUEROA CAMACHOÎncă nu există evaluări
- Informe Humedad y CenizasDocument3 paginiInforme Humedad y CenizasBrianm FlorezÎncă nu există evaluări
- Ortiz Quinatoa - MielDocument9 paginiOrtiz Quinatoa - MielAdriana QuinatoaÎncă nu există evaluări
- OBTENCION Y PROPIEDADES Del Acetileno, Informe 3Document5 paginiOBTENCION Y PROPIEDADES Del Acetileno, Informe 3maria camilaÎncă nu există evaluări
- Laboratorio - Casi CompletadoDocument5 paginiLaboratorio - Casi CompletadoJulieth AlvisÎncă nu există evaluări
- 1BOYLEDocument9 pagini1BOYLEREYNALDO PIZARROÎncă nu există evaluări
- Balanza AnaliticaDocument11 paginiBalanza Analiticajaime rubenÎncă nu există evaluări
- Pueden Las Fuerzas Deformar Los CuerposDocument4 paginiPueden Las Fuerzas Deformar Los CuerposAngela100% (2)
- Tincion Diferencial de Gram123Document2 paginiTincion Diferencial de Gram123Cesar Augusto Torres Linares0% (1)
- PRACTICA No 3 DETERMINACION DE DENSIDADES DE LIQUIDOS Y SÓLIDOSDocument4 paginiPRACTICA No 3 DETERMINACION DE DENSIDADES DE LIQUIDOS Y SÓLIDOSJeimer Abel Jimenez EscobarÎncă nu există evaluări
- Informe 3 Laboratorio de Física, Caida Libre.Document4 paginiInforme 3 Laboratorio de Física, Caida Libre.Brayan J. PérezÎncă nu există evaluări
- Informe 3. Preparación de Una Solucion de Acido HCL y NaOHDocument6 paginiInforme 3. Preparación de Una Solucion de Acido HCL y NaOHRoberto Paternostro100% (1)
- Determinación de La Densidad Con Diferentes Figuras de AluminioDocument4 paginiDeterminación de La Densidad Con Diferentes Figuras de AluminioBrayan Esteban Guerrero Hermida100% (1)
- Determinación de Densidades de Sólidos Regulares e IrregularesDocument4 paginiDeterminación de Densidades de Sólidos Regulares e IrregularesKevin Ramírez RoncalloÎncă nu există evaluări
- Densidad de Una MezclaDocument5 paginiDensidad de Una MezclaSusana Belen Mendoza FariñaÎncă nu există evaluări
- Informe de Propiedades Coligativas PDFDocument16 paginiInforme de Propiedades Coligativas PDFAlex MalizaÎncă nu există evaluări
- Informe de Preparación de DisolucionesDocument3 paginiInforme de Preparación de DisolucionesNadia CamargoÎncă nu există evaluări
- Informe Propiedades de SólidosDocument4 paginiInforme Propiedades de SólidosSofia AlfonsoÎncă nu există evaluări
- INFORME EstequiometriaDocument6 paginiINFORME EstequiometriaManuel Peña50% (2)
- Informe de Quimica Nro 3Document4 paginiInforme de Quimica Nro 3jimyÎncă nu există evaluări
- Informe 6Document8 paginiInforme 6RojasJosues100% (1)
- Laboratorio N°4 Determinación de La Fórmula de Una Sal Hidratada Objetivo: Fundamento TeoricoDocument3 paginiLaboratorio N°4 Determinación de La Fórmula de Una Sal Hidratada Objetivo: Fundamento TeoricoPaola ChincheroÎncă nu există evaluări
- Lab N°4 MRUVDocument3 paginiLab N°4 MRUVSebastian Castillo Vill100% (2)
- Informe de Lab 2 Propiedades Fisicas de La MateriaDocument11 paginiInforme de Lab 2 Propiedades Fisicas de La Materiapepitaperez6Încă nu există evaluări
- Practica 4 ARMANDO 4276Document8 paginiPractica 4 ARMANDO 4276Armando TiconaÎncă nu există evaluări
- Informe Metodo DumasDocument8 paginiInforme Metodo Dumasestefania_ramos_4100% (2)
- Análisis y RecomendacionesDocument2 paginiAnálisis y Recomendacionesefrain6299Încă nu există evaluări
- Cuestionario de Reconocimiento de Materiales - LaboratorioDocument8 paginiCuestionario de Reconocimiento de Materiales - LaboratorioSANDRA ROJAS MALDONADOÎncă nu există evaluări
- RESULTADOS Y DISCUSIÓN Ley de HookeDocument2 paginiRESULTADOS Y DISCUSIÓN Ley de HookeJuvia LoxarÎncă nu există evaluări
- Laboratorio N. Pruebas Generales para LipidosDocument10 paginiLaboratorio N. Pruebas Generales para LipidosHenry Alejandro Polanco TapieroÎncă nu există evaluări
- Laboratorio #1 GRAVIMETRIA DE LA VOLATILIZACIONDocument6 paginiLaboratorio #1 GRAVIMETRIA DE LA VOLATILIZACIONJosept Churqui Condori0% (1)
- EnviarDocument16 paginiEnviaresneider linares romeroÎncă nu există evaluări
- Informe de Gases IdealesDocument8 paginiInforme de Gases IdealesJulio Cesar CancioÎncă nu există evaluări
- Mapa Conceptual-Metodo GravimetricoDocument1 paginăMapa Conceptual-Metodo GravimetricoEmili Vio KantutaÎncă nu există evaluări
- Reactivo LimiteDocument6 paginiReactivo LimiteCristian Rojas RÎncă nu există evaluări
- INFORME-6 ANALISIS ELEMENTAL CUALITATIVOlDocument12 paginiINFORME-6 ANALISIS ELEMENTAL CUALITATIVOlJâviiêr OrtizzÎncă nu există evaluări
- Informe de La Práctica N°5Document6 paginiInforme de La Práctica N°5Magaly Chipana BartoloméÎncă nu există evaluări
- FisicoquimicaAntonio (1) 93 104Document12 paginiFisicoquimicaAntonio (1) 93 104gabriel sarzuri0% (1)
- Capacidad de Extraccion de Solventes Grasa Del ManiDocument12 paginiCapacidad de Extraccion de Solventes Grasa Del ManijuanÎncă nu există evaluări
- Practica Quimica 3Document7 paginiPractica Quimica 3Nestor Vargas CondoriÎncă nu există evaluări
- Marco Teorico Densidad de Liquidos y SolidosDocument4 paginiMarco Teorico Densidad de Liquidos y SolidosDaniel Camilo Malaver MendozaÎncă nu există evaluări
- Iv. Discusiones: Muestras Con Tiras de PHDocument3 paginiIv. Discusiones: Muestras Con Tiras de PHFernando Valladolid SuarezÎncă nu există evaluări
- Densidad y Peso EspecificoDocument2 paginiDensidad y Peso EspecificoEnrique Joel Irahola50% (4)
- INTRODUCCIÓN Y CONCLUSION INFORME 6 UdeCDocument1 paginăINTRODUCCIÓN Y CONCLUSION INFORME 6 UdeCMaria José Ramos CoronadoÎncă nu există evaluări
- Informe de Operaciones Basicas en El LaboratorioDocument5 paginiInforme de Operaciones Basicas en El LaboratorioIkky YagamiÎncă nu există evaluări
- Informe 7 (Principio de Arquimedes)Document11 paginiInforme 7 (Principio de Arquimedes)MATEO ESCORCIA SIERRAÎncă nu există evaluări
- Practica EstequiometríaDocument3 paginiPractica EstequiometríaLUIS MATEO HINCAPIÉ MARTÍNEZÎncă nu există evaluări
- Informe de Laboratorio. MedicionesDocument10 paginiInforme de Laboratorio. MedicionesMauricio Albert Cortez ZelayaÎncă nu există evaluări
- Informe Aumento Punto de Ebullicion1.9Document4 paginiInforme Aumento Punto de Ebullicion1.9Leonardo ReyesÎncă nu există evaluări
- Informe 1. Estandarizacion SolucionesDocument8 paginiInforme 1. Estandarizacion SolucionesLuciano Lizarazo100% (1)
- Reporte de Primer LaboratorioDocument20 paginiReporte de Primer LaboratorioDanthe VergaraÎncă nu există evaluări
- 00693540850IA05S110551061GASESIDEALESDocument32 pagini00693540850IA05S110551061GASESIDEALESKIARA ALESSANDRA SANDONAS GONZALESÎncă nu există evaluări
- Copia de Problemas Ecuación Del Gas Ideal - José Alfonso Ramírez MartínezDocument4 paginiCopia de Problemas Ecuación Del Gas Ideal - José Alfonso Ramírez MartínezJesús Robles EscobarÎncă nu există evaluări
- Bolilla #1 - Equilibrio de Fases en Sistemas SimplesDocument14 paginiBolilla #1 - Equilibrio de Fases en Sistemas SimplesSofia CbaÎncă nu există evaluări
- Estado GaseosoDocument24 paginiEstado GaseosoFernando Lopez AveiraÎncă nu există evaluări
- Ex TD 1 S98 SolDocument4 paginiEx TD 1 S98 SolshinjiasdÎncă nu există evaluări
- Refrigeración y LicuefacciónDocument22 paginiRefrigeración y LicuefacciónJhoel Daniel Gamboa MejiaÎncă nu există evaluări
- Hidrodinámica IIIDocument7 paginiHidrodinámica IIIDAVID MUSICÎncă nu există evaluări
- 1ra Und Propiedades de Los FluidosDocument24 pagini1ra Und Propiedades de Los FluidosJhon MedinaÎncă nu există evaluări
- Practica 5 - Equilibrio Liquido Vapor-Sitema BinarioDocument9 paginiPractica 5 - Equilibrio Liquido Vapor-Sitema BinarioYomar GuillenÎncă nu există evaluări
- CavitacionDocument4 paginiCavitacionEdward MayanchaÎncă nu există evaluări
- Unidad 01 Fisico QuimicaDocument30 paginiUnidad 01 Fisico QuimicaJoan Huaman CastilloÎncă nu există evaluări
- Mecanica de Fluidos Trabajo 1Document13 paginiMecanica de Fluidos Trabajo 1Abi CárdenasÎncă nu există evaluări
- Comp Re Sores Blue StarDocument19 paginiComp Re Sores Blue StarrobmeierÎncă nu există evaluări
- Primer PrincipioDocument19 paginiPrimer PrincipioChristian CabralÎncă nu există evaluări
- Gases RealesDocument32 paginiGases RealesMARIA ISABEL CCOSCCO COSTILLAÎncă nu există evaluări
- Informe de Fisicoquimica 2Document18 paginiInforme de Fisicoquimica 2Ruth Andromeda Lazarte MontesinosÎncă nu există evaluări
- DF C Separador Ciclonico - 240307 - 214221Document2 paginiDF C Separador Ciclonico - 240307 - 214221dianacatherinnesoteloÎncă nu există evaluări
- Practica 1 Fisicoquimica Ley de BoyleDocument7 paginiPractica 1 Fisicoquimica Ley de BoyleCarlitos HernandezÎncă nu există evaluări
- MASADocument10 paginiMASAAlejandra Nustes PerezÎncă nu există evaluări
- 4 Torre de Destilacion AtmosfericaDocument4 pagini4 Torre de Destilacion AtmosfericaIngrith Perez LacatoÎncă nu există evaluări
- Unidad 5Document91 paginiUnidad 5Andres LopezÎncă nu există evaluări
- U.I.Ejercicios de Clase - Septiembre.2021Document11 paginiU.I.Ejercicios de Clase - Septiembre.2021FTopnite 08Încă nu există evaluări
- Ejercicios Bernoulli Tipeado GrupalDocument13 paginiEjercicios Bernoulli Tipeado GrupalRoyF.CallaÎncă nu există evaluări
- S08.s2 MaterialDocument21 paginiS08.s2 MateriallupozhÎncă nu există evaluări
- Densidad y Peso Molecular Aparente Del Aire Terminado FinalDocument11 paginiDensidad y Peso Molecular Aparente Del Aire Terminado FinalRonald Gutierrez MenesesÎncă nu există evaluări
- Informe Campo MayDocument11 paginiInforme Campo MayJaime GarciaÎncă nu există evaluări
- Lavador VenturiDocument45 paginiLavador VenturiDianita RodriguezÎncă nu există evaluări
- (3.1) .-Guía Aprendizaje.3 Termodinamica UNJ@Document31 pagini(3.1) .-Guía Aprendizaje.3 Termodinamica UNJ@Renato Xavier Pusma SánchezÎncă nu există evaluări