Documente Academic
Documente Profesional
Documente Cultură
Hydratation Du Ciment Portland
Încărcat de
GenieCivil0 evaluări0% au considerat acest document util (0 voturi)
311 vizualizări3 paginiHydratation Du Ciment Portland
Drepturi de autor
© © All Rights Reserved
Formate disponibile
DOCX, PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentHydratation Du Ciment Portland
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
0 evaluări0% au considerat acest document util (0 voturi)
311 vizualizări3 paginiHydratation Du Ciment Portland
Încărcat de
GenieCivilHydratation Du Ciment Portland
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 3
Hydratation du ciment Portland
La plupart des proprits du bton, et plusieurs aspects de sa
durabilit dpendent des caractristiques de la pte de ciment
durci. Il est donc important de comprendre la structure de la
pte de ciment hydrat
La prise du ciment nest pas un schage de la pte aprs ajout
de leau ; il sagit dun ensemble de ractions chimiques
dhydratation permettant le passage de la pte de ciment
(ciment additionn deau) de ltat liquide ltat solide.
La pte de ciment hydrat est le rsultat de ractions
chimiques entre leau et les composs du ciment. Il sagit dun
processus complexe dans lequel les principaux composs du
ciment C3S, C2S, C3A, et C4AF ragissent pour former de
nouveaux composs insolubles qui entranent la prise et le
durcissement progressif du matriau.
Ltude des ractions dhydratation des composants du ciment
dissocie artificiellement des mcanismes dont le droulement
est, dans les faits, simultan.
Mcanismes dhydratation dun ciment Portland
Lhydratation du ciment Portland implique, nous venons de le
voir, la raction des quatre phases minrales qui le composent.
Comme le ciment est compos principalement de C3S, cest
lhydratation du C3S qui contrle la cintique globale de
lhydratation. Il existe cependant une synergie entre les
diffrentes ractions.
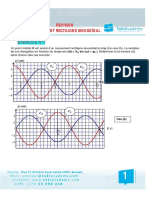
La Figure 1 prsente la courbe caractristique de calorimtrie
isotherme dun ciment qui peut tre dcoupe en quatre
priodes :
Priode 1 : ractions initiales
Cette priode dbute ds le contact entre leau et le ciment et
dure quelques minutes. Le C3S et le C3A des grains de ciment
ragissent immdiatement avec leau, formant de lettringite et
des C-S-H (mtastables) : les ions entrent en solution.
Priode 2 : priode dormante
Le dgagement de chaleur est faible. Aucune volution de la
pte ne semble se produire. Les ractions chimiques ont
pourtant commenc : des ions passent en solution dans leau
durant cette phase (ions calcium, silicates, hydroxydes et
sulfates). Quand leau de gchage est sature en ions, le
dbut de la prise se produit. Le pH de la solution augmente,
ce qui ralentit la dissolution des constituants.
Priode 3 : priode dacclration
Cette priode dbute lorsque la concentration en ions Ca 2+et
OH- de la solution devient critique, la conductivit lectrique de
la solution tant alors son maximum. Cette sursaturation
induit la prcipitation de la portlandite. Il sensuit alors les
mcanismes de dissolution, de nuclation et de prcipitation
des diffrentes phases, permettant la formation des hydrates
(ettringite, portlandite, C-S-H). Cette activit chimique dgage
beaucoup de chaleur. Les hydrates forms commencent
senchevtrer et crent donc un solide.
Priode 4 : priode de ralentissement
Les grains anhydres se trouvent recouverts dune couche
dhydrates qui spaissit de plus en plus. Pour que lhydratation
se poursuive, il faut que leau diffuse travers les pores de gel.
La chaleur dgage diminue.
Si le rseau poreux est ferm, une partie du ciment nest jamais
atteinte et donc ne sera jamais hydrate. Cest pendant cette
priode que lettringite de type AFt se dissout afin de se
transformer en type AFm.
Les mcanismes complexes lorigine de la cration des
diffrents produits de lhydratation que sont les silicates et les
aluminates sont ladsorption, lhydrolyse, la dissolution, la
solvatation et la cristallisation.
S-ar putea să vă placă și
- Cours Sur Le BoisDocument57 paginiCours Sur Le BoisSpihanorÎncă nu există evaluări
- Hydratation Du Ciment PortlandDocument99 paginiHydratation Du Ciment PortlandChouaib Aribi100% (4)
- EHTP Cours Hydratation-Ciments DiffDocument23 paginiEHTP Cours Hydratation-Ciments DiffToufik Ait HamouÎncă nu există evaluări
- Ration Aliment PDFDocument44 paginiRation Aliment PDFAude DESBOISÎncă nu există evaluări
- Durabilité de BétonDocument26 paginiDurabilité de BétonMorabit Mohamed50% (2)
- Microstructure de La Pâte de Ciment DurcieDocument74 paginiMicrostructure de La Pâte de Ciment DurcieChouaib Aribi100% (1)
- Chapitre 1Document22 paginiChapitre 1Asm MaÎncă nu există evaluări
- Cours de Chromatographie L3 Pro Synthese PDFDocument20 paginiCours de Chromatographie L3 Pro Synthese PDFHenri Jowel0% (1)
- Durabilité BETONDocument30 paginiDurabilité BETONSoufiane LamrabtiÎncă nu există evaluări
- Structure Multifonctionnelle: Les futurs systèmes de l'armée de l'air seront intégrés dans des cellules matérielles multifonctionnelles avec capteur intégré et composants de réseauDe la EverandStructure Multifonctionnelle: Les futurs systèmes de l'armée de l'air seront intégrés dans des cellules matérielles multifonctionnelles avec capteur intégré et composants de réseauÎncă nu există evaluări
- Les AdjuvantsDocument108 paginiLes AdjuvantsChouaib AribiÎncă nu există evaluări
- Resources en Eau Eau de Consommation QualitésDocument66 paginiResources en Eau Eau de Consommation QualitésGéovanie Tossou100% (1)
- Cours de Chromatographie GazDocument185 paginiCours de Chromatographie Gazchaou chaimaÎncă nu există evaluări
- Questions Et Réponses EnvironnementDocument6 paginiQuestions Et Réponses EnvironnementApolinaire MuderhwaÎncă nu există evaluări
- BIOCHIMIEDocument6 paginiBIOCHIMIECheick SANOUÎncă nu există evaluări
- La Pollution de L EauDocument13 paginiLa Pollution de L Eaumonsieurgogo100% (2)
- Eau ChlorationDocument76 paginiEau ChlorationagnierÎncă nu există evaluări
- Anaerobies StrictesDocument20 paginiAnaerobies StrictesAuxy MassandeÎncă nu există evaluări
- Ashley Sivil CVDocument2 paginiAshley Sivil CVapi-200670817Încă nu există evaluări
- Cabanes F. Déphosphatation Des EffluentsDocument219 paginiCabanes F. Déphosphatation Des EffluentsniebelungenÎncă nu există evaluări
- Le Plâtre PDFDocument4 paginiLe Plâtre PDFFeriel Kh100% (1)
- CIMENTS - Cours Et ExercicesDocument15 paginiCIMENTS - Cours Et Exerciceschouaib100% (2)
- Cuivre PDFDocument91 paginiCuivre PDFjhonwaker100% (1)
- Glissement Et RhéomètrieDocument27 paginiGlissement Et Rhéomètriemp87_ing100% (1)
- Bio TechnologiesDocument6 paginiBio TechnologiesblogmalikaÎncă nu există evaluări
- TurbomachineDocument7 paginiTurbomachineYakoub AiouazÎncă nu există evaluări
- Durete PDFDocument4 paginiDurete PDFElle IntissarÎncă nu există evaluări
- Projet de Fin de Cycle PDFDocument1 paginăProjet de Fin de Cycle PDFAmira SaaÎncă nu există evaluări
- Liang C. Caractérisations Électriques de Polymères ConducteursDocument152 paginiLiang C. Caractérisations Électriques de Polymères ConducteursniebelungenÎncă nu există evaluări
- Libération Contrôlée Thèse PDFDocument214 paginiLibération Contrôlée Thèse PDFMelissa TorresÎncă nu există evaluări
- Cours Biodiversite s6Document145 paginiCours Biodiversite s6Infamara Mané50% (2)
- Etude Phytochimique Et Biologique de Leea Guinensis (Leeaceae)Document233 paginiEtude Phytochimique Et Biologique de Leea Guinensis (Leeaceae)ophil7467% (3)
- L'enseignement Apprentissage Du FLE Par Le Biais Du Site Pédagogique de RFI PDFDocument77 paginiL'enseignement Apprentissage Du FLE Par Le Biais Du Site Pédagogique de RFI PDFIrina ColatauÎncă nu există evaluări
- MitidjaDocument4 paginiMitidjaouarab asmaÎncă nu există evaluări
- Hydratation Du Ciment PortlandDocument3 paginiHydratation Du Ciment PortlandYounes TaoufikÎncă nu există evaluări
- Hydratation Du Ciment PortlandDocument5 paginiHydratation Du Ciment PortlandAdilson Jose Marito MaritoÎncă nu există evaluări
- Durabilité Des MatériauxDocument72 paginiDurabilité Des MatériauxBouchra IslemÎncă nu există evaluări
- Expose Alteration Chimique Des RochesDocument8 paginiExpose Alteration Chimique Des Rocheskoko jean- jacquesÎncă nu există evaluări
- Corrigé Examen S3 Janvier2019Document4 paginiCorrigé Examen S3 Janvier2019Hamza BEYADÎncă nu există evaluări
- Altération2016Document53 paginiAltération2016Ihave BirdaÎncă nu există evaluări
- Chapitre 1 GénéraliésDocument140 paginiChapitre 1 GénéraliésZAKARIA EL KHABBABIÎncă nu există evaluări
- Les Roches SedimentairesDocument9 paginiLes Roches Sedimentairessaidiadamyounes711Încă nu există evaluări
- Ciments Et Bétons: Composition, Propriétés Et UtilisationsDocument19 paginiCiments Et Bétons: Composition, Propriétés Et UtilisationsKin JazzÎncă nu există evaluări
- AltérationnnnnnnnnnnnnnDocument55 paginiAltérationnnnnnnnnnnnnnOmar OmarÎncă nu există evaluări
- 1 Composition Du BetonDocument11 pagini1 Composition Du BetonMajida RoumyÎncă nu există evaluări
- Cours de Sédimentologie ITA LP GPG-MIN 2020Document96 paginiCours de Sédimentologie ITA LP GPG-MIN 2020Emmanuel NguiletÎncă nu există evaluări
- Géochimie Organique MIDocument21 paginiGéochimie Organique MIOumarou MOUSSA IPTEÎncă nu există evaluări
- 2021 Cours-RetraitDocument11 pagini2021 Cours-Retraitbouloufa abdelhadiÎncă nu există evaluări
- Les Ciments de Construction.Document6 paginiLes Ciments de Construction.Makhtar DioneÎncă nu există evaluări
- Exposé (La Structure Phys de La Pate Cimentaire)Document8 paginiExposé (La Structure Phys de La Pate Cimentaire)خديجة مزيان بن طاهرÎncă nu există evaluări
- Chapitre 2Document18 paginiChapitre 2Anes MeraziÎncă nu există evaluări
- Chap2 Les Ciments PortlandDocument18 paginiChap2 Les Ciments PortlandAHMED BelÎncă nu există evaluări
- Les Ciments Chap2Document18 paginiLes Ciments Chap2bouÎncă nu există evaluări
- CH4Document5 paginiCH4عبد العزيز مروىÎncă nu există evaluări
- HydradationDocument5 paginiHydradationSawsen CheboukiÎncă nu există evaluări
- Durcissement Du CimentDocument1 paginăDurcissement Du CimentTOVIHO SessinouÎncă nu există evaluări
- +++++++++ Lafrage.... PDF - Cours - UCB - 2009 - B - Albert................ CimentDocument63 pagini+++++++++ Lafrage.... PDF - Cours - UCB - 2009 - B - Albert................ CimentLyes Kh100% (1)
- Corrigé Examen S3 Janvier2020 MatériauxDocument2 paginiCorrigé Examen S3 Janvier2020 MatériauxHamza BEYADÎncă nu există evaluări
- Roches SédimentairesDocument30 paginiRoches SédimentairesOtmane LekhlifiÎncă nu există evaluări
- 2010chapitre Les Roches Sedimentaires PDFDocument27 pagini2010chapitre Les Roches Sedimentaires PDFBoulaouche Abdel HalimÎncă nu există evaluări
- Lvolution Post SdimentaireDocument19 paginiLvolution Post SdimentaireYoussefAkninÎncă nu există evaluări
- Eau de GachageDocument1 paginăEau de GachageGenieCivilÎncă nu există evaluări
- Classification Des AdjuvantsDocument15 paginiClassification Des AdjuvantsGenieCivilÎncă nu există evaluări
- Effet Du Mode DDocument1 paginăEffet Du Mode DGenieCivilÎncă nu există evaluări
- CimentDocument6 paginiCimentGenieCivilÎncă nu există evaluări
- CimentDocument6 paginiCimentGenieCivilÎncă nu există evaluări
- Les Poésies Des CP-CE1Document6 paginiLes Poésies Des CP-CE1Carole KaïdÎncă nu există evaluări
- Resume de CodeDocument5 paginiResume de CodeTheArtificerÎncă nu există evaluări
- 17 SaadiDocument53 pagini17 SaadiChaimae OuafikÎncă nu există evaluări
- Le Lieu Et Le Lien: Jacques-Alain MillerDocument10 paginiLe Lieu Et Le Lien: Jacques-Alain MillerKeisukeItoÎncă nu există evaluări
- Documento PDFDocument12 paginiDocumento PDFLisbeth De los SantosÎncă nu există evaluări
- Formation Sur Le Reglage de La Machoire Du ConcasseurDocument15 paginiFormation Sur Le Reglage de La Machoire Du ConcasseurkatukaÎncă nu există evaluări
- Cours de EsiDocument61 paginiCours de EsiInnocent BIAÎncă nu există evaluări
- A La Découverte de La TunisieDocument10 paginiA La Découverte de La TunisieGANG SHOOTÎncă nu există evaluări
- Serie Dexercice Module 1Document2 paginiSerie Dexercice Module 1Duchess Gazeru Güzel TebessümÎncă nu există evaluări
- Construire Un Business Plan - Issam EZ ZAHIDocument7 paginiConstruire Un Business Plan - Issam EZ ZAHIIssam EzzahiÎncă nu există evaluări
- ELOGIE - Etude D'exécutionDocument16 paginiELOGIE - Etude D'exécutionVirane DantonÎncă nu există evaluări
- gWoBYo3CVRE 0rxwUcL9twDocument3 paginigWoBYo3CVRE 0rxwUcL9twMurat OdabasÎncă nu există evaluări
- Mini Guide Express de La Compagnie Du BicarbonateDocument2 paginiMini Guide Express de La Compagnie Du BicarbonateAtilo5Încă nu există evaluări
- DAEFLE À Distance (Information)Document8 paginiDAEFLE À Distance (Information)Dina MardianaÎncă nu există evaluări
- Travaux Dirigés-Recherche Opérationnelle Lp-Mcol: Exercice 1Document2 paginiTravaux Dirigés-Recherche Opérationnelle Lp-Mcol: Exercice 1Abdelâali Dhn100% (1)
- Cinétique ChimiqueDocument22 paginiCinétique ChimiqueChai mae AgnawÎncă nu există evaluări
- Rapport AissaDocument25 paginiRapport Aissaassia benomarÎncă nu există evaluări
- 1.. Revision PhysiqueDocument3 pagini1.. Revision PhysiqueAbderahmen Haj DahmenÎncă nu există evaluări
- Projet Tutoré: Licence Professionnelle Hôtellerie - RestaurationDocument131 paginiProjet Tutoré: Licence Professionnelle Hôtellerie - Restaurationhajar elouadihÎncă nu există evaluări
- InformatiqueDocument26 paginiInformatiqueimed imddÎncă nu există evaluări
- Vocable Espagnol - 10 Janvier 2019Document36 paginiVocable Espagnol - 10 Janvier 2019Adriana RiveraÎncă nu există evaluări
- Michel BrealDocument3 paginiMichel BrealPedroÎncă nu există evaluări
- TD Avec SolutionDocument21 paginiTD Avec SolutionAll AhmeDcia0% (1)
- Def DBODocument2 paginiDef DBOmed ll100% (1)
- Controler Etancheite Circuit BP Moteur 604Document3 paginiControler Etancheite Circuit BP Moteur 604Alfaro GustavoÎncă nu există evaluări
- Date C#Document10 paginiDate C#NAJAHI MounirÎncă nu există evaluări
- Roman La Reine Des NeigesDocument161 paginiRoman La Reine Des NeigesFroiaÎncă nu există evaluări
- Plantes Médicinales Et Toxiques de La Côte D'ivoire - Haute-Volta - Mission D'étude de La Pharmacopée Indigène en A.O.F PDFDocument301 paginiPlantes Médicinales Et Toxiques de La Côte D'ivoire - Haute-Volta - Mission D'étude de La Pharmacopée Indigène en A.O.F PDFModeste DarjÎncă nu există evaluări
- TEC Notions GénéralesDocument10 paginiTEC Notions GénéralesWasi SikesoÎncă nu există evaluări