Documente Academic
Documente Profesional
Documente Cultură
Mielopoyesis
Încărcat de
Darwin Mamani Quispe100%(1)100% au considerat acest document util (1 vot)
629 vizualizări8 paginiAl igual que el resto de la hematopoyesis, la mielopoyesis toma lugar dentro de la medula ósea, sitio en donde las células troncales hematopoyéticas dan lugar a los progenitores mieloides comunes (PMC).
Drepturi de autor
© © All Rights Reserved
Formate disponibile
DOCX, PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentAl igual que el resto de la hematopoyesis, la mielopoyesis toma lugar dentro de la medula ósea, sitio en donde las células troncales hematopoyéticas dan lugar a los progenitores mieloides comunes (PMC).
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
100%(1)100% au considerat acest document util (1 vot)
629 vizualizări8 paginiMielopoyesis
Încărcat de
Darwin Mamani QuispeAl igual que el resto de la hematopoyesis, la mielopoyesis toma lugar dentro de la medula ósea, sitio en donde las células troncales hematopoyéticas dan lugar a los progenitores mieloides comunes (PMC).
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 8
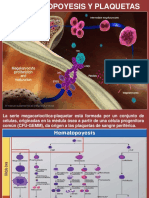
Mielopoyesis Al igual que el resto de la hematopoyesis, la mielopoyesis toma
lugar dentro de la medula sea, sitio en donde las clulas troncales
hematopoyticas dan lugar a los progenitores mieloides comunes (PMC). Los
PMC son clulas con una alta capacidad proliferativa (y por lo tanto activas en
el ciclo celular), pero incapaces de auto-renovarse y cuyo potencial de
diferenciacin est restringido a linajes especficos; estas clulas son
responsivas a un determinado tipo y nmero de citocinas, evento que est
definido por el nmero de receptores que cada progenitor presenta (5). Los
PMC subsecuentemente se pueden diferenciar en progenitores ms especficos,
tales como los progenitores granulo-monocticos (PGM), y los progenitores
eritroides-megacariocticos (PEM) (6), tal y como se ejemplifica en la Figura 1.
La maduracin posterior en cada uno de los linajes hematopoyticos est
definida por dos procesos fundamentales: la prdida definitiva del potencial de
auto-renovacin y la adquisicin de una identidad especfica. Estos procesos
son controlados por programas genticos en donde los genes que mantienen la
capacidad de auto-renovacin se apagan, al tiempo que los genes que regulan
la diferenciacin se encienden. De esta manera, los progenitores
hematopoyticos se diferencian a clulas precursoras, a travs de una serie de
eventos en donde grupos alternados de genes en asociacin con diversos
factores de crecimiento determinan el destino celular en donde cada clula
madura tiene una identidad y funcin definitiva. Entre los principales genes
involucrados en la diferenciacin al linaje mieloide se encuentran: PU.1 (7), Hox
(8), C/EBPa, C/EBPb y C/EPBe (9), RUNX1 (10) y SCL (11). Cabe hacer notar que
altos niveles de expresin de PU.1 se asocian con la diferenciacin
granuloctica, mientras que su baja expresin se asocia con diferenciacin
hacia el linaje eritroide (7). PU.1, junto con los factores de transcripcin GATA 1,
GATA 2 y FOG, son esenciales para la maduracin y diferenciacin eritroide y
megacarioctica (12,13). Una vez que los factores de transcripcin se
encienden o apagan son capaces de inducir la expresin de receptores de
factores de crecimiento involucrados con la diferenciacin eritroide,
megacarioctica y granulo-monoctica. Progenitores Eritroides Diversos
sistemas de cultivo han demostrado que los progenitores eritroides tienen
diferente potencial proliferativo. Los progenitores eritroides ms primitivos son
denominados unidades formadoras de brotes eritroides (del ingls BFUE), las
cuales mantienen una alta tasa de proliferacin en respuesta a citocinas,
mientras que los progenitores eritroides ms maduros, denominados unidades
formadoras de colonias eritroides (del ingls CFU-E) tienen un limitado
potencial de proliferacin. Estos progenitores dan lugar a precursores
eritroides, dentro de los que se incluyen proeritroblastos, eritroblastos
basfilos, eritroblastos policromatfilos, eritroblastos orocromticos, y
reticulocitos; estos ltimos, a su vez, dan origen a los eritrocitos (Fig. 2). CTH
PMP PMC PLC PEM PGM Figura 1 Mielopoyesis. La Clula Troncal
Hematopoytica (CTH), da lugar a Progenitores Multipotentes (PMP), los cuales
pierden capacidad de autorrenovarse pero generan al Progenitor Linfoide
Comn (PLC) y al Progenitor Mieloide Comn (PMC). Este ltimo es capaz de
generar Progenitores Granulocito/Monocticos (PGM) y a Progenitores
Eritroides/Megacariocticos (PEM), los cuales continan con su va de
diferenciacin, y dan lugar a las clulas maduras circulantes (Figuras 2 y 3) 98
Hematopoyesis A lo largo de esta ruta de diferenciacin, la eritropoyetina (EPO)
acta como una de las principales citocinas reguladoras de la eritropoyesis.
Esta molcula es producida por clulas renales y en menor proporcin por
clulas hepticas. La principal actividad de la EPO es controlar la produccin de
clulas eritroides a travs de la promocin de la sobrevivencia, proliferacin y
diferenciacin de progenitores eritroides en la mdula sea. En clulas
progenitoras eritroides tempranas (BFU-E), la EPO acta como agente
mitognico y promueve su proliferacin, mientras que en progenitores
eritroides tardos (CFU-E), acta como agente de sobrevivencia (14). Es
importante destacar que adems de la EPO, citocinas como interleucina 3 (IL3), trombopoyetina (TPO), ligando de la tirosina fetal 3 (FLT-3L) y el factor de
clulas seminales (SCF) participan tambin en la eritropoyesis; estas citocinas
son capaces de sinergizar con EPO y regular la proliferacin, diferenciacin y
sobrevivencia de clulas progenitoras y precursores eritroides (15).
Progenitores Megacariocticos En relacin a los progenitores megacariocticos,
una clasificacin jerrquica ha sido desarrollada con base en sus potenciales de
proliferacin y la expresin de c-mpl (el receptor de trombopoyetina) en su
superficie. Los progenitores ms tempranos son definidos como clulas
formadoras de brotes megacariocticos (meg-BFC) y son capaces de formar
colonias de alrededor de 100 clulas, despus de 21 das de cultivo. Estos megBFC dan lugar a clulas formadoras de colonias de megacariocitos (meg-CFC)
que representan a los progenitores tardos, capaces de formar pequeas
colonias despus de 12 das de cultivo. Estos meg-CFC a lo largo de 5 a 7 das,
tienen diversas endomitosis (replicacin del ADN sin divisin nuclear), que
conducen a la formacin de precursores poliploides denominados
megacariocitos inmaduros, quienes una vez que desarrollan un citoplasma
maduro dan lugar a megacariocitos maduros, que eventualmente darn lugar a
las plaquetas (Fig. 2). A lo largo de todo el proceso de diferenciacin
megacarioctica, el elemento regulador clave es la trombopoyetina, ya que
promueve el crecimiento de los meg-CFC, incrementando sustancialmente la
tasa de endocitosis y estimulando la diferenciacin a megacariocitos maduros.
Algunas otras citocinas involucradas con este proceso son IL-3, IL-6 e IL-11.
Progenitores Granulo-Monocticos Los progenitores mieloides por su parte
incluyen unidades formadoras de colonias granulo-monociPEM BFU-E Meg-BFC
Meg-CFC CFU-E PE EB EPC EO RET Eritrocito Meg-I Meg-M Plaquetas Figura 2
Diferenciacin Eritroide. El progenitor eritroide-megacarioctico (PEM), da lugar
a Unidades Formadoras de Brote Eritroide (BFU-E), quienes a su vez originan
Unidades Formadoras de Colonias Eritroides (CFU-E), para posteriormente dar
lugar a proeritroblastos (PE), eritroblastos basoflicos (EB), eritroblastos
policromatoflicos (EPC), eritroblastos ortocromticos (EO), reticulocitos (RET) y
clulas eritroides maduras. El progenitor eritroidemegacarioctico tambin
puede dar lugar a Clulas Formadoras de Brotes Megacariocticos (Meg-BFC),
los cuales, a su vez, generan Clulas Formadoras de Colonias Megacariocticas
(Meg-CFC), que posteriormente generaran megacariocitos inmaduros (Meg-I) y
maduros (Meg-M), que finalmente liberaran a las plaquetas. Mayani et al,
Cancerologa 2 (2007): 95-107 99 CFU-M CFU-G PGM MIEL PM MIEL MM MONOB
PMON MON Macrfago Basfilo Neutrfilo Eosinfilo tcas (del ingls CFU-GM),
que a su vez dan origen a unidades formadoras de colonias granulocitcas (del
ingls CFU-G) y unidades formadoras de colonias monocitcas (del ingls CFUM). Una vez encaminadas en la va de diferenciacin, las CFUG dan lugar a
mieloblastos, promielocitos, mielocitos, metamielocitos y clulas maduras
(eosinofilos, neutrofilos y basofilos). Mientras que las CFU-M dan lugar a
monoblastos, promonocitos, monocitos, y finalmente macrfagos (Fig. 3). A lo
largo de toda la ruta de diferenciacin, las clulas de linaje mieloide son
reguladas por un amplio nmero de citocinas entre las que se encentran: el
factor estimulador de colonias de granulocitos y monocitos (GM-CSF), el factor
estimulador de colonias de granulocitos (G-CSF), el factor estimulador de
colonias de monocitos (MCSF), la interleucina-3 (IL-3), IL-6 y el factor de clulas
seminales (SCF), entre muchas otras. Los factores estimuladores de colonias
son capaces de inducir la sobrevivencia y proliferacin de clulas progenitoras
hematopoyticas, conducindolas hacia linajes especficos (macrofgico,
megacarioc- tico, neutroflico), dependiendo de la combinacin de factores
empleados. De esta forma, por ejemplo, el G-CSF tiene un efecto ms
especfico para la diferenciacin a linaje granuloctico, en donde, adems de
inducir la diferenciacin, incrementa la funcionalidad de las clulas maduras
(16,17). Aunado a lo anterior, se sabe que citocinas como el SCF y el Flt-3L por
s solos son capaces de estimular el crecimiento de clulas troncales y
progenitoras hematopoyticas, as como de los linajes linfoides y mieloides,
aunque tienden a tener un mayor efecto cuando actan en combinacin con
otros factores de crecimiento, como GM-CSF, IL-3, IL-6, G-CSF, TPO y EPO
(18,19). Cabe mencionar que adems de las citocinas estimuladoras de la
mielopoyesis existe tambin un n- mero considerable de citocinas que la
inhiben, tal y como sucede con el factor de necrosis tumoral- (TNF-), el
factor de crecimiento transformante- (TGF-), la protena inflamatoria de
macrfagos- 1 (MIP-1) y los interferones (IFN), entre otras. Estas molculas
son capaces de disminuir los niveles de clulas troncales y progenitoras
hematopoyticas mediante la inhibicin de su proliferacin; dicha inhibicin
puede ocurrir de manera directa -por inducir la disminucin de la expresin de
receptores de molculas estimuladoras- o a travs del efecto Figura 3
Diferenciacin Mieloide. Los progenitores grnulo-monocito o Unidades
Formadoras de Colonias Grnulo-monocticas (CFU-GM), dan lugar Unidades
Formadoras de colonias Granulocticas (CFU-G) y Unidades Formadoras de
Colonias Mielocticas (CFU-M). Una vez encaminadas en la va de diferenciacin
las CFU-G dan lugar a mieloblastos (MIEL), promielocitos (PM), mielocitos
(MIEL), metamielocitos (MM) y clulas maduras (basfilos, neutrfilos y
eosinfilos). Mientras que las CFU-M dan lugar a monoblastos (MONOB),
promonocitos (PMON), monocitos (MON), y finalmente macrfagos. 100
Hematopoyesis sinrgico entre dos o ms factores, causando un efecto
supresor en la proliferacin y formacin de colonias hematopoyticas (20-22).
Linfopoyesis Tal y como ocurre en la mielopoyesis, la produccin de las clulas
del linaje linfoide (linfocitos B, linfocitos T, clulas NK y algunas categoras de
clulas dendrticas) es un proceso dinmico y complejo, el cual est
determinado por combinaciones de factores intrnsecos y microambientales
que guan la diferenciacin de progenitores linfoides a partir de las clulas
troncales hematopoyticas (23). Definiendo a los Progenitores Linfoides
Tempranos Est bien establecido que la diferenciacin del linaje linfoide
progresa gradualmente en la mdula sea desde progenitores muy primitivos
con potenciales mltiples hasta precursores restringidos que pierden opciones
de diferenciacin en paralelo con una ganancia de funciones especializadas
(23). A lo largo de este progreso la transcripcin del locus de la enzima que
recombina los segmentos genticos VDJ de la inmunoglobulina y del TCR, la
recombinasa RAG1, marca a los progenitores linfoides ms primitivos del ratn,
denominados ELPs (del ingls early lymphoid progenitors) (24,25). Ellos son
tempranos en trminos de marcadores de superficie, factores de transcripcin
en contexto, y tiempo requerido para su diferenciacin, y muestran un
tremendo potencial para generar todas las lneas de clulas linfoides. Siendo
responsables de la mayor produccin de clulas dendrticas plasmacitoides
(pDCs) (26) y contribuyendo a la generacin de las recientemente descritas
clulas dendrticas asesinas productoras de interfern (IKDC) (27), los ELPs dan
origen a los progenitores linfoides comunes o CLPs, que son reconocidos como
los ms eficientes precursores de linfocitos B y clulas NK en la mdula sea
(28,29). Adems, estos progenitores tempranos constituyen uno de los
candidatos ms probables para la colonizacin del timo y la iniciacin de la
linfopoyesis de T en el ratn (30). En la mdula sea y el cordn umbilical del
ser humano una variedad de progenitores multipotentes residen en la fraccin
celular que no expresan en la superficie membranal ningn marcador de clula
sangunea madura, pero expresan molculas CD34. La aparicin de CD10 y de
la enzima desoxinucleotidil-transferasa terminal (TdT) en dichas clulas es
probablemente uno de los eventos iniciales que distinguen a los progenitores
linfoides (31). As mismo, el receptor de quimiocina CXCR4 es sustancialmente
expresado en clulas con actividad precursora linfoide, de tal modo que se
especula que podra ser un marcador distintivo de la contraparte de ELPs del
ratn. Los posibles progenitores linfoides comunes (CLPs) expresan adems el
receptor de interleucina 7 (IL-7), CD38 y CD45RA, y aunque, tanto en cultivo
como in vivo, muestran un potencial residual hacia clulas T, NK y dendr- ticas,
se diferencian principalmente a linfocitos B (32). Por otro lado, clulas que
expresan CD34, CD45RA y CD7, pero no expresan CD10 ni el receptor de IL-7,
son altamente eficientes en la generacin de clulas T y NK (33). Desarrollo de
las Clulas B En la ontogenia, el desarrollo de las clulas B puede ocurrir en el
epiplon y el hgado fetal, mientras que despus del nacimiento se confina
primordialmente a la mdula sea. An cuando la informacin acerca de los
eventos de transicin a partir de los potenciales CLPs a los precursores de
clulas B es muy limitada, se han identificado poblaciones funcionales que
definen la va de diferenciacin ro abajo, iniciando con las clulas B tempranas
CD34+CD19-CD10+ y continuando con pro-B CD34+CD19+CD10+, pre-BI
grandes CD34+CD19+CD10+, pre-BII grandes CD34-CD19+CD10+, pre-BII
peque- as CD34-CD19+CD10+, B inmaduras CD34- CD19+CD10+sIgM+
hasta la produccin de B maduras CD34-CD19+CD10-sIgM+sIgD+, que
eventualmente sern exportadas a los tejidos linfoides perifricos para cumplir
su funcin de reconocimiento de antgeno, activacin y produccin de
anticuerpos especficos. El proceso completo Mayani et al, Cancerologa 2
(2007): 95-107 101 en la mdula sea requiere de la accin concertada de
mltiples factores de transcripcin, incluyendo Ikaros, PU.1, E2A, EBF y Pax-5.
Los dos primeros actan paralelamente en el control de la transicin de las
clulas troncales a progenitores, mientras que E2A, EBF y Pax-5 regulan
secuencialmente el desarrollo de las clulas B tempranas (34). La linfopoyesis
de B en el humano parece cumplirse sin el requerimiento de algunas citocinas
documentadas como esenciales para el proceso en el ratn, como la
interleucina 7, y hasta el momento se desconocen los factores de crecimiento
y/o citocinas que la dirigen. Desarrollo de las Clulas T Debido a que el timo no
produce progenitores de renovacin autloga, la linfopoyesis de T es
mantenida por la importacin peridica de progenitores hematopoyticos a
travs de la corriente sangunea (35), y aunque a mltiples progenitores se les
reconoce cierto potencial para generar clulas T, no todos ellos tienen la
propiedad de establecerse en este rgano. Las bases moleculares de su
entrada no han sido totalmente elucidadas, pero se predice que pudiera ser un
proceso secuencial anlogo al homing de leucocitos, esto es: adhesin dbil al
endotelio vascular mediado por selectinas, sealizacin va quimiocinas,
adhesin fuerte a travs de integrinas, y transmigracin. Al respecto, los
modelos experimentales han mostrado la importancia que CD44, P-selectina y
CCR9 tienen en la colonizacin tmica (36). Los precursores tmicos ms
tempranos (ETP) residen en la poblacin CD34+CD1aCD38loCD44+IL-7R+ y a
partir de ellos se inicia el proceso de compromiso de estadios intermedios de
diferenciacin desde clulas pre-T, clulas inmaduras CD4 uni-positivas
pequeas, clulas CD4 uni-positivas grandes, clulas tempranas doblepositivas (EDP), hasta los timocitos DP CD4+CD8+TCR+, los cuales darn
origen a la diversidad de linfocitos T maduros CD4 y CD8 con capacidad de
reconocimiento de antgeno y activacin. La participacin de algunos factores
de transcripcin en ste proceso ha sido blanco de gran investigacin, y
actualmente es claro que las interacciones de los receptores Notch con sus
ligandos juegan un papel crucial en el control de la diferenciacin y
proliferacin de los precursores tempranos, dirigiendo as las decisiones de
linaje de T en el timo (35), concomitante con la supresin del linaje de B. As
mismo, el balance de la expresin de las protenas E y sus antagonistas
naturales Id est implicado en la diversificacin tmica T/NK (31), y el factor
GATA3 es esencial para el re-arreglo apropiado de genes del receptor de clulas
T. Respecto a la importancia de las citocinas, se conoce que la linfopoyesis de
T es crticamente dependiente de IL-7, lo que ha sido sustentado por la
profunda deficiencia en clulas T (pero no B) que desarrollan los pacientes con
inmunodeficiencia severa combinada por defectos genticos en el gen que
codifica para la cadena c del receptor de IL-7, as como los pacientes
deficientes en IL-7R (31). Desarrollo de Clulas NK Las clulas asesinas
naturales (NK) pueden producirse en mltiples sitios. En el feto se han
encontrado precursores en mdula sea, hgado, timo, bazo y ganglios
linfticos, mientras que en nios y adultos la mdula sea es el sitio
predominante de su desarrollo a partir de progenitores linfoides. Los factores
de transcripcin Id2 y Id3 controlan el desarrollo temprano de las clulas NK,
mientras que los tres estadios que definen el proceso completo -el compromiso
de linaje, la seleccin del repertorio de receptores NK y la maduracin
funcional- son crticamente dependientes de interleucina 15, que mantiene la
viabilidad y sostiene la proliferacin de las clulas en desarrollo (37). Desarrollo
de Clulas Dendrticas A la fecha, el origen hematopoytico del creciente
nmero de poblaciones de clulas dendrticas en el humano est pobremente
definido; sin embargo, la expresin de algunos genes asociados al linaje
linfoide en las clulas plasmacitoides dendrticas (pDCs) sugiere una afiliacin
linfoide en la mdula sea, y datos recientes indican que Notch, en concierto
con 102 Hematopoyesis 1. Regulacin humoral 3. Interaccin Celular 2.
Interaccin a travs de Molculas de la Matriz Extracelular Macrfagos
Fibroblastos Estromales Osteoblastos Adipocitos Nicho + el factor de
transcripcin Spi-B pudieran regular la diversificacin de linaje T/pDC en el timo
(38). Microambiente Hematopoytico La hematopoyesis es un proceso
finamente regulado que se lleva a cabo nicamente en ciertos rganos,
denominados rganos hematopoyticos (saco vitelino, bazo, hgado, mdula
sea). En ellos las clulas hematopoyticas se desarrollan en un ambiente
especfico denominado microambiente hematopoytico (MH) (39,40). El MH
consiste en una estructura tridimensional, altamente organizada, de clulas del
estroma y sus productos (matriz extracelular, citocinas, quimiocinas, entre
otras) que regula la localizacin y fisiologa de las clulas hematopoyticas
(39,41). Clulas del Estroma La palabra estroma deriva del griego que quiere
decir cama y del latn que quiere decir colchn (39), ya que de acuerdo con
la definicin ms antigua se pensaba que las clulas estromales nicamente
provean un soporte fsico para las clulas hematopoyticas. Uno de los
grandes avances para entender la biologa de las clulas del estroma fue el
desarrollo de los cultivos denominados a largo plazo tipo Dexter (42), los cuales
hasta la fecha son un modelo in vitro que permite el crecimiento de clulas
hematopoyticas y estromales de mdula sea por varias semanas (humano) e
incluso meses (ratn) (43). Este tipo de cultivos favorecen el crecimiento de
una capa de clulas estromales, conformada en su mayor parte por fibroblastos
estromales, una proporcin menor de macrfagos y por diferentes tipos
celulares como adipocitos y osteoblastos, los cuales permiten el desarrollo de
las clulas hematopoyticas sin la necesidad de aadir ningn elemento o
citocina exgena al cultivo. A esta capa heterognea de clulas adherentes se
le denomina genricamente como estroma (Fig. 4) (44). Para su estudio, las
clulas estromales pueden ser clasificadas de acuerdo a su origen en dos
componentes: el componente hematopoytico, conformado por los macrfagos
estromales, los cuales derivan de las clulas troncales hematopoyticas, y el
componente mesenquimal, conformado por fibroblastos estromales, adipocitos
y osteoblastos, los cuales derivan de la clula troncal mesenquimal.
Componente Hematopoytico Los macrfagos estromales son los nicos
elementos del estroma que presentan el antgeno CD45. Figura 4
Microambiente Hematopoytico. Esquema representativo de los diferentes
tipos celulares que integran el microambiente hematopoytico y los
mecanismos de regulacin de la hematopoyesis. El microambiente se compone
principalmente de cuatro tipos celulares, macrfagos, fibroblastos estromales,
adipocitos y osteoblastos. El microambiente hematopoytico regula la
proliferacin, sobrevida, maduracin, autorrenovacin y migracin de las
clulas hematopoyticas a travs de tres mecanismos: (1) el humoral, a travs
de la secrecin de citocinas y quimiocinas, (2) la interaccin a travs de matrz
extracelular y (3) el contacto clula-clula a travs de molculas de adhesin y
morfgenos. Dentro del microambiente hematopoytico, los osteoblastos
forman el nicho hematopoytico, regulando a las clulas troncales
hematopoyticas Mayani et al, Cancerologa 2 (2007): 95-107 103 Estas clulas
pueden distinguirse gracias a que expresan molculas especficas como las
molculas del complejo mayor de histocompatibilidad clase II (MHC II), el
antgeno CD14, CD11c y CD68. Los macrfagos estromales son el segundo
componente del estroma ms abundante de la mdula sea y de los cultivos
lquidos a largo plazo (39). Dentro de la mdula sea stos se localizan en
diferentes sitios: como macrfagos centrales en las islas eritroblsticas, en el
endotelio y dispersos entre las clulas hematopoyticas. Estas clulas llevan a
cabo diferentes y muy importantes funciones, regulando la hematopoyesis
mediante interacciones clula clula, y por medio de la secrecin de citocinas
estimuladoras e inhibidoras de la hematopoyesis. Dentro de la variedad de
citocinas producidas por los macrfagos encontramos el factor estimulante de
colonias de macrfagos (FEC-M), de granulocitos y monocitos (FEC-GM),
diversas interleucinas (IL) como la IL-3, la IL-1, la IL-6, IL-8 y el factor de
necrosis tumoral alfa (TNF) (39, 45,46). Componente Mesenquimal El
componente mesenquimal se encuentra conformado por distintos tipos de
clulas que provienen de una clula troncal mesenquimal (47) y que,
dependiendo de los factores que se encuentren en su ambiente, sigue un
determinado patrn de diferenciacin hacia fibroblastos estromales, adipocitos,
y osteoblastos. Estas clulas estromales de origen mesenquimal tienen un
papel fundamental en la regulacin de la hematopoyesis (48). Fibroblastos
Estromales La mayor parte de las clulas estromales CD45- son clulas
vasculares tipo msculo liso, tambin conocidas como clulas reticulares o
fibroblastos estromales o miofibroblastos (39,44,48). Estas clulas presentan
varios marcadores que comparten con las clulas de msculo liso vascular,
como las protenas de citoesqueleto: actina alfa de msculo liso y
metavinculina, entre otras (48). Estas clulas tambin expresan una variedad
de molculas de la matriz extracelular como vimetina, fibronectina, colgena
tipo I, III y IV. En sistemas in vitro se ha demostrado que los fibroblastos
estromales son capaces de mantener la hematopoyesis sin la adicin de
citocinas exgenas, ya que son capaces de sintetizar y secretar citocinas como
la IL-1, 6, 7, 8, 11, FEC-M, FEC-G, el factor de crecimiento de clulas troncales
(SCF) y el interfern-beta (IFN-). Estas molculas actan sobre receptores
especficos en las clulas hematopoyticas, desencadenando cascadas de
sealizacin que modulan la expresin de genes reguladores de proliferacin,
sobrevida, diferenciacin, adhesin y secrecin de citocinas. Los fibroblastos
estromales tambin secretan una variedad de molculas que forman parte de
la matriz extracelular, como fibronectina (49), colgena tipo I y III, heparn
sulfato, cido hialurnico (50) las cuales interactan con las clulas
hematopoyticas gracias a que stas expresan en su superficie una serie de
molculas de adhesin, como VLA-4, VLA-5, L2 integrina y CD44, entre otras
(51,52). Las molculas de matriz extracelular tambin regulan la hemato
S-ar putea să vă placă și
- !SIMPLEMENTE CANTA! - Aprende A - Shadi SparklingDocument134 pagini!SIMPLEMENTE CANTA! - Aprende A - Shadi Sparklingniesy1867% (3)
- HEMATOPOYESISDocument35 paginiHEMATOPOYESISMiguel Angel Santacruz VasquezÎncă nu există evaluări
- Hematopoyesis ArticuloDocument13 paginiHematopoyesis ArticuloMarlene Sinai Melo100% (1)
- MielopoyesisDocument2 paginiMielopoyesisNinna Mariel Novikov NaranjoÎncă nu există evaluări
- 3 Leucopoyesis ResumenDocument4 pagini3 Leucopoyesis ResumenVeruzka PinzonÎncă nu există evaluări
- Resumen HematoDocument6 paginiResumen HematoCatalina MendezÎncă nu există evaluări
- Hematologia Hoffbrand Capitulo 01Document6 paginiHematologia Hoffbrand Capitulo 01Jorge SolisÎncă nu există evaluări
- Cuestionario Hematopoyesis - DDSJEDocument9 paginiCuestionario Hematopoyesis - DDSJEJessica SilvaÎncă nu există evaluări
- Hematopoyesis ResumenDocument4 paginiHematopoyesis ResumenErika Elizabeth Medina ToledoÎncă nu există evaluări
- Desarrollo de La Hematopoyesis en El CuerpoDocument8 paginiDesarrollo de La Hematopoyesis en El CuerpoJose CaballeroÎncă nu există evaluări
- Monocitopoyesis: Formación de monocitos y macrófagosDocument19 paginiMonocitopoyesis: Formación de monocitos y macrófagosMariana TurizoÎncă nu există evaluări
- Sistema HemáticoDocument22 paginiSistema HemáticoAlejandra PaolaÎncă nu există evaluări
- Clase 05 Hematopoyesis Celulas Maduras e InmadurasDocument199 paginiClase 05 Hematopoyesis Celulas Maduras e InmadurasWilliam Apaza MamaniÎncă nu există evaluări
- 1C 02-23 Hematopoyesis y Órganos HematopoyéticosDocument38 pagini1C 02-23 Hematopoyesis y Órganos HematopoyéticosEdward GilÎncă nu există evaluări
- MielopoyesisDocument17 paginiMielopoyesisRodrigo Fernando Fernandez ApazaÎncă nu există evaluări
- Fisiologia de La HematopoyesisDocument16 paginiFisiologia de La HematopoyesisJacqueline López Salazar100% (4)
- HematopoyesisDocument10 paginiHematopoyesisDaniel MuñozÎncă nu există evaluări
- CAPÍTULO 10 - HematopoyesisDocument9 paginiCAPÍTULO 10 - HematopoyesisLaura Daniela Sierra GuevaraÎncă nu există evaluări
- Hematopoyesis DR Franco DR FloresDocument86 paginiHematopoyesis DR Franco DR Floresivanlucavechi24Încă nu există evaluări
- Documento de Sabri Martins G.Document76 paginiDocumento de Sabri Martins G.Majo MachadoÎncă nu există evaluări
- HematopoyesisDocument33 paginiHematopoyesisMarlon RangelÎncă nu există evaluări
- HEMATOPOYESISDocument19 paginiHEMATOPOYESISWendy Marleen Rodriguez GutierrezÎncă nu există evaluări
- LA FORMACIÓN DE CELULAS DE LA SANGREDocument3 paginiLA FORMACIÓN DE CELULAS DE LA SANGRElucianaavilabrunelaÎncă nu există evaluări
- CUADRO_DESCRIPTIVO_DE_LA_HEMATOPOYESIS_RUTH_CAMPA_GRUPO_12_LABORATORIO_CLINICO - copiaDocument4 paginiCUADRO_DESCRIPTIVO_DE_LA_HEMATOPOYESIS_RUTH_CAMPA_GRUPO_12_LABORATORIO_CLINICO - copiaESTEFANIA CAMPAÎncă nu există evaluări
- Factores de Crecimiento Hematopoyéticos e InterleucinasDocument5 paginiFactores de Crecimiento Hematopoyéticos e InterleucinasNatalio Vazquez CruzÎncă nu există evaluări
- Hematopoyesis 1Document29 paginiHematopoyesis 1Sofía JiménezÎncă nu există evaluări
- HematopoyesisDocument26 paginiHematopoyesisDalila TerniÎncă nu există evaluări
- Hematopoyesis: Formación de células sanguíneasDocument9 paginiHematopoyesis: Formación de células sanguíneasOk AmisitaÎncă nu există evaluări
- Hemostasia PrimariaDocument54 paginiHemostasia PrimariaMonserrat Duarte MunozÎncă nu există evaluări
- HEMATOPOYESISDocument154 paginiHEMATOPOYESISadelaÎncă nu există evaluări
- HematopoyesisDocument13 paginiHematopoyesisFernanda Casas ValdezÎncă nu există evaluări
- 02.tema 1 Hematopoyesis-2Document23 pagini02.tema 1 Hematopoyesis-2Angelica Duran100% (1)
- HematopoyesisDocument38 paginiHematopoyesisrobertÎncă nu există evaluări
- ERITROPOYESISDocument6 paginiERITROPOYESISKenny Saavedra CamposÎncă nu există evaluări
- Factor de Crecimiento Estimulante de Colonias de Granulocitos y MacrófagosDocument6 paginiFactor de Crecimiento Estimulante de Colonias de Granulocitos y MacrófagosOlivia CutipaÎncă nu există evaluări
- TrombopoyesisDocument7 paginiTrombopoyesisDome ChávezÎncă nu există evaluări
- Clase 1 Hematopoyesis 2016Document33 paginiClase 1 Hematopoyesis 2016Josefa CasanuevaÎncă nu există evaluări
- HematopoyesisDocument5 paginiHematopoyesisJuan Peña JimenezÎncă nu există evaluări
- Fisiología de La HematopoyesisDocument4 paginiFisiología de La HematopoyesisAdhee VillaRiosÎncă nu există evaluări
- M EDULADocument45 paginiM EDULASofia Vanessa Velázquez Juárez100% (2)
- Hematopoyesis 140321000228 Phpapp02Document32 paginiHematopoyesis 140321000228 Phpapp02Luis Sojo0% (1)
- Resumen HematopoyesisDocument15 paginiResumen HematopoyesisNicko HidalgoÎncă nu există evaluări
- Biotecnología DentalDocument9 paginiBiotecnología DentalRocío Del PilarÎncă nu există evaluări
- HEMATOPOYESIS Resumen KiaraDocument6 paginiHEMATOPOYESIS Resumen KiarakiaraÎncă nu există evaluări
- HematopoyesisDocument9 paginiHematopoyesisISAAC JAEL LOPEZ ORTIZÎncă nu există evaluări
- HematopoyesisDocument19 paginiHematopoyesisJocelyne Calderon PadillaÎncă nu există evaluări
- Compartimientos de Hematopoyesis y Eritropoyesis y Sus Reguladores.Document1 paginăCompartimientos de Hematopoyesis y Eritropoyesis y Sus Reguladores.Donaldo HerreraÎncă nu există evaluări
- Hematopoyesis: Proceso de formación de células sanguíneasDocument26 paginiHematopoyesis: Proceso de formación de células sanguíneasJorge Noceda100% (2)
- Apuntes de HematologíaDocument80 paginiApuntes de HematologíaJosé Manuel López RamírezÎncă nu există evaluări
- Hematopoyesis: Proceso de Formación de Células SanguíneasDocument13 paginiHematopoyesis: Proceso de Formación de Células SanguíneasIvette FloresÎncă nu există evaluări
- Alteraciones de los glóbulos rojos y regulación de la eritropoyesisDocument69 paginiAlteraciones de los glóbulos rojos y regulación de la eritropoyesisFranco CasaliaÎncă nu există evaluări
- Capítulo 7 - HematopoyesisDocument8 paginiCapítulo 7 - HematopoyesisMelina RodriguezÎncă nu există evaluări
- Tema 1 HematopoyesisDocument23 paginiTema 1 HematopoyesisArielCristianUrquizoCallau100% (1)
- HematopoyesisDocument2 paginiHematopoyesisBibi' Olivas100% (1)
- Descripción de Las Celulas de La Linea MieloideDocument5 paginiDescripción de Las Celulas de La Linea MieloideSantiagoMarinRamirezÎncă nu există evaluări
- Informe TrombopoyesisDocument9 paginiInforme TrombopoyesisBrandon Omar Sardan TeranÎncă nu există evaluări
- Guía HematologíaDocument70 paginiGuía HematologíaJacqueline Z MRÎncă nu există evaluări
- Hematopoyesis: Formación de células sanguíneas en la médula óseaDocument20 paginiHematopoyesis: Formación de células sanguíneas en la médula óseaMarco Antonio Sicard arceÎncă nu există evaluări
- Leuco y Eritro - PoyesisDocument20 paginiLeuco y Eritro - PoyesisCarlos MartinezÎncă nu există evaluări
- Función de las plaquetas en el desarrollo tumoralDocument21 paginiFunción de las plaquetas en el desarrollo tumoralRolando CuaÎncă nu există evaluări
- Uso de Derivados del Cannabis en Pacientes con CáncerDe la EverandUso de Derivados del Cannabis en Pacientes con CáncerÎncă nu există evaluări
- Rejuvenecer Con El Plasma Sanguíneo De Los JóvenesDe la EverandRejuvenecer Con El Plasma Sanguíneo De Los JóvenesEvaluare: 5 din 5 stele5/5 (1)
- ProteinasDocument3 paginiProteinasDarwin Mamani Quispe100% (1)
- Lógica ProposicionalDocument5 paginiLógica ProposicionalDarwin Mamani QuispeÎncă nu există evaluări
- Causas y Consecuencias de La ContamDocument6 paginiCausas y Consecuencias de La ContamDarwin Mamani QuispeÎncă nu există evaluări
- Modelos de Carta de SolicitudDocument12 paginiModelos de Carta de SolicitudDarwin Mamani QuispeÎncă nu există evaluări
- SANGRE GeneralidadesDocument5 paginiSANGRE GeneralidadesDarwin Mamani QuispeÎncă nu există evaluări
- El Cultivo Del LiliumDocument9 paginiEl Cultivo Del LiliumDarwin Mamani QuispeÎncă nu există evaluări
- SANGRE GeneralidadesDocument5 paginiSANGRE GeneralidadesDarwin Mamani QuispeÎncă nu există evaluări
- Lilium (Azucena)Document68 paginiLilium (Azucena)Darwin Mamani QuispeÎncă nu există evaluări
- Contaminacion y TurismoDocument25 paginiContaminacion y TurismoLuisÎncă nu există evaluări
- Lilium (Azucena)Document68 paginiLilium (Azucena)Darwin Mamani QuispeÎncă nu există evaluări
- Resuemen de La ContaminacionDocument1 paginăResuemen de La ContaminacionDarwin Mamani QuispeÎncă nu există evaluări
- Efectos de La Contaminacion AtmosfericaDocument13 paginiEfectos de La Contaminacion AtmosfericaJosue Basebed PerezÎncă nu există evaluări
- Contaminacion y TurismoDocument25 paginiContaminacion y TurismoLuisÎncă nu există evaluări
- Contaminacion y TurismoDocument25 paginiContaminacion y TurismoLuisÎncă nu există evaluări
- Anatomía y Fisiología de La GallinaDocument6 paginiAnatomía y Fisiología de La GallinaEdgar Pérez Aparicio100% (6)
- Inervación Del AbdomenDocument51 paginiInervación Del AbdomenUSMP FN ARCHIVOS88% (8)
- El Tejido Epitelial GlandularDocument10 paginiEl Tejido Epitelial GlandularIsis Alondra Isabel Bernaola Quispe100% (1)
- 3 Eso Diver Biología Tema 3 Aparato Respiratorio Apuntes de ClaseDocument6 pagini3 Eso Diver Biología Tema 3 Aparato Respiratorio Apuntes de ClaseJuan Luis MaldonadoÎncă nu există evaluări
- Hipertensión Arterial y Trombosis Venosa ProfundaDocument6 paginiHipertensión Arterial y Trombosis Venosa ProfundaareliÎncă nu există evaluări
- Capitulo 18Document33 paginiCapitulo 18Juan Carlos Segovia VicenteÎncă nu există evaluări
- Envejecimiento Del Sistema EndocrinoDocument4 paginiEnvejecimiento Del Sistema EndocrinoErin Gonzalez VasquezÎncă nu există evaluări
- Sistema NerviosoDocument2 paginiSistema NerviosoNadia Sandoval de SánchezÎncă nu există evaluări
- Arterias y Venas CorporalesDocument29 paginiArterias y Venas CorporalesJofre AlejandroÎncă nu există evaluări
- Disgammaglobulinemia PDFDocument3 paginiDisgammaglobulinemia PDFromerilloÎncă nu există evaluări
- Potencial membrana y acción guión UASDDocument18 paginiPotencial membrana y acción guión UASDArisleidy Quezada MorelÎncă nu există evaluări
- Clasificación de Los Defectos Alveolares CinthiaDocument28 paginiClasificación de Los Defectos Alveolares CinthiaCinthia Lorena Jimenez VazquezÎncă nu există evaluări
- Cuidado Del Sistema Musculo EsqueleticoDocument19 paginiCuidado Del Sistema Musculo Esqueleticonatalia marinÎncă nu există evaluări
- Drenaje Linfatico Modulo 2Document44 paginiDrenaje Linfatico Modulo 2Erika RoblesÎncă nu există evaluări
- Trabajo Práctico 10 - Sistema EndocrinoDocument10 paginiTrabajo Práctico 10 - Sistema EndocrinoAinara zubillaga100% (2)
- HematologiaDocument63 paginiHematologiaJP Anthony FuertesÎncă nu există evaluări
- Periodo Metamórfico - EmbriologíaDocument14 paginiPeriodo Metamórfico - EmbriologíaNatalia Vargas LizardiÎncă nu există evaluări
- CAPÍTULO 80 - Regulación Del Metabolismo Del Calcio, Fósforo y MagnesioDocument27 paginiCAPÍTULO 80 - Regulación Del Metabolismo Del Calcio, Fósforo y MagnesioKchnshd 671Încă nu există evaluări
- Desechos Del Cuerpo Humano en QuechuaDocument5 paginiDesechos Del Cuerpo Humano en QuechuaMrss HelenÎncă nu există evaluări
- Cuadro de CompletacionDocument3 paginiCuadro de Completacionandreads18Încă nu există evaluări
- OVIDUCTODocument19 paginiOVIDUCTOMaritzel RiveraÎncă nu există evaluări
- Aparatos y SistemasDocument1 paginăAparatos y Sistemaserika parapiÎncă nu există evaluări
- INMADocument5 paginiINMAL0u D0uÎncă nu există evaluări
- RM 2022 F3 - UrologíaDocument42 paginiRM 2022 F3 - Urologíakevin camacho gonzalesÎncă nu există evaluări
- Citología ExfoliativaDocument1 paginăCitología ExfoliativaRegina AlpizarÎncă nu există evaluări
- Sistema Nervioso CentralDocument8 paginiSistema Nervioso CentralJacqueline Hernandez HernandezÎncă nu există evaluări
- IgG superficie molecularDocument2 paginiIgG superficie molecularFacundo Horacio Xeling SanchezÎncă nu există evaluări
- Sexualidad (Respuesta Sexual)Document10 paginiSexualidad (Respuesta Sexual)Tercer GraditoÎncă nu există evaluări
- Glosario de Embriología PDFDocument1 paginăGlosario de Embriología PDFAngamaiteÎncă nu există evaluări
- Repaso AnatomiaDocument22 paginiRepaso AnatomialauraÎncă nu există evaluări