Documente Academic
Documente Profesional
Documente Cultură
Métodos de Linealización
Încărcat de
Danny PaulDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Métodos de Linealización
Încărcat de
Danny PaulDrepturi de autor:
Formate disponibile
UNIVERSIDAD TECNICA DE AMBATO
FACULTAD DE CIENCIAS E INGENIERIA EN ALIMENTOS
CARRERA DE INGENIERIA BIOQUIMICA
INGENIERA DE LAS ENZIMAS
Alumnos:
Danny Chango
Fecha:
08/07/2015
Profesor: Ing. Cecilia Carpio
Semestre: Octavo U
TEMA:
VENTAJAS Y DESVENTAJAS DE LOS PARMETROS CINTICOS DE
LINEALIZACIN
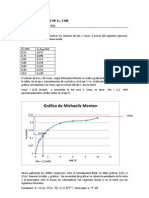
DIAGRAMA DE LINEWEAVER-BURKE
Se emplea como herramienta
grfica
para
calcular
los
parmetros cinticos de una
enzima.
Consiste en que el recproco
de la cintica de MichaelisMenten
es
fcilmente
representable y que de l
emanan mucha informacin de
inters.
La representacin grfica de
Lineweaver-Burk
permite
identificar el Km y Vmax; el
punto de corte con el eje de
ordenadas es el equivalente a
la inversa de Vmax, y el de
abscisas es el valor de -1/Km
Ventajas
Este mtodo se puede aplicar
a la ecuacin de MichaelisMenten
Permite identificar la Km y
Vmax; a partir del punto de
interseccin
El mtodo es muy sencillo y no
requiere
un
software
especfico.
Resulta
fcil
de
evaluar
estadsticamente
Es el nico en el cual las
variables
dependiente
e
independiente
estn
separadas
Desventajas
Este
Mtodo
es
muy
dependientes de la calidad de
los datos de velocidad.
Se
aplican
slo
para
mediciones
de
velocidad
inicial
Los
errores
en
la
determinacin de velocidad a
bajas
concentraciones
de
sustrato se amplifican en este
mtodo , estas distorsiones se
incrementan
en
transformaciones
que
combinan los valores de x y y.
DIAGRAMA DE HANES WOOLF
Se emplea como herramienta grfica para calcular los parmetros
cinticos de una enzima.
Si
multiplicamos
ambos
miembros de la ec. de dobles
inversos, por [S]
OBTENEMOS LA ECUACION
DE HANES-WOOLF.
Pendiente = 1/Vmax
corta en el eje [S]/v en un
punto = Km/Vmax,
Corta en el eje [S] en un
punto = - Km
Ventajas
El error est ms igualmente
distribuido que en grfico de
Lineweaver-Burk
La representacin de Hanes es
preferible
a
otras
linealizaciones de la ecuacin
de Michaelis-Menten.
contiene
la
variable
independiente en el eje Y
(dependiente)
Desventajas
las
variables
no
estn
separadas en este mtodo
obscurece en alguna extensin
la interpretacin de los datos.
DIAGRAMA DE EADIE Y HOFSTEE
Se emplea como herramienta grfica para calcular los parmetros
cinticos de una enzima.
relaciona la velocidad de una
reaccin
con
la
concentracin del sustrato:
multiplica
obtiene
Ventajas
por
Vmax,
se
contiene
la
variable
dependiente en el eje X
(independiente)
permite
visualizar
rpidamente los parmetros
cinticos importantes como
Km y vmax
est menos afectado por el
margen
de
error
que
el
diagrama de Lineweaver-Burke
asigna el mismo peso a todos
los puntos para cualquier
concentracin del sustrato o
velocidad de reaccin
Desventajas
las variables en la ordenada y
en
la
abscisa
no
son
independientes.
ambas
dependen
de
la
velocidad de reaccin
Cualquier error experimental
se manifiesta en ambos ejes.
DIAGRAMA DE INTEGRALES
Se emplea como herramienta grfica para calcular los parmetros
cinticos de una enzima.
Determinacin de los parmetros cinticos es el basado en la
evaluacin de la concentracin de sustrato a travs del tiempo. De
hecho, por integracin de la ecuacin de Michaelis-Menten:
Ventajas
Desventajas
Permite la determinacin de
los parmetros cinticos a
partir de la pendiente e
interceptos del grfico de 1/t
ln(Si/S) vs (Si-S)/t
Este sistema es ms simple
que
el
basado
en
las
mediciones de la velocidad
inicial puesto que solamente
se necesita un experimento.
tiempos cortos de reaccin se
deben usar, especialmente si
la enzima es inestable o est
sujeta a fuerte inhibicin por
producto.
las
condiciones
del
experimento
deben
ser
cuidadosamente escogidas y
controladas
como
para
discriminar cualquier factor
distinto al agotamiento del
sustrato que puede afectar la
actividad de la enzima.
El
experimento
se
debe
conducir
entonces
bajo
condiciones en las cuales la
inactivacin,
inhibicin por
producto y reversibilidad de la
reaccin son despreciables
Fuente:
Eadie,
GS
(1942).
The
Inhibition of Cholinesterase
by
Physostigmine and Prostigmine. Journal of Biological Chemistry
146: 8593.
Voet,D., Voet, J.G. and Pratt, C.W. . 2008. Fundamentals of
Biochemistry. Life at the molecular level. pp. 377-393.
S-ar putea să vă placă și
- Determinaciòn de Los Parámetros Cinéticos de La EnzimaDocument30 paginiDeterminaciòn de Los Parámetros Cinéticos de La EnzimaLeon VásquezÎncă nu există evaluări
- Cinetica KMDocument3 paginiCinetica KMAnahi Pereda Castellanos100% (1)
- Cuestionario P2Document2 paginiCuestionario P2Niggerman Collins100% (1)
- Cultivos Semicontinuos - P2.3Document19 paginiCultivos Semicontinuos - P2.3Juan Carlos Sasintuña0% (1)
- Acido PalmiticoDocument3 paginiAcido PalmiticoDavid Pernia100% (1)
- Quesos Viri PracticaDocument13 paginiQuesos Viri PracticaTann MoralesÎncă nu există evaluări
- PurificaciónDocument6 paginiPurificaciónJUAN DANIEL GIRALDO MUÑOZÎncă nu există evaluări
- Ruta de EntnerDocument2 paginiRuta de Entnerfatycas100% (4)
- 4.2.2 Modelo de Michaellis MenteDocument11 pagini4.2.2 Modelo de Michaellis MenteDiana Akatzukis Gusemëz50% (2)
- Transportadores de Los Azucares A Las LevadurasDocument2 paginiTransportadores de Los Azucares A Las LevadurasElmer Sanchez RamosÎncă nu există evaluări
- Balance Materia en Sistemas de CultivoDocument19 paginiBalance Materia en Sistemas de CultivoWilfredo TullumeÎncă nu există evaluări
- Efecto de La Concentración Del Sustrato Sobre La Velocidad de ReacciónDocument3 paginiEfecto de La Concentración Del Sustrato Sobre La Velocidad de ReacciónCristy López Rivas50% (4)
- Gráficos Cinética Enzimatica - Ventajas y DesventajasDocument1 paginăGráficos Cinética Enzimatica - Ventajas y DesventajasGonzalo Mun50% (2)
- Práctica No.5.4 Efecto de La Concentración de Sustrato Sobre La Velocidad de Reacción e Inhibición EnzimáticaDocument2 paginiPráctica No.5.4 Efecto de La Concentración de Sustrato Sobre La Velocidad de Reacción e Inhibición Enzimáticaagmanti100% (4)
- Caracteristicas de Adsorcion de Gases Por SolidosDocument2 paginiCaracteristicas de Adsorcion de Gases Por SolidosRubenAlejandroSilvaBritoÎncă nu există evaluări
- Cuestionario Practica No.1 Seccion 1 5qm2Document43 paginiCuestionario Practica No.1 Seccion 1 5qm2IvanÎncă nu există evaluări
- Diagrama de EadieDocument1 paginăDiagrama de EadieKely RosmeryÎncă nu există evaluări
- Taller Cinetica EnzimaticaDocument2 paginiTaller Cinetica Enzimaticalaura garcia100% (1)
- Bradford Vs LowryDocument4 paginiBradford Vs LowryMinerva Resendiz Ballado100% (1)
- Estabilidad Del RNAmDocument31 paginiEstabilidad Del RNAmEduardo Mata GonzálezÎncă nu există evaluări
- Separación de Proteínas Por Electroforesis en Gel de PoliacrilamidaDocument12 paginiSeparación de Proteínas Por Electroforesis en Gel de PoliacrilamidaPedro Daniel Benhumea Morales50% (4)
- DEDUCCION DELA ECUACIÓN DE MICHAELIS-MENTEN ... ModificadoDocument10 paginiDEDUCCION DELA ECUACIÓN DE MICHAELIS-MENTEN ... ModificadoDarly Bernabe Rimachi HuamanÎncă nu există evaluări
- Guia Ejercicios Propuestos EnzimologíaDocument7 paginiGuia Ejercicios Propuestos EnzimologíaJairo Quimbita ShadowssÎncă nu există evaluări
- Determinación de Proteínas Por El Método de Lowry y BradfordDocument13 paginiDeterminación de Proteínas Por El Método de Lowry y BradfordRafael Ochoa100% (1)
- Modelo de MonodDocument5 paginiModelo de MonodyenyÎncă nu există evaluări
- Determinacion de Aminoacidos - Metodo de SangerDocument2 paginiDeterminacion de Aminoacidos - Metodo de SangerCarlos ramiresÎncă nu există evaluări
- Problemas de Bioenergética Tarea2017-1Document3 paginiProblemas de Bioenergética Tarea2017-1Mari Fer Pintor OlveraÎncă nu există evaluări
- Para BioquimicaDocument7 paginiPara Bioquimicacristhian10_00Încă nu există evaluări
- Tutorial Calculos de KM y VmaxDocument3 paginiTutorial Calculos de KM y VmaxFrancisca Fuentes100% (1)
- Guia de Ejercicios Cinetica EnzimaticaDocument2 paginiGuia de Ejercicios Cinetica Enzimaticarobert ocrospomaÎncă nu există evaluări
- Correccion Tarea FQ II (Unidad IV)Document4 paginiCorreccion Tarea FQ II (Unidad IV)Michelle GarcíaÎncă nu există evaluări
- Informe AloeVeraDocument9 paginiInforme AloeVeraAlex Salazar MedinaÎncă nu există evaluări
- Bib1 U1 Ea JormDocument5 paginiBib1 U1 Ea JormJavier RangelÎncă nu există evaluări
- Laboratorio 2 StaphylococcusDocument13 paginiLaboratorio 2 StaphylococcusMassiel ZuritaÎncă nu există evaluări
- Mètodo Del SulfitoDocument6 paginiMètodo Del SulfitoAllan PgÎncă nu există evaluări
- APLICACIÓN KLaDocument2 paginiAPLICACIÓN KLaClau BecerrilÎncă nu există evaluări
- Problemas Cinetica EnzimaticaDocument9 paginiProblemas Cinetica EnzimaticamichypaoÎncă nu există evaluări
- I. Seminarios Cinética EnzimáticaDocument7 paginiI. Seminarios Cinética EnzimáticaLaura Célix100% (1)
- HDT 1. Bioenergetica y Metabolismo - RespuestasDocument3 paginiHDT 1. Bioenergetica y Metabolismo - RespuestasBenighted_Soul100% (1)
- Velocidad de Dilucion Cultivo Continuo PDFDocument2 paginiVelocidad de Dilucion Cultivo Continuo PDFLuis TapiaÎncă nu există evaluări
- Ejercicios Cinética Michaelis MentenDocument2 paginiEjercicios Cinética Michaelis MentenDavid Esteban Soler Camargo100% (1)
- Taller de Reacciones de Aldehidos y Cetonas CJYDDocument4 paginiTaller de Reacciones de Aldehidos y Cetonas CJYDCarmen DíazÎncă nu există evaluări
- Sintesis de MelaninaDocument10 paginiSintesis de MelaninaJesus Octavio Sepulveda CamachoÎncă nu există evaluări
- Practica 10. Fermentación AlcohólicaDocument4 paginiPractica 10. Fermentación AlcohólicajuanÎncă nu există evaluări
- Plantilla Práctica 1Document13 paginiPlantilla Práctica 1María DelgadoÎncă nu există evaluări
- Potencial NormalDocument8 paginiPotencial Normaladriana lizeth arzate guillenÎncă nu există evaluări
- SUSTRATO E INHIBIDOR PrácticaDocument5 paginiSUSTRATO E INHIBIDOR PrácticaAngel E. RockÎncă nu există evaluări
- Bioquimica WordDocument3 paginiBioquimica WordDaniela Valencia LópezÎncă nu există evaluări
- 7 Cinética EnzimáticaDocument10 pagini7 Cinética EnzimáticaKath RodríguezÎncă nu există evaluări
- Articulo BioqDocument14 paginiArticulo BioqKevin Torres ValenciaÎncă nu există evaluări
- Cinética de MichaelisDocument3 paginiCinética de MichaelisRenzo Abrahan Rodriguez MendezÎncă nu există evaluări
- Cinética de MichaelisDocument2 paginiCinética de MichaelisAdrianyela TeixeiraÎncă nu există evaluări
- Diapositivas de Métodos Matemáticos para Calcular Parámetros CinéticosDocument30 paginiDiapositivas de Métodos Matemáticos para Calcular Parámetros CinéticosMirella Corina Vargas GòmezÎncă nu există evaluări
- Semana 7 - Cinética Del Crecimiento CelularaDocument7 paginiSemana 7 - Cinética Del Crecimiento CelularaGT NoemÎncă nu există evaluări
- Dinámica de FluidosDocument8 paginiDinámica de FluidosRussell Guzman MÎncă nu există evaluări
- P3 S KM VmaxDocument2 paginiP3 S KM VmaxEdson DiazÎncă nu există evaluări
- Determinación de Los Parámetros Cinéticos de Una EnzimaDocument14 paginiDeterminación de Los Parámetros Cinéticos de Una EnzimaYonel VillanuevaÎncă nu există evaluări
- Trabajo Alterno ZIMOGRAMADocument5 paginiTrabajo Alterno ZIMOGRAMAMaría PérezÎncă nu există evaluări
- Modelos Cinetica EnzimaticaDocument4 paginiModelos Cinetica EnzimaticaDui Dui Dui DuiÎncă nu există evaluări
- #1 Regresión Lineal SimpleDocument5 pagini#1 Regresión Lineal SimpleCAMILO JOS€ BERNAL RODRIGUEZÎncă nu există evaluări
- Frutas SupleDocument3 paginiFrutas SupleDanny PaulÎncă nu există evaluări
- CV (JL - Burguera)Document39 paginiCV (JL - Burguera)Danny PaulÎncă nu există evaluări
- CV (JL - Burguera)Document39 paginiCV (JL - Burguera)Danny PaulÎncă nu există evaluări
- Deber Ejercicios Sobre Actividad InhibDocument3 paginiDeber Ejercicios Sobre Actividad InhibDanny PaulÎncă nu există evaluări
- Valorizacion de ResiduosDocument7 paginiValorizacion de ResiduosDanny PaulÎncă nu există evaluări
- La Sintesis de Proteina Microbiana en El Rumen y Su Importancia para Los RumiantesDocument5 paginiLa Sintesis de Proteina Microbiana en El Rumen y Su Importancia para Los RumiantesMaria Quimbayo AcostaÎncă nu există evaluări
- Características de La Planta y FenologíaDocument6 paginiCaracterísticas de La Planta y FenologíaNathaly W. León PelaézÎncă nu există evaluări
- Práctica#12-Análisis de Bilirrubina Total y DirectaDocument5 paginiPráctica#12-Análisis de Bilirrubina Total y DirectaJohana Calderon Manzanillas100% (1)
- Problemática Ambiental MoqueguaDocument10 paginiProblemática Ambiental MoqueguaHekart Charahua100% (4)
- Esponjas Clase CalcáreaDocument18 paginiEsponjas Clase CalcáreaPaulina CastroÎncă nu există evaluări
- Secuencia Yoga PDFDocument4 paginiSecuencia Yoga PDFAndreaVangÎncă nu există evaluări
- Bleichmar, S. (2006) Paradojas en La Constitucion Sexual Masculina. en Bleichmar, S. Paradojas de La Sexualidad MasculinaDocument9 paginiBleichmar, S. (2006) Paradojas en La Constitucion Sexual Masculina. en Bleichmar, S. Paradojas de La Sexualidad MasculinaMartinaÎncă nu există evaluări
- Caso Clinico - TVTDocument16 paginiCaso Clinico - TVTDiana Patricia Molano PerezÎncă nu există evaluări
- Riesgos Ocupacionales PDFDocument6 paginiRiesgos Ocupacionales PDFDiana Cecilia Cruz GuzmanÎncă nu există evaluări
- Plan Sanamiento Basico V0Document80 paginiPlan Sanamiento Basico V0Roselvira Arias ZaaÎncă nu există evaluări
- Ecorregiones PerúDocument16 paginiEcorregiones PerúRosa de AméricaÎncă nu există evaluări
- CLASE 1a - RELACIÓN HOSPEDERO-PARÁSITO 2022Document29 paginiCLASE 1a - RELACIÓN HOSPEDERO-PARÁSITO 2022almendra hinostrozaÎncă nu există evaluări
- Taller de Sistema RespiratorioDocument2 paginiTaller de Sistema RespiratorioAnonymous WJRL9I100% (1)
- Manual Trima PDFDocument110 paginiManual Trima PDFMarcos Andres Espinoza Mendez80% (5)
- La Hoja de CocaDocument11 paginiLa Hoja de CocaMArisol Huaman100% (2)
- Sufrimiento Fetal-Renata GarciaDocument24 paginiSufrimiento Fetal-Renata GarciaAna UrbinaÎncă nu există evaluări
- + Manual de Procedimientos y Funciones Del Servicio de Alimentacion PDFDocument38 pagini+ Manual de Procedimientos y Funciones Del Servicio de Alimentacion PDFOSCAR DANIEL BOLIVAR VASQUEZ100% (3)
- PLACENTADocument15 paginiPLACENTAKarina Cruz FernándezÎncă nu există evaluări
- CASOSDocument3 paginiCASOSAngi Fiorella Yupanqui Piñas0% (1)
- Diencefalo y Telencefalo 20231128 112033 0000Document6 paginiDiencefalo y Telencefalo 20231128 112033 0000Matias ValenzuelaÎncă nu există evaluări
- GuiaCompleta 62011014 2023Document44 paginiGuiaCompleta 62011014 2023CERROHOS_Încă nu există evaluări
- Reporte Pract 4Document8 paginiReporte Pract 4Diego MéndezÎncă nu există evaluări
- Triptico Autorizacion Sanitaria Almacenamiento Sustancias PeligrosasDocument2 paginiTriptico Autorizacion Sanitaria Almacenamiento Sustancias PeligrosasCami AyalaÎncă nu există evaluări
- Tarea 6 de Organizacion de Grupos y EventoDocument10 paginiTarea 6 de Organizacion de Grupos y EventoEdward MardalenoÎncă nu există evaluări
- La CelulaDocument63 paginiLa CelulaArleen SalinasÎncă nu există evaluări
- Syllabus Bases Neurobiologicas Del AprendizajeDocument105 paginiSyllabus Bases Neurobiologicas Del AprendizajeKary Sol Castillo VelasquezÎncă nu există evaluări
- Op-14 S PinoDocument73 paginiOp-14 S PinoOsir Daygor VidalÎncă nu există evaluări
- Cuestionario Un Milagro de Lorenzo PDFDocument4 paginiCuestionario Un Milagro de Lorenzo PDFKiara Brighith La Rosa GomezÎncă nu există evaluări
- Genes ModificadoresDocument2 paginiGenes ModificadoresAleeh AvilaÎncă nu există evaluări
- Ap14 Ufv PDFDocument2 paginiAp14 Ufv PDFdeandaevaÎncă nu există evaluări