Documente Academic
Documente Profesional
Documente Cultură
Demostración de La Curva de Vapor de Presión Del Agua
Încărcat de
Miriam Monteith HartDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Demostración de La Curva de Vapor de Presión Del Agua
Încărcat de
Miriam Monteith HartDrepturi de autor:
Formate disponibile
DEMOSTRACIN DE LA CURVA DE PRESIN VAPOR DE
DEL AGUA
OBJETIVO
Determinar la curva de presin de vapor del agua
HIPTESIS
Inicialmente se plante la hiptesis de que la curva que tendra no sera de manera lineal si
no sera exponencialmente de tomando en cuenta los cambios de fase que presenta la
temperatura y el vapor.
INTRODUCCIN
Las molculas de la superficie de un lquido, debido a la energa cintica que poseen,
pueden escapar del lquido penetrando en el espacio que se halla sobre l. No todas
consiguen escapar, slo aquellas que poseen suficiente energa cintica. Este fenmeno se
conoce con el nombre de vaporizacin. Las molculas del vapor formado sobre la
superficie del lquido retornan a su vez al ser captadas por las molculas de la superficie
hasta que se alcanza el equilibrio. El vapor ejerce en este momento una presin sobre el
lquido conocida como presin de vapor saturante. Para cada temperatura existe una
determinada presin de vapor saturante. La presin de vapor aumenta con la temperatura.
Cuando la formacin de vapores tiene lugar en la atmsfera gaseosa recibe el nombre de
evaporacin. Al evaporarse un lquido pierde energa y por tanto se enfra. La energa
calorfica necesaria para evaporar 1 kg. de un lquido a temperatura constante se denomina
"calor de vaporizacin". La ebullicin es una forma especial de vaporizacin en la que no
slo se desprenden molculas de la superficie sino tambin del interior del lquido. Un
lquido e bulle o hierve a aquella temperatura en que su presin de vapor saturante es igual
a la atmosfrica; en consecuencia, un aumento de presin exterior trae consigo una
elevacin del punto de ebullicin. Por ejemplo, el agua sometida a una presin atmosfrica
normal de 1 atm hierve a 100 C, a una presin de 10 atm hierve a 180 C, etc.
TEORA
Cualquier sustancia puede existir en ms de un estado o fase de la materia. El equilibrio
entre las fases es dinmico; esto es, que existe una transferencia contina de partculas de
una fase a la otra. El equilibrio en este sistema dinmico se presenta cuando la velocidad de
transferencia entre las fases es similar. El cambio de la materia de un estado a otro se
denomina cambio de fase. Las conversiones de un slido a lquido (fusin), de un slido a
gas (sublimacin), o de un lquido a gas (vaporizacin) son todos procesos endotrmicos;
es decir, que la entalpa de la fusin, sublimacin o vaporizacin es positiva. El proceso
inverso, la conversin de un lquido a slido (congelacin), de un gas a
slido (deposicin) o de un gas a lquido (condensacin) son todos procesos exotrmicos,
en esta forma los cambios de entalpa para estos procesos son negativos.
El estado fsico de una sustancia depende no slo de las fuerzas de atracciones
intermoleculares inherentes, sino tambin de la temperatura y la presin. Ahora que hemos
examinado cada estado, podemos concluir nuestra discusin considerando la temperatura y
la presin a la cual las diferentes fases de una sustancia pueden existir. Tal informacin se
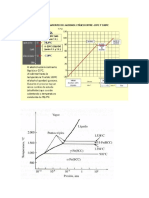
puede resumir en un diagrama de fase. La forma general para este tipo de diagramas para
una sustancia simple que presenta tres fases es muy similar a la del agua, la cual se
representa por la figura 1
Este diagrama contiene tres curvas importantes,
cada una de las cuales representa la condicin de
temperatura y presin a la cual las diferentes fases
pueden coexistir en equilibrio. La lnea de B a C
es la curva de la presin de vapor del lquido.
Representa el equilibrio entre las fases lquida y
gaseosa a diferentes temperaturas. Esta curva
termina en C, el punto crtico. La temperatura en
este punto es la Temperatura crtica; la
temperatura arriba de la cual la sustancia no
puede existir como lquido est relacionada con la
presin que se le aplique. A esta temperatura las
fases lquidas y gaseosas se vuelven
Figura 1 (Diagrama de Fase Vapor-Temperatura)
indistinguibles. La presin a temperatura crtica
es la presin crtica. Ms all del punto crtico la sustancia se describe como un lquido
supercrtico. El punto en la curva BC en donde el equilibrio de la presin de vapor es 1 atm,
es por supuesto el punto de ebullicin normal de la sustancia.
La lnea AB representa la variacin en la presin de vapor del slido en funcin de la
temperatura.
La lnea de B a D representa el cambio en el punto de fusin del slido con el aumento de
presin. Esta lnea se inclina ligeramente hacia la derecha a medida que la presin aumenta;
la mayora de los slidos se expanden por encima de su punto de fusin y aumentando la
presin se favorece la formacin de la fase slida ms densa.
El punto B, donde se juntan las tres curvas, se conoce como punto triple. Este punto se da
cuando la presin de vapor de la forma slida de una sustancia es igual a la presin de
vapor de sus estado lquido, las tendencias a escapar (fugacidades) de los dos estados son
idnticas. En este caso, no hay tendencia a cambiar de un estado a otro, y ambos estados
pueden existir juntos en equilibrio con su vapor, durante un periodo indefinido de tiempo.
Esto ocurre si:
La temperatura es constante y
la grfica de log P contra 1/T para el slido, produce una lnea que intersecta
la lnea de una grfica anloga para el estado lquido. El punto de
interseccin es el punto triple.
PRESIN DE VAPOR
Las presiones de vapor de los lquidos aumentan en proporcin no lineal en relacin con la
temperatura. La ebullicin se presenta cuando la presin de vapor iguala a la presin que se
ejerce externamente. El punto normal de ebullicin es la temperatura a la cual la presin de
vapor del lquido es igual a 1 atm.
MTODO EXPERIMENTAL
Para realizar la comprobacin de la curva de presin de vapor del agua se utiliz un aparato
de vapor de alta presin (Figura 2) en cual se procedio a
S-ar putea să vă placă și
- Dependencia Del Vapor Del Agua Con La TemperaturaDocument20 paginiDependencia Del Vapor Del Agua Con La TemperaturaPaulÎncă nu există evaluări
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDe la EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesÎncă nu există evaluări
- R1600H Manual de Operación y MantenimientoDocument234 paginiR1600H Manual de Operación y MantenimientoCesar Miguel Gallardo Torrel50% (2)
- Curso Termodinamica de Las Sustancia PurasDocument32 paginiCurso Termodinamica de Las Sustancia PurasMonica Cornejo GonzalezÎncă nu există evaluări
- Guía de Estudio - Parte 3Document33 paginiGuía de Estudio - Parte 3Juan Jay CasalÎncă nu există evaluări
- Comport A Mien To PVT de Sustancias PurasDocument8 paginiComport A Mien To PVT de Sustancias Puraspaisa solo paisa100% (2)
- Presion de Vapor-IntroduccionDocument6 paginiPresion de Vapor-IntroduccionRubi Nieto UgarteÎncă nu există evaluări
- Sustancias Puras VariablesDocument6 paginiSustancias Puras VariablesNacho CortezÎncă nu există evaluări
- Cambios de FasesDocument26 paginiCambios de Fasesmediciones ssmaÎncă nu există evaluări
- Termodinámica y Cinetica Capitulo 5Document27 paginiTermodinámica y Cinetica Capitulo 5diegoÎncă nu există evaluări
- Equilibrio L VDocument8 paginiEquilibrio L Vcarlina hernandezÎncă nu există evaluări
- Curva de CoexistenciaDocument5 paginiCurva de CoexistenciaMariano HernandezÎncă nu există evaluări
- Comportamiento de HenryDocument4 paginiComportamiento de HenryVeronica Estefania CabezaÎncă nu există evaluări
- Entalpia de Sustancias PurasDocument38 paginiEntalpia de Sustancias PurasWilber X Siempre50% (2)
- Diagrama de FasesDocument26 paginiDiagrama de FasesGianfranco Romero MendezÎncă nu există evaluări
- Presión de VaporizaciónDocument2 paginiPresión de VaporizaciónVictor Hugo Valdez GallosoÎncă nu există evaluări
- Presion de VaporDocument3 paginiPresion de VaporjhairÎncă nu există evaluări
- Termodinamica2 Final PDFDocument6 paginiTermodinamica2 Final PDFHl ObÎncă nu există evaluări
- Presión de VaporDocument3 paginiPresión de VaporHumberto Romero CuroÎncă nu există evaluări
- DiagramasDocument7 paginiDiagramasESTHER ISABEL CEBALLOS PORTILLOÎncă nu există evaluări
- Guia 3 Sustancia Pura 2018Document10 paginiGuia 3 Sustancia Pura 2018Ivanny NaranjoÎncă nu există evaluări
- Clase Diagrama de Fases GeronesDocument25 paginiClase Diagrama de Fases Geronesgenaradolores texeiraÎncă nu există evaluări
- IntroducciónDocument20 paginiIntroducciónAevorg IrodnocÎncă nu există evaluări
- Fisico QuimicaDocument17 paginiFisico QuimicaGianfranco Yucra RojasÎncă nu există evaluări
- Resumen Capítulo 3 - Yunus CengelDocument9 paginiResumen Capítulo 3 - Yunus CengelMiguelAngelGha100% (3)
- Ensayo de Termodinámica 112-135Document5 paginiEnsayo de Termodinámica 112-135damianÎncă nu există evaluări
- 04 Presion de VaporDocument14 pagini04 Presion de VaporMauricio Montaño SaavedraÎncă nu există evaluări
- Presión de VaporizaciónDocument4 paginiPresión de VaporizaciónVictor Hugo Valdez GallosoÎncă nu există evaluări
- Fundameto Teorico Presion de VaporDocument5 paginiFundameto Teorico Presion de VaporSmithAnthonyBlasMÎncă nu există evaluări
- Material de Estudio - IIM504Document237 paginiMaterial de Estudio - IIM504pedroÎncă nu există evaluări
- Cambios de FaseDocument5 paginiCambios de Faseluciamoriconi19Încă nu există evaluări
- Presión de VaporDocument6 paginiPresión de VaporYonathan ArevaloÎncă nu există evaluări
- Trabajo Practico - Punto de EbullicionDocument11 paginiTrabajo Practico - Punto de Ebullicionjulio032125Încă nu există evaluări
- Método para Determinar Presión de Vapor y Sistemas Gas LíquidoDocument9 paginiMétodo para Determinar Presión de Vapor y Sistemas Gas LíquidoRocio RojasÎncă nu există evaluări
- Diagramas Presion-VolumenDocument3 paginiDiagramas Presion-VolumenJose Ignacio RCÎncă nu există evaluări
- PRESIÓN DE VAPOR (Lunes 7 NOVIEMBRE 2022)Document9 paginiPRESIÓN DE VAPOR (Lunes 7 NOVIEMBRE 2022)EliGaby MoralesÎncă nu există evaluări
- Sustancias PurasDocument73 paginiSustancias PurasMiliana LPÎncă nu există evaluări
- Estado LiquidoDocument24 paginiEstado LiquidoRodrigo Miranda LlanosÎncă nu există evaluări
- Resumen Capitulo 3 Cengel 8 EdicionDocument13 paginiResumen Capitulo 3 Cengel 8 EdicionpepepepeÎncă nu există evaluări
- Temperatura de Ebullición y de RocíoDocument2 paginiTemperatura de Ebullición y de RocíoRodolfo LuisÎncă nu există evaluări
- Influencia de La Temperatura en La Presion de Vapor 1Document13 paginiInfluencia de La Temperatura en La Presion de Vapor 1Sandy Vanessa CardenasÎncă nu există evaluări
- Sustancia PurasDocument14 paginiSustancia PurasRossy CarÎncă nu există evaluări
- Teoría 3 - Equilibrios FísicosDocument6 paginiTeoría 3 - Equilibrios FísicosMiguel HerreraÎncă nu există evaluări
- Practica 5 (Determinación Experimental de La Presión de Vapor de Un Líquido Puro)Document8 paginiPractica 5 (Determinación Experimental de La Presión de Vapor de Un Líquido Puro)Omar Cremer100% (3)
- Unidad 2 TermodinamicaDocument10 paginiUnidad 2 TermodinamicaFilix QMÎncă nu există evaluări
- Antecedent EsDocument4 paginiAntecedent EsAndres CruzÎncă nu există evaluări
- Soluciones LiquidasDocument13 paginiSoluciones LiquidasJhon Henry Silvestre Bazan100% (1)
- Maaaaaaaaardeeeeto Resumen PDFDocument24 paginiMaaaaaaaaardeeeeto Resumen PDFmiguelÎncă nu există evaluări
- Ensayo de Comportamiento de Fase de Los HidrocarburosDocument16 paginiEnsayo de Comportamiento de Fase de Los HidrocarburosLuis CulebroÎncă nu există evaluări
- VibracionesDocument13 paginiVibracionesRicaardo CastellanossÎncă nu există evaluări
- Punto Triple Del AguaDocument4 paginiPunto Triple Del AguaEdgar Vinicio MonteroÎncă nu există evaluări
- Sustancias PurasDocument7 paginiSustancias PurasCarlosCarrilloÎncă nu există evaluări
- Presion de VaporDocument4 paginiPresion de VaporDe Sangre Azul YTÎncă nu există evaluări
- Unidad I - Sustancias PurasDocument38 paginiUnidad I - Sustancias PurasJeremy CastilloÎncă nu există evaluări
- Comportamiento Cualitativo Sistema Bifasico de HCsDocument29 paginiComportamiento Cualitativo Sistema Bifasico de HCsJoel Alejandro Troncos MartosÎncă nu există evaluări
- Diagramas de FaseDocument19 paginiDiagramas de FaseKleyjarh CorreaÎncă nu există evaluări
- TermodinamicaDocument5 paginiTermodinamicaMarco SánchezÎncă nu există evaluări
- Tema 3 Propiedades de Una Sustancia PuraDocument29 paginiTema 3 Propiedades de Una Sustancia Puradiana gÎncă nu există evaluări
- La Prensa HidráulicaDocument8 paginiLa Prensa HidráulicaViktor SeanÎncă nu există evaluări
- Sujeto Inclusión y Diferencia.-161-241Document81 paginiSujeto Inclusión y Diferencia.-161-241Miriam Monteith HartÎncă nu există evaluări
- 1 PBDocument24 pagini1 PBjoignacio0% (1)
- DOF - Diario Oficial de La FederaciónDocument14 paginiDOF - Diario Oficial de La FederaciónMiriam Monteith HartÎncă nu există evaluări
- Polis 7792Document9 paginiPolis 7792Colibri De FuegoÎncă nu există evaluări
- L.S. Vygotsky - La Imaginacion y El Arte en La InfanciaDocument56 paginiL.S. Vygotsky - La Imaginacion y El Arte en La InfanciaGustavo Soto Cid100% (1)
- Volnovich. Los Complices Del Silencio LIBRO COMPLETODocument82 paginiVolnovich. Los Complices Del Silencio LIBRO COMPLETOMiriam Monteith HartÎncă nu există evaluări
- Sujeto Inclusión y Diferencia.-1-80Document80 paginiSujeto Inclusión y Diferencia.-1-80Miriam Monteith HartÎncă nu există evaluări
- Violencia Estructural y Buenas IntencionDocument22 paginiViolencia Estructural y Buenas IntencionMiriam Monteith HartÎncă nu există evaluări
- Dialnet InfanciaYDiscapacidadElDerechoAUnaEducacionInclusi 3649006Document8 paginiDialnet InfanciaYDiscapacidadElDerechoAUnaEducacionInclusi 3649006Paula TuozzoÎncă nu există evaluări
- Sujeto Inclusión y Diferencia.-161-241Document81 paginiSujeto Inclusión y Diferencia.-161-241Miriam Monteith HartÎncă nu există evaluări
- Sujeto Inclusión y Diferencia.-242-320Document79 paginiSujeto Inclusión y Diferencia.-242-320Miriam Monteith HartÎncă nu există evaluări
- TeornumDocument14 paginiTeornumMiriam Monteith HartÎncă nu există evaluări
- Intervención Grupal e Investigación. Margarita BazDocument77 paginiIntervención Grupal e Investigación. Margarita BazMiriam Monteith HartÎncă nu există evaluări
- Sujeto Inclusión y Diferencia.-81-160Document80 paginiSujeto Inclusión y Diferencia.-81-160Miriam Monteith HartÎncă nu există evaluări
- Numreal 25 AbrilDocument28 paginiNumreal 25 AbrilMÎncă nu există evaluări
- Una Nueva Visión de La Célula ProcariotaDocument9 paginiUna Nueva Visión de La Célula ProcariotaMiriam Monteith HartÎncă nu există evaluări
- Contexto de EstudioDocument2 paginiContexto de EstudioMiriam Monteith HartÎncă nu există evaluări
- Meca 1 Escobar Figueroa RicardoDocument5 paginiMeca 1 Escobar Figueroa RicardoMiriam Monteith HartÎncă nu există evaluări
- FísicaDocument2 paginiFísicaMiriam Monteith HartÎncă nu există evaluări
- Física 2 Hugo Medina GuzmánDocument249 paginiFísica 2 Hugo Medina GuzmánMuzito_Diego82% (22)
- Teoria General de La ImagenDocument34 paginiTeoria General de La Imagenlady83sbÎncă nu există evaluări
- Numeros ComplejosDocument10 paginiNumeros ComplejosBryan PerezÎncă nu există evaluări
- PapiroflexiaDocument4 paginiPapiroflexiaMiriam Monteith HartÎncă nu există evaluări
- TermodinamicaDocument2 paginiTermodinamicaMiriam Monteith HartÎncă nu există evaluări
- Sistema de Fuerzas Que Se Encuentra en Equilibrio Con Tres Masas DisitintasDocument2 paginiSistema de Fuerzas Que Se Encuentra en Equilibrio Con Tres Masas DisitintasMiriam Monteith HartÎncă nu există evaluări
- Lista 2Document2 paginiLista 2Miriam Monteith HartÎncă nu există evaluări
- Movimiento Rectilíneo Uniforme 2Document36 paginiMovimiento Rectilíneo Uniforme 2Milton Patricio Moreano BÎncă nu există evaluări
- Lista 2Document2 paginiLista 2Miriam Monteith HartÎncă nu există evaluări
- Problemas CursoDocument25 paginiProblemas CursoOchoa Jara BrayanÎncă nu există evaluări
- Difusividades - Resumen UntDocument86 paginiDifusividades - Resumen UntskuÎncă nu există evaluări
- Liquidos Penetrantes CAP I II RotaricaDocument30 paginiLiquidos Penetrantes CAP I II RotaricakarlambÎncă nu există evaluări
- Plan de ClasesDocument11 paginiPlan de ClasesElizabeth martinez50% (2)
- Teoria de SedimentaciónDocument7 paginiTeoria de SedimentaciónMiguel SantosÎncă nu există evaluări
- Capilaridad-2012-2Document12 paginiCapilaridad-2012-2Van SanchezÎncă nu există evaluări
- TERMINOLOGÍADocument17 paginiTERMINOLOGÍAJeffersonAsanzaÎncă nu există evaluări
- Fuerza Ejercida Por Un Líquido Sobre Una Superficie PlanaDocument3 paginiFuerza Ejercida Por Un Líquido Sobre Una Superficie PlanaDaniel EusseÎncă nu există evaluări
- Curva de CalibracionDocument5 paginiCurva de CalibracionXavi VelezÎncă nu există evaluări
- Mecanismos de DesplazamientosDocument14 paginiMecanismos de DesplazamientosKatherine Pinto OrdoñezÎncă nu există evaluări
- Mecanica SuelosDocument394 paginiMecanica SuelosJennifer FloydÎncă nu există evaluări
- ECUASALDocument8 paginiECUASALAbby AcostaÎncă nu există evaluări
- Labo 6 - ViscosidadDocument27 paginiLabo 6 - ViscosidadAngelo SalvatoreÎncă nu există evaluări
- Bombas y CompresoresDocument40 paginiBombas y CompresoresCosmo GalletaÎncă nu există evaluări
- Medicina Legal - Resumen FinalDocument25 paginiMedicina Legal - Resumen FinalLuciana BattipiedeÎncă nu există evaluări
- Material de LaboratorioDocument4 paginiMaterial de LaboratorioDeirdre L. CraneÎncă nu există evaluări
- Lubricantes y GrasasDocument6 paginiLubricantes y GrasasJorge ReynaÎncă nu există evaluări
- Manual de Instrucciones Manual de Instrucciones: IPL1000T-1ES2.pdf IPL1000T-1ES2 PDFDocument166 paginiManual de Instrucciones Manual de Instrucciones: IPL1000T-1ES2.pdf IPL1000T-1ES2 PDFIng. Ariel CordobaÎncă nu există evaluări
- Guía Fuerza de Empuje UTP PDFDocument4 paginiGuía Fuerza de Empuje UTP PDFElizabeth Lucero HCÎncă nu există evaluări
- Ruiz Stephani Diagrama HidráulicoDocument4 paginiRuiz Stephani Diagrama HidráulicoDiánelis OcampoÎncă nu există evaluări
- 2.6 PropiedadesDocument2 pagini2.6 PropiedadesUrias Garay Jose EduardoÎncă nu există evaluări
- Transductores de CaudalDocument11 paginiTransductores de Caudalfausto_tapia4067Încă nu există evaluări
- Evaporador Pelicula DescendenteDocument15 paginiEvaporador Pelicula DescendenteCarlos Avila GonzalesÎncă nu există evaluări
- Lunes 22 A Viernes 26Document18 paginiLunes 22 A Viernes 26JULISSA SOTO CHAHUAÎncă nu există evaluări
- Tema 2 - Quimica - ALUMNOSDocument99 paginiTema 2 - Quimica - ALUMNOSKelly Johana Melendez ZapataÎncă nu există evaluări
- 07PP - Esfuerzo y Deformaciones - Rigido - KENSLABSDocument25 pagini07PP - Esfuerzo y Deformaciones - Rigido - KENSLABSAdriánÁvilaSarmientoÎncă nu există evaluări
- Informe de ViscosidadDocument9 paginiInforme de ViscosidadPamela KarenÎncă nu există evaluări
- Sesión 1 - IA1-2020-1Document50 paginiSesión 1 - IA1-2020-1LIZ MILAGROS BURGA CAROÎncă nu există evaluări
- UNIDAD I Empuje y FlotacionDocument26 paginiUNIDAD I Empuje y FlotacionJorge PinargoteÎncă nu există evaluări
- Mecanica de Fluidos Con Aplicaciones en LabVIEW-ResumenDocument105 paginiMecanica de Fluidos Con Aplicaciones en LabVIEW-ResumenWilber Pinares100% (2)