Documente Academic
Documente Profesional
Documente Cultură
Reporte8.-Inmovilizacion de Enzima Xilanasa Usando Alginato de Sodio
Încărcat de
Albo Josué Hernández RojasDescriere originală:
Titlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Reporte8.-Inmovilizacion de Enzima Xilanasa Usando Alginato de Sodio
Încărcat de
Albo Josué Hernández RojasDrepturi de autor:
Formate disponibile
UNIVERSIDAD AUTONOMA DE QUERETARO || FACULTAD DE QUIMICA
INGENIERIA EN BIOTECNOLOGIA
INMOVILIZACIN DE XILANASA
Albo Josu Hernndez Rojas
Ingeniera en biotecnologa, Universidad Autnoma de Quertaro, albojosuehr@outlook.es
Fernando Olvera Martnez
Ingeniera en biotecnologa, Universidad Autnoma de Quertaro, fert_om2@yahoo.com.mx
Natalia Garca Orihuela
Ingeniera en biotecnologa, Universidad Autnoma de Quertaro, naty1095@hotmail.com
RESUMEN: La inmovilizacin sobre enzimas es una aplicacin que mejora alguna de las cualidades durante
la obtencin de un producto, como es la reutilizacin de las enzimas, mejora su estabilidad y separacin del
producto para volver a ser usadas. En la presente prctica se realiz la inmovilizacin de la enzima Xilanasa
usando el alginato de sodio como medio de soporte, formando esferas que retienen a las enzimas, se realiz
el ensayo la actividad enzimtica comparando la enzima libre frente a la inmovilizada, as como tambin los
residuos de enzima no inmovilizados, se calcul el porcentaje de eficiencia, actividad recuperada y
rendimiento, y se obtuvieron los siguientes resultados respectivamente 153.631, 52.298 y 34.042, tambin se
cuantificaron la concentracin de enzima en mg/L que se tena en las esferas de alginato, la enzima libre y en
los residuos no inmovilizados y los resultados fueron los siguiente respectivamente 2.156 mg/mL, 0.124
mg/mL y 0.195 mg/mL. Logramos una efectiva inmovilizacin de la enzima xilanasa en soporte de alginato
de sodio, con una alta eficiencia, esto se traduce en que se puede reusar la enzima por varios ciclos.
PALABRAS CLAVE: Alginato de sodio, cloruro de calcio, encapsulacin, inmovilizacin, Xilanasa,
Xilano.
ABSTRACT: The immobilization of enzymes is one of the applications that improves the qualities of the
extraction of the product, such as the reuse of the enzymes, stability and isolation of the product to be used
again. The present paper presents the immobilization of the Xylanase using sodium alginate and calcium
chlorine, producing spheres that retain the enzyme. An enzyme activity assay was performed to determine the
activity in the free enzyme, in the immobilized and in the waste- To evaluate the immobilization three
concepts were evaluated obtaining the following results: 153.631% efficiency, 52.298% recovered activity
and 34.042% yield. In order to get these parameters, the amount of protein was quantified in the alginate
spheres, the free enzyme and in the wastes, 2.156 mg/mL, 0.124 mg/mL and 0.195 mg/mL.respectively. Met
effective immobilization of the xylanase enzyme in sodium alginate support, with high efficiency, this means
that the enzyme can be reused for several cycles.
KEY WORDS: sodium alginate, calcium chlorine, spherification, immobilization, xylanase, xylan.
UNIVERSIDAD AUTONOMA DE QUERETARO || FACULTAD DE QUIMICA
INGENIERIA EN BIOTECNOLOGIA
INTRODUCCIN
cadena polimrica como la carga y volumen de los
grupos carboxlicos confieren al gel formado
caractersticas
de flexibilidad o rigidez
dependiendo del contenido en G. Si en su
estructura polimrica se tiene mayor cantidad de
G-bloques, generalmente el gel es fuerte y frgil,
mientras que con la presencia de mayor proporcin
de M-bloques el gel formado se presenta suave y
elstico. El proceso de gelificacin ocurre en
presencia de cationes multivalentes (excepto el
magnesio) donde el in calcio es el ms empleado
por la industria alimentaria. La gelificacin tiene
lugar al producirse una zona de unin entre un Gbloque de una molcula de alginato que se enlaza
fsicamente a otro Gbloque contenido en otra
molcula de alginato a travs del in calcio [3].
En los ltimos aos, la biotecnologa ha
experimentado grandes avances y, paralelamente
sus aplicaciones industriales en la obtencin de
productos qumicos, en la industria alimentaria y
farmacutica. Los procesos catalizados por
enzimas en la industria son cada da ms
numerosos, ya que presentan una serie de ventajas
frente a los catalizadores convencionales no
biolgicos, ya que presentan una alta actividad
enzimtica, especificidad, son muy activos a
tempera tura ambiente y a presin atmosfrica, sin
embargo a pesar de estas ventajas, el uso de
enzimas no se ha generalizado en los procesos
industriales debido a que no son estables en las
condiciones de trabajo y la separacin de las
enzimas despus de obtenido el producto es difcil.
Una solucin frente a este problema es la
inmovilizacin enzimtica al ser un proceso
biotecnolgico econmico y rentable [1].
Con el objetivo de familiarizarse con la
inmovilizacin de enzimas, as como calcular la
eficacia de la inmovilizacin a travs de tres
parmetros: rendimiento, eficiencia, y actividad
recuperada, se trabajar con xilanasa, alginato de
sodio y cloruro de calcio.
METODOLOGA
Diversas tcnicas para la inmovilizacin de
clulas han sido propuestas. Reciente el uso de
trampas de geles de polisacridos o encapsulacin
se han convertido en un mtodo desafiante. Y el
uso de esferas de gel de alginato se destaca como
el mtodo ms prometedor y verstil todava [2].
Inmovilizacin de la enzima
En un vaso de precipitado se mezclaron 15 mL
de una solucin de alginato de sodio (40 g/L) con
15 mL de una solucin de la enzima xilanasa (1%
Peso
/Volumen) en un amortiguador de acetatos 0.1 M
(pH 5), de esta mezcla se tomaron alcuotas con
una jeringa tipo insulina de 6 mL para poder hacer
pequeas gotas esta mezcla, que se dejaron caer en
una solucin de CaCl2 0.4M, con esto se lograron
la creacin de esferas de la mezcla de alginato de
sodio (40 g/L) y de la enzima xilanasa (1%
Peso
/Volumen), ya que se han formado las esferas se
retiraron de la solucin de CaCl2 0.4M, despus se
lavaron con el amortiguador de acetatos (pH 5), se
retir el exceso de amortiguador con papel
El alginato es un hidrocoloide que posee
propiedades
gelificantes,
estabilizantes
y
espesantes, razones por las cuales ha sido de gran
inters para la industria alimentaria. El alginato es
descrito como un polisacrido lineal polinico e
hidroflico proveniente de algas marinas
conformado por dos monmeros en su estructura,
el cido -L-gulurnico (G) y el cido -Dmanurnico (M) que se distribuyen en secciones
constituyendo homopolmeros tipo G-bloques (GGG-), M-bloques (-MMM-) o heteropolmeros
donde los bloques M y G se alternan (-MGMG-).
Tanto la distribucin de sus monmeros en la
2
UNIVERSIDAD AUTONOMA DE QUERETARO || FACULTAD DE QUIMICA
INGENIERIA EN BIOTECNOLOGIA
absorbente o una toalla de papel, despus se
volvieron a lavar con el amortiguador de acetatos
y nuevamente se retir el exceso de amortiguador,
se asegur que las esferas estn completamente
secas. Este proceso se repiti para una mezcla de
alginato de sodio (20 g/L) pero sin mezclar con
enzimas, se obtuvieron esferas solo de alginato de
sodio.
tomaron 500 L de la mezcla de enzima-sustrato y
se trasvasaron a un tubo Eppendorf y a este se le
agregaron 500 L del reactivo de DNS se volvi a
incubar durante 10 minutos, pero a 100C, se hizo
por triplicado la cuantificacin de azucares
reductores. Por ltimo, se midi la absorbancia a
570 nm.
Ensayo enzimtico para la enzima residual
Nota: Para conseguir que las esferas fueran
similares en tamao se presion la jeringa con
fuerza constante, esto fue necesario para poder
hacer pruebas posteriormente.
En un tubo de ensayo con 700 L del
amortiguador de acetatos, se le agregan 200 L del
sustrato (Xilano 1%) y 100 L de la enzima que
est mezclado con el alginato de sodio y el CaCl 2
y que no se esterifico, se incub a 50C durante 10
minutos, pasado el tiempo de incubacin se
tomaron 500 L de la mezcla de enzima-sustrato y
se trasvasaron a un tubo Eppendorf y a este se le
agregaron 500 L del reactivo de DNS, se volvi a
incubar durante 10 minutos 100C, , se hizo por
triplicado la cuantificacin de azucares
reductores.. Por ltimo, se midi la absorbancia a
570 nm. Se calcul la actividad con la curva de
calibracin para DNS (Figura 1). Y se utilizaron
las formulas del anexo para calcular los
porcentajes de actividad recuperada, rendimiento y
eficiencia
Ya obtenidas las esferas, tanto de alginato de
sodio con la enzima, como las de alginato de sodio
solas, se procede a pesar 20 esferas de cada
mezcla, y as calcular el peso promedio de cada
esfera.
Ensayo enzimtico para la enzima libre
En un tubo de ensayo con 700 L del
amortiguador de acetatos, se le agregan 200 L del
sustrato (Xilano 1%) y 100 L de la enzima, se
incub a 50C durante 10 minutos, pasado el
tiempo de incubacin se tomaron 500 L de la
mezcla de enzima-sustrato y se trasvasaron a un
tubo Eppendorf y a este se le agregaron 500 L del
reactivo de DNS, se volvi a incubar durante 10
minutos 100C, el ensayo se hizo por triplicado.
Por ltimo, se midi la absorbancia a 570 nm. Se
calcul concentracin de xilosa con la curva de
calibracin para DNS y la absorbancia obtenida
(figura 1).
Concentracin de la enzima
En una microplaca se agreg en un pocillo 100
L de la enzima libre con 100 L del reactivo de
Bradford. Se midi 595 nm. Este proceso se
repiti para medir la concentracin de la enzima
inmovilizada y para el residual, pero para estos se
tomaron 0.1 g con 100 L del reactivo de
Bradford. Se utiliz la curva de calibracin para
Bradford (Figura 2) para calcular la concentracin
en mg/mL.
Ensayo enzimtico para la enzima inmovilizada
En un tubo de ensayo con 700 L del
amortiguador de acetatos, se le agreg 200 L del
sustrato (Xilano 1%) y 0.5 g de la enzima
inmovilizada, se incub a 50C durante 10
minutos pasado el tiempo de incubacin se
Determinacin
de
efectividad
inmovilizacin de la enzima
3
de
la
UNIVERSIDAD AUTONOMA DE QUERETARO || FACULTAD DE QUIMICA
INGENIERIA EN BIOTECNOLOGIA
La efectividad de la inmovilizacin se determin a
travs de tres parmetros:
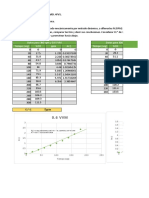
Tabla 2. Absorbancias obtenidas para la curva de
calibracin de Bradford
Concentracin ABS1
ABS2
ABS
[mg/ml]
de
promedio
protena
0.125
0.15
0.143
0.1465
0.25
0.212
0.25
0.231
0.375
0.288
0.276
0.282
0.5
0.291
0.32
0.3055
Porcentaje de actividad recuperada (%AR)
%AR= [(Activad observada de la enzima libre) /
(activad
observada
de
la
enzima
inmovilizada)]*100
Porcentaje de rendimiento (%R)
La curva de calibracin para azucares reductores
por el mtodo de DNS tiene una correlacin lineal
de 0.9885 y para la curva de calibracin de
Bradford esta correlacin lineal es de 0.9373.
%R= [(actividad observada de la enzima libre actividad de los residuos)/ (actividad observada de
la enzima libre)]*100
Eficiencia (E)
Curva de calibracin para azcares reductores por DNS
Absorbancia = 0.02465 + 0.1584 [mM]
E= [(activad observada de la enzima inmovilizada)
/ (actividad observada de la enzima libre actividad de los residuos)]
1.4
Absorbancia
Con la concentracin en mM del Xilano y la
absorbancia promedio de la tabla 1 se obtuvo la
curva de calibracin para DNS (Figura 1). Para
hacer la curva de calibracin para Bradford (figura
2) se utiliz la concentracin en mg/mL de la
enzima y la absorbancia que estn en la tabla 2.
0.6495
1.055
1.064
1.0595
1.341
1.275
1.308
10
1.571
1.543
1.557
0.8
0.4
0.2
1
10
Concentracin mM de Xilosa
Figura 1. Curva de calibracin del DNS con Xilano.
Eje de las ordenas es la absorbancia y eje de las
abscisas es la concentracin del azcar reductor.
Curva de calibracin para protenas por el metdo de Bradford.
Absorbancia = 0.1093 + 0.4224 [mg/mL]
0.325
S
R-Sq
R-Sq(adj)
0.300
0.0215876
93.7%
90.6%
0.275
Absorbancia
0.672
1.0
0.6
Tabla 1. Absorbancias obtenidas para la curva de
calibracin de DNS
Concentraci Absorbanci Absorbanci Absorbanci
n Mm de
a1
a2
a Promedio
Xilosa
2
0.301
0.303
0.302
0.627
0.0624315
98.8%
98.5%
1.2
RESULTADOS
S
R-Sq
R-Sq(adj)
1.6
0.250
0.225
0.200
0.175
0.150
0.1
0.2
0.3
0.4
0.5
Concentracion en mg/mL de proteina
Figura 2. Curva de calibracin de Bradford con la
enzima xilanasa. Eje de las ordenadas es la absorbancia
y eje de las abscisas es la concentracin de la enzima.
UNIVERSIDAD AUTONOMA DE QUERETARO || FACULTAD DE QUIMICA
INGENIERIA EN BIOTECNOLOGIA
Con la absorbancia promedio se calcul la
actividad observada utilizando la curva de
calibracin para DNS (Figura 1) en la enzima
libre, inmovilizada y la residual, estos datos se
encuentran la tabla 3.
En la tabla 6 se expresa la actividad que es la
cantidad de sustrato expresada en nkat que es la
cantidad de nanomoles de producto por segundo
que se obtiene y la actividad especifica que es la
cantidad de micromoles de producto que se
obtiene por minuto por cada miligramo de enzima
que se tiene en el medio.
Tabla 3. Absorbancias y concentracin de xilosa y
actividad enzimtica.
Muestra
Libre
Inmovilizada
c/enzima
Residuos
inmovilizados
no
AB
S1
0.18
2
0.14
3
0.12
6
AB
S2
0.18
6
0.04
6
0.12
6
AB
S3
0.16
7
0.12
6
0.12
6
AB
Sp
0.17
8
0.10
5
0.12
6
[mM]
Xilosa
0.971
de
Tabla 6. Actividad enzimtica de Xilanasa
Actividad (nkat)
0.508
especifica
0.640
Para obtener la concentracin de la enzima libre,
inmovilizada y el residual se utiliz la curva de
calibracin para Bradford (figura 2). De acuerdo a
lo resultados (ver tabla 5), la inmovilizacin hace
que la enzima se concentre 11 veces comparada
con la enzima libre, por lo que concuerda con el
aumento de la eficiencia en la enzima
inmovilizada.
Unidades
nmol/s
mol/(min*mg)
Libre
1.617
0.782
E. Inmovilizada
0.846
0.023
Residuos
1.067
0.388
Con la activad observada se calcularon los
porcentajes de actividad recuperada que fue del
52.3%, que es la relacin entre la actividad
observada de la enzima libre y la enzima
inmovilizada, se tiene un 34% de rendimiento con
la inmovilizacin, con una eficiencia del 153.6%
comparando la enzima inmovilizada y la enzima
libre (Tabla 7).
Tabla 4. Cuantificacin de la concentracin de protena
por medio de Bradford.
Absorbancia
Concentracin
Muestra
(mg/ml)
0.162
0.124
Enzima
Libre
0.192 0.195
Residual
1.02 2.156
Enzima inmovilizada
Tabla 7. Propiedades de la inmovilizacin.
Como se observa en la tabla 5 las esferas del
alginato de calcio sin la enzima pesa el doble que
con enzima.
Tabla 5. Pesos de las esferas de la enzima
el alginato sin enzima.
Sin enzima
25
Cantidad de perlas
0.5
Peso (g)
Actividad
%Actividad recuperada
52.298 %
% Rendimiento
34.042 %
%Eficiencia
153.631 %
DISCUSIN
El alginato de sodio es un polisacrido aninico, es
decir que contiene iones con carga elctrica
negativa [4]. Su estructura (C6H7NaO6)n se
muestra en la figura 3, donde se observa la
presencia de los iones de sodio.
inmovilizada y
Con enzima
50
0.5
UNIVERSIDAD AUTONOMA DE QUERETARO || FACULTAD DE QUIMICA
INGENIERIA EN BIOTECNOLOGIA
Figura 4. Proceso de formacin delas esferas al
entrar en contacto el alginato de sodio con el
cloruro de calcio.
Figura 3. Estructura del alginato de sodio, donde se
CONCLUSIONES
observa la presencia de sodio (Na).
Se logr el objetivo de la prctica al obtener los
tres parmetros; rendimiento, eficacia y actividad
recuperada, que determinan la efectividad de la
inmovilizacin de xilanasa realizada. A pesar de
que no se logr una inmovilizacin muy eficaz, la
enzima que s se inmoviliz present un alto grado
de actividad reflejado en la eficiencia del 153%.
Cuando el alginato de sodio mezclado con la
enzima, xilanasa, entra en contacto con el cloruro
de calcio, los iones de sodio en el alginato de sodio
son sustituidos por los iones de Calcio (2+),
formando as enlaces diferentes en el alginato. El
calcio es capaz de formar dos enlaces, mientras
que el sodio solo puede formar uno. Este proceso
se observa en la figura 4.
AGRADECIMIENTOS
Agradecemos a la Academia de Biotecnologa por
brindar el espacio y las instalaciones necesarias
para llevar a cabo este trabajo. Tambin
agradecemos al Dr. Aldo Amaro Reyes el apoyo
brindado al proporcionar equipo, material y
reactivo, indispensable para la obtencin de los
resultados aqu presentados. Agradecemos a los
miembros de la sesin por la compra del alginato
de sodio as como de las jeringas utilizadas.
Debido a esta interaccin, la rigidez del gel
depender del tiempo que estn en contacto as
como la concentracin del cloruro de calcio, que
en este caso fue de 0.4M, es decir de la cantidad
de iones de calcio disponibles en el medio [5].
Como se muestra en la tabla 4, se observa un
rendimiento del 34.04% de inmovilizacin y una
porcentaje de eficacia de 153.6%, lo que significa
que no se realiz una efectiva inmovilizacin pero
la enzima que se logr inmovilizar tiene una alta
actividad, que se demuestra en el porcentaje de
eficiencia, aunque sta solo represente el 52.2% de
la actividad de la enzima libre, es decir el
parmetro que representa la actividad recuperada
[6].
BIBLIOGRAFIA
[1] Arroyo M. Inmovilizacin de enzimas.
Fundamentos, mtodos y aplicaciones. Madrid.
Departamento de bioqumica y biologa molecular
I Facultad de Ciencias Biolgicas, (1998).
[2] Lupo-Pasin B., Gonzales Azon C., Maestro
Garriga A. Microencapsulacin con alginato en
UNIVERSIDAD AUTONOMA DE QUERETARO || FACULTAD DE QUIMICA
INGENIERIA EN BIOTECNOLOGIA
alimentos. Tcnicas y aplicaciones. Revista VCyTA
2012; 1: 130-151
disueltos en 40 mL de agua destilada) y se
disuelven en 200 mL de agua destilada.
[3] Olav-Smidsrod & Skjak-Braek G., Alginate as
inmobilization matrix for cells. Revista TIBTECH
1990; 8:71-74
Formulas
[4] Garibay M., Quintero R., Lpez-Mungua A.
Biotecnologa alimentaria. Editorial Limusa. 1963.
Absorbancia = 0.1584[mM] + 0.0246
[5] Waldman, AS, Schechinger, L, Govindarajoo,
G, Nowick, JS, Pignolet. The alginate
demonstration: polymers, food science, and ion
exchange. Journal of Chemical Education. 1998.
[6] Sheeldon R. Van Pelt S. Enzyme
immobilisation in biocatalysis: why, what and
how. Chem Soc Rev. RSC Publishing. 2013.
ANEXOS
Preparacin de las soluciones
100 mL de Alginato de calcio (40 g/L) en
Amortiguador de acetatos 0.1M pH 5
Se pesaron 4 g de alginato de calcio y se aforaron
a 100mL con el amortiguador de acetatos
200 mL de cloruro CaCl2 (0.4M)
11.7584 g de cloruro de calcio di hidratado se
mezclan y aforar a 200mL con agua destilada
200 mL Amortiguador de acetatos 0.1 M
en cloruro de sodio 0.5 M
Mezclar 1.7548g de acetato de sodio, 0.40 mL de
cido actico concentrado y 5.8440g de cloruro de
sodio y aforar a 200 mL
Ecuacin de la curva de DNS
200 ml del reactivo de DNS
En un matraz de 200 mL se mezclan 0.2g de cido
3,5-dinitrosalicilico, 60g de tartrato de sodio y
potasio y 40 mL de NaOH 4M (5.2g de NaOH
Ecuacin de la curva de Bradford
Absorbancia = 0.4224 [ ] + 0.1093
S-ar putea să vă placă și
- 1 - Biología Molecular y CitogenéticaDocument24 pagini1 - Biología Molecular y CitogenéticaElisa Baena0% (1)
- Seminario Iv-V BiotecnologiaDocument2 paginiSeminario Iv-V Biotecnologialuis fernando muro cordovaÎncă nu există evaluări
- Maria Moreira (Taller 1)Document11 paginiMaria Moreira (Taller 1)Maria Jose MoreiraÎncă nu există evaluări
- PraÌEctica 10-Estudio Del Equilibrio QuiÌEmico en Una ReaccioÌEn HomogeÌEneaDocument2 paginiPraÌEctica 10-Estudio Del Equilibrio QuiÌEmico en Una ReaccioÌEn HomogeÌEneaLeslie Maria QuintanaÎncă nu există evaluări
- Guia de Ejercicios 5 (Cultivo Continuo) 1Document2 paginiGuia de Ejercicios 5 (Cultivo Continuo) 1sebastianscribd2014Încă nu există evaluări
- Entrega 4. Simulación SuperProDocument6 paginiEntrega 4. Simulación SuperProcamila andrea rengifo mejiaÎncă nu există evaluări
- Difusion +ebull+condensDocument4 paginiDifusion +ebull+condensZhakaDeVirgoÎncă nu există evaluări
- Examen Final Quimica Analitica 2016 IDocument4 paginiExamen Final Quimica Analitica 2016 IwildanÎncă nu există evaluări
- Guia Laboratorio Inmovilizacion Alfa-AmilasaDocument4 paginiGuia Laboratorio Inmovilizacion Alfa-AmilasaFAUSTO GABRIEL YEPEZ CALDERON100% (1)
- 4efecto de La Actividad Enzimática de Inulinasas Usando Metales MG y Co Como Posibles Activador o Inhibidor Utilizando Kluyveromyces MarxianusDocument8 pagini4efecto de La Actividad Enzimática de Inulinasas Usando Metales MG y Co Como Posibles Activador o Inhibidor Utilizando Kluyveromyces MarxianusEnrique GomezÎncă nu există evaluări
- Experim.6 NeutralizaciónDocument5 paginiExperim.6 NeutralizaciónJose Gabriel Navarro GallegosÎncă nu există evaluări
- Clase 19-20 CromatografiaDocument19 paginiClase 19-20 CromatografiaJean Piero Bocanegra0% (1)
- ING Biorreactores Mezclado, Trans Calor y MasaDocument2 paginiING Biorreactores Mezclado, Trans Calor y MasaDaniel Alberto Velázquez VillarrealÎncă nu există evaluări
- Oxidación Anaerobia y La Desnitrificación Organotrofica en Presencia de P-Cresol.Document31 paginiOxidación Anaerobia y La Desnitrificación Organotrofica en Presencia de P-Cresol.Roberto Gallegos GuerreroÎncă nu există evaluări
- Pre-Trat. AR-BMDocument45 paginiPre-Trat. AR-BMFiorela FloresÎncă nu există evaluări
- Bioprocesos CuestionarioDocument7 paginiBioprocesos CuestionarioDaniel LoorÎncă nu există evaluări
- Serie 5 Balance de Materia y EnergíaDocument5 paginiSerie 5 Balance de Materia y EnergíaSalvador ZúñigaÎncă nu există evaluări
- Resultados p4Document6 paginiResultados p4Juan Emanuel VGÎncă nu există evaluări
- Guía de Ejercicios #1 Balances de Masa en BioprocesosDocument7 paginiGuía de Ejercicios #1 Balances de Masa en BioprocesosCatalina Zamora AstudilloÎncă nu există evaluări
- Determinación de Azúcares Reductores Por El Método DNSDocument9 paginiDeterminación de Azúcares Reductores Por El Método DNSlindaÎncă nu există evaluări
- Entrega FinalDocument19 paginiEntrega FinalAngie Patricia Oviedo SaucedoÎncă nu există evaluări
- 1.-Presentación Bioseparaciones MecanicasDocument22 pagini1.-Presentación Bioseparaciones MecanicasJesy MezaÎncă nu există evaluări
- ProblemasDocument7 paginiProblemasJuce ChipanaÎncă nu există evaluări
- PrroblemasDocument2 paginiPrroblemasEdwar MarquezÎncă nu există evaluări
- Termodinámica Ii Equilibrio Líquido Vapor en Un Sistema No IdealDocument8 paginiTermodinámica Ii Equilibrio Líquido Vapor en Un Sistema No Idealyael vazquezÎncă nu există evaluări
- El Punto IsoeléctricoDocument9 paginiEl Punto IsoeléctricoDainer SalgadoÎncă nu există evaluări
- Práctica 6Document5 paginiPráctica 6Rodrigo Manuel Bravo PachecoÎncă nu există evaluări
- Sedimentadores DiscontinuosDocument16 paginiSedimentadores DiscontinuosJANY VILELAÎncă nu există evaluări
- Conjunta 3P MergedDocument103 paginiConjunta 3P MergedJenny S-boomÎncă nu există evaluări
- Informe Fermentacion ModDocument6 paginiInforme Fermentacion ModAngela D Cortés DomínguezÎncă nu există evaluări
- Pruebas Colorimétricas para AnfetaminasDocument3 paginiPruebas Colorimétricas para AnfetaminasMonika OlguinÎncă nu există evaluări
- Curva de Crecimiento para Hongos No Filamentosos FungusDocument5 paginiCurva de Crecimiento para Hongos No Filamentosos Fungusluz lopezÎncă nu există evaluări
- Tarea 3 SeguridadDocument12 paginiTarea 3 SeguridadAlejandra Fabiola CadenasÎncă nu există evaluări
- Laboratorio 2 StaphylococcusDocument13 paginiLaboratorio 2 StaphylococcusMassiel ZuritaÎncă nu există evaluări
- Práctica 3 Disminución de La Acidez Del Jugo de Limón Por Cromatografía de Intercambio IónicoDocument5 paginiPráctica 3 Disminución de La Acidez Del Jugo de Limón Por Cromatografía de Intercambio IónicoMARISOL GOMEZ ROBLESÎncă nu există evaluări
- Ruptura CelularDocument30 paginiRuptura CelularRonald HernandezÎncă nu există evaluări
- Laboratorio de BioconversionesDocument29 paginiLaboratorio de BioconversionesDevi SweetÎncă nu există evaluări
- Velocidad de Cremiento Aspergillus NigerDocument1 paginăVelocidad de Cremiento Aspergillus NigerWilliam Andres AgudeloÎncă nu există evaluări
- Gravimetría de Neutralización Informe AnaliticaDocument9 paginiGravimetría de Neutralización Informe AnaliticajoseÎncă nu există evaluări
- Cálculo de KLA Por Método DinámicoDocument7 paginiCálculo de KLA Por Método DinámicoGirard GarciaÎncă nu există evaluări
- Reacciones MultisustratoDocument12 paginiReacciones MultisustratoKarla Alejo GonzalezÎncă nu există evaluări
- Biosintesis de DesoxirribonucleotidosDocument23 paginiBiosintesis de DesoxirribonucleotidosingristabÎncă nu există evaluări
- Carne 2Document5 paginiCarne 2Hernan Huaynates PerezÎncă nu există evaluări
- OBTENCION DE JABONES A PARTIR DE GRASAS ANIMALES y VEGETALESDocument7 paginiOBTENCION DE JABONES A PARTIR DE GRASAS ANIMALES y VEGETALESAxel ColinÎncă nu există evaluări
- Cultivos Semicontinuos - P2.3Document19 paginiCultivos Semicontinuos - P2.3Juan Carlos Sasintuña0% (1)
- Problemas Ponchon Savarit Metodo Grafico Equipo 6Document19 paginiProblemas Ponchon Savarit Metodo Grafico Equipo 6Irma MartínezÎncă nu există evaluări
- Tarea 3 Absorbancia Corregida UVVEDocument4 paginiTarea 3 Absorbancia Corregida UVVEJoel CarrascoÎncă nu există evaluări
- Biorremediación AnilinaDocument2 paginiBiorremediación AnilinaManuel MendozaÎncă nu există evaluări
- Práctica No.2 AnaliticaDocument9 paginiPráctica No.2 AnaliticaLeonardo De la CruzÎncă nu există evaluări
- Prod de B Carotenos y Callo SemiDocument29 paginiProd de B Carotenos y Callo SemiDiego OcampoÎncă nu există evaluări
- Tema 2 Filtracion Operaciones UnitariasDocument24 paginiTema 2 Filtracion Operaciones UnitariasCoral DiazÎncă nu există evaluări
- EjemploDocument4 paginiEjemploHamilton0% (1)
- 11 RendimientosDocument7 pagini11 RendimientosLalix Lee50% (2)
- Trabajo 1 Profesor Elvin. Procesos IndustrialesDocument7 paginiTrabajo 1 Profesor Elvin. Procesos Industrialesleyser david100% (1)
- Ejercicio 3 y 4Document4 paginiEjercicio 3 y 4Papeleria Punto mobileÎncă nu există evaluări
- Tunel de SecadoDocument7 paginiTunel de SecadoIsabella GonzalezÎncă nu există evaluări
- Coeficiente de RepartoDocument6 paginiCoeficiente de RepartoGrace VeraÎncă nu există evaluări
- Taller Cinética Enzimática Básica y Biorreactores Enzimáticos-IngAlimDocument7 paginiTaller Cinética Enzimática Básica y Biorreactores Enzimáticos-IngAlimJulio Cesar Concejal VerdeÎncă nu există evaluări
- Aravena, Cisternas. 2014 Inmovilización de Alcalasa para Su Uso en La Hidrólisis de Proteina de Suero de Leche.Document5 paginiAravena, Cisternas. 2014 Inmovilización de Alcalasa para Su Uso en La Hidrólisis de Proteina de Suero de Leche.Felipe Cisternas IbarraÎncă nu există evaluări
- Practicas de Biotecnologia1Document26 paginiPracticas de Biotecnologia1edurangobÎncă nu există evaluări
- Reporte 2 EnzimologiaDocument8 paginiReporte 2 EnzimologiaArturo PeñablassiÎncă nu există evaluări
- Resultados Potencia GaseadaDocument10 paginiResultados Potencia GaseadaAlbo Josué Hernández RojasÎncă nu există evaluări
- Una Historia de La Biotecnologia VegetalDocument22 paginiUna Historia de La Biotecnologia VegetalAlbo Josué Hernández RojasÎncă nu există evaluări
- P4. Transfeccion pGLODocument3 paginiP4. Transfeccion pGLOAlbo Josué Hernández RojasÎncă nu există evaluări
- Reporte1. Determinación Cualtitativa de Algunas Enzimas TipicasDocument7 paginiReporte1. Determinación Cualtitativa de Algunas Enzimas TipicasAlbo Josué Hernández RojasÎncă nu există evaluări
- Metodologia EnzimaticaDocument2 paginiMetodologia EnzimaticaAlbo Josué Hernández RojasÎncă nu există evaluări
- Untitled 1Document6 paginiUntitled 1Albo Josué Hernández RojasÎncă nu există evaluări
- Untitled 1Document6 paginiUntitled 1Albo Josué Hernández RojasÎncă nu există evaluări
- Segundo Parcial InmunoDocument8 paginiSegundo Parcial InmunoFernando OrtizÎncă nu există evaluări
- Microbiologia Rutas MetabolicasDocument8 paginiMicrobiologia Rutas MetabolicasDaniel AlonsoÎncă nu există evaluări
- Actividad 3 BiologiaDocument3 paginiActividad 3 BiologiaErikaÎncă nu există evaluări
- Practicas N 2 de Fisiologiauniversidad Nacional de CañeteDocument8 paginiPracticas N 2 de Fisiologiauniversidad Nacional de CañetePercy Valentin LUYO RUIZÎncă nu există evaluări
- Membranas BiologicasDocument41 paginiMembranas BiologicasJohanna Bustos NutricionistaÎncă nu există evaluări
- Biologia Celular y Molecular UbcDocument22 paginiBiologia Celular y Molecular UbcOscar QuevedoÎncă nu există evaluări
- Eptp - I - Unjfsc - Inginf - Bgral - 2023 - Ii - Docente Jessenia GamboaDocument3 paginiEptp - I - Unjfsc - Inginf - Bgral - 2023 - Ii - Docente Jessenia GamboaLuis DionicioÎncă nu există evaluări
- MLSTDocument24 paginiMLSTJayro RanseyÎncă nu există evaluări
- 30 E30 440263 LaboratoriosDocument1 pagină30 E30 440263 LaboratoriosDayana AguirreÎncă nu există evaluări
- FITOHORMONASDocument8 paginiFITOHORMONASKEVIN JAIR MORILLO CHAVEZÎncă nu există evaluări
- V. Ev 1 CatálogoDocument28 paginiV. Ev 1 Catálogojoselyne luqueÎncă nu există evaluări
- Cadena de Trensporte de LectronesDocument13 paginiCadena de Trensporte de LectronesGiancarloÎncă nu există evaluări
- Informe 4 de MicroDocument20 paginiInforme 4 de MicroAbel Melanio Gaspar GonzalesÎncă nu există evaluări
- TransfecciónDocument23 paginiTransfecciónAdriana SalazarÎncă nu există evaluări
- Ingeniería Genética - OdpDocument53 paginiIngeniería Genética - OdpMauricio Toro VascoÎncă nu există evaluări
- Arn de TransferenciaDocument8 paginiArn de TransferenciaAsael Antonio FloresÎncă nu există evaluări
- Resumen de Células MadreDocument3 paginiResumen de Células MadreAdriana Paola Ortega QuinteroÎncă nu există evaluări
- 01-Organizador Visual - BioquímicaDocument1 pagină01-Organizador Visual - BioquímicaModesto ChavezÎncă nu există evaluări
- TP N°2 Biologia 2022Document17 paginiTP N°2 Biologia 2022Lu MuñizÎncă nu există evaluări
- Tarea 4 Introducción A La Ingeniería Yerly Katherine HernándezDocument14 paginiTarea 4 Introducción A La Ingeniería Yerly Katherine HernándezAlejandra Mendoza100% (1)
- SYLLABUS Genetica 2019ADocument10 paginiSYLLABUS Genetica 2019AFrancisco Javier LeónÎncă nu există evaluări
- BioenergéticaDocument23 paginiBioenergéticaMiichael RamirezÎncă nu există evaluări
- Glosario de GeneticaDocument20 paginiGlosario de GeneticaE ArtunduagaÎncă nu există evaluări
- Lectura 2 Semana 09 Upc pb1Document14 paginiLectura 2 Semana 09 Upc pb1lindaÎncă nu există evaluări
- Grupo 1 Evaluación I - GeneticaDocument7 paginiGrupo 1 Evaluación I - Geneticaedwin rojasÎncă nu există evaluări
- Genetica 1.0Document19 paginiGenetica 1.0Renzo HurtadoÎncă nu există evaluări
- Ingeniería GenéticaDocument6 paginiIngeniería GenéticaSaamanthaMaartinezÎncă nu există evaluări
- INFORMR 5 Cinetica de Crecimiento S.cerevisiaeDocument4 paginiINFORMR 5 Cinetica de Crecimiento S.cerevisiaeBerenice ArroyoÎncă nu există evaluări
- Illumina IncDocument4 paginiIllumina IncGaby Símbala FeijooÎncă nu există evaluări