Documente Academic
Documente Profesional
Documente Cultură
Ley de Los Estados Correspondientes
Încărcat de
Liliana MonserratDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Ley de Los Estados Correspondientes
Încărcat de
Liliana MonserratDrepturi de autor:
Formate disponibile
QFI
AGOSTO DICIEMBRE 2016
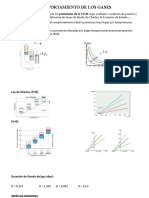
VENTAJAS Y DESVANTAJAS DE LA ECUACIN DE VAN DER WAALS
P= [
]-
Desventajas
Ventajas
No puede emplearse para clculos Da visin del comportamiento de los
precisos de las propiedades de los gases gases, de su relacin con los lquidos.
No es precisa cerca del estado critico
Predice estados crticos
Existen otras ecuaciones
DESVIACIONES DE LOS GASES REALES
La ley del gas ideal no representa la forma precisa el comportamiento de los gases
reales (Castellan, 1976)
Las desviaciones con respecto al comportamiento de un gas ideal se clasifican en:
MEZCLAS DE GASES EN
EQUILIBRIO DESPUS
DE LA REACCIN
APARENTE
No TOTAL DE
MOLCULAS DEPENDEN
DE LA PRESIN
DESVIACIONES
DE
GAS REAL
GASES PUROS
REAL
MEZCLAS DE GASES NO
REACCIONANTES
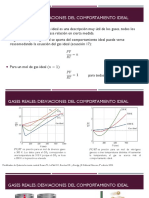
Una de las desviaciones que se trataron se representa en una grfica del factor de
compresibilidad en funcin de la presin
QFI
AGOSTO DICIEMBRE 2016
Si Z = 1 el gas tiene comportamiento ideal
Cuando Z< 1 los gases se licuan fcilmente
Todas las sustancias coinciden en cuanto a la forma del diagrama Zvs P , pero se
diferencian en el valor de las propiedades, para obtener un diagrama generalizado
se han reducido las propiedades , de manera que se obtienen los estados
correspondientes o variables reducidas:
Presin reducida
= =
Temperatura reducida
= =
= =
Volumen reducido
QFI
AGOSTO DICIEMBRE 2016
La ecuacin de van der Waals expresada en funcin de las variables reducidas
queda:
=[
8
3
] 2
3 1
Van der Waals indic que dos gases distintos a la misma temperatura reducida y
bajo la misma presin reducida tendrn el mismo valor de volumen reducido, es
decir se encuentran es estados correspondientes
7
8
9
Presin reducida
10
QFI
AGOSTO DICIEMBRE 2016
Al hacer la reduccin solo se utilizar un grfico el del factor generalizado.
ISOTERMAS DE GASES REALES
Cuando la relacin presin vs volumen para un gas real se miden a varias
temperaturas se obtiene una familia de isotermas como se muestra a continuacin.
Lo que se puede observar en el diagrama es que a temperaturas altas las isotermas
se parecen a un gas ideal.
A bajas temperaturas se observan las isotermas de manera muy diferente.
QFI
AGOSTO DICIEMBRE 2016
Un gas se puede licuar por cualquiera de las dos tcnicas siguientes:
1.- Al enfriar una muestra de gas disminuye la energa cintica en sus molculas,
por lo que stas se agregan y forman pequeas gotas de lquido.
2.- Al aplicar presin al gas. La compresin reduce la distancia promedio entre las
molculas de tal forma que se mantienen unidas por atraccin mutua.
Si la temperatura del gas est sobre la temperatura crtica, el gas no se puede
condensar, sin importar la presin aplicada.
Toda sustancia tiene una temperatura crtica (Tc), por arriba de la cual la fase
gaseosa no se puede licuar, independientemente de la magnitud de la presin que
se aplique, por arriba de la temperatura crtica no hay una distincin fundamental
entre un lquido y un gas.
La presin crtica (Pe) es la mnima presin que se debe aplicar para llevar a cabo la
licuefaccin a la temperatura crtica.
S-ar putea să vă placă și
- Factor de Compresibilidad ZDocument7 paginiFactor de Compresibilidad ZJim Tico GutiérrezÎncă nu există evaluări
- Termodinámica Gases RealesDocument35 paginiTermodinámica Gases RealesGerardoEstebanRodríguezÎncă nu există evaluări
- Clase 08 Unidad II DIM 404Document54 paginiClase 08 Unidad II DIM 404SAIR MORALES ARAVENAÎncă nu există evaluări
- Evidenica 5 Quimica AplicadaDocument5 paginiEvidenica 5 Quimica AplicadaYoxtal DominguezÎncă nu există evaluări
- Gases Reales e IdealesDocument14 paginiGases Reales e IdealesGeorges EskandarÎncă nu există evaluări
- Desviacion Del Comportamiento IdealDocument2 paginiDesviacion Del Comportamiento Idealxduche100% (1)
- Proceso de Sustancias RealesDocument22 paginiProceso de Sustancias RealesJair OñateÎncă nu există evaluări
- Gases Reales y Ecuacion de EstadoDocument3 paginiGases Reales y Ecuacion de EstadoAlberto Elera SubiñasÎncă nu există evaluări
- Gases RealesDocument11 paginiGases RealeskdaguileraÎncă nu există evaluări
- Gas IdealDocument7 paginiGas IdealNoa SofreeÎncă nu există evaluări
- DIFERENCIASDocument1 paginăDIFERENCIASmegavasolbanÎncă nu există evaluări
- Gases RealesDocument36 paginiGases RealesLucero Fierro100% (1)
- El Factor de Compresibilidad ZDocument4 paginiEl Factor de Compresibilidad ZJulio FooseÎncă nu există evaluări
- IntroIQ Clase 17 y 18Document27 paginiIntroIQ Clase 17 y 18AR QuímicaÎncă nu există evaluări
- Factor de CompresibilidadDocument5 paginiFactor de CompresibilidadPaola Barbosa100% (7)
- Seminario N°1 Gases Ideales y RealesDocument6 paginiSeminario N°1 Gases Ideales y Realesnikolle loayzaÎncă nu există evaluări
- Tema IV Propiedades Físicas Del Gas NaturalDocument7 paginiTema IV Propiedades Físicas Del Gas NaturalMaria Carola Colque GutierrezÎncă nu există evaluări
- Factor de CompresibilidadDocument6 paginiFactor de CompresibilidadBryanyMariaÎncă nu există evaluări
- Term0dinamica GasesDocument6 paginiTerm0dinamica GasesYojhan YandelÎncă nu există evaluări
- Propiedades Del Aire y Leyes de Los GasesDocument25 paginiPropiedades Del Aire y Leyes de Los GasesAndrea Alvarez FloresÎncă nu există evaluări
- Gases Reales y Ecuaciones de EstadoDocument27 paginiGases Reales y Ecuaciones de EstadoMARLIOVER SAN JUANÎncă nu există evaluări
- Comportamiento de Los GasesDocument25 paginiComportamiento de Los GasesElsa Marzana SanizoÎncă nu există evaluări
- Comportamiento de Los GasesDocument25 paginiComportamiento de Los GasesERIKA LOZADA RUSSELÎncă nu există evaluări
- Factor Compresibilidad Standing Katz ProgramacionDocument23 paginiFactor Compresibilidad Standing Katz ProgramacionDanny Guzman80% (5)
- Factor de CompresibilidadDocument11 paginiFactor de CompresibilidadGaby Fraga100% (1)
- Gas IdealDocument51 paginiGas IdealAnother Boy On InternetÎncă nu există evaluări
- CAP 1 GASES REALES. Parte 3 Desviación Del Comportamiento IdealDocument30 paginiCAP 1 GASES REALES. Parte 3 Desviación Del Comportamiento IdealHelen BautistaÎncă nu există evaluări
- Clase 1 Semana 2 - Gases RealesDocument25 paginiClase 1 Semana 2 - Gases RealesCarlos AlarconÎncă nu există evaluări
- Ley de Los Estados CorrespondientesDocument7 paginiLey de Los Estados CorrespondientesKaren Soledad Sondor Maza0% (1)
- Calculo Del Factor Z de Los Gases Por ElDocument18 paginiCalculo Del Factor Z de Los Gases Por EljeraldoÎncă nu există evaluări
- Ensayo Gas IdealDocument12 paginiEnsayo Gas Idealjeankarlovelazquez12Încă nu există evaluări
- Calculo Del Factor Z de Los Gases Por ElDocument18 paginiCalculo Del Factor Z de Los Gases Por ElAngel ViberosÎncă nu există evaluări
- Presentacion Gases RealesDocument14 paginiPresentacion Gases RealesLenn Adriana Martinez SolanoÎncă nu există evaluări
- Teorema de Los Estados CorrespondientesDocument8 paginiTeorema de Los Estados CorrespondientesLuis LeonÎncă nu există evaluări
- Ecuación de Estado de Gases RealesDocument2 paginiEcuación de Estado de Gases RealesBryan FariasÎncă nu există evaluări
- Gases RealesDocument6 paginiGases RealesRenato EspinosaÎncă nu există evaluări
- Calculo Del Factor Z de Los Gases Por ElDocument18 paginiCalculo Del Factor Z de Los Gases Por ElHumberto Ivan Gonzales TapiaÎncă nu există evaluări
- Ecuaciones de Estado y Factor de CompresibilidadDocument4 paginiEcuaciones de Estado y Factor de CompresibilidadJesusEduardoPerezPerezÎncă nu există evaluări
- Gases RealesDocument23 paginiGases RealesHerlin RomeroÎncă nu există evaluări
- La Composición Química Determina El Comportamiento de Los Fluidos Del YacimientoDocument6 paginiLa Composición Química Determina El Comportamiento de Los Fluidos Del YacimientoOskr OvalleÎncă nu există evaluări
- Ecuaciones de Estado para Gases RealesDocument25 paginiEcuaciones de Estado para Gases RealesKEVIN ARNOLDO PEREZ RIVASÎncă nu există evaluări
- Ecuación de Estado de Un Gas IdealDocument3 paginiEcuación de Estado de Un Gas IdealJipson Uresto100% (1)
- Diferencia Entre Gas Real y Gas IdealDocument4 paginiDiferencia Entre Gas Real y Gas IdealBRANDONÎncă nu există evaluări
- Desviación Del Comportamiento Ideal de Los GasesDocument2 paginiDesviación Del Comportamiento Ideal de Los GasesRenzo HansÎncă nu există evaluări
- Ecuaciones de Estado para Gases No IdealesDocument29 paginiEcuaciones de Estado para Gases No IdealesFernando LópezÎncă nu există evaluări
- CAP 1 GASES REALES. Parte 4 Desviación Del Comportamiento Ideal PuntualDocument21 paginiCAP 1 GASES REALES. Parte 4 Desviación Del Comportamiento Ideal PuntualDaniel FeymanÎncă nu există evaluări
- Factor Volumétrico de Formación Del GasDocument11 paginiFactor Volumétrico de Formación Del GasJorge Matus SanchezÎncă nu există evaluări
- Emilio MontillaDocument33 paginiEmilio MontillaSAIA MARACAIBOÎncă nu există evaluări
- Gases Reales 2 CGTDocument26 paginiGases Reales 2 CGTHector Aliaga TantavilcaÎncă nu există evaluări
- Clase10 Teoriagases2013aDocument15 paginiClase10 Teoriagases2013aMauricio RamirezÎncă nu există evaluări
- Gases Reales - ECUACION DE ESTADO - PITZERDocument17 paginiGases Reales - ECUACION DE ESTADO - PITZERDaniel TovarÎncă nu există evaluări
- Teoria Practica 1Document2 paginiTeoria Practica 1Carlos MontúfarÎncă nu există evaluări
- Gases RealesDocument25 paginiGases RealesCARLOS SOSAÎncă nu există evaluări
- Termodinamica - Gas Ideal PDFDocument49 paginiTermodinamica - Gas Ideal PDFAndrés David Rodríguez JineteÎncă nu există evaluări
- Estudio de Los Gases Ideales y Reales - Lab 1Document27 paginiEstudio de Los Gases Ideales y Reales - Lab 1Rosario CcahuanticoÎncă nu există evaluări
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe la EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSEvaluare: 4.5 din 5 stele4.5/5 (7)
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDe la EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesÎncă nu există evaluări
- Laboratorio 4Document7 paginiLaboratorio 4Julian BurbanoÎncă nu există evaluări
- Practica 1 Mecanica de FluidosDocument15 paginiPractica 1 Mecanica de FluidosAdolfo AlmonteÎncă nu există evaluări
- Informe FinalDocument85 paginiInforme FinalJordyLuisSánchezVásquezÎncă nu există evaluări
- Teorema de Stokes FinalDocument10 paginiTeorema de Stokes FinalRekii YumuraÎncă nu există evaluări
- P-090-AR-tcm68-9748 Bombas Vacio KaeserDocument2 paginiP-090-AR-tcm68-9748 Bombas Vacio KaeserLENDÎncă nu există evaluări
- Metalurgia de Polvos VDocument28 paginiMetalurgia de Polvos VJuan •castroÎncă nu există evaluări
- Analisis PVTDocument23 paginiAnalisis PVTAmhed Torrico VacaÎncă nu există evaluări
- Ejemplos ToberaDocument2 paginiEjemplos ToberaAlex MendozaÎncă nu există evaluări
- Ejercicio MulticomponenteDocument6 paginiEjercicio MulticomponenteRenzo MuñozÎncă nu există evaluări
- Osorio Diaz Estefania - 7CM2 - Tarea 08 ResonadorDocument4 paginiOsorio Diaz Estefania - 7CM2 - Tarea 08 ResonadorEstefania OsorioÎncă nu există evaluări
- Practica CompresionDocument2 paginiPractica CompresionLili AlbarranÎncă nu există evaluări
- 3ro de Secundaria SolucionDocument3 pagini3ro de Secundaria SolucionKaterin FrancoÎncă nu există evaluări
- Semana 4 Proyecto 4Document2 paginiSemana 4 Proyecto 4Melany RamosÎncă nu există evaluări
- Radiacion PDFDocument14 paginiRadiacion PDFMarisol Contreras PlazasÎncă nu există evaluări
- 9-.Relaciones Tensiones y Deformaciones en Rango PlásticoDocument24 pagini9-.Relaciones Tensiones y Deformaciones en Rango PlásticoJuancarlosMercedesAguilarÎncă nu există evaluări
- ¿Qué Voy A Aprender?: SABERES PREVIOS: ¿Qué Causa Que Un Cuerpo Cambie Su Velocidad? Piensa y RespondeDocument16 pagini¿Qué Voy A Aprender?: SABERES PREVIOS: ¿Qué Causa Que Un Cuerpo Cambie Su Velocidad? Piensa y RespondeTatianaFrancoÎncă nu există evaluări
- Jose - Silva - Tarea - Semana - 5Document7 paginiJose - Silva - Tarea - Semana - 5Miguel Angel Barrera MuñozÎncă nu există evaluări
- BernoulliDocument11 paginiBernoulliCristian LaragomezÎncă nu există evaluări
- Determinacion de La Carga ElectricaDocument5 paginiDeterminacion de La Carga ElectricaAnaly S. MamaniÎncă nu există evaluări
- 05 MEF-2021 22-VigasDocument66 pagini05 MEF-2021 22-VigasmauricioÎncă nu există evaluări
- Monografia Refrigeracion en CascadaDocument26 paginiMonografia Refrigeracion en CascadaPatiitOwh FernandezÎncă nu există evaluări
- Fibras de Acero WirandDocument25 paginiFibras de Acero WirandAlonso PolarÎncă nu există evaluări
- Digital Heat PipeDocument4 paginiDigital Heat PipeRobin GomezÎncă nu există evaluări
- 02 Capítulo 2 F2 - Temperatura Del 15 SetiembreDocument70 pagini02 Capítulo 2 F2 - Temperatura Del 15 SetiembreFiorela arellanoÎncă nu există evaluări
- Separata N°1 - Carga Eléctrica y Ley de CoulombDocument1 paginăSeparata N°1 - Carga Eléctrica y Ley de CoulombLEONARDO DAVID RAMIREZ CIEZAÎncă nu există evaluări
- Espectrofotometría UVDocument40 paginiEspectrofotometría UVWilmer Bobadilla Cruz100% (1)
- Calculos para Informe 2Document8 paginiCalculos para Informe 2CARLOS EDUARDO SEJAS OLGUINÎncă nu există evaluări
- Balances de MateriaDocument27 paginiBalances de MateriaClari EsquivelÎncă nu există evaluări
- Camion Cisterna 4x2Document25 paginiCamion Cisterna 4x2Clara Chuquimia Juli100% (3)