Documente Academic
Documente Profesional
Documente Cultură
Variaciones Fenotipicas en El Sindrome de Aicardi Goutieres
Încărcat de
karlito52Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Variaciones Fenotipicas en El Sindrome de Aicardi Goutieres
Încărcat de
karlito52Drepturi de autor:
Formate disponibile
NOTA CLNICA
Variaciones fenotpicas en el sndrome de Aicardi-Goutires
causado por mutaciones en el gen RNASEH2B: presentacin
de dos nuevos casos
Saturnino Ortiz-Madinaveitia, David Conejo-Moreno, Javier Lpez-Pisn, Jos Luis Pea-Segura,
M. Luisa Serrano-Madrid, Ingrid C. Durn-Palacios, Pilar Pelez-Cabo
Introduccin. El sndrome de Aicardi-Goutires es un trastorno inmunitario raro debido a mutaciones en siete genes que
codifican protenas llamadas TREX1, el complejo ribonucleasa H2, SAMHD1, ADAR e IFIH1 (MAD5), las cuales estn implicadas en el metabolismo de los cidos nucleicos. A continuacin se presentan dos nuevos casos por mutacin en el gen
RNASEH2B, uno de los cuales presenta una mutacin no descrita hasta la fecha.
Casos clnicos. Caso 1: varn que consult porque desde los 5 meses, coincidiendo con cuadros febriles de repeticin,
presentaba prdida de los tems madurativos adquiridos hasta la fecha. Caso 2: nio de 4 meses que desde los 2 meses
mostraba gran irritabilidad con dificultades en la alimentacin, asociado a un grave retraso psicomotor. En ambos casos
se constat un aumento de las pterinas en el lquido cefalorraqudeo, principalmente de la neopterina, con calcificaciones
en los ganglios basales. El diagnstico se confirm mediante secuenciacin del gen RNASEH2B; el caso 2 presentaba una
mutacin no descrita en la literatura mdica.
Conclusiones. Los casos corresponden a la descripcin clsica realizada por Aicardi-Goutires. Debe tenerse en cuenta este
sndrome ante un paciente con un cuadro de encefalopata subaguda de comienzo en el primer ao de vida, distona/espasticidad en grado variable e importante afectacin/regresin del desarrollo psicomotor, especialmente si asocia aumento
de las pterinas (neopterina) en el lquido cefalorraqudeo y calcificaciones en los ganglios basales.
Palabras clave. Aicardi-Goutires. Calcificaciones. Encefalopata. Inmunidad. Interfern. RNASEH2B.
Introduccin
El sndrome de Aicardi-Goutires es un raro trastorno inmunitario, causado por mutaciones en TREX1,
RNASEH2A, RNASEH2B, RNASEH2C, SAMHDI,
ADAR e IFIH1 (MAD5). Estos genes codifican protenas, las cuales estn involucradas en el metabolismo/sealizacin de los cidos nucleicos [1]. La
mutacin va a provocar un aumento de la actividad
del interfern de tipo I en lquido cefalorraqudeo y
suero, as como un aumento en la transcripcin de
genes estimulados por el interfern en sangre perifrica [2-4]. Desde la descripcin original del sndrome por Aicardi y Goutires en 1984 (encefalopata subaguda caracterizada por irritabilidad extrema, episodios febriles estriles, perdida de tems
madurativos adquiridos previamente y enlentecimiento en el crecimiento del permetro craneal) [5],
el espectro fenotpico se ha ido ampliando, incluyendo pacientes cuya nica manifestacin puede
ser una necrosis bilateral del estriado o formas no
sindrmicas de paraparesia espstica [1,6]. Se presentan dos nuevos casos por mutaciones en el gen
que codifica la subunidad B del complejo ribonu-
www.neurologia.com Rev Neurol 2016; 62 (4): 165-169
cleasa H2 (RNasa H2), responsable del 36% de los
casos [1], uno de los cuales muestra una mutacin
no descrita hasta la fecha.
Casos clnicos
Servicio de Pediatra; Hospital
Universitario de Burgos (D. ConejoMoreno). Unidad de Neuropediatra;
Hospital Infantil Miguel Servet;
Zaragoza (J. Lpez-Pisn, J.L. PeaSegura). Servicio de Pediatra
(S. Ortiz-Madinaveitia, M.L. SerranoMadrid); Servicio de Radiodiagnstico
(I.C. Durn-Palacios, P. Pelez-Cabo);
Hospital Santa Brbara; Soria,
Espaa.
Correspondencia:
Dr. Saturnino Ortiz Madinaveitia.
Servicio de Pediatra. Hospital
Santa Brbara. Paseo de Santa
Brbara, s/n. E-42005 Soria.
E-mail:
saturortizm@hotmail.com
Aceptado tras revisin externa:
25.11.15.
Cmo citar este artculo:
Ortiz-Madinaveitia S, ConejoMoreno D, Lpez-Pisn J, PeaSegura JL, Serrano-Madrid ML,
Durn-Palacios IC, et al. Variaciones
fenotpicas en el sndrome de
Aicardi-Goutires causado por
mutaciones en el gen RNASEH2B:
presentacin de dos nuevos casos.
Rev Neurol 2016; 62: 165-9.
2016 Revista de Neurologa
Caso 1
Varn que consult porque desde los 5 meses, en
un contexto de procesos febriles aspticos, presentaba un cuadro de regresin neurolgica con prdida de tems adquiridos hasta la fecha. Era el segundo hijo de un matrimonio joven no consanguneo, y
su hermano mayor estaba sano. El embarazo fue
controlado. Las serologas TORCH eran negativas.
El parto eutcico transcurri sin incidencias y los
datos antropomtricos neonatales fueron normales. En la exploracin a los 7 meses llamaba la atencin una tendencia al llanto con hipotona axial y
espasticidad/distona en las extremidades, reflejos
osteotendinosos exaltados con reflejo cutaneoplantar extensor bilateral. Presentaba un adecuado seguimiento visual y el permetro craneal se encon-
165
S. Ortiz-Madinaveitia, et al
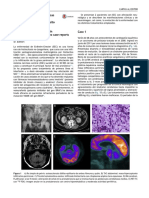
Figura 1. Caso 1: a) Resonancia magntica cerebral realizada a los 7 meses en secuencia axial potenciada
en T2. Se observa un aumento de la seal en la sustancia blanca frontal, parietal y temporal anterior
con ampliacin de los surcos corticales en la regin frontal; b) Tomografa axial computarizada cerebral
realizada a los 43 meses en la que se aprecian focos milimtricos de densidad de calcio en los ncleos
lenticulares y en la sustancia blanca subcortical frontal.
te T163I (c.488 C>T), segunda en frecuencia (7%)
[7]. La variante A177T haba sido heredada por va
materna, y la variante T163I, por va paterna. En la
evolucin posterior present un enlentecimiento
en el crecimiento del permetro craneal hasta los 18
meses, con un descenso en la curva de crecimiento
por debajo del percentil 3. A partir de los 12 meses
mejor la tendencia al llanto y el contacto social; no
obstante, persisti una importante afectacin motora grado 5 en la Gross Motor Function Classification System (GMFCS), a pesar de la cual ha sido
posible la comunicacin a partir de los 4 aos a travs de un ordenador adaptado para su uso con el
ojo por parte del paciente; permanece estable actualmente con 5,5 aos.
Caso 2
traba dentro de los lmites normales. El estudio neurometablico realizado fue normal, salvo por la elevacin de la creatincinasa (1.678 U/L), que se normaliz en controles posteriores. La resonancia magntica cerebral objetivaba una dilatacin de los espacios subaracnoideos con una ligera ventriculomegalia supratentorial y una alteracin difusa de la
seal en la sustancia blanca subcortical de las regiones frontales, parietales y temporales anteriores
(Fig. 1a). El fondo de ojo, el ecocardiograma, el
electroencefalograma y el electroneurograma fueron normales. En el estudio de neurotransmisores
en el lquido cefalorraqudeo haba aumento de las
pterinas, sobre todo de la neopterina, con un descenso del cido 5-hidroxiindolactico y del cido
homovanlico. La citoqumica del lquido cefalorraqudeo presentaba una ligera pleocitosis (23 leucocitos/mm3) de predominio mononuclear (88%). Desde los 12 meses padeca, sobre todo coincidiendo
con los meses fros, eritema pernio en codos, tobillos y, ocasionalmente, pabellones auriculares. Ante
la sospecha de un sndrome de Aicardi-Goutires,
se realiz una tomografa axial computarizada cerebral, donde se apreciaron microcalcificaciones,
fundamentalmente en los ganglios basales, presentes tambin en la sustancia blanca subcortical frontal y parietal (Fig. 1b). El diagnstico se confirm
mediante secuenciacin del gen RNASEH2B, al hallarse en heterocigosis la variante A177T (c.529 G>A),
mutacin ms prevalente (62%) encontrada en los
pacientes con mutacin en RNASEH2B, y la varian-
166
Varn que consult porque desde los 2 meses presentaba gran irritabilidad, especialmente en relacin con las tomas. Se trataba del segundo hijo de
una pareja no consangunea con antecedente de dos
abortos involuntarios del primer trimestre. Embarazo a trmino controlado. Las serologas TORCH
fueron negativas. Se practic cesrea urgente por
riesgo de prdida del bienestar fetal intraparto. Apgar 6/9. La antropometra en el momento del nacimiento fue normal. En la exploracin llamaba la
atencin la tendencia al llanto ante mnimos estmulos fsicos o auditivos, ausencia de contacto visual, actitud en libro abierto con nulo sostn ceflico, reflejos cutaneoplantares, osteotendinosos y de
sobresalto exaltados, clono dbilmente positivo y
permetro craneal en el percentil 3. El estudio neurometablico, citomegalovirus en tira de cribado
neonatal, electroencefalograma, electroneurograma,
potenciales evocados troncoenceflicos, ecocardiograma y fondo de ojo fueron normales. Los potenciales evocados visuales eran compatibles con una
ceguera cortical, y en la citoqumica del lquido cefalorraqudeo se objetiv una leve leucocitosis (20 leucocitos/mm3) a expensas de mononucleares (89%).
En la resonancia magntica cerebral realizada a los
5 meses se observaba una atrofia cerebral supratentorial generalizada con una mielinizacin muy disminuida para la edad. La irritabilidad persisti hasta los 15 meses, con un cese en el crecimiento del
permetro craneal hasta los 18 meses. Present un
posterior crecimiento, pero siempre muy por debajo
del percentil 3, y asociando un importante grado de
discapacidad motora. A los 28 meses se repiti la
resonancia cerebral (Fig. 2a), donde se apreci una
alteracin generalizada del proceso de mielinizacin,
prcticamente ausente en la regin frontotemporal,
www.neurologia.com Rev Neurol 2016; 62 (4): 165-169
Variaciones fenotpicas en el sndrome de Aicardi-Goutires
y algo ms preservada en el cerebelo y en la regin
parietooccipital; asimismo, en las secuencias de gradiente se observaba principalmente en los ganglios
basales lo que pudiera corresponder con pequeos
focos de calcificacin. Ante la sospecha de un sndrome de Aicardi-Goutires, se realiz una tomografa axial computarizada cerebral (Fig. 2b), donde
se confirm la presencia de mltiples depsitos de
calcio, principalmente en los ganglios basales, aunque tambin intraparenquimatosos y en el ncleo
dentado. Se repiti de nuevo el estudio del lquido
cefalorraqudeo y persista una ligera pleocitosis (25
leucocitos/mm3) de predomino mononuclear (96%),
con un aumento marcado de neopterina (409 nmol/L)
y algo menor de biopterina (53 nmol/L). El diagnstico se confirm mediante secuenciacin del gen
RNASEH2B, al encontrarse en heterocigosis la variante A177T heredada por va paterna y la variante
K170K (c.510 G>A), mutacin no descrita hasta la
fecha, heredada por va materna. A los 33 meses comenz con crisis epilpticas. Permanece estable con
4,5 aos.
Discusin
El sndrome de Aicardi-Goutires es un trastorno
inmunitario crnico, causado por mutaciones generalmente en heterocigosis en TREX1, RNASEH2A,
RNASEH2B, RNASEH2C, SAMHDI, ADAR e IFIH1
(MAD5). El patrn de herencia es autosmico recesivo, como en los dos casos, salvo para las mutaciones en IFIH1, donde todos los pacientes descritos
hasta la fecha presentan una herencia autosmica
dominante. Lo mismo ocurre en algunos casos con
mutaciones en ADAR y TREX1 [1,6,8].
El complejo RNasa H2 se compone de tres sub
unidades (RNASEH2A, RNASEH2B y RNASEH2C)
y se encarga de la vigilancia del genoma, eliminando ribonucletidos del ADN [9] que se incorporan
con relativa frecuencia durante la replicacin. La
mutacin en cualquiera de las tres subunidades conlleva una prdida de funcin y la acumulacin de
hbridos de ARN/ADN que van a ser responsables,
por un lado, de inestabilidad genmica [1,2,10], y
por otro, van a provocar una respuesta inmunomediada con aumento de la actividad del interfern
de tipo I en lquido cefalorraqudeo y suero [1,3,11],
as como un incremento en la expresin de genes
estimulados por el interfern en sangre perifrica
(interferon signature) que se negativiza con la edad
[2,4]. Consecuencia tambin del estmulo por el interfern va a ser la produccin por parte de clulas
del sistema inmune y neuronales de neopterina, que
www.neurologia.com Rev Neurol 2016; 62 (4): 165-169
Figura 2. Caso 2: a) Hiperintensidad de seal en secuencia T2 en la sustancia blanca, fundamentalmente
frontotemporal y periventricular, con mala delimitacin de la sustancia gris-sustancia blanca; b) Tomografa axial computarizada cerebral realizada en la misma fecha en donde se observan calcificaciones
groseras en los ncleos lenticulares y mltiples focos puntiformes/lineales en la corteza cerebral.
se encuentra elevada en el lquido cefalorraqudeo y
que tambin se negativiza con la edad [1,7], lo que
es indicativo de un proceso inflamatorio/autoinmune [12,13]. Por ello, en fases iniciales puede confundirse con una infeccin perinatal, especialmente
cuando la mutacin afecta a TREX1 [1]. En ambos
casos se pudo constatar un incremento en los niveles de neopterina con una pleocitosis leve de predominio mononuclear en el lquido cefalorraqudeo,
siendo normales estos valores en el caso 1 a los 4
aos; en el caso 2, a los 28 meses, a pesar de la mejora referida por los padres, persista una marcada
elevacin de la neopterina, y presentaba crisis epilpticas a los 33 meses. La determinacin de pterinas en el lquido cefalorraqudeo (debe protegerse
de la luz y congelar a 70 C hasta su anlisis) ayuda a diferenciar causas de encefalopata inflamatoria, inmune o infecciosa [15,16] de otras posibles
etiologas. Asimismo, en el caso de pacientes con
sndrome de Aicardi-Goutires, permite determinar si se encuentran en el perodo de encefalopata
(valores elevados de neopterina) o en una fase ms
estable de la enfermedad.
El inicio de la sintomatologa es variable: puede
ir desde el nacimiento con un cuadro que semeja
una infeccin congnita con sintomatologa neuro
lgica inespecfica (irritabilidad, problemas en la alimentacin, movimientos anormales y crisis epilpticas) asociado a trombocitopenia y hepatoesplenomegalia [1,7], hasta los 5 aos en forma de un cuadro de distona subaguda, causado por mutaciones
167
S. Ortiz-Madinaveitia, et al
en ADAR [14]. La mayora de los pacientes presenta al nacimiento o a lo largo del primer ao de vida
un cuadro de encefalopata subaguda caracterizado
por espasticidad, distona, crisis epilpticas (40%),
ceguera cortical (31%), microcefalia progresiva y
grave afectacin del desarrollo psicomotor [1,5,7].
En algunos pacientes, como el caso 1, esta fase de
encefalopata se precede de un perodo de aparente
normalidad que ocurre hasta en el 21% de los pacientes con mutaciones en RNASEH2B; este perodo es ms frecuente en el caso de mutaciones en
IFIH1 y ADAR (63% y 57%, respectivamente) [1]. Tras
la fase de encefalopata, que suele durar varios meses (siete meses para el caso 1 y doce para el caso 2),
no suele haber un empeoramiento y algunos pacientes presentan una leve mejora [1,7]. Esto es ms probable para pacientes con mutaciones en RNASEH2B,
SAMHD1, ADAR e IFIH1, los cuales suelen tener
mayores capacidades, aunque con bastantes limitaciones [1]. Como ocurre en ambos casos, la mayora de los pacientes presenta una gran limitacin
funcional (GMFCS: 4-5), en parte por el alto grado
de espasticidad/distona asociada al sndrome; no
obstante, aunque menos frecuentes, hay formas mucho menos invalidantes (GMFCS: 1-2), en especial
asociadas a mutaciones en ADAR e IFIH1 [1,6].
El signo clnico no neurolgico que se asocia con
mayor frecuencia es el eritema pernio o saban
[1,7,15]. El caso 1 los presenta de forma recurrente,
especialmente en codos, talones y orejas, sobre to
do coincidiendo con los meses ms fros; los sabaones estn presentes en casi un tercio de los pacientes, independientemente de la mutacin que
presenten [1]. Por eso, ante un nio que presenta
un cuadro grave de deterioro/regresin neurolgica
con distona y sabaones, debe plantearse la posibilidad de que se trate de un sndrome de AicardiGoutires. El siguiente signo que se relaciona con
ms frecuencia es el glaucoma, salvo para los que
presentan mutaciones en ADAR o IFIH1. Generalmente se presenta en los seis primeros meses de
vida, aunque hay un caso descrito a los 6 aos [1].
Otros signos descritos, con un trasfondo inflamatorio/autoinmune, en orden decreciente son: hipo
tiroidismo, cardiomiopata, accidentes cerebrovasculares (slo descritos en pacientes con mutaciones
en SAMHD1) [16], neuropata perifrica, trastornos
inflamatorios intestinales (enfermedad de Crohn,
hepatitis autoinmune, gastritis atrfica, etc.), lupus
eritematoso sistmico/sndrome antifosfolpido (en
mutaciones en TREX1, ADAR e IFIH1), diabetes
inspida y otros trastornos autoinmunes [1]. Es importante el diagnstico de la patologa comrbida,
ya que el tratamiento precoz del glaucoma o el hipo-
168
tiroidismo supone una mejora en la calidad de vida;
en este sentido, ambos pacientes reciben control anual
oftalmolgico, endocrino y cardiolgico.
La neuroimagen puede ser tan variable como la
presentacin clnica, desde las formas clsicas con
atrofia cerebral asociada a leucodistrofia y calcificaciones de predomino en los ganglios basales (aunque
tambin pueden estar presentes en el tlamo, el ncleo dentado y la sustancia blanca periventricular
[5,7]), hasta formas cuyo nico hallazgo sea una necrosis bilateral del estriado [14]. Ambos casos son
un buen ejemplo de la variabilidad en la neuroimagen a pesar de presentar mutaciones en el mismo gen.
Las nuevas tcnicas de secuenciacin van a permitir ampliar progresivamente el espectro fenotpico, as como un diagnstico ms precoz, y quiz la
futura aparicin de nuevas dianas teraputicas permita disminuir las consecuencias del proceso inflamatorio/inmune en estadios precoces (en fase de
encefalopata), lo que mejore la morbimortalidad
de estos pacientes. Hasta entonces es importante el
tratamiento precoz de las posibles complicaciones
asociadas.
Bibliografa
1. Crow YJ, Chase DS, Lowenstein Schmidt J, Szynkiewicz M,
Forte GM, Gornall HL, et al. Characterization of human
disease phenotypes associated with mutations in TREX1,
RNASEH2A, RNASEH2B, RNASEH2C, SAMHD1, ADAR,
and IFIH1. Am J Med Genet A 2015; 167A: 296-312.
2. Crow YJ, Leitch A, Hayward BE, Garner A, Parmar R,
Griffith E, et al. Mutations in genes encoding ribonuclease
H2 subunits cause Aicardi-Goutieres syndrome and mimic
congenital viral brain infection. Nat Genet 2006; 38: 910-6.
3. Rigby RE, Rehwinkel J. RNA degradation in antiviral immunity
and autoimmunity. Trends Immunol 2015; 36: 179-88.
4. Rice GI, Forte GM, Szynkiewicz M, Chase DS, Aeby A,
Abdel-Hamid MS, et al. Assessment of interferon-related
biomarkers in Aicardi-Goutires syndrome associated with
mutations in TREX1, RNASEH2A, RNASEH2B, RNASEH2C,
SAMHD1, and ADAR: a case-control study. Lancet Neurol
2013; 12: 1159-69.
5. Aicardi J, Goutires F. A progressive familial encephalopathy
in infancy with calcifications of the basal ganglia and chronic
cerebrospinal fluid lymphocytosis. Ann Neurol 1984; 15: 49-54.
6. Crow YJ, Zaki MS, Abdel-Hamid MS, Abdel-Salam G,
Boespflug-Tanguy O, Cordeiro NJ, et al. Mutations in ADAR1,
IFIH1, and RNASEH2B presenting as spastic paraplegia.
Neuropediatrics 2014; 45: 386-93.
7. Crow YJ. Aicardi-Goutires syndrome. GeneReviews. URL:
http://www.ncbi.nlm.nih.gov/books/NBK1475/. [10.09.2015].
8. Diamond J. Autosomal dominant IFIH1 gain-of-function
mutations cause Aicardi-Goutires syndrome. Clin Genet
2014; 86: 473-4.
9. Chon H, Vassilev A., DePamphilis ML, Zhao Y, Zhang J,
Burgers PM, et al. Contributions of the two accessory subunits,
RNASEH2B and RNASEH2C, to the activity and properties
of the human RNase H2 complex. Nucleic Acids Res 2009;
37: 96-110.
10. Pizzi S, Sertic S, Orcesi S, Cereda C, Bianchi M, Jackson AP,
et al. Reduction of RNase H2 activity in Aicardi-Goutires
syndrome cells leads to replication stress and genome instability.
Hum Mol Genet 2015; 24: 649-58.
www.neurologia.com Rev Neurol 2016; 62 (4): 165-169
Variaciones fenotpicas en el sndrome de Aicardi-Goutires
11. Crow YJ, Manel N. Aicardi-Goutires syndrome and the
type I interferonopathies. Nat Rev Immunol 2015; 15: 429-40.
12. Dale RC, Brilot F, Fagan E, Earl J. Cerebroespinal fluid neopterin
in paediatric neurology: a marker of active central nervous
system inflammation. Dev Med Child Neurol 2009; 51: 317-23.
13. Dale RC, Brilot F. Biomarkers of inflammatory and autoimmune central nervous system disorders. Curr Opin Pediatr
2010; 22: 718-25.
14. Livingston JH, Lin JP, Dale RC, Gill D, Brogan P, Munnich A,
et al. A type I interferon signature identifies bilateral striatal
necrosis due to mutations in ADAR1. J Med Genet 2014;
51: 76-82.
15. Abdel-Salam GM, El-Kamah GY, Rice GI, El-Darouti M,
Gornall H, Szynkiewicz M, et al. Chilblains as a diagnostic
sign of Aicardi-Goutires syndrome. Neuropediatrics 2010;
41: 18-23.
16. Ramesh V, Bernardi B, Stafa A, Garone C, Franzoni E,
Abinun M, et al. Intracerebral large artery disease in AicardiGoutires syndrome implicates SAMHD1 in vascular
homeostasis. Dev Med Child Neurol 2010; 52: 725-32.
Phenotypic variations in Aicardi-Goutires syndrome caused by RNASEH2B gene mutations: report of two
new cases
Introduction. Aicardi-Goutires syndrome is a rare immune disorder due to mutations in seven different genes that encode
proteins called TREX1, ribonuclease H2 complex, SAMHD1, ADAR and IDIH1 (MDA5), which are involved in acid nucleic
metabolism. Two cases are described in detail below caused by RNASEH2B gene mutation, one of which displays a mutation
no described to date.
Case reports. Case 1: male consulting because from 5-month-old shows loss of maturity items acquired until then, coming
with several fever episodes. Case 2: a 4-month-old boy showing since 2-month-old great irritability and oral-feeding trouble
with severe psychomotor impairment. In both cases it was found an increase of pterines in the cerebrospinal fluid, mainly
neopterine, with calcifications in the basal ganglia. The diagnosis was proved by sequencing RNASEH2B gene, founding in
case 2 a new mutation not described previously.
Conclusions. The reported cases belong to the description already done by Aicardi-Goutires, it should be noticed this
syndrome in a patient with a subacute encephalopathy of debut in the first year of life, dystonia/spasticity in variable
degree and important affectation/regression of psychomotor development, particularly in those with increase of pterines
(neopterine) in the cerebrospinal fluid and calcifications in the basal ganglia.
Key words. Aicardi-Goutires. Calcifications. Encephalopathy. Immunity. Interferon. RNASEH2B.
www.neurologia.com Rev Neurol 2016; 62 (4): 165-169
169
S-ar putea să vă placă și
- Bioenergetica - Metabolismo de CarbohidratosDocument41 paginiBioenergetica - Metabolismo de CarbohidratosRosa AlvaradoÎncă nu există evaluări
- SC Caso ClinicoDocument2 paginiSC Caso ClinicoMatias Campos VenegasÎncă nu există evaluări
- Síndrome Pierde Sal Cerebral - 2011Document2 paginiSíndrome Pierde Sal Cerebral - 2011arnaldops333Încă nu există evaluări
- pdf24_converted 6Document5 paginipdf24_converted 6EDUARDO CARRILLO GODINEZÎncă nu există evaluări
- Encefalopatia de HashimotoDocument4 paginiEncefalopatia de HashimotoEva DauelsbergÎncă nu există evaluări
- Casos Clínicos Transtorno Del Metabolismo de Los LípidosDocument11 paginiCasos Clínicos Transtorno Del Metabolismo de Los LípidosMisa TuyÎncă nu există evaluări
- Xxix Congreso Academia Iberoamericana Neurología Pediatrica (Ainp) QUITO 2023 Abstracts de ComunicacionesDocument5 paginiXxix Congreso Academia Iberoamericana Neurología Pediatrica (Ainp) QUITO 2023 Abstracts de Comunicacionestomas arturo tejeda rodalÎncă nu există evaluări
- Enfermedad de MenkesDocument5 paginiEnfermedad de Menkesalfredo camposÎncă nu există evaluări
- Manifestaciones Neurológicas en La Enfermedad de Erdheim-Chester: A Propósito de 2 CasosDocument3 paginiManifestaciones Neurológicas en La Enfermedad de Erdheim-Chester: A Propósito de 2 CasosGerman HaroÎncă nu există evaluări
- BH 010060Document2 paginiBH 010060CarlosÎncă nu există evaluări
- Síndrome de KabukiDocument3 paginiSíndrome de KabukivacapekyÎncă nu există evaluări
- Ataxia-Telangiectasia: Reporte de CasoDocument5 paginiAtaxia-Telangiectasia: Reporte de CasoKarla msalinasÎncă nu există evaluări
- 0034 8597 RNP 83 02 123Document4 pagini0034 8597 RNP 83 02 123UCCb - REF Eugenia SalvaiÎncă nu există evaluări
- Casos InmunoDocument15 paginiCasos InmunoAngel CarbajalÎncă nu există evaluări
- Descripción de Un Caso de Oreja Caída en Bovinos Causado Por CriptococosDocument2 paginiDescripción de Un Caso de Oreja Caída en Bovinos Causado Por CriptococosCaaarolÎncă nu există evaluări
- Tay Sach (Caso Clinico Upch) PDFDocument5 paginiTay Sach (Caso Clinico Upch) PDFBritni UscaÎncă nu există evaluări
- Caso Clínico LeighDocument4 paginiCaso Clínico LeighChriss OlagueeÎncă nu există evaluări
- SRMDocument2 paginiSRMStephanie MorenoÎncă nu există evaluări
- Hipotermia Terapéutica en Recién Nacidos Con Encefalopatía Hipóxico-IsquémicaDocument7 paginiHipotermia Terapéutica en Recién Nacidos Con Encefalopatía Hipóxico-IsquémicaYaya YayaÎncă nu există evaluări
- LeighDocument3 paginiLeighsheili24Încă nu există evaluări
- 2000-136-6-605-606 SC Caso ClínicoDocument6 pagini2000-136-6-605-606 SC Caso ClínicoFioRe AlvaÎncă nu există evaluări
- Caso Clinico de MeningitisDocument2 paginiCaso Clinico de MeningitisMARCELINA HUAYTA CUMBAÎncă nu există evaluări
- Actualización de La Enfermedad de BehçetDocument8 paginiActualización de La Enfermedad de BehçetGonzalo JustinianoÎncă nu există evaluări
- Diagnóstico de Ataxia Espinocerebelosa tipo 3 en ChileDocument2 paginiDiagnóstico de Ataxia Espinocerebelosa tipo 3 en ChileDhamar RiosÎncă nu există evaluări
- Artículo de Sistemas Muscular PDFDocument4 paginiArtículo de Sistemas Muscular PDFAngi AspiazuÎncă nu există evaluări
- Anticuerpos Anti YoDocument3 paginiAnticuerpos Anti YoJjor Orozco Orozco RamirezÎncă nu există evaluări
- 3 HerpezosterDocument5 pagini3 HerpezosterYoselyn Aguero OjedaÎncă nu există evaluări
- Adreno Leucodistrofia Parte 1-Dpg3Document4 paginiAdreno Leucodistrofia Parte 1-Dpg3Lizbeth Rodriguez PorrasÎncă nu există evaluări
- Un caso clásico de meningitis bacterianaDocument2 paginiUn caso clásico de meningitis bacterianaSofia De La RosaÎncă nu există evaluări
- CACESDocument244 paginiCACESRoberth MeroÎncă nu există evaluări
- Holoprosencefalia: caso clínicoDocument7 paginiHoloprosencefalia: caso clínicoRafa Rodríguez AveigaÎncă nu există evaluări
- NeurocristopatiasDocument4 paginiNeurocristopatiasAnaAguerrevereÎncă nu există evaluări
- Mutaciones heterocigóticas en el gen de la α-galactosidasa A en dos pacientesDocument4 paginiMutaciones heterocigóticas en el gen de la α-galactosidasa A en dos pacientesvalentinaÎncă nu există evaluări
- Revista Médica Herediana 1018-130X: Issn: Famed - Revista.medica@oficinas-Upch - PeDocument6 paginiRevista Médica Herediana 1018-130X: Issn: Famed - Revista.medica@oficinas-Upch - PeRosita Aguirre FloresÎncă nu există evaluări
- Hipoglucemia Severa Intradiálisis Asociada A Marihuana: Severe Intradialytic Hypoglycemia Associated With Marijuana UseDocument2 paginiHipoglucemia Severa Intradiálisis Asociada A Marihuana: Severe Intradialytic Hypoglycemia Associated With Marijuana UseRodrigo OlivoÎncă nu există evaluări
- Caso Clínico (Genetica) (MPSII)Document7 paginiCaso Clínico (Genetica) (MPSII)Miguel Angel Ramirez RamirezÎncă nu există evaluări
- Sindrome de OpitzDocument4 paginiSindrome de OpitzAddi H. MendozaÎncă nu există evaluări
- Encefalitis herpética: importancia del diagnóstico y tratamiento precozDocument5 paginiEncefalitis herpética: importancia del diagnóstico y tratamiento precozDaniel Emiliano GarciaÎncă nu există evaluări
- La encefalopatía hipóxico-isquémica neonatal aguda: diagnóstico, tratamiento y pronósticoDocument13 paginiLa encefalopatía hipóxico-isquémica neonatal aguda: diagnóstico, tratamiento y pronósticoAlex D Jesús RiveroÎncă nu există evaluări
- Charla Dr. Politie - Fabry PDFDocument60 paginiCharla Dr. Politie - Fabry PDFRosa CepedaÎncă nu există evaluări
- Parte 2 SimulacrosDocument77 paginiParte 2 SimulacrosAna Maria Roldan OspinaÎncă nu există evaluări
- Art 9Document4 paginiArt 9danielaÎncă nu există evaluări
- Caso Clinico Cisticercosis PDFDocument5 paginiCaso Clinico Cisticercosis PDFDennis SangaÎncă nu există evaluări
- NeurologíaDocument6 paginiNeurologíaAron GarciaÎncă nu există evaluări
- Clase Malformaciones Del Sistema Nervioso CentralDocument167 paginiClase Malformaciones Del Sistema Nervioso CentralTerry Aquize100% (1)
- Caso Clínico de Meningitis BacterianaDocument6 paginiCaso Clínico de Meningitis BacterianaDuby593 FlowÎncă nu există evaluări
- Embriopatía Por Isotretinoína Un Daño EvitableDocument4 paginiEmbriopatía Por Isotretinoína Un Daño EvitableJean CarlosÎncă nu există evaluări
- Melas en PeruDocument8 paginiMelas en PeruJuanCarlosHernandezBalcazarÎncă nu există evaluări
- Bibliografía: Tabla 1Document3 paginiBibliografía: Tabla 1Jacson SegalesÎncă nu există evaluări
- Caso Clínico CadenaDocument10 paginiCaso Clínico Cadenakaren2795Încă nu există evaluări
- LibroDocument5 paginiLibroArquimedes Sanchez BravoÎncă nu există evaluări
- Casos ClínicosDocument58 paginiCasos ClínicosHéctor Galván100% (1)
- Errores innatos del metabolismo: galactosemia, MPS y MELASDocument4 paginiErrores innatos del metabolismo: galactosemia, MPS y MELASJose EdgarÎncă nu există evaluări
- SX Otahara DR RodriguezDocument7 paginiSX Otahara DR RodriguezEdu RotÎncă nu există evaluări
- Casos Clinicos 2Document7 paginiCasos Clinicos 2Ivan VazquezÎncă nu există evaluări
- Issn:: Biomédica 0120-4157 Instituto Nacional de SaludDocument8 paginiIssn:: Biomédica 0120-4157 Instituto Nacional de Saludgajl110802Încă nu există evaluări
- Muñoz John P6 - Análisis Caso Clínico Crisis AsmáticaDocument6 paginiMuñoz John P6 - Análisis Caso Clínico Crisis AsmáticaGabriel Guanoluiza LópezÎncă nu există evaluări
- Criterios clínicos de enfermedades genéticasDe la EverandCriterios clínicos de enfermedades genéticasEvaluare: 1 din 5 stele1/5 (1)
- Propiedades de los derivados del cannabis en el AlzheimerDe la EverandPropiedades de los derivados del cannabis en el AlzheimerÎncă nu există evaluări
- Absorción con filtro BK como terapia eficaz en el riñón del mieloma múltipleDe la EverandAbsorción con filtro BK como terapia eficaz en el riñón del mieloma múltipleÎncă nu există evaluări
- Sindrome de Noonan Genes MutantesDocument5 paginiSindrome de Noonan Genes Mutanteskarlito52Încă nu există evaluări
- Genomica en Medicina 2017Document82 paginiGenomica en Medicina 2017guillermoÎncă nu există evaluări
- Delirium Revision Orientada A La Practica ClinicaDocument14 paginiDelirium Revision Orientada A La Practica Clinicakarlito52Încă nu există evaluări
- CC Patologia DualDocument58 paginiCC Patologia DualbrainpharmaÎncă nu există evaluări
- Casos CIe-10Document64 paginiCasos CIe-10Hyuna Junni Joong78% (9)
- Delirium. Revision Orientada A La Practica ClinicaDocument13 paginiDelirium. Revision Orientada A La Practica ClinicaEstefania GonzalezÎncă nu există evaluări
- Escala de Acatisia de Simpson AngusDocument5 paginiEscala de Acatisia de Simpson Anguskarlito52Încă nu există evaluări
- Cocaina y Percepcion de Riesgo en ConsumidoresDocument7 paginiCocaina y Percepcion de Riesgo en Consumidoreskarlito52Încă nu există evaluări
- Anatomia de ArtistasDocument7 paginiAnatomia de Artistaskarlito52Încă nu există evaluări
- Antipsicoticos de DepositoDocument15 paginiAntipsicoticos de Depositokarlito52Încă nu există evaluări
- Lupus NeuropsiquiatricoDocument6 paginiLupus Neuropsiquiatricokarlito52Încă nu există evaluări
- Zonas Del Cuerpo Con PorcentajesDocument1 paginăZonas Del Cuerpo Con Porcentajeskarlito52Încă nu există evaluări
- Estado Epileptico No Convulsivo en El NiñoDocument9 paginiEstado Epileptico No Convulsivo en El NiñoIvan Osorio RuizÎncă nu există evaluări
- Conductas de Acumulacion PDFDocument9 paginiConductas de Acumulacion PDFkarlito52Încă nu există evaluări
- 13 Esp 247569Document124 pagini13 Esp 247569Álvaro Sanabria ChacónÎncă nu există evaluări
- Numero 54 Julio 2016Document44 paginiNumero 54 Julio 2016karlito52Încă nu există evaluări
- Complejo Demencia - SidaDocument8 paginiComplejo Demencia - Sidakarlito52Încă nu există evaluări
- 17 de Mayo de 2016Document48 pagini17 de Mayo de 2016karlito52Încă nu există evaluări
- 32 53 1 PBDocument24 pagini32 53 1 PBFausto RoseyÎncă nu există evaluări
- Imss - 042 - 08 - GRR (2016)Document16 paginiImss - 042 - 08 - GRR (2016)ioetroqÎncă nu există evaluări
- Inventario de Síntomas PrefrontalesDocument11 paginiInventario de Síntomas PrefrontalesRosarioBengocheaSecoÎncă nu există evaluări
- Adenosina y Sueño PDFDocument8 paginiAdenosina y Sueño PDFkarlito52Încă nu există evaluări
- Fibromialgia y Sueño PDFDocument19 paginiFibromialgia y Sueño PDFAndrea Melissa Mora UmañaÎncă nu există evaluări
- Epilepsia y Deprivacion de SueñoDocument7 paginiEpilepsia y Deprivacion de Sueñokarlito52Încă nu există evaluări
- Mayo Vol 3 Numero 51Document50 paginiMayo Vol 3 Numero 51karlito52Încă nu există evaluări
- Aportación Del EEG en TEADocument9 paginiAportación Del EEG en TEACarmenTOÎncă nu există evaluări
- Vol 3 Numero 45Document48 paginiVol 3 Numero 45karlito52Încă nu există evaluări
- Vol 3 Numero 59 Sep 20Document42 paginiVol 3 Numero 59 Sep 20karlito52Încă nu există evaluări
- Educar sin estrés en 7 díasDocument4 paginiEducar sin estrés en 7 díasadrianaÎncă nu există evaluări
- El Cuenco y El Baston 120 Cuentos Zen Taisen DeshimaruDocument171 paginiEl Cuenco y El Baston 120 Cuentos Zen Taisen DeshimaruEtnan tusken100% (1)
- Informe #1 Observaciones MicroscopicasDocument9 paginiInforme #1 Observaciones MicroscopicasJorge GuevaraÎncă nu există evaluări
- Banco Preguntas Agosto2016Document104 paginiBanco Preguntas Agosto2016rodolfoÎncă nu există evaluări
- Clase 2 Bocadillos Salados y DulcesDocument11 paginiClase 2 Bocadillos Salados y DulcesrigelÎncă nu există evaluări
- 3ra practica-ABASTECIMIENTODocument10 pagini3ra practica-ABASTECIMIENTOGustavo Q. SdftzÎncă nu există evaluări
- Cuidados durante la menstruaciónDocument2 paginiCuidados durante la menstruaciónAlejandro MartinezÎncă nu există evaluări
- Carro de Enganche Motorizado para Caballos de TiroDocument5 paginiCarro de Enganche Motorizado para Caballos de TirojairoÎncă nu există evaluări
- Clasificación de Los Elementos Químicos Por Su ReactividadDocument4 paginiClasificación de Los Elementos Químicos Por Su ReactividadJose Guadalupe Treviño PeralesÎncă nu există evaluări
- Programacion NeurolinguisticaDocument11 paginiProgramacion NeurolinguisticacarolinaÎncă nu există evaluări
- Obligaciones CoordinadorDocument3 paginiObligaciones CoordinadorIsabela Godoy LeonÎncă nu există evaluări
- El Uso de La Interpretación de Los Sueños en El PsicoanálisisDocument9 paginiEl Uso de La Interpretación de Los Sueños en El PsicoanálisisRodrigo BarrazaÎncă nu există evaluări
- Preguntas para Examen ConflictoDocument5 paginiPreguntas para Examen ConflictoMariaJoseMartinez67% (3)
- Autoayuda-En-Crisis Batista PDFDocument398 paginiAutoayuda-En-Crisis Batista PDFLUISÎncă nu există evaluări
- Escolarizacion - Caso PracticoDocument4 paginiEscolarizacion - Caso PracticoRocíoÎncă nu există evaluări
- Mejora proceso engorde ganado vacuno TapoDocument83 paginiMejora proceso engorde ganado vacuno TapoAlexis CasasÎncă nu există evaluări
- Adt-Ma-0001 Manual Programa Institucional de Farmacovigilancia Vigente Version 1Document42 paginiAdt-Ma-0001 Manual Programa Institucional de Farmacovigilancia Vigente Version 1beatrÎncă nu există evaluări
- Actividad Del ViernesDocument7 paginiActividad Del ViernesKaren Yuliana WilchesÎncă nu există evaluări
- Educacion Sexual Integral PDFDocument13 paginiEducacion Sexual Integral PDFMaria Clara SaptieÎncă nu există evaluări
- INFORME 1era UNIDAD - GRUPO 1Document23 paginiINFORME 1era UNIDAD - GRUPO 1MISTER IBAN CORDOVA PEÑAÎncă nu există evaluări
- 6.-Gramineas de CorteDocument25 pagini6.-Gramineas de CorteDesahily Juarez100% (1)
- Cartones Bingo 75 BolasDocument10 paginiCartones Bingo 75 BolasLalyn NavarroÎncă nu există evaluări
- ESTUDIO DE IMPACTO AMBIENTAL Y PLAN DE MANEJO AMBIENTAL PARA LA FASE DE DESARROLLO Y PRODUCCIÓN Andes-Petroleum-2 PDFDocument918 paginiESTUDIO DE IMPACTO AMBIENTAL Y PLAN DE MANEJO AMBIENTAL PARA LA FASE DE DESARROLLO Y PRODUCCIÓN Andes-Petroleum-2 PDFxavierÎncă nu există evaluări
- Ev 2 PROYECTO FINALDocument40 paginiEv 2 PROYECTO FINALCorinaÎncă nu există evaluări
- TrabajoDocument26 paginiTrabajoEladio ChavezÎncă nu există evaluări
- La Nueva MedicinaDocument126 paginiLa Nueva MedicinashaktigraÎncă nu există evaluări
- Esguinces de Tobillo. Anatomía, Tratamiento y TiposDocument10 paginiEsguinces de Tobillo. Anatomía, Tratamiento y TiposRaúl Padel StarÎncă nu există evaluări
- Infecciones de Piel y HeridasDocument36 paginiInfecciones de Piel y HeridasBritanny ScarletÎncă nu există evaluări
- Implementación SST Aditivos UTECDocument38 paginiImplementación SST Aditivos UTECAdolfo Ricardo Piminchumo SausaÎncă nu există evaluări
- Identificación Del Tema y La Idea PrincipalDocument5 paginiIdentificación Del Tema y La Idea PrincipalImi Aguirre LiberatoÎncă nu există evaluări