Documente Academic
Documente Profesional
Documente Cultură
Cap4 PDF
Încărcat de
marger1001Titlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Cap4 PDF
Încărcat de
marger1001Drepturi de autor:
Formate disponibile
III.
El Gas Ideal clsico
Funcin de particin
Ecuacin de estado
Energa interna y calor especfico
Entropa (Sackur-Tetrode)
Paradoja de Gibbs
Mdulo de Mecnica Estadstica
Instituto de Fsica - Facultad de Ingeniera
Funcin de particin para una partcula en una caja
h2 2 2
2
2
Ei =
(
n
+
n
+
n
x
y
z)
2
2ML
Niveles de energa de una partcula de masa M
en una caja cbica de lado L son:
En equilibrio trmico a temperatura T, la funcin de particin es:
Z1 =
En x , ny ,nz
kT
(nx,ny,nz )
( nx2 + ny2 + nz2 )
( n x, n y, n z )
2
2
n2
= e n x e y e n z = Z x3
ny
n z 24
1n4
x
24
3 14
3
24
3 14
Zx
Zy
Zz
h 2 2
donde Zx = Zy = Zz son las funciones de particin en una dimensin y =
2ML2 kT
h2 2 2
nx
Para poder sumar, aproximamos
1
1/3
x2
2 ML2 kT
Z
=
e
e
dx
=
la suma por una integral (*):
2
n
x
3/2
Z1 (V ,T ) =
3/2
MkT
=
2
2 h
Mdulo de Mecnica Estadstica
(*) Esto es vlido si la separacin entre niveles es
pequea en relacin a kT
E
(2nx + 1) = 1
kT
Cual es el orden de magnitud de a temperauta
ambiente?
Instituto de Fsica - Facultad de Ingeniera
Funcin de particin para N partculas distinguibles
r
n j = (nx ,ny ,nz ) j
Un estado de N partculas queda determinado por N vectores
N
de componentes enteras. La energa total es la suma E = E
j
j =1
La funcin de particin de N partculas no interactuantes (*) es simplemente
ZN =
E
kT
estados
Ej
kT
r r
r
n1 , n2 KnN j =1
E1
kT
estados del
atomo 1
MkT
Z N (V ,T ) =
2
2 h
1
= e e L e
= e kT = Z1N
r
r
r
n1
n2
nN
nr1
123
123
123
3N / 2
VN
E2
kT
estados del
atomo 2
EN
kT
estados del
atomo N
Para pensar:
Cunto vale ZN para un mol de He en
condiciones normales (P=1atm, T=0 C) ?
tiene significado fsico este nmero?
(*) Las partculas no interactuantes no se ven. Es como tener cada tomo por si slo en la caja:
x
Estados del
tomo 1
...
x
Estados del
tomo2
Mdulo de Mecnica Estadstica
Estados del
tomo 3
=
Estados del
tomo N
Estados del gas
Instituto de Fsica - Facultad de Ingeniera
Partculas idnticas: Son siempre distinguibles?
Caso clsico:
En una interaccin (choque) entre
dos bolas de billar la identidad de los
participantes se mantiene en todo momento.
Las partculas clsicas idnticas
son distinguibles.
Caso cuntico:
En una interaccin entre dos tomos iguales,
los efectos de interferencia entre las ondas de
materia asociadas, hacen imposible distinguir
quien es quien.
Las partculas cunticas idnticas
son fundamentalmente indistinguibles.
Mdulo de Mecnica Estadstica
t
?
Instituto de Fsica - Facultad de Ingeniera
Como afecta la indistinguibilidad a Z N?
Se puede escribir la funcin de particin (para partculas distinguibles) como
Z N = g n1 e
n12
n12
n12 , n22, K, nN2
g n2 e
n22
n22
g n1 ,n2, K, nN e
L g nN e
n 2N
( n12
+n22 + K+ n2N
nN2
n 2j = ( nx2, j + ny2, j + nz2, j )
g n j = numero de estados con energia Ej
h 2 2
=
2ML2 kT
Cada trmino de esta suma esta caracterizado por un vector
de N componentes enteras.
( n1 , n2 , K , n N )
Si las partculas son indistinguibles, el intercambio de las etiquetas (i,j) que
identifican a dos partculas cualesquiera no produce un estado nuevo.
En el vector de N componentes hay N! intercambios posibles entre pares de
partculas, que no corresponden a nuevos estados. La funcin de particin
se corrige entonces por este factor:
Gas ideal,
N partculas indistinguibles
Mdulo de Mecnica Estadstica
1 MkT
Z N (V ,T ) =
N ! 2 h 2
Instituto de Fsica - Facultad de Ingeniera
3N / 2
VN
5
Energa interna y Calor Especfico
La energa interna de un sistema
con funcin de particin Z es:
U = kT 2
ln Z
T
Para el gas ideal:
3 N Mk 3 N
ln Z =
ln
+
ln T + N ln V ln N !
2
2
2 h 2
y resulta
U=
3
NkT
2
3
U
CV =
= Nk
T V 2
Resultados ya conocidos para el gas ideal.
Mdulo de Mecnica Estadstica
Instituto de Fsica - Facultad de Ingeniera
Ecuacin de Estado (Presin)
F
ln Z
P =
=
kT
V T
V T
La presin P se obtiene de
la funcin de particin Z
Para el gas ideal:
P = kT
N ln V NkT
=
V
V
Se obtiene la ecuacin de estado
PV = NkT
Para pensar:
1)Se pueden obtener las expresiones para U(T) y P(V,T)
partiendo slo de los principios de la Termodinmica?
2) Son diferentes estas expresiones si las partculas del gas son distinguibles?
3) Muestre que el calor especfico a P=cte. es 5NkT/2.
Mdulo de Mecnica Estadstica
Instituto de Fsica - Facultad de Ingeniera
Entropa
F
La entropa se obtiene a partir de S =
kT ln Z
=
T V T
Gas ideal:
3
3
Mk
S = Nk ln T + ln V + 1 + ln
k1ln
N!
(ecuacin de
2
3
2
2
2 h particulas
2
Sackur-Tetrode)
indistinguibles
Para pensar:
1) Halle la expresin de la entropa S cuando el gas est formado de
partculas distinguibles.
2) Es extensiva la funcin S(N,V,T) ?
3) Muestre que si el gas est formado por partculas indistinguibles, S es
extensiva.
Mdulo de Mecnica Estadstica
Instituto de Fsica - Facultad de Ingeniera
Indistinguibilidad: La entropa es extensiva
3
2
N 2N
Para particulas distinguibles: S = Nk ln T + ln V +
Si se duplica el tamao del sistema:
V 2V
3
3
Mk
S 2 Nk ln T + ln 2V + 1 + ln
2
2
2
2
3
Mk
1 + ln
2
2
2
se duplica S?
No!
El trmino NlnV
no es extensivo.
Mk
Teniendo en cuenta S = Nk ln T + ln V + 1 + ln
k ln N !
2
2
2 h
la indistinguibilidad
2
de las partculas:
3
V 3
Mk
Ahora S es
extensiva!
Nk ln T + ln + 1 + ln
2
N 2
2 h
2
3
V 3
Mk
S 2 Nk ln T + ln + 1 + ln
2
2
N
2
2
Mdulo de Mecnica Estadstica
Instituto de Fsica - Facultad de Ingeniera
N ?1
Aprox. Stirling
lnN! NlnN
Paradoja de Gibbs (partculas distinguibles)
Nk 3
V 3
M 1k
S1 =
ln T + ln + 1 + ln
2
2 2
2 2
2 h
S2 =
Nk 3
V 3
M 2k
ln
T
+
ln
+
1
+
ln
2 h 2
2 2
2 2
Si se retira el tabique y las partculas son
idnticas (M1=M2=M), resulta
Gas 1
V/2
N/2
Gas 2
V/2
N/2
Reserva trmica T
3
3
Absurdo, dado que slo
Mk
S1+ 2 = Nk ln T + ln V + 1 + ln
>
S
+
S
1
2
2
cambi el punto de vista.
2
2
2
Para pensar:
1)
2)
Muestre que si las partculas son diferentes, el aumento de entropa debido a la
mezcla que tiene lugar al retirar el tabique es: S = S1+2 S1 S 2 = Nk ln 2
Considere partculas idnticas indistinguibles y muestre como se resuelve la
paradoja.
Mdulo de Mecnica Estadstica
Instituto de Fsica - Facultad de Ingeniera
10
S-ar putea să vă placă și
- Quimica CuanticaDocument219 paginiQuimica CuanticaChris Anderson100% (1)
- Campos VectorialesDocument8 paginiCampos VectorialesEJoelMozoLÎncă nu există evaluări
- Escrrito de Capacitores M3Document1 paginăEscrrito de Capacitores M3marger1001Încă nu există evaluări
- Evaluación Parcial 6toDocument2 paginiEvaluación Parcial 6tomarger1001Încă nu există evaluări
- Evaluacion Fisica 2 ADocument2 paginiEvaluacion Fisica 2 Amarger1001Încă nu există evaluări
- Situaciones ProblemaDocument1 paginăSituaciones Problemamarger1001100% (1)
- Primer Escrito Medicina L - 3Document1 paginăPrimer Escrito Medicina L - 3marger1001Încă nu există evaluări
- Definición de MitoDocument1 paginăDefinición de Mitomarger1001100% (1)
- Características Del Héroe TrágicoDocument1 paginăCaracterísticas Del Héroe Trágicomarger1001Încă nu există evaluări
- Tema 2Document4 paginiTema 2marger1001Încă nu există evaluări
- Características de La Literatura AntiguaDocument3 paginiCaracterísticas de La Literatura Antiguamarger1001Încă nu există evaluări
- Examen02 19 PDFDocument4 paginiExamen02 19 PDFmarger1001Încă nu există evaluări
- Fii P1 2017Document4 paginiFii P1 2017marger1001Încă nu există evaluări
- Física I Medio FINAL PDFDocument211 paginiFísica I Medio FINAL PDFmarger1001Încă nu există evaluări
- Examen07 19 PDFDocument4 paginiExamen07 19 PDFmarger1001Încă nu există evaluări
- Actas de Resumenes IV CIECIBA 1 PDFDocument100 paginiActas de Resumenes IV CIECIBA 1 PDFmarger1001Încă nu există evaluări
- Analisis de Un Cuento de MorosoliDocument8 paginiAnalisis de Un Cuento de Morosolimarger1001Încă nu există evaluări
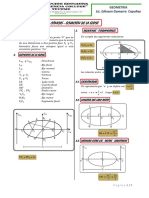
- 1-Ecuacion de La ElipseDocument7 pagini1-Ecuacion de La Elipseedinson enrique gamarra capuñayÎncă nu există evaluări
- Cálculo III A3aaDocument2 paginiCálculo III A3aaManuel FuguetÎncă nu există evaluări
- Derivadas Parciales 2012 4 PDFDocument35 paginiDerivadas Parciales 2012 4 PDFcxhxb777Încă nu există evaluări
- Métodos Numéricos SEMANA 6Document10 paginiMétodos Numéricos SEMANA 6Guillermo Manuel DiazÎncă nu există evaluări
- Mecánica TeóricaDocument219 paginiMecánica TeóricaalvaroÎncă nu există evaluări
- Delta de DiracDocument1 paginăDelta de DiracDaniel GarciaÎncă nu există evaluări
- Practica 6Document2 paginiPractica 6LDAC_13Încă nu există evaluări
- Forma de Hacer MonografiaDocument6 paginiForma de Hacer MonografiaAlicé Zwee SeytúÎncă nu există evaluări
- Modelo de SchroodingerDocument7 paginiModelo de SchroodingerTania Barrantes QuirosÎncă nu există evaluări
- Mecanica Clasica 2019 2c Guia 2Document6 paginiMecanica Clasica 2019 2c Guia 2Juan ZetaÎncă nu există evaluări
- Elipsoide de EsfuerzosDocument2 paginiElipsoide de EsfuerzosRICARDO HUAMAN CORREAÎncă nu există evaluări
- Taller 1 PDFDocument5 paginiTaller 1 PDFJOHAN STIVEN CARDENAS RODRIGUEZÎncă nu există evaluări
- Propiedades GeometricasDocument10 paginiPropiedades GeometricasJoaquin Nicolas RiccitelliÎncă nu există evaluări
- Solución Examen Final Parte I 03-20Document4 paginiSolución Examen Final Parte I 03-20CARLOS RODRIGO LOPEZ LOPEZÎncă nu există evaluări
- 203 - Calculo Integral - Jaime - PereaDocument12 pagini203 - Calculo Integral - Jaime - PereaJAIME ANDRES PEREA RAMIREZÎncă nu există evaluări
- Resumen Teoría de La Relatividad EspecialDocument2 paginiResumen Teoría de La Relatividad EspecialÁlvaro Villarino BonetÎncă nu există evaluări
- Modelos de Estructura Atomica para Cuarto de SecundariaDocument8 paginiModelos de Estructura Atomica para Cuarto de SecundariaHaydee ContrerasÎncă nu există evaluări
- Instituto Politecnico NacionalDocument13 paginiInstituto Politecnico NacionalKaren JanetzyÎncă nu există evaluări
- Deber 1Document4 paginiDeber 1KevinPoolÎncă nu există evaluări
- Tarea de FisicaDocument16 paginiTarea de FisicaJesus Gutierrez0% (1)
- Enfiledownloadclientc237cffa 184b 4611 Aaf9 7228853b3023filename MorenoSantoyoMariana20Tarea4.PDF 3Document20 paginiEnfiledownloadclientc237cffa 184b 4611 Aaf9 7228853b3023filename MorenoSantoyoMariana20Tarea4.PDF 3Mariana Moreno SantoyoÎncă nu există evaluări
- ELECTRICIDADDocument3 paginiELECTRICIDADJORGE ERNESTO CAICEDO CAICEDOÎncă nu există evaluări
- 3 Leyes de La TermodinámicaDocument1 pagină3 Leyes de La TermodinámicaHastor Copy BoqueteÎncă nu există evaluări
- Problemas Propuestos Interacción Radiación-MateriaDocument2 paginiProblemas Propuestos Interacción Radiación-MateriaAlex Esteban DesposorioÎncă nu există evaluări
- TVMDocument9 paginiTVMEddy Bosquez100% (1)
- Seminario VectoresDocument1 paginăSeminario VectoresWabner De La CruzÎncă nu există evaluări
- Regiones en El PlanoDocument6 paginiRegiones en El PlanoViiaNy OlguInÎncă nu există evaluări
- Principio de Incertidumbre ExpDocument10 paginiPrincipio de Incertidumbre ExpFélix MatíasÎncă nu există evaluări