Documente Academic
Documente Profesional
Documente Cultură
EVL Nomogramas de Priester PDF
Încărcat de
Mariia Martinezz AguiilarDescriere originală:
Titlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
EVL Nomogramas de Priester PDF
Încărcat de
Mariia Martinezz AguiilarDrepturi de autor:
Formate disponibile
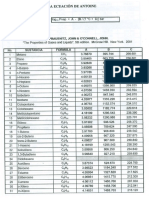
564
CAP!lL?L,O 13. Propiedades termodinmicas y EVL a partir de las ecuaciones de estado
capacidad del mtodo de ecuacin de estado para reproducir los datos. Los resultados de la RCM a 473.15 K (200C) indican la calidad de las predicciones basadas slo en datos de la presin de vapor para la especie pura yen datos de la mezcla
a 90C. Una extrapolacin basada sobre los mismos datos a 523.15 K (250C)
produce resultados comparables. Puede esperarse que las extrapolaciones a temperaturas an ms elevadas se conviertan progresivamente en menos exactas. La
calidad de la prediccin para 200 y 250C se indica en el diagrama Pxy de la figura
13.3.
EVL a partir de correlaciones de valor K
Debido a la funcionalidad compleja de los valores K, los clculos del EVL requieren, en general, procedimientos iterativos adecuados slo para una resolucin en
computadora (seccin 12.6). No obstante, en el caso de mezclas de hidrocarburos
ligeros, en las cuales los campos de fuerza molecular son relativamente poco complicados, se puede suponer como una aproximacin razonable que ambas fases,
lquida y de vapor, son soluciones ideales. La ecuacin (10.85) muestra que Jiti =
&, y la suposicin de las soluciones ideales reduce la ecuacin (13.28) a
La fugacidad fi (T, P) est dada por la ecuacin (10.41), la cual se convierte aqu
en
en donde V, es el volumen molar de la especie pura i como un lquido saturado.
As, el valor K est dado por
K, = ~.?#I~(T, r) exp v,(P - emt)
z
RT
WU, PI
(13.66)
El gran atractivo de la ecuacin (13.66) es que contiene solamente propiedades de la especie pura y, por consiguiente, expresa valores K como funciones de T y
P, independientes de las composiciones de las fases lquida y de vapor. Adems, se
pueden evaluar 4 y # a partir de las ecuaciones de estado para la especie pura
o a partir de correlaciones generalizadas. Esto permite que los valores K para los
hidrocarburos ligeros sean calculados y correlacionados como funciones de T y P.
No obstante, el mtodo est limitado para cualquier especie a temperaturas
subcrticas, porque la curva de la presin de vapor termina en el punto crtico.
565
13.4 ElCL a partir de ecuaciones cbicas de estado
En las figuras 13.4 y 13.5 se presentan los nomogramas para los valores K
de los hidrocarburos ligeros como funciones de T y P, preparados por DePriesterlO
sobre la base de los clculos de la ecuacin de estado anterior; stos permiten un
efecto promedio de composicin y son adecuados para clculos aproximados.
Ejemplo 13.3 Para una mezcla de 107o mol de metano, 20% mol de etano y 70%
mol de propano a 50(F), determine:
a)
b)
La presin en el punto de roco.
La presin en el punto de burbuja.
Los valores K se dan en la figura 13.4.
a) Cuando el sistema est en su punto de roco, slo hay una pequesima cantidad de lquido, y las fracciones mol dadas son valores de yi. Como la temperatura est especificada, los valores K dependen de la eleccin de P y, por ensayo, se
encuentra el valor para el cual se satisface la ecuacin (13.61). Los resultados para
varios valores de P se dan en la tabla siguiente:
SOLUCIN
P = lOO(psia)
P = 150(psia)
P = 126(psia)
Especie
yi
Ki
~8-6
Ki
yi/&
Ki
Y&
Metano
Etano
Propano
0.10
0.20
0.70
20.0
3.25
0.92
0.005
0.062
0.761
13.2
2.25
0.65
0.008
0.089
1.077
16.0
2.65
0.762
0.006
0.075
0.919
C(yJ&)
= 0.828
C(yJKJ = 1.174
Z,(y;JKii)
= 1.000
A partir de los resultados que se dan en las dos ltjmas columnas se ve que se satisface la ecuacin (13.61) cuando P = 126(psia). Esta es la presin en el punto de
roco, y la composicin de la pequesima cantidad de lquido est dada por los valores de zi = y&, enlistados en la ltima columna de la tabla.
b) Cuando el sistema est casi completamente condensado, se encuentra en el
punto de burbuja y las fracciones mol dadas se convierten en los valores de xi. En este
caso, se encuentra por ensayo el valor de P para el cual los valores de Ki satisfacen la
ecuacin (13.60). En la siguiente tabla se dan resultados para varios valores de P:
P = 380(psia)
Especie
Metano
Etano
Propano
zi
Ki
Kixi
P = 400(psia)
Ki
0.10 5.60
0.560 5.25
0.20 1.11
0.222 1.07
0.70 0.335 0.235 0.32
cKixi = 1.017
P = 385(psia)
Kixi
Ki
Kixi
0.525
0.214
0.224
5.49
1.10
0.33
0.549
0.220
0.231
zKixi = 0.963
XKixi = 1.000
loC. L. DePriester, Chem. Eng. Progl: Symp. Ser No. 7, vol. 49, pp. l-43, 1953. Se han publicado .
en forma modificada para el uso directo con las unidades SI (C y kPa) por D. B. Dadybujor, Chem.
Eng. Progr., vol. 74(4), pp. 85-86, abril, 1978.
PI
&
g 0
z0
Er,os-Jaa
0 0 0 0 0
Presin (psia)
cn
0
Temperatura (F)
gi
,m
Metano
m-lacn
0880
Metano
P
;k
Temperatura (F)
n-Decano
Presin (psia)
568
CAP!lTJLO 13.
Propiedades termodinmicas y EVL
a partir de las ecuaciones de estado
Es evidente que se satisface la ecuacin (13.60) cuando P = 385 (psia). sta es la
presin en el punto de burbuja. La composicin de la burbuja de vapor est dada por
yi = Kgri, como se muestra en la ultima columna.
Los clculos de evaporacin instantnea tambin se pueden hacer para
hidrocarburos ligeros con los datos de las figuras 13.4 y 13.5. Aqu, el procedimiento es exactamente como se describe en el ejemplo 12.3, en donde se aplica
la ley de Raoult. Recurdese que el problema es hacer el clculo, para un sistema de composicin general dada {zi} a T y P dadas, de la fraccin del sistema
que es vapor V y de las composiciones de la fase de vapor {yi} y de la fase
lquida {xi}. La ecuacin que debe satisfacerse es la ecuacin (12.27), escrita
aqu como
Z,K,
1
i 1 + V(Ki - 1) =
(13.67)
Dado que T y P estn especificadas, se conocen las Ki para los hidrocarburos ligeros, como se dan en las figuras 13.4 y 13.5, y Ves la nica incgnita en la ecuacin
(13.67) que se encuentra por ensayo.
Para el sistema que se describe en el ejemplo 13.3, &qu fraccin del
sistema es vapor cuando la presin es 200 (psia) y Qcules son las composiciones de
las fases de vapor y lquida en equilibrio?
Ejemplo 13.4
La presin que se da queda entre las presiones en el punto de roco y el
punto de burbuja, establecidas para este sistema en el ejemplo 13.3. Por lo tanto, el
sistema consta de dos fases. El procedimiento consiste en encontrar mediante ensayo el valor de Y para el cual la ecuacin (13.67) se satisface. Ntese que siempre
existe una solucin trivial para Y = 1. En la tabla siguiente se muestran los resultados de varios ensayos. Las columnas encabezadas yi proporcionan los valores de los
trminos de la suma de la ecuacin (13.67), porque cada trmino de hecho es un
valor de yi.
SOLUCIN
xi = y+Ki
Especie
zi
yi
Ki
Metano 0.10 10.0
Etano
0.20 1.76
Propano 0.70 0.52
para
yi para
yi
para
para
v= 0.35
v= 0.25
V= 0.273
V= 0.273
0.241
0.308
0.296
0.414
0.289
0.292
0.029
0.166
0.805
0.278
0.438
0.419
zyi = 0.957 cyi = 1.018 Zyi = 1.000 & = 1.000
As, se satisface la ecuacin (13.67) cuando V = 0.273. Las composiciones de las
fases se dan en las dos ltimas columnas de la tabla.
S-ar putea să vă placă și
- Proceso de Produccion de Eter EtilicoDocument69 paginiProceso de Produccion de Eter EtilicoLeydi PatiñoÎncă nu există evaluări
- Problema 1Document12 paginiProblema 1Kartel KalientitoxÎncă nu există evaluări
- Taller 6Document12 paginiTaller 6David HenaoÎncă nu există evaluări
- Problema 1. Teorema Pi de BuckinghamDocument6 paginiProblema 1. Teorema Pi de BuckinghamAna Sordo CastilloÎncă nu există evaluări
- Calculo Del Perfil de Concentraciones para Un Reactor Tubular y Del Volumen Del Reactorcon Solución Numérica Con El Método de RungeDocument3 paginiCalculo Del Perfil de Concentraciones para Un Reactor Tubular y Del Volumen Del Reactorcon Solución Numérica Con El Método de RungeLemuelMoralesÎncă nu există evaluări
- 6 1Document3 pagini6 1Alejandra CuzcoÎncă nu există evaluări
- 1er Examen Parcial de Ingeniería de Reactores Químicos II 26Document2 pagini1er Examen Parcial de Ingeniería de Reactores Químicos II 26TobiI SempaiÎncă nu există evaluări
- GUIA 8 - Humidificacion PDFDocument3 paginiGUIA 8 - Humidificacion PDFLeandro FelipeÎncă nu există evaluări
- Solucion Parcial IDocument11 paginiSolucion Parcial ILeonardo ReyesÎncă nu există evaluări
- PRACTICA #10 ElectroquimicaDocument9 paginiPRACTICA #10 ElectroquimicaMiriam Vasquez Bravo100% (1)
- Ejercicios Resueltos Del Libro de SeaderDocument18 paginiEjercicios Resueltos Del Libro de SeaderMarco Fernando Moscoso RamirezÎncă nu există evaluări
- Método Grafico de MickleyDocument14 paginiMétodo Grafico de MickleyAlex Anthony Cruz Vizcarra100% (1)
- Balance de Materia y Energia en Una CaldDocument14 paginiBalance de Materia y Energia en Una Caldnatanael quiñoneÎncă nu există evaluări
- Intercambiadores de CalorDocument105 paginiIntercambiadores de CalorGladis tarifaÎncă nu există evaluări
- Practica Torre de Enfriamiento LIQ 1Document6 paginiPractica Torre de Enfriamiento LIQ 1AlfredoÎncă nu există evaluări
- Sistemas Con Reacciones QuimicasDocument6 paginiSistemas Con Reacciones QuimicasNatali CondeñaÎncă nu există evaluări
- Destilacion FlashDocument3 paginiDestilacion FlashAndrei Sheldon Raul Garibay ValadezÎncă nu există evaluări
- Ejercicio 8 1 TreybalDocument5 paginiEjercicio 8 1 TreybalDiego LeivaÎncă nu există evaluări
- Torre de Enfriamiento PDFDocument8 paginiTorre de Enfriamiento PDFKevin M. MoyaÎncă nu există evaluări
- Ley de RaoultDocument3 paginiLey de RaoultMattheoGonzalezBalderas50% (2)
- Ejercicio Reactores 031220Document1 paginăEjercicio Reactores 031220Ezmyytha CaZtiillo Reyyna0% (3)
- Taller de EjerciciosDocument11 paginiTaller de EjerciciosKatherine Muñoz GalazÎncă nu există evaluări
- Practica 7Document11 paginiPractica 7Rafael LópezÎncă nu există evaluări
- 3 Equiipo 5 Problemario PDFDocument11 pagini3 Equiipo 5 Problemario PDFSalvador SantosÎncă nu există evaluări
- 3.11 Henley-SeaderDocument5 pagini3.11 Henley-SeaderCarlos GonzálezÎncă nu există evaluări
- Tarea 5 - Produccion - CumenoDocument14 paginiTarea 5 - Produccion - CumenoRafael Loza GarcíaÎncă nu există evaluări
- LAB OP1. Practica 6Document29 paginiLAB OP1. Practica 6Jesus David OcandoÎncă nu există evaluări
- Tarea 1 CC Ene-Jun2019Document3 paginiTarea 1 CC Ene-Jun2019Edgar adrian reyes carrilloÎncă nu există evaluări
- Ejercicios Del Punto de Pliegue PDFDocument2 paginiEjercicios Del Punto de Pliegue PDFGilbert Rodriguez PalmaÎncă nu există evaluări
- Smith Apendice A-DDocument19 paginiSmith Apendice A-DeliccrÎncă nu există evaluări
- Diagrama de Equilibrio Liquido - Vapor para El Sistema N-Pentano y N-Hexano - Lizbeth Gonzalez HernandezDocument4 paginiDiagrama de Equilibrio Liquido - Vapor para El Sistema N-Pentano y N-Hexano - Lizbeth Gonzalez HernandezLizbeth Gonzalez HernandezÎncă nu există evaluări
- Problema 3.27Document6 paginiProblema 3.27Diego.CCÎncă nu există evaluări
- Porceos de Separación I Tarea AbsorciónDocument5 paginiPorceos de Separación I Tarea AbsorciónMARCO ANTONIO FLORES BRISENOÎncă nu există evaluări
- Ejemplo de Metodo-Unifac Reporte 1Document7 paginiEjemplo de Metodo-Unifac Reporte 1chavaÎncă nu există evaluări
- Apendices SeaderDocument16 paginiApendices SeaderTomas RodriguezÎncă nu există evaluări
- Actividad 5Document10 paginiActividad 5Luis Fernando Tapia RodriguezÎncă nu există evaluări
- Levenspiel Ejercicio 9.17. Ingenierìa de ReactoresDocument5 paginiLevenspiel Ejercicio 9.17. Ingenierìa de ReactoresOscarÎncă nu există evaluări
- Reglas HeuristicasDocument3 paginiReglas HeuristicasMonica AlbaÎncă nu există evaluări
- PS 1-2008 2do ParcialDocument2 paginiPS 1-2008 2do ParcialRosmaryan GuzmanÎncă nu există evaluări
- Guia Problemas Resueltos Cinetica Reactores 141210194618 Conversion Gate01 PDFDocument51 paginiGuia Problemas Resueltos Cinetica Reactores 141210194618 Conversion Gate01 PDFLiz MartínezÎncă nu există evaluări
- Calculos Evaporacion Flash PDFDocument7 paginiCalculos Evaporacion Flash PDFCristofer Sebastian Bustos ColladoÎncă nu există evaluări
- Problemas de Destilacion FlashDocument4 paginiProblemas de Destilacion FlashDivita ArandaÎncă nu există evaluări
- Edoc - Pub - Auto Evaluacion de La Unidad 2docxDocument10 paginiEdoc - Pub - Auto Evaluacion de La Unidad 2docxBryan Sait De León ReyesÎncă nu există evaluări
- Ejemplo 13-1 Construcción de Las Curvas C (T) y E (T)Document8 paginiEjemplo 13-1 Construcción de Las Curvas C (T) y E (T)Nashiely RdzÎncă nu există evaluări
- Reporte Torre de PlatosDocument14 paginiReporte Torre de PlatosLuis RamírezÎncă nu există evaluări
- Masa 1Document4 paginiMasa 1Alvaro CerÎncă nu există evaluări
- EVLDocument12 paginiEVLVíctor Hugo Castro TavaresÎncă nu există evaluări
- Problemas 26 y 27Document6 paginiProblemas 26 y 27Adrian VergaraÎncă nu există evaluări
- Balance 4Document7 paginiBalance 4Adrian Alvarez SaltoÎncă nu există evaluări
- Tarea 1 Unidad 1Document2 paginiTarea 1 Unidad 1Víctor VarelaÎncă nu există evaluări
- Seminario MTBE y ETBEDocument25 paginiSeminario MTBE y ETBEcamila soto gonzalez100% (1)
- IQ.09.01 - Actividad Asincrónica 6Document4 paginiIQ.09.01 - Actividad Asincrónica 6Adolfo LazoÎncă nu există evaluări
- Metodo McCabe ThieleDocument12 paginiMetodo McCabe ThieleSantiago Villegas HdezÎncă nu există evaluări
- Problema 12.7 HenleyDocument4 paginiProblema 12.7 HenleyEdgar Gonzàlez SànchezÎncă nu există evaluări
- Equilibrio de fases: Un enfoque basado en competenciasDe la EverandEquilibrio de fases: Un enfoque basado en competenciasÎncă nu există evaluări
- Artículo Peng-RobinsonDocument8 paginiArtículo Peng-RobinsonF5LucasÎncă nu există evaluări
- Ejercicios Primer PeríodoDocument5 paginiEjercicios Primer PeríodoAndrea VillaÎncă nu există evaluări
- Taller FQ1Document5 paginiTaller FQ1johanna escorcia diazÎncă nu există evaluări
- R 63490Document4 paginiR 63490vdlg2107Încă nu există evaluări
- Guia 1Document8 paginiGuia 1Junior Benjamin Castro FloresÎncă nu există evaluări
- ¿Cuáles Son Los Gases de Efecto Invernadero ¿CTI PDFDocument4 pagini¿Cuáles Son Los Gases de Efecto Invernadero ¿CTI PDFMariia Martinezz AguiilarÎncă nu există evaluări
- Problemas de Fugacidad PDFDocument1 paginăProblemas de Fugacidad PDFMariia Martinezz AguiilarÎncă nu există evaluări
- Cálculos de EVLDocument4 paginiCálculos de EVLJorgeReyesÎncă nu există evaluări
- Coeficientes de La Correlación de Lee Kesler PDFDocument4 paginiCoeficientes de La Correlación de Lee Kesler PDFMariia Martinezz AguiilarÎncă nu există evaluări
- Calculos Evaporacion Flash PDFDocument7 paginiCalculos Evaporacion Flash PDFMariia Martinezz Aguiilar0% (1)
- Tablas Termodinámicas Smith - Van NessDocument9 paginiTablas Termodinámicas Smith - Van NessMariia Martinezz Aguiilar0% (1)
- Coeficientes de La Correlación de Lee Kesler PDFDocument4 paginiCoeficientes de La Correlación de Lee Kesler PDFMariia Martinezz AguiilarÎncă nu există evaluări
- Bosquejo Del MetodoDocument2 paginiBosquejo Del MetodoMariia Martinezz AguiilarÎncă nu există evaluări
- Constantes de AntoineDocument3 paginiConstantes de AntoineMariia Martinezz AguiilarÎncă nu există evaluări
- WORLDROCKMUSICK - Discografia Completa de Guns N' RosesDocument11 paginiWORLDROCKMUSICK - Discografia Completa de Guns N' RosesMariia Martinezz Aguiilar100% (1)
- Ley de Boyle y MariotteDocument7 paginiLey de Boyle y MariotteMaykoll Alberto Zenteno ClarosÎncă nu există evaluări
- Estudio de Gases RealesDocument25 paginiEstudio de Gases RealesMaria Huanchi CondoriÎncă nu există evaluări
- Eter2 U1 A1 RiigDocument3 paginiEter2 U1 A1 RiigRicardo IbarraÎncă nu există evaluări
- 5 Fisica Ciencia e Ingenieria Vol 2 GiancoliDocument3 pagini5 Fisica Ciencia e Ingenieria Vol 2 GiancoliMiguel Ángel Mamani MamaniÎncă nu există evaluări
- Estado GaseosoDocument59 paginiEstado Gaseosojorgecocono100% (1)
- Practica #1 Gases Reales e IdealesDocument12 paginiPractica #1 Gases Reales e IdealesMadeleine Jennifer Ayoso100% (1)
- Escuela Profesional de Física de La FCNM de La Unac Asignatura: TermodinámicaDocument33 paginiEscuela Profesional de Física de La FCNM de La Unac Asignatura: TermodinámicaJoel GuerraÎncă nu există evaluări
- Problemas Sobre Sustancia Pura 01Document76 paginiProblemas Sobre Sustancia Pura 01Mario César Bartra FloresÎncă nu există evaluări
- Calculo de Z para Gases AmargosDocument4 paginiCalculo de Z para Gases AmargosZabdiel PiñaÎncă nu există evaluări
- Explotacion Del GasDocument434 paginiExplotacion Del GasmarioloboaÎncă nu există evaluări
- Resumen Capítulo 3 - Yunus CengelDocument9 paginiResumen Capítulo 3 - Yunus CengelMiguelAngelGha100% (3)
- Tutorial Hysys PDFDocument157 paginiTutorial Hysys PDFCrezpo Yz100% (2)
- Propiedades Físicas y Químicas Del Gas Natural y Crudo - KarelyDocument12 paginiPropiedades Físicas y Químicas Del Gas Natural y Crudo - KarelyArcvil Alz100% (1)
- Unidad IIDocument22 paginiUnidad IILikinpark HernandezÎncă nu există evaluări
- Teoria Cinetica de Los GasesDocument10 paginiTeoria Cinetica de Los GasesDulce GonzalesÎncă nu există evaluări
- Termodinamica Unidad 2 Gases Ideales y Sustancia PuraDocument55 paginiTermodinamica Unidad 2 Gases Ideales y Sustancia PuraLee-hoo Transe Beeath100% (2)
- TALLER PRIMER CORTE FisicoquimicaDocument8 paginiTALLER PRIMER CORTE Fisicoquimicakaren mestraÎncă nu există evaluări
- Manual Analisis NodalDocument20 paginiManual Analisis NodalJuan CandelasÎncă nu există evaluări
- PROBLEMARIO TERMODINÁMICA 2. Mezclas Multicomponentes y FugacidadDocument3 paginiPROBLEMARIO TERMODINÁMICA 2. Mezclas Multicomponentes y FugacidadVíctor Hugo Castro TavaresÎncă nu există evaluări
- Gas Ideal, Gas RealDocument18 paginiGas Ideal, Gas RealkeilerÎncă nu există evaluări
- Term Odin A MicaDocument45 paginiTerm Odin A MicaGoenyi GoenyiÎncă nu există evaluări
- Introduccion GeoquimicaDocument18 paginiIntroduccion GeoquimicaJudith Trujillo TellezÎncă nu există evaluări
- Propiedades de La Sustancia Pura y Diagrama, Gas Ideal, Análisis de Masa y EnergíaDocument9 paginiPropiedades de La Sustancia Pura y Diagrama, Gas Ideal, Análisis de Masa y EnergíaJhony Alfonso Atiaga VelasteguiÎncă nu există evaluări
- Syllabus - Fisicoquimica 1-2024Document86 paginiSyllabus - Fisicoquimica 1-2024Mileny Mamani Valdez0% (1)
- Libro Transporte Parte 2Document38 paginiLibro Transporte Parte 2Omar QvÎncă nu există evaluări
- Analisis Al SIPDocument88 paginiAnalisis Al SIPOscar Jiménez100% (3)
- 3 CalorimetríaDocument33 pagini3 CalorimetríaJoan Carrion RamosÎncă nu există evaluări
- Manual Basico Aspen HYSYSDocument114 paginiManual Basico Aspen HYSYSmmonjard80% (5)
- Guía Gases PDFDocument27 paginiGuía Gases PDFÁngel Pérez ZapataÎncă nu există evaluări