Documente Academic
Documente Profesional
Documente Cultură
Ex0 C3 Reactions Totales Ou Limitees
Încărcat de
Med BriniTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Ex0 C3 Reactions Totales Ou Limitees
Încărcat de
Med BriniDrepturi de autor:
Formate disponibile
Ex0C3
EXERCICES SUR LES RACTIONS TOTALES OU LIMITES
1.
Solution dacide ascorbique
On prpare 500 mL dune solution aqueuse en dissolvant dans leau pure 0,44 g dacide ascorbique C 6H8O6 ( vitamine C ) en poudre. Le pH de
cette solution vaut 3,2 .
Le couple qui intervient est C6H8O6 / C6H7O6- ( ion ascorbate).
MC = 12 g/mol
MH = 1,0 g/mol
MO = 16 g/mol
a.
Calculer la concentration molaire en solut apport (ou introduit) dans cette solution aqueuse.
b. Montrer, en utilisant la variation du pH au cours de la dissolution, quune raction sest produite entre lacide ascorbique et leau. On
admet que cette raction est trs rapide.
c.
crire lquation de cette raction et montrer quil sagit dune raction acido-basique. Identifier les 2 couples acido-basiques.
d. Construire son tableau davancement. On dfinira pralablement lavancement x et on calculera lavancement maximal x m.
e. Calculer lavancement final xf en utilisant la valeur du pH de la solution.
f.
La raction tudie est-elle totale ou limite ? Justifier la rponse. Calculer le taux davancement final.
g. Donner la composition finale de la solution en quantits de matire, puis calculer les concentrations molaires finales des espces en
solution.
h. Expliquer pourquoi on parle alors dquilibre chimique. En quoi est-il dynamique ?
2.
Solution dacide chlorhydrique
On dissout 1,0 L de chlorure dhydrogne gazeux HCl dans 1,0 L deau pure, sans variation de volume.
La mesure du pH de cette solution dacide chlorhydrique donne 1,4.
volume molaire gazeux : Vm = 25 L.mol-1
a.
Calculer la concentration molaire de cette solution en solut introduit.
b. Montrer que la dissolution du chlorure dhydrogne dans leau constitue une raction acido-basique. crire lquation de cette raction,
quon admettra trs rapide. Identifier les 2 couples acido-basiques mis en jeu dans cette raction.
c.
Dresser le tableau davancement de cette raction.
d. Dterminer les valeurs de lavancement maximal et de lavancement final. Conclure. Que vaut le taux davancement final ?
e. Calculer les concentrations molaires finales des espces prsentes dans la solution . Est-il correct dcrire sur ltiquette dun flacon
contenant de lacide chlorhydrique la formule HCl ? Justifier.
f.
partir de la solution prcdente, on dsire prparer par dilution 200 mL dune solution chlorhydrique de concentration molaire 2
mmol.L-1 . Quel volume de solution initiale doit-on prlever ? Quelle verrerie doit-on utiliser ?
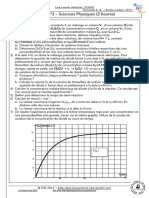
3. Dilution dune solution dacide mthanoque
Lacide mthanoque, ou acide formique (de formica = fourmi), de formule
HCOOH, constitue le liquide projet par les fourmis sur leurs adversaires. De c ( mol/L )
mme, les dmangeaisons dsagrables provoques par les orties sont dues
pH
lacide mthanoque.
On mesure le pH de diffrentes solutions dacide mthanoque.
a.
b.
1,0 10-2
1,0 10-3
2,4
3,0
3,4
crire la formule de la base conjugue de lacide mthanoque. Nommer-la.
laide de lquation de la raction entre lacide mthanoque et leau, et de son tableau davancement, tablir la relation :
[ H3O+ ]
=
c
c.
d.
1,0 10-1
, tant le taux davancement final et c la concentration molaire de la solution.
Calculer la valeur de correspondant chacune des 3 solutions.
Comment volue le taux davancement final quand on dilue une solution dacide mthanoque ?
4. Une solution aqueuse dacide perchlorique HClO4 aq , de concentration molaire en solut apport cHClO4 =2,0010-3mol.L-1 a un pH=2,70.
a.
crire lquation de la raction entre lacide perchlorique et leau. Indiquer les 2 couples acido-basiques mis en jeu dans cette raction
b. Construire le tableau davancement de la raction prcdente. Dterminer lavancement maximal, lavancement final et le taux
davancement final. Conclure.
c.
Faire linventaire des espces chimiques prsentes dans cette solution ltat final.
5. Une solution aqueuse dacide hypochloreux HClOaq , de concentration molaire en solut apport cHClO = 1,0 10-2 mol.L-1 , a un pH = 4,7
a.
crire lquation de la raction entre lacide hypochloreux et leau. Indiquer les 2 couples acido-basiques mis en jeu dans cette
raction.
b et c : mme questions que lexercice 5
6.
Le chlorure dammonium NH4Cl est un solide ionique, soluble dans leau.
Celle-ci disperse les ions chlorure et ammonium. Les ions chlorure sont indiffrents (ou spectateurs).
a.
crire lquation de dissolution.
b. Une solution aqueuse de chlorure dammonium, de concentration molaire en solut introduit c = 1,0 10-1 mol.L-1 , a un pH = 5,1.
Montrer quil y a eu raction entre lion ammonium et leau.
Construire le tableau davancement de la raction prcdente.
Dterminer lavancement maximal, lavancement final et le taux davancement final. Conclure.
S-ar putea să vă placă și
- EquilibreQoutionReactionExercices 16-17 PDFDocument4 paginiEquilibreQoutionReactionExercices 16-17 PDFالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Acide Base ExercicesDocument36 paginiAcide Base Exerciceschaari abdelouahadÎncă nu există evaluări
- Série d'Éxercices Des Transformations Associées Aux Réactions Acido-basiques2024Document3 paginiSérie d'Éxercices Des Transformations Associées Aux Réactions Acido-basiques2024sassin2006Încă nu există evaluări
- Série 5 Transformations Associées À Des Réactions Acido-Basiques en Solution AqueuseDocument6 paginiSérie 5 Transformations Associées À Des Réactions Acido-Basiques en Solution AqueuseFATIMA fatiii100% (1)
- Réactions Acido-Basiques PDFDocument9 paginiRéactions Acido-Basiques PDFAzizElheniÎncă nu există evaluări
- Chimie en Ligne TD 8 Acides BasesDocument5 paginiChimie en Ligne TD 8 Acides BasesMed BriniÎncă nu există evaluări
- Acides Et Bases PcDocument15 paginiAcides Et Bases Pcrkibi.khadija2006Încă nu există evaluări
- C.P 22-23 Solution AqueusesDocument2 paginiC.P 22-23 Solution AqueusesdiarratogsibÎncă nu există evaluări
- Les transf chimiq s’effectuant ds les deux sens - Série 2 - Soutien à distance - Prof OTHMANEDocument11 paginiLes transf chimiq s’effectuant ds les deux sens - Série 2 - Soutien à distance - Prof OTHMANEAyoub LatifÎncă nu există evaluări
- Transformations Chimiques S Effectuant Dans Les 2 Sens Exercices Non Corriges 1 1Document4 paginiTransformations Chimiques S Effectuant Dans Les 2 Sens Exercices Non Corriges 1 1boufdili0% (2)
- Exercices 5transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseDocument1 paginăExercices 5transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseIman QÎncă nu există evaluări
- Exercice IDocument15 paginiExercice IInes De Paul Feudjeu100% (1)
- Série D'exercices 5, Transformations Associées À Des Réactions Acido-Basiques en Solution - Dosage, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument12 paginiSérie D'exercices 5, Transformations Associées À Des Réactions Acido-Basiques en Solution - Dosage, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDboudhar mohamed0% (1)
- Exerice Équilibre ChimiqueDocument2 paginiExerice Équilibre ChimiqueMouad HmiÎncă nu există evaluări
- Acides Et Bases SMDocument23 paginiAcides Et Bases SMSalma ZaÎncă nu există evaluări
- Activités Réaction S'effectuant Dans Les Deux Sens - CopieDocument1 paginăActivités Réaction S'effectuant Dans Les Deux Sens - CopieC'est YanaÎncă nu există evaluări
- Transformations Chimiques S Effectuant Dans Les 2 Sens Activites 1 1Document1 paginăTransformations Chimiques S Effectuant Dans Les 2 Sens Activites 1 1Youssef AddiÎncă nu există evaluări
- Exercices 1transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseDocument1 paginăExercices 1transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseAyoub ShaitÎncă nu există evaluări
- C7 Af BF WahabDiopDocument5 paginiC7 Af BF WahabDiopGaye BachirÎncă nu există evaluări
- TD PH COUPLE-ACIDE-BASE 2016Document13 paginiTD PH COUPLE-ACIDE-BASE 2016Oumar TraoréÎncă nu există evaluări
- Exercices Chapitre 2 Et 3 R actionsAB PDFDocument2 paginiExercices Chapitre 2 Et 3 R actionsAB PDFAnas HasniÎncă nu există evaluări
- Série N°8Document2 paginiSérie N°8Jihad ELÎncă nu există evaluări
- Bac Math Pysh Acide Base Serie 4Document1 paginăBac Math Pysh Acide Base Serie 4Nourhene Jlassi33% (3)
- Serie 12 Acide BaseDocument4 paginiSerie 12 Acide Basemazen chebbiÎncă nu există evaluări
- Série 1 - équilibre Chimique (WWW - Pc1.ma)Document6 paginiSérie 1 - équilibre Chimique (WWW - Pc1.ma)b01554837Încă nu există evaluări
- tp11 Evolution Spontanee D Un Systeme Chimique EleveDocument4 paginitp11 Evolution Spontanee D Un Systeme Chimique Elevemohamed laghribÎncă nu există evaluări
- Serie3 Reaction LimitéDocument1 paginăSerie3 Reaction Limitéhurrem unsalezÎncă nu există evaluări
- Série Réaction Acide BaseDocument5 paginiSérie Réaction Acide BaseScriblouÎncă nu există evaluări
- TR ACIDOBASIQUES PCDocument11 paginiTR ACIDOBASIQUES PCalaeddineÎncă nu există evaluări
- Examens de Chimie-1Document17 paginiExamens de Chimie-1Anas HajimÎncă nu există evaluări
- Preuve de Chimie, BAC Séries C-D, Année 2015, CamerounDocument4 paginiPreuve de Chimie, BAC Séries C-D, Année 2015, CamerounJean Pierre GatsouÎncă nu există evaluări
- Couple Acide - Base: ExercicesDocument16 paginiCouple Acide - Base: ExercicesAhamadi ElhouyounÎncă nu există evaluări
- TransReaAcideBaseExercices 16-17 PDFDocument7 paginiTransReaAcideBaseExercices 16-17 PDFالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Les Transformations Effectuent 2 SensJKDocument3 paginiLes Transformations Effectuent 2 SensJKsouukainazaarÎncă nu există evaluări
- Série 1 - Dosage Acido-BasiqueDocument2 paginiSérie 1 - Dosage Acido-BasiqueAzdine MC100% (1)
- Série D'exercices N°7 - Chimie Série Physique Dipole RLC SCIENCE & MATH - Bac Sciences Exp (2011-2012) MR TLILI TOUHAMI PDFDocument2 paginiSérie D'exercices N°7 - Chimie Série Physique Dipole RLC SCIENCE & MATH - Bac Sciences Exp (2011-2012) MR TLILI TOUHAMI PDFAzizElheni100% (1)
- Banque D'exercicesDocument37 paginiBanque D'exercicesyves100% (4)
- Série Acide - BaseDocument6 paginiSérie Acide - BaseMehdi Bnmssd100% (1)
- Série 1 - Équilibre ChimiqueDocument6 paginiSérie 1 - Équilibre ChimiqueMed RT100% (1)
- Etat D Equilibre D Un Systeme Chimique Exercices Non Corriges 4 1Document2 paginiEtat D Equilibre D Un Systeme Chimique Exercices Non Corriges 4 1boufdiliÎncă nu există evaluări
- Cours de VirologieDocument5 paginiCours de VirologieFrancisca AgboviÎncă nu există evaluări
- Serie 7 ChimieDocument6 paginiSerie 7 ChimieJabri ImeneÎncă nu există evaluări
- Feuille TD n°3Document2 paginiFeuille TD n°3Warren Wany'sÎncă nu există evaluări
- Série de TD N°2 - Équilibres Acido-BasiquesDocument2 paginiSérie de TD N°2 - Équilibres Acido-Basiqueskim namjoon100% (1)
- Serie 2 Les Transformations S'effectuants en Deux Sens Etat D'equilibre (2) - 1Document4 paginiSerie 2 Les Transformations S'effectuants en Deux Sens Etat D'equilibre (2) - 1yunuabou3Încă nu există evaluări
- Exercices-Transformations-non-totales-d - Un-Système-Chimique (WWW - Pc1.ma)Document5 paginiExercices-Transformations-non-totales-d - Un-Système-Chimique (WWW - Pc1.ma)Walaa WalaaÎncă nu există evaluări
- Acides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeDocument5 paginiAcides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeNjuga Sene100% (1)
- 21 PH Des Solutions Aqueuses 3Document2 pagini21 PH Des Solutions Aqueuses 3Ilyes Ben JemaaÎncă nu există evaluări
- Solutions AqueuesDocument3 paginiSolutions AqueuesnorelÎncă nu există evaluări
- SeÌ Rie 1 - Dosage Acido-BasiqueDocument2 paginiSeÌ Rie 1 - Dosage Acido-Basiqueb01554837Încă nu există evaluări
- TD Acide Faible-2024-Lsll - WahabdiopDocument2 paginiTD Acide Faible-2024-Lsll - Wahabdiopxydj5wh2wbÎncă nu există evaluări
- Serie Dexercices Dacides Et Bases Du Bac Sciences en TunisieDocument5 paginiSerie Dexercices Dacides Et Bases Du Bac Sciences en TunisieJaafar Abdelhafidh100% (1)
- Exercices 2 Réaction S'effectuant Dans Les Deux Sens - CopieDocument1 paginăExercices 2 Réaction S'effectuant Dans Les Deux Sens - CopieMohamed SalhÎncă nu există evaluări
- S2 - Equilibres Acido-Basiques en Solution AqueuseDocument4 paginiS2 - Equilibres Acido-Basiques en Solution AqueuseZAguirÎncă nu există evaluări
- Etat D 'Quilibre 1Document1 paginăEtat D 'Quilibre 1hamzacrypto080Încă nu există evaluări
- Serie Acide BaseDocument5 paginiSerie Acide Basebenmaleksamir84Încă nu există evaluări
- TD Exercices Corrigés Chimie en SolutionDocument21 paginiTD Exercices Corrigés Chimie en SolutionOussam Ouadidi63% (16)
- Équilibres en solution: Les Grands Articles d'UniversalisDe la EverandÉquilibres en solution: Les Grands Articles d'UniversalisÎncă nu există evaluări
- Applications de la spectrophotomérie en phytochimie: sciencesDe la EverandApplications de la spectrophotomérie en phytochimie: sciencesÎncă nu există evaluări
- Glucides: Les Grands Articles d'UniversalisDe la EverandGlucides: Les Grands Articles d'UniversalisÎncă nu există evaluări
- 2008 09 Antilles Exo3 Sujet Titrage DemiEq PKa 4ptsDocument2 pagini2008 09 Antilles Exo3 Sujet Titrage DemiEq PKa 4ptsMed BriniÎncă nu există evaluări
- C01 Cinetique CorrectionDocument5 paginiC01 Cinetique CorrectionMed BriniÎncă nu există evaluări
- Suivi CinetiqueDocument7 paginiSuivi CinetiqueMed BriniÎncă nu există evaluări
- Devoir de Synthese N - 1-2Document5 paginiDevoir de Synthese N - 1-2Med BriniÎncă nu există evaluări
- D5 TS1 2016 LSLL Wahabdiop PDFDocument3 paginiD5 TS1 2016 LSLL Wahabdiop PDFMed BriniÎncă nu există evaluări
- Physique Terminale PDFDocument175 paginiPhysique Terminale PDFMed Brini100% (2)
- Sal-Dev 2 15-16 TS2Document2 paginiSal-Dev 2 15-16 TS2Med BriniÎncă nu există evaluări
- Cours Physique Nature Ondulatoire de La Lumiere Sciences2016 Eleve1Document4 paginiCours Physique Nature Ondulatoire de La Lumiere Sciences2016 Eleve1Med BriniÎncă nu există evaluări
- Particule Dans Champ ElectDocument1 paginăParticule Dans Champ ElectMed BriniÎncă nu există evaluări
- On Réalise Le Montage Schématisé CiDocument11 paginiOn Réalise Le Montage Schématisé CiMed BriniÎncă nu există evaluări
- Ac - Base 1Document2 paginiAc - Base 1Med BriniÎncă nu există evaluări
- CO2 TS2 2016 LSLL Interrompu WahabdiopDocument4 paginiCO2 TS2 2016 LSLL Interrompu WahabdiopMed BriniÎncă nu există evaluări
- 2009 Afrique Exo3 Sujet Quantique Brahic 4ptsDocument3 pagini2009 Afrique Exo3 Sujet Quantique Brahic 4ptsla physique selon le programme FrançaisÎncă nu există evaluări
- CO1 TS2 2016 LSLL WahabdiopDocument4 paginiCO1 TS2 2016 LSLL WahabdiopMed BriniÎncă nu există evaluări
- D3 TS2 2017 Copel WahabdiopDocument2 paginiD3 TS2 2017 Copel WahabdiopMed BriniÎncă nu există evaluări
- D3 TS2 2017 Copel WahabdiopDocument2 paginiD3 TS2 2017 Copel WahabdiopMed BriniÎncă nu există evaluări
- CO1 TS1 2016 Lolb Wahabdiop-1Document4 paginiCO1 TS1 2016 Lolb Wahabdiop-1Med Brini0% (1)
- Project NavireDocument3 paginiProject NavireMed BriniÎncă nu există evaluări
- D0 TS2 2006 LSLL Ramplacement WahabdiopDocument2 paginiD0 TS2 2006 LSLL Ramplacement WahabdiopMed BriniÎncă nu există evaluări
- Sal-Dev 2 15-16 TS2Document2 paginiSal-Dev 2 15-16 TS2Med BriniÎncă nu există evaluări
- D0 TS2 2006 LSLL Ramplacement WahabdiopDocument2 paginiD0 TS2 2006 LSLL Ramplacement WahabdiopMed BriniÎncă nu există evaluări
- D3 TS1 2016 LSLL Full WahabdiopDocument3 paginiD3 TS1 2016 LSLL Full WahabdiopMed BriniÎncă nu există evaluări
- Sal-Dev 2 15-16-TS3Document3 paginiSal-Dev 2 15-16-TS3Med BriniÎncă nu există evaluări
- CO1 TS2 2016 LSLL WahabdiopDocument4 paginiCO1 TS2 2016 LSLL WahabdiopMed BriniÎncă nu există evaluări
- Le Livre de PHYSIQUE - CHIMIE 1er S PDFDocument88 paginiLe Livre de PHYSIQUE - CHIMIE 1er S PDFالغزيزال الحسن EL GHZIZAL Hassane89% (44)
- Le Livre de PHYSIQUE - CHIMIE 1er S PDFDocument88 paginiLe Livre de PHYSIQUE - CHIMIE 1er S PDFالغزيزال الحسن EL GHZIZAL Hassane89% (44)
- Sal-Dev 1 15-16 TS3Document3 paginiSal-Dev 1 15-16 TS3Med BriniÎncă nu există evaluări
- D2 TS1 2016 Lolb WahabdiopDocument4 paginiD2 TS1 2016 Lolb WahabdiopMed BriniÎncă nu există evaluări
- Exercices Champs Electrique Et Energie Potntielle Electrique SM 12 PDFDocument3 paginiExercices Champs Electrique Et Energie Potntielle Electrique SM 12 PDFMed BriniÎncă nu există evaluări
- Exercices Champs Electrique Et Energie Potntielle Electrique SM 12 PDFDocument3 paginiExercices Champs Electrique Et Energie Potntielle Electrique SM 12 PDFMed BriniÎncă nu există evaluări
- Contrats Speciaux de FormationDocument7 paginiContrats Speciaux de FormationBencherqui YassineÎncă nu există evaluări
- Mode de Metre Normalise Des Ouvrages Sur PlanDocument38 paginiMode de Metre Normalise Des Ouvrages Sur PlanEDOHÎncă nu există evaluări
- Analyse Comptable Et Financière PDFDocument31 paginiAnalyse Comptable Et Financière PDFAna ToufikÎncă nu există evaluări
- Analyse Fonctionnelle BilanDocument18 paginiAnalyse Fonctionnelle BilanlcombetÎncă nu există evaluări
- Energie EolienneDocument3 paginiEnergie EolienneAlexandra Roxana CosteaÎncă nu există evaluări
- 2012 04 26 Best QualiteProgressive AFNORDocument45 pagini2012 04 26 Best QualiteProgressive AFNORTê HátÎncă nu există evaluări
- Indh Taroudant 2019Document3 paginiIndh Taroudant 2019ESSANHAJI AliÎncă nu există evaluări
- Exercices-Corr HacheurDocument11 paginiExercices-Corr HacheurNihad Aghbalou80% (5)
- MS Maritime - DossierDocument40 paginiMS Maritime - DossierEsther PieriÎncă nu există evaluări
- Disjoncteur MagnetothermiqueDocument6 paginiDisjoncteur MagnetothermiqueMaxence KouessiÎncă nu există evaluări
- Examen - de - Rattrapage - FAC - Lic - Prof - Juillet - 2013.docx Filename UTF-8''Examen de Rattrapage FAC Lic Prof Juillet 2013Document5 paginiExamen - de - Rattrapage - FAC - Lic - Prof - Juillet - 2013.docx Filename UTF-8''Examen de Rattrapage FAC Lic Prof Juillet 2013Lolita LoloÎncă nu există evaluări
- Analyse Du Système D'optimisation de La Trésorerie À La CIEDocument104 paginiAnalyse Du Système D'optimisation de La Trésorerie À La CIECoulibaly KhalilÎncă nu există evaluări
- Bip 2018Document80 paginiBip 2018antoinekayokaÎncă nu există evaluări
- France - Politique: Le Cadeau Fiscal de Sarkozy Et Woerth À L'aga KhanDocument4 paginiFrance - Politique: Le Cadeau Fiscal de Sarkozy Et Woerth À L'aga KhanPascal GibertÎncă nu există evaluări
- Diapo Analyse FinancièreDocument13 paginiDiapo Analyse FinancièreAu DreyÎncă nu există evaluări
- TDS Leaflet FRDocument10 paginiTDS Leaflet FRteteatangana01Încă nu există evaluări
- Signalisation de Police Nadia 2013 007034200 1530 19032013Document26 paginiSignalisation de Police Nadia 2013 007034200 1530 19032013Morad AsadeÎncă nu există evaluări
- Chap.12.Management Des Approv. Du ProjetDocument19 paginiChap.12.Management Des Approv. Du ProjetAssef ZraouraÎncă nu există evaluări
- Plan de Production OptimalDocument14 paginiPlan de Production OptimalMad AbdouÎncă nu există evaluări
- Livre Blanc TFS - tsf-2012v8!8!24pDocument24 paginiLivre Blanc TFS - tsf-2012v8!8!24pch71Încă nu există evaluări
- Pompes Immergees FR 2013 VLDocument54 paginiPompes Immergees FR 2013 VLgueyetapha77Încă nu există evaluări
- Grille de Salaires Par Activite Et Par Fonction-2 PDFDocument1 paginăGrille de Salaires Par Activite Et Par Fonction-2 PDFjasoo__Încă nu există evaluări
- H3 La Vie Au Moyen AgeDocument5 paginiH3 La Vie Au Moyen Agesandra.leforestier.2Încă nu există evaluări
- BOUCHRADocument18 paginiBOUCHRAKenza BensaidÎncă nu există evaluări
- Conditions Générales AutoDocument64 paginiConditions Générales AutoSalvadorÎncă nu există evaluări
- Cours Droit Des SuccessionsDocument51 paginiCours Droit Des Successionsruben0406Încă nu există evaluări
- Rapport de Stage ONEDocument28 paginiRapport de Stage ONEmohammed_afif664371% (7)
- Courroie Synchrone (TEXROPE)Document64 paginiCourroie Synchrone (TEXROPE)jfejfe100% (1)
- Economie Politique L1Document159 paginiEconomie Politique L1guiguigolden100% (1)
- Katalog FRDocument15 paginiKatalog FRdukonÎncă nu există evaluări