Documente Academic
Documente Profesional
Documente Cultură
TD CG - 01 Acides Bases
Încărcat de
Med BriniTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
TD CG - 01 Acides Bases
Încărcat de
Med BriniDrepturi de autor:
Formate disponibile
TS1C
CG_01
2011-2012
EXERCICES Acides / Bases
A - Gnralits sur les quilibres acido-basiques
1. Ecrire les quations des ractions de chacun des difices suivants sur leau ; en dduire sil
sagit dacides, de bases ou dampholytes acido-basiques.
HCO3HNO3
S2SO42Zn(H2O)62+
C6H5NH3+
C2H5OH2PO4BrSO2
2. Calculer les constantes thermodynamiques des ractions acido-basiques suivantes :
C6H5COO- + H2O =
C6H5COOH + OHpKA = 4,2
HCO3 =
CO2 + OH
pKA = 6,4 et 10
HCO3- + H2O = CO32- + H3O+
HF + OH- =
F- + H2 O
pKA = 3,2
PO43- + H3O+ = HPO42- + H2O
pKA = 2,2 7,2 12,1
3. Soit lacide benzoque pour lequel KA = 6,3.10-5.
a) Dmontrer sur cet exemple la relation entre la constante dacidit KA et le coefficient de
dissociation dun acide faible.
b) Calculer le coefficient de dissociation de lacide benzoque en solution
1,0.10-1 mol.L-1 et 1,0.10-4 mol.L-1.
4. Classer par ordre de basicit dcroissante les bases suivantes, en justifiant la rponse :
C2O42- (pKA = 4,1) ; SO42- (pKA = 2,1) ; C6H5NH2 (pKB = 9,4) ; CH3COO- (KA = 1,8.10-5).
5. Reprsenter le diagramme de prdominance des diffrentes formes acido-basiques
correspondant au dioxyde de carbone en solution aqueuse. pKA1 = 6,4 ; pKA2 = 10,3.
6. Dans une solution de soude on fait barboter du dioxyde de carbone CO2 raison de
0,100 mol.L-1. Le pH final est pH = 10,8. Calculer les concentrations molaires des espces
OH-, CO2(aq), HCO3-, CO32- dans le mlange obtenu. Pour CO2(aq) : pKA1 = 6,4 ; pKA2 = 10,3.
7. Dans une solution dhydrognophosphate de potassium 0,100 mol.L-1, on ajoute de lacide
chlorhydrique avec une variation de volume ngligeable. Le pH final est pH = 6,8. Calculer les
concentrations molaires des espces H3PO4, H2PO4-, HPO42-, PO43- dans le mlange obtenu.
Pour H3PO4 : pKA1 = 2,1 ; pKA2 = 7,2 ; pKA3 = 12,3.
B Calculs de pH
Toute relation donnant le pH sera dmontre et toute approximation sera justifie.
I- Calculer le pH des solutions suivantes :
1. Acides forts
a. solution dacide nitrique 0,0100 mol.L-1 puis 1,00 10-7 mol.L-1.
b. un mlange de 100,0 mL dacide nitrique 0,0100 mol.L-1 et 200,0 mL dacide
chlorhydrique
0,0500 mol.L-1.
TS1C
CG_01
2011-2012
2. Bases fortes
a. solution dhydroxyde de sodium 1,00 10-3 mol.L-1 puis 1,00 10-7 mol.L-1.
b. un mlange de 200,0 mL de soude 5,00 10-3 mol.L-1 et 300,0 mL de potasse 2,00 10-3
mol.L-1.
3. Acides faibles
a. solution dacide thanoque 0,0100 mol.L-1 puis 1,00 10-5 mol.L-1 (pKA = 4,8).
b. solution dacide monochlorothanoque 0,0100 mol.L-1 (pKA = 2,9).
4. Bases faibles
a. solution dammoniaque 0,0100 mol.L-1 puis 1,00 10-5 mol.L-1 (pKA = 9,2).
b. solution dthylamine 0,0100 mol.L-1 (pKA = 10,6).
5. Polyacides et polybases
a. solution dacide phosphorique 0,100 mol.L-1 (H3PO4 pKA1 = 2,1 ; pKA2 = 7,2 et pKA3=
12,1).
b. solution dacide sulfurique centimolaire (pKA1 = 0 ; pKA2 = 1,9).
c. solution dacide sulfurique 1,00 10-4 mol.L-1 (pKA1 = 0 ; pKA2 = 1,9).
d. solution 0,0100 mol.L-1 de phosphate de sodium (H3PO4 pKA1 = 2,1 ; pKA2 = 7,2 et pKA3
= 12,1).
6. Ampholytes
a. solution 0,100 mol.L-1 puis 1,00 10-4 mol.L-1 dhydrognocarbonate de sodium (H2CO3
pKA1 = 6,3 ; pKA2 = 10,4).
b. solution 0,100 mol.L-1 dhydrognooxalate de sodium (H2C2O4 pKA1 = 1,2 ; pKA2 = 4,3).
7. Mlanges
a. V1 = 30,0 mL dune solution de soude c1 = 0,100 mol.L-1 + V2 = 100 mL dune solution
dacide chlorhydrique c2 = 0,020 mol.L-1 + V3 = 50,0 mL dune solution de chlorure de
sodium c3 = 0,0100 mol.L-1.
b. acide chlorhydrique 0,100 mol.L-1 et acide thanoque 0,100 mol.L-1 (pKA = 4,8).
c. acide thanoque 0,100 mol.L-1 (pKA = 4,8) et chlorure dammonium 0,100 mol.L-1 (pKA
= 9,2).
d. acide thanoque 0,100 mol.L-1 (pKA = 4,8) et acide mthanoque 0,0100 mol.L-1 (pKA =
3,8).
e. acide thanoque 0,0100 mol.L-1et thanoate de sodium 0,0200 mol.L-1 (pKA = 4,8).
f. acide thanoque 1,00 10-5 mol.L-1et thanoate de sodium 2,00 10-5 mol.L-1 (pKA =
4,8).
g. solution de nitrite dammonium 0,100 mol.L-1(HNO2 pKA = 3,3 et NH4+ pKA = 9,2).
II- Calculer le pH des solutions suivantes :
1. solution dacide chlorique centimolaire (pKA = 0)
2. solution de chlorate de sodium dcimolaire
3. solution de chlorure dammonium dcimolaire (pKA = 9,2)
4. solution de nitrate de zinc 0,0100 mol.L-1 (pKA = 9,6)
5. solution dacide orthoborique centimolaire (H3BO3 pKA = 9,2)
6. solution de benzoate de sodium centimolaire (pKA = 4,2)
7. solution dhypochlorite de sodium centimolaire (pKA = 7,5)
8. solution doxalate de sodium dcimolaire (H2C2O4 pKA1 = 1,2 ; pKA2 = 4,3)
9. solution dacide sulfureux centimolaire (H2SO3 pKA1 = 1,9 ; pKA2 = 7,2)
10. solution de sulfite de sodium centimolaire (H2SO3 pKA1 = 1,9 ; pKA2 = 7,2)
2
TS1C
CG_01
2011-2012
11. solution 0,200 mol.L-1 dhydrognophosphate de sodium (H3PO4 pKA1 = 2,1 ; pKA2 =
7,2 et pKA3= 12,1).
12. solution dhydrognosulfate de sodium dcimolaire (pKA1 = 0 ; pKA2 = 1,9)
13. solution dhydrognosulfure dammonium centimolaire (H2S pKA1 = 7,0 ; pKA2 = 14,0 et
NH4+ pKA = 9,2)
14. solution dhydrognophosphate de sodium et dammonium centimolaire (H3PO4 pKA1 =
2,1 ; pKA2 = 7,2 et pKA3= 12,1 et NH4+/NH3 pKA = 9,2).
15. solution de phosphate dammonium centimolaire (H3PO4 pKA1 = 2,1 ; pKA2 = 7,2 et
pKA3= 12,1 et NH4+/NH3 pKA = 9,2).
16. solution de borax centimolaire :
Na2B4O7 , 10 H2O 2 Na+ + B4O72et B4O72- + 7 H2O 2 H3BO3 + 2 B(OH)4H3BO3 / B(OH)4- pKA = 9,2
III- Calculer le pH des mlanges suivants :
1. V1 = 250 mL dune solution dacide chlorhydrique c1 = 0,100 mol.L-1 + V2 = 500 mL dune
solution dacide fluorhydrique c2 = 0,100 mol.L-1(pKA = 3,2).
2. V1 = 1,00 L dune solution dammoniaque c1 = 0,0200 mol.L-1 (pKA = 9,2) + V2 = 10,00 mL
dune solution de cyanure de sodium c2 = 2,00 mol.L-1 (pKA = 9,3).
3. V1 = 200 mL dune solution dammoniaque de concentration c1 = 0,200 mol.L-1 et
V2 = 400 mL dune solution de chlorure dammonium de concentration c2 = 0,150 mol.L-1.
(pKA = 9,2).
4. On mlange V1 = 20,00 mL dune solution dacide thanoque de concentration molaire
c1 = 0,100 mol.L-1 avec un volume V2 dune solution de soude de concentration molaire
c2 = 0,100 mol.L-1.
Calculer 25C le pH du mlange obtenu dans les 3 cas suivants :
V2 = 14,00 mL
V2 = 20,00 mL
V2 = 24,00 mL
CH3COOH / CH3COO- pKA = 4,8
C Applications
1. Pour chacune des solutions suivantes, donner les espces majoritaires et le rapport entre les
concentrations de chaque acide et de leur base associe :
a. solution d'hydrognocarbonate de potassium, pH = 4 / pH = 8 / pH = 13
pKa :
6,4
10,3
b. mlange acide actique et ammoniac, pH = 2 / pH = 6 / pH = 12
pKa :
4,8
9,2
c. mlange acide actique et acide formique, pH = 1 / pH = 3 / pH = 7
pKa :
4,8
3,8
d. mlange acide oxalique et aniline, pH = 2 / pH = 8 / pH = 11
pKa :
1,2 et 4,3
4,6
e. solution d'acide phosphorique, pH = 4 / pH = 9
pKa : 2,1 ; 7,2 et 12,3.
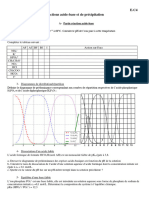
2. Lacide malonique HOOC CH2 COOH est un diacide not H2A. Le document ci-dessous
donne son diagramme de distribution en fonction du pH : les courbes reprsentent les
pourcentages de chacune des espces H2A, HA- et A2- en fonction du pH.
3
TS1C
CG_01
2011-2012
a) Donner pour chacun des pourcentages son expression en fonction de h et des constantes
dacidit notes KA1 et KA2 de lacide malonique.
b) Dduire du diagramme les valeurs de pKA1 et pKA2.
3. Identification d'un indicateur color.
On dispose d'un flacon d'indicateur color avec comme seule indication sa concentration molaire :
C0 = 2,90.10-4 mol.L-1. On mesure son pH : 4,2.
Le couple acide/base prsent dans cet indicateur color sera not HInd/Ind.
La solution d'indicateur color a t prpare partir de la forme acide de l'indicateur : HInd.
a. Dterminer lavancement et le taux de dissociation final de la raction de l'acide HInd
avec l'eau.
b. Donner l'expression littrale de la constante d'acidit KA de la raction de l'acide HInd sur
l'eau. La calculer et identifier l'indicateur l'aide des donnes du tableau suivant :
Indicateur
Couleur acide
Zone de virage
Couleur basique
pKA
Hlianthine
rouge
3,1 4,4
Jaune orang
3,7
Vert de Bromocrsol
jaune
3,8 5,4
bleu
4,7
Bleu de Bromothymol
jaune
6,0 7,6
bleu
7,0
Phnolphtaline
incolore
8,2 10,0
fuschia
9,4
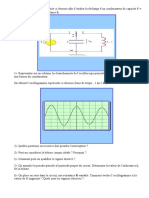
4. On dose un volume V1 = 100,0 mL dune solution ammoniaque de concentration molaire c1 =
0,050 mol.L-1 par une solution dacide chlorhydrique de concentration c2 = 0,050 mol.L-1.
a. Calculer 25C le pH du mlange obtenu selon les diffrents volumes dacide
chlorhydrique verss :
V2 = 40,0 mL
V2 = 100,0 mL
V2 = 130,0 mL
b. Vrifier vos rsultats avec la courbe de dosage ci-dessous, obtenue laide du
logiciel de simulation Dozzzaqueux.
TS1C
CG_01
2011-2012
NH4+ / NH3 pKA = 9,2
5. On mlange un volume V1 = 10,00 mL dune solution de carbonate de sodium de concentration
molaire c1 = 0,060 mol.L-1 avec un volume V2 dune solution dacide chlorhydrique de
concentration molaire c2 = 0,100 mol.L-1.
a. Calculer le pH du mlange obtenu selon les diffrents volumes dacide chlorhydrique
verss :
V2 = 1,80 mL; 6,00 mL ; 10,20 mL ; 12,00 mL ; 13,80 mL
b. Vrifier vos valeurs en traant la courbe de dosage laide du logiciel Dozzzaqueux.
On donne pKA1 = 6,3 et pKA2 = 10,3
6. Etude dun acide amin naturel
Un acide amin naturel a pour formule :
Ce compos existe ltat solide et en solution aqueuse sous la forme :
appele amphion ou ion dipolaire ou zwitterion
1) Expliquer pourquoi ?
2) Quelle est la formule de la base conjugue de lamphion ?
3) Quelle est la formule de lacide conjugu de lamphion ?
4) Lamphion intervient dans 2 couples acide /base ; dans le cas ou R est le groupe mthyle
(lacide amin est lalanine) les constantes dacidit des deux couples sont :
KA1 = 10-2,3 ; KA2 = 10-9,9.
- Attribuer chaque couple sa constante dacidit.
- Etablir le domaine de prdominance de chaque espce.
5) a) Calculer 25C le pH dune solution dalanine de concentration c = 0,100 mol.L-1.
b) A 100 mL de cette solution on ajoute sans variation de volume 5,00 10-3 mol de chlorure
dhydrogne ; calculer la nouvelle valeur du pH.
c) Refaire le mme calcul si lon ajoute 5,00 10-3 mol de soude.
S-ar putea să vă placă și
- Équilibres en solution: Les Grands Articles d'UniversalisDe la EverandÉquilibres en solution: Les Grands Articles d'UniversalisÎncă nu există evaluări
- Glucides: Les Grands Articles d'UniversalisDe la EverandGlucides: Les Grands Articles d'UniversalisÎncă nu există evaluări
- Série Acide - BaseDocument6 paginiSérie Acide - BaseMehdi Bnmssd100% (1)
- TD Exercices-Corrigés PDFDocument21 paginiTD Exercices-Corrigés PDFabdelouahed.rhaouiÎncă nu există evaluări
- Chimie en Solution PDFDocument27 paginiChimie en Solution PDFKhalid Zeg0% (1)
- CHP 2 TD - Chimie - SolutionDocument8 paginiCHP 2 TD - Chimie - SolutionSimplice Assemien100% (2)
- Acides Bases PDFDocument8 paginiAcides Bases PDFHafidi AhmedÎncă nu există evaluări
- TD Risa Uman 2017 Final 2Document9 paginiTD Risa Uman 2017 Final 2Sa Majesté David50% (2)
- Solutionaqueusechap 2TDDocument2 paginiSolutionaqueusechap 2TDHamzaÎncă nu există evaluări
- TD Exercices Corrigés Chimie en SolutionDocument21 paginiTD Exercices Corrigés Chimie en SolutionOussam Ouadidi65% (17)
- TD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseDocument5 paginiTD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - Monobaseel hazbi fadilaÎncă nu există evaluări
- E.C4 - Réaction Acide Base Et de PrécipitationDocument4 paginiE.C4 - Réaction Acide Base Et de Précipitationnoamassin78Încă nu există evaluări
- Série D'éxercices Des Transformations Associées Aux Réactions Acido-Basiques2024Document3 paginiSérie D'éxercices Des Transformations Associées Aux Réactions Acido-Basiques2024sassin2006Încă nu există evaluări
- Acides Et Bases SMDocument23 paginiAcides Et Bases SMSalma ZaÎncă nu există evaluări
- TD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseDocument5 paginiTD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseLOUkmen Bel100% (1)
- Caisse de Solidarite Du Groupe G3 Nioro Du RipDocument3 paginiCaisse de Solidarite Du Groupe G3 Nioro Du RipMohamed CoulibalyÎncă nu există evaluări
- PH Des Solutions Aqueuses 023 0Document10 paginiPH Des Solutions Aqueuses 023 0km.aouadiÎncă nu există evaluări
- Série D'exercices - Chimie PH Des Solutions AqueusesDocument4 paginiSérie D'exercices - Chimie PH Des Solutions AqueusesBaccari100% (2)
- Solutions Aqueuses IpDocument13 paginiSolutions Aqueuses IpEmmanuel PolvenskyÎncă nu există evaluări
- Serie 5CDocument3 paginiSerie 5CTwansa WbattalaÎncă nu există evaluări
- Dosage Acide Base IndicDocument3 paginiDosage Acide Base IndicAs Ma50% (2)
- Dosage Acide BaseDocument4 paginiDosage Acide BaseSaifeddine Makni0% (1)
- Cours de VirologieDocument5 paginiCours de VirologieFrancisca AgboviÎncă nu există evaluări
- Chimyaeaa 3 AedadzDocument66 paginiChimyaeaa 3 Aedadzsoufyane el ouahabiÎncă nu există evaluări
- MPSI2 TD1 R Acido BasiqueDocument4 paginiMPSI2 TD1 R Acido Basiquehidamohamed326Încă nu există evaluări
- S - Rie TD Chimie1Document12 paginiS - Rie TD Chimie1Aristide MfifenÎncă nu există evaluări
- Réactions Acido-Basiques PDFDocument9 paginiRéactions Acido-Basiques PDFAzizElheniÎncă nu există evaluări
- Ex 1Document6 paginiEx 1teghre chekhne El koryÎncă nu există evaluări
- TD Acide Faible Base Faible Constante Dacidite TS2 2023 2024Document12 paginiTD Acide Faible Base Faible Constante Dacidite TS2 2023 2024fallccheikhÎncă nu există evaluări
- TD PH COUPLE-ACIDE-BASE 2016Document13 paginiTD PH COUPLE-ACIDE-BASE 2016Oumar TraoréÎncă nu există evaluări
- Acides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeDocument5 paginiAcides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeNjuga Sene100% (1)
- Chimie en Ligne TD 8 Acides BasesDocument5 paginiChimie en Ligne TD 8 Acides BasesMed BriniÎncă nu există evaluări
- S2 - Equilibres Acido-Basiques en Solution AqueuseDocument4 paginiS2 - Equilibres Acido-Basiques en Solution AqueuseZAguirÎncă nu există evaluări
- Exercices 1transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseDocument1 paginăExercices 1transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseAyoub ShaitÎncă nu există evaluări
- Travaux Dirigés BIO 141 N°1Document2 paginiTravaux Dirigés BIO 141 N°1Berthe Aristide Ngue Nkongo100% (3)
- Serie 9 CHIMIE DES SOLUTIONS AQUEUSES 2Document2 paginiSerie 9 CHIMIE DES SOLUTIONS AQUEUSES 2deyinÎncă nu există evaluări
- Chimie en SolutionDocument27 paginiChimie en SolutionNabil holmes100% (3)
- Serie 12 Acide BaseDocument4 paginiSerie 12 Acide Basemazen chebbiÎncă nu există evaluări
- Chimie TD Force Acide BaseDocument3 paginiChimie TD Force Acide BaseJunior Le PyromaneÎncă nu există evaluări
- Exercices 8Document3 paginiExercices 8charafensamÎncă nu există evaluări
- Série de TD N°2 - Équilibres Acido-BasiquesDocument2 paginiSérie de TD N°2 - Équilibres Acido-Basiqueskim namjoon100% (1)
- 2° Contrôle SMPC S2 2012 2013 PDFDocument2 pagini2° Contrôle SMPC S2 2012 2013 PDFAbdelah El ArabiÎncă nu există evaluări
- 2° Contrôle SMPC S2 2012 2013Document2 pagini2° Contrôle SMPC S2 2012 2013lahssane hmidat100% (1)
- 2° Contrôle SMPC S2 2012 2013 PDFDocument2 pagini2° Contrôle SMPC S2 2012 2013 PDFAbdelah El ArabiÎncă nu există evaluări
- 2° Contrôle SMPC S2 2012 2013 PDFDocument2 pagini2° Contrôle SMPC S2 2012 2013 PDFAbdelah El ArabiÎncă nu există evaluări
- 2° Contrôle SMPC S2 2012 2013 PDFDocument2 pagini2° Contrôle SMPC S2 2012 2013 PDFAbdelah El Arabi100% (2)
- BAC SM 2008 2018 Acide Et BaseDocument14 paginiBAC SM 2008 2018 Acide Et BaseEL BAKRAOUI YOUSSEF100% (1)
- Série D'exercices - Chimie - PH Des Solution - Bac Math (2016-2017) MR Afdal AliDocument3 paginiSérie D'exercices - Chimie - PH Des Solution - Bac Math (2016-2017) MR Afdal AliDhiya Klai100% (1)
- TD Tampon 2013 lsll-WahabDiopDocument4 paginiTD Tampon 2013 lsll-WahabDiopFy EzahanaÎncă nu există evaluări
- Serie 13 BACDocument4 paginiSerie 13 BACimenehmida2023Încă nu există evaluări
- Brochure de Chimie TSMDocument53 paginiBrochure de Chimie TSMOūs Mān BereteÎncă nu există evaluări
- C6 TDDocument2 paginiC6 TDKld Mnt0% (1)
- Transformations Liees A Des Reactions Acide Base Exercices Non Corriges 1 1Document6 paginiTransformations Liees A Des Reactions Acide Base Exercices Non Corriges 1 1boufdili100% (2)
- Série Réaction Acide BaseDocument5 paginiSérie Réaction Acide BaseScriblouÎncă nu există evaluări
- Solutions Aqueuses Acides Et BasiquesDocument3 paginiSolutions Aqueuses Acides Et BasiquesLiza mezariÎncă nu există evaluări
- Acides Et Bases en Solution Aqueuse-1-1Document6 paginiAcides Et Bases en Solution Aqueuse-1-1Lumière HabaÎncă nu există evaluări
- BAC SM 2008 2018 Acide Et BaseDocument14 paginiBAC SM 2008 2018 Acide Et BaseHAMADA1972100% (2)
- Applications de la spectrophotomérie en phytochimie: sciencesDe la EverandApplications de la spectrophotomérie en phytochimie: sciencesÎncă nu există evaluări
- Traité élémentaire de chimie: Tomes 1&2: Présenté dans un ordre nouveau et d'après les découvertes modernes; avec FiguresDe la EverandTraité élémentaire de chimie: Tomes 1&2: Présenté dans un ordre nouveau et d'après les découvertes modernes; avec FiguresÎncă nu există evaluări
- Suivi CinetiqueDocument7 paginiSuivi CinetiqueMed BriniÎncă nu există evaluări
- Devoir de Synthese N - 1-2Document5 paginiDevoir de Synthese N - 1-2Med BriniÎncă nu există evaluări
- Cours Physique Nature Ondulatoire de La Lumiere Sciences2016 Eleve1Document4 paginiCours Physique Nature Ondulatoire de La Lumiere Sciences2016 Eleve1Med BriniÎncă nu există evaluări
- Ac - Base 1Document2 paginiAc - Base 1Med BriniÎncă nu există evaluări
- Physique Terminale PDFDocument175 paginiPhysique Terminale PDFMed Brini100% (2)
- CO2 TS2 2016 LSLL Interrompu WahabdiopDocument4 paginiCO2 TS2 2016 LSLL Interrompu WahabdiopMed BriniÎncă nu există evaluări
- D3 TS2 2017 Copel WahabdiopDocument2 paginiD3 TS2 2017 Copel WahabdiopMed BriniÎncă nu există evaluări
- CO1 TS1 2016 Lolb Wahabdiop-1Document4 paginiCO1 TS1 2016 Lolb Wahabdiop-1Med Brini0% (1)
- D3 TS2 2017 Copel WahabdiopDocument2 paginiD3 TS2 2017 Copel WahabdiopMed BriniÎncă nu există evaluări
- D5 TS1 2016 LSLL Wahabdiop PDFDocument3 paginiD5 TS1 2016 LSLL Wahabdiop PDFMed BriniÎncă nu există evaluări
- Project NavireDocument3 paginiProject NavireMed BriniÎncă nu există evaluări
- CO1 TS2 2016 LSLL WahabdiopDocument4 paginiCO1 TS2 2016 LSLL WahabdiopMed BriniÎncă nu există evaluări
- Série D'exercices #11 - Sciences Physiques Masse Volumique - Solubilité - 1ère AS (2010-2011) MR Adam BoualiDocument2 paginiSérie D'exercices #11 - Sciences Physiques Masse Volumique - Solubilité - 1ère AS (2010-2011) MR Adam BoualiMed BriniÎncă nu există evaluări
- Série D'exercices #11 - Sciences Physiques Masse Volumique - Solubilité - 1ère AS (2010-2011) MR Adam BoualiDocument2 paginiSérie D'exercices #11 - Sciences Physiques Masse Volumique - Solubilité - 1ère AS (2010-2011) MR Adam BoualiMed BriniÎncă nu există evaluări
- Sal-Dev 2 15-16 TS2Document2 paginiSal-Dev 2 15-16 TS2Med BriniÎncă nu există evaluări
- D0 TS2 2006 LSLL Ramplacement WahabdiopDocument2 paginiD0 TS2 2006 LSLL Ramplacement WahabdiopMed BriniÎncă nu există evaluări
- D2 TS1 2016 Lolb WahabdiopDocument4 paginiD2 TS1 2016 Lolb WahabdiopMed BriniÎncă nu există evaluări
- On Réalise Le Montage Schématisé CiDocument11 paginiOn Réalise Le Montage Schématisé CiMed BriniÎncă nu există evaluări
- Qte Mat+noeudDocument3 paginiQte Mat+noeudMed BriniÎncă nu există evaluări
- Concentration 3Document2 paginiConcentration 3Med Brini100% (1)
- Série D'exercices #11 - Sciences Physiques Masse Volumique - Solubilité - 1ère AS (2010-2011) MR Adam BoualiDocument2 paginiSérie D'exercices #11 - Sciences Physiques Masse Volumique - Solubilité - 1ère AS (2010-2011) MR Adam BoualiMed BriniÎncă nu există evaluări
- Série D'exercices - Physique Chimie - 1ère As MR YoussefDocument2 paginiSérie D'exercices - Physique Chimie - 1ère As MR YoussefMed Brini100% (1)
- Les Enjeux de La MondialisationDocument4 paginiLes Enjeux de La MondialisationLudvik L'emblematikÎncă nu există evaluări
- Comptabilité SectorielleDocument61 paginiComptabilité SectorielleDhahri Tarek71% (7)
- Série de Chimie - 4ème Année Sc. Exp - Technique & MathématiquesDocument3 paginiSérie de Chimie - 4ème Année Sc. Exp - Technique & MathématiquesأشرفالمبروكÎncă nu există evaluări
- Exposé Les Obligation D'un Agent CommercialDocument13 paginiExposé Les Obligation D'un Agent CommercialBouslim HassanÎncă nu există evaluări
- Rapport de Thèse MQ V03Document73 paginiRapport de Thèse MQ V03Marcos QuispeÎncă nu există evaluări
- Alergenos e Dermatites France Ta86Document23 paginiAlergenos e Dermatites France Ta86Airton MarinhoÎncă nu există evaluări
- Stratégies Des Femmes Dans La Lutte Contre La Pauvreté en Zone Urbaine: Cas de L'association Chigata de Natiokobadara Dans La Commune de Korhogo (Côte D'ivoire)Document9 paginiStratégies Des Femmes Dans La Lutte Contre La Pauvreté en Zone Urbaine: Cas de L'association Chigata de Natiokobadara Dans La Commune de Korhogo (Côte D'ivoire)IJEAB JournalÎncă nu există evaluări
- Expose Tva WordDocument43 paginiExpose Tva Wordredecosadman100% (1)
- T2 S201Document2 paginiT2 S201Anonymous 73gEYyEtLÎncă nu există evaluări
- PFE Bella Rim PDFDocument100 paginiPFE Bella Rim PDFtrkÎncă nu există evaluări
- Marketing StratégiqueDocument2 paginiMarketing StratégiqueKhalid Fadil100% (1)
- LCPDocument1 paginăLCP6406Încă nu există evaluări
- 2017 Chiffres Clés BovinsDocument12 pagini2017 Chiffres Clés BovinsdindanayÎncă nu există evaluări
- Devis Peinture & Sol Appt RDCDocument2 paginiDevis Peinture & Sol Appt RDCetravoÎncă nu există evaluări
- Aide À La Mise en Place D'un Atelier de Fabrication Mécanique en Adéquation Avec La Norme ISO 9001/2000Document111 paginiAide À La Mise en Place D'un Atelier de Fabrication Mécanique en Adéquation Avec La Norme ISO 9001/2000Nassim Yanis94% (17)
- Ne Le Dis Pas A MamanDocument784 paginiNe Le Dis Pas A Mamansouna200100% (2)
- MKT S5 +corrigéDocument4 paginiMKT S5 +corrigéIRIZI CHAIMAA100% (1)
- Analyse Financiere SommaireDocument7 paginiAnalyse Financiere SommairekamalÎncă nu există evaluări
- Formation Sur Les Marchés Publics TSGO 2016Document125 paginiFormation Sur Les Marchés Publics TSGO 2016Ayoub Fares100% (1)
- Géographie HUMAINE Géographie UrbaineDocument30 paginiGéographie HUMAINE Géographie UrbaineEstebane MAILELT100% (8)
- Cap2 FeuilletageDocument4 paginiCap2 FeuilletagePawan CoomarÎncă nu există evaluări
- Une Réforme Du Secteur Bancaire Et Financier en AlgérieDocument8 paginiUne Réforme Du Secteur Bancaire Et Financier en AlgérieRaouf MaÎncă nu există evaluări
- Pont - Haubans-En-Harpe - PPTX Filename - UTF-8''pont-à-haubans-en-harpeDocument34 paginiPont - Haubans-En-Harpe - PPTX Filename - UTF-8''pont-à-haubans-en-harpefareshassen1996Încă nu există evaluări
- Numismatique: Vendredi 24 Mai 2019 À 9H30 Et 14HDocument35 paginiNumismatique: Vendredi 24 Mai 2019 À 9H30 Et 14HAbdelghafour MezianeÎncă nu există evaluări
- Presentation TPMDocument12 paginiPresentation TPManas lhabachiÎncă nu există evaluări
- Cas PratiquesDocument12 paginiCas PratiquesHalyna114100% (1)
- Fin RapportpdfDocument3 paginiFin RapportpdfMelissa LeblancÎncă nu există evaluări
- Vérification Du Réalisme D'idéeDocument4 paginiVérification Du Réalisme D'idéeatoÎncă nu există evaluări
- Exercices Heritage 1Document2 paginiExercices Heritage 1iTarfa2Încă nu există evaluări
- Management Des ProcessusDocument93 paginiManagement Des ProcessusMohammed Marzake100% (44)