Documente Academic
Documente Profesional
Documente Cultură
Acide Base PDF
Încărcat de
Foudil LaouiciTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Acide Base PDF
Încărcat de
Foudil LaouiciDrepturi de autor:
Formate disponibile
CM C3a - anne 2006-07 - B.
Vuillemin - Universit de Bourgogne
REACTIONS ACIDE-BASE EN SOLUTIONS
AQUEUSES
I - Dfinitions (rappels)
Dfinition selon Brnsted (1923)
- Un acide est une espce chimique qui est susceptible de librer un proton selon
une raction de type :
A " B + H+
Exemples :
CH3 COOH " CH3 COO- + H+
HCl " H+ + ClNH4 + " NH3 + H+
- Une base est une espce chimique qui est susceptible de capter un proton selon
une raction de type :
B + H+ " A
Exemples : (les ractions inverses des ractions ci-dessus)
OH- + H+ " H2 O
- Un acide est d'autant plus fort qu'il libre facilement son proton,
- Une base est d'autant plus forte qu'elle capte facilement un proton.
NB : une base peut aussi tre dfinie comme une espce susceptible de librer un
ion OH- (dfinition d'Arrhnius).
- Un polyacide est une espce susceptible de librer plusieurs protons.
diacides : H2 SO4 , H2 S, H2 CO3
triacides : H3 PO4
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
- Une polybase est une espce susceptible de capter plusieurs protons.
dibases : S2-, CO32tribase : PO4 3- Une espce amphotre est une espce qui rassemble les deux caractres acide et
basique.
Exemples : H2 O, HS -, HCO3-, (Ecrire les ractions relatives aux deux
couples acide/base de chaque espce)
NB : Il existe une autre dfinition de l'acidito-basicit dite de Lewis. Au sens de
Lewis :
-
un acide est une espce (molcule, ion,) "pauvre" en lectrons : cations
une base est une espce (molcule, ion,) "riche" en lectrons : anions,
molcules avec insaturations et/ou doublets libres.
II - Equilibres acide-base
II-1 Raction acide -base en solution aqueuse
Le caractre acide d'une espce n'a de sens que dans la mesure o une autre
espce peut capter le proton libr, en d'autre terme dans le cadre d'une raction
(ou quilibre) dite acido-basique. Par exemple la raction :
CH3 COOH (aq) + NH3 (aq) = CH3 COO- (aq) + NH4 + (aq)
K=104,5 25C.
qui peut tre considre comme la somme des deux demi ractions.
CH3 COOH " CH3 COO- + H+
NH3 + H+ " NH4 +
NB : Gnralement pour les calculs on pourra considrer qu'une raction est
totale si K>103 , et qu'elle ne se fait quasiment pas pour K>10-3 . Entre ces deux
valeurs il est difficile de faire des approximations sur l'avancement de la raction.
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
Compte tenu de la constante de cet quilibre, on peut dire qu'un quilibre acidobasique est "dplac" dans le sens de la consommation de l'acide et de la base la
plus forte.
Toutes les ractions acide-base que nous allons tudier ont lieu en solution
aqueuse. La mise en solution d'un acide ou d'une base dans l'eau se traduira donc
toujours par une raction, ou quilibre, acido-basique tant donn le caractre
amphotre de H2 O. Ce caractre amphotre peut amener l'eau ragir sur "ellemme" dans le cadre d'une raction d'change de proton :
H2 O+ H+ " H3 O+
H2 O " OH- + H+
Soit au bilan :
2 H2 O = H3 O+ + OHCette raction, appele autoprotolyse de l'eau, pour constante Ke=10-14 25C.
A 80C, cette valeur de Ke devient 36,4.10-14 . Que valent les concentrations en
H3 O+ et OH- dans ces conditions ? Cette raction est elle endo- ou exothermique ?
II-2 Forces relatives des acides et des bases
On choisit de classer les acides (et les bases) par rapport un solvant amphotre,
H2 O.
Exemple : couple Acide/base A/B. Que se passe-t'il lorsque l'on met A dans l'eau.
1er cas : l'acide est totalement dissoci, par exemple 1 L de solution d'acide
chlorhydrique de concentration 0,01 mol/L:
HCl (g) +H2 O " Cl- (aq)+ H3 O+ (aq)
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
HCl
Cl-
H3 O+
t=0
0,01 mole
t>0 , ni
0,01 mole
0,01 mole
Ci
soit 0,01 mol L-1
soit 0,01 mol L-1
si, dans les mmes conditions (mme nombre de mole, mme volume,), on met
un autre acide totalement dissoci A' en solution, on aura toujours au final C0 =
n0
V
moles de H3 O+ en solution.
Conclusion : en solution aqueuse il est impossible de diffrentier, au niveau de
leur force respective, deux acides totalement dissocis (appels aussi "acides
fort").
Exemples d'acides totalement dissocis en solution aqueuse : HCl, HNO3 , H2 SO4
(seule la premire acidit est "forte").
2eme cas : l'acide est partiellement dissoci
A(aq) + H2 O = B (aq) + H3 O+ (aq)
t=0
(tat quilibre)
H3 O+
n0 mole
mole
mole
x mol L-1
x mol L-1
C0
t>0 =tq, ni
Ci
n0 -
C0-x mol L-1
NB : tant en phase HOMOGENE, on peut exprimer un avancement par unit de
volume x=/V en mol/L.
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
A l'quilibre, la concentration (ou activit) de chaque espce est donne par la
constante d'quilibre Ka appele constante d'acidit :
Ka =
[B] [H3O+ ] = x 2 = C0 2
[A]
C0 x 1
si est le taux de dissociation (=nb de mole dissocie/nombre de mole initiale =
/n0= =x/C0 )
Plus l'acide a tendance sa dissocier dans le solvant :
-
plus " 1
plus x " C0
plus son Ka est grand
plus son pKa (=- log(Ka)) est petit.
Lorsque les acides sont partiellement dissocis dans le solvant (="acides faibles").
leur force respective peut tre classe (contrairement aux "acides forts") selon une
chelle de Ka ou de pKa. Ainsi on dit que l'acide faible A est plus fort que A' si :
Ka(A/B) > Ka(A'/B')
pKa(A/B) < pKa(A'/B')
Exemples d'acide partiellement dissocis dans l'eau : H2 S, HF, H2 CO3 , H2 SO4
(deuxime acidit), les acides organiques (CH3 COOH, HCOOH, .)
Remarque : Si on remplace l'eau par un solvant plus acide, tel l'acide thanoque
anhydre, H2 SO4 devient un monoacide faible :
H2 SO4 (sol) + CH3 COOH (l)= HSO4 - (sol) + CH3 COOH2 +(sol)
Cas des bases : Le traitement est strictement identique. Si on considre le cas
d'une base B que l'on met en solution dans l'eau :
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
1er cas : Une base totalement dissocie dans l'eau est dite "forte". On montre ainsi
qu'il n'exis te pas de base plus forte que OH- en solution aqueuse.
Exemples de bases fortes : CH3 CH2 ONa, NaOH
CH3 CH2 ONa " CH3 CH2O- + Na+
CH3 CH2 O- + H2O " CH3 CH2OH + OH2eme cas : Si la base n'est que partiellement dissocie, on parle d'une base faible :
exemple : NH3 + H2 O = NH4 + + OHde constante d'quilibre :
] [
K e OH NH+4
=
Ka
NH3
En effet l'quilibre ci-dessus est la somme des deux quilibres :
NH3 + H3 O+= NH4 + + H2 O
2 H2 O = H3 O+ + OHConsquences :
H3 O+, acide conjugu de H2 O, tant l'acide le plus fort pouvant se trouver
en solution aqueuse,
OH-, base conjugue de H2 O, tant la base la plus forte pouvant se trouver
en solution aqueuse,
que valent les Ka des couples H3 O+/H2 O et H2 O/OH- ?
+
- H3 O /H2 O : H3 O + H2 O = H2 O + H3O
- H2 O/OH- : H2 O + H2 O = H3 O+ + OH-
a (H 2O) a ( H3O+ )
K a=
=1, pKa=0
a (H3O+ ) a ( H2O)
Ka= Ke=10-14 , pK a=14
On ne pourra donc discerner dans l'eau la force d'un couple acide/base faible d'un
autre couple que si leur pKa sont dans l'intervalle [0,14].
6
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
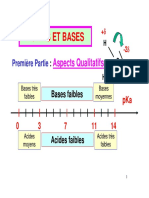
Echelle de pKa de diffrents couples acide-base
Acide
H2 SO3
H3 PO4
HF
CH3 COOH
H2 CO3
ACIDE
DE
FORCE
CROISSANTE
H2 S
H2 PO4
HSO3
NH4+
HCN
HCO3
HPO42
HS
pKA
1,9
2,2
3,2
4,7
6,4
7
7,2
7,2
9,2
9,3
10,3
12,3
12,9
base
HSO3
H3 PO4
F
CH3 COO
HCO3
HS
HPO42
SO32
NH3
CN
CO32
PO43
S- -
BASE
DE
FORCE
CROISSANTE
Compte tenu des valeurs de Ka, on pourra dire que dans une solution d'acide
faible, par exemple HF, la forme acide prdomine deva nt la forme basique, soit :
[HF]>>[F-].
De la mme faon dans une solution de base faible, par exemple KCN, la forme
basique prdomine devant la forme acide, soit : [CN-]>>[HCN].
II-3 Polyacides et polybases (faibles)
Lorsqu'un polyacide est mis en solution, plusieurs quilibres acido-basique vont
se produire.
Polyacides : H2 S, qui est un gaz dans les conditions standards, est soluble dans
l'eau.
H2 S (g) = H2 S (aq)
H2 S (aq) + H2 O = HS - (aq)+ H3 O+ (aq)
HS- (aq) + H2 O = S2- (aq)+ H3 O+ (aq)
[H O ] [HS ]=10-7
+
Ka1=
[H2S]
[H O ] [S ] =10-13
Ka2=
[HS ]
+
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
Par consquent, compte tenu des valeurs des Ka, une solution aqueuse de H2 S
contiendra "principalement " H2 S, "trs peu" de HS -, et "quasiment pas" de S2-.
Dans tous les cas des polyacides faibles, la deuxime acidit est souvent trs
faible par rapport la premire (cart de plus de 2 units de pKa). Donc on peut
dire qu'un polyacide faible se comporte de la mme faon qu'un monoacide faible.
Autres exemples : Ecrire les quilibres pour CO2 (g) (responsable de
l'acidification de l'eau distille), et H3 PO4 .
Polybase : Le raisonnement est strictement le mme (traiter les cas de Na2 CO3 ,
Na2 S), et conduit la conclusion qu'une polybase faible se comporte de la mme
faon qu'une monobase faible.
III - Distribution des espces en fonction du pH (spciation)
III-1 Definition du pH
La notion de pH a t introduite par Sorensen (1909) pour caractriser l'activit en
ions H3 O+
(le pH est une mesure de "l'acidit libre"):
pH= log a (H 3O + )
ou, en solution dilue : pH= log H 3O +
Donc si on arrive dterminer la concentration en ions H3 O+ d'une solution, on
peut en calculer le pH. Toutefois le pH est avant tout une grandeur mesure
exprimentalement l'aide d'une lectrode de pH.
Ce qui intresse le plus souvent le chimiste c'est de connatre la concentration de
toutes les espces prsentes en fonction du pH du milieu (spciation).
Question : la mesure du pH permet-elle de connatre avec prcision la
concentration en H3 O+ libre ?
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
Rponse : Si l'on considre qu'une mesure de pH s'effectue avec une prcision
tout au plus de 0,5 unit de pH :
pH = log H 3O+ =
ln H 3O +
2,3
[ ]
[ ]
[H O ]
(pH) =
2,3[H O ]
[H O ]
[H O ] = 2,3(pH) 11%
d (pH) =
d H 3O +
2,3 H3O+
+
Ce qui est trs insuffisant !
III-2 Calcul des concentrations
a- Mthode analytique
Le calcul de la concentration des diffrentes espces d'un systme l'quilibre
s'effectue, de la faon la plus rigoureuse, en posant autant d'quations
indpendantes qu'il n'y a d'espces dans le milieu, et rsoudre ce systme
d'quations non linaires par une mthode analytique ou numrique.
La dmarche suivre sera donc la suivante :
- crire toutes les ractions chimiques
- faire le bilan des espces prsentes en solution.
- crire toutes les quations ncessaires pour dterminer la quantit de chacune
des espces prsentes en solution : constantes d'quilibre, conservation de la
matire, lectroneutralit de la solution (il faut bien entendu autant d'quations
qu'il y a d'inconnues).
- rsoudre ce systme d'quations.
exemple 1: calculer le pH d'une solution de soude de concentration C0 .
NaOH (s) "Na+ + OH2 H2 O = H3 O+ + OH-
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
3 espces sont prsentes l'quilibre : Na+, OH- et H3 O+ il faut donc 3 quations :
constante d'quilibre : Ke=[ H3 O+].[ OH-]=10-14
lectroneutralit :
C z
i i
= 0 soit : [Na+] + [H3 O+] =[OH-]
conservation de la matire : C0 = [Na+]
Le calcul se fait le plus facilement en rsolvant l'quation d'lectroneutralit dans
laquelle on exprime toutes les concentrations en fonction de [H3 O+] et des
grandeurs connues (les Ki et les C0 ). Si on a "n" inconnues, on arrive un
polynme de degr "n-1".
On comprend que la mise en quation devient de plus en plus ardue lorsque l'on
augmente le nombre d'espces dans le milieu :
Exemple 2 : cas d'une solution d'acide faible AH de concentration C0 .
AH +H2 O = A- (aq)+ H3 O+ (aq)
2 H2 O = H3 O+ + OHOn a cette fois 4 espces en solution, on doit donc arriver un polynme de degr
3:
Ka =
[A ] [H O ]
[AH ]
Ke=[ H3 O+].[ OH-]
electroneutralit : [H3 O+] =[OH-]+ [A-]
Conservation de la matire : [AH]+[A-]=(C 0 -x)+x=C0 (faire le tableau
d'avancement)
A partir de l'quation d'lectroneutralit :
[ H 3O + ] =
Ke
K a C0
+
+
[ H3O ] [H 3O+ ] + Ka
[ H3O+ ]3 + K a [ H3O+ ]2 ( K a C0 + K e )[ H3O+ ] Ka K e = 0
10
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
Ce qui devient trs vite fastidieux rsoudre moins de faire quelques
approximations :
1ere approximation : le milieu est acide, donc [H3 O+] >>[OH-],
lectroneutralit : [H3 O+] ~ [A-]
2eme approximation : un acide faible est trs faiblement dissoci (faux si pKa<2
et/ou si l'acide est trs dilu!), donc [AH]>>[A-]. On a donc :
C0 ~ [AH]
Donc:
[H O ]
=
+ 2
Ka
C0
pH = log[ H 3O + ] =
1
(pK a log C0 )
2
Dans le cas d'une base faible telle qu'une solution d'ammoniac NH3 de
concentration C0 , vous montrerez que :
-
on a 4 espces en solution,
avec le mme type d'approximations, on arrive
C H 3O +
Ka = 0
Ke
1
pH = log[ H 3O + ] = ( pKa + pK e + log C0 )
2
b- Mthodes graphiques
Les mthodes graphiques sont drives des mthodes analytiques. Elles consistent
le plus souvent reprsenter, sur un graphe, la concentration (ou des rapports de
concentration) des diffrentes espces en fonction du pH. En ce sens elles ne sont
pas vraiment destines calculer un pH.
Reprenons le couple acide-base AH/A- :
AH +H2 O = A- (aq)+ H3 O+ (aq)
11
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
et considrons que l'on part d'une solution d'acide AH de concentration C0 dont on
va imposer le pH en ajoutant un acide ou une base forte concentre :
-
au dpart, cet acide tant peu dissoci (car faible) on peut dire que
[AH]>>[A-]
si on alcalinise le milieu, en ajoutant une base forte, l'quilibre ci-dessus
sera dplac dans le sens gauche droite (cf loi de modration) et on peut
imaginer qu' pH basique on aura [AH]<<[A-].
Nous allons reprsenter la concentration des diffrentes espces en fonction du
pH.
* log H 3O + =-pH
* log OH = log
Ke
=pH-14
[ H 3O + ]
* log [AH] ?
Ka =
[A ] [H O ]
[AH ]
[AH]+[A-]=C0
D'aprs ces deux quations on peut crire :
(C0 [ AH]) [ H3O+ ]
Ka =
[ AH]
log[ AH ] = log C0 + log[ H3O+ ] log( Ka + [H3O+ ])
1er cas : Ka<<[H3 O+] ce qui quivaudrait dire que [H3 O+]/K a >10, soit pH<pKa-1
log[ AH] = log C0
2eme cas : Ka>>[H3 O+] ce qui quivaudrait dire que [H3 O+]/K a <10, soit
pH>pKa+1
log[ AH] = log C0 + pK a pH
* log [A-] ?
Ka =
[A ] [H O ]
[AH ]
12
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
[AH]+[A-]=C0
D'aprs ces deux quations on peut crire :
[A ] [H3O+ ]
Ka =
C0 [ A ]
log[ A ] = pKa + log C0 log( Ka + [H3O+ ]
1er cas : Ka<<[H3 O+], soit pH<pKa-1
log[ A ] = pH pKa + log C0
2eme cas : Ka>>[H3 O+], soit pH>pKa+1
log[ A ] = log C0
Remarques :
-
on voit bien que pour pH<pKa, c'est la forme acide AH qui prdomine, et
pour pH>pKa c'est la forme A-,
pour
pKa-1<pH<pKa+1, on est oblig d'utiliser les formules non
approximes pour tracer log[AH] et log[A-]=f(pH),
-
lorsque pH=pKa, log[A-]=log[AH]=logC 0 -log2,
on a utilis toutes les quations, sauf celle d'lectroneutralit.
Prenons
l'exemple
du
couple
CH3 COOH/CH3 COO-
(pKa=4,8)
concentration totale C0 =10-2 mol/L.
-
pour pH<pKa :
log[AH]=-2
log[A-]=pH-6,8
pour pH>pKa :
log[AH]= 2,8-pH
log[A-]=-2
le diagramme est donn ci-dessous :
13
une
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
Une autre faon de reprsenter la distribution des espces est d'utiliser le
diagramme de prdominance. Ce diagramme s'obtient partir des mmes
formules de conservation de la matire et de constante d'quilibre :
Ka =
[A ] [H O ]
[AH ]
[AH]+[A-]=C0
D'aprs ces deux quations on peut crire :
* fraction de AH =
* fraction de A- =
[ AH]
[ H 3O + ]
=
C0
[ H 3O + ] + K a
[ A ]
Ka
=
C0
[ H 3O + ] + K a
Dans le cas prcdent de l'acide thanoque on obtient le graphe suivant :
14
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
IV- Calcul des concentrations aprs ractions acide-base
La dtermination de la concentration de chaque espce aprs raction acide-base
peut tre conduite de faon rigoureuse comme nous l'avons vu dans le chapitre
prcdent, c'est--dire en posant autant d'quations que d'inconnues.
Toutefois cette approche peut se rvler fastidieuse dans certains cas (plus de 4
espces diffrentes en solution). C'est la raison pour laquelle on est amen le plus
souvent faire des approximations, et plus particulirement ne considrer dans
les calculs que les ractions de constante d'quilibre K la plus leve, que l'on
appelle "raction prpondrante"
mthodologie :
Le calcul du pH par la raction prpondrante s'effectue de la faon suivante :
- On classe tous les couples acido-basiques intervenant dans la solution sur une
chelle de pKa.
15
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
- On repre toutes les espces majoritaires prsentes initialement (c'est--dire
avant toute raction) en solution.
- On crit toutes les ractions acido-basiques possibles ainsi que leur constante
d'quilibre K.
- La concentration de chacune des espces est dtermine l'aide de tableaux
d'avancement effectus sur les ractions dites quantitatives, c'est--dire ayant une
constante d'quilibre leve (K > 100).
- Le pH est dtermin partir du tableau d'avancement de la premire raction
non quantitative.
Exemple 1 : pH dun acide faible en solution dans leau
Soit un acide faible HA ( ex CH3 COOH) mis en solution dans leau avec une
concentration initiale en acide (avant raction avec leau) C0 =10-2 mol/L
* On trace un diagramme o figurent les diffrents couples acide-base
intervenant, et on repre les espces prsentes initialement (avant tout quilibre):
Force croissante de lacide
H3 0+
CH3COOH
H2O
H2 O
CH3COO -
OH-
4,8
14
pKa
Force croissante de la base
* La raction prpondrante est celle qui se fait entre l'acide le plus fort et la base
la plus forte, soit :
CH3COOH + H2 O = CH3COO + H3 O+
Ka= 10-4,8
(2 H2 O = H3 O+ + OH Ke = 1014 )
16
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
* On fait un tableau d'avancement :
CH3 COOH
CH3 COO -
H3 O+
t=0
C0
t>0 =tq,
C0-x mol L-1
x mol L-1
x mol L-1
[CH COO ] [H O ] =
=
Ka
[CH3COOH]
x2
C0 x
et on rsout cette quation du second degr. Cela dit on peut (parfois!) faire
l'hypothse suivante pour simplifier le calcul : l'acide tant faible (trs
partiellement dissoci), x<<C0 , et donc :
Ka
x2
C0
x = C0 K a
log x = pH =
1
( pKa log C0 )
2
NB : cette dernire hypothse doit toujours tre vrifie a posteriori.
Application numrique : x=5,6. 10-4 mol/L, pH=3,2
Exemple 2 : Concentration des diffrentes espces dans une solution de carbonate
de sodium de concentration C0 =10-2 mol/L.
Na2 CO3 " 2 Na+ + CO32-
Force croissante de lacide
H3 0+
HCO 3-
H 2O
H2 O
CO3 2-
OH-
10,3
14
Force croissante de la base
17
pKa
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
On voit que la raction prpondrante est :
CO32-+ H2 O =HCO3 - + OH-
K= Ke/K a =2 10-4
CO32-
HCO3 -
OH-
t=0
10-2
t>0 =tq,
10-2-x mol L-1
x mol L-1
x mol L-1
Kb =
x2
x2
10 2 x 10 2
x = 10 2 K b
x=[OH-]= [HCO3-]=1,4 10-3 mol/L
[CO32-]=8,6 10-3 mol/L
[H 3 O+]=7,1 10-12 (pH=11,1)
On remarque que l'approximation consistant ngliger x devant 10-2 est "limite".
La rsolution de l'quation sans approximation donne une valeur de x=1,3 10-3
mol/L.
Exemple 3 : mlange de 10-2 mole de NH4Cl avec 2 10-2 moles de CH3 COONa
dans un litre d'eau.
NH4 Cl(s) " NH4 + + ClCH3COONa(s) " CH3COO + Na+
Force croissante de lacide
H3 0+
CH3COOH
NH4+
H2O
H2 O
CH3COO -
NH3
OH-
4,8
9,2
14
Force croissante de la base
18
pKa
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
NH4 + + H2 O = NH3 + H3 O+
Ka1=10-9,2
CH3COO + H2 O = CH3 COOH + OH-
K=Ke/Ka2= 1014 /10-4,8 = 10-9,2
2 H2 O = H3 O+ + OH
Ke = 1014
Mais la raction prsentant la plus forte constante est :
CH3COO + NH4 += CH3 COOH + NH3
K= Ka1 /Ka2 =10-4,4
CH3 COO -
NH4 +
CH3COOH
NH3
t=0
2 10-2
10-2
t>0 =tq,
2 10-2-x
10-2- x
x mol L-1
x mol L-1
K = 10 4, 4 =
x2
x2
10 2 x ( 2.10 2 x) 2.10 4
x = 2.10 8, 4 = 8,9.10 5
On voit que l'approximation est valable. Le calcul des diffrentes concentrations
est ais, celui de la concentration en H3 O+ peut se faire soit avec :
[ H 3O + ] = K a 2
[CH3COOH]
[CH3COO ]
soit
pH
=
pK
+
log
a2
[ CH3COO ]
[ CH3COOH]
soit avec :
[ NH+4 ]
[ NH3 ]
[ H3O ] = K a1
soit pH = pKa 1 + log
[ NH3 ]
[ NH +4 ]
+
Dans un cas comme dans l'autre on obtient pH=7,14
Appliquer cette mthode d'autres mlanges acide base (acide fort + base forte,
acide fort + base faible, acide faible + base faibles ,.)
19
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
V - Effet tampon
Lorsque l'on met en prsence un acide faible avec sa base conjugue, on peut
considrer qu'il existe un quilibre d'change protonique de type :
AH + A- = A- + AH
La constante de cet quilibre vaut K=1. On peut donc faire le tableau
d'avancement suivant :
AH
A-
AH
A-
t=0
Ca
Cb
t>0 =tq,
Ca - x
Cb - x
x mol L-1
x mol L-1
A l'quilibre on aura toujours : [AH]=Ca- x + x =Ca et [A -]=Cb - x + x =Cb
Compte tenu de l'tat d'quilibre entre AH et A- :
[A ] [H O ] soit pH = pK
=
Ka
[AH ]
[ A ]
+ log
[ AH]
Une telle solution est appele "solution tampon" car son pH, voisin du pKa du
couple est quasiment invariant lorsque :
-
on la dilue (de faon modre). En effet l'quilibre ci-dessus n'est pas
modifi par l'ajout de H2 O, et si Ca est divis par 10, Cb l'est aussi et au
final le pH est le mme.
on lui ajoute un acide ou une base (de faon modre).
Dans beaucoup d'applications, on utilisera des solutions tampons pour fixer le pH
d'un milieu qui pourrait tre modifi par :
-
de l'vaporation de l'eau
des ractions de prcipitation (d'hydroxydes par exemple)
des ractions de rduction ou d'oxydation de l'eau, qui se traduisent
respectivement par une augmentation ou une diminution du pH.
Les solutions tampons sont obtenues :
20
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
soit en mlangeant un acide faible et sa base conjugue dans un rapport
pouvant aller de 0,1 10. Donc le pH d'un tel milieu est compris entre pKa1 et pKa+1 (cas prcdent),
soit en ajoutant un acide fort (en dfaut) une base faible,
soit en ajoutant une base forte (en dfaut) un acide faible.
Les deux derniers cas seront traits dans le cadre des dosages acide-base.
VI - Dosages acide-base
Les ractions acide base peuvent tre trs faiblement dplaces (constantes
d'quilibres faibles, <10-2 ), ou totales (constantes d'quilibre leves, >102 ). Dans
le dernier cas, on peut utiliser ces raction comme support de dosage pour mesurer
la concentration d'une espce (acide ou base) dans un milieu. Le point
d'quivalence sera mis en vidence par :
-
l'volution du pH
le changement de couleur d'un indicateur color
VI-1 Dosage pH mtrique d'un acide faible par une base forte
L'acide faible dos est l'acide ethanoque, la base est l'hydroxyde de sodium 0,1 M
On a donc :
ractif titrant (burette) : NaOH(s) " Na+ + OHractif titr (becher) :
Cb =[OH -]=0,1 mol/L
CH3COOH + H2O = CH3 COO- + H3 O+ Ca = inconnu
Lorsque l'on mlange ces deux ractifs on est en prsence du systme suivant :
Force croissante de lacide
H3 0+
CH3COOH
H2O
H2 O
CH3COO -
OH-
4,8
14
Force croissante de la base
21
pKa
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
la raction du dosage est donc:
CH3COOH + OH - = CH3 COO- + H2O
avec une constante d'quilibre K=Ka/K e=109,2 , ce qui indique que la raction est
totale. Si VE est le volume de soude vers l'quivalence, ce qui correspond aux
conditions stoechiomtriques, alors on peut faire le tableau suivant :
CH3 COOH
OH-
CH3COO -
t=0
CaVa
CbVb
t>0 avant quiv.
CaVa- CbVb
CbVb
t>0 l'quiv.
CbVE
t>0 aprs l'quiv.
CbVb -CaVa
CbVE
Avant l'quivalence, on est dans la situation o l'on a un mlange d'acide faible
avec sa base conjugue, on est donc dans une zone "tampon". La recherche du pH
par la mthode de la RP dans cette zone conduirait au schma suivant :
Force croissante de lacide
H3 0+
CH3COOH
H 2O
H2 O
CH3COO -
OH-
4,8
14
pKa
Force croissante de la base
Par consquent la RP est la raction de l'acide sur sa base conjugue, de constante
K=1, et donc le pH est donn par :
22
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
pH = pKa + log
pH = 4,8 + log
[CH3COO ]
[ CH3COOH]
C bVb
C a Va Cb Vb
Or CaVa=CbVE, donc :
pH = 4,8 + log
Vb
VE Vb
On voit que lorsque Vb =VE/2, [CH3 COOH] = [CH3COO -], et pH=pKa=4,8
* A l'quivalence, le pH est celui d'une solution d'actate de concentration
C0 =
Cb VE
Va + VE
Si Va=10ml, VE=8ml, C0 =0,044 mol/L
Par la mthode des RP on a le schma suivant :
Force croissante de lacide
H3 0+
CH3COOH
H2O
H2 O
CH3COO -
OH-
4,8
14
pKa
Force croissante de la base
Donc la RP est dans ce cas :
CH3COO - + H2O = CH3 COOH + OH-
K=Kb =Ke/K a=10-9,2
Par un tableau d'avancement on arrive : K = 10 9 , 2 =
x2
C0 x
et on trouve x=[OH-]=0.53 10-5 , soit pH=8,7.
* Aprs l'quivalence, le pH sera impos par la base que l'on mettra dans le milieu,
et donc :
23
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
[OH-]= pH = pKe + log
Cb ( Vb VE )
0,1(Vb 8)
= 14 + log
Va + Vb
10 + Vb
La courbe pH mtrique du dosage a donc l'allure suivante :
13
12
11
10
pH
quivalence :pH=8,7
demi quivalence
pH=pKa=4,8
7
6
5
4
1
10
11
12
13
14
15
16
Vb
On voit bien sur cette courbe dans la zone tampon (donc avant l'quivalence) que
la pente
dpH
est minimale, lorsque Vb =VE/2. Ceci se dmontre facilement. En
dVb
effet si on reprend l'expression du pH dans cette zone :
pH = 4,8 + log
dpH =
Vb
VE Vb
1 dVb d( VE Vb )
2,3 Vb
( VE Vb )
dpH
1
VE
=
dVb 2,3 Vb ( VE Vb )
Cette dernire expression est minimale lorsque X=Vb (VE-Vb ) est maximal, c'est-dire lorsque
dX
= 0 , soit (2Vb -VE)=0, donc pour Vb =VE/2.
dVb
24
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
VI-2 Utilisation d'un indicateur color
Certaines molcules organiques possdant des fonctions caractre acido-basique
telles que des fonctions -COOH, -NH2 , -SO3H peuvent apparatre sous des
couleurs diffrentes selon la forme (acide ou basique) prdominante dans le
milieu. Ces molcules sont appeles des indicateurs colors.
Soit H-Ind une telle molcule, on a l'quilibre :
H-Ind + H2 O = Ind- + H 3O+
KaI
Lorsque le pH du milieu est impos par ailleurs, ce qui suppose que la prsence de
l'indicateur n'a pas d'incidence sur ce pH :
pH = pKaI + log
[Ind ]
[H Ind ]
D'aprs ce que nous avons vu :
-
[ Ind ]
la forme acide de la molcule sera visible lorsque
< 0,1 donc
[H Ind ]
lorsque pH<pKaI-1,
la forme basique de la molcule sera visible lorsque
[ Ind ]
> 10 donc
[H Ind ]
lorsque pH>pKaI+1.
La zone de pH comprise entre pKaI-1 et pKaI+1 est appele zone de virage de
l'indicateur.
On comprend que si cette zone de virage correspond au pH mesur l'quivalence
d'un dosage acide-base, on peut se passer d'un pH-mtre. Encore faut-il connatre
a-priori ce pH l'quivalence. En effet si l'on reprend l'exemple du dosage
prcdent et que l'on utilise un indicateur tel que le bleu de bromothymol, qui a un
pKa de 7, on sous-estimera le volume vers l'quivalence comme l'indique la
figure ci dessous.
25
CM C3a - anne 2006-07 - B. Vuillemin - Universit de Bourgogne
13
12
11
10
pH
9
8
zone de virage
7
6
5
VE "fictif"
4
1
VE rel
8
10
11
12
13
Vb
Par contre vous montrerez que cet indicateur est bien adapt au dosage d'un
acide fort par une base forte.
Exemples d'indicateurs usuels :
indicateur
forme acide
forme base
3,1 4,4
rouge
Jaune-orang
4,2 6,2
rouge
jaune
Bleu de bromothymol (pKa =7,3)
6 7,6
jaune
bleu
du Phnol-phtaline (pKa = 8,7)
8,0 9,9
incolore
pourpre
Hlianthine
(pKa = 3,5)
Rouge de mthyle (pKa = 4,6)
zone de
virage
26
S-ar putea să vă placă și
- Acide BaseDocument35 paginiAcide BaseKhoudia Sy CamaraÎncă nu există evaluări
- Chap I Acide BaseDocument81 paginiChap I Acide BaseyoussefÎncă nu există evaluări
- Chimie Cinétique Chimique 2013 2014 (Afdal Ali)Document6 paginiChimie Cinétique Chimique 2013 2014 (Afdal Ali)Hassan Rifki100% (1)
- Simili 2Document3 paginiSimili 2Noureddine ElmabroukiÎncă nu există evaluări
- 10038734Document36 pagini10038734dam 12100% (1)
- 2 Bacsme 3Document8 pagini2 Bacsme 3Möha Mëd IIÎncă nu există evaluări
- SerieDocument7 paginiSeriemehdi benmassoudÎncă nu există evaluări
- Cour Cine 2020-2021 Final-1Document79 paginiCour Cine 2020-2021 Final-1Salah IneÎncă nu există evaluări
- Acide Benzoique PDFDocument3 paginiAcide Benzoique PDFFoudil LaouiciÎncă nu există evaluări
- Nombres ComplexesDocument4 paginiNombres ComplexesHakimAlioua100% (1)
- Acide BaseDocument10 paginiAcide BaseAmeni Slimen100% (1)
- ThermochimieDocument33 paginiThermochimiejulienlaunayÎncă nu există evaluări
- Suivi CinetiqueDocument7 paginiSuivi CinetiqueMed BriniÎncă nu există evaluări
- Chimie GénéraleDocument55 paginiChimie Généralenova couliÎncă nu există evaluări
- Capture D'écran . 2022-06-03 À 00.30.04Document80 paginiCapture D'écran . 2022-06-03 À 00.30.04Tomscov 26Încă nu există evaluări
- Isom Conformation AliphatiqueDocument3 paginiIsom Conformation AliphatiqueSamba BarhamÎncă nu există evaluări
- Corrigé Série 2Document8 paginiCorrigé Série 2Chk YahyaÎncă nu există evaluări
- Cours III Acides - Bases-A. BENAMARDocument60 paginiCours III Acides - Bases-A. BENAMARMed Seghir YounesÎncă nu există evaluări
- Spe Physique Chimie 2021 Zero 1 CorrigeDocument8 paginiSpe Physique Chimie 2021 Zero 1 CorrigeChahid OUAAZIZIÎncă nu există evaluări
- TD Acide Base 24 Fevrier 2016Document10 paginiTD Acide Base 24 Fevrier 2016Tkra G Sil100% (1)
- Cours Diagrammes Binaires Liquide-Vapeur-1Document71 paginiCours Diagrammes Binaires Liquide-Vapeur-1MOHAMED MAZOUARIÎncă nu există evaluări
- ComplexesDocument4 paginiComplexesSoufiane AzikiÎncă nu există evaluări
- BB 2018 Spé Physique-1Document10 paginiBB 2018 Spé Physique-1De la fuente100% (1)
- OXYDOREDUCTION Le VigneronDocument5 paginiOXYDOREDUCTION Le Vigneronالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Chap.6 TP12 Titrage PH Metrique D Un Vinaigre Correction PDFDocument2 paginiChap.6 TP12 Titrage PH Metrique D Un Vinaigre Correction PDFYouSsef EchafaiÎncă nu există evaluări
- Sem 1 S10405Document4 paginiSem 1 S10405jamjamalÎncă nu există evaluări
- Chimie SolutionDocument164 paginiChimie SolutionZonta NeoÎncă nu există evaluări
- Ethanoate de Sodium CorrigeDocument3 paginiEthanoate de Sodium CorrigestefanÎncă nu există evaluări
- TD Nº3Document26 paginiTD Nº3Œū Ssa MēÎncă nu există evaluări
- 12 Thermochimie2 Td-EnonceDocument5 pagini12 Thermochimie2 Td-Enoncecours importantÎncă nu există evaluări
- Notions de BaseDocument6 paginiNotions de BaseNour El Amal MbarekÎncă nu există evaluări
- Resume Acides Et Bases PDFDocument2 paginiResume Acides Et Bases PDFAnonymous nbHyrU81Încă nu există evaluări
- Thermodynamique 2nd Cycle Parcours Innovation Sujet Juin 2020Document2 paginiThermodynamique 2nd Cycle Parcours Innovation Sujet Juin 2020Willi BallaÎncă nu există evaluări
- Serie1-Chimie Des Solutions-Ch5Document7 paginiSerie1-Chimie Des Solutions-Ch5KOUKI SOFIENÎncă nu există evaluări
- Série5 Liqvap 2022 PC2Document4 paginiSérie5 Liqvap 2022 PC2Aymen GharbiÎncă nu există evaluări
- AcibaseDocument35 paginiAcibaseAbdessamad EttariqiÎncă nu există evaluări
- Reactions Acide-BaseDocument8 paginiReactions Acide-BaseMahmoud GazzahÎncă nu există evaluări
- Biophysique Des Solutions 2023Document26 paginiBiophysique Des Solutions 2023zaki taleb100% (1)
- TD Thermochimie IIDocument2 paginiTD Thermochimie IIZougmoréÎncă nu există evaluări
- Indicateurs ColorésDocument3 paginiIndicateurs ColorésAicha DiabyÎncă nu există evaluări
- Bac 2em Groupe 2017Document3 paginiBac 2em Groupe 2017Seydina omar LoÎncă nu există evaluări
- Chapitre 2 (2) (EN COURS)Document4 paginiChapitre 2 (2) (EN COURS)Beatrice FlorinÎncă nu există evaluări
- Devoir 1 pc2 PDFDocument6 paginiDevoir 1 pc2 PDFالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Mathematiques Pour Les Sciences de La Vie Et de La SanteDocument160 paginiMathematiques Pour Les Sciences de La Vie Et de La SanteRakl LoÎncă nu există evaluări
- Cinétique ChimiqueDocument10 paginiCinétique Chimiquearfpower100% (2)
- Chapitre 1 Introduction À La L'étude Des SolutionsDocument6 paginiChapitre 1 Introduction À La L'étude Des SolutionsETUSUP100% (1)
- Chapitre 2CDocument15 paginiChapitre 2CIbrahim Ouagague100% (2)
- TPcyclohexanoDocument3 paginiTPcyclohexanoAnis SouissiÎncă nu există evaluări
- Acides Et Bases Selon BrönstedDocument3 paginiAcides Et Bases Selon BrönstedLotfi Chimie100% (1)
- Aromatique SDocument13 paginiAromatique SPpeÎncă nu există evaluări
- Devoir de Contrôle N°1 - Math - Bac Informatique (2017-2018) MR Chebbi LamjedDocument6 paginiDevoir de Contrôle N°1 - Math - Bac Informatique (2017-2018) MR Chebbi Lamjedtigana100% (1)
- Applications de la spectrophotomérie en phytochimie: sciencesDe la EverandApplications de la spectrophotomérie en phytochimie: sciencesÎncă nu există evaluări
- Chsol - Chapitre IiDocument28 paginiChsol - Chapitre IielkhiatmohammedamineÎncă nu există evaluări
- Chapitre 2 Acide BaseDocument17 paginiChapitre 2 Acide BaseSouFien MabroukÎncă nu există evaluări
- Chap5 - EC2-Eqgilibres Acido-Basiques - 2022 - ON - DEPDocument74 paginiChap5 - EC2-Eqgilibres Acido-Basiques - 2022 - ON - DEPDylanÎncă nu există evaluări
- Chapitre I Partie 1Document8 paginiChapitre I Partie 1Amna TahriÎncă nu există evaluări
- Chimie en SolutionDocument166 paginiChimie en Solutionjawad izallalenÎncă nu există evaluări
- Cours Acide BaseDocument14 paginiCours Acide BaseAli AllamÎncă nu există evaluări
- Chapitre 6 Acides-BasesDocument50 paginiChapitre 6 Acides-BasesMo DicÎncă nu există evaluări
- 2005 AmSud Correction Exo3 Cinetique Sapo 6 5ptsDocument3 pagini2005 AmSud Correction Exo3 Cinetique Sapo 6 5ptsFoudil LaouiciÎncă nu există evaluări
- Avancement 2Document2 paginiAvancement 2Foudil LaouiciÎncă nu există evaluări
- 2012 DS1 Acide Base PDFDocument2 pagini2012 DS1 Acide Base PDFFoudil LaouiciÎncă nu există evaluări
- ph2 1RC-coursDocument9 paginiph2 1RC-coursFoudil LaouiciÎncă nu există evaluări
- 0607DM2 PDFDocument3 pagini0607DM2 PDFFoudil Laouici100% (1)
- Acide Benzoique PDFDocument3 paginiAcide Benzoique PDFFoudil LaouiciÎncă nu există evaluări
- Acide Benzoique PDFDocument3 paginiAcide Benzoique PDFFoudil LaouiciÎncă nu există evaluări
- CH7 Dipole RCDocument5 paginiCH7 Dipole RCFoudil LaouiciÎncă nu există evaluări
- Datation K ArDocument1 paginăDatation K ArFoudil LaouiciÎncă nu există evaluări
- 2.réaction TotaleDocument5 pagini2.réaction TotaleFoudil LaouiciÎncă nu există evaluări
- C2 JavelDocument3 paginiC2 JavelFoudil LaouiciÎncă nu există evaluări
- Ac bs1Document34 paginiAc bs1ataiebÎncă nu există evaluări
- Examen2 Techniques Danalyses BiologiqueDocument5 paginiExamen2 Techniques Danalyses BiologiqueaxelÎncă nu există evaluări
- Reactivité Chimique - Chapitre 2Document69 paginiReactivité Chimique - Chapitre 2abraham LincolnÎncă nu există evaluări
- 1 - Equilibre Acido Basique 22 PDFDocument18 pagini1 - Equilibre Acido Basique 22 PDFalimkettoucheÎncă nu există evaluări
- Reactions AcidobasiquesDocument54 paginiReactions AcidobasiquesVanelle NlemÎncă nu există evaluări
- Prépa Bac 2022 Chimie ThéoriqueDocument25 paginiPrépa Bac 2022 Chimie Théoriqueb60032595Încă nu există evaluări
- Généralités SolutionDocument116 paginiGénéralités SolutionHichem Khelifi Touhami0% (1)
- Notice-Ph Metre Hi98121Document9 paginiNotice-Ph Metre Hi98121veilleregdsa38Încă nu există evaluări
- Acide Base PDFDocument16 paginiAcide Base PDFchahin07Încă nu există evaluări
- VI..Etude Sommaire Des Mélanges: Johannes Broenstedt (1879 - 1947)Document31 paginiVI..Etude Sommaire Des Mélanges: Johannes Broenstedt (1879 - 1947)Bill644Încă nu există evaluări
- 6 Exc2001Document5 pagini6 Exc2001Yassine RakchoÎncă nu există evaluări
- Cours de Base de Sciences Du SolDocument78 paginiCours de Base de Sciences Du SolRivaldo Nvo Nguema AvomoÎncă nu există evaluări
- Tableau Comparatif Des Techniques ChromatographiquesDocument1 paginăTableau Comparatif Des Techniques Chromatographiqueskhouloud gazzehÎncă nu există evaluări
- Memoire Fin Etude Eau Et Envir - MarahDocument39 paginiMemoire Fin Etude Eau Et Envir - Marahseghir4431Încă nu există evaluări
- 31 TamponphDocument5 pagini31 TamponphAbde TamÎncă nu există evaluări
- Force Des Acides Et BasesDocument4 paginiForce Des Acides Et Basestjmhfkdkd5Încă nu există evaluări
- CNC 2000 Chimie MP CorrectionDocument4 paginiCNC 2000 Chimie MP CorrectionNouhaila AfakireÎncă nu există evaluări
- Chapitre - 1 Les Acides Et Les BasesDocument14 paginiChapitre - 1 Les Acides Et Les Baseseduardo3000Încă nu există evaluări
- Support Solutions Tampon Finale Pour ÉtudiantsDocument3 paginiSupport Solutions Tampon Finale Pour Étudiantsikram bt100% (1)
- Théme 1 - Chapitre 8 - Carte MentaleDocument1 paginăThéme 1 - Chapitre 8 - Carte MentaleAbdel ElouaerÎncă nu există evaluări
- CHM 112 - Chimie Des Solutions (2020)Document27 paginiCHM 112 - Chimie Des Solutions (2020)Berthe Aristide Ngue NkongoÎncă nu există evaluări
- AqequilibriumDocument30 paginiAqequilibriumSophie RosiÎncă nu există evaluări
- Comment Entretenir Votre TitreurDocument1 paginăComment Entretenir Votre TitreurCynthia EspinosaÎncă nu există evaluări