Documente Academic
Documente Profesional
Documente Cultură
Analisis de Resultados Reactores 3
Încărcat de
MartinGarcíadeSánchez0 evaluări0% au considerat acest document util (0 voturi)
2 vizualizări1 paginălab de reactores
Drepturi de autor
© © All Rights Reserved
Formate disponibile
DOCX, PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentlab de reactores
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
0 evaluări0% au considerat acest document util (0 voturi)
2 vizualizări1 paginăAnalisis de Resultados Reactores 3
Încărcat de
MartinGarcíadeSánchezlab de reactores
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 1
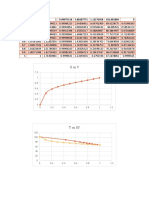
De acuerdo con los resultados obtenidos en la determinacin de la constante de
velocidad y el orden de reaccin se puede concluir lo siguiente:
En general puede decirse que la velocidad de la reaccin aumenta al elevarse la
temperatura, lo cual se ve reflejada en la experimentacin al obtener una
k=0.003802 a T=27 C y conforme la temperatura es menor as mismo lo es la
constante de velocidad.
El aumento de temperatura incrementa la energa media y la velocidad de las
molculas reaccionantes, aumentando el nmero de choques entre ellas y el
numero de molculas que alcanza o supera la energa de activacin, necesario
para que el choque entre ellas sea eficaz.
Generalmente, al llevar a cabo una reaccin a una temperatura ms alta provee
ms energa al sistema, por lo que se incrementa la velocidad de reaccin al
ocasionar que haya ms colisiones entre partculas, como lo explica la teora de
colisiones. Sin embargo, la principal razn porque un aumento de temperatura
aumenta la velocidad de reaccin es que hay un mayor nmero de partculas en
colisin que tienen la energa de activacin necesaria para que suceda la
reaccin, resultando en ms colisiones exitosas.
La influencia de la temperatura est descrita por la ecuacin de Arrhenius. Como
una regla de cajn, las velocidades de reaccin para muchas reacciones se
duplican por cada aumento de 10 C en la temperatura, aunque el efecto de la
temperatura puede ser mucho mayor o mucho menor que esto.
Finalmente de acuerdo al resultado obtenido se concluye que la energa necesaria
para que los reactivos formen el complejo activado es de 12070.7 cal/mol k y que
adems representa la barrera de energa que han de salvar las molculas para
que tenga lugar la reaccin.
S-ar putea să vă placă și
- Fundamentacion Del TemaDocument1 paginăFundamentacion Del TemaMartinGarcíadeSánchezÎncă nu există evaluări
- Tabla y GraficasDocument3 paginiTabla y GraficasMartinGarcíadeSánchezÎncă nu există evaluări
- Banda ProporcionalDocument1 paginăBanda ProporcionalMartinGarcíadeSánchezÎncă nu există evaluări
- Tabla y GraficasDocument1 paginăTabla y GraficasMartinGarcíadeSánchezÎncă nu există evaluări
- Conclusion JubsDocument6 paginiConclusion JubsMartinGarcíadeSánchezÎncă nu există evaluări
- Tabla y GraficasDocument1 paginăTabla y GraficasMartinGarcíadeSánchezÎncă nu există evaluări
- Gel Texturizador Cromo-Oleo HsDocument7 paginiGel Texturizador Cromo-Oleo HsMartinGarcíadeSánchezÎncă nu există evaluări
- Reduce Lo Mejor Que Podemos Hacer Por El Planeta Es Explotarlo Lo Menos PosibleDocument1 paginăReduce Lo Mejor Que Podemos Hacer Por El Planeta Es Explotarlo Lo Menos PosibleMartinGarcíadeSánchezÎncă nu există evaluări
- Evaluacion Diagnostica 6Document96 paginiEvaluacion Diagnostica 6MartinGarcíadeSánchez67% (15)
- Nom 009 Parte 2Document98 paginiNom 009 Parte 2MartinGarcíadeSánchez83% (12)
- Nom 009 2011Document1 paginăNom 009 2011MartinGarcíadeSánchezÎncă nu există evaluări
- Tabla y GraficasDocument1 paginăTabla y GraficasMartinGarcíadeSánchezÎncă nu există evaluări
- Nom 009 2011Document1 paginăNom 009 2011MartinGarcíadeSánchezÎncă nu există evaluări
- Origen y Significado Del Escudo de La EsiqieDocument1 paginăOrigen y Significado Del Escudo de La EsiqieMartinGarcíadeSánchezÎncă nu există evaluări
- NOM 009 STPS 2011 Trabajos en AlturaDocument55 paginiNOM 009 STPS 2011 Trabajos en AlturaJose de la PazÎncă nu există evaluări
- Comentario Bibliografico BDZDocument2 paginiComentario Bibliografico BDZMartinGarcíadeSánchezÎncă nu există evaluări
- Por Qué Es Importante Estudiar La Historia Del Derecho en MéxicoDocument1 paginăPor Qué Es Importante Estudiar La Historia Del Derecho en MéxicoMartinGarcíadeSánchezÎncă nu există evaluări
- Resumen Unidad 2 NOM031-1Document1 paginăResumen Unidad 2 NOM031-1MartinGarcíadeSánchezÎncă nu există evaluări
- Nom 006 STPS 2014 PDFDocument56 paginiNom 006 STPS 2014 PDFAlam RojasÎncă nu există evaluări
- Practicas Seguras en Laindustria de La Construcción (Metodologia)Document8 paginiPracticas Seguras en Laindustria de La Construcción (Metodologia)Yoahimm Sanchtmar RibbiattÎncă nu există evaluări
- Resumen Unidad 3 NOM031-1Document1 paginăResumen Unidad 3 NOM031-1MartinGarcíadeSánchezÎncă nu există evaluări
- ResumenUnidad1NOM025 PDFDocument1 paginăResumenUnidad1NOM025 PDFJUANÎncă nu există evaluări
- Resumen Unidad 3 NOM031-1Document1 paginăResumen Unidad 3 NOM031-1MartinGarcíadeSánchezÎncă nu există evaluări
- Pre ColonialDocument1 paginăPre ColonialMartinGarcíadeSánchezÎncă nu există evaluări
- Nom 006 STPS 2014 PDFDocument56 paginiNom 006 STPS 2014 PDFAlam RojasÎncă nu există evaluări
- Diagnostic oDocument96 paginiDiagnostic oMartinGarcíadeSánchez50% (4)
- Resumen Unidad 1 NOM031-1Document1 paginăResumen Unidad 1 NOM031-1MartinGarcíadeSánchezÎncă nu există evaluări
- Estimar La Presion de Saturacion Del NDocument2 paginiEstimar La Presion de Saturacion Del NMartinGarcíadeSánchezÎncă nu există evaluări
- Topico OrganicaDocument7 paginiTopico OrganicaMartinGarcíadeSánchezÎncă nu există evaluări
- Diagnostic oDocument96 paginiDiagnostic oMartinGarcíadeSánchez50% (4)