Documente Academic
Documente Profesional
Documente Cultură
C6 TD
Încărcat de
Kld MntTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
C6 TD
Încărcat de
Kld MntDrepturi de autor:
Formate disponibile
TD C6 Chimie 2016/17
Travaux dirigs de Chimie n 6
Acides Bases
Exercice 1 : Dissolution de lacide perchlorique
On dissout de l'acide perchlorique, HClO4 dans l'eau. Il s'agit d'un acide fort.
1. Ecrire la raction de lacide perchlorique avec leau. Cette raction est-elle totale ou quilibre ?
2. On dissout m=0,10g de cet acide dans 1L d'eau. On supposera que le volume de la solution
obtenue fait V = 1L. Quelle est la composition du systme ltat final ?
3. En dduire la valeur du pH de la solution.
4. Quelle est alors la concentration des ions hydroxydes [OH-] ?
Donnes : M(Cl)=35,5g/mol ; M(H) = 1g/mol ; M(O) = 16 g/mol
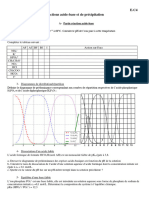
Exercice 2 : Diagramme de distribution de lammoniaque
Le diagramme de distribution des espces acide et basique
du couple ion ammonium/ammoniaque NH4+/NH3 est
reprsent ci-contre.
1. Identifier lespce chimique correspondant chacune
des 2 courbes.
2. Prciser pour quelle valeur du pH on a la relation :
[NH4+] = [NH3].
3. En dduire le pKA puis le KA du couple NH4+/NH3.
Exercice 3 : Diagramme de distribution de lacide citrique
Lacide citrique de formule C6H8O7 est un triacide not
H3A. Le document ci-dessous donne son diagramme de
distribution en fonction du pH. Les courbes traces
reprsentent le pourcentage de chacune des espces
contenant A lorsque le pH varie.
1. Identifier chacune des courbes.
2. En dduire les constantes pKAi et KAi relatives aux
trois couples mis en jeu.
3. 250,0mL de solution ont t prpars en dissolvant
1,05g dacide citrique monohydrat C6H8O7, H2O.
a. Calculer la concentration c de la solution.
b. Dterminer, partir de c et du diagramme de
distribution, la composition du mlange
pH=4,5.
Exercice 4 : Les couples du CO2.
1. Ecrire les quilibres liant les espces de couples H2CO3/HCO3- et HCO3-/CO32-.
2. Exprimer les constantes dacidits associes aux deux couples en fonction des concentrations.
3. Prciser sur un axe gradu en pH les domaines de prdominance des diffrentes espces.
4. Ecrire la raction entre H2CO3 et CO32-. Quelle est la valeur de la constante dquilibre ?
5. Dterminer lespce majoritaire dans les trois solutions suivantes S1, S2 et S3 caractrises par :
a. pH(S1)=3,20.
b. [H3O+]S2=2,5.10-8mol/L.
c. [HO-]S3=5,2.10-2mol/L.
Donnes : pKA1=6,4 ; pKA2=10,3.
O.KELLER TSI1 Page 1 sur 2 Lyce Louis Vincent Metz
TD C6 Chimie 2016/17
Exercice 5 : Raction acido-basique.
On prpare 200,0mL de solution en dissolvant 2,00.10-2mol de chlorure danilinium (C6H5NH3+,Cl-)
(pKA=4,50) et 3,00.10-2mol de borate de sodium Na+BO2- (pKA=9,20).
1. Tracer un diagramme de prdominance des espces acides et basiques des deux couples.
2. Ecrire lquation de la raction qui se produit lors du mlange des ractifs. Calculer sa constante K0.
3. Dterminer la composition finale du systme. En dduire une valeur approche du pH de la solution.
Exercice 6 : pH dune solution dacide ascorbique
La vitamine C, dont le nom est acide-ascorbique, est un diacide not AscH2. Les pKA successifs sont 4,4
et 11,6.
1. Ecrire les couples acido-basiques associs lacide ascorbique et dresser le diagramme de
prdominance des espces acido-basiques issues de lacide ascorbique en fonction du pH de la
solution.
2. Ecrire lquation de la raction entre AscH2 et leau, dterminer sa constante dquilibre.
3. On dissout dans leau un comprim contenant 500 mg dacide ascorbique dans une fiole jauge de
volume V = 200 mL.
a. En considrant uniquement la premire acidit de AscH2, (seule la raction prcdente a lieu),
dterminer la composition de la solution lquilibre. En dduire le pH de la solution.
b. Quelles espces prdominent dans la solution ? Etait-il justifi de ne pas prendre en compte la
seconde acidit de AscH2 ?
Prcipitation
Exercice 7 : Prcipitation ou non ?
On effectue les mlanges suivants, y a-t-il ou non formation dun prcipit ?
1. 100 mL de (Zn2+ + 2 Cl-) 2.10-5 mol/L et 150 mL de soude (Na+ + OH-) 2.10-3 mol/L.
2. 150 mL de (Al3+ + 3Cl-) 2.10-3 mol/L et 100mL de (Ag+ + NO3-) 2.10-4 mol/L.
Donnes : pKs(AgCl) = 9,7 ; pKs(Zn(OH)2) = 16,3
Exercice 8 : Hydroxyde de Fer II
1. Quelle est la valeur de pOh = - log[HO-] de dbut de prcipitation de lhydroxyde de fer II (not
Fe(OH)2) partir dune solution 10-2 mol/L en ions Fe2+ ?
2. Indiquer sur un diagramme, pOH en abscisse, les domaines de prdominance des ions Fe2+ et
dexistence du solide Fe(OH)2
Donne : pKs(Fe(OH)2) = 15
Exercice 9 : Solubilit
Aprs avoir tabli une relation entre la solubilit s dans leau pure et le produit de solubilit des composs
suivants, dterminer s en supposant que les ions forms lors de la dissociation des solides ne ragissent
pas avec leau :
a. ZnCO3 (pKs = 10,8)
b. Zn(CN)2 (pKs = 12,6)
c. Zn3(PO4)2 (pKs = 32,0)
Exercice 10 : A propos de luranium
Luranium donne en solution aqueuse les ions U3+, U4+ et UO22+ dont les hydroxydes respectifs ont
comme pKs : 18,5 ; 49 et 24.
a. Quelles sont les formules des hydroxydes ?
b. Prciser, pour chaque couple, les domaines de prdominance de dexistence partir de solutions
10-3 mol/L. Le diagramme sera gradu en pOH.
O.KELLER TSI1 Page 2 sur 2 Lyce Louis Vincent Metz
S-ar putea să vă placă și
- TD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseDocument5 paginiTD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - Monobaseel hazbi fadilaÎncă nu există evaluări
- TD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseDocument5 paginiTD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseLOUkmen Bel100% (1)
- MPSI2 TD1 R Acido BasiqueDocument4 paginiMPSI2 TD1 R Acido Basiquehidamohamed326Încă nu există evaluări
- Solutionaqueusechap 2TDDocument2 paginiSolutionaqueusechap 2TDHamzaÎncă nu există evaluări
- Solutions Aqueuses IpDocument13 paginiSolutions Aqueuses IpEmmanuel PolvenskyÎncă nu există evaluări
- TD1 Acide BaseDocument3 paginiTD1 Acide BaseAnass Badre-EddineÎncă nu există evaluări
- TD Acide Faible Base Faible Constante Dacidite TS2 2023 2024Document12 paginiTD Acide Faible Base Faible Constante Dacidite TS2 2023 2024fallccheikhÎncă nu există evaluări
- TD 5Document2 paginiTD 5Serena SouaibyÎncă nu există evaluări
- S2 - Equilibres Acido-Basiques en Solution AqueuseDocument4 paginiS2 - Equilibres Acido-Basiques en Solution AqueuseZAguirÎncă nu există evaluări
- Série Réaction Acide BaseDocument5 paginiSérie Réaction Acide BaseScriblouÎncă nu există evaluări
- CHP 2 TD - Chimie - SolutionDocument8 paginiCHP 2 TD - Chimie - SolutionSimplice Assemien100% (2)
- Serie 12 Acide BaseDocument4 paginiSerie 12 Acide Basemazen chebbiÎncă nu există evaluări
- E.C4 - Réaction Acide Base Et de PrécipitationDocument4 paginiE.C4 - Réaction Acide Base Et de Précipitationnoamassin78Încă nu există evaluări
- Acides Et Bases SMDocument23 paginiAcides Et Bases SMSalma ZaÎncă nu există evaluări
- TDchimiesol 1Document5 paginiTDchimiesol 1MyFeed ClubÎncă nu există evaluări
- Exercices Chapitre 2 Et 3 R actionsAB PDFDocument2 paginiExercices Chapitre 2 Et 3 R actionsAB PDFAnas HasniÎncă nu există evaluări
- TD4 - Réaction Acido BasiqueDocument8 paginiTD4 - Réaction Acido Basiquemelo.lasserreÎncă nu există evaluări
- Serie Dexercices Dacides Et Bases Du Bac Sciences en TunisieDocument5 paginiSerie Dexercices Dacides Et Bases Du Bac Sciences en TunisieJaafar Abdelhafidh100% (1)
- TD Exercices-Corrigés PDFDocument21 paginiTD Exercices-Corrigés PDFabdelouahed.rhaouiÎncă nu există evaluări
- TransReaAcideBaseExercices 16-17 PDFDocument7 paginiTransReaAcideBaseExercices 16-17 PDFالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Série D'exercices - Chimie PH Des Solutions AqueusesDocument4 paginiSérie D'exercices - Chimie PH Des Solutions AqueusesBaccari100% (2)
- Chimie TD Force Acide BaseDocument3 paginiChimie TD Force Acide BaseJunior Le PyromaneÎncă nu există evaluări
- Chimie en Solution TDDocument15 paginiChimie en Solution TDChk YahyaÎncă nu există evaluări
- Dosage Acide BaseDocument4 paginiDosage Acide BaseSaifeddine Makni0% (1)
- C.P 22-23 Solution AqueusesDocument2 paginiC.P 22-23 Solution AqueusesdiarratogsibÎncă nu există evaluări
- Série 5 Transformations Associées À Des Réactions Acido-Basiques en Solution AqueuseDocument6 paginiSérie 5 Transformations Associées À Des Réactions Acido-Basiques en Solution AqueuseFATIMA fatiii100% (1)
- Acides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeDocument5 paginiAcides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeNjuga Sene100% (1)
- TD Acide Faible-2024-Lsll - WahabdiopDocument2 paginiTD Acide Faible-2024-Lsll - Wahabdiopxydj5wh2wb100% (1)
- TddeuxchimieDocument2 paginiTddeuxchimieZAguirÎncă nu există evaluări
- Série D'éxercices Des Transformations Associées Aux Réactions Acido-Basiques2024Document3 paginiSérie D'éxercices Des Transformations Associées Aux Réactions Acido-Basiques2024sassin2006Încă nu există evaluări
- Acides Bases PDFDocument8 paginiAcides Bases PDFHafidi AhmedÎncă nu există evaluări
- SA-Exos - 1 - 1112 Acido Basique ExocorrigéDocument12 paginiSA-Exos - 1 - 1112 Acido Basique ExocorrigéLarbii BadrourÎncă nu există evaluări
- Serie 5CDocument3 paginiSerie 5CTwansa WbattalaÎncă nu există evaluări
- Série 4 en Chimie Générale EIB S1Document3 paginiSérie 4 en Chimie Générale EIB S1M'VOULABOLOÎncă nu există evaluări
- Série TD 3 Chimie 2Document2 paginiSérie TD 3 Chimie 2salma koudriÎncă nu există evaluări
- Série D'exercices - Chimie - PH Des Solution - Bac Math (2016-2017) MR Afdal AliDocument3 paginiSérie D'exercices - Chimie - PH Des Solution - Bac Math (2016-2017) MR Afdal AliDhiya Klai100% (1)
- Ex 1Document6 paginiEx 1teghre chekhne El koryÎncă nu există evaluări
- Serie 13 BACDocument4 paginiSerie 13 BACimenehmida2023Încă nu există evaluări
- Couple Acide - Base: ExercicesDocument16 paginiCouple Acide - Base: ExercicesAhamadi ElhouyounÎncă nu există evaluări
- Livre Vers Le Bacc T2Document27 paginiLivre Vers Le Bacc T2Hanine Hmida50% (2)
- DM Nâ°1Document8 paginiDM Nâ°1grégoire beraudÎncă nu există evaluări
- Exercices Corriges Chimie en SolutionDocument157 paginiExercices Corriges Chimie en SolutionKhalid Zeg83% (23)
- Acides Et Bases PCDocument15 paginiAcides Et Bases PCrkibi.khadija2006Încă nu există evaluări
- AcademicaDocument4 paginiAcademicaJules Milson RazanajaoÎncă nu există evaluări
- Exercices Révision GénéraleDocument3 paginiExercices Révision Généraleklunx0% (1)
- Dosage Acide Base IndicDocument3 paginiDosage Acide Base IndicAs Ma50% (2)
- Série Pka Et PKBDocument1 paginăSérie Pka Et PKBAdel DridiÎncă nu există evaluări
- TD CG - 01 Acides BasesDocument5 paginiTD CG - 01 Acides BasesMed BriniÎncă nu există evaluări
- Réactions Acido-Basiques PDFDocument9 paginiRéactions Acido-Basiques PDFAzizElheniÎncă nu există evaluări
- Exos21 Acides BasesDocument4 paginiExos21 Acides BasesSohaib LamineÎncă nu există evaluări
- Serie 9 CHIMIE DES SOLUTIONS AQUEUSES 2Document2 paginiSerie 9 CHIMIE DES SOLUTIONS AQUEUSES 2deyinÎncă nu există evaluări
- Serie 7 8 Acides Faibles Bases Faibles Solutions TamponsDocument10 paginiSerie 7 8 Acides Faibles Bases Faibles Solutions TamponsBrahim DahaiÎncă nu există evaluări
- ExoDocument2 paginiExotoiliiÎncă nu există evaluări
- Données: Pka Des Couples de Références, (HDocument1 paginăDonnées: Pka Des Couples de Références, (HalaadoubekhÎncă nu există evaluări
- TD Exercices Corrigés Chimie en SolutionDocument21 paginiTD Exercices Corrigés Chimie en SolutionOussam Ouadidi65% (17)
- PH Des Solutions Aqueuses EnonceDocument8 paginiPH Des Solutions Aqueuses Enonceaziz0% (1)
- Équilibres en solution: Les Grands Articles d'UniversalisDe la EverandÉquilibres en solution: Les Grands Articles d'UniversalisÎncă nu există evaluări
- Glucides: Les Grands Articles d'UniversalisDe la EverandGlucides: Les Grands Articles d'UniversalisÎncă nu există evaluări
- Traité élémentaire de chimie: Tomes 1&2: Présenté dans un ordre nouveau et d'après les découvertes modernes; avec FiguresDe la EverandTraité élémentaire de chimie: Tomes 1&2: Présenté dans un ordre nouveau et d'après les découvertes modernes; avec FiguresÎncă nu există evaluări
- (TDH) (TD) Transfert-Exercices D ApplicationDocument2 pagini(TDH) (TD) Transfert-Exercices D ApplicationKld MntÎncă nu există evaluări
- La Notion de Compétence: Et Son ÉvaluationDocument4 paginiLa Notion de Compétence: Et Son ÉvaluationKld MntÎncă nu există evaluări
- Questions Reponses Evaluation A DistanceDocument6 paginiQuestions Reponses Evaluation A DistanceKld MntÎncă nu există evaluări
- 4762 Fiche de Preparation RecepteursDocument1 pagină4762 Fiche de Preparation RecepteursKld Mnt100% (1)
- 11-Capteurs CorrigéDocument3 pagini11-Capteurs CorrigéKld Mnt100% (1)
- 11 Langage ISO, ProgrammationDocument15 pagini11 Langage ISO, ProgrammationKld MntÎncă nu există evaluări
- 1 Slides Cinématique - 2 M - BouriDocument33 pagini1 Slides Cinématique - 2 M - BouriKld MntÎncă nu există evaluări
- Exo Cours t2 1er PpeDocument2 paginiExo Cours t2 1er PpeKld MntÎncă nu există evaluări
- Chapitre Systemes ÉchantillonnesDocument14 paginiChapitre Systemes ÉchantillonnesKld MntÎncă nu există evaluări
- TD t2 1er-PpeDocument12 paginiTD t2 1er-PpeKld MntÎncă nu există evaluări
- Exo Cours t3 2nd PpeDocument1 paginăExo Cours t3 2nd PpeKld MntÎncă nu există evaluări
- Poly ENSADocument36 paginiPoly ENSAKld MntÎncă nu există evaluări
- Poutre VibrationsDocument3 paginiPoutre VibrationsKld MntÎncă nu există evaluări
- Ionisation Des Acides AminésDocument11 paginiIonisation Des Acides AminésRoland SawadogoÎncă nu există evaluări
- Lycée Pilote Sfax DC 3 2010Document3 paginiLycée Pilote Sfax DC 3 2010Maram BouaskerÎncă nu există evaluări
- Exercices 1, Réactions Acido-Basique, Chtoukaphysique - 2Document1 paginăExercices 1, Réactions Acido-Basique, Chtoukaphysique - 2boudhar mohamedÎncă nu există evaluări
- 22 PH Des Solutions Aqueuses 4Document3 pagini22 PH Des Solutions Aqueuses 4Ilyes Ben JemaaÎncă nu există evaluări
- Bac CH 2001Document3 paginiBac CH 2001Haman Bello OumarouÎncă nu există evaluări
- ABdosageDocument5 paginiABdosageslamtrezaÎncă nu există evaluări
- TP Chemie 02Document6 paginiTP Chemie 02Before SunriseÎncă nu există evaluări
- Exam 2019-87-92Document6 paginiExam 2019-87-92loldavijinÎncă nu există evaluări
- Devoir Synthese N°2 Physique Avec Correction001Document8 paginiDevoir Synthese N°2 Physique Avec Correction001Nidhàl BouzidiÎncă nu există evaluări
- Examen Chimie en Sol CE1-Ratt Juillet 2021Document1 paginăExamen Chimie en Sol CE1-Ratt Juillet 2021Wi Em ChÎncă nu există evaluări
- 201703080733551Document8 pagini201703080733551سمير دبيليÎncă nu există evaluări
- Chapitre 2 PH Des Solutions Acides BasesDocument26 paginiChapitre 2 PH Des Solutions Acides BasesRottina RossyÎncă nu există evaluări
- Fabrication Acide SulfuriqueDocument7 paginiFabrication Acide SulfuriqueBen Abd100% (1)
- 1 - Evolution Spontanée D'un Système ChimiqueDocument7 pagini1 - Evolution Spontanée D'un Système ChimiqueTaha BoulmaneÎncă nu există evaluări
- TP PH Correction PDFDocument1 paginăTP PH Correction PDFMohamedÎncă nu există evaluări
- CHIMIE 4 Reactions Acido BasiquesDocument11 paginiCHIMIE 4 Reactions Acido Basiquesbeebac2009Încă nu există evaluări
- Curs 13-14Document36 paginiCurs 13-14didibutterflyÎncă nu există evaluări
- Correction - TD 6 Acide BaseDocument8 paginiCorrection - TD 6 Acide BaseBILLBOARD TOP AFRICAÎncă nu există evaluări
- 53 Bba 01 Ceda 68Document4 pagini53 Bba 01 Ceda 68Bøũdįāf KhäwlåÎncă nu există evaluări
- DS 3Document6 paginiDS 3Houssam BenkerroumÎncă nu există evaluări
- Série 3-Complexes Et Solubilité - SMPC S2-CH Sol-2021-2022Document2 paginiSérie 3-Complexes Et Solubilité - SMPC S2-CH Sol-2021-2022-the queen-100% (1)
- TP AnalytiqueDocument7 paginiTP AnalytiqueRoubio Hiba100% (1)
- Équilibre Acido Basique MédecineDocument72 paginiÉquilibre Acido Basique Médecinemalakzerizer2005Încă nu există evaluări
- Devoir de Synthèse N°2 Avec Correction 2012 2013 (Sidi Zikri)Document11 paginiDevoir de Synthèse N°2 Avec Correction 2012 2013 (Sidi Zikri)fayeÎncă nu există evaluări
- Indicateurs ColoresDocument3 paginiIndicateurs ColoresWEMBE RAOULÎncă nu există evaluări
- Chapitre IV 1Document37 paginiChapitre IV 1sidiÎncă nu există evaluări
- Mission N°5 Pourquoi Lait Caille-T-IlDocument2 paginiMission N°5 Pourquoi Lait Caille-T-IlAmélie D.Încă nu există evaluări
- Cours Réactivité Chimique BCG S2 (2020)Document198 paginiCours Réactivité Chimique BCG S2 (2020)Casa AbdessamadÎncă nu există evaluări
- Corrigé Série 1Document5 paginiCorrigé Série 1Mohamed ECHAMAI100% (2)