Documente Academic
Documente Profesional
Documente Cultură
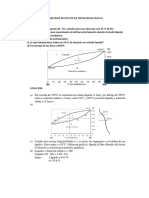
Primer Trabajo de Fisicoquimica
Încărcat de
Gelbert Pedro Alzamora ValleDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Primer Trabajo de Fisicoquimica
Încărcat de
Gelbert Pedro Alzamora ValleDrepturi de autor:
Formate disponibile
INGENIERA METALRGICA
UNIVERSIDAD NACIONAL JOS FAUSTINO SANCHEZ CARRION
FACULTAD DE INGENIERA QUMICA Y METALURGIA
E.A.P. INGENIERA METALRGICA
ASIGNATURA : FISICOQUMICA
DOCENTE : ING. YASMIN JESUS VELES CHANG
CICLO :VA
TURNO : TARDE
TEMA : LEY DE GASES
GRUPO : LOS INNOVADORES DE LA UNJFSC
INTEGRANTES :
ALZAMORA VALLE, GELBERT PEDRO
CARO TORRES, LIN
HERRERA ZARSOSA, VERNICA
FUMAGALLI REYES, DAYANA
HUACHO PER 2017
LEY DE LOS GASES 1
INGENIERA METALRGICA
LEY DE LOS GASES 2
INGENIERA METALRGICA
DEDICATORIO
Dedicamos este informe de prctica a Dios, nuestros
padres y a la Ing.Yasmin Jesus Veles Chang. A Dios
porque ha estado Con nosotros en cada paso que
damos, cuidndonos y dndonos fortaleza para
continuar; a nuestros padres, quienes a lo largo de
nuestras vidas han velado por nuestro bienestar y
educacin siendo nuestro apoyo en todo momento,
depositando su entera confianza en cada reto que se
nos ha presentaba sin dudar ni un solo momento en
nuestra inteligencia y capacidad y a la Ing. yAS por
motivarnos a ser mejores. Es por ello que somos lo
que somos ahora. Los amamos con todo el corazn.
Los Innovadores de la UNJFSC
LEY DE LOS GASES 3
INGENIERA METALRGICA
RESUMEN
En el presente trabajo se estudia la Ley de los gases las cuales fueron estudiadas tomando en
cuenta ciertas condiciones ideales. El presente trabajo fue dividido en: Introduccin, que nos da
un alcance de los detalles que nos permiten explicar de manera breve y concisa, los factores y el
comportamiento de los gases frente al incremento de la temperatura y la relacin que tiene esta
con la energa cintica e interna de los gases; fundamento terico, la cual fue dividida en las tres
leyes (Charles ,Boyle y Gay_ Lussac)que nos permite conocer en mayor detalle en qu
consisten cada uno de dichas leyes; para completar la parte terica se hizo cuatro experimentos,
las cuales fueron desarrolladas, explicadas y concluidas en cada experimento; por ltimo
encontramos la refencia o bibliografa que nos permiten conocer las fuentes que nos permitieron
desarrollar este informe.
LEY DE LOS GASES 4
INGENIERA METALRGICA
INTRODUCCIN
Todo en el Universo est formado por materia. La materia se puede encontrar en 3 estados de
agregacin o estados fsicos: slido, lquido y gaseoso.
Para entender los diferentes estados en los que la materia existe, es necesario entender algo
llamado Teora Molecular cintica de la Materia. La Teora Molecular cintica tiene muchas
partes, pero aqu introduciremos slo algunas. Uno de los conceptos bsicos de la teora
argumenta que los tomos y molculas poseen una energa de movimiento, que percibimos como
temperatura. En otras palabras, los tomos y molculas estn en movimiento constante y medimos
la energa de estos movimientos como la temperatura de una sustancia. Mientras ms energa hay
en una sustancia, mayor movimiento molecular y mayor la temperatura percibida.
Los gases se forman cuando la energa de un sistema excede todas las fuerzas de atraccin entre
molculas. As, las molculas de gas interactan poco, ocasionalmente chocndose. En el estado
gaseoso, las molculas se mueven rpidamente y son libres de circular en cualquier direccin,
extendindose en largas distancias.
El comportamiento de todos los gases se ajusta a tres leyes, las cuales relacionan el volumen de
un gas con su temperatura y presin. Los gases que obedecen estas leyes son llamados gases
ideales o perfectos.
En el siguiente informe estudiaremos la ley de Boyle y Mariotte y la ley de Charles y Gay-lussac.
LEY DE LOS GASES 5
INGENIERA METALRGICA
INICIO
DEDICATORIO .......................................................................................................................... 3
RESUMEN ................................................................................................................................... 4
INTRODUCCIN....................................................................................................................... 5
INICIO ......................................................................................................................................... 6
LEY DE LOS GASES ............................................................................................................. 7
LEY DE CHARLES: ................................................................................................................... 7
LEY DE BOYLE......................................................................................................................... 8
LEY DE GAY-LUSSAC............................................................................................................... 9
EXPERIMENTO I ................................................................................................................ 10
EXPERIMENTO II .............................................................................................................. 10
EXPERIMENTO III ............................................................................................................ 11
EXPERIMENTO IV ............................................................................................................. 11
REFERENCIAS ........................................................................................................................ 12
LEY DE LOS GASES 6
INGENIERA METALRGICA
LEY DE LOS GASES
Las primeras leyes de los gases fueron desarrolladas desde finales del siglo XVII, cuando los
cientficos empezaron a darse cuenta de que en las relaciones entre la presin, el volumen y la
temperatura de una muestra de gas, en un sistema cerrado, se podra obtener una frmula que
sera vlida para todos los gases. Estos se comportan de forma similar en una amplia variedad
de condiciones debido a la buena aproximacin que tienen las molculas que se encuentran ms
separadas, y los gases se consideran como casos especiales de la ecuacin del gas ideal, con una
o ms de las variables constantes.
LEY DE CHARLES:
Establece que el volumen de un gas es directamente proporcional a su temperatura absoluta,
asumiendo que la presin es constante.
Si la temperatura aumenta el volumen aumenta, pero si la temperatura baja el volumen disminuye.
V=KT
P es constante
Disminuye temperatura
La temperatura es directamente proporcional a la energa cintica de las partculas.
Si tenemos una cantidad de gas encerrado en un recipiente flexible a una temperatura dada, las
molculas chocaran contra las paredes del globo al calentar el gas, las partculas de van a moverse
ms deprisa produciendo un mayor nmero de choques contra la pared del globo y por tanto un
aumento de la presin interna que supera la presin atmosfrica que est en el exterior lo que hace
que las paredes flexibles se desplaza, de esta forma la dilatacin del globo tiene lugar hasta que
la presin interna sea igualada la externa.
Cuando bajamos la temperatura, ocurre todo lo contrario las molculas se mueven menos, hay
menos choques y se debe reducir el volumen.
LEY DE LOS GASES 7
INGENIERA METALRGICA
LEY DE BOYLE
Esta ley fue descubierta por Robert Boyle en 1662. Edme Mariotte tambien llego a la misma
conclusion que Boyle, pero no publico sus trabajos hasta 1676, es por esta razon que en muchos
libros encontramos esta ley con el nombre de Boyle.
La ley de boyle establece que la presion de un gas en un recipiente cerrado es inversamente
proporcional al volumen del recipiente, cuando la temperatura es constante.
El volumen es inversamente proporcinal a la presion:
- Si la presion, aumenta el volumen disminuye.
- Si la presion, disminuye el volumen aumenta.
PORQUE ESTO OCURRE?
Al aumentar el volumen, las particulas (atomos o moleculas) del gas tardan mas en llegar a las
paredes del recipiente y por lo tanto chocan menos veces por unidad de tiempo contra ellas. Esto
significa que la presion sera menorr ya que esta representa la frecuencia de choques del gas contra
las paredes.
Cuando disminuye el volumen la distancia que tienen que recorrer las particulas es menor y por
tanto se producen mas choques en cada unidad de tiempo: Aumenta la presion.
Lo que Boyle descubrio es que si la cantidad de gas y la temperatura permanecen constantes, el
producto de la presion por el volumen siempre tiene el mismo valor.
La expresion matematica de esta ley es:
P.V=K
(El producto de la presion por el volumen es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una presion P1 al
comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la
presion cambiara a P2, y se cumplira:
LEY DE LOS GASES 8
INGENIERA METALRGICA
P1 . V1 = P2 . V2
Esta ecuacion es otra manera de expresar la ley de Boyle.
LEY DE GAY-LUSSAC
Relacin entre la presin y la temperatura de un gas cuando el volumen es constante.
Fue enunciada por Joseph Louis Gay-Lussac a principios de 1800.
Establece la relacin entre la temperatura y la presin de un gas cuando el volumen es constante.
La presin del gas es directamente proporcional a su temperatura:
Si aumentamos la temperatura, aumentar la presin.
Si disminuimos la temperatura, disminuir la presin.
Por qu ocurre esto?
Al aumentar la temperatura las molculas del gas se mueven ms rpidamente y por tanto aumenta
el nmero de choques contra las paredes, es decir aumenta la presin ya que el recipiente es de
paredes fijas y su volumen no puede cambiar.
Gay-Lussac descubri que, en cualquier momento de este proceso, el cociente entre la presin y
la temperatura siempre tena el mismo valor:
P/T=k
(El cociente entre la presin y la temperatura es constante)
Supongamos que tenemos un gas que se encuentra a una presin P1 y a una temperatura T1 al
comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la
presin cambiar a P2, y se cumplir:
LEY DE LOS GASES 9
INGENIERA METALRGICA
P1/T1=P2/T2
Que es otra manera de expresar la ley de Gay-Lussac.
Esta ley, al igual que la de Charles, est expresada en funcin de la temperatura absoluta. Al igual
que en la ley de Charles, las temperaturas han de expresarse en Kelvin.
EXPERIMENTO I
Agregamos agua caliente en el vaso precipitado y luego colocamos un globo a medio
inflar.
Luego con la pinza cogemos el mismo globo y lo colocamos en otro vaso precipitado que
contiene agua helada Que sucede?
Observacin 1: en el primer caso, al introducir el globo en el recipiente de agua caliente
observamos que el globo tiende a aumentar su volumen.
Observacin 2:
en el segundo caso, al sacar el globo del mismo recipiente e introducirlo en el otro que contena
agua helada observamos que el globo tiende a contraer su volumen regresando a su momento
inicial.
Concluimos que interviene la ley de Charles.
EXPERIMENTO II
1.-Llenamos un globo pequeo con aire y luego colocamos en la boca de una botella de plstico.
Si apretamos la botella de plstico que sucede? Observa y describe Que ley es enunciada?
Si apretamos la botella observamos que el globo se contrae poco a poco en la parte interior
de la botella hasta que finalmente el globo sale desprendido de la botella con mucha
fuerza.
Entonces deducimos que la botella en un inicio ya tiene una presin determinada a
temperatura ambiente y al introducir una parte del globo inflado dentro de la botella
tiende a subir un poco ms la presin; y ya al apretar la botella el gas que est contenida
en ella al no tener escapatoria empuja al globo por efecto de la presin del gas acumulado
y este sale disparado.
Concluimos que se trata de la ley de Boyle.
LEY DE LOS GASES 10
INGENIERA METALRGICA
EXPERIMENTO III
2.-Meter la botella con el globo en un recipiente de agua caliente en el vaso precipitado. Qu
sucede?
Al meter la botella en agua caliente junto con el pequeo globo inflado, observamos que
despus de un instante el efecto de la temperatura hace que el gas se excite y aumente la
presin y por ello el globo sale disparado de la botella.
Concluimos que interviene la ley de Gay-Lussac.
EXPERIMENTO IV
MATERIALES:
Una Vela.
Una Tina Chica.
Un Vaso De Vidrio Transparente.
Agua.
Fosforo.
En una pequea tina colocamos una vela encendida, luego vertemos agua menos de la de la
octava parte y lo encerramos con un recipiente transparente cerrado. Que observa en el
experimento?
PROCEDIMENTO :
Primero encendemos la vela y la colocamos bien en la tina, luego echamos una cantidad
considerable de agua no mucha.
Luego encendemos la vela, cubrimos la vela encendida con el vaso de vidrio y
observamos lo que pasa.
OBSERVACION:
Al calentar el gas(aire) que se encuentra atrapado dentro del vaso, con la vela; aumentamos la
temperatura del gas, por lo que la presin aumenta, adems, el dixido de carbono caliente que se
desprende de la combustin hace que la presin interna del gas que se encuentra dentro de la
botella aumente y apague la llama de la vela.
LEY DE LOS GASES 11
INGENIERA METALRGICA
REFERENCIAS
26/09/17 Recuperado en: http://www.monografias.com/trabajos91/leyes-gases-
quimica/leyes-gases-quimica.shtml
26/09/17 Recuperado en: https://es.wikipedia.org/wiki/Leyes_de_los_gases
LEY DE LOS GASES 12
S-ar putea să vă placă și
- IRAM 2184-11 2016 Protección Contra Los RayosDocument108 paginiIRAM 2184-11 2016 Protección Contra Los RayosMicael Reyuk100% (1)
- Curso Ultrasonidos IndustrialDocument129 paginiCurso Ultrasonidos IndustrialGUIRIA00Încă nu există evaluări
- Smaart EspanolDocument118 paginiSmaart EspanolLuis FunkÎncă nu există evaluări
- Guía de Electrónica BásicaDocument29 paginiGuía de Electrónica BásicaFridy Ayipey100% (5)
- Diseño de Planta TerminadoDocument101 paginiDiseño de Planta TerminadoGelbert Pedro Alzamora ValleÎncă nu există evaluări
- 2021.9.10ñññ110738Document58 pagini2021.9.10ñññ110738Gelbert Pedro Alzamora ValleÎncă nu există evaluări
- 1610-Texto Del Artículo-6788-1-10-20180316Document4 pagini1610-Texto Del Artículo-6788-1-10-20180316Nini MuñozÎncă nu există evaluări
- K-30EQUIPDocument70 paginiK-30EQUIPGelbert Pedro Alzamora ValleÎncă nu există evaluări
- Primera Ley de La Termodinamica.Document15 paginiPrimera Ley de La Termodinamica.Gelbert Pedro Alzamora ValleÎncă nu există evaluări
- 01 TermoquímicaDocument45 pagini01 Termoquímicajoe1000100% (14)
- Termoquímica: Calor de ReaccionesDocument19 paginiTermoquímica: Calor de ReaccionesGelbert Pedro Alzamora Valle50% (2)
- Primera Ley de La Termodinamica.Document15 paginiPrimera Ley de La Termodinamica.Gelbert Pedro Alzamora ValleÎncă nu există evaluări
- TermoquimicaDocument30 paginiTermoquimicajhonÎncă nu există evaluări
- Separata TermoquímicaDocument30 paginiSeparata TermoquímicaGelbert Pedro Alzamora ValleÎncă nu există evaluări
- Separata N - 09 Transformaciones de Fase en Los MetalesDocument13 paginiSeparata N - 09 Transformaciones de Fase en Los MetalesElbert Torres RuaÎncă nu există evaluări
- Separata N - 09 Transformaciones de Fase en Los MetalesDocument13 paginiSeparata N - 09 Transformaciones de Fase en Los MetalesElbert Torres RuaÎncă nu există evaluări
- 3 TermoquimicaDocument49 pagini3 TermoquimicaManolo LlamasÎncă nu există evaluări
- Informe de PeletizacionDocument10 paginiInforme de PeletizacionGelbert Pedro Alzamora ValleÎncă nu există evaluări
- Tesis Sobre PeletizacionDocument97 paginiTesis Sobre PeletizacionGelbert Pedro Alzamora Valle100% (1)
- Termoquímica: Calor de ReaccionesDocument19 paginiTermoquímica: Calor de ReaccionesGelbert Pedro Alzamora Valle50% (2)
- Trabajo Fisicoquímica IIIDocument21 paginiTrabajo Fisicoquímica IIIGelbert Pedro Alzamora ValleÎncă nu există evaluări
- Informe de Cuanti n1Document9 paginiInforme de Cuanti n1Gelbert Pedro Alzamora ValleÎncă nu există evaluări
- Ejercicios de Metalurgia Fisica IIDocument7 paginiEjercicios de Metalurgia Fisica IIGelbert Pedro Alzamora ValleÎncă nu există evaluări
- Separata N - 01 Diagramas Equilibrio FasesDocument12 paginiSeparata N - 01 Diagramas Equilibrio FasesGelbert Pedro Alzamora ValleÎncă nu există evaluări
- Densidad real, aparente y global: métodos para su cálculoDocument24 paginiDensidad real, aparente y global: métodos para su cálculoalonsogonzalesÎncă nu există evaluări
- Trabajo Fisicoquímica IIIDocument21 paginiTrabajo Fisicoquímica IIIGelbert Pedro Alzamora ValleÎncă nu există evaluări
- Separata N - 01 Diagramas Equilibrio FasesDocument12 paginiSeparata N - 01 Diagramas Equilibrio FasesGelbert Pedro Alzamora ValleÎncă nu există evaluări
- Separata N - 01 Diagramas Equilibrio FasesDocument12 paginiSeparata N - 01 Diagramas Equilibrio FasesGelbert Pedro Alzamora ValleÎncă nu există evaluări
- TERMODINAMICA Ind 08 HutinDocument4 paginiTERMODINAMICA Ind 08 HutinGelbert Pedro Alzamora ValleÎncă nu există evaluări
- TermoquimicaDocument28 paginiTermoquimicaMazinges AjesaÎncă nu există evaluări
- Ley de Hooke y Movimiento Armónico SimpleDocument17 paginiLey de Hooke y Movimiento Armónico SimpleGelbert Pedro Alzamora ValleÎncă nu există evaluări
- Disociacion GaseosaDocument3 paginiDisociacion GaseosaGelbert Pedro Alzamora ValleÎncă nu există evaluări
- Incidencia ondas planas mediosDocument9 paginiIncidencia ondas planas mediosOscar RMÎncă nu există evaluări
- Cuaderno EIE 400Document41 paginiCuaderno EIE 400Adhemar Zenteno100% (1)
- La vigencia de los conceptos freudianos a la luz de los avances científicosDocument7 paginiLa vigencia de los conceptos freudianos a la luz de los avances científicosAndrés Díaz MataÎncă nu există evaluări
- Energía, Trabajo y PotenciaI LDDLDocument7 paginiEnergía, Trabajo y PotenciaI LDDLlendry del rosarioÎncă nu există evaluări
- DISEÑO TERMICO Y MECANICO DE INTERCAMBIADORES DE CALOR DE CASCOS Y TUBOS (Unlocked by WWW - Freemypdf.com)Document219 paginiDISEÑO TERMICO Y MECANICO DE INTERCAMBIADORES DE CALOR DE CASCOS Y TUBOS (Unlocked by WWW - Freemypdf.com)Alvaro VillabonaÎncă nu există evaluări
- Trabajo Final Fisica 2 - DínamoDocument9 paginiTrabajo Final Fisica 2 - DínamoWilliam renato Palomino SanchezÎncă nu există evaluări
- Planeación 1 Trimestre Ciencias 2 FísicaDocument6 paginiPlaneación 1 Trimestre Ciencias 2 Físicaserafin_efra1865100% (1)
- Trabajo de Mi AmorcitoDocument3 paginiTrabajo de Mi AmorcitoZholÎncă nu există evaluări
- MECÁNICA NEWTON|ANA: MOVIMIENTO DE UNA PARTÍCULA EN UNA DIMENSIÓNDocument9 paginiMECÁNICA NEWTON|ANA: MOVIMIENTO DE UNA PARTÍCULA EN UNA DIMENSIÓNFranconos 21Încă nu există evaluări
- Práctica8 DAALDocument7 paginiPráctica8 DAALDiego AragónÎncă nu există evaluări
- Verificacion TorricellyDocument10 paginiVerificacion TorricellyCristian David Ticona MamaniÎncă nu există evaluări
- 1LimaSerranoJoseBernabe InfografiaDocument25 pagini1LimaSerranoJoseBernabe InfografiaJose Bernabe Lima SerranoÎncă nu există evaluări
- Cuestionario y EjerciciosDocument3 paginiCuestionario y EjerciciosXfieldZÎncă nu există evaluări
- Clase Gases IdealesDocument30 paginiClase Gases IdealesJohanCHÎncă nu există evaluări
- Conciencia Budista - Ruiz y NavarroDocument15 paginiConciencia Budista - Ruiz y NavarroJuan Cristobal Ruiz DiazÎncă nu există evaluări
- Resistencia y Ensayo de Los Materiales Actividades 2Document4 paginiResistencia y Ensayo de Los Materiales Actividades 2Martin EspindolaÎncă nu există evaluări
- Termoquimica Clases PDFDocument8 paginiTermoquimica Clases PDFAnaBelénCruzÎncă nu există evaluări
- Tarea de Preparación 4 - JorgeDocument2 paginiTarea de Preparación 4 - JorgeJorge Mayor100% (1)
- Tippens Fisica 7e Diapositivas 22bDocument28 paginiTippens Fisica 7e Diapositivas 22bCENVIM UNSCH CEMROBÎncă nu există evaluări
- Naturaleza luz onda partículaDocument4 paginiNaturaleza luz onda partículaLeonardo Olan ValdiviesoÎncă nu există evaluări
- TAREA #2-ELVIS GALLEGOS SANALEA..... XCVXDocument5 paginiTAREA #2-ELVIS GALLEGOS SANALEA..... XCVXEliana Aguirre RamosÎncă nu există evaluări
- Determinación Experimental Coeficiente Conveccion Sobre Un CilindroDocument6 paginiDeterminación Experimental Coeficiente Conveccion Sobre Un CilindroJuan Sebastian Becerra VillamilÎncă nu există evaluări
- Problemas - Cinematica de La Particula en 2D y 3DDocument5 paginiProblemas - Cinematica de La Particula en 2D y 3DJerson FernándezÎncă nu există evaluări
- Quím - Tem 02 - Estructura AtómicaDocument3 paginiQuím - Tem 02 - Estructura AtómicaDaniela SanchezÎncă nu există evaluări
- Parcial ControlDocument16 paginiParcial ControlMariana CifuentesÎncă nu există evaluări